Oligomery Kwasu Peptydonukleinowego jako inhibiotry
bakteryjnej translacji
Autor: Anna Górska
Promotor: Dr. hab. Joanna Trylska
[email protected]
Laboratorium Maszyn Biomolekularnych
Centrum Nowych Technologii
Uniwersytet Warszawski
Wstęp
Szacuje się, że w samej tylko Uni Europejskiej oporność na antybiotyki generuje dodatkowo ok. miliarda
euro kosztów rocznie, nie wspominając o ludzkim zdrowiu i życiu [1]. Walcząc z tym problemem, naukowcy
poszukują nowych leków pośród sztucznych pochodnych naturalnych antybiotyków [2]. Zarówno naturalne jak i sztuczne antybiotyki działają niespecyficznie, szkodząc naturalnej mikroflorze ludzkiego przewodu
pokarmowego.
Nowym podejściem jest zastosowanie oligomerów modyfikowanych kwasów nukleinowych, tak aby celować
w konkretne patogeny. Oligomery wiążą się na zasadzie komplementarnego parowania zasad z naturalnymi
kwasami nukleinowym, stąd możliwe jest zaprojektowanie sekwencji specyficznej do danego fragmentu RNA
czy DNA. Zaprojektowane oligomery miałyby wiązać się z funkcjonalnymi cząsteczkami kwasów nukleinowych
w komórkach bakteryjnych blokując ich działanie.
Kwas Peptydonukleinowy (PNA) jest analogiem naturalnych kwasów nukleinowych, ale zamiast fosforanowocukrowego szkieletu posiada on nienaładowane podjednostki połączone wiązaniem peptydowym [7]. Nienaładowany szkielet PNA nie jest odpychany przez grupy fosforanowe naturalnych kwasów nukleinowych – dzięki
czemu jego oligomery wiążą się mocno i wysoce specyficznie ze względu na komplementarność sekwencji.
Z drugiej strony, celem terapeutycznym musi być element ewolucyjnie konserwowany oraz zbudowany
chociaż w części z RNA. Kryteria te spełnia rybosom; jego głównym elementem funkcjonalnym są dwie
cząsteczki RNA: 16S rRNA (ok. 1500 nukleotydów) i 23S rRNA (ok. 2500 nukleotydów) [5], jest on obecny
w komórkach wszystkich organizmów a jego struktura została rozwiązana krystalogaficznie.
Celem pracy jest zastosowanie krótkich oligomerów PNA jako inhibitorów translacji u bakterii patogennych. Moim zadaniem było wybranie in silico możliwie najlepszych sekwencji oligomerów aby ograniczyć
czasochłonne i kosztowne eksperymenty.
Metody
Efektywność antybiotykowej aktywności oligomerów zależy od wielu czynników z których wszystkie muszą być
rozważane jednocześnie: sekwencja oligomeru musi być specyficzna, a miejsce w które on celuje funkcjonalne,
oraz dostępne do wiązania. Jednocześnie, chcielibyśmy aby nasz PNA był możliwie specyficzny względem
bakterii patogennych.
Wszystkie maksymalnie zachodzące fragmenty rRNA (długości od 10 do 15 nukleotydów), zostały opisane za pomocą kilkunastu różnych deskryptorów, które po znormalizowaniu i zsumowaniu tworzą tzw.
PNAScore, czyli funkcję oceny. Mamy nadzieję, że obliczony PNAScore będzie proporcjonalny do eksperymentalnego IC50 (Rys. 1) dla oligomeru komplementarnego do danego fragmentu rRNA. IC50 opisuje stężenie
inhibitora obniżającego efektywność procesu biologicznego o połowę (ang. half maximal inhibitory concentration). Doświadczenia potwierdzające inhibicję translacji bakteryjnej przez oligomery PNA w bakteryjnym
pozakomórkowym systemie ekspresji genów (ang. cell-free system) zostały przeprowadzone w naszym laboratorium.
Funkcjonalność rRNA
Dane na temat funkcjonalnych miejsc w rRNA zebraliśmy z literatury: miejsca A, P i E wiązania tRNA,
wiązania mRNA w rybosomie (anti-SD), centrum reakcji (PTC) [11] oraz mostki między podjednostkami [4].
1
Rysunek 1: Deskryptory wchodzące w skład PNAScore: RMSD czyli średnie odchylenie kwadratowe (ang. Root
Mean Square Deviation), RMSF - średnie wahania kwadratowe (ang. Root Mean Square Fluctuation) są obliczone
dla trajektorii, SASA - powierzchnia dostępna dla wody (ang. Solvent Accessible Surface Area) jest obliczana na
podstawie struktury statycznej. Przerywana linia sugeruje, że zakres ekologiczny nie jest częścią PNAScore jako, że
nie ma on znaczenia dla eksperymentalnego IC50 . PNA mocniej oddziałuje z homo-purynowymi fragmentami, dlatego
faworyzujemy fragmenty o wysokiej zawartości puryn.
Za funkcjonalne uznaliśmy również mutacje, powodujące utratę funkcji przez rybosom [13, 14] i te powodujące oporność na antybiotyki [3, 10, 12]. Pozostałe, czyli miejsca wiązania antybiotyków oraz białkowych
czynników regulujących translację - sprawdziliśmy na za pomocą automatycznej analizy struktur rybosomów
zdeponowanych w PDB.
Dostępność fragmentów rRNA
Dostępność w rybosomie jest estymowana za pomocą obliczonej powierzchni dostępnej dla wody w strukturze rybosomu. Dostępność na poziomie struktury drugorzędowej RNA sprawdzamy poprzez pomiar energii
otwierania - czyli różnicy między energią otwartej i zamkniętej struktury RNA [6], używając rybosomowych
sekwencji drugorzędowych zdeponowanych we Frabase [9].
Jednocześnie na podstawie trajektorii małej podjednostki rybosomu E. coli (Rys. 2), co nie było możliwe dla dużej podjednostki ze względu na moc obliczeniową, zmierzyliśmy energię stakingu dla wszystkich
nukleotydów, ich ruchliwość (RMSF) oraz dynamikę struktury drugorzędowej (za pomocą MINT, Rys. 3).
Rysunek 2: Protokół symulacji dynamiki molekularnej zastosowany do małej
podjednostki rybosomu E. coli.
Rysunek 3: MINT znajduje wiązania wodorowe, na ich podstawie klasyfikuje strukturę drugorzędową, oraz oblicza oddziaływania stakingowe. Dla trajektorii MINT generuje statystyczny opis struktury podczas
dynamiki. MINT jest dostępny do ściągnięcia i w wersji internetowej na
stronie http://mint.cent.uw.edu.pl.
2
Bioinformatyczna analiza bakteryjnych sekwencji rRNA
Wszystkie sekwencje rRNA dostępne w NCBI zostały pobrane z bazy danych i podzielone na cztery grupy: bakterie patogenne, niepatogenne, E. coli i wszystkie. Dla każdej z grup wykonaliśmy ten sam protokół (Rys. 1).
Ostatecznie zakres ekologiczny powinien odzwierciedlać jak wiele bakterii z danej grupy jest podatnych na
oligomer o konkretnej sekwencji.
Wyniki
Każdy nukleotyd w obydwu cząsteczkach rRNA został opisany za pomocą wszystkich zebranych deskryptorów. Na tej podstawie obliczyliśmy PNAScore. Ze względu na brak danych dynamicznych dla dużej podjednostki rybosomu, ostatecznie wybraliśmy fragmenty 16S rRNA. W wyniku zbiorczej analizy najlepszych
wyników dla wszystkich długości oligomeru (10 do 15 nukleotdydów) wytypowałam 10 najwyżej ocenionych
regionów (przedstawionych w Tab. 1 i zaznaczonych na Rys. 4). Wyniki dla tych regionów zostały uśrednione.
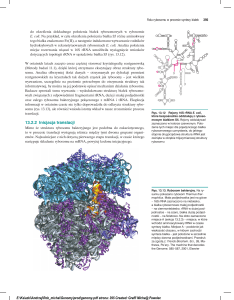
Rysunek 4: Regiony wybrane
za pomocą PNAScore zaznaczone na strukturze drugorzędowej
rRNA [8].
region 16S
rRNA
średni
wynik ±
odchylenie
standardowe
średni
zakres
ekologiczny
dla bak.
patogennych
127-142
646-683
724-751
37,2±3,1
44,9±4,1
42,3±4,5
50
75,7±20,1
86,5±6,5
funkcjonalności
/ miejsca
wiązania
motywy/
struktura
drugorzędowa
RNA
-
wybrzuszenia
gentamycyna
wybrzuszenie
wybrzuszenie,
pętla
pętla
wewnętrzna,
pętla
696-714
42,9±2,5
102,3±3,8
tetracyklina,
kasugamycyna
822-859
43,7±5,9
83,8±4,8
gentamycyna
928-943
41,4±2,7
185
1103-1121
1373-1392
1409-1427
37,9±1,6
38,6±3,7
43,0±2,2
174,3±15,8
185,4±9,2
114,5±3,5
1521-1543
44,2±2,8
128,1±13,1
kasugamycyna,
spektynomycyna
mutacje
gentamycyna
miejsce A
miejsce
Anty-SD,
Parmomycyna
pętla
wewnętrzna
wybrzuszenie
wybrzuszenie
wybrzuszenie
koniec 30
Tabela 1: Wybrane regiony i ich właściwości.
Wstępnie wyniki modelowania porównane zostały do wcześniej wykonanych przez dr Sapnę Thoudukę
i mgr Zofię Dąbrowską eksperymentów. Użyty w nich pozakomórkowy system ekspresji składa się tylko z
elementów potrzebnych do translacji oraz enzymu reporterowego. W otoczeniu buforu, po dodaniu mRNA
rozpoczyna się produkcja enzymu który przekształca dodany substrat w kolorowy produkt - dzięki temu
możliwy jest pomiar ilości powstałego enzymu [15]. Dodany oligomer wiąże się do rRNA powodując zatrzymanie działanie rybosomu, zmniejszenie produkcji enzymu i ilości kolorowego produktu reakcji, dzięki temu
możemy zmierzyć IC50 testowanego oligomeru.
Wyniki modelowania dla zastosowanych oligomerów nie korelują z otrzymanym eksperymentalnie IC50 .
Wszystkie komponenty w PNAScore są sumowane z jednakowymi wagami – ponieważ nie posiadamy żadnych przesłanek z których owe wagi mogłyby być estymowane. 12 pomiarów IC50 to również za mało aby
zastosować jakikolwiek algorytm uczący albo chociaż dopasowanie funkcji. Dodatkowo IC50 są miernikiem
blokowania translacji a nie wiązania się oligomerów do rybosomu, więc nie muszą się dokładnie przekładać
na blokowanie samych rybosomów.
Później, mgr Agnieszka Markowska wykonała eksperymenty badające wpływ oligomerów PNA na wzrost
bakterii E. coli. Jeden z najlepiej ocenionych fragmentów (region 830-840 w 16S rRNA) wykazywał właściwości bakteriobójcze. Są to wstępne wyniki, ale kolejne sekwencje są dalej testowane.
Wnioski i dyskusja
Za pomocą różnorodnych technik bioinformatycznych udało mi się zebrać duży zbiór danych dotyczących
fizycznych i biologicznych właściwości rybosomu, oraz na ich podstawie zaprojektować sekwencje PNA, które
3
mogą blokować działanie rybosomu. Drugorzędnym wynikiem mojej pracy jest otrzymanie 30 ns pełnoatomowej trajektorii małej podjednostki rybosomu oraz stworzenie programu MINT do analizy trajektorii
kwasów nukleinowych.
Główną trudnością w tym projekcie jest konieczność wnioskowania z różnych danych jednocześnie, które
same w sobie są wewnętrznie skorelowane w nieznanym stopniu. Równocześnie, nie dysponujemy żadnymi
danymi dotyczącymi fizyki wiązania PNA do RNA, ani jego specyficzności względem sekwencji. Dlatego
dokładnie przyjrzałam się celom i zbudowałam ogólny model, który przy rosnącej liczbie danych eksperymentalnych może być rozwijany. Cała procedura może być zastosowana do innych celów molekularnych
i terapeutycznych w których RNA stanowi funkcjonalną część.
Literatura
[1] Eileen R Choffnes, David A Relman, and Alison Mack. Antibiotic Resistance: Implications for Global Health and Novel Intervention
Strategies: Workshop.
[2] Julian Davies. Microbes have the last word. Molecular Biology, 2007.
[3] L H Hansen, P Mauvais, and S Douthwaite. The macrolide-ketolide antibiotic binding site is formed by structures in domains II and
V of 23S ribosomal RNA. Molecular Microbiology, 31(2):623–631, January 1999.
[4] Anna M Kietrys, Aleksandra Szopa, and Kamilla Bkowska. Structure and function of intersubunit bridges in procaryotic ribosome.
Biotechnologia, 1(1):48–58.
[5] Andrei Korostelev and Harry F Noller. The ribosome in focus: new structures bring new insights. Trends in Biochemical Sciences,
32(9):9–16, 2007.
[6] David H Mathews, Matthew D Disney, Jessica L Childs, Susan J Schroeder, Michael Zuker, and Douglas H Turner. Incorporating
chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure. Proceedings of
the National Academy of Sciences of the United States of America, 101(19):7287–92, May 2004.
[7] Peter E. Nielsen. Peptide Nucleic Acid. A Molecule with Two Identities. Accounts of Chemical Research, 32(7):624–630, July 1999.
[8] Harry F Noller and Carl R Woese. Secondary Structure of 16S Ribosomal RNA. Science, 212(4493), 1981.
[9] Mariusz Popenda, Marek Blazewicz, Marta Szachniuk, and Ryszard W Adamiak. RNA FRABASE version 1.0: an engine with a
database to search for the three-dimensional fragments within RNA structures. Nucleic Acids Research, 36(Database issue):D386–91,
January 2008.
[10] J I Ross, E a Eady, J H Cove, and W J Cunliffe. 16S rRNA mutation associated with tetracycline resistance in a gram-positive
bacterium. Antimicrobial Agents and Chemotherapy, 42(7):1702–5, July 1998.
[11] Thomas a Steitz. A structural understanding of the dynamic ribosome machine. Nature reviews. Molecular Cell Biology, 9(3):242–53,
March 2008.
[12] J Thompson and E Cundliffe. The binding of thiostrepton to 23S ribosomal RNA. Biochemie, 73:1131–1135, 1991.
[13] Aymen Yassin, Kurt Fredrick, and Alexander S Mankin. Deleterious mutations in small subunit ribosomal RNA identify functional sites
and potential targets for antibiotics. Proceedings of the National Academy of Sciences of the United States of America, 102(46):16620–
5, November 2005.
[14] Aymen Yassin and Alexander S Mankin. Potential new antibiotic sites in the ribosome revealed by deleterious mutations in RNA of
the large ribosomal subunit. The Journal of Biological Chemistry, 282(33):24329–42, August 2007.
[15] Y-H Percival Zhang. Production of biocommodities and bioelectricity by cell-free synthetic enzymatic pathway biotransformations:
challenges and opportunities. Biotechnology and Bioengineering, 105(4):663–77, March 2010.
4