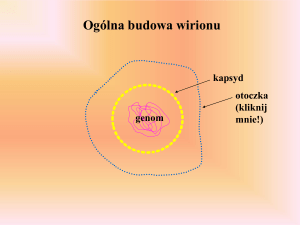
Ćwiczenie 7 - badanie wydajności procesu wyciszania poprzez analizę ekspresji badanego genu
metodą real-time RT- PCR
Zadanie 1 – Izolacja RNA z komórek za pomocą TRI-reagent
1. rozmrozić komórki zawieszone w TRI reagent
2. na 0.75 ml TRI reagentu dodać 0.2ml chloroformu
3. wytrząsać intensywnie
4. inkubować w temperaturze pokojowej przez 2-15 min.
5. wirować 12 000 xg przez 15 min. w temp. 4° C
6. górną fazę wodną przenieść do nowej probówki
7. dodać 0.5ml izopropanolu na 0.75ml TRI reagentu
8. inkubować w temp. pokojowej przez 5-10 min.
9. wirować 12 000 xg przez 10 min. w temp. 4° C
10. osad przepłukać za pomocą 1ml etanolu 75%
11. osad wysuszyć (probówki odwrócone) – maks. 15 min.
12. rozpuścić osad RNA w 30µl wody (mieszać przez pipetowanie, umieścić w temp. 55° C na 10-15
min.); przechowywać w lodzie
13. zmierzyć stężenie RNA spektrofotometrycznie
14. roztwór RNA zamrozić w -70° C.
Zadanie 2 – Przygotowanie RNA do reakcji Q-RT-PCR
15. zmierzyć stężenie RNA spektrofotometrycznie przygotowując do pomiaru rozcieńczenie: 5µl próbki
i 95µl wody.
16. zidentyfikować próbkę o najniższym stężeniu
17. doprowadzić stężenie pozostałych próbek do stężenia próbki najmniej skoncentrowanej – wskazane
jest aby miały stężenie min. 0,05 µg/µl, maks. 0,5 µg/µl. Przygotować 10 µl roztworu RNA
18. Pozostały roztwór RNA zamrozić w -70° C.
Zadanie 2 – reakcja Q-RT-PCR
1. Nastawić reakcje (w lodzie lub specjalnym chłodzącym statywie !):
MnSOD
HPRT
składnik
bufor Tth 20x
MgCl2 25mM
wzmacniacz 10x
dNTPs 2mM
MnSO4 25mM
Starter fSOD 10µM
starter rSOD 10µM
Rox
SybrGreen
RNA lub DNA standard lub woda
Polimeraza DNA Tth 5U/µl
woda
RAZEM
ilość (8 porcji po 15µl)
6 µl
16,2 µl
24 µl
24 µl
2,4 µl
2,4 µl
2,4 µl
12 µl
1,8 µl
0.3 – 1.0 µg RNA na
reakcję lub standardy
po 2µl
1,2 µl
składnik
bufor Tth 20x
MgCl2 25mM
wzmacniacz 10x
dNTPs 2mM
MnSO4 25mM
starter 5’mHPRT 10µM
starter 3’mHPRT 10µM
Rox
SybrGreen
RNA lub woda
Polimeraza DNA Tth
5U/µl
woda
RAZEM
ilość (5 porcji po 15µl)
2,25 µl
7,2 µl
9 µl
9 µl
0,9 µl
0,9 µl
0,9 µl
4,5 µl
0,67 µl
0.3 – 1.0 µg RNA na reakcję
0,45 µl
45 µl
120 µl
a. matryce do reakcji MnSOD: 5 standardów, kontrola negatywna, 2próbki badane. Standardy
DNA do krzywej standardowej zawierają sklonowany cDNA genu MnSOD w plazmidzie
(pSODex). Występują w rozcieńczeniach 5ng/µl, 0.5ng/µl, 50pg/µl, 5pg/µl, 0.5pg/µl. Do
każdej reakcji dodajemy 2µl odpowiedniego standardu.
b. matryce do reakcji HPRT: 2 próbki badane, kontrola negatywna
Zakład Biotechnologii i Inżynierii Genetycznej
Metody terapii genowej
2. Zaprojektować układ płytki w programie MxPro dokładnie wg poniższego schematu:
3. Zaprojektować parametry reakcji:
60° C – 20min.
40 cykli:
95° C – 45sek
64° C – 30sek (+ akwizycja sygnału)
72° C – 30 sek (+ akwizycja sygnału)
80° C – 15 sek (+ akwizycja sygnału)
domyślna krzywa meltingu (95° C – 1 min., 55° C – 30sek, 95° C – 30 sek)
4. Rozpocząć eksperyment
Zakład Biotechnologii i Inżynierii Genetycznej
Metody terapii genowej