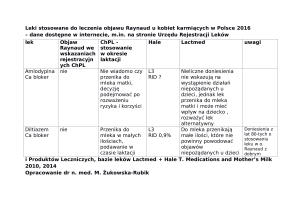
Z mlekiem matki dziecko otrzymuje jej komórki
macierzyste: czy to przyspiesza rozwój noworodka?
Dr Foteini Hassiotou
Hartmann Human Lactation Research Group, The University of Western Australia
Mleko matki jest kompleksowym płynem, zawierającym mnóstwo składników biochemicznych i komórkowych,
które zapewniają niemowlęciu korzyści odżywcze, immunologiczne i rozwojowe. Chociaż jego skład
biochemiczny był intensywnie badany, komórkom mleka matki poświęcono niewiele uwagi. W ostatniej
dekadzie postęp technologiczny w dziedzinie mikroskopii, cytometrii przepływowej i biologii molekularnej
wspomagał badania komórek mleka matki, odsłaniając niektóre z ich unikalnych cech i inspirował potencjalne
zastosowania. Wbrew wcześniejszym przekonaniom wykazano, że komórki odpornościowe stanowią
mniejszość w dojrzałym mleku ludzkim, gdy zarówno matka, jak i dziecko są zdrowi. Okresy infekcji stymulują
jednakże szybki wzrost liczby komórek odpornościowych w mleku matki, z obniżeniem do niskiego poziomu
wyjściowego po powrocie do zdrowia. Ta obserwacja podkreśliła, że podczas okresów zdrowia większość
komórek w mleku matki nie jest pochodzenia odpornościowego. Analizy cytometrii przepływowej wykazały,
że komórki nabłonkowe, takie jak laktocyty oraz w mniejszym stopniu komórki mięśniowo-nabłonkowe,
stanowią większość komórek w dojrzałym mleku matki w całym okresie laktacji. Poza tymi komórkami w
mleku matki zidentyfikowano komórki macierzyste i progenitorowe. Niektóre z tych komórek macierzystych
prezentują znane właściwości komórek macierzystych gruczołu piersiowego, mających zdolność do
przekształcenia się w funkcyjne laktocyty syntetyzujące mleko w hodowli. Co ciekawe, subpopulacje
komórek macierzystych mleka matki wydają się być bardzo plastyczne i zdolne do przekształcenia w
komórki wszystkich trzech warstw zarodkowych, w tym neurony, glej, hepatocyty, komórki trzustkowe,
komórki mięśnia sercowego, osteoblasty, chondrocyty i adipocyty. Pokazywano również, że są one zdolne
do ekspresji genów embrionalnych komórek macierzystych kontrolujących samoodnowę i różnicowanie,
potencjalnie uwalniając właściwości tych komórek wynikające z pochodzenia od wielu linii. Badanie ludzkiego
gruczołu piersiowego w okresie odpoczynku oraz laktacji wykazało, że komórki te występują w tkance
nabłonkowej gruczołu w okresie laktacji, a jest ich niewiele w okresie fazy odpoczynku gruczołu piersiowego.
Biorąc pod uwagę, że donoszone niemowlę karmione piersią spożywa 470-1300 ml mleka matki dziennie,
a zawartość komórkowa mleka matki waha się w zakresie od 10 000 do 13 000 000 komórek/ml mleka,
można obliczyć, że karmione piersią niemowlę przyjmuje każdego dnia miliony miliardów komórek z mleka
matki. Jakie są losy tych komórek? Aby rzucić trochę światła na to zagadnienie, użyliśmy modelu mysiego,
aby sprawdzić dystrybucję tkanek i okres utajenia komórek macierzystych mleka u noworodków. Matki,
które powszechnie wydzielały geny TdTomato (TDT), niańczyły krzyżowo oseski myszy typu dzikiego, które
poddawano obrazowaniu w okresie karmienia piersią, ale także w życiu dorosłym. U noworodków karmionych
piersią, pochodzące z mleka komórki TdT+ obserwowano w żołądku i grasicy. Żadnych komórek TdT+ nie
znaleziono w kontrolach typu dzikiego karmionych piersią przez matki biologiczne. Analiza metodą cytometrii
przepływu krwi pobranej od tych noworodków wykazała obecność komórek TdT+ pochodzących z mleka
we krwi, co sugeruje przeżycie niektórych komórek mleka i migrację do obiegu krwi. Narządy tych myszy
ekstrahowano, utrwalono w formalinie i zatopiono w parafinie, a następnie pocięto na skrawki i barwiono pod
kątem immunologicznym z zastosowaniem mikroskopii konfokalnej. Komórki TdT+ obserwowano w jamie
żołądka oraz dołączone do błony śluzowej żołądka, i penetrujące w głąb błony. Komórki TDT+ zaobserwowano
również w grasicy, wątrobie, trzustce, śledzionie i mózgu. Niektóre z tych komórek TDT+ wydzielały markery
komórek macierzystych OCT4, NANOG oraz CD49f. Grasica oraz w mniejszym stopniu wątroba i inne
badane narządy dysponowały klonami komórek TdT+ pochodzących z mleka, które prowadziły ekspresję
markerów komórek macierzystych. W bliskim sąsiedztwie do podwójnie dodatniej populacji obserwowano
komórki TdT+ pochodzące z mleka, z niewielką lub żadną ekspresją markerów komórek macierzystych, co
sugeruje różnicowanie i asymilację z tkanką gospodarza i/lub migrację innych typów komórek TdT+ mleka
w tych narządach. Faktycznie znajdowano w wątrobie komórki mleka dodatnie dla albuminy i TdT; komórki
mleka dodatnie dla insuliny i TdT obserwowano w trzustce; a komórki mleka dodatnie dla MAP2 oraz
10
TdT stwierdzano w mózgu. Dane te sugerują funkcjonalne różnicowanie komórek macierzystych mleka w
narządach noworodka. Ponadto komórki odpornościowe mleka TdT+/CD45+ obserwowano również w wielu
badanych narządach, zwłaszcza w grasicy. Badano również krew krzyżowo niańczonych noworodków po
odstawieniu do czasów dorosłości, ujawniając, że niektóre pochodzące z mleka komórki TdT+ utrzymywały się
we krwi nawet po zaprzestaniu karmienia piersią. Wyniki te stanowią pierwszy dowód na przeżycie komórek
macierzystych mleka u noworodka i wskazują na migrację i integrację funkcjonalną do narządów, w których
mogą zapewniać korzyści rozwojowe potomstwu.
Źródła
1
Hassiotou F., Heath B., Ocal O., Filgueira L., Geddes D.T., Hartmann P.E., Wilkie T.M. (2014). Breastmilk stem cell transfer from mother to
neonatal organs. Experimental Biology, April 2014.
2
Hassiotou F., Hartmann P.E. (2014). At the dawn of a new discovery: The potential of breastmilk stem cells. Advances in Nutrition (in
press).
3
Hassiotou F., Hepworth A.R., Metzger P., Lai C.T., Trengove N., Hartmann P.E., Filgueira L. (2013). Maternal and infant infections stimulate
a rapid leukocyte response in breastmilk. Clinical & Translational Immunology 2: e3.
4
Hassiotou F., Geddes, D.T., Hartmann P.E. (2013). Cells in human milk: State of the science. Journal of Human Lactation 29(2): 171-182.
5
Twigger A.-J., Hodgetts S., Filgueira L., Hartmann P.E., Hassiotou F. (2013). From breastmilk to brains: The potential of stem cells in
human milk. Journal of Human Lactation 29(2):136-139.
6
Hassiotou F., Geddes D. (2013). Anatomy of the human mammary gland – Current status of knowledge. Clinical Anatomy 26(1): 29-48.
7
Hassiotou F., Beltran A., Chetwynd E., Stuebe A.M., Twigger A.-J., Metzger P., Trengove N., Lai C.T., Filgueira L., Blancafort P., Hartmann
P.E. (2012). Breastmilk is a novel source of stem cells with multi-lineage differentiation potential. Stem Cells 30: 2164–2174.
Notatki
11