jakościowa
Analityczna
ilościowa
Fizyczna
Chemia
Organiczna (tzw. Chemia związków węgla)
Nieorganiczna
PIERWIASTEK-jest substancją złożoną z atomów jednego rodzaju
Nazwa
Pierwiastek
symbol
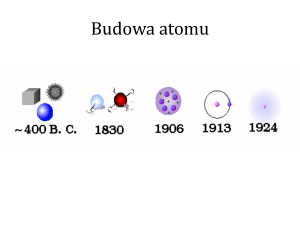
JĄDROWY MODEL ATOMU:
1. atomy zbudowane są z cząsteczek subatomowych (elektronów, protonów i neutronów)
2. protony i neutrony tworzą zwarte ciało zwane jądrem atomowym
3. elektrony tworzą w przestrzeni chmurę otaczającą jądro
Właściwości cząsteczek subatomowych:
ładunek
Elektron
-1
Proton
+1
Neutron
0
A
Z
E
A- liczba masowa, suma protonów i neutronów
Z- liczba atomowa, liczba protonów
IZOTOPY- atomy o jednakowej ilości liczbie atomowej, a o różnych liczbach masowych.
SPEKTROMETR MAS- przyrząd służący do wyznaczania masy atomu
SPEKTROSKOPIA- metoda badania struktury materii wykorzystującą spektrometr.
O własnościach pierwiastka i jego reaktywności decyduje sposób rozmieszczenia
elektronów w atomie, czyli struktura elektronowa atomu.
UKŁAD OKRESOWY PIERWIASTKOW- tablica wskazująca podobieństwo chemiczne;
twórcą jest Mendelejew, układ zawiera 7 okresów i 18 grup: 8 grup głównych (1,2,13-18) i 1o
grup pobocznych (3-12). Własności pierwiastków w grupie zmieniają się w sposób regularny
od gazu (F, Cl) poprzez ciecz (Br) do ciała stałego (J). w okresach obserwuje się przejście od
metali poprzez półmetale do niemetali.
Metale- przewodzą prad elektryczny, połysk metaliczny
Niemetale- nie wykazują powszechnych własności
Półmetale- wygląd i pewne właściwości fizyczne metali, lecz właściwości chemiczneniemetali.
MECHANIKA KWANTOWA- opis zachowania się elektronów w atomie (Bohr, Planck,
Schrödinger)
- długość fali
c
c
E hv h
v
v
E- energia fotonu
h- stała Plancka
h=6,63*10-34J*s
ZASADA NIEOZNACZNOŚCI HEISENBERGA- nie można równocześnie określić
położenia i prędkości czasteczki subatomowej, można mowic tylko o prawdopodobieństwie
znalezienia elektronu w określonym miejscu w atomie
POSTULATY MECHANIKI KWANTOWEJ:
- pojęcie kwantu (porcji energii)- Planck
- E h * v - Bohr
- zasada nieoznaczności położenia i prędkości elektronu- Heisenberg
Te postulaty doprowadzili do współczesnego modelu atomu sformułowanego przez
Schrödingera:
-wprowadził pojęcie tzw. Funkcji falowej elektronu w atomie (orbitalu atomowego)
-prawdopodobieństwo znalezienia elektronu w danym punkcie w przestrzeni jest
proporcjonalne do kwadratu funkcji w tym punkcie.
ORBITALE- określony kształt i energie
ORBITAL S- symetria sferyczna (kulista chmura, której gęstość maleje wraz ze wzrostem
odległości od jądra), nie ma płaszczyzny zerowego prawdopodobieństwo.
ORBITAL P- chmura z dwoma płatami po przeciwnych stronach jądra rodzielona
płaszczyzną węzłową przecinającą jądro, w której znika prawdopodobieństwo znalezienia
elektronu; 3 orbitale p o jednakowej energii skierowanej w trzech prostopadłych kierunkach.
d- kształt bardziej skomplikowany (istnieje 5 orabitali o danej energii)
f- orbitale mają jeszcze bardziej skomplikowany kształt (7 równo cennych)
ENERGIA JONIZACJI- (Ej)- to energia potrzebna do oderwania elektronu od atomu
pierwiastka w fazie gazowej (w grupie- maleje, w okresie- rośnie)
LICZBY KWANTOWE:
U- główna
l-poboczna
m-magnetyczna
ms-spinowa
1,2,…..
-określa powłokę
(energię)
-podaje wielkość
0,1,….,n-1
-określa podpowłokę
-podaje kształt
(s,p,d,f)
0,….,l-1
-określa orbitale
podpowłoki
-podaje kierunek px,
py, pz
1 1
+ ,
2 2
-określa stan spinowy
-podaje kierunek
spinu
ZAKAZ PAULIEGO- mówi, że w jednym atomie dwa elektrony muszą różnić się wartością
przynajmniej jednej liczby kwantowej (np. w jednym poziomie orbitalnym muszą mieć
przeciwną orientację spinu).
Z punktu widzenia chemii najważniejszymi elektronami w atomie są elektrony walencyjne.