ww
w.
Collegium-Novum, Kursy Maturalne, tel 022 4248966, 502269834, www.domatury.pl
Moduł 1. Budowa atomu.
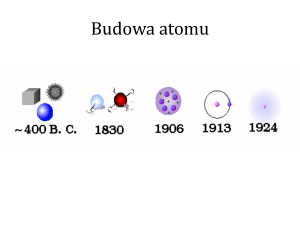
1. Modele budowy atomu
poglądy Demokryta 460-470 p.n.e. -atomy to niepodzielne cząstki
poruszające się w próżni, (grec. a-tomos nie-podzielny), dyfuzja
poglądy Arystotelesa -materia jest ciągła;
teoria Johna Daltona (ang. fizyk i chemik) XVIII w.
postulaty atomistyczno-cząsteczkowej budowy materii: atomy to trwałe
niepodzielne cząstki, istnieje tyle różnych atomów ile jest różnych pierwiastków;
model Josepha Thomsona, (1897 odkrył elektron), promieniowanie
katodowe, ładunki dodatnie rozmieszczone w morzu ładunków ujemnych
model Ernesta Ruthenforda, doświadczenie Geigera-Marsdena z folią Au,
planetarny model budowy atomu
model Nielsa Bhora (1913) kwantowa teoria budowy powłok
elektronowych, elektron krąży po ściśle określonej orbicie wokół jądra
atomowego, ruch el. wewnątrz powłoki bez start energii, 2n2 liczba
elektronów na danej powłoce
do
II. Promieniotwórczość naturalna i sztuczna.
m
2. Definicje:
pierwiastek zbiór atomów otakiej samej liczbie protonów w jądrze
atomowym
liczba atomowa Z informuje o liczbie protonów w jądrze atomowym
liczba masowa A informuje o sumie protonów i neutronów w jądrze
atomowym
cząsteczki subatomowe to protony i neutrony, które składają się z kwarków
cząsteczki elementarne to np. elektron
nukleony to cząsteczki budujące jądro atomowe - protony i neutrony
nukildy atomy o ściśle określonym składzie jądra atomowego, podane Z i A
radinuklidy
izotopy tego samego pierwiastka różniące się liczbą neutronów w jądrze
atomowym np. H, D, T
izobary atomy różnych pierwwiasktów, które mają taką samą liczbę masową
różnią się liczbą atomową
izotony atomy różnych pierwwiasktów, które mają taką samą liczbę
neutronów różnią się liczbą atomową i liczbą masową
rdzeń atomowy jądro atomowe + elektrony niewalencyjne
elektrony walencyjne znajdują się na ostataniej powłoce, decydują o
właściwościach chemicznych pierwiastka
anihilacja
defekt masy różnica między sumą mas cząstek subatomowych a masą
cząsteczek związanych w jądrze, im większy tym silniejsze oddziaływania.
Atomowa jednostka masy 1/12 masy atomu węgla 12C 1u= 1.66*10-24g
masa atomowa średnia ważona uwzględniająca masy poszczególnych
izotopów
1. Promieniowanie jądrowe: α (42Ηε2+), β (0−1ε), γ (fala elektromagnetyczna)
oddziaływanie w polu elektrycznym i magnetycznym
zasięg (α kartka papieru, β glin, γ ołów)
at
2. Czynniki decydujące o trwałości jąder atomowych:
n/p
parzystość jąder atomowych, liczby magiczne (2, 8, 20, 50, 82, i 126 dla n)
ur
3. Promieniotwórczość naturalna:
przemiana α (Z > 82), γ (emisja nadmiaru energii)
przemiana β− gdy jest nadmiar neutronów ( 1 0n = 11p + 1 -1e + antyneutrio)
powstaje nowy pierwiastek o Z+1, A bez zmian,
przemiana β+ rozpad protonu (11p = 10n + 11e + neutrino) powstaje nowy
pierwiastek o Z-1, A bez zmian,
dla sztucznie otrzymanych nuklidów wychwyt K (10n + 1-1e = 11p + neutrino)
powstaje nowy pierwiastek o Z+1, A bez zmian,
antyneutrino i neutrino unoszą część energii
Zasada zachowania ładunku i nukleonów
Reguła przesunięć Fajansa i Soddego
y.
p
4. Naturalne szeregi promieniotwórcze:
uranowo radowy 238U – 206Pb
uranowo- aktynowy 235U – 207Pb
l
1
ww
w.
Collegium-Novum, Kursy Maturalne, tel 022 4248966, 502269834, www.domatury.pl
torowy 232Th – 208Pb
III. Struktura elektronowa atomu.
5. Czas połowicznego rozpadu – czas w którym rozpada się połowa zgromadzonych
jąder atomowych, masa próbki maleje o połowę, charakterystyczny dla danego
nuklidu. Dla trwałych nuklidów czas połowicznego rozpadu jest dłuższy niż 109 lat.
6. Prawo rozpadu promieniotwórczego m=mo⋅(1/2)t/τ1/2
do
7. Sztuczne przemiany promieniotwórcze
(pierwsza sztuczna przemiana 14N(α ,p)17O):
przemiany jądrowe:
bombardowanie n 3517Cl(n,p)3516S,
bombardowanie p 63Li(p, α) 42He,
bombardowanie D 4119Kr(D, p)4219K;
bombardowanie γ 2713Al(γ , p)2612Mg
synteza jądrowa, 73Li + 11H → 242He + energia
rozszczepienie jądrowe, 235U + 10n → 140Ba + 93Kr + 310n
8. Dawka pochłonięta, ilość promieniowania, która przekazuje 1 kg masy ciała
energię 1 J [Gy] grej, zależy od:
ilość, rodzaj promieniowania, energia promieniowania, czas, odległość od
źródła
Równoważnik dawki=QF⋅D [Sv] siwert,
Dawka letalna po upływie 30 dni powoduje śmierć 50 % populacji [Sv]: (człowiek 34, małpa 5-6, żółw 15, nietoperz 500, pantofelek 3000, bakteria gronkowiec 7000). W
Polsce roczna dawka promieniowania 3 mSv, zdjęcie rentgenowskie 0.82 mSv
9. Promieniowanie jonizujące: jądrowe i X;
energia promieniowania w [eV] 1eV=1.6·10-19J
1. 1924 Louis de Broglie falowa natura elektronu:
dyfrakcja (zmiana kierunku rozchodzenia się fal po przejściu przez
szczelinę o małej porównywalnej z długością fali szerokści)
interferencja (wzmocnienie bądź osłabienie dwóch fal).
Zastosowanie natury falowej elektronu w mikroskopie elektronowym.
2. 1927 r. zasada nieoznaczoności Heisenberga
niemożliwe jest jednczesne wyznaczenie z dowolnie dużą dokładnością położenia i
pędu cząstki Δx·Δp≥h/4π; (energia - czas) nie dotyczny skali makro
m
[A/s·(m2kg/As3)]
10. Detekcja promieniowania:
klisza fotograficzna
siarczek cynku, scyntylator, luminescencja
licznik Geigera i Mullera przewodnictwo elektryczne zjonizowanego
powietrza
3. Sposoby opisania ruchu (mechanika klasyczna równanie Newtona i mechanika
kwantowa równanie Schrodnigera)
Równanie Schrodingera opisuje ruch cząstek, funkcja będąca rozwiązaniem zwana
jest funkcją falową. Funkcja falowa zależy od 3 parametrów- liczb kwantowych (n,
l, m). Kwantowanie energii - skutek wyboru takich rozwiązań równania
Schrodingera, które mają sens fizyczny.
at
ur
Orbital - funkcja falowa opisująca stan 1 elektronu i zależna od jego współrzędnych
przestrzennych
y.
p
Gęstość prawdopodobieństwa znalezienia cząstki w przestrzeni jest to kwadrat
funkcji falowej, określa nam powierzchnię graniczną albo kontur orbitalu,
4. Liczby kwantowe:
n główna, wartości 1 = K, 2 = L, 3 = M, 4 = N..., decyduje o całkowitej
energii elektronu, rozmiarach powłok i rozmiarach konturu orbitalu
l poboczna = orbitalna, wartości: 0...(n-1); orbitalny moment pędu w ruchu
obiegowym wokół jądra, określa liczbę podpowłok w powłoce, decyduje o
kształcie konturu orbitalu 0 = s (kulisty), 1=p (3 ósemki), 2=d, 3=f, 4=g..,
m magnetyczna, wartości: -l,...0...l; liczba wartości (2l+1), określa rzut
oritalnego momentu pędu na wyróżniony zewnętrznym polem kierunek w
przestrzeni, określa liczbę poziomów orbitalnych w danej podpowłoce i
l
2
ww
w.
Collegium-Novum, Kursy Maturalne, tel 022 4248966, 502269834, www.domatury.pl
decyduje o orientacji przestrzennej konturu orbitalu; s – 1 orbital, p-3
orbitale, d- 5 orbitali, f-7 orbitali
ms magnetyczna spinowa +1/2, -1/2, rzut spinowego momentu pędu na
wyróżniony kierunek w przestrzeni ↑↓
5. Zakaz Pauliego w atomie wieloelektronowym nie może być dwóch elektronów,
których stan jest opisywany identycznym zestawem liczb kwantowych, muszą się
różnić co najmniej wartością jednej liczby kwantowej, np. spinowej
do
6. Reguła Hunda - najniższą energię ma stan o najwyższym możliwym całkowitym
spinie, maksymalna liczba orbitali musi być zapełiona
7. Konfiguracje elektronowe Cr i Cu - promocja, zapis klatkowy,
m
8. Stan podstawowy a stan wzbudzony dla C, S, Cl
serie emisyjne wodoru (Lymana na 1, nadfiolet, Balmera na 2 widzialny, Paschena
na 3 podczerwień, Bracketta na 4 i 4 prążeki, Pfunda na 5 część 1. str. 114/1)
9. Budowa atomu a układ okresowy:
numer grupy głównej informuje o liczbie elektronów walencyjnych
numer okresu informuje o liczbie powłok elektronowych, odpowiada wartości
głównej liczby kwantowej
pierwiastek w nieparzystej grupie tworzy trwałe związki na nieparzystych st.
utlenienia,
bloki energetyczne w układzie okresowym,
podobieństwo właściwości pierwiastków w grupie związane z taką samą
liczbą elektronów walencyjnych
elektroujemność – zdolność do przyciągania elektronów
powinowactwo elektronowe – energia jaką uzyskuje się przy przyłączeniu elektronu
do obojętnego atomu
energia jonizacji – energia jaką trzeba dostarczyć by oderwać elektron od atomu (w
grupach maleje, w okresach rośnie)
at
ur
y.
p
l
3