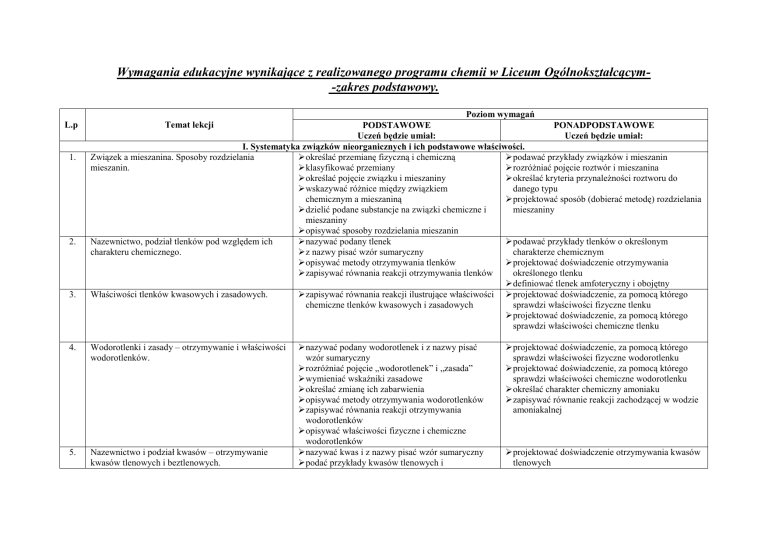
Wymagania edukacyjne wynikające z realizowanego programu chemii w Liceum Ogólnokształcącym-zakres podstawowy.
L.p
1.
2.
3.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
I. Systematyka związków nieorganicznych i ich podstawowe właściwości.
Związek a mieszanina. Sposoby rozdzielania
określać przemianę fizyczną i chemiczną
podawać przykłady związków i mieszanin
mieszanin.
klasyfikować przemiany
rozróŜniać pojęcie roztwór i mieszanina
określać pojęcie związku i mieszaniny
określać kryteria przynaleŜności roztworu do
wskazywać róŜnice między związkiem
danego typu
chemicznym a mieszaniną
projektować sposób (dobierać metodę) rozdzielania
dzielić podane substancje na związki chemiczne i
mieszaniny
mieszaniny
opisywać sposoby rozdzielania mieszanin
Nazewnictwo, podział tlenków pod względem ich
nazywać podany tlenek
podawać przykłady tlenków o określonym
charakteru chemicznego.
z nazwy pisać wzór sumaryczny
charakterze chemicznym
opisywać metody otrzymywania tlenków
projektować doświadczenie otrzymywania
zapisywać równania reakcji otrzymywania tlenków
określonego tlenku
definiować tlenek amfoteryczny i obojętny
Właściwości tlenków kwasowych i zasadowych.
zapisywać równania reakcji ilustrujące właściwości projektować doświadczenie, za pomocą którego
chemiczne tlenków kwasowych i zasadowych
sprawdzi właściwości fizyczne tlenku
projektować doświadczenie, za pomocą którego
sprawdzi właściwości chemiczne tlenku
Temat lekcji
4.
Wodorotlenki i zasady – otrzymywanie i właściwości
wodorotlenków.
5.
Nazewnictwo i podział kwasów – otrzymywanie
kwasów tlenowych i beztlenowych.
nazywać podany wodorotlenek i z nazwy pisać
wzór sumaryczny
rozróŜniać pojęcie „wodorotlenek” i „zasada”
wymieniać wskaźniki zasadowe
określać zmianę ich zabarwienia
opisywać metody otrzymywania wodorotlenków
zapisywać równania reakcji otrzymywania
wodorotlenków
opisywać właściwości fizyczne i chemiczne
wodorotlenków
nazywać kwas i z nazwy pisać wzór sumaryczny
podać przykłady kwasów tlenowych i
projektować doświadczenie, za pomocą którego
sprawdzi właściwości fizyczne wodorotlenku
projektować doświadczenie, za pomocą którego
sprawdzi właściwości chemiczne wodorotlenku
określać charakter chemiczny amoniaku
zapisywać równanie reakcji zachodzącej w wodzie
amoniakalnej
projektować doświadczenie otrzymywania kwasów
tlenowych
Poziom wymagań
L.p
Temat lekcji
PODSTAWOWE
Uczeń będzie umiał:
beztlenowych
opisywać metody otrzymywania kwasów
tlenowych i beztlenowych
zapisywać równania reakcji otrzymywania kwasów
podać nazwy wskaźników kwasowych
określać zmianę ich zabarwienia
opisywać właściwości fizyczne i chemiczne
kwasów: HCl, HBr, HJ, H2S, H2SO4, HNO3,
H3PO4,
zapisywać za pomocą równań reakcji właściwości
chemiczne kwasów: HCl, HBr, HJ, H2S, H2SO4,
HNO3, H3PO4,
nazywać sole i z nazw pisać wzory sumaryczne
opisywać podstawowe metody otrzymywania soli
zapisywać równania reakcji otrzymywania soli
6.
Właściwości kwasów.
7.
Metody otrzymywania soli.
8.
określać typ reakcji chemicznej
II. Mol i molowa interpretacja przemian chemicznych.
Wprowadzenie pojęcia mola.
wyjaśniać pojęcie mola, jako miary liczebności
materii
stosować liczbę Avogadra
obliczać liczbę moli na podstawie liczby molekuł
obliczać liczbę molekuł na podstawie liczby moli
Molowa interpretacja przemian chemicznych.
odczytywać zapis równania reakcji w interpretacji
molowej
podawać interpretację molową znanej reakcji
chemicznej
obliczać liczbę moli produktu reakcji przy
dowolnej liczbie moli jednego z substratów
Obliczanie masy reagentów na podstawie równań
stosować pojęcie masy atomowej i cząsteczkowej
reakcji chemicznych.
stosować pojęcie masy molowej
9.
10.
11.
PONADPODSTAWOWE
Uczeń będzie umiał:
projektować doświadczenie otrzymywania kwasów
beztlenowych
opisywać właściwości fizyczne i chemiczne
kwasów: HNO2, H2SO3, H2CO3, HF
zapisywać za pomocą równań reakcji właściwości
chemiczne kwasów: HNO2, H2SO3, H2CO3, HF
rozróŜniać kwasy trwałe i nietrwałe
projektować doświadczenie otrzymywania soli z
uŜyciem soli, jako jednego z substratów
charakteryzować odmienność reakcji z metalami
takich kwasów jak rozcieńczony i stęŜony kwas
siarkowy(VI) i zapisywać odpowiednie równania
reakcji
podawać produkty reakcji metali z kwasem
azotowym(V)
Reakcje syntezy, analizy i wymiany.
definiować pojęcie mola, jako miary liczebności
materii
obliczać liczbę moli reagentów na podstawie
molowej interpretacji procesu
obliczać masę reagentów na podstawie molowej
interpretacji procesu
L.p
Temat lekcji
12.
Objętość molowa gazów w warunkach normalnych.
13.
Obliczenia z wykorzystaniem objętości molowej.
14.
Obliczenia dla mieszanin niestechiometrycznych.
14.
StęŜenia procentowe i molowe.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
obliczać masę produktu reakcji przy dowolnej
masie jednego z substratów
obliczać liczbę moli produktu reakcji przy
dowolnej masie jednego z substratów
obliczać masę produktu reakcji przy dowolnej
liczbie moli jednego z substratów
posługiwać się w obliczeniach procentem
określać parametry warunków normalnych
objętościowym gazów
podawać wartość objętości molowej gazów w
warunkach normalnych
obliczać gęstość gazów w warunkach normalnych
przeliczać objętość gazu na liczbę moli,. masę i
liczbę molekuł
przeliczać liczbę moli, masę i liczbę molekuł na
objętość gazu
obliczać objętość produktu reakcji przy dowolnej
posługiwać się procentem objętościowym gazów w
objętości jednego z substratów
obliczeniach stechiometrycznych
obliczać objętość substratu reakcji przy dowolnej
objętości jednego z produktów
obliczać objętość produktu reakcji przy dowolnej
liczbie moli jednego z substratów
obliczać objętość substratu reakcji przy dowolnej
liczbie moli jednego z produktów
obliczać objętość produktu reakcji przy dowolnej
masie jednego z substratów
obliczać objętość substratu reakcji przy dowolnej
masie jednego z produktów
obliczać objętość produktu reakcji przy dowolnej
liczbie molekuł jednego z substratów
obliczać objętość substratu reakcji przy dowolnej
liczbie molekuł jednego z produktów
obliczać liczbę, moli, masę, objętość produktu przy obliczać liczbę molekuł produktu przy
niestechiometrycznej ilości substratów
niestechiometrycznej ilości substratów
III. StęŜenia roztworów.
posługiwać się w obliczeniach pojęciem stęŜenia
posługiwać się gęstością roztworu, rozpuszczalnika
procentowego
i substancji rozpuszczonej do obliczania stęŜenia
wyjaśniać pojęcie stęŜenia molowego
molowego i procentowego roztworu
stosować stęŜenie molowe do obliczania liczby
przeliczać stęŜenie molowe na procentowe
L.p
Temat lekcji
15.
ZatęŜanie i rozcieńczanie roztworów.
16.
Przygotowanie roztworów o określonym stęŜeniu.
17.
Liczba masowa i atomowa, jako informacja o
budowie atomu. Izotopy.
18.
Naturalne przemiany promieniotwórcze α i β.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
przeliczać stęŜenie procentowe na molowe
moli substancji rozpuszczonej
obliczać stęŜenie molowe i procentowe z
stosować w obliczeniach stęŜenie molowe do
obliczenia objętości roztworu zawierającego
wykorzystaniem objętości molowej
określona liczbę moli substancji rozpuszczonej
rozpuszczanych gazów (np. chlorowodoru przy
stosować w obliczeniach stęŜenia molowego
otrzymywaniu kwasu solnego)
określoną masę substancji rozpuszczonej
obliczać stęŜenie procentowe roztworu
obliczać stęŜenie molowe roztworu, otrzymanego
otrzymanego przez dodanie rozpuszczalnika do
po dodaniu rozpuszczalnika do roztworu o znanym
stęŜeniu molowym
roztworu o kreślonym stęŜeniu molowym
obliczać stęŜenie molowe roztworu otrzymanego
obliczać stęŜenie procentowe roztworu,
przez dodanie rozpuszczalnika do roztworu o
otrzymanego po dodaniu rozpuszczalnika do
kreślonym stęŜeniu procentowym
roztworu o znanym stęŜeniu procentowym
obliczać stęŜenie molowe roztworu, otrzymanego
po odparowaniu rozpuszczalnika lub dodaniu
substancji rozpuszczonej do roztworu o znanym
stęŜeniu molowym
obliczać stęŜenie procentowe roztworu,
otrzymanego po odparowaniu rozpuszczalnika lub
dodaniu substancji
rozpuszczonej do roztworu o znanym stęŜeniu
procentowym
rozróŜniać naczynia miarowe i wymieniać ich
przygotowywać roztwór o określonym stęŜeniu
zastosowanie
procentowym przez rozcieńczanie roztworu
przygotowywać z odwaŜki roztwór o określonym
bardziej stęŜonego
stęŜeniu procentowym
przygotowywać roztwór o określonym stęŜeniu
przygotowywać z odwaŜki roztwór o określonym
molowym przez rozcieńczanie roztworu bardziej
stęŜeniu molowym
stęŜonego
IV. Budowa atomu i cząsteczki.
obliczać liczbę cząstek składowych atomu
posługując się liczbą atomową i liczbą masową
definiować izotop
opisywać izotopy wodoru
określać promieniowanie α i β.
wyjaśniać, na czym polegają przemiany α i β
posługiwać się czasem połowicznego rozpadu dla
uzupełniać równanie przemian α i β.
określenia trwałości pierwiastków
określać na podstawie wykresu ilość preparatu
L.p
Temat lekcji
19.
Model Bohra atomu wodoru – wzbudzenie atomu i
jego jonizacja.
20.
Falowo-korpuskularna natura elektronu, orbitale s i p.
21.
Kolejność wypełniania podpowłok – reguła Hunda.
22.
Konfiguracje elektronowe atomów, róŜne sposoby
zapisu konfiguracji.
23.
Bloki s, p w układzie okresowym.
24.
Zmiana właściwości pierwiastków w układzie
okresowym.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
opisywać zastosowania nuklidów
promieniotwórczego pozostałego w próbce
promieniotwórczych
wyjaśniać zagroŜenia związane z
promieniotwórczością
opisywać model budowy atomu według Bohra
posługiwać się pojęciem wzbudzenia atomu
wyjaśniać pojęcie wzbudzenia atomu
posługiwać się pojęciem energii jonizacji
wyjaśniać pojęcie energii jonizacji
wyjaśniać pojęcie orbitalu atomowego
wyjaśniać, Ŝe elektron jest cząstką z ruchem której
związana jest fala elektromagnetyczna
rozpoznawać kształty orbitali s i p
róŜnicować orbitale 1s i 2s oraz 2s i 2p oraz
wyjaśniać sens zasady nieoznaczoności
analogicznie dla powłoki trzeciej
Heisenberga
stosować zakaz Pauliego
interpretować orbital, jako rozwiązanie równania
Schrödingera
określać strukturę chmury elektronowej – czterech
stosować schemat ukośnika dla zapisu konfiguracji
pierwszych powłok
elektronowej pierwiastków grup głównych
zapisywać konfigurację elektronową pierwiastków
o liczbach atomowych od 1 do 22
stosować regułę Hunda dla konfiguracji powłoki
walencyjnej
stosować poznane reguły do zapisu róŜnych postaci zapisywać róŜnymi sposobami konfigurację
konfiguracji elektronowych
elektronową pierwiastków grup głównych o
liczbach atomowych powyŜej 22
wskazywać połoŜenie bloków s i p w układzie
wskazywać połoŜenie bloku d w układzie
okresowym
okresowym
zapisywać konfigurację elektronową dla
ustalać zaleŜność między strukturą powłoki
walencyjnej a połoŜeniem pierwiastka w układzie
pierwiastków bloku d czwartego okresu
okresowym
wykorzystywać przynaleŜność do bloku w celu
zapisu konfiguracji tylko powloki walencyjnej
atomu
określać pojęcie elektroujemności
określać, jak zmienia się energia jonizacji w
określać, jak zmienia się elektroujemność w
układzie okresowym
układzie okresowym
określać pojecie powinowactwa elektronowego
posługiwać się skalą elektroujemności Paulinga
wiązać informacje dotyczące energii jonizacji i
określać, jak zmienia się promień atomu w układzie
powinowactwa elektronowego z wielkością
okresowym
elektroujemności
L.p
Temat lekcji
25.
Wiązania kowalencyjne, spolaryzowane i jonowe.
26.
Wiązanie koordynacyjne.
27.
Pisanie wzorów elektronowych.
28.
Określanie polarności cząsteczek.
29.
Budowa cząsteczki a właściwości związku – wiązania
międzycząsteczkowe.
30.
Szereg homologiczny alkanów.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
wyjaśniać, jak zmienia się promień kationu i
anionu w stosunku do macierzystego atomu
określać, jak zmienia się promień jonu w układzie
okresowym
wyjaśniać związek elektroujemności z tendencją
atomu do tworzenia kationów i anionów
proponować wzory sumaryczne i elektronowe
zapisywać konfigurację atomu w postaci wzoru
prostych cząsteczek zbudowanych z dwóch
Lewisa
wymieniać rodzaje wiązań
pierwiastków
opisywać, w jaki sposób powstają wiązania
kowalencyjne, kowalencyjne spolaryzowane i
jonowe
określać rodzaj wiązania w podanej cząsteczce
zapisywać wzory prostych cząsteczek
kowalencyjnych i związków jonowych wzorami
Lewisa przy podanym wzorze sumarycznym
wyjaśniać warunki, jakie muszą spełniać atomy
zapisywać wzory elektronowe związków, w
tworzące wiązanie koordynacyjne
których występuje wiązanie koordynacyjne
wykorzystywać poznane wiadomości i
wyjaśniać róŜnicę w sposobie tworzenia i trwałości
umiejętności do zapisu wzoru elektronowego
wiązania σ i π
cząsteczki i określenia rodzaju wiązań
ustalać zaleŜność między wzorem elektronowym a
budową przestrzenną prostej cząsteczki
interpretować pojęcie polarności
uzasadniać polarność cząsteczek poprzez analizę
określać kierunek polaryzacji
rodzaju wiązania i kształtu cząsteczki
przewidywać polarność cząsteczki na podstawie
analizy jej budowy
uzasadniać właściwości typowego związku,
proponować właściwości pierwiastka na podstawie
posługując się budową elektronową jego cząsteczki
jego budowy elektronowej
rozróŜniać rodzaje sieci krystalicznych,
określać warunki tworzenia się wiązania
uwzględniające typy wiązań w sieci
wodorowego
opisać oddziaływania międzycząsteczkowe
proponować właściwości związku,. posługując się
analizą budowy elektronowej jego cząsteczki
V. Węglowodory.
wyjaśniać pojęcia: węglowodór nasycony, alkan,
określić rodzaje wiązań w alkanach (σ i π)
L.p
Temat lekcji
31.
Izomeria konstytucyjna w alkanach.
32.
Nazewnictwo i właściwości fizyczne alkanów.
33.
Reakcje alkanów – substytucja i spalanie alkanów.
34.
Szereg homologiczny alkenów – nazewnictwo i
izomeria geometryczna.
35.
Otrzymywanie i właściwości alkenów.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
szereg homologiczny
opisać i narysować kształty cząsteczek metanu,
etanu i propanu
podać wzór ogólny szeregu alkanów
określić, które z podanych związków są izomerami, napisać wzory strukturalne izomerów heptanu i
a które homologami
oktanu
napisać wzory strukturalne izomerów butanu,
pentanu i heksanu
wyjaśnić pojęcie izomerii konstytucyjnej
podać nazwy n-alkanów C1-C10
zastosować zasady nazewnictwa systematycznego
celem nazwania większych lub mniej typowych
nazwać alkan o podanym wzorze strukturalnym
napisać wzór strukturalny alkanu na podstawie
cząsteczek
podać nazwy zwyczajowe izomerów butanu i
podanej nazwy
pentanu
omówić zmiany właściwości fizycznych alkanów
wraz ze wzrostem długości łańcucha
wyjaśnić, dlaczego dany alkan ma określone
właściwości fizyczne
wymienić rodzaje oddziaływań miedzy
cząsteczkami alkanów
napisać równanie reakcji spalania i półspalania
przewidzieć, jakie izomeryczne produkty powstaną
dowolnego alkanu
w reakcji chlorowcowania alkanów o dłuŜszym
napisać równanie reakcji chlorowania i
łańcuchu
bromowania alkanu C1-C4
wśród podanych reakcji wskazać reakcję
substytucji
wyjaśnić, na czym polega reakcja substytucji
wyjaśnić pojęcia: węglowodór nienasycony, alken,
omówić rodzaje wiązań w cząsteczce etenu
izomery cis-trans
omówić kształt cząsteczki but-2-enu i wskazać,
które atomy leŜą na tej samej płaszczyźnie
podać wzór ogólny szeregu alkenów
określić kształt cząsteczki etenu
z podanych cząsteczek wybrać izomery cis-trans
nazwać alken o podanym wzorze strukturalnym
przewidzieć, które alkeny tworzą izomery cis-trans
i narysować ich wzory
napisać wzór alkenu na podstawie jego nazwy
narysować przykładowe wzory izomerów cis-trans
wymienić metody otrzymywania alkenów z
zaproponować metodę rozróŜnienia węglowodoru
alkoholi i chlorowcopochodnych
nasyconego i nienasyconego
zapisać równania reakcji otrzymywania alkenów
przewidzieć produkt główny reakcji addycji do
wskazać reakcje addycji i eliminacji
niesymetrycznego alkenu
L.p
Temat lekcji
36.
Alkiny – nazewnictwo, budowa i właściwości.
37.
Budowa i właściwości benzenu.
38.
Homologi i pochodne wielopierścieniowe benzenu
39.
Reakcje benzenu i toluenu.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
wymienić reakcje charakterystyczne dla alkenów
zapisać równanie reakcji addycji do symetrycznego
alkenu
omówić zmiany właściwości fizycznych alkenów
wraz ze wzrostem długości łańcucha
opisać budowę i kształt cząsteczek alkinów
omówić budowę etynu
omówić rodzaje wiązań w cząsteczkach alkinów
określić kształt cząsteczki etynu
zapisać równanie reakcji addycji do symetrycznych
podać nazwę alkinu o określonym wzorze
alkinów
zapisać wzór alkinu na podstawie nazwy
zapisać równanie reakcji addycji do
wymienić metody otrzymywania alkinów z
niesymetrycznych alkinów
chlorowcopochodnych
zapisać równania reakcji otrzymywania alkinów na zaprojektować doświadczenie wykazujące
nienasycony charakter etynu
drodze eliminacji
zapisać równanie reakcji otrzymywania etynu z
karbidu
zapisać równania reakcji addycji do etynu
opisać zastosowania acetylenu
omówić budowę cząsteczki benzenu
uzasadnić aromatyczny charakter benzenu przez
wyjaśnić pojęcia: węglowodór aromatyczny,
analizę struktury elektronowej cząsteczki
wyjaśnić pojecie: elektrofil, substytucja
elektrony zdelokalizowane, pierścień aromatyczny
opisać właściwości fizyczne i chemiczne benzenu
elektrofilowa
zapisać równania reakcji nitrowania i chlorowania
zaprojektować doświadczenie pozwalające
odróŜnić węglowodór aromatyczny od
benzenu
zapisać równanie reakcji spalania benzenu w
alifatycznego
powietrzu i tlenie
zapisać wzory i podać nazwy najbliŜszych
podać nazwy wskazanych przez nauczyciela
homologów benzenu
pochodnych benzenu
zastosować w nazewnictwie przedrostki: orto-,
podać nazwy wskazanych przez nauczyciela
meta-, parapochodnych naftalenu
omówić budowę i właściwości naftalenu
wyjaśnić aromatyczny charakter naftalenu
uzasadnić właściwości fizyczne naftalenu na
podstawie analizy budowy jego cząsteczki
zapisać równania reakcji, którym ulega benzen i
uwzględnić kierujący wpływ podstawników w
toluen
reakcjach substytucji elektrofilowej celem
nazwać wielopodstawione pochodne benzenu
określenia produktów reakcji
zaproponować wieloetapową syntezę związku
Poziom wymagań
L.p
Temat lekcji
40.
Naturalne źródła węglowodorów.
41.
Nazewnictwo i otrzymywanie alkoholi
jednowodorotlenowych.
42.
Reakcje alkoholi jednowodorotlenowych.
43.
Alkohole wielowodorotlenowe.
PODSTAWOWE
Uczeń będzie umiał:
wymienić naturalne źródła węglowodorów
wymienić podstawowe frakcje z destylacji ropy
naftowej oraz określić ich zastosowania
opisać proces krakingu i reformingu
VI. Jedno- i wielofunkcyjne pochodne węglowodorów.
nazwać prosty alkohol jednowodorotlenowy
napisać wzór alkoholu jednowodorotlenowego na
podstawie jego nazwy
określić rzędowość alkoholu
jednowodorotlenowego
napisać wzory izomerycznych alkoholi
jednowodorotlenowych C1-C4
wymienić metody otrzymywania alkoholi
napisać równania reakcji otrzymywania prostych
alkoholi z alkenu i chlorowcopochodnej
zapisać równanie reakcji fermentacji alkoholowej
glukozy
opisać właściwości fizyczne metanolu, etanolu i
butan-1-olu
wymienić reakcje charakterystyczne dla alkoholi
zapisać równania reakcji substytucji i eliminacji dla
prostych alkoholi jednowodorotlenowych
zapisać równania reakcji prostych alkoholi
jednowodorotlenowych z sodem
podać systematyczna i zwyczajową nazwę glicerolu
i glikolu etylenowego
określić, jakie alkohole zalicza się do
wielowodorotlenowych
opisać właściwości fizyczne glikolu etylenowego i
glicerolu
napisać równania reakcji glicerolu i glikolu
etylenowego z sodem
PONADPODSTAWOWE
Uczeń będzie umiał:
aromatycznego
wyjaśnić pojecie liczby oktanowej
podać nazwy zwyczajowe butanoli
wypisać wzory i podać nazwy izomerycznych
alkoholi o dłuŜszym łańcuchu
zapisać równanie reakcji przemysłowej metody
otrzymywania metanolu
uzasadnić właściwości fizyczne metanolu, etanolu i
butan-1-olu na podstawie budowy ich cząsteczek
przewidzieć właściwości fizyczne alkoholu
jednowodorotlenowego na podstawie wzoru
związku
nazwać prosty alkoholan
zapisać równania reakcji hydrolizy alkoholanów i
określić odczyn roztworu
uzasadnić właściwości fizyczne glicerolu i glikolu
etylenowego na podstawie budowy ich cząsteczek
podać nazwę systematyczną prostego alkoholu
wielowodorotlenowego
podać metodę otrzymywania glikolu etylenowego
zaproponować metodę rozróŜnienia alkoholi
jednowodorotlenowych od glikolu etylenowego lub
glicerolu
określić warunki trwałości alkoholi
wielowodorotlenowych
L.p
Temat lekcji
44.
Fenole – nazewnictwo, właściwości i budowa.
45.
Rola alkoholu i fenoli w Ŝyciu codziennym.
46.
Aceton i metanal, jako przedstawiciele aldehydów i
ketonów.
47.
Wykorzystanie acetonu i formaldehydu w
gospodarce.
Kwasy karboksylowe – nazewnictwo i właściwości.
48.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
Podać nazwy zwyczajowe najbliŜszych homologów
rozróŜnić wzory alkoholi i fenoli
fenolu
podać nazwy systematyczne najbliŜszych
Wyjaśnić na podstawie budowy cząsteczki kwasowy
homologów fenolu
charakter fenolu
opisać właściwości fizyczne fenolu
opisać właściwości chemiczne fenolu
Wyjaśnić wpływ grupy –OH na aktywność
zapisać równanie reakcji nitrowania i zobojętniania pierścienia aromatycznego
fenolu
porównać właściwości alkoholi i fenoli
zaproponować metodę rozróŜnienia alkoholu i
wymienić zastosowania etanolu, glikolu
fenolu
etylenowego, glicerolu i fenolu
zaproponować kilkuetapową syntezę alkoholu i
fenolu
wyjaśnić pojęcie: związek karbonylowy, grupa
omówić róŜnice w strukturze aldehydów i ketonów
i wynikające z tego właściwości związków
karbonylowa, aldehyd, keton
zaproponować metodę rozróŜnienia aldehydów i
rozróŜniać wzory aldehydów i ketonów
podać nazwy systematyczne prostych aldehydów i
ketonów
ketonów
opisać próbę Tollensa i Trommera i zapisać
podać sposób otrzymywania aldehydów i ketonów
równania reakcji dla obu tych prób
podać wzory alkoholi, z których powstaje
określony aldehyd lub keton
opisać właściwości fizyczne metanalu i acetonu
określić róŜnice aldehydów i ketonów w zdolności
do ulegania procesowi utlenienia
wymienić zastosowania acetonu i metanalu
wyjaśnić pojecie polikondensacji
wyjaśnić pojecie polimeryzacji
wskazać grupę karboksylowa w cząsteczce związku zaproponować kilkuetapową syntezę kwasu
określić typ reakcji otrzymywania kwasów
karboksylowego
wyjaśnić właściwości fizyczne i chemiczne
karboksylowych
napisać wzór aldehydu lub alkoholu, z którego
kwasów karboksylowych na podstawie budowy ich
otrzymuje się dany kwas
cząsteczek
podać nazwy systematyczne prostych kwasów
karboksylowych
podać nazwy zwyczajowe kwasu mrówkowego,
octowego, masłowego, palmitynowego,
stearynowego i oleinowego
opisać właściwości fizyczne kwasu octowego i
stearynowego
L.p
Temat lekcji
49.
Reakcje otrzymywania estrów i ich właściwości.
50.
Tłuszcze, jako rodzaj estrów.
51.
Zmydlanie tłuszczu – właściwości mydeł i
detergentów.
52.
Porównanie budowy i właściwości glukozy i
fruktozy.
53.
Dwucukry redukujące i nieredukujace.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
napisać równania reakcji prostych kwasów z
metalami, tlenkami metali i wodorotlenkami
podać nazwę prostego estru
wyjaśnić właściwości estru na podstawie budowy
opisać właściwości fizyczne octanu etylu
cząsteczek
napisać równanie reakcji estryfikacji
napisać równanie reakcji hydrolizy estru
opisać budowę tłuszczu
zapisać wzór tłuszczu nasyconego i nienasyconego
opisać właściwości fizyczne tłuszczu
wyjaśnić właściwości fizyczne tłuszczu na
wyjaśnić związek budowy cząsteczek tłuszczu z
podstawie analizy struktury cząsteczki
jego stanem skupienia
zaproponować metodę odróŜnienia tłuszczu
nasyconego od nienasyconego
omówić sposób otrzymywania margaryny z oleju
roślinnego
wyjaśnić, na czym polega zmydlanie tłuszczu
zapisać równanie reakcji zmydlania tłuszczu
omówić budowę mydła
wyjaśnić pojecie twardości wody
wyjaśnić pojecie detergentu
omówić piorące właściwości mydła
zapisać równania reakcji hydrolizy soli kwasów
nazwać proste sole kwasów karboksylowych
zapisać wzór soli kwasu karboksylowego na
karboksylowych i określić odczyn roztworu
podstawie nazwy
podać metody otrzymywania soli kwasów
karboksylowych
zapisać równania reakcji otrzymywania prostych
soli kwasów karboksylowych
wyjaśnić pojęcia: związek wielofunkcyjny, cukier
napisać wzory Fischera i Hawortha fruktozy i
prosty, aldoza, ketoza, pentoza, heksoza, pierścień
glukozy
hemiacetalowy, cukry szeregu L i D, anomery α i β wyjaśnić pojecie cukier redukujący
wymienić rodzaje grup funkcyjnych występujących zinterpretować próbę Fehlinga
omówić reakcjekompleksowania Cu(OH)2 za
w cząsteczkach aldoz i ketoz
pomocą glukozy, jako dowód struktury jej
zaliczyć glukozę i fruktozę do odpowiednich grup
cząsteczki
cukrów
opisać właściwości fizyczne glukozy
wyjaśnić pojęcia: dwucukier, wiązanie
napisać wzory maltozy i sacharozy
glikozydowe
wyjaśnić pojecie wiązania α- i β-glikozydowego
wyjaśnić, na czym polega hydroliza dwucukru
omówić związek właściwości redukujących cukru z
opisać róŜnice w budowie i właściwościach
jego struktura
L.p
Temat lekcji
54.
Polisacharydy.
55.
Otrzymywanie i właściwości amin.
56.
Budowa i właściwości aminokwasów.
57.
Struktura i właściwości białek.
58.
Czynniki wpływające na szybkość reakcji.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
sacharozy i maltozy
omówić właściwości fizyczne sacharozy
wyjaśnić pojecie: polisacharyd
omówić budowę skrobi i celulozy
wymienić podstawowe polisacharydy występujące
wyjaśnić właściwości fizyczne i chemiczne skrobi i
w przyrodzie
celulozy na podstawie budowy ich cząsteczek
opisać właściwości fizyczne skrobi i celulozy
zaproponować metodę rozróŜnienia celulozy i
skrobi
zaproponować metodę identyfikacji skrobi w
produktach spoŜywczych
omówić budowę metyloaminy i aniliny
porównać właściwości metyloaminy i aniliny i
określić rzędowość amin o podanych wzorach
powiązać je z budową cząsteczek
podać nazwy prostych amin
zapisać równania reakcji amin z HCl
wyjaśnić, na czym polegają zasadowe właściwości
amin
napisać równania reakcji otrzymywania
metyloaminy i aniliny
wymienić grupy funkcyjne wchodzące w skład
wyjaśnić pojecie jonu obojnaczego
cząsteczki aminokwasu
opisać kwasowo-zasadowe właściwości
aminokwasów
wyjaśnić pojecie: aminokwas białkowy
podać wzór glicyny i alaniny
napisać równania reakcji glicyny i alaniny z NaOH
zapisać wzory peptydów zbudowanych z glicyny i
i HCl
alaniny
na wzorze peptydu określić połoŜenie wiązań
peptydowych
zapisać równanie reakcji otrzymywania
dwupeptydu
wyjaśnić, na czym polega I-, II- i III-rzędowa
wyjaśnić róŜnice w procesach denaturacji i
struktura białka
wysalania białka
wymienić czynniki denaturujące białko
zaproponować metodę identyfikacji białka
VII. Procesy równowagowe w roztworach.
wymienić czynniki wpływające na szybkość reakcji zaproponować doświadczenie ilustrujące wpływ
wyjaśnić pojecie katalizatora i inhibitora
róŜnych czynników na szybkość reakcji
rozróŜnić katalizatory homogeniczne i
zaproponować róŜne metody przyspieszenia
heterogeniczne
określonej reakcji
opisać doświadczenie ilustrujące wpływ
temperatury i stęŜenia substratów na szybkość
Poziom wymagań
L.p
Temat lekcji
PODSTAWOWE
Uczeń będzie umiał:
reakcji
zdefiniować pojęcie reakcji egzo- i
endoenergetycznej
rozróŜnić w danym doświadczeniu układ i
otoczenie
ocenić, które ze wskazanych przez nauczyciela
reakcji są egzo-, a które endotermiczne
podać przykład reakcji egzotermicznej
59.
Reakcje egzo- i endoenergetyczne.
60.
Ustalanie się równowagi w przypadku reakcji
odwracalnych.
wyjaśnić pojęcie reakcji odwracalnej i
nieodwracalnej
podać przykłady typowych reakcji odwracalnych
napisać wyraŜenie na stałą równowagi reakcji
61.
Dysocjacja elektrolityczna kwasów – moc kwasów.
62.
Pisanie równań dysocjacji kwasów i zasad –
nazywanie jonów.
63.
Pisanie równań dysocjacji soli i nazywanie jonów.
64.
Stała dysocjacji, jako przykład stałej równowagi
reakcji.
wyjaśnić pojecie dysocjacji elektrolitycznej i
elektrolitu
podzielić kwasy na mocne i słabe
zapisać równania dysocjacji kwasów mocnych i
słabych, jedno- i wieloprotonowych
zapisać równania dysocjacji zasad mocnych i
słabych
podać nazwy jonów powstałych w wyniku
dysocjacji kwasów i zasad
zapisać wzory jonów powstałych podczas
dysocjacji kwasów i8 zasad
zapisać równania dysocjacji soli
podać nazwy jonów powstałych w wyniku
dysocjacji soli
zapisać wzory jonów powstałych podczas
dysocjacji soli
zapisać wyraŜenia na stałe dysocjacji kwasów i
zasad
posługiwać się wartością stałej dysocjacji w celu
określenia mocy kwasu
PONADPODSTAWOWE
Uczeń będzie umiał:
zdefiniować energię aktywacji
zdefiniować pojęcie energii wewnętrznej układu
wyjaśnić mechanizm reakcji, posługując się teoria
zderzeń i kompleksu aktywnego
narysować wykres zmian energii wewnętrznej
podczas przebiegu reakcji
wyjaśnić na podstawie teorii zderzeń wpływ
poszczególnych czynników na szybkość reakcji
wyjaśnić pojecie równowagi dynamicznej
sformułować prawo działania mas
ocenić na podstawie wartości stałej równowagi
reakcji, w która stronę jest przesunięte połoŜenia
równowagi
omówić mechanizm reakcji dysocjacji
wyjaśnić zdolność substancji do dysocjacji na
podstawie budowy jej cząsteczek
utworzyć nazwę mniej typowego jonu
omówić mechanizm dysocjacji soli
obliczyć stęŜenie jonów powstałych w wyniku
dysocjacji kwasu jednoprotonowego, posługując się
wartością stałej lub stopnia dysocjacji
obliczyć stopień dysocjacji kwasu
jednoprotonowego.
L.p
Temat lekcji
65.
Skala pH, jako miernik kwasowości i zasadowości
roztworu.
66.
Przypomnienie wiadomości o stęŜeniach.
67.
Roztwory nasycone i nienasycone.
68.
Reakcje zobojętniania i strącania osadów, jako
przykłady reakcji jonowych.
69.
Wpływ stęŜenia roztworów na moŜliwości
wytrącania osadów.
70.
Proces hydrolizy soli.
Poziom wymagań
PODSTAWOWE
PONADPODSTAWOWE
Uczeń będzie umiał:
Uczeń będzie umiał:
posługiwać się pojęciem pH dla określenia odczynu podać metody pomiaru pH roztworu
roztworu
obliczyć pH roztworu mocnego kwasu i mocnej
wymieniać wskaźniki kwasowo-zasadowe
zasady
obliczyć pH roztworu o znanym stęŜeniu jonów
wodorowych lub wodorotlenowych
wykorzystać iloczyn jonowy wody dla obliczenia
stęŜenia jonów wodorowych i wodorotlenowych
obliczyć stęŜenie molowe jonów w roztworze
przeloczyc stęŜenie roztworu z molowego na
obliczyć stęŜenie procentowe roztworu
procentowe i odwrotnie
obliczyć stęŜenie roztworu poddanego
rozcieńczeniu
wykonać obliczenia stechiometryczne dotyczące
reakcji pomiędzy roztworami
posługiwać się pojęciem roztworu nasyconego i
omówić mechanizmy rozpuszczania związków
nienasyconego
niejonowych w wodzie
przeprowadzić trudniejsze obliczenia związane z
wyjaśniać mechanizm rozpuszczania związków
jonowych w wodzie
rozpuszczalnością
wyjaśniać pojecie hydratacji
zinterpretować tabelę i wykres rozpuszczalności
przeprowadzić proste obliczenia związane z
rozpuszczalnością
wskazać reakcję zobojętniania i strącania
zaproponować doświadczenie ilustrujące proces
zapisać jonowe równania reakcji zobojętniania i
zobojętniania i strącania
strącania
omówić metodę miareczkowania
opisać doświadczenie ilustrujące zobojętnianie i
alkacymetrycznego
strącanie
omówić wpływ stęŜenia roztworu na łatwość
zaproponować doświadczenie ilustrujące wpływ
wytrącania się osadu
stęŜenia roztworu na moŜliwość wytrącanie się
zapisać jonowe równanie reakcji strącania
osadu
opisać doświadczenie ilustrujące wpływ stęŜenia
przeprowadzać trudniejsze obliczenia związane z
roztworu na moŜliwość wytracania się osadu
rozpuszczalnością
podzielić sole na ulęgające i nieulegajace
zaproponować doświadczenie ilustrujące proces
hydrolizie
hydrolizy soli
zapisać jonowe równanie reakcji hydrolizy
wskazać procesy hydrolizy zachodzące w
określić odczyn roztworu wskazanej soli
przyrodzie i gospodarstwie domowym
opisać doświadczenie ilustrujące proces hydrolizy
Poziom wymagań
L.p
Temat lekcji
71.
Stopnie utlenienia pierwiastka w cząsteczce i jonie.
72.
Procesy redoks – bilans elektronowy i materiałowy
reakcji.
73.
Uzgadnianie współczynników reakcji redoks za
pomocą bilansu elektronowego i materiałowego.
74.
Typowe reakcje redoks – utleniacze i reduktory.
75.
Utleniające właściwości związków chromu i
manganu.
76.
Podsumowanie.
PODSTAWOWE
Uczeń będzie umiał:
soli
VIII. Procesy zachodzące z wymiana elektronów.
obliczyć stopień utlenienia pierwiastka w typowej
cząsteczce lub jonie
określić, czy dane równanie opisuje reakcję redoks
wskazać proces utleniania i redukcji w danym
równaniu
wskazać utleniacz i reduktor
przeprowadzić bilans elektronowy i materiałowy
dla prostej reakcji
przeprowadzić bilans elektronowy i materiałowy
oraz uzgodnić współczynniki w prostym równaniu
reakcji
wymienić typowe utleniacze i reduktory
opisać doświadczenie przebiegające z udziałem
typowego utleniacza i reduktora
opisać utleniające właściwości tlenu i chloru
zapisać równania reakcji kwasów z metalami
zapisać równania reakcji przebiegających z
udziałem tlenu i chloru
opisać doświadczenie ilustrujące utleniające
właściwości jonu MnO4- i Cr2O72 zbilansować podane równania reakcji
przebiegających z udziałem jonów MnO4- i Cr2O72-
wyjaśnić pojecie korozji
omówić sposoby zapobiegania korozji
PONADPODSTAWOWE
Uczeń będzie umiał:
zdefiniować pojecie stopnia utlenienia
obliczyć stopień utlenienia pierwiastka w mniej
typowej cząsteczce lub jonie
zdefiniować pojęcia: reduktor, utleniacz, utlenienie,
redukcja
podać róŜne sposoby zapisu równań połówkowych
przeprowadzić bilans elektronowy i materiałowy
oraz uzgodnić współczynniki w trudniejszym
równaniu reakcji
przeprowadzić i zinterpretować reakcje kwasów z
metalami
opisać utleniające właściwości tlenu i chloru
zaproponować doświadczenie ilustrujące przebieg
reakcji z udziałem jonów MnO4- i Cr2O72 omówić zaleŜność reakcji redukcji jonów MnO4- i
Cr2O72 od pH roztworu
zapisać równanie reakcji przebiegającej a udziałem
jonów MnO4- i Cr2O72 podać przykłady reakcji redoks występujące w
Ŝyciu codziennym
wyjaśnić pojecie przeciwutleniacza.