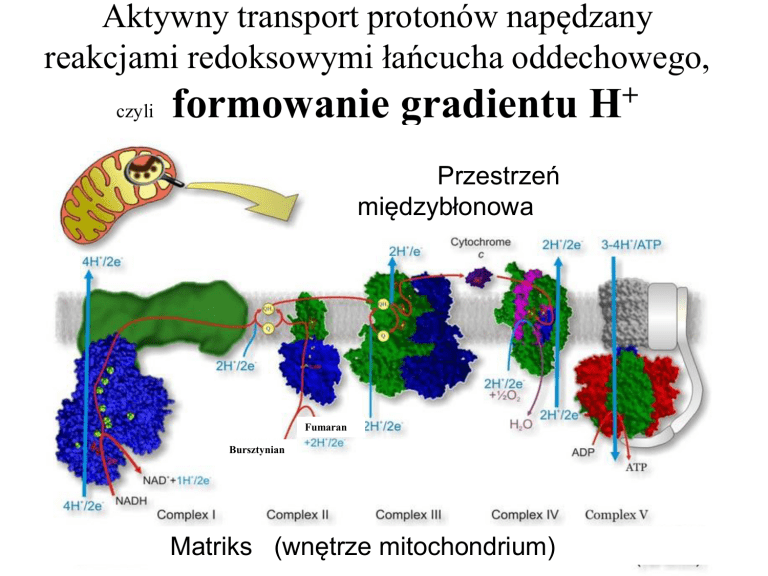
Aktywny transport protonów napędzany
reakcjami redoksowymi łańcucha oddechowego,
czyli
formowanie gradientu H+
Przestrzeń
międzybłonowa
Fumaran
Bursztynian
Matriks (wnętrze mitochondrium)
Cztery wielkocząsteczkowe kompleksy
białkowe + koenzym Q i cytochrom C, są
podstawowymi komponentami
Mitochondrialnego Łańcucha Oddechowego:
Koenzym Q przemieszcza się swobodnie w
hydrofobowej dwuwarstwie lipidowej wewnętrznej
błony mitochondrialnej, pomiędzy jego miejscami
wiążącymi, w odpowiednich kompleksach
białkowych.
Cytochrome C jest zlokalizowany w przestrzeni
międzybłonowej. Wiąże się z kompleksem III i IV
przenosząc elektrony.
Łańcuch oddechowy
Błona wewnętrzna
Łańcuch oddechowy
wewnętrznej błony
mitochondrialnej jest
głównym źródłem energii
komórek eukariotycznych.
Składa się z czterech
białkowych „generatorów
energii”, które przekształcają
chemiczną energię reakcji
redoksowych w transmembranowy potencjał
electro-chemiczny gradientu
protonowego.
Schemat ogólny reakcji
łańcucha oddechowego
Różnica potencjału
redoksowego pomiędzy
poziomem NADH a poziomem
H2O wynosi:
0,82 V-(-0,32V) = 1.14 Volta
Zastosuj powyższą wielkość
(E) do obliczenia energii
Gibbsa dla całego łańcucha
oddechowego.
(patrz przezrocze nr 6 wykładu
z energetyki
Kompleks I , Dehydrogenaza NADH – Koenzym Q. Patrz 3D modele
dla 10 różnych gatunków. Uderzające podobieństwo kształtu pomiędzy
bakteryjnymi a mitochondrialnymi kompleksami, zarówno zwierzęcymi
jak i roślinnymi.
Skład: 46 podjednostek białkowych (7 z nich to produkty
autonomicznych genów mitochondrialnych), FMN oraz 9 zespołów
Fe-S.
1. N. crassa. (Leonard et al., 1987)
2. N. crassa. (Hofhaus et al., 1991)
3. N. crassa (Guénebaut et al., 1997)
4. E. coli NDH-1 (Guénebaut et al., 1998)
5. Bydlęca – z m. sercowego (Grigorieff, 1998)
6. Y. lipolytica (Radermacher et al., 2006)
7 i 8. E. coli (Böttcher et al., 2002); 7 jest postacią „nieaktywną”, 8 "aktywną".
9. Arabidopsis (Dudkina et al., 2005)
10. Bydlęca (Clason et al., 2010)
Dehydrogenaza NADH (kont.)
Ogólnie, reakcja katalizowana przez ten kompleks polega na
odebraniu dwóch elektronów z NADH i ich przeniesieniu na
ubichinon (Q). Powstały produkt, ubiquinol (QH2) swobodnie
dyfunduje wewnątrz błony a energia uwolniona w tym
procesie redoksowym służy do translokacji czterech protonów
(H+) na zewnątrz błony. Kompleks nr I jest także jednym z
miejsc, gdzie może dojść do przedwczesnego przecieku
elektronów na tlen, co prowadzi do powstania szkodliwych
nadtlenków.
Sam przepływ elektronów wewnątrz kompleksu odbywa się
wielostopniowo, przy udziale dodatkowych przenośników:
Flawino-mononukleotydu oraz zespołów Fe-S. Z nich
elektrony pojedynczo przechodzą na ubichinon (Q), tworząc
kolejno semichinol a następnie ubichinol.
Dehydrogenaza bursztynianowa
(SDH, Kompleks II)
Skład: Cztery
podjednostki białkowe
(A,B,C,D) oraz
następujące
przenośniki
elektronów:
FADH2,
zespoły Fe-S,
hem b560,
ubichinon.
Dehydrogenaza bursztynianowa
lub
Oksydoreduktaza Bursztynian - Koenzym Q
Kompleks II jest enzymem wnętrza mitochondrium, lecz
mocno osadzonym w wewnętrznej błonie mitochondrialnej
eukariontów lub w błonach komórek bakteryjnych.
Jest jedynym enzymem biorącym bezpośredni udział zarówno w
cyklu Krebsa jak i w łańcuchu transportu elektronów.
W ósmym etapie cyklu kwasów trikarboksylowych (Krebsa),
SDH katalizuje utlenienie bursztynianu do fumaranu we wnętrzu
mitochondrium, oraz sprzęga tą reakcję z redukcją ubichinonu
do ubichinolu wewnątrz lipidowej błony mitochondrialnej.
Reakcja mitochondrialnej matriks
katalizowana przez kompleks SDH
Cała reakcja (netto) katalizowana
przez kompleks II
Kompleks III. Oksydoreduktaza
Koenzym Q – Cytochrom C
Skład: 11 podjednostek białkowych (w tym jedna
kodowana przez mitochondrialne DNA), oraz 3
centra redoksowe:
Cytochromy bH and bl, Cytochrom c1, Zespół Fe-S
Rieske’go (niezwykły zespół Fe-S w którym dwie
reszty histydynowe zastępują reszty cysteinowe w
mocowaniu jednego z atomów żelaza).
Reakcje kompleksu III:
Dwa elektrony odebrane od QH2 (w miejscu jego wiązania Qo) są
kolejno przenoszone na dwie cząsteczki cytochromu c, przenośnika
ulokowanego w fałdach przestrzeni międzybłonowej.
Dwa inne elektrony są również kolejno przenoszone do drugiego
miejsca wiązania ubichinonu (Qi), gdzie dochodzi do częściowej
redukcji chinonu do chinolu.
Pompowanie protonów odbywa się dzięki utlenieniu dwóch cząstek
chinolu w miejscu Qo tak, aby utworzyć jeden chinol w miejscu Qi.
W sumie, sześć protonów jest przeniesionych: dwa z nich redukują
chinon do chinolu a cztery zostają uwolnione po stronie zewntrznej.
Kompleks bc1 pomaga więc w formowaniu gradientu protonowego
dzięki asymetrycznemu wychwytywaniu i uwalnianiu protonów.
Uszkodzenia funkcji kompleksu III (np. przez aktynomycynę) mogą
również prowadzić do powstawania szkodliwych nadltenków.
Kompleks IV – oksydaza
cytochromowa
Skład: 13 podjednostek białkowych (3
kodowane przez mitochondrialny DNA),
3 atomy miedzi i dwie cząsteczki hemu
A (w cytochromach a i a3), które służą
jako grupy prostetyczne, bezpośrednio
zaangażowane w transport elektronów.
Reakcje kompleksu IV
Cztery elektrony, usuwane z czterech
cząsteczek cytochromu c i przenoszone na
tlen cząsteczkowy (O2), dają dwie
cząsteczki wody. Równocześnie, cztery
protony są aktywnie transportowane przez
błonę, przyczyniając się do formowania
gradientu protonowego. Aktywność tego
kompleksu jest nieodwracalnie hamowana
przez cyjanki.
Efektywność łańcucha oddechowego
Energia uwolniona przez parę elektronów wędrujących
przez cały łańcuch oddechowy, może być wyliczona z
wielkości potencjału redoksowego (1,14 Voltów), i
wynosi w przybliżeniu 220 kJ/mol. Natomiast liczba
cząsteczek ATP syntetyzowana i zmagazynowana po
użyciu tej energii wynosi 2.5. Taka ilość ATP jest
równoważna ok. 75 kJ. Zatem maksymalna wydajność
syntezy ATP w mitochondiach wynosi około 35% .
Jeśli jednak para elektronów odbywa krótszą drogę (z
poziomu FAD) ilość zmagazynowanej energii jest
mniejsza (tylko 1,5 cząsteczek ATP).
Przerzut elektronów z cytozolowych
układów redoksowych to mitochondrium
NADH nie jest w stanie penetrować błony mitochondrialnej, ale istnieją
dwa specjalne mechanizmy (czółenka), przeznaczone do przerzucania
elektronów z cytozolu do mitochondrium:
1. Czółenko glicerofosforanowe (mózg, mięśnie szkieletowe i inne
tkanki) jest w stanie przenieść dwa elektrony z cytozolu do dwuwarstwy
lipidowej wewnętrznej błony mitochondrialnej, gdzie ich akceptorem jest
cząsteczka FAD.
oraz
2. Czółenko jabłczanowo - asparaginianowe (mięsień sercowy i
wątroba) które jest w stanie przenieść parę electronów na akceptorową
cząsteczkę NAD, zlokalizowaną w mitochondrialnej matriks
Czółenko glicerofosforanowe
Ponieważ FAD jest tu
akceptorem, para
elektronów przerzucana
przez ten układ, może
przejść przez tylko dwa
kompleksy pompujące
protony (III i IV) w
łańcuchu oddechowym.
Zatem tylko 1,5
cząsteczki ATP może
powstać dzięki
uwolnionej energii.
Czółenko jabłczanowo -asparaginianowe
W tym czółenku,
wewnątrz mitochondrialna
cząsteczka NAD jest
użyta jako akceptor
pary elektronowej.
Wtedy wszystkie trzy
pompy H+ (I, III i IV)
są sprzęgane z
procesem tworzenia
gradientu protonowego.
Zatem para elektronów
daje tutaj 2,5 cząsteczki
ATP
Podsumowanie
Mitochondrialny łańcuch oddechowy polega na serii
egzoergicznych reakcji redoksowych, w wyniku których
dochodzi do przemieszczenia elektronów od pierwszego
donora (NADH lub QH2) na tlen jako końcowy acceptor.
Niektóre z tych reakcji są sprzężone z procesem
formowania gradientu protonowego w poprzek wewnętrznej
błony mitochondrialnej.
Trzy spośród czterech kompleksów katalizujących te
procesy (I, III i IV) są pompami protonowymi. Gradient
protonowy jest następnie użyty do produkcji ATP i do
innych celów omawianych na wykładzie z energetyki.
Ogólny schemat struktury mitochondrialnej syntazy ATP
Jest ona jednym z dwóch poznanych dotąd biologicznych
mechanizmów wykorzystujących ruch obrotowy.
Kompleks syntazy ATP jest silnikiem obrotowym na poziomie molekularnym,
napędzanym przepływem protonów
Cztery etapy syntezy ATP