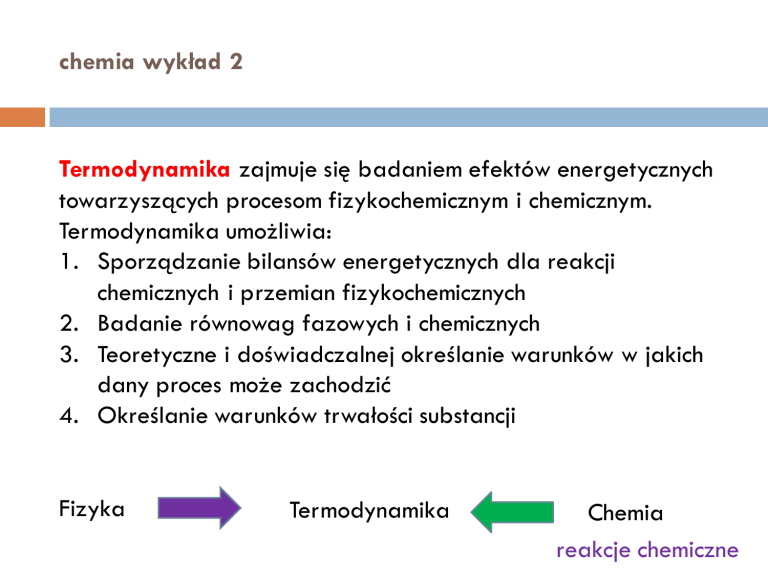
chemia wykład 2
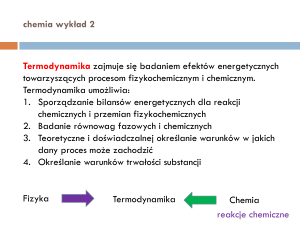
Termodynamika zajmuje się badaniem efektów energetycznych
towarzyszących procesom fizykochemicznym i chemicznym.
Termodynamika umożliwia:
1. Sporządzanie bilansów energetycznych dla reakcji
chemicznych i przemian fizykochemicznych
2. Badanie równowag fazowych i chemicznych
3. Teoretyczne i doświadczalnej określanie warunków w jakich
dany proces może zachodzić
4. Określanie warunków trwałości substancji
Fizyka
Termodynamika
Chemia
reakcje chemiczne
chemia wykład 2
ENERGIA JEST ZDOLNOŚCIĄ
WYKONANIA PRACY
h
T1>T2
gaz
chemia wykład 2
ENERGIA NIE MOŻE BYĆ TWORZONA ANI NIE MOŻE ULEC
ZNISZCZENIU
PRAWO ZACHOWANIA ENERGII
Prawo zachowania energii ma fundamentalne znaczenie dla chemii
gdyż większość reakcji chemicznych towarzyszy wydzielanie lub
obieranie energii, przemiana jednej formy energii w inną, a nie jej
zanik lub powstawanie.
Procesy dzielimy na egzotermiczne i endotermiczne.
chemia wykład 2
Układ- część przyrody, której zachowanie badamy
Otoczenie-część przyrody, w której dokonujemy
obserwacji
układ
otoczenie
chemia wykład 2
Układ otwarty - układ wymieniający z otoczeniem materię
i energię
Układ zamknięty - układ nie wymieniający z otoczeniem
materii
Układ izolowany - układ nie wymieniający z otoczeniem
materii i energii
chemia wykład 2
Układ izolowany termiczne od otoczenia nazywamy
układem adiabatycznym
Najczęściej rozpatruje się układy zamknięte
i izolowane
chemia wykład 2
Energię układu zamkniętego można zmienić
jedynie na dwa sposoby, na sposób pracy
i ciepła.
Praca ….
Ciepło….
chemia wykład 2
PRACA
energia jako praca
układ
CIEPŁO
energia jako ciepło
układ
Która z form energii została chronologicznie opanowana wcześniej?
chemia wykład 2
Energię układu zamkniętego można zmienić
jedynie na dwa sposoby, na sposób pracy
i ciepła.
Praca
przedstawia
przeniesienie
energii
powodujące jednolity ruch w otoczeniu bądź
będące skutkiem takiego ruchu.
Ciepło przedstawia
przeniesienie
energii
powodujące chaotyczny ruch w otoczeniu bądź
będące skutkiem takiego ruchu.
chemia wykład 2
Praca rozprężania inaczej praca objętościowa, czyli
praca wykonana gdy układ rozpręża się przeciwko
działającemu nań ciśnieniu.
DV=Ah
h
chemia wykład 2
𝑤 = 𝑝𝑧 ∗ ∆𝑉 praca w przeciwko stałemu ciśnieniu zewnętrznemu
𝑤 𝑚𝑎𝑥 = 𝑛𝑅𝑇𝑙𝑛
1.
2.
3.
𝑉𝑘
𝑉𝑝
praca maksymalna
układ wykonuje maksymalna pracę objętościową, gdy ciśnienie
zewnętrzne jest równe ciśnieniu panującemu
w układzie
układ wykonuje maksymalna pracę objętościową, gdy znajduje
się w stanie mechanicznej równowagi ze swym otoczeniem
(nieskończenie mała zmiana ciśnienia może spowodować
odwrócenie kierunku procesu)
układ wykonuje maksymalna pracę objętościową, gdy zmienia
się w sposób odwracalny (proces, którego kierunek można
odwrócić, zmieniając jakąś wielkość)
chemia wykład 2
𝑤 𝑚𝑎𝑥
𝑤=
𝑉𝑘
𝑉𝑝
𝑝 𝑑𝑉 =
𝑉𝑘
𝑉𝑝
𝑉𝑘
= 𝑛𝑅𝑇𝑙𝑛
𝑉𝑝
𝑛𝑅𝑇
𝑑𝑉 = 𝑛𝑅𝑇
𝑉
𝑉𝑘
𝑉𝑝
𝑑𝑉
𝑉𝑘
= 𝑛𝑅𝑇 𝑙𝑛
𝑉
𝑉𝑝
chemia wykład 2
Wielkością umożliwiającą śledzenie zmian energii układu jest
energia wewnętrzna
Praca wykonana przez układ (-)
Praca wykonana na układzie (+)
Ciepło oddane przez układ (-)
Ciepło przekazana do układu (+)
DU
DU=q+w
𝑤 = −𝑝𝑧 ∗ ∆𝑉 praca przeciwko stałemu ciśnieniu zewnętrznemu
𝑤 𝑚𝑎𝑥 = −𝑛𝑅𝑇𝑙𝑛
𝑉𝑘
𝑉𝑝
praca maksymalna
chemia wykład 2
DU-funkcja stanu
I-sza zasada termodynamiki
Zmiana energii wewnętrznej układu zamkniętego jest równa
energii, która przepływa przez jego granice na sposób ciepła
lub pracy
DU=q+w
V=const
DU=q
chemia wykład 2
Pojemność cieplna
Cv, Cp
Cp,m-Cv,m=R
Substancja
Właściwa
pojemność cieplna
[J/K g]
Molowa
pojemność cieplna
J/K mol
Benzen
1,05
136,1
Powietrze
1,01
29
Etanol
2,42
111,5
Woda ciecz
4,18
75,29
chemia wykład 2
ENTALPIA
p=const
DH=q
Reakcja egzotermiczna DH<0
Reakcja endotermiczna DH>0
DH=DU+pDV
chemia wykład 2
PRAWO HESSA
STANDARDOWA ENTALPIA REAKCJI JEST RÓWNA
SUMIE STANDARDOWYCH ENTALPII REAKCJI, NA
JAKIE MOŻNA ROZŁOŻYĆ DANĄ REAKCJĘ.
Ćw. lab
NaOH/H2O
Stosowalność prawa Hessa
chemia wykład 2
PRAWO KIRCHOFFA
𝑻𝟐
∆𝑯𝑻𝟐 = ∆𝑯𝑻𝟏 +
∆𝑪𝒑 𝒅𝑻
𝑻𝟏
chemia wykład 2
STANDARDOWA ENTALPIA REAKCJI JEST RÓWNA RRÓZNICY
STANDARDOWYCH
ENTALPII
TWORZENIA
PRODUKTÓW
I
SUBSTRATÓW, W KTÓREJ KAŻDY CZYNNIK JEST POMNOŻONY
PRZEZ WSPÓŁCZYNNIK STECHIOMETRYCZNY ODPOWIEDNIEGO
REAGENTA
∆𝐻⊝ =
𝑛Δ𝑡𝑤 𝐻⊝ −
𝑝𝑟𝑜𝑑𝑢𝑘𝑡𝑦
𝑛Δ𝑡𝑤 𝐻⊝
𝑠𝑢𝑏𝑠𝑡𝑟𝑎𝑡𝑦
Standardowa entalpia tworzenia substancji przedstawia standardową
entalpię reakcji, w której 1 mol substancji tworzy się z pierwiastków w
ich stanie podstawowym.
Standardowe entalpie tworzenia pierwiastków w ich stanach
podstawowych są z definicji równe zeru.
chemia wykład 2
Pierwiastek
Stan podstawowy
Azot
Gaz
Jod
Stały
Rtęć
Ciecz
Węgiel
Grafit
Siarka
Siarka rombowa
Związek
∆𝑡𝑤 H [kJ/mol]
Dwutlenek siarki
-296,83
Kwas siarkowy
-813,99
Benzen (c)
+49
Glukoza
-1268
Metanol
-238,86
Sacharoza
-2222
chemia wykład 2
Procesy samorzutne –
wykazują naturalna
tendencję do zachodzenia
Procesy niesamorzutne – nie wykazują naturalnej
tendencji do
zachodzenia, a
by wymusić proces
niesamorzutny
trzeba wykonać nad
układem pracę
chemia wykład 2
Siłą napędową procesów samorzutnych jest
tendencja energii i materii do zwiększania stanu
nieuporządkowania
samorzutnie
niesamorzutnie
chemia wykład 2
Stosowaną w termodynamice miarą
nieuporządkowania materii i energii jest ENTROPIA
oznaczana symbolem S
II-ga zasada termodynamiki
Entropia wszechświata ma tendencję do
zwiększania się
chemia wykład 2
Organizm człowieka pozostającego w spoczynku wytwarza około
100 W ciepła. Określ zmianę entropii otoczenia o temp. 20st C
wywołaną w ciągu doby przez spoczywającego człowieka.
ciepło dostarczone otoczeniu w ciągu doby wynosi:
q = 86 400 s x 100 J/s = 8,64 x10 6 [J]
zmiana entropii otoczenia wynosi więc
DS (ot) = 8,64 x10 6 [J] / 293 K = +2,95x10 4 [J/K]