1
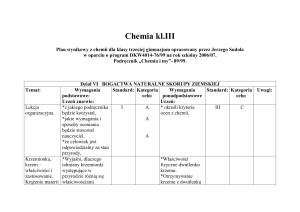
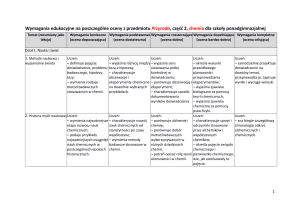
PLAN WYNIKOWY
CHEMIA
KLASA III
NAUCZYCIEL : Jolanta Galach
Nr
lekcji
NUMER PROGRAMU
Temat lekcji
Wymagania
Podstawowe
uczeń wie, umie:
1.
2.
3.
4.
Ponadpodstawowe
uczeń wie, umie:
DZIAŁ: WĘGIEL I JEGO ZWIĄZKI Z WODOREM
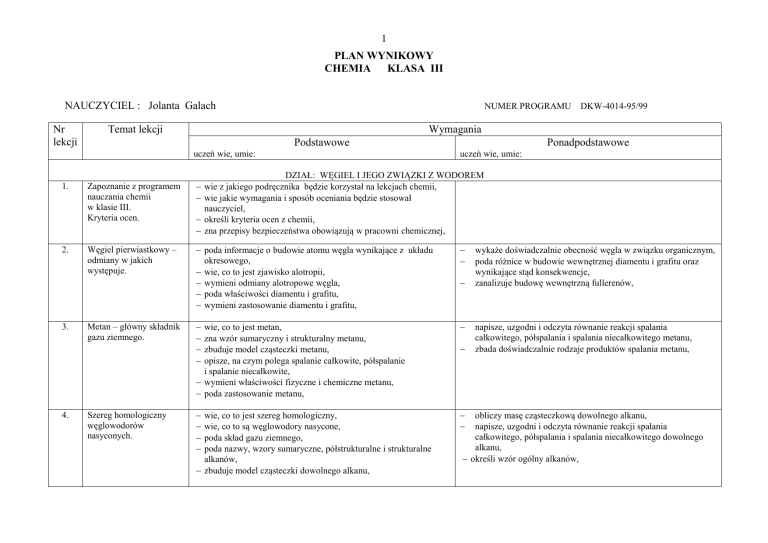
wie z jakiego podręcznika będzie korzystał na lekcjach chemii,
wie jakie wymagania i sposób oceniania będzie stosował
nauczyciel,
określi kryteria ocen z chemii,
zna przepisy bezpieczeństwa obowiązują w pracowni chemicznej,
Zapoznanie z programem
nauczania chemii
w klasie III.
Kryteria ocen.
Węgiel pierwiastkowy –
odmiany w jakich
występuje.
poda informacje o budowie atomu węgla wynikające z układu
okresowego,
wie, co to jest zjawisko alotropii,
wymieni odmiany alotropowe węgla,
poda właściwości diamentu i grafitu,
wymieni zastosowanie diamentu i grafitu,
wie, co to jest metan,
zna wzór sumaryczny i strukturalny metanu,
zbuduje model cząsteczki metanu,
opisze, na czym polega spalanie całkowite, półspalanie
i spalanie niecałkowite,
wymieni właściwości fizyczne i chemiczne metanu,
poda zastosowanie metanu,
Metan – główny składnik
gazu ziemnego.
Szereg homologiczny
węglowodorów
nasyconych.
DKW-4014-95/99
wie, co to jest szereg homologiczny,
wie, co to są węglowodory nasycone,
poda skład gazu ziemnego,
poda nazwy, wzory sumaryczne, półstrukturalne i strukturalne
alkanów,
zbuduje model cząsteczki dowolnego alkanu,
wykaże doświadczalnie obecność węgla w związku organicznym,
poda różnice w budowie wewnętrznej diamentu i grafitu oraz
wynikające stąd konsekwencje,
zanalizuje budowę wewnętrzną fullerenów,
napisze, uzgodni i odczyta równanie reakcji spalania
całkowitego, półspalania i spalania niecałkowitego metanu,
zbada doświadczalnie rodzaje produktów spalania metanu,
obliczy masę cząsteczkową dowolnego alkanu,
napisze, uzgodni i odczyta równanie reakcji spalania
całkowitego, półspalania i spalania niecałkowitego dowolnego
alkanu,
określi wzór ogólny alkanów,
2
5.
Szeregi homologiczne
węglowodorów
nienasyconych (alkeny
i alkiny).
wie, co to są alkeny i alkiny,
tworzy nazwy węglowodorów nienasyconych,
podaje wzory sumaryczne i strukturalne alkenów i alkinów,
zbuduje model cząsteczki dowolnego alkenu i alkinu,
określi wzór ogólny alkenów i albinów,
obliczy masę cząsteczkową dowolnego alkenu i alniku,
6.
Eten – przedstawiciel
alkenów.
wymieni właściwości fizyczne i chemiczne etenu,
wyjaśni na czym polega proces polimeryzacji,
poda zastosowanie etenu,
wie, w jaki sposób można otrzymać eten,
dokona analizy właściwości fizycznych i chemicznych etenu,
napisze, uzgodni i odczyta równanie reakcji spalania
całkowitego, półspalania i spalania niecałkowitego etenu,
napisze, uzgodni i odczyta równanie reakcji przyłączenia bromu
i bromowodoru do etenu,
zapisze przebieg reakcji polimeryzacji etenu,
zbada doświadczalnie właściwości etenu,
7.
Etyn (acetylen) –
przedstawiciel Albinów.
wymieni właściwości fizyczne i chemiczne acetylenu,
poda zastosowanie acetylenu,
wie w jaki sposób można otrzymać acetylen,
dokona analizy właściwości fizycznych i chemicznych acetylenu,
zbada doświadczalnie właściwości acetylenu,
napisze, uzgodni i odczyta równania reakcji:
*otrzymywania etynu,
*przyłączania bromu do etynu,
*spalania etynu,
*polimeryzacji etynu,
8.
Polietylen jako przykład
tworzyw sztucznych.
wyjaśni, na czym polega proces polimeryzacji,
omówi budowę polimeru,
poda, z jakich surowców otrzymuje się tworzywa sztuczne,
poda przykłady tworzyw sztucznych,
określi zalety i wady tworzyw sztucznych,
9.
Porównanie budowy
cząsteczek i właściwości
alkanów, alkenów
i alkinów.
wie, co to są węglowodory,
wymieni rodzaje węglowodorów,
poda zastosowanie węglowodorów,
wie, jak odróżnić węglowodory nasycone od nienasyconych,
napisze wzory sumaryczne, strukturalne i półstrukturalne
dowolnych węglowodorów,
napisze, uzgodni i odczyta równanie reakcji spalania
całkowitego, półspalania i spalania niecałkowitego dowolnego
węglowodoru,
napisze, uzgodni i odczyta równanie reakcji przyłączania bromu,
chloru lub wodoru do węglowodorów nienasyconych,
określi zależności między właściwościami fizycznymi a liczbą
atomów węgla w cząsteczce węglowodorów,
zaproponuje doświadczenie, które pozwoli odróżnić dowolny
węglowodór nasycony od nienasyconego,
3
Podsumowanie
wiadomości o węglu
i jego związkach
z wodorem.
„Węgiel i jego związki
z wodorem” –
sprawdzenie wiadomości.
Podsumowanie wiadomości i umiejętności z ostatnich lekcji.
12.
Szereg homologiczny
alkoholi jako pochodnych
alkanów.
13.
Metanol i etanol –
przedstawiciele alkoholi.
wie, że metanol jest bardzo silną trucizną,
poda zastosowanie metanolu,
wyjaśni, na czym polega fermentacja alkoholowa,
poda zastosowanie etanolu,
określi właściwości fizyczne metanolu i etanolu,
napisze równania spalania metanolu i etanolu,
zbada odczyn etanolu i wytłumaczy, dlaczego mimo obecności
grupy –OH , odczyn jest obojętny,
przedyskutuje zastosowanie etanolu (zalety i niebezpieczeństwa),
wykryje obecność etanolu,
10.
11.
Sprawdzenie wiadomości i umiejętności z działu „Węgiel i jego związki z wodorem”.
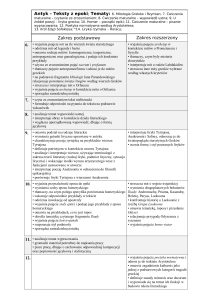
DZIAŁ: POCHODNE WĘGLOWODORÓW
wie, co to znaczy, że alkohole są pochodnymi węglowodorów,
wyjaśni pojęcia rodnik i grupa funkcyjna,
wyjaśni, jak się tworzy nazwy alkoholi,
poda nazwy, wzory sumaryczne, strukturalne i półstrukturalne
czterech pierwszych członów szeregu homologicznego alkoholi,
zbuduje model cząsteczki alkoholu,
wskaże i nazwie rodnik i grupę funkcyjną w czterech pierwszych
członach szeregu homologicznego alkoholi,
określi wzór ogólny alkoholi,
poda nazwy, wzory sumaryczne, strukturalne i półstrukturalne
dowolnego alkoholu,
wskaże i nazwie rodnik i grupę funkcyjną w cząsteczce alkoholu,
14.
Glikol i gliceryna –
alkohole
wielowodorotlenowe.
wyjaśni pojęcie alkohol wielowodorotlenowy,
wie, że glikol i gliceryna to alkohole wielowodorotlenowe,
poda zastosowanie glikolu i gliceryny,
określi właściwości fizyczne gliceryny,
określi właściwości fizyczne glikolu,
zbuduje model cząsteczki glikolu i gliceryny,
podaje przykłady alkoholi wielowodorotlenowych,
zapisze równania reakcji spalania glikolu i gliceryny,
opowiada o wynalezieniu dynamitu przez A. Nobla,
15.
Kwas octowy
i mrówkowy – budowa
cząsteczki
i otrzymywanie.
wyjaśnia sformułowanie: niższe kwasy karboksylowe,
zbuduje model cząsteczki kwasu octowego i mrówkowego,
wyjaśnia, na czym polega fermentacja octowa,
wie, że kwas mrówkowy jest silną trucizną,
omawia występowanie kwasu mrówkowego i octowego,
omawia przebieg fermentacji octowej,
zapisuje równanie reakcji fermentacji octowej,
16.
Kwas octowy
i mrówkowy –
omawia właściwości fizyczne kwasu mrówkowego i octowego,
bada odczyn roztworu kwasów papierkami wskaźnikowymi,
uzasadnia odczyn kwasowy badanych kwasów zapisem procesu
dysocjacji jonowej i nazywa powstałe jony,
4
właściwości fizyczne
i chemiczne.
17.
18.
Szereg homologiczny
kwasów karboksylowych.
Wyższe kwasy
karboksylowe (kwas
palmitynowy, stearynowy
i oleinowy).
omawia zastosowanie w/w kwasów,
omawia zasady bezpieczeństwa, których należy przestrzegać
w czasie pracy ze stężonymi kwasami karboksylowymi,
wyjaśnia, co to są kwasy karboksylowe,
zapisuje wzór ogólny kwasów karboksylowych i wskazuje grupę
funkcyjną,
rysuje wzory półstrukturalne i strukturalne 4 pierwszych kwasów
z szeregu homologicznego kwasu mrówkowego
wyjaśnia sformułowanie: wyższe kwasy karboksylowe, kwasy
tłuszczowe – podaje stosowne przykłady,
określi właściwości fizyczne przedstawicieli w/w kwasów,
wyjaśni, czy zasady reagują z kwasami tłuszczowymi,
zapisuje budowę cząsteczki mydła,
określa rodzaje i właściwości mydeł,
19.
20.
21.
Porównanie właściwości
kwasów karboksylowych.
Estry – pachnąca chemia.
Inne pochodne
węglowodorów – aminy
i aminokwasy.
wie, że w miarę wzrostu długości łańcucha węglowego wzrasta
gęstość, temperatura topnienia i wrzenia kwasów karboksylowych,
wie, że w miarę wzrostu długości łańcucha węglowego maleje
rozpuszczalność w wodzie, zdolność do dysocjacji jonowej i
aktywność chemiczna kwasów karboksylowych,
wie, na czym polega reakcja estryfikacji,
podaje właściwości przykładowych estrów,
podaje zastosowanie estrów,
tworzy nazwy estrów, znając nazwy substratów,
poda wzór ogólny estrów,
wyjaśni, co to są aminy,
omówi właściwości amin,
wskaże występowanie amin,
zbuduje model cząsteczki prostej aminy,
wyjaśni, co to są aminokwasy,
zapisze wzór ogólny aminokwasów,
zapisuje równanie reakcji kwasu octowego z metalem i zasadą,
nazywa powstałe produkty,
zapisuje równania reakcji spalania kwasu octowego
i mrówkowego,
rysuje wzory półstrukturalne i strukturalne dowolnych kwasów
z szeregu homologicznego kwasu mrówkowego,
porównuje przebieg reakcji kwasów organicznych i kwasu
solnego z cynkiem, formułuje wniosek,
zapisuje równanie reakcji zobojętniania w postaci cząsteczkowej ,
jonowej i jonowej skróconej,
zapisze wzory przykładowych kwasów tłuszczowych,
projektuje doświadczenie potwierdzające nienasycony charakter
kwasu oleinowego,
zapisuje równanie reakcji zmydlania,
wyjaśnia, na czym polega mechanizm prania,
zapisze równanie reakcji mydła z solami rozpuszczonymi w
wodzie,
wyjaśnia, co to są detergenty,
przedstawia wady i zalety stosowania detergentów,
wykorzystuje praktycznie wiadomości do identyfikacji kwasów
karboksylowych i zapisu odpowiednich równań reakcji,
przedstawi schemat doświadczenia pozwalającego odróżnić
nasycone i nienasycone kwasy karboksylowe,
zapisze równanie reakcji estryfikacji,
wskaże i nazwie rodniki i grupę estrową w cząsteczce estru,
na podstawie nazwy lub wzoru estru przewidzi nazwy i wzory
alkoholu i kwasu, z których powstał ester,
udowodni różnicę między reakcją estryfikacji a zobojętniania,
wyjaśni, jakie są konsekwencje istnienia dwóch grup funkcyjnych
w cząsteczce aminokwasu,
wskaże i nazwie rodniki i grupy funkcyjne w cząsteczkach
aminokwasów,
5
omówi występowanie aminokwasów,
zbuduje model cząsteczki prostego aminokwasu,
22.
23.
Podsumowanie
wiadomości
o pochodnych
węglowodorów.
„Pochodne
węglowodorów” –
sprawdzenie wiadomości.
24.
Podstawowe składniki
żywności i ich rola
w organizmie.
25.
Tłuszcze – budowa
cząsteczki, rodzaje
i właściwości.
26.
Białka – skład
pierwiastkowy,
właściwości, reakcje
charakterystyczne.
Podsumowanie wiadomości i umiejętności z ostatnich lekcji.
Test sprawdzający wiadomości i umiejętności.
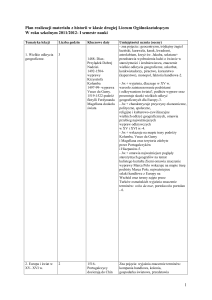
DZIAŁ: ZWIĄZKI CHEMICZNE W ŻYWIENIU I W ŻYCIU CODZIENNYM
wymienia podstawowe pierwiastki wchodzące w skład organizmu
potrafi zaplanować prawidłowy dzienny jadłospis ucznia,
człowieka,
wyjaśnia co to są mikro- i makro elementy; podaje stosowne
przykłady,
wymienia rodzaje składników pokarmowych,
wskazuje źródła białka, cukrów i tłuszczów,
określa rolę składników pokarmowych w organizmie człowieka,
omawia rolę wody w organizmie człowieka,
omawia rolę witamin i soli mineralnych; podaje stosowne
przykłady,
wyjaśni zasady prawidłowego żywienia,
wyjaśnia, co to są tłuszcze,
podaje właściwości fizyczne tłuszczów,
podaje podział tłuszczów ze względu na ich pochodzenie i stan
skupienia,
podaje przykłady poszczególnych rodzajów tłuszczów,
określa czym różnią się tłuszcze roślinne od zwierzęcych,
odróżnia tłuszcze od innych substancji,
wyjaśnia, co to są białka,
wymienia pierwiastki wchodzące wskład białek,
omawia budowę białek,
przedstawia podział białek na proste i złożone; podaje stosowne
przykłady,
omawia wpływ różnych czynników na białka – denaturacja białka,
wymienia reakcje charakterystyczne białek,
zapisuje równanie reakcji otrzymywania tłuszczu,
przedstawia i omawia reakcje zmydlania tłuszczów,
udowadnia, że tłuszcz jest estrem,
zaproponuje i przeprowadzi identyfikację tłuszczów
nienasyconych,
wyjaśnia, co to jest utwardzanie tłuszczów,
zapisuje reakcje charakterystyczne białek – biuretowa
i ksantoproteinowa,
6
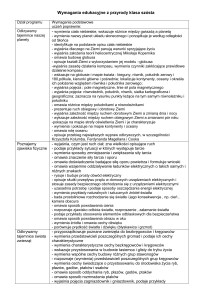
27.
Glukoza jako przykład
cukru prostego.
wyjaśnia, co to są węglowodany,
podaje skład pierwiastkowy cukrów,
zapisuje wzór ogólny węglowodanów,
omawia rodzaje węglowodanów,
wymienia cukry proste, dwucukry i cukry złożone,
przedstawia właściwości fizyczne glukozy,
zapisuje wzór sumaryczny glukozy,
opisuje spalanie glukozy w organizmie człowieka; zapisuje
stosowną reakcję,
udowadnia, że glukoza ma właściwości redukujące,
przeprowadza reakcje charakterystyczne glukozy,
28.
Sacharoza – przykład
dwucukru.
omawia właściwości sacharozy,
zbada właściwości fizyczne sacharozy,
omawia właściwości fizyczne i chemiczne dwucukrów,
omawia występowanie dwucukrów,
projektuje i sprawdza doświadczalnie, czy sacharoza ma
właściwości redukujące,
wyjaśnia do czego służy próba Trommera i Tollensa,
zapisuje równanie reakcji hydrolizy sacharozy,
29.
Wielocukry – skrobia
i celuloza.
30.
Włókna naturalne
i syntetyczne.
wymienia rodzaje włókien,
wyjaśnia, co to są włókna naturalne i syntetyczne,
31.
„Związki chemiczne
w żywieniu i w życiu
codziennym” –
podsumowanie
wiadomości.
„Związki chemiczne
w żywieniu i w życiu
codziennym” –
sprawdzenie wiadomości.
Negatywne skutki
działania niektórych
substancji na organizm
człowieka.
Podsumowanie wiadomości i umiejętności z ostatnich lekcji.
32.
33.
omawia budowę skrobi i celulozy,
wymienia właściwości fizyczne i chemiczne skrobi i celulozy,
określa występowanie skrobi i celulozy,
określa czym różni się budowa skrobi i celulozy,
omawia znaczenie błonnika jako składnika pokarmowego,
przeprowadzi reakcje charakterystyczna skrobi,
wyjaśni jak wykryć skrobię,
zapisuje przebieg reakcji hydrolizy skrobi,
dokonuje podziału włókien; podaje stosowne przykłady,
opisuje właściwości i zastosowanie włókien,
odróżni doświadczalnie włókno bawełniane od wełnianego,
Test sprawdzający wiadomości i umiejętności.
wyjaśnia pojęcia: alkoholizm, narkomania, lekomania, nikotynizm,
wyjaśnia jak unikać zatruć,
określa, co robić w przypadku zatrucia niezidentyfikowanym środkiem,