chyba dobre.doc
(92 KB) Pobierz
stęp
We współczesnym, wysoko rozwiniętym świecie, niepełnosprawność intelektualna ( ang. intellectual
disability), dotycząca ok. 3% populacji, stanowi poważny problem medyczny i społeczny. Częstość jej
występowania wśród dzieci do lat 16 waha się od 2 do 4%, a wśród osób dorosłych od 1 do 2% (1-4).
Do niedawna w terminologii upośledzenia umysłowego (ang. mental retardation) spotykało się określenia
godne potępienia, takie jak: debilizm, imbecylizm, idiocja lub idiotyzm czy głuptactwo. Co więcej,
niepełnosprawność intelektualna, jako przyprawiona etykieta medyczna miała często pejoratywne
znaczenie w służbie zdrowia (niechęć do podejmowania leczenia zwykłych przypadłości wieku dziecięcego z
racji określania a prori niekorzystnego rokowania – dziecko „przeznaczone na straty”). W ostatnich latach
zaszły duże zmiany w poglądach na zjawisko ludzkiej niepełnosprawności umysłowej. Przemiany te
warunkuje rozwój nauk biomedycznych, a także nauk społecznych, w tym bioetyki. Pomimo znaczących
osiągnięć naukowych w problematyce niepełnosprawności intelektualnej nadal jest dużo niewiadomych i
kontrowersji oraz zaniedbań w sferze diagnostycznej i terapeutyczno-rehabilitacyjnej (5).
W 1997 roku dzięki pracom Międzynarodowego Stowarzyszenia do Badań Naukowych nad Upośledzeniem
Umysłowym (IASSID - International Association for the Scientific Study of Intelectual Disability) oraz
Amerykańskiego Towarzystwa Upośledzenia Umysłowego (AAMR - American Association of Mental
Retardation) określenie omawianego zaburzenia uległo unowocześnieniu i zaktualizowaniu. W opisywaniu
zaburzeń w rozwoju umysłowym zalecono posługiwanie się terminem niepełnosprawność intelektualna
(ang. intellectual disability) lub osoba z niepełnosprawnością intelektualną, co bardziej precyzyjnie oddaje
definicję tego zaburzenia (http://www.aamr.org, http://www.iassid.org). Spośród innych terminów
określających zaburzenie rozwoju intelektualnego proponuje się ponadto: niezdolność uczenia się (ang.
learning disability) oraz niepełnosprawność rozwojowa (ang. developmental disability). Osoba
niepełnosprawna jest w ten sposób postrzegana nie tylko jako jednostka z problemami chorobowymi,
wymagająca odpowiedniej opieki medycznej, ale jako członek społeczności, którego prawa człowieka
dotyczą w takim samym stopniu jak reszty społeczeństwa. Stosowana terminologia upośledzenia
umysłowego jest o tyle ważna, że kształtuje sposób myślenia społeczeństwa o istocie niepełnosprawności.
W literaturze można znaleźć różne definicje niepełnosprawności intelektualnej (NI). Najczęściej i najprościej
NI określa się jako stan powstały w okresie rozwojowym (przed 18 rokiem życia) objawiający się obniżeniem
rozwoju sprawności intelektualnej znamiennie poniżej przeciętnej z wyraźnym niedostatkiem społecznych
zachowań przystosowawczych. Można tez przyjąć definicję, że jest to całkowity brak zdolności uczenia się
lub jej osłabienie, wskutek czego umiejętności umysłowe nie rozwijają się, bądź też rozwój ten jest
ograniczony i (lub) opóźniony. Niepełnosprawność intelektualna definiowana jest przez Amerykańskie
Towarzystwo Psychiatryczne oraz przez AAMR jako istotnie niższy niż przeciętny ogólny poziom
funkcjonowania intelektualnego, któremu towarzyszą ograniczenia w funkcjonowaniu przystosowawczym
wyrażającym się zaburzeniami w rozwoju mowy, funkcji poznawczych i reakcji psychospołecznych oraz
zaburzeniami w sprawności socjalnej (5-7). Różnorodność definicji niedorozwoju intelektualnego dowodzi
złożoności problemu.
Powszechnie wiadomo, że ogólny poziom funkcjonowania intelektualnego jest oceniany za pomocą ilorazu
inteligencji (ang. intelligence quotient - IQ) uzyskanego przy zastosowaniu standaryzowanych testów
inteligencji np.: skala inteligencji Wechslera (1, 7). Upośledzenie strefy intelektualnej w stopniu lekkim
stwierdza się wtedy, gdy IQ wynosi pomiędzy 55-69, umiarkowanym – 40-54, w stopniu znacznym – 25-39 i
głębokim – IQ poniżej 25. Upośledzenie lekkie stanowi około 90% wszystkich przypadków
niepełnosprawności intelektualnej (1, 5, 7).
U dzieci do 2-3 roku życia trudno jest oddzielić rozwój intelektualny od rozwoju ruchowego. Rozwój
motoryczny ściśle koreluje z rozwojem psychicznym i jego zaburzenia odzwierciedlają uszkodzenia w
ośrodkowym układzie nerwowym (rozwój psycho-motoryczny, inteligencja sensoryczno-motoryczna).
Dlatego u dzieci w tym wieku nie określa się poziomu sprawności intelektualnej lecz mówi się o rozwoju
psychoruchowym. W tym czasie etykieta, jaka może być przyprawiona dziecku przez nieprawidłowe
postawienie rozpoznania jako przyczyny upośledzenia umysłowego, może być dla niego oraz dla jego
rodziny szkodliwa. W perspektywie kształtowania się zdolności intelektualnych osoby, należy pamiętać, że w
pierwszych latach, szczególnie w pierwszym roku życia istnieją największe możliwości przyspieszenia i
wyrównania sprawności fizycznej i psychicznej dziecka. U dzieci dotkniętych niepełnosprawnością
intelektualną lekką obserwuje się głównie zaburzenie procesów orientacyjno-poznawczych, spostrzegania,
uwagi, pamięci, procesów emocjonalnych, motywacyjnych i dojrzałości społecznej. Generalnie, osoby te po
osiągnięciu dojrzałości fizycznej mogą samodzielnie żyć i pracować. Obecnie postuluje się, że osoby z
genetycznie uwarunkowaną niepełnosprawnością intelektualną rozwijają się zgodnie z własnymi normami,
mają odmienny profil rozwojowy w porównaniu z osobami bez zaburzeń genetycznych (różnorodność
genetycznych norm rozwojowych) (5-7). Według Profesor Małgorzaty Kościelskiej nie docenia się potencjału
rozwojowego osób z upośledzeniem. W książce „Oblicza upośledzenia” autorka przekonuje, że należy
poszukiwać i rozwijać obszary normalności u osób z niepełnosprawnością intelektualną, co może służyć jako
propozycja terapeutyczna zmniejszająca stopień zaburzeń spowodowanych przez zaniedbania
środowiskowe (wtórne upośledzenie umysłowe) (5).
Cel pracy
Celem artykułu jest przybliżenie genetycznych przyczyn niepełnosprawności umysłowej. Wiedza jest jednym
z głównych czynników niezbędnych do tworzenia ludziom niepełnosprawnym godnych warunków do
aktywnego życia oraz integracji ze społeczeństwem. Niski poziom wiedzy o osobach z niepełnosprawnością
intelektualną dotyczy min.: poglądów na nieodwracalne ograniczenia osób z upośledzeniem we wszystkich
strefach rozwoju i funkcjonowania.
Przyczyny upośledzenia umysłowego mogą być różnorodne. Mogą to być czynniki genetyczne lub
środowiskowe, pochodzenia endogennego i egzogennego (czynniki teratogenne, infekcyjne, urazowe,
społeczne, psychologiczne). Czynniki uszkadzające płód powodując niepełnosprawność umysłową mogą
działać w okresie prenatalnym, peri- oraz postnatalnym (tab. 1). Upośledzenie umysłowe może być
podstawową lub jedną z cech współistniejących w zespołach wad wrodzonych lub mieć postać izolowaną,
jednokrotnie w połączeniu z cechami dysmorficznymi. Etiologię niepełnosprawności umysłowej można
określić w około 50-60% przypadków. Genetyczne przyczyny upośledzenia umysłowego stanowią 60%
przypadków o znanej etiologii. Przy poprawie opieki prenatalnej i okołoporodowej czynniki genetyczne
stanowią coraz większe znaczenie (8). W katalogu McKusicka oraz w bazie internetowej OMIM opisanych
jest około 7 tysięcy chorób genetycznych (OMIM – Online Mendeltelian Inheritance In Man, www.ncbi.
nlm.nih.gov). Ze względu na etiologię, można je podzielić na zaburzenia powstające na podłożu 1) zmian
liczby lub struktury chromosomów, 2) zaburzeń jednogenowych oraz 3) zmian wieloczynnikowych
(genetycznych, środowiskowych) (tab. 2, 3).
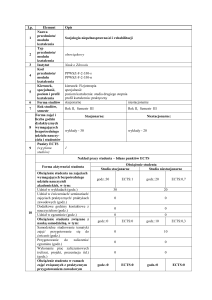
Tabela 1. Czynniki etiologiczne wpływające na zaburzenie rozwoju układu nerwowego u dzieci.
Okres
Rodzaj czynnika sprawczego
prenatalny
Przykłady czynników
Genetyczny
wady rozwojowe
zaburzenia chromosomowe
choroby wrodzone monogenowe
zaburzenia metaboliczne
Środowiskowy
zakażenia płodu - wirusy, pierwotniaki (TORCH)
stany niedotlenienia i niedokrwienia działanie substancji toksycznych (np.: alkohol, papierosy, narkotyki)
choroby matki (cukrzyca, zatrucie, niedożywienie), promieniowanie RTG
perinatalny
Środowiskowy
przedwczesny poród
zamartwica - niedotlenienie okołoporodowe, ciąża mnoga, wylewy wewnątrzczaszkowe, powikłania choroby
hemolitycznej
postnatalny
Środowiskowy
zakażenia OUN
urazy,
nabyte choroby neurologiczne,
chemiczne trucizny środowiskowe, niedobory żywieniowe nieprawidłowe warunki rozwoju - czynniki
społeczne
Tabela 2. Genetyczne przyczyny niepełnosprawności intelektualnej.
Rodzaj zaburzenia genetycznego
Aberracje chromosomowe
Aberracje liczbowe
Aberracje strukturalne
Aberracje mikroskopowe, w tym aberracje subtelomerowe
Mozaikowatość
Choroby jednogenowe
Dziedziczenie mendlowskie:
? Autosomalne dominujące
? Autosomalne recesywne
? Sprzężone z chromosomem X
Dziedziczenie nie-mendlowskie:
? Mutacje dynamiczne
? Choroby mitochondrialne
? Rodzicielskie piętnowanie genomowe
Choroby wieloczynnikowe
Działanie środowiskowe
Działanie wielogenowe
Tabela 3. Wybrane choroby genetyczne z towarzyszącą niepełnosprawnością intelektualną.
Choroba
Przyczyna zaburzenia genetycznego
Rodzaj dziedziczenia
występowania na 1000 urodzeń
Zespół Downa
Chromosomalna
Zespół Edwardsa
Zespół Patau
Zespół cri du chat
Zespół kruchego X
-
Chromosomalna
Chromosomalna
Chromosomalna
Monogenowa
1, 3-1, 5
-
-
Częstość
0, 125
0, 04-0, 06
-
0, 02-0, 03
powtórzenia trójnukleotydowe
0, 6-0, 8, u
0, 3-0, 4 u
Stwardnienie guzowate
Neurofibromatoza 1
Fenyloketonuria
Galaktozemia
Zespół Hunter
Zespól Lesha-Nyhana
Zespół Retta
Monogenowa
Monogenowa
Monogenowa
Monogenowa
Monogenowa
Monogenowa
Monogenowa
autosom., dom.
0, 06
autosom., dom.
autosom., rec.
autosom., rec.
0, 3
0, 08
0, 017
sprzężone z chrom. X, rec.
sprzężone z chrom. X, rec
sprzężone z chrom. X, dom
0, 01
0, 05
0, 05-0, 1
Niepełnosprawność umysłowa w stopniu głębokim zazwyczaj uwarunkowana jest ścisłym działaniem
czynnika genetycznego. Rozkład częstości występowania tego typu zaburzeń jest na ogół podobny w
różnych grupach społecznych. Dzięki rozwojowi cytogenetyki i genetyki molekularnej możliwe jest ustalenie
przyczyny niepełnosprawności intelektualnej u około 60% osób z IQ <50 i tylko u 20-30% osób z IQ
odzwierciedlającym lekki stopień zaburzenia rozwoju intelektualnego (4, 8, 9). Niepełnosprawność
intelektualna w stopniu lekkim jest jednym z typowych przykładów dziedziczenia wieloczynnikowego.
Niejednokrotnie od rodziców dziedziczone są geny warunkujące niższy poziom rozwoju intelektualnego, do
działania których dołączają się czynniki środowiskowe nie sprzyjające jego rozwojowi (4).
1. Niepełnosprawność intelektualna związana z aberracjami chromosomowymi
Częstość występowania aberracji chromosomowych wynosi około 6 na 1000 żywo urodzonych
noworodków. Zaburzenia liczby lub struktury chromosomów stwierdza się u 30% chorych z NI w stopniu
znacznym oraz u 10% osób z NI w stopniu lekkim (16).
Niepełnosprawność umysłowa w aberracjach liczbowych
Częstość występowania aberracji chromosomowych wynosi około 6 na 1000 żywo urodzonych
noworodków. Zaburzenia chromosomowe występują u 30% chorych z niepełnosprawnością intelektualną w
stopniu znacznym oraz u 10% osób z upośledzeniem w stopniu lekkim (8, 10). Aberracje chromosomowe
dzielą się na liczbowe (np.: trisomie, monosomie, triploidie) oraz strukturalne (np.: najczęściej występujące
delecje i translokacje). Ze znanych przyczyn genetycznych najliczniejszą grupę osób z upośledzeniem
umysłowym stanowią osoby z zespołem Downa. Średnia populacyjna częstość występowania tej aberracji
wynosi 1:750 żywo urodzonych dzieci i zależy od wieku matki (8).
Zespół Downa jest powszechnie znanym zespołem genetycznym i po raz pierwszy był zdiagnozowany
cytogenetycznie przez Profesora Jerome Lejeune´a w 1959 roku. Zespół Downa jest uwarunkowany
występowaniem dodatkowego chromosomu 21 pary. Prosta trisomia chromosomu 21 (95% przypadków)
oraz postać mozaikowa tego zaburzenia (1% przypadków) są zmianami sporadycznymi, powstałymi w
wyniku nodnysjunkcji w podziałach mejotycznych lub mitotycznych. W obu tych postaciach zespołu Downa
ryzyko powtórzenia u kolejnego dziecka będzie zależeć od wieku matki (ryzyko rośnie z wiekiem). Postać
translokacyjna (4% przypadków) może powstawać de novo lub dziedziczyć się (wynik nieprawidłowej
segregacji gamet u rodzica, nosiciela zrównoważonej translokacji chromosomowej). Stwierdzenie
translokacji niezrównoważonej u dziecka zespołem Downa jest jednocześnie wskazaniem do wykonania
kariotypów u rodziców i rodzeństwa pacjenta. Rozróżnienie tych dwóch przyczyn zespołu Downa (postaci
sporadycznej i translokacyjnej) jest ważne ze względu na charakterystyczny sposób dziedziczenia oraz
różnice w ryzyku powtórzenia się zespołu w rodzinie. Niewykonanie badania cytogenetycznego u osoby
podejrzanej o występowanie zespołu Downa jest błędem w sztuce lekarskiej.
Typowymi objawami zespołu Downa, któremu najczęściej towarzyszy niepełnosprawność intelektualna typu
umiarkowanego, jest charakterystyczna dysmorfia twarzy (m.in.: małogłowie, skośne w górę ustawienie
szpar powiekowych, zmarszczka nakątna, spłaszczenie twarzy, duży, bruzdowany język, krótka głowa) i
całego ciała (m.in.: poprzeczna bruzda dłoni, skrócenia piątego palca obu rąk), uogólniona hipotonia,
niskorosłość, a także dodatkowe wady wrodzone, najczęściej wady serca i układu pokarmowego. W zespole
trisomii 21 opisano ponad 80 cech dysmorficznych (1, 4, 8).
Rzadziej występującymi liczbowymi aberracjami chromosomowymi jest trisomia chromosomu 18 (zespół
Edwardsa) oraz chromosomu 13 (zespół Patau). Zespołom tym towarzyszy z reguły głębokie upośledzenie
umysłowe. W obrazie tych zaburzeń występują ponadto liczne cechy dysmorficzne oraz dodatkowe wady
wrodzone, w tym ciężkie wady serca, które wraz z zaburzeniami ośrodka oddechowego są przyczyną zgonów
dzieci w większości do 6-12 m.ż. (4, 8).
Aberracjom chromosomów płci rzadziej towarzyszy niepełnosprawność intelektualna. W najczęściej
spotykanych aberracjach tych chromosomów, zespole Turnera, zespole Klinefeltera, zespole 47, XXX czy 47,
XYY, sprawność intelektualna pacjentów mieści w granicach normy. Zespołom tym częściej towarzyszą
zaburzenia w adaptacji psycho-społecznej oraz specyficzne zaburzenia uczenia się, czasami zaburzenia
zachowania. Niepełnosprawność intelektualną stwierdzić można w rzadszych postaciach zespołu Klinefeltera
oraz zespołu XXX. W zespole Klinefeltera (np.: klasyczna postać 47, XXY), którego częstość występowania
wynosi 1/800-1000 chłopców, ryzyko wystąpienia niepełnosprawności umysłowej (także wad wrodzonych)
wzrasta z każdym dodatkowym chromosomem X w kariotypie (48, XXXY; 49, XXXXY).
Niepełnosprawność umysłowa w aberracjach strukturalnych
Zespół cri du chat („kociego krzyku”) rozpoznany przez Jerome Lejeune w 1963 roku jest spowodowany
utratą części krótkiego ramienia chromosomu piątego (46, XX, del(5)(p15)), występuje z częstością 1:50 000
żywych urodzeń. Delecja w obrębie tego regionu najczęściej występuje de novo, tylko w 10-15% jest
dziedziczona. Zespół ten rozpoznaje się najczęściej w okresie noworodkowo-niemowlęcym. U dzieci z tym
zespołem bardzo charakterystyczny jest płacz (cecha zanika wraz z wiekiem dziecka) na wysokich tonach
przypominający miauczenie kota, co jest spowodowane odmienną budową krtani. Dodatkowo u dzieci z
monosomią 5p występuje niska urodzeniowa masa ciała, uogólniona hipotonia, trudności w karmieniu,
zaburzony odruch ssania i połykania, słabe przyrosty masy ciała, charakterystyczne cechy dysmorficzne,
które z wiekiem ulegają zmianie, a także czasami dodatkowe wady wrodzone. Zaburzenie rozwoju
umysłowego występuje w szerokim zakresie, od stopnia lekkiego do głębokiego i współistnieje z
zaburzeniem mowy. Ocenia się, że dzięki odpowiednim postępowaniom rehabilitacyjnym obejmującym
wczesną stymulację rozwoju dziecka zmniejsza się częstość negatywnych zachowań, poprawia relacje
emocjonalne z otoczeniem oraz ogranicza się rozwój zachowań autystycznych i wtórnej niepełnosprawności
intelektualnej uwarunkowanej środowiskowo (11-13).
Nie wszystkie aberracje chromosomowe widoczne są w klasycznym badaniu cytogenetycznym. Mniejsze
aberracje można wykryć natomiast w badaniu fluorescencyjnej hybrydyzacji in situ (FISH). Delecja małego
fragmentu chromosomu powoduje utratę pewnej liczby genów doprowadzając najczęściej nie tylko do
niepełnosprawności intelektualnej, ale również wad rozwojowych i różnorodnych cech dysmorficznych. I tak
na przykład mikrodelecja części chromosomu 7 (7q11.23) określana jako zespół Williamsa powoduje bardzo
charakterystyczny fenotyp behawioralny, niepełnosprawność intelektualną o różnym stopniu, wady serca
lub naczyń oraz liczne cechy dysmorficzne twarzy. Częstość występowania zespołu Williamsa wynosi 1/25
tysięcy urodzeń (1, 4, 8).
Kolejnym zespołem mikrodelecji autosomalnej z odmiennym rozwojem umysłowym jest delecja ramienia
krótkiego chromosomu 4, zwana zespołem Wolfa-Hirschhorna (W-H) występujący z częstością około 50
tysięcy. Zespół W-H cechuje się hipotrofią wewnątrzmaciczną, upośledzeniem rozwoju fizycznego,
uogólnioną hipotonią, bogatą, bardzo typową dysmorfią twarzy (m.in.: małogłowie, wypukłe czoło, szeroka
nasada nosa i hiperteloryzm, łukowate brwi, długi nos z krótką rynienką nosowo-wargową, nisko osadzone
uszy). Charakterystyczny fenotyp twarzy nadaje jej wygląd "hełmu wojownika greckiego”. U dzieci z
zespołem delecji 4p16 występują także napady drgawkowe, trudności w ssaniu i połykaniu, rozszczep wargi
i/lub podniebienia oraz wady narządów wewnętrznych (głównie wady serca, nerek, mózgu) (14).
Odpowiednie postępowanie wychowawcze i terapeutyczne sprawia, że można skutecznie ograniczyć u tych
dzieci wtórne pogarszanie się ich sprawności umysłowej, socjalnej i społecznej (podobnie jak w innych
defektach genetycznych z odmiennym rozwojem umysłowym).
Niektórym zespołom mikrodelecji towarzyszy zjawisko rodzicielskiego piętnowania (imprinting genomowy),
w którym stopień ekspresji genu różni się w zależności od tego, od którego rodzica gen został przekazany.
Przykładem wystąpienia imprintingu genomowego w chorobach genetycznych są: zespoły Angelmana (AS)
oraz Pradera i Williego (PWS). PWS jest jedną z najczęstszych opisywanych mikrodelecji występujących z
częstością 1:10-15 tysięcy urodzeń. Patomechanizm tego zespołu polega na mikrodelecji fragmentu
chromosomu 15p11-13 pochodzącego od ojca (70% chorych) lub na jednorodzicielskiej matczynej disomii w
tym regionie (28% pacjentów), a także na mutacji imprintingowej w genie SNRPN zlokalizowanym w rejonie
15q11-q13 (2% pacjentów). Cechy kliniczne zespołu PWS obejmują niską wagę urodzeniową, obniżenie
napięcia mięśniowego w okresie niemowlęcym oraz opóźnienie rozwoju psychoruchowego, zaburzony
odruch ssania oraz olbrzymie trudności z karmieniem dziecka do około 12 miesiąca życia. Od 1-2 roku życia
dziecka narasta łaknienie oraz w konsekwencji otyłość i jej powikłania, dodatkowo występują napady złości,
niedorozwój zewnętrznych narządów płciowych, upośledzenie rozwoju intelektualnego, zaburzenia
zachowania, a także cechy dysmorficzne takie jak m.in.: twarz owalna, zwężenie dwuskroniowe, szpary
powiekowe w kształcie migdałów, małe dłonie i stopy (4, 8, 15, 16).
Zespół Angelmana (AS, ang. happy puppet syndrome) powodowany jest delecją 15p11-13 chromosomu
pochodzącego od matki lub uniparenteralną disomią ojcowską (odwrotna sytuacja jak w PWS) oraz
mutacjami w genie UBE3A zlokalizowanym w tym samym regionie co gen SNRPN. Częstość występowania
AS wynosi 1:20 tysięcy urodzeń. Cechy kliniczne charakterystyczne dla tego zespołu to charakterystyczna
dysmorfia twarzy, głębokie lub znaczne opóźnienie rozwoju psychoruchowego i intelektualnego, brak lub
słaby rozwój mowy, gwałtowne ruchy i nieuzasadnione napady śmiechu (charakterystyczny fenotyp
behawioralny), nieprawidłowy chód i napady padaczkowe (16).
Aberracje mikroskopowe i submikroskopowe stanowią przyczynę do 10% przypadków idiopatycznej
niepełnosprawności intelektualnej. Innymi cechami klinicznymi w tych zespołach są cechy dysmorfii,
opóźnienie rozwoju fizycznego oraz wady wrodzone. Zastosowanie w badaniach cytogenetycznych
wykonywanych rutynowo w diagnostyce niepełnosprawności intelektualnej, technik molekularnych, jak
fluorescencyjna hybrydyzacja in situ – FISH, pozwoliło ustalić, że częstą przyczyną upośledzenia umysłowego
o nieustalonej dotychczas etiologii są patologie w obrębie regionów telomerowych autosomów w postaci
delecji czy translokacji. Blisko u połowy pacjentów z submikroskopowymi aberracjami chromosomowymi
występuje obciążony wywiad rodzinny (kilka przypadków upośledzenia umysłowego występujących w
rodzinie) (9, 10, 17-20).
2. Niepełnosprawność intelektualna w chorobach monogenowych.
Częstość występowania chorób uwarunkowanych uszkodzeniem pojedynczego genu wynosi około 10:1000
żywych urodzeń. Choroby te mogą być dziedziczone w sposób autosomalny dominujący (częstość
występowania - 7:1000) lub recesywny (2, 5:1000), jako cecha sprzężona z chromosomem X (0, 4:1000), a
także jako cecha mitochondrialna (uszkodzenie genów znajdujących się w mitochondriach). W internetowej
bazie OMIM (www.ncbi.nlm.nih.gov) istnieje ponad tysiąc opisów klinicznych zespołów monogenowych
zawierających niepełnosprawność intelektualną w obrazie choroby (4, 8).
Już w 1938 roku w badaniach epidemiologicznych Lionel Penrose, brytyjski psychiatra, stwierdził, że
upośledzenie umysłowe występuje częściej u mężczyzn niż u kobiet o 25-30% (21-23). Obecnie podaje się, że
częstość upośledzenia umysłowego sprzężonego z chromosomem X (ang. X-link mental retardation, XLMR)
wynosi 1, 66 na 1000 mężczyzn (3, 23). W bazie OMIM opisuje się obecnie 271 chorób sprzężonych z
chromosomem X, którym towarzyszy niepełnosprawność intelektualna. Choroby te mogą się dziedziczyć w
sposób dominujący (np.: zespół łamliwego chromosomu X, zespół Retta) lub recesywny [np.: zespół LeshaNyhana, a-talasemia z upośledzeniem umysłowym (ATR-X), zespół Coffin-Lowry (RSK2)].
Zespoły genetyczne z NI dziedziczone w sprzężeniu z płcią
Drugą co do częstości występowania znaną przyczyną niepełnosprawności intelektualnej u mężczyzn jest
zespół kruchego (łamliwego) chromosomu X (FraX, ang. Fragile X syndrome). Patogenetycznym podłożem
zespołu jest mutacja dynamiczna genu FRAX (Xq27.3) dziedziczona w sposób dominujący w sprzężeniu z
płcią. Mutacje dynamiczne genu FRAX polegają na zwiększonej liczbie powtórzeń trzech nukleotydów
(CGG)n powyżej 200. Jeżeli liczba powtórzeń wynosi pomiędzy 55 a 200 mówimy o premutacji, która może
być przekazywana na kolejne pokolenia. Mutacje występujące w genie FRAX cechuje wyjątkowa
niestabilność podczas ich dziedziczenia, międzypokoleniowe wydłużanie się niestabilnej sekwencji CGGn (im
większa premutacja tym większe ryzyko przekazania mutacji) oraz tzw paradoks Shermana, który oznacza,
że prawdopodobieństwo wystąpienia choroby wśród rodzeństwa bezobjawowego nosiciela jest mniejsze,
niż wśród jego wnuków i prawnuków (wzrost liczby osób z upośledzeniem umysłowym w kolejnych
generacjach w rodzinach obciążonych mutacją) (24-26).
Zespół ten cechuje się niepełną penetracją, częstość jego występowania zależy od płci, wynosi średnio
1/4000 żywo urodzonych chłopców i 1/8000 u dziewcząt (24). Zespół FraX występuje głównie u chłopców ze
względu na to, że jest to cecha sprzężona z chromosomem X. U chłopców niepełnosprawność intelektualna
jest z reguły umiarkowana, może być głęboka. Jeżeli choroba występuje u płci żeńskiej to upośledzenie jest
typu lekkiego. Oprócz wiodącego objawu niepełnosprawności intelektualnej u pacjentów występują inne
charakterystyczne cechy fenotypowe, takie jak: duża głowa, szczególnie zwiększony jej wymiar podłużny,
wydatne czoło, asymetria twarzy, duża żuchwa (prognatyzm), gotyckie podniebienie, duże, dysmorficzne
małżowiny uszne (odstające małżowiny uszne stwierdza się u 80% chorych niezależnie od wieku) oraz
przerost zewnętrznych narządów płciowych po okresie dojrzewania, szczególnie patognomoniczne jest
powiększenie jąder u chłopców (stwierdzana u 90% chorych dorosłych mężczyzn). U małych dzieci
specyficzność fenotypowa tego zespołu jest niska (26).
Zespół Retta po raz pierwszy opisany był przez Andreasa Retta w 1966 roku. Częstość występowania zespołu
Retta wynosi 1/10-20 tysięcy (w Polsce zrzeszonych jest ponad 120 rodzin dzieci z tym zespołem). W latach
90-tych zidentyfikowano gen MECP2 (Xq28), który w 80% odpowiedzialny jest za powstanie fenotypu
choroby dziedziczonej w sposób dominujący sprzężony z chromosomem X. Gen ten koduje białko, które
uczestniczy w prawidłowym rozwoju i różnicowaniu komórek podczas embriogenezy. W genie
MECP2opisano około 50 różnych mutacji, w stanowczej większości sporadycznych (27, 28). Choroba
występuje u dziewczynek. Chłopcy z defektem genu MECP2zwykle umierają przed urodzeniem lub po
urodzeniu z ciężkimi objawami neurologicznymi (28). Choroba cechuje się prawidłowym rozwojem do około
6-18 miesiąca życia, następnie opisuje się postępującą regresję rozwoju psychomotorycznego, osłabienie
kontaktu emocjonalnego, zahamowanie rozwoju mowy, utratę zdolności celowego używania rak oraz ruchy
stereotypowyme (głównie rąk). Dodatkowo u pacjentek występuje małogłowie (przy prawidłowym
obwodzie głowy przy urodzeniu), uboga mimika, zaburzenie chodu oraz odmienny wzór rozwoju
intelektualnego. W przebiegu choroby występuje wyciszenie objawów w 2 dekadzie życia.
Innym przykładem zespołu sprzężonego z chromosomem X dziedziczonego recesywnie jest zespół LeschaNyhana. Jego częstość występowania wynosi 1 na 10-20 tysięcy urodzeń chłopców. W okresie niemowlęcym
objawy polegają na wzmożonym napięciu mięśniowym. Zmiany neurologiczne są progresywne, dodatkowo
pojawiają się ruchy pląsawicze, samouszkodzenia, w tym obgryzanie warg i palców, kolejno kamica
moczanowa oraz dnawe uszkodzenia stawów. Upośledzenie umysłowe może być umiarkowane, jak i
znaczne. Gen odpowiedzialny za powstanie zburzenia ( HPRT1 - Xq26-27) koduje enzym uczestniczący w
produkcji kwasów nukleinowych. Skutkiem ubocznym zaburzenia funkcji tego enzymu jest duże stężenie
kwasu moczowego we krwi oraz moczu. Do tej pory opisano wiele różnych mutacji w genie HPRT1 (1, 4, 8).
Spośród zaburzeń przebiegających z upośledzeniem rozwoju intelektualnego wyodrębnia się także
niespecyficzną, izolowaną niepełnosprawność intelektualna sprzężoną z chromosomem X (MRX1-MRX75).
Ocenia się, że występuje ona z częstością 0, 9-1, 4 na 1000 urodzeń. Charakterystycznymi cechami MRX jest
ich rodzinne występowanie, brak postępu choroby powodującej zaburzenia funkcji poznawczych i
intelektualnych, brak innych objawów (neurologicznych i metabolicznych) oraz brak lub dyskretne cechy
dysmorficzne. Obecnie zlokalizowano 66 genów na chromosomem X odpowiedzialnych za MRX, z tego 59
genów zmapowano i 7 sklonowano. Przykłady znanych genów, których uszkodzenie może prowadzić do
upośledzenia umysłowego to: gen ATR-X kodujący białko wiążąc się z chromatyną i regulujący ekspresję
genów w regionach heterochromatynowych, FMR2i FMR3 (Xq28), GDI1 (Xq28), OPHN1 (Xq12), PAK3 (Xq22),
ARHGEF6 (Xq26), IL1RAPL (Xp21.3-22.1), TM4SF2 (Xp11.4), FACL4 (Xq28), RSK2 (Xp22), a także gen
homeoboks ARX (Xp22.1), który wyznacza rozwój i plan budowy ciała (3, 21, 23).
Zespoły genetyczne z NI dziedziczone w sposób autosmalny recesywny
Dużą grupą chorób w przeważającej większości uwarunkowanych monogenowo i dziedziczonych w sposób
autosomalny recesywny są choroby metaboliczne. Na początku XX wieku Archibald Garrod wprowadził
pojęcie wrodzonych błędów metabolicznych. Ich częstość występowania wynosi 1:2500-5000 urodzeń.
Najczęstsze objawy obejmują oprócz upośledzenie umysłowego, zaburzenie rozwoju ruchowego oraz
somatycznego. Do sztandarowych przykładów tych chorób zalicza się fenyloketonurię, galaktozemię,
mukopolisacharydozy i wiele innych.
Klasycznym przykładem choroby monogenowej powodującej powstanie głębokiej niepełnosprawności
intelektualnej jest fenyloketonuria (PKU), po raz pierwszy opisana przez norweskiego lekarza Asbiorna
Föllinga w 1934 roku. Jak większość chorób metabolicznych jest to choroba dziedziczona w sposób
autosomalny recesywny. PKU polega na zaburzonej przemianie fenyloalaniny do tyrozyny. Uszkodzeniu
ulega gen PAH (12q22-q24.1) kodujący hydroksylazę fenyloalaninową. W genie tym opisano około 300
mutacji punktowych. Częstość występowania PKU w populacji europejskiej wynosi 1:8-12 tysięcy urodzeń,
natomiast nosicielstwo defektu PAH w jednym genie w populacji europejskiej wynosi 1:40. Ryzyko
ponownego wystąpienia choroby u potomstwa rodziców będących nosicielami uszkodzonej jednej kopii
genu wynosi 25%. Dzięki powszechnym badaniom przesiewowym wykonywanym w Europie i w Polsce od lat
siedemdziesiątych (wczesne rozpoznanie choroby) oraz dzięki skutecznemu leczeniu dietetycznemu
(drastyczne ograniczenie fenyloalaniny w diecie dziecka), główny objaw fenyloketonurii, jakim jest ciężka
niepełnosprawność intelektualna, został prawie wyeliminowany. Nowym problemem medycznym w
przebiegu PKU jest jej postać matczyna, która polega na teratogennym działaniu na płód podwyższonego
poziomu fenyloalaniny we krwi matki chorej na PKU, co powoduje poważne uszkodzenie płodu (1, 4, 8).
Zespoły genetyczne z NI dziedziczone w sposób autosomalny dominujący
Ostatnią omawianą w tym artykule grupą chorób w przebiegu, których występuje niepełnosprawność
intelektualna są choroby monogenowe dziedziczone w sposób autosomalny dominujący. Cechują się one
zmienną ekspresją, często niepełną penetracją genu i zjawiskiem przeskakiwania pokoleń, a także dość
wysoką częstością nowych mutacji powstałych de novo, a nie dziedziczonych od rodziców. Ryzyko
przekazania uszkodzonego genu potomstwu wynosi 50%. Przykładem takich chorób są fakomatozy, jak np.:
nerwiakowłókniakowatość typu 1 oraz stwardnienie guzowate.
Nerwiakowłókniakowatość typu 1 (NF1), zwane też zespołem nerwowo-skórnym występuje z częstością
1:3000 urodzeń, Gen dla tej choroby ( NF1) zlokalizowany jest w locus 17q11.2, składa się z 60 eksonów.
Zespół NF1 ma złożoną symptomatologię, objawy głównie są pochodzenia neuroektodermalnego: plamy
typu kawy z mlekiem (ang. cafe au lait), piegi w okolicy pachowej, włókniaki obwodowe, guzki Lisha
tęczówki (guzki typu hamartomata), guzy CUN oraz nowotwory złośliwe (w 1, 5% przypadków).
Niepełnosprawność intelektualna występuje z u około 30% pacjentów, zwykle jedynie dominują jednak
niewielkie problemy w nauce oraz dyslekcja (4, 8).
Objawy stwardnienia guzowatego (sclerosis tuberosa, zespół Bourneville´a-Pringle´a) polegają na
występowaniu gruczolaków na skórze twarzy i innych częściach ciała, zmianach guzowatych we wszystkich
narządach wewnętrznych (mózgu, serca, nerkach). Niepełnosprawność intelektualna występuje w 50%
przypadków, dość często mają miejsca napady drgawkowe przy istniejących zmianach w mózgu. Objawy
choroby nasilają się w miarę dojrzewania dziecka. Częstość występowania choroby wynosi 1/200 tysięcy
urodzeń. Fenotyp choroby jest powodowany mutacjami w kilku genach np.: TSC1i TSC2 (4, 8).
Zakończenie
Niezależnie od częstości występowania chorób, którym towarzyszy niepełnosprawność intelektualna,
zastosowanie odpowiedniej diagnostyki służącej do ich rozpoznania jest ważne z wielu powodów. Po
pierwsze, prawidłowe i odpowiednio wczesne rozpoznanie daje choremu i często również jego rodzinie
większą szansę uzyskania właściwego wsparcia, leczenia i postępowania rehabilitacyjnego (wczesna
interwencja). W niektórych przypadkach wczesne rozpoznanie może wpływać na stopień upośledzenia
rozwoju umysłowego i fizycznego dziecka. Po drugie, poznanie przyczyn niepełnosprawności intelektualnej
może być równoznaczne z identyfikacją rodziny wysokiego ryzyka powtórzenia się zaburzenia u kolejnych
osób w rodzinie. Powoduje to m.in. konieczność objęcia danej rodziny poradnictwem genetycznym
...
Plik z chomika:
que-hiciste
Inne pliki z tego folderu:
Dokument.rtf (12 KB)
Genetyka - Wykład 8, 27.01.2011 - Choroby mitochondrialne.rar (63925 KB)
2010-12 (gru).rar (3860 KB)
Dziedziczny rak piersi.pdf (3623 KB)
------.txt (0 KB)
Inne foldery tego chomika:
2010-2011
2016-17
Egzamin
gena-prezki
Genetyka
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dla Mediów
Dział Pomocy
Opinie
Program partnerski
Regulamin serwisu
Polityka prywatności
Ochrona praw autorskich
Platforma wydawców
Copyright © 2012 Chomikuj.pl