Innowacyjne wdrażanie standardów postępowania
molekularnych w zintegrowanym systemie zarządzania
medycznego:
jakość
badań
Dr n. med. Marzena A. Lewandowska MBA, dr n. med. Zbigniew Pawłowicz, dr n. med
Wiesława Windorbska, dr n. med. Anna Koper, dr n. med. Wojciech Jóźwicki
Wszystkie kategorie świadczeń medycznych, udzielanych pacjentowi, są elementem
kompleksowej opieki medycznej. Kompleksowość opieki medycznej wymaga wykonania
szeregu usług medycznych w diagnostyczno-terapeutycznym planie pacjenta. Pacjenci
rozpoczynający i kończący pobyt w szpitalu powinni mieć ponadto zagwarantowaną
kontynuację opieki, która jest również elementem kompleksowego działania (1). Taki sposób
postępowania, w tym zespołowe zaangażowanie lekarzy klinicystów, lekarzy patomorfologów
oraz genetyków molekularnych i diagnostów laboratoryjnych, w ramach zintegrowanego
systemu, zapewniającemu dostęp do danych pacjenta w czasie rzeczywistym, umożliwiło
wprowadzenie standardów kompleksowej opieki medycznej w Centrum Onkologii w
Bydgoszczy.
Podobnie, jak w przypadku unikalności linii papilarnych, także nowotwór, u każdego
pacjenta posiada własny, unikalny, profil molekularny, który może być odpowiedzialny za
odmienną wrażliwość tkanki nowotworowej na stosowane metody leczenia. Analizując
molekularnie próbkę biologiczną, zawierającą komórki nowotworowe, określamy w Centrum
Onkologii, dostosowanie skuteczności leków i terapii, do nowotworu u konkretnego pacjenta.
Taka personalizacja leczenia, jest najbardziej efektywna kiedy cały proces kwalifikacji
pacjenta do leczenia celowanego, przeprowadzony jest w ośrodku o ustalonym standardzie
jakości, zdefiniowanym w zintegrowanym systemie zarządzania.
Personalizacja leczenia oparta na analizie mutacji w pojedynczym genie
Personalizacja medycyny skupia się na molekularnej, a w szczególności genetycznej
informacji o pacjencie.
Przykładem personalizacji leczenia, opartej na analizie 29 mutacji w pojedynczym genie dla
receptora naskórkowego czynnika wzrostu (EGFR) w raku niedrobnokomórkowym płuca
(NSCLC), jest terapia inhibitorami kinazy tyrozynowej (TKI), które silnie hamują
wewnątrzkomórkową fosforylację EGFR. Mutacje somatyczne w obrębie domeny kinazy
EGFR są obecne populacyjnie u około 10% -15% pacjentów z NSCLC, z obszaru Ameryki
Północnej i Europy Zachodniej (2). W podobnym odsetku (13%) mutacje somatyczne
wykrywane są w eksonach 18,19, 20 i 21 genu EGFR, u pacjentów Centrum Onkologii w
Bydgoszczy.
Zdefiniowanie zasad współpracy torakochirurga, patomorfologa, genetyka/biologa
molekularnego oraz onkologa, w poszczególnych etapach procesu kwalifikacji pacjenta z
niedrobnokomórkowym rakiem płuca do leczenia celowanego inhibitorami TK, pozwala na
znaczne przyspieszenie leczenia dzięki jednolitemu procesowi. Sprawny i skuteczny proces
kwalifikacji pacjenta daje możliwość znacznego zredukowania czasu kompleksowej usługi
medycznej, jeżeli jej poszczególne kroki wykonywane są w tym samym ośrodku. Działanie
proceduralne, zapewniające jakość standardu kompleksowej usługi medycznej, pozwala
minimalizację występowania fałszywie pozytywnych i fałszywie negatywnych wyników,
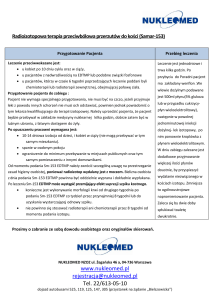
zmniejszając ryzyko błędnej kwalifikacji pacjenta do terapii celowanej (Tabela 1).
Etap/proces
Możliwe błędy
Powinno być
Kwalifikacja pacjenta do Błąd skierowania (np. ocena Ocena najczęstszych mutacji
badania leczenia lekiem najczęstszych mutacji w w genie EGFR
(TKI)
genie KRAS zamiast EGFR)
Patomorfologiczna
materiału
histopatologicznego
cytologicznego do
molekularnych
ocena Przypadkowa
selekcja
materiału
do
badań
lub molekularnych
bez
badań jakościowej
i ilościowej
analizy patomorfologicznej
Izolacja
DNA i
jego
ilościowa i jakościowa ocena
do przed dalszymi badaniami
molekularnymi
Ocena
histopatologiczna
(barwienie
hematoksylina/eozyna)
z
analizą ilościowa komórek
nowotworowych w materiale
zatopionym w bloczkach
parafinowych lub materiale
cytologicznym
Izolacja DNA zestawami Zwalidowany proces izolacji
nieznanymi,
lub DNA
posiadającymi CE-IVD – ale
bez wcześniejszej walidacji
Analiza 29 najczęstszych Analiza DNA bez kontroli Zwalidowana metoda PCR z
mutacji
aktywujących
i pozytywnej
w
każdym kontrolą
pozytywną,
inhibujących w genie EGFR badaniu
negatywną oraz
kontrolą
metoda PCR w czasie
wewnętrzną, w każdym
rzeczywistym
wykonywanym badaniu.
Interpretacja i przygotowanie Wydanie
wyniku
po Wydanie
wyniku
po
wyniku
automatycznej
analizie automatycznej i dodatkowej
badania
manualnej analizie wyniku.
Tabela 1: etapy diagnostyczne wpływające na jakość badań molekularno-genetycznych i
kwalifikacje pacjenta do terapii celowanej
Średni czas molekularnej charakterystyki procesu nowotworowego, opartej na analizie
mutacji pojedynczego genu, wynosi w Centrum Onkologii w Bydgoszczy 9 dni roboczych dla
materiału z bloczków parafinowych i/lub materiału cytologicznego. Czas charakterystyki
molekularnej liczony jest od momentu skierowania pacjenta na oznaczenie mutacji w genie
EGFR do momentu umieszczeniu wyniku badania w zintegrowanym systemie zarządzania
(niepublikowane dane).
Personalizacja leczenia oparta na analizie ekspresji wielu genów ( 20 tys. genów)
Nowe technologie, jakimi są: data-mining i techniki „wysokowydajnych technologii”,
jak mikromacierze i sekwencjonowanie nowej generacji, otwierają drzwi w kierunku
medycyny personalizowanej, pozwalając na diagnostykę oraz planowanie leczenia na
poziomie molekularnym, specyficznym dla każdego chorego (3). Wysokowydajne
technologie są doskonałym źródłem informacji do personalizowanej medycyny. W chwili
obecnej profile genetyczno-molekularne, z których korzystają, w planowaniu indywidualnego
leczenia, onkolodzy Centrum Onkologii w Bydgoszczy, wykonywane są w certyfikowanych
laboratoriach CLIA – z 2 rodzajów materiałów biologicznych: ze świeżej tkanki
nowotworowej (dla wszystkich rodzajów nowotworów) oraz z materiału tkankowego
utrwalonego, zatopionego w parafinie (dla raka piersi – CE-IVD, FDA -approved).
Każda z tych próbek musi przejść liczne kontrole jakości, zaczynając od
zwalidowanego zabezpieczenia próbki przed degradacją RNA, poprzez ocenę
patomorfologiczną odsetka komórek nowotworowych i kwalifikację/dyskwalifikację
materiału do dalszej analizy molekularnej. W dalszej kolejności wykonywana jest analiza
jakościowa i ilościowa wyizolowanych kwasów nukleinowych, przeznaczonych do badania
ponad 20 tys. genów w profilu genetyczno-molekularnym. Wszystkie analizy wsparte są
kontrolnymi profilami genetyczno-molekularnymi, kontrolami platformy eksploracyjnej która „odkodowuje” genetyczną informacją. Ważnym elementem jest także bieżąca edukacja
osób zaangażowanych w proces medyczny, w szczególności onkologów.
Innowacyjne wdrażanie standardów postępowania medycznego – wnioski.
Medycyna Personalizowana – „skrojona na miare”, według informacji genetycznej
zawartej w komórkach nowotworowych pacjenta, już dziś jest stosowana w oparciu o analizę
mutacji w pojedynczych genach (np. rak płuca, rak jelita grubego, rak piersi).
W ramach wdrażania innowacyjnych standardów postępowania medycznego, w
Centrum Onkologii im Prof. Franciszka Łukaszczyka w Bydgoszczy wdrażany jest
onkologiczny standard personalizacji – oparty na analizie ponad 20 tys. genów.
Taka innowacyjna diagnostyka, dzięki aplikacji klinicznej wcześniejszych badań z
zakresu nauk podstawowych, pozwala na zwiększenie odsetka pacjentów odnoszących
korzyść z zastosowanego leczenia, a tym samym wpływa na obniżenie kosztów skutecznego
leczenia. W ten sposób personalizacja działań medycznych staje się ważnym elementem
racjonalnego wykorzystania środków finansowych w ośrodkach świadczących usługi
medyczne.
Referencje:
1. Program akredytacji szpitali - zestaw standardów akredytacyjnych pod redakcja Ewy
Dudzik-Urbaniak; Centrum Monitorowania Jakości w Ochroni Zdrowia (CMJ) 2009.
2. Marchetti, A., C. Martella, et al. (2005). "EGFR mutations in non-small-cell lung
cancer: analysis of a large series of cases and development of a rapid and sensitive
method for diagnostic screening with potential implications on pharmacologic
treatment." Journal of clinical oncology : official journal of the American Society of
Clinical Oncology 23(4): 857-865.
3. Lewandowski R, Roszkowski K, Lewandowska MA. Medycyna personalizowana w
onkologii – wizja czy realna koncepcja ? Współczesna Onkologia (2011) vol. 15; 1
(1–6).