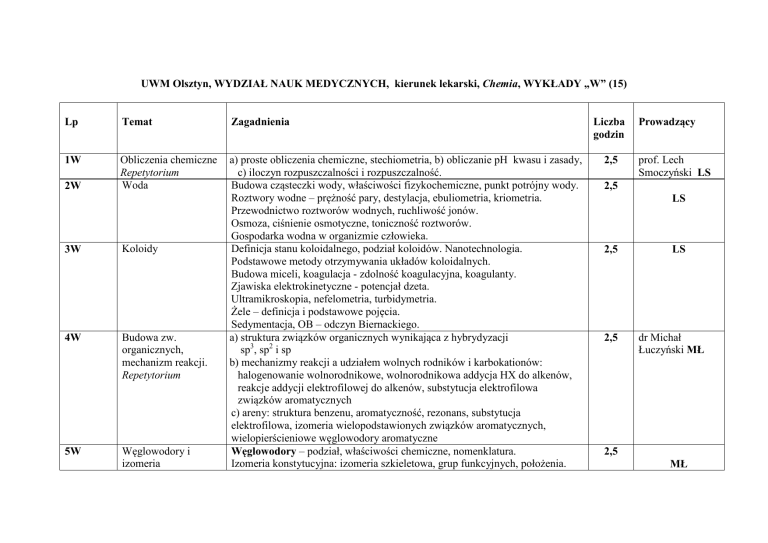
UWM Olsztyn, WYDZIAŁ NAUK MEDYCZNYCH, kierunek lekarski, Chemia, WYKŁADY „W” (15)
Lp
Temat
Zagadnienia
1W
Obliczenia chemiczne
Repetytorium
Woda
a) proste obliczenia chemiczne, stechiometria, b) obliczanie pH kwasu i zasady,
c) iloczyn rozpuszczalności i rozpuszczalność.
Budowa cząsteczki wody, właściwości fizykochemiczne, punkt potrójny wody.
Roztwory wodne – prężność pary, destylacja, ebuliometria, kriometria.
Przewodnictwo roztworów wodnych, ruchliwość jonów.
Osmoza, ciśnienie osmotyczne, toniczność roztworów.
Gospodarka wodna w organizmie człowieka.
Definicja stanu koloidalnego, podział koloidów. Nanotechnologia.
Podstawowe metody otrzymywania układów koloidalnych.
Budowa miceli, koagulacja - zdolność koagulacyjna, koagulanty.
Zjawiska elektrokinetyczne - potencjał dzeta.
Ultramikroskopia, nefelometria, turbidymetria.
Żele – definicja i podstawowe pojęcia.
Sedymentacja, OB – odczyn Biernackiego.
a) struktura związków organicznych wynikająca z hybrydyzacji
sp3, sp2 i sp
b) mechanizmy reakcji a udziałem wolnych rodników i karbokationów:
halogenowanie wolnorodnikowe, wolnorodnikowa addycja HX do alkenów,
reakcje addycji elektrofilowej do alkenów, substytucja elektrofilowa
związków aromatycznych
c) areny: struktura benzenu, aromatyczność, rezonans, substytucja
elektrofilowa, izomeria wielopodstawionych związków aromatycznych,
wielopierścieniowe węglowodory aromatyczne
Węglowodory – podział, właściwości chemiczne, nomenklatura.
Izomeria konstytucyjna: izomeria szkieletowa, grup funkcyjnych, położenia.
2W
3W
Koloidy
4W
Budowa zw.
organicznych,
mechanizm reakcji.
Repetytorium
5W
Węglowodory i
izomeria
Liczba
godzin
2,5
Prowadzący
prof. Lech
Smoczyński LS
2,5
LS
2,5
2,5
2,5
LS
dr Michał
Łuczyński MŁ
MŁ
6W
Najważniejsze grupy
związków
organicznych
Izomeria konfiguracyjna: izomeria cis-trans, izomeria Z-E. Chiralność i
enancjomeria, projekcja Fischera, określanie konfiguracji R-S przy centrum
stereogenicznym. Właściwości fizyczne i chemiczne enancjomerów.
Skręcalność właściwa. Diastereoizomery. Cząsteczki o więcej niż jednym
centrum stereogenicznym. Związek mezo. Właściwości fizyczne i chemiczne
diastereoizomerów. Stereoselektywność reakcji i rozdział mieszaniny
racemicznej. Działanie biologiczne stereoizomerów, kluczowe znaczenie
stereoizomerii w oddziaływaniu związków chemicznych z receptorami.
Alkohole i fenole. Klasyfikacja i nomenklatura alkoholi. Struktura grupy
hydroksylowej a właściwości alkoholi. Alkohole jako słabe kwasy. Alkohole
jako słabe zasady – reakcje substytucji i eliminacji. Konkurencyjny metabolizm
metanolu i etanolu w organizmie ludzkim. Porównanie budowy alkoholi i
fenoli. Fenole jako słabe kwasy. Aldehydy i ketony. Nazewnictwo. Budowa
grupy karbonylowej i jej wpływ na właściwości fizyczne i reaktywność
aldehydów i ketonów. Reakcje addycji nukleofilowej do grupy karbonylowej.
Reaktywność tzw. Atomów wodoru α; kondensacja aldolowa. Reakcje redoks z
udziałem aldehydów i ketonów, utlenianie aldehydów, reakcja Cannizzaro,
utlenianie ketonów metylowych w reakcjach haloformowych. Redukcja
aldehydów i ketonów. Kwasy karboksylowe i ich pochodne. Nomenklatura.
Budowa, właściwości fizyczne i reaktywność. Sole kwasów karboksylowych –
otrzymywanie i hydroliza. Czynniki wpływające na moc kwasów. Podstawienie
grupy hydroksylowej. Otrzymywanie kwasów karboksylowych. Pochodne
kwasów: struktura, klasyfikacja i reaktywność. Zastosowanie salicylanów w
leczeniu stanów zapalnych. Substytucja nukleofilowa przy grupie arylowej –
mechanizmy reakcji. Otrzymywanie, nazewnictwo, struktura i reakcje:
bezwodników kwasowych, chlorków kwasowych, estrów kwasów
karboksylowych, amidów i nitryli. Mechanizm reakcji estryfikacji. Aminy –
klasyfikacja i nazewnictwo. Rzędowość amin. Aminy aromatyczne i
alifatyczne. Budowa, właściwości fizyczne i reaktywność amin. Zasadowość
amin. Aminy jako nukleofile. Zastosowanie soli diazoniowych w syntezie
organicznej. Aminy jako związki biologicznie aktywne, opionoidy, reguła
morfinowa.
2,5
MŁ
UWM Olsztyn, WYDZIAŁ NAUK MEDYCZNYCH
kierunek lekarski, Chemia
ĆWICZENIA LABORATORYJNE „L” (25), SEMINARIUM „S” (10)
Lp
Temat
Zagadnienia
0L
Wstępne ćwiczenia
laboratoryjne
Zasady bezpieczeństwa pracy w laboratorium. Zapoznanie się ze sprzętem i
podstawowymi czynnościami laboratoryjnymi.
Równowaga chemiczna.
Reguła Le Chateliera
Pojęcie stanu równowagi dynamicznej reakcji chemicznej. Wpływ stężenia
reagentów i temperatury na równowagę reakcji. Przewidywanie przebiegu reakcji
po zaburzeniu równowagi dynamicznej. Reguła Le Chateliera. Stała równowagi
(K) reakcji dysocjacji i reakcji kompleksowania. Równowaga reakcji
strąceniowych.
Bufory – rodzaje, skład i właściwości. Bufory płynów fizjologicznych
(wodorowęglanowy, fosforanowy, białczanowy). Sporządzanie roztworów
buforowych (buforowany roztwór soli fizjologicznej PBS). Wyznaczanie
pojemności buforowej. Określenie wpływu rozcieńczania na pH buforu oraz
pojemność buforową.
Podstawy spektrofotometrii absorpcyjnej. Kolorymetria. Prawo Lamberta-Beera.
Molowy współczynnik absorpcji. Krzywa standardowa (wzorcowa, kalibracyjna).
Zasada ilościowego oznaczania białka metodą biuretową.
Chromatografia cienkowarstwowa (TLC). Współczynnik retencji. Rozdział
barwników roślinnych metodą chromatografii cienkowarstwowej. Synteza
popularnych leków aspiryny i paracetamolu. Szacowanie czystości produktu:
pomiar temperatury topnienia i chromatografia cienkowarstwowa (TLC).
Zastosowanie chromatografii w diagnostyce laboratoryjnej.
Badanie rozpuszczalności tłuszczów. Zasadowa hydroliza tłuszczu – reakcja
zmydlania. Ocena charakteru tłuszczów.
1L
Kolokwium 1
Roztwory buforowe
2L
Kolokwium 2
3L
Ilościowe oznaczanie białka
metodą spektrofotometryczną
Kolokwium 3
TLC
4L
Aspiryna, paracetamol
Tłuszcze
Liczba
godzin
1
4
4
4
4
Prowadzący
Aminokwasy, białka
Cukry
5L
Kolokwium 4
Produkty naturalne
6L
Kolokwium 5
7S
Zajęcia organizacyjne.
8S
Obliczenia chemiczne.
Chemia wolnych rodników.
9S
Kinetyka chemiczne.
Elektrochemia.
Amfoteryczne właściwości aminokwasów. Słabe właściwości kwasowe
aminokwasów. Reakcja z generowanym in situ kwasem azotowym(III)
(diazowanie). Reakcja z solami miedzi(II). Reakcja z ninhydryną.
Reakcja Millona. Reakcja biuretowa. Reakcja cystynowa. Denaturacja białka.
Reakcja ksantoproteinowa.
Reakcja Molisha. Właściwości redukujące cukrów prostych – reakcje Tollensa i
Fehlinga. Reakcja Seliwanowa.. Kwasowa hydroliza sacharozy. Enzymatyczna
hydroliza sacharozy. Reakcje polisacharydów z płynem Lugola. Reakcje, na
których opiera się laboratoryjna diagnostyka medyczna.
Destylacja z parą wodną i ekstrakcja prosta ciecz-ciecz: otrzymywanie olejku
goździkowego. Olejki eteryczne, destylacja z parą wodną. Ekstrakcja prosta i
suszenie roztworów w rozpuszczalnikach organicznych – otrzymywanie i
charakterystyka olejku goździkowego. Izolacja trimirystyny z gałki
muszkatołowej - zastosowanie aparatu Soxhleta. Wykorzystanie naturalnych
źródeł substancji biologicznie aktywnych w medycynie.
Omówienie tematyki seminariów. Przydział tematów referatów 1 i 2.
Omówienie tematyki pozostałych referatów. Organizacja i regulamin zajęć.
Referat 1 – Obliczanie: a) pH roztworu (bufory, sole), b) aktywności jonu,
c) rozpuszczalności.
Referat 2 – Powstawanie wolnych rodników. Reaktywne formy tlenu. Kwas
podchlorawy i jego pochodne. Tlenek azotu i nadtlenoazotyn. Wolne rodniki
organiczne. Inaktywacja wolnych rodników. Destrukcyjne działanie wolnych
rodników na elementy budulcowe komórek. Pozytywne działanie wolnych
rodników w organizmie.
Referat 3 – Cząsteczkowość i rząd reakcji, stała szybkości reakcji I i II rzędu –
graficznie i matematycznie, czas połowicznej przemiany (leku, substancji
promieniotwórczej), wyznaczanie rzędu reakcji, wpływ temperatury na szybkość
reakcji – współczynnik van’t Hoffa i równanie Arrheniusa, energia aktywacji w
wybranych procesach biochemicznych.
Referat 4 – Procesy redoks – znaczenie przyrodnicze, procesy aerobowe,
anoksyczne i anaerobowe (siarkowodór, septyczność). Potencjał półogniwa
(Nernsta). Półogniwa wzskaźnikowe i odniesienia. Ogniwa chemiczne i
4
4
1
LS
2
LS
2
LS
10S Chemia steranu
Związki heterocykliczne
Węglowodany
11S Lipidy i błony biologiczne.
Kwasy nukleinowe
Eikozanoidy
12S Zaliczenie
stężeniowe. Elektrochemia, polaryzacja elektrod, nadnapięcie. Analityczne
metody amperometryczne. Fizykochemia procesu oddychania w organizmie.
Referat 5 - Nomenklatura steroidów. Właściwości chemiczne. Wpływ
podstawników na właściwości chemiczne. Stereochemia układu steranu α- i βsteran. Budowa i właściwości cholesterolu, kwasu cholowego i kwasów
żółciowych. Hormony steroidowe (glukokortykosteroidy, androgeny, estrogeny)
– synteza. Cyklopenta[a]fenantren.
Referat 6 - Związki heterocykliczne o znaczeniu dla organizmu ludzkiego.
Witaminy. Związki heterocykliczne zawierające atomy azotu, tlenu, siarki i
selenu.
Referat 7 - Budowa i właściwości fizykochemiczne polisacharydów pełniących
funkcje zapasowe i strukturalne. Pochodne cukrów o znaczeniu biologicznym:
glikozydy, homoglikany, heteroglikany. Glikoproteiny i proteoglikany.
Referat 8 - Lipidy. Woski i tłuszcze. Kwasy tłuszczowe nasycone i nienasycone:
budowa, właściwości, nazewnictwo. Fosfolipidy. Glikolipidy. Terpeny. Błony
biologiczne – struktura i funkcja. Budowa chemiczna i fizyczna błon
komórkowych. Funkcje błon biologicznych. Rodzaje transportu przez błony.
Detektory zapachu i smaku. Biosensory.
Referat 9 - Budowa i właściwości fizykochemiczne zasad azotowych. Budowa i
znaczenie biologiczne nukleozydów i nukleotydów. Budowa i właściwości
kwasów nukleinowych. Enzymy i koenzymy.
Genotoksyczność. Oksydatywny metabolizm wielopierścieniowych
węglowodorów aromatycznych. Korelacja struktury i szkodliwej aktywności
biologicznej wybranych związków organicznych.
Referat 10 - Kwas arachidonowy – budowa, właściwości występowanie.
Pochodne kwasu arachidonowegopowstające na szlaku cyklooksygenazowym
(prostaglandyny, prostacykliny, tromboksany), lipoksygenazowym (leukotrieny,
lipoksyny, hepoksyliny, trioksyliny), epoksygenazowym. Izoporostany.
Podsumowanie ćwiczeń lab i proseminarium, zaliczenie.
2
MŁ
2
MŁ
1
LS