FIZYKA dla studentów
POLIGRAFII
Falowe własności materii
Mikroświat
Fale materii
Rok 1924 - francuski fizyk Louis de Broglie
Potwierdzenie eksperymentalne w 1927 roku - Davisson i Germer
Dyfrakcja elektronów na krysztale
Pomiar z wiązką o bardzo
małym natężeniu
Interferencja fal jednego
elektronu, uginających się na
różnych płaszczyznach kryształu
Zasada nieoznaczoności
Pomiar położenia poruszającej się cząstki
Z 1 minimum dyfrakcyjnego:
Warunek na minimum:
Zasada nieoznaczoności
Werner Heisenberg w 1927 roku
Wielkości kanonicznie sprzężone.
Równanie Schrödingera
Równanie Schrödingera przypisuje
poruszającej się swobodnie cząstce falę
o określonej częstotliwości i długości
Rozwiązaniem jest funkcja opisująca
przemieszczanie się fali – funkcja falowa
W mechanice kwantowej nie określamy położenia cząstki, a
określamy prawdopodobieństwo tego położenia.
Zasada nieoznaczoności
Poruszająca się cząstka paczka falowa
Paczka falowa - suma fal harmonicznych różniących się
częstotliwościami, a więc i długościami fal.
Funkcja falowa
Funkcja falowa jest często funkcją zespoloną.
Sens fizyczny ma kwadrat funkcji odpowiadający
prawdopodobieństwu tego,że cząstka znajduje się
w określonym punkcie w przestrzeni i czasie.
Wielokrotne pomiary położenia w tych samych
warunkach - różne wyniki mające pewien rozkład
statystyczny charakteryzujący "rozmycie" położenia
w przestrzeni.
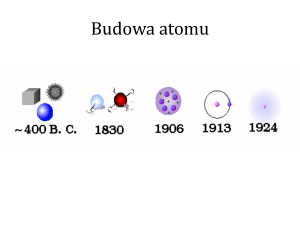
Struktura atomu
Model Thompsona:
Eksperyment Rutherforda (1911):
Masa skupiona w jądrze
o rozmiarach ~ 10-14 m
10-10 m
Struktura atomu
Wynik oczekiwany dla
modelu Thompsona:
Wynik eksperymentu
Rutherforda:
Struktura atomu
Trudności modelu Rutherforda:
•Elektrony nie mogą być w spoczynku, bo siły
elektrostatyczne przyciągnęłyby je do dodatniego jądra.
•Jeśli elektrony krążą wokół jądra, to zgodnie z teorią
Maxwella muszą emitować promieniowanie o widmie
ciągłym – obserwujemy widmo liniowe!
•Wskutek emisji promieniowania elektrony tracą energię
i w końcu spadną na jądro.
Widmo wodoru
Widmo światła białego
Widmo wodoru
Seria Balmera:
Liczba falowa:
Stała Rydberga:
Widmo wodoru
Wzór dla wszystkich serii:
m identyfikuje nazwę serii: Lymana (m=1), Balmera
(m=2), Paschena (m=3), Bracketta (m=4), Pfunda (m=5).
Model atomu Bohra
Niels Bohr (1913)
1. Elektron w atomie może poruszać się tylko po takich orbitach,
dla których orbitalny moment pędu równy jest całkowitej
wielokrotności stałej Plancka
. W takim stanie ruchu
elektron nie emituje promieniowania elektromagnetycznego.
2. Emisja promieniowania następuje w sposób nieciągły gdy
elektron zmienia swe położenie przeskakując na inna orbitę.
Częstotliwość wyemitowanego wówczas promieniowania
określona jest przez różnicę energii elektronu na obu
orbitach:
gdzie E1 i E2 oznaczają odpowiednio
energie elektronu na orbitach przed i po emisji.
Model atomu Bohra
2 r n
h
p
h
2 r n
p
h
p r n
2
I postulat Bohra
Model atomu Bohra
Atom wodoropodobny
Równowaga sił:
I postulat Bohra:
n
vn
m rn
Model atomu Bohra
Energia elektronu:
Model atomu Bohra
4 0 2 2
rn
n
2
m Z e
Energia elektronu na
n-tej orbicie
Model atomu Bohra
Energia elektronu na
n-tej orbicie
Model atomu Bohra
Energia fotonu wypromieniowana przy przeskoku
z orbity n na orbitę m
Model atomu Bohra
Stała Rydberga
Emisja promieniowania rentgenowskiego
Promieniowanie liniowe
Promieniowanie ciągłe
(hamowania)