Rozdzielanie kwasów perfluorokarboksylowych metodą
elektroforezy kapilarnej z detekcją bezpośrednią UV
Electrophoresis, w druku
Lena Wójcik 1, Bogdan Szostek 2, Wioleta Maruszak 3, Marek Trojanowicz 1
1) Wydział Chemii Uniwersytetu Warszawskiego,
2) DuPont Haskell Laboratory for Health and Environmental Sciences, USA,
3) Instytut Farmaceutyczny, Rydygiera 8, Warszawa
Opracowano warunki rozdzielania i oznaczania perfluorowanych kwasów
karboksylowych (PFCAs) zawierających od 6 do 12 atomów węgla w cząsteczce
metodą elektroforezy kapilarnej z detektorem diodowym. Optymalizowano warunki
pomiarów przez dobór odpowiedniego rodzaju i stężenia elektrolitu podstawowego,
jak również typu i zawartości procentowej modyfikatora organicznego. Za optymalne
warunki rozdzielania badanych kwasów uznano 50 mM bufor fosforanowy o pH 9,3
zawierający 40% izopropanolu. Za optymalną długość fali detekcji uznano 190 nm.
Dla detekcji pośredniej badano kilka chromoforów, a 5 mM kwas 3,5dinitrobenzoesowy w 20 mM buforze fosforanowym uznano za optymalny eluent dla
detekcji pośredniej przy 280 nm. Limit detekcji oznaczony dla detekcji bezpośredniej
zawiera się w przedziale od 2 g/mL dla C6-PFCA do 33 g/mL dla C12-PFCA. Limit
detekcji osiągnięty dla detekcji pośredniej był porównywalny do limitu detekcji dla
detekcji bezpośredniej UV.
0.0062
3
Absorbancja, AU
0.0060
4
5
7
6
2
1
0.0058
0.0056
0.0054
0.0052
10
11
12
13
14
15
16
17
18
19
20
Czas, s
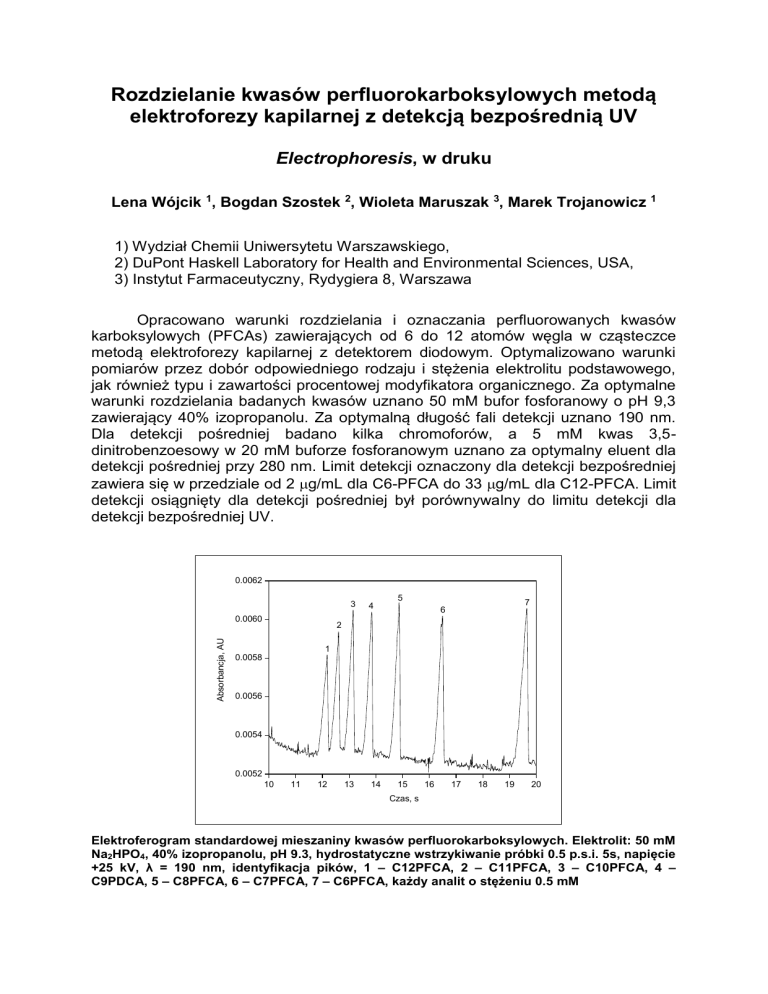
Elektroferogram standardowej mieszaniny kwasów perfluorokarboksylowych. Elektrolit: 50 mM
Na2HPO4, 40% izopropanolu, pH 9.3, hydrostatyczne wstrzykiwanie próbki 0.5 p.s.i. 5s, napięcie
+25 kV, λ = 190 nm, identyfikacja pików, 1 – C12PFCA, 2 – C11PFCA, 3 – C10PFCA, 4 –
C9PDCA, 5 – C8PFCA, 6 – C7PFCA, 7 – C6PFCA, każdy analit o stężeniu 0.5 mM
Zastosowanie różnych technik zatężania on-line w
oznaczeniach melatoniny i wybranych neuroprzekaźników
metodą elektroforezy kapilarnej
Electrophoresis, przyjęte do druku
Jacek Musijowski, Ewa Poboży, Marek Trojanowicz
Melatonina (N-acetylo-5metoksytryptamina) jest hormonem wydzielanym
przez szyszynkę. Spełnia ona wiele istotnych funkcji w organizmach. Najlepiej
została poznana jej funkcja jako fizjologicznego regulatora dobowego cyklu snu.
Opracowano metodę oznaczania i rozdzielania melatoniny (MT) i innych związków
indolowych współwystępujących w próbkach naturalnych: 6-hydroksymelatoniny (6HMT), kwasu 5-metoksyindolooctowego (5-MIAA), 5-metoksytryptaminy (5-MTRA),
tryptofanu (TRP) i serotoniny (SER). Jako metodę rozdzielania zastosowano
micelarną chromatografię elektrokinetyczną (MEKC) z dodecylosiarczanem sodu
jako fazą pseudostacjonarną. Uzyskano dobre rozdzielenie wszystkich analitów.
Ponieważ melatonina występuje w płynach ustrojowych na poziomie pg/ml,
konieczne jest przeprowadzenie wstępnego zatężania próbki. W tym celu
sprawdzono możliwość zastosowania różnych wariantów technik zatężania on-line w
kapilarze: spiętrzania (ang. stacking) oraz zmiatania (ang. sweeping). Uzyskane dla
melatoniny współczynniki zatężania przedstawiono poniżej (EOF –przepływ
elektroosmotyczny, LD – limit detekcji)
Spiętrzanie
przy wysokim
EOF
Spiętrzanie
przy zatrzymanym
EOF
Zmiatanie
przy wysokim
EOF
Zmiatanie
przy zatrzymanym
EOF
Współczynnik
zatężania
52,8
8,6
41,8
11,9
LD [ng/ml]
40
30
59
36
Technika
Elektroforeogramy otrzymane po zastosowaniu techniki zmiatania z odwróconą migracją miceli
i różnych czasach wstrzykiwania próbki 3, 30 i 50 sekund.
Próbka: 1) 5-MTRA, 2) SER, 3)L-TRP, 4) MT, 5) 5-MIAA, 6) 6-HMT, 1 g/ml każdy;
Elektrolit: 20 mM bufor fosforanowy pH 3,3 z 50 mM SDS; Napięcie: -20kV. Detekcja UV λ=214 nm.
Zastosowanie cyklodekstryn w rozdzielaniu kompleksów
metaloporfirynowych metodą elektroforezy kapilarnej
Electrophoresis, wysłane do opublikowania
Krystyna Pyrzyńska, Krzysztof Kilian
Rozdzielanie i ilościowe oznaczanie porfiryn i ich kompleksów odgrywa istotną
rolę w analizie klinicznej i farmaceutycznej.
Niestety jakość uzyskanych
elektroferogramów jest często obniżona przez silne rozmycie czołowe lub tyłowe
sygnałów.
Cyklodekstryny są naturalnie występującymi cyklicznymi oligosacharydami, w
których jednostki D-glukozy tworzą lukę, oddziałującą z
cząsteczkami o
odpowiednim kształcie i wielkości na zasadzie gość-gospodarz. Metaloporfiryny
tworzą z cyklodekstrynami kompleksy inkluzyjne o stechiometrii 1:2, których
charakterystyczną właściwością jest ograniczenie oddziaływań pomiędzy
cząsteczkami metaloporfiryn w roztworze.
Zbadano możliwość zastosowania modyfikacji elektrolitu podstawowego cyklodekstryną do poprawy rozdzielenia mieszaniny kompleksów Co, Cu, Cd, Ni i Zn
z TCPP, o stężeniu 10-5 mol/dm3 . Zastosowano bufor boranowy o stężeniu 50
mmol/dm3 i pH=9.0 z dodatkiem 2 mmol/dm3 -cyklodekstryny. Zastosowanie
-cyklodekstryny pozwoliło na rozdzielenie mieszaniny metaloporfiryn i
uzyskanie sygnałów o poprawnych kształtach.
CuTCPP
CoTCPP
NiTCPP
ZnTCPP
CdTCPP
Elektroferogram mieszaniny kompleksów metaloporfirynowych po modyfikacji
elektrolitu podstawowego 2 mmol/dm3 -cyklodekstryną (TCPP – 5,10,15,20-tetrakis
(4-karboksyfenylo) porfiryna).
Wykorzystanie zintegrowanego systemu chromatografów
jonowych do oznaczania chlorków, fosforanów
i siarczanów w roztworach stężonego kwasu azotowego
Journal of Chromatography A, 1026 (2004) 195-200
Magdalena Biesaga 1, Nicole Schmidt 2 and Andreas Seubert *,2
1) Wydział Chemii Uniwersytetu Warszawskiego
2) Department of Chemistry, Philipps-University of Marburg, Niemcy
Wysokiej czystości kwas azotowy jest wykorzystywany w produkcji elementów
elektronicznych. Oznaczanie śladowych zanieczyszczeń w roztworach o
skomplikowanej matrycy jest szczególnie trudnym zagadnieniem.
Dwa połączone on-line systemy chromatografów jonowych zostały
wykorzystane do oznaczanie zawartości chlorków, fosforanów i siarczanów w
roztworze stężonego kwasu azotowego. Pierwszy system zawierał kolumnę
anionową z kopolimerem divinylobenzenu i polistyrenu i unieruchomionymi grupami
N-metylodietanolowymi o dużej pojemności, która umożliwiała oddzielenie
anionowych zanieczyszczeń od wysokiego stężenia azotanów. Drugi system
zawierający komercyjną kolumnę anionową był wykorzystywany do oznaczeń
ilościowych. Oba systemy były połączone zaworem z kolumienką zatężającą.
Calkowity czas analizy wynosił 30 minut. Granica wykrywalności dla Cl -, SO42-, PO43wynosiła odpowiednio 0,1; 1 i 5 mg/l w kwasie azotowym o stężeniu 69%.
(a)
(b)
Schemat układu (a) zatężanie próbki; (b) analizowanie próbki
Wpływ stężenia kwasu azotowego
(system 1)
Chromatograam mieszaniny anionów po
oddzieleniu matrycy-system 2
Opracowanie układu do chromatografii cieczowej z
detekcją w podczerwieni i detekcją Ramana z
zastosowaniem mikrodyspensera przepływowego
Journal of Chromatography A, w druku
Izabella Surowiec 1, Josefa R. Baena 2, Johannes Frank 2, Thomas Laurell 3,
Marek Trojanowicz 1, Bernhard Lendl 2
1) Wydział Chemii Uniwersytetu Warszawskiego,
2) Instytut Technologii Chemicznej i Analizy Politechniki Wiedeńskiej, Austria
3) Wydział Pomiarów Elektrycznych, Instytut Technologii Uniwersytetu w Lund,
Szwecja
Mikrodyspenser (Rys.1) jest urządzeniem zbudowanym z dwóch struktur
silikonowych z kanałem pomiędzy nimi, umożliwiającym jego podłączenie do
pomiarowego systemu przepływowego (np. HPLC, Rys.2). Do kanału zamocowany
jest poprzez płytkę z pleksi element piezoceramiczny. Przyłożenie napięcia do tego
elementu powoduje jego zginanie a tym samym nacisk na kanał przepływowy i
wypchnięcie kropli z małego otworu znajdującego się w nim. Zastosowanie
mikrodyspensera umożliwia naniesienie wycieku z kolumny chromatograficznej na
płytkę spektroskopową sterowaną komputerem i poruszającą się z określoną
prędkością pod urządzeniem w postaci szeregu kropel o objętości pikolitrów.
Odparowanie eluenta z tych kropel jest szybkie i umożliwia analizę otrzymanych
suchych depozytów różnymi technikami mikroskopowymi.
Układ HPLC-mikrodyspenser został wykorzystany do oznaczania pięciu
kwasów fenolowych występujących w próbkach win, po ich uprzednim
chromatograficznym rozdzieleniu na kolumnie C-18 o średnicy 2.1 mm. Widma
poszczególnych osadzonych związków zostały wykonane mikroskopią w
podczerwieni oraz mikroskopią Ramana i wykazały dużą zgodność z widmami
odniesienia wzorców, udowadniając tym samym przydatność powyższej techniki do
analizy i charakterystyki związków metodą HPLC z detekcją w podczerwieni.
Rys. 1. Schemat mikrodyspensera
Rys. 2. Schemat układu HPLC-mikrodyspenser.
Porównanie różnych sorbentów stosowanych w ekstrakcji
do fazy stałej (SPE) do zatężania herbicydów
fenoksykwasowych
Praca w przygotowaniu do opublikowania
Anna Jankowska, Magdalena Biesaga, Krystyna Pyrzyńska
Badano efektywność zatężania 6 herbicydów fenoksykwasowych: dikamby,
MCPA, 2,4-D, MCPP, 2,4-DP i 2,4,5-T na różnych sorbentach: fenylowym, C18,
Strata X, SAX, Oasis. Zatężone związki oznaczano za pomocą chromatografii
cieczowej w układzie izokratycznym z detekcją UV przy długości fali 225 nm.
Eluentem była acetonitrylu z 26,2 mM kwasem octowym o pH 2,5 o stosunku obj.
(40/60, v/v).
Przed zatężaniem próbki były zakwaszane do pH 2,5 kwasem octowym i
wymywane 1 ml metanolu. Inną procedurę stosowano przy zatężaniu próbki na
silnym wymieniaczu anionowym SAX, próbek nie zakwaszano, i wymywano anality 1
ml acetonitrylu z buforem octanowym o pH 6,9 (40/60, v/v). Porównywano odzysk
uzyskany na każdym sorbencie. Chromatogramy przestawiają zatężone próbki wody
oligoceńskiej i z Kanału Żerańskiego z dodatkiem wzorców o stężeniu 5 µg/L.
Najlepsze rezultaty uzyskano na sorbentach polimerycznych: Strata X i Oasis oraz
na sorbencie fenylowym, rzędu 90% dla MCPA, 2,4-D, MCPP i 2,4-DP, ponad 80%
dla 2,4,5-T, najgorszy odzysk na wszystkich sorbentach otrzymano dla dikamby,
która w odróżnieniu od pozostałych herbicydów jest pochodną kwasu
benzoesowego.
0,0085
0,0075
1
2
0,0065
woda zatężona na
sorbencie fenylowym
3
1
woda zatężona na
sorbencie fenylowym
0,0055
2
Intensity
(AU)
3
0,0045
4 5
Intensity
(AU)
6
Strata X
4
5
6
0,0035
Strata X
0,0025
fenylowy
fenylowy
0,0015
Oasis
Oasis
0
5
10
15
20
25
Retention Time (min)
30
35
0
5
a
10
15
20
25
Retention Time (min)
30
35
Enzymatyczne oznaczanie mikrocystyn z
wykorzystaniem bioczujników amperometrycznych
Biosensors and Bioelectron 20 (2005) 1520-1530
M. Campas2, Dorota Szydlowska1, Marek Trojanowicz1, J.-L. Marty2
1) Wydział Chemii Uniwersytetu Warszawskiego,
2) Centrum Fitofarmacji Uniwersytetu w Perpignan, Francja
Celem badań było opracowanie bioczujników przeznaczonych do szybkiego
monitoringu środowiskowego szkodliwych produktów metabolizmu cyjanobakterii
(sinic) występujących w zbiornikach słodko- i słonowodnych. Bioczujniki te będą
przeznaczone
do
detekcji
jednej
z
najobszerniejszych
klas
toksyn
cyjanobakteryjnych, mikrocystyn, wywołujących silne efekty chorobotwórcze.
(6) D-Glu (iso)
(7) N-methyldehydro Ala
CH3
N
HN
O
O
Adda
H3C
O
COOH
NH
CH2
OCH3
CH3
NH
CH3
(1) D-Ala
CH3
H
N
Z
(4) Z
O
O
H3C
X
(2) X
COOH
(3) D-erythro--methylAsp (iso)
Toksyczność mikrocystyn jest wynikiem ich silnego wiązania do kluczowych
enzymów komórkowych nazywanych fosfatazami proteinowymi. Mikrocystyny
powodują
inhibicję
enzymów
odpowiedzialnych
za
defosforylację
wewnątrzkomórkowych fosfoprotein. Wielkość inhibicji enzymu może być użyta jako
miara zawartości mikrocystyn w badanych próbkach. Inhibitowane enzymy należą do
klasy fosfataz serynowo/treoninowych (PP).
W pracy badawczej wykorzystano węglowe elektrody sitodrukowane służące
jako podłoże do unieruchomienia fosfatazy proteinowej typu 2A (PP2A). Enzym
unieruchomiono na zasadzie pułapkowania cząsteczek białka w matrycy polimerowej
alkoholu poliwinylowego sprzężonego z grupami styrylopirydynowymi. (PVA-SbQ).
Oznaczanie mikrocystyn opiera się na inhibicji unieruchomionego na powierzchni
bioczujnika enzymu, oraz możliwości amperometrycznej detekcji powstającego w
reakcji enzymatycznej elektroaktywnego produktu. Uzyskane wyniki wskazują, że
stężenie przy którym inhibicja osiąga wartość 50 % wynosi IC50 = 0,867µg/L
0,001
0,01
0,1
1
10
MC-LR ug/L
100
1000
100
90
80
70
60
50
40
30
20
10
0
10000
% inhibicji
Inhibicja unieruchomionej fosfatazy proteinowej (PP)
Zastosowanie elektrod sitodrukowanych modyfikowanych
nanorurkami węglowymi do konstrukcji czujników
chemicznych i bioczujników
Analytical Letters, 37 (2004) 3185-3204
Marek Trojanowicz 1, Ashok Mulchandani 2, Marco Mascini 3
1) Wydział Chemii Uniwersytetu Warszawskiego
2) Wydział Inżynierii Chemicznej i Środowiskowej Uniwersytetu Kalifronijskiego w
Riverside, USA
3) Laboratorium Bioczujników Wydziału Chemii Uniwersytetu we Florencji,
Włochy
Do
modyfikowania
powierzchni
grafitowych
elektrod
pracujących
trójelektrodowych sitodrukowanych czujników elektrochemicznych zastosowano
wielościenne nanorurki węglowe (CNT) otrzymane metodą CVD przez sublimację
ferrocenu. Modyfikowanie prowadzono przez odparowanie na powierzchni elektrod
grafitowych zawiesin nanorurek w dimetyloformamidzie. Wykazano wpływ
zmodyfikowania na odwracalność procesów elektrodowych. Efekt ten wykorzystano
do poprawy czułości detekcji i poziomu wykrywalności pestycydu paraoksonu w
pomiarach z bioczujnikiem zawierającym unieruchomiony enzym hydrolazę
organofosforową OPH (Rys.1). Pozytywny efekt modyfikacji nanorurkami uzyskano
również w elektrokatalitycznym pomiarze metanolu w obecności jonów kobaltu(II) w
roztworze (Rys.2).
40
700
600
30
Current, uA
Current, nA
500
400
300
200
20
10
100
0
0
0
10
20
30
40
50
Paraoxon concentration, M
Rys. 1. Zależność wielkości prądu anodowego od
stężenia
paraoksonu
dla
bioczujnika
z
powierzchnią niemodyfikowaną CNT () oraz
modyfikowaną 5 g () i 20 g () CNT. Pomiar w
50 l próbki umieszczonej na powierzchni
bioczujnika.
60
0
100
200
300
400
500
600
700
Methanol concentration, mM
Rys. 2. Zależność wielkości prądu od stężenia
metanolu mierzona czujnikami
niezmodyfikowanymi CNT (,) oraz
zmodyfikow
,). Pomiar w
,) oraz
+0.9 V vs. Ag/AgCl (,).
Enancjoselektywne czujniki ze unieruchomioną oksydazą
D-aminokwasową
Praca w przygotowaniu do publikacji
Marzena Wcisło1, Dario Compagnone2, Marek Trojanowicz1
1) Wydział Chemii Uniwersytetu Warszawskiego,
2) Wydział Chemii Żywności Uniwersytetu w Teramo, Włochy
Celem pracy było stworzenie i zoptymalizowanie bioczujnika z
unieruchomioną oksydazą D-aminokwasową. Jest to enzym niespecyficzny gdyż
utlenia więcej niż jeden aminokwas o konfiguracji względnej D, wyróżnia się
natomiast wysoką enancjoselektywnością w stosunku do aminokwasów D.
Jako analit wybrana została alanina, gdyż zawartość jej enancjomeru D w
naturalnych próbkach żywności może być wskaźnikiem czystości bakteriologicznej.
Stosunek enancjomerów związków będących składnikami żywności jest istotnym
wskaźnikiem jakości, postępu procesów technologicznych, zanieczyszczenia,
podrabiania, bądź starzenia się produktu. Konstrukcja bioczujnika oparta były na
elektrodzie “screen-printed” pokrytej warstwą Błękitu Pruskiego, który stanowił
mediator czuły na zmiany stężenia nadtlenku wodoru, wprost proporcjonalne do
zmian stężenia aminokwasów o konformacji D.
Optymalizacja bioczujnika polegała na wyborze odpowiedniego buforu,
ustaleniu najlepszego pH, dobraniu odpowiednich proporcji składników warstwy z
unieruchomionym enzymem, sposobu jej przygotowania i przechowywania gotowego
czujnika. Sprawdzana była czułość bioczujnika, czas jego życia i
enancjoselektywność.
Unieruchomienie DAAOx możliwe było po dializie enzymu, który, handlowo
dostępny zawiera sole TRIS, które utrudniały immobilizację enzymu. Otrzymany
bioczujnik jest enancjoselektywny. Może być stosowany do oznaczania całkowitej
ilości D aminokwasów przy obecności L aminokwasów. Otrzymano liniową
odpowiedź dla D alaniny w zakresie stężeń 10-250 mol/l. Czas życia bioczujnika
wynosił 10 dni.
70
60
I [nA]
50
40
30
20
10
0
-10 0
y = 0,246x + 2,3165
R2 = 0,9944
DAlanine
LAlanine
y = -0,0027x + 0,5636
R2 = 0,5237
50
100
150
200
250
300
Stężenie D- lub L-alaniny
[mol/l]
Porównanie odpowiedzi elektrody wobec enancjomerów D i L alaniny. Pomiary w
buforze fosforanowym 0,05 mol/l z dodatkiem KCl 0,1 mol/l i FAD 10 mol/l.