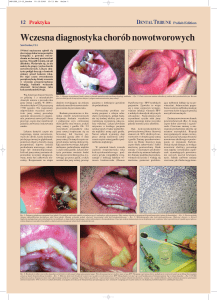
Prace poglądowe
Dent. Med. Probl. 2012, 49, 1, 69–77
ISSN 1644-387X
© Copyright by Wroclaw Medical University
and Polish Dental Society
Beata Petkowicz, Izabela Jastrzębska, Rafał Jamrogiewicz
Zapalenie błony śluzowej jamy ustnej
jako powikłanie w chemioterapii nowotworów
Oral Mucositis as Neoplasm Chemotherapy Complication
Samodzielna Pracownia Medycyny Jamy Ustnej, Uniwersytet Medyczny w Lublinie
Streszczenie
W ostatniej dekadzie liczba pacjentów dotkniętych chorobą nowotworową stale wzrasta. Ocenia się, że nawet co
drugi leczony chemioterapią cierpi z powodu powikłań dających objawy w jamie ustnej. Zmiany te w znacznym
stopniu obniżają komfort życia, mogą prowadzić do groźnych zakażeń ogólnoustrojowych oraz wydłużać czas
i koszt leczenia. Patogeneza powikłań stomatologicznych u pacjentów onkologicznych jest związana z toksycznością chemioterapeutyków. Stosowanie tych specyficznych preparatów skutkuje rozwojem neutropenii, zmniejszeniem sekrecji śliny, a także szczególnie silnym działaniem na komórki ulegające podziałom. Z tych względów
tkanki miękkie jamy ustnej są w sposób szczególny narażone na toksyczne działanie chemioterapeutyków. Objawy
stomatologiczne pojawiające się podczas chemioterapii nie powinny być bagatelizowane, gdyż mogą być przyczyną poważnych powikłań, takich jak bakteriemie, nadkażenia grzybicze lub wirusowe. Bardzo istotna jest efektywna współpraca lekarza onkologa ze stomatologiem. Odpowiednia profilaktyka, przygotowanie stomatologiczne
pacjenta oraz wczesne wykrycie zmian rozwijających się w jamie ustnej mogą w znacznym stopniu ograniczyć
występowanie ciężkich powikłań stomatologicznych podczas chemioterapii. W pracy przedstawiono zagadnienia
z zakresu epidemiologii, patogenezy, przebiegu, a także profilaktyki i leczenia zapaleń błony śluzowej jamy ustnej
będących konsekwencją terapii nowotworów (Dent. Med. Probl. 2012, 49, 1, 69–77).
Słowa kluczowe: zapalenie błony śluzowej jamy ustnej, chemioterapia, nowotwór, powikłania, leczenie.
Abstract
According to many researchers in last ten years amount of patients with neoplasms significantly increased. It is
estimated that even one out of two asked patients, complains about stomatological complications during antineoplastic treatment. Oral changes significantly decreases quality of life, lead to potentially serious systemic infectious
complications and extends time and cost of care. The pathogenesis of this debilitating side effect can be attributed
to the direct mucosal toxicity of cytotoxic agents which cause neutropenia, reduced saliva volume and direct influence on dividing cells. Dental symptoms which appear during chemotherapy should not be underestimated, as
they may lead to serious complications such as bacteremia or fungal or viral superinfection. Cooperation between
oncologist and dentist is essential. The appropriate prophylactics, proper stomatological preparation of patient as
well as early recognition of developing pathoses in considerable degree can reduce occurrence of severe stomatological complications during chemotherapy. This article applies to issues of epidemiology, pathogenesis, course,
prevention and treatment of oral mucositis that is a consequence of neoplasm therapy (Dent. Med. Probl. 2012,
49, 1, 69–77).
Key words: oral mucositis, chemotherapy, neoplasm, complications, treatment.
Chemioterapia onkologiczna jest leczeniem
obciążającym organizm pacjenta. Z postępowaniem tym wiąże się występowanie licznych powikłań ogólnoustrojowych i miejscowych, w tym
odczynów zapalnych różnego pochodzenia. Wiele patologicznych objawów pojawia się w jamie
ustnej. Powikłania powstają w wyniku skumulo-
wania efektu cytotoksycznego terapii przeciwnowotworowej, rozwijającego upośledzenia układu
odpornościowego oraz zmniejszenia wydzielania
śliny. Zmiany w układzie stomatognatycznym potrafią w istotny sposób pogorszyć komfort życia,
a nawet doprowadzić do stanów będących poważnym zagrożeniem dla zdrowia pacjenta. Należy
70
B. Petkowicz, I. Jastrzębska, R. Jamrogiewicz
podkreślić, iż powikłania stanów zapalnych u chorych leczonych chemioterapią są znacznie bardziej
nasilone niż u osób zdrowych, dlatego wymagają
szybszego i bardziej efektywnego leczenia. Wczesne wykrycie i monitorowanie zmian patologicznych w jamie ustnej umożliwia zahamowanie progresji rozwijającej się choroby i uniknięcie groźnych infekcji ogólnoustrojowych.
Epidemiologia zapalenia
błony śluzowej jamy
ustnej indukowanego
chemioterapią
Zapalenie błony śluzowej jamy ustnej – oral
mucositis (OM) charakteryzuje się występowaniem rumieni, obrzęków błony śluzowej, nadżerek i owrzodzeń mogących prowadzić do wtórnej
infekcji. Objawy kliniczne mogą się różnić m.in.
w zależności od przyjmowanego leczenia przeciwnowotworowego. W 2008 r. w Oncology Nursing
Society Research Priorities OM umieszczono na
20. pozycji w kolejności objawów ubocznych pojawiających się podczas chemioterapii [1].
Dane dotyczące częstości występowania OM
u pacjentów onkologicznych leczonych chemioterapeutykami ze względu na różne definiowanie
samego pojęcia mogą się różnić w poszczególnych
opracowaniach. OM występuje u 20–75% chorych
leczonych onkologicznie z zastosowaniem chemioterapii. Najczęściej dotyka pacjentów przechodzących intensywną chemioterapię przed przeszczepem komórek hematopoetycznych [2]. Wiele
czynników wpływa na wystąpienie OM: częstość
oraz rodzaj podawanego chemioterapeutyku, płeć,
wiek, rasa, świadomość zdrowotna pacjenta, stan
ogólny chorego [3]. Wyniki badań nad czynnikami ryzyka nie są jednoznaczne, sugerują jednak,
iż kobiety częściej niż mężczyźni przechodzą stany zapalne jamy ustnej. Na wystąpienie OM bardziej narażone są osoby po 50. r.ż. i dzieci [4].
Osoby starsze częściej cierpią na OM ze względu na zmniejszoną efektywność procesów regeneracyjnych i odpornościowych, dzieci ze względu
na większą szybkość podziału komórek warstwy
podstawnej nabłonka. Środkami farmakologicznymi powodującymi najczęstszą obecność zmian
w jamie ustnej są: doksorubicyna, bleomycyna,
fluorouracyl, cisplatyna, vinblastyna, metotreksat
(tab. 1) [5]. Leki działające w sposób swoisty na fazę S cyklu komórkowego (np. metotreksat, 5-fluorouracyl, cytarabina) wykazują zwiększoną toksyczność dla tkanek miękkich jamy ustnej. Chemioterapeutyki działające w sposób nieswoisty wywołują mniej objawów ubocznych pochodzących
z układu stomatognatycznego [6]. Należy również
podkreślić, że w ocenie toksyczności istotny jest
nie tylko rodzaj chemioterapeutyku, ale również
jego dawka. Chemioterapeutyki podawane w małych dawkach prowadzą do znacznie mniejszej
liczby powikłań, zarówno miejscowych jak i ogólnoustrojowych.
Tabela 1. Chemioterapeutyki stwarzające duże ryzyko
wystąpienia zapalenia błony śluzowej jamy ustnej
Table 1. Chemotherapeutic agents presenting a high risk
of inflammation of oral mucosa
Grupa
(Group)
Rodzaj cytostatyku
(Type of cytostatic agent)
Antymitotyki
cisplatyna
Antymetabolity
metotreksat
5-fluorouracyl
cytarabina
merkaptopuryna
Antybiotyki
doksorubicyna
bleomycyna
Alkaloidy roślinne
vinblastyna
Taksany
paclitaksel
Epipodofilotoksyny
etopozyd
Chorzy z małą aktywnością procesu próchnicowego i wysokim poziomem higieny jamy ustnej mają mniejszą skłonność do rozwoju OM. Pacjenci w tym samym wieku, płci, z takim samym
rodzajem nowotworu i schematem chemioterapii
oraz poziomem higieny wykazują jednak różnice
w dynamice rozwoju OM. To może wskazywać na
genetyczną skłonność lub też oporność na rozwój
zmian zapalnych w jamie ustnej. Należy zauważyć, że 20% osób leczonych chemioterapeutykami
przechodzi tak intensywne zapalenie błony śluzowej jamy ustnej, iż zachodzi konieczność zmniejszenia dawki leku, a ból związany ze stanem zapalnym jamy ustnej może być podstawą do zastosowania leków należących do drabiny analgetycznej,
łącznie z opioidami [7]. Owrzodzenia związane
z wystąpieniem OM zwiększają także ryzyko bakteriemii paciorkowcowej, a nawet posocznicy. Według Bergmanna [8] jedna trzecia notowanych
przypadków u pacjentów z obniżoną odpornością
rozpoczyna się zakażeniem w jamie ustnej.
Przebieg zapalenia
jamy ustnej
W przebiegu zapalenia jamy ustnej (mucositis) można wyróżnić 4 fazy: zapalną (naczyniową),
nabłonkową, bakteryjną (nadżerkową) oraz fazę
gojenia (tab. 2) [2]. Fazy zapalna oraz nabłonkowa nie są związane z użyciem określonego rodzaju
Zapalenie błony śluzowej jamy ustnej jako powikłanie w chemioterapii nowotworów
Tabela 2. Przebieg OM (oral mucositis)
Table 2. OM (oral mucositis) development
Faza oral mucositis
(Oral mucositis
phase)
Objawy kliniczne i histologiczne
(Clinical and histological manifestation)
Faza zapalna
reakcja zapalna
ścieńczenie nabłonka
zaburzenia regeneracji komórek
podstawnych
zmiany zanikowe
podbiegnięcia krwawe
Faza nabłonkowa
obumarcie komórek warstwy podstawnej
ubytki nabłonka
Faza bakteryjna
(nadżerkowa)
nadżerki
owrzodzenia
Faza gojenia
odbudowa struktury nabłonkowej
chemioterapii. Terapia przeciwnowotworowa upośledza mechanizmy obronne jamy ustnej, zarówno fizycznie (bezpośredni wpływ na błonę śluzową) jak i immunologicznie (np. wynik neutropenii). Chemioterapeutyki mają znaczący wpływ na
wydzielanie interleukiny-1 (IL-1) oraz czynnika
martwicy nowotworu (TNF-α). Interleukina-1 powoduje zainicjowanie procesu zapalnego. Zachodzą zmiany w strukturze flory bakteryjnej jamy
ustnej, a nawet mogą pojawiać się bakterie typowe
dla innych odcinków układu pokarmowego, takie
jak E. coli czy P. aeruginosa [10]. Zwiększa się ilość
bakterii Gram (–), które są w głównej mierze odpowiedzialne za rozwój mucositis. Bakterie uwalniają endotoksyny (LPS – lipopolisacharydy), które oddziałują na makrofagi, prowokując je do wydzielania cytokin prozapalnych (TNF-α, IL-1 oraz
IL-6). Proces ten prowadzi to uszkodzenia komórek i zainicjowania lub zaostrzenia choroby [9].
W wyniku aktywności fazy zapalnej zwiększa
się przepuszczalność nabłonka naczyń krwionośnych, prowadząc do zwiększenia stężenia chemioterapeutyku w tkankach. Zaburzona zostaje gospodarka glutaminy jako źródła energetycznego
dla komórek nabłonkowych, co powoduje wystąpienie zmian w ich budowie oraz metabolizmie
komórkowym. W pierwszej fazie mucositis, poza
zmianami zapalnymi, dochodzi również do ścieńczenia nabłonka oraz zaburzenia regeneracji komórek podstawnych. W wyniku tych procesów
rozwijają się zmiany zanikowe oraz podbiegnięcia krwawe. W fazie nabłonkowej obumierają komórki warstwy podstawnej. W następstwie zaburzenia procesów regeneracyjnych powstają ubytki w strukturze nabłonka o charakterze nadżerek
i/lub owrzodzeń. Zmiany te pojawiają się ok. 7.
71
dnia od podania danego kursu chemioterapii. Czas
ten pokrywa się również z początkiem rozwoju
neutropenii, która osiąga swoje maksimum ok. 14.
dnia cyklu. Na skutek zaburzenia odporności organizmu, zmniejszenia wydzielania śliny oraz zaburzenia funkcji obronnej nabłonka flora fizjologiczna staje się patogenna i stanowi zagrożenie dla
zdrowia pacjenta. Między 7. a 14. dniem od podania chemioterapeutyku pacjent jest w największym stopniu narażony na infekcje ogólnoustrojowe, a dolegliwości w jamie ustnej są nasilone najbardziej. W fazie gojenia następuje odtworzenie
efektywności działania układu odpornościowego
oraz odbudowa struktury tkanki nabłonkowej [6].
OM może się również rozprzestrzenić na błonę
śluzową całego przewodu pokarmowego, prowadząc do ciężkich powikłań, takich jak np. owrzodzenie błony śluzowej żołądka [11].
Wrażliwość tkanek miękkich
jamy ustnej
Tkanki miękkie jamy ustnej, które nie ulegają rogowaceniu oraz te, których komórki szybko się dzielą są w większym stopniu uszkadzane
przez chemioterapię. Według Woo et al. [2] 95,7%
zmienionych obszarów jamy ustnej, stanowią te
pozbawione warstwy rogowaciejącej. Dodatkowym czynnikiem sprzyjającym rozwojowi zmian
patologicznych w tkankach miękkich podczas
trwania chemioterapii jest indukcja apoptozy komórek progenitorowych, która skutkuje zmniejszeniem regeneracji oraz ścieńczeniem nabłonka.
Z powodu wyżej wymienionych czynników zmiany zapalne najczęściej pojawiają się w obrębie błony śluzowej policzków, dziąseł, warg oraz dolnej
powierzchni języka. Zauważono bezpośrednią zależność między kinetyką rozwoju zapalenia jamy
ustnej a obrotem metabolicznym komórek warstwy podstawnej nabłonka (turnover ok. 10 dni).
Nabłonek z wolniejszym obrotem metabolicznym
jest mniej podatny na działanie chemioterapeutyków.
Powstało wiele skal szeregujących toksyczność
chemioterapeutyków. Powszechnie jest stosowana
skala wg Światowej Organizacji Zdrowia. Umożliwia ona ewaluację wpływu chemioterapii na cały
organizm, w tym na stan błony śluzowej jamy ustnej. Nasilenie toksyczności danego leku jest stopniowane w skali od 0 do 4, gdzie stopień czwarty oznacza nasilenie stanu zapalnego uniemożliwiające przyjmowanie pokarmów [12]. Stosowanie
ujednoliconej skali do określenia toksycznego
wpływu chemioterapeutyku na organizm pozwala na obiektywne porównanie nasilenia powikłań
pojawiających się podczas terapii określonymi cy-
72
B. Petkowicz, I. Jastrzębska, R. Jamrogiewicz
tostatykami oraz zastosowanie schematów leczenia odpowiednich dla danego stopnia nasilenia
objawów patologicznych.
Zakażenia bakteryjne,
wirusowe i grzybicze
W fazie nadżerkowej, gdy nastąpi przerwanie
ciągłości tkanek, drobnoustroje wnikają w głąb organizmu. Toksyny bakteryjne stymulują komórki
prozapalne, prowadząc do zaostrzenia procesów
patologicznych. W przypadku upośledzenia procesów obronnych gospodarza bakterie mogą zajmować tkankę podśluzową i penetrować do naczyń krwionośnych, co prowadzi do bakteriemii,
a nawet posocznicy [13]. Szczególnie podatni na
zakażenia bakteryjne są pacjenci z neutropenią.
Granulocyty obojętnochłonne, m.in. ze względu
na swoją zdolność do fagocytozy stanowią główną
linię obrony przeciwko bakteriom [14]. Pacjenci
z ciężką lub też przedłużającą się powyżej 10 dni
neutropenią są szczególnie narażeni na ciężkie
zakażenia bakteryjne, dlatego też już przy pierwszych objawach zakażenia powinna być stosowana antybiotykoterapia. Szczególnie niebezpieczne są zakażenia bakteriami Gram (–), gdyż mogą
wywołać wstrząs septyczny i prowadzić do szybkiego zgonu. Badania przeprowadzone przez Gassas et al. [15] na grupie 79 dzieci przygotowywanych do przeszczepu komórek macierzystych lub
leczonych chemioterapią z powodu nowotworu
złośliwego wykazały, iż każdy z pacjentów przynajmniej raz przeszedł bakteriemię. W ok. 18%
przypadków wystąpił zespół paciorkowcowego
wstrząsu toksycznego, 2 pacjentów nie przeżyło
zakażenia.
Poważnym problemem klinicznym i terapeutycznym u pacjentów leczonych onkologicznie są zakażenia wirusowe, występujące zwłaszcza w okresach obniżenia odporności organizmu.
Badania wykazały, że co najmniej 31% dorosłych
pacjentów poddanych przeszczepowi komórek
krwiotwórczych i 18% chorych na białaczkę było hospitalizowanych z powodu ostrych chorób
układu oddechowego w wyniku zakażeń wirusowych [16]. Szczególnie częste są zakażenia u pacjentów cierpiących na nowotwory krwi, u których trzeba wykonać przeszczep komórek krwiotwórczych. U tych pacjentów częstość reaktywacji
wirusa opryszczki zwykłej (HSV1) wynosi od 65
do 95% [17]. Powstające w wyniku reaktywacji wirusa nadżerki są bardzo bolesne i uciążliwe, a ponadto mogą stanowić wrota zakażenia dla patogennych drobnoustrojów.
Innym powikłaniem w chemioterapii nowotworów są zakażenia grzybicze jamy ustnej, któ-
re występują u ok. 85% pacjentów leczonych onkologicznie z zastosowaniem chemioterapii [4].
Mechanizm rozwoju zakażenia jest złożony, a jego istotnym czynnikiem jest interakcja i kooperacja między Candida i bakteriami bytującymi w jamie ustnej. Autorzy Hsu et al. [18] zbadali, że niektóre szczepy bakteryjne koagregują z C. albicans,
ponadto mają ligandy ułatwiające adhezję drożdży do komórek nabłonka. Najczęstsza koagregacja następowała z Streptococcus sanguis. Ilość
C. albicans w jamie ustnej zależy od dynamicznej
interakcji z limfocytami T CD4, co jest szczególnie
istotne u pacjentów z obniżoną odpornością [19].
Zaburzenia
w wydzielaniu śliny
Chemioterapia prowadzi do zmian jakościowych i ilościowych śliny. W odniesieniu do osób
zdrowych obniżone jest pH oraz zdolność buforowa śliny, zmniejsza się efektywność działania i stężenie immunoglobulin (sIgA, IgG) laktoperoksydazy, lizozymu oraz laktoferrytyny [20].
Zmniejsza się stężenie jonów fluorkowych oraz
fosforanowych. Zaburzone są procesy remineralizacji, jest ułatwiona adhezja bakterii do powierzchni twardych tkanek zębów. Pacjenci poddawani chemioterapii zgłaszają wzmożone czucie
smaku słonego i gorzkiego. Suchość jamy ustnej
(kserostomia) w znacznym stopniu obniża komfort życia pacjentów poddawanych chemioterapii.
Brak śliny sprawia, iż łatwiej dochodzi do uszkodzeń mechanicznych błony śluzowej. Powstają bolesne zmiany zapalne jamy ustnej utrudniające pobieranie pokarmów, co może prowadzić do zaburzeń gospodarki mineralnej, awitaminozy, utraty
wagi [3]. Zmniejszone wydzielanie śliny wiąże się
również z utrudnieniem procesu mówienia oraz
koniecznością częstszego uzupełniania płynów.
Aspekty psychiczne związane
z oral mucositis
Jednym z powikłań po chemioterapii jest ból
w jamie ustnej, który utrudnia mówienie, spożywanie pokarmów, na skutek czego ma wpływ na
stan psychiczny pacjenta. Chorzy zgłaszają kłopoty ze snem, pojawiają się zaburzenia nastroju, stany
depresyjne, złość [21]. Badania wykazały związek
między zwiększonym wydzielaniem cytokin prozapalnych a wahaniami nastrojów, a także udział
w etiologii anoreksji, kacheksji, anemii [22].
Zapalenie błony śluzowej jamy ustnej jako powikłanie w chemioterapii nowotworów
Profilaktyka oral mucositis
Skuteczna profilaktyka OM zależy od zespołu
terapeutycznego, w skład którego powinien wejść
lekarz stomatolog. Zadaniem jego jest udzielenie odpowiednich wskazówek dotyczących zmiany przyzwyczajeń dietetycznych (m.in. unikania
potraw drażniących, zawierających znaczne ilości cukrów prostych), przeprowadzenie instruktażu higieny, poinformowanie o środkach do płukania jamy ustnej, substytutach śliny oraz lekach
przeciwzapalnych, które można stosować miejscowo. Warto zaznaczyć, że leczenie stomatologiczne powinno być rozpoczęte jak najszybciej,
gdyż czas między zdiagnozowaniem nowotworu a wdrożeniem terapii onkologicznej jest krótki. Instruktaż higieny jamy ustnej pacjenta powinien obejmować kontrolę dotychczasowych nawyków higienicznych, wykaz popełnianych błędów
oraz element motywujący i aktywizujący pacjenta. Szczególnie istotne w instruktażu jest wyeliminowanie błędów w technice szczotkowania zębów. Powszechne wśród pacjentów „szorowanie”
powierzchni przedsionkowych może doprowadzić do urazu tkanek przyzębia oraz uszkodzenia
twardych tkanek zęba. Metoda szorowania może
być stosowana wyłącznie przy oczyszczaniu powierzchni żujących. Pacjenci do oczyszczania powierzchni przedsionkowych i językowych zębów
powinni stosować techniki okrężne lub wibracyjne. Godna polecenia z uwagi na swoją skuteczność, bezpieczeństwo i prostotę w wykonaniu jest
metoda roll (wymiatania). Pacjenci ze stanem zapalnym przyzębia mogą dodatkowo stosować metodę Bassa, która efektywnie oczyszcza kieszonki
zębowe. Należy poinstruować chorego, iż przynajmniej 2 razy dziennie, a najkorzystniej po każdym
posiłku należy myć zęby i płukać jamę ustną. Pacjenci powinni używać szczoteczek o włosiu średnim (średnica włosia 0,20–0,25 mm) lub miękkim
(średnica włosia 0,15–0,20 mm). Istotnym jest poinformowanie pacjenta o konieczności wymiany
szczoteczki na nową co 2–3 miesiące. Do oczyszczania przestrzeni międzyzębowych służą szczoteczki międzyzębowe lub nici stomatologiczne.
Miejsca trudno dostępne mogą zostać oczyszczone za pomocą szczoteczek jednopęczkowych. Korzystne jest wykorzystywanie dodatkowych przyborów higienicznych, takich jak np. irygatory.
Badania przeprowadzone przez Chenga et al. [23] wykazały, że utrzymywanie wysokiego poziomu higieny jamy ustnej połączone ze stosowaniem 0,2% roztworu chlorheksydyny pozwala na
zmniejszenie o 38% liczby przypadków OM u pacjentów leczonych chemioterapią. W czasie poprzedzającym terapię onkologiczną należy wyleczyć wszelkie zmiany próchnicowe. Zęby nie ro-
73
kujące należy usunąć nie później niż 10 dni przed
rozpoczęciem chemioterapii, a optymalny czas
między ekstrakcją a rozpoczęciem chemioterapii
wynosi ok. 3 tygodnie [24]. Pacjent powinien zostać poddany konsultacji protetycznej, a potencjalne leczenie ortodontyczne należy przerwać na czas
leczenia onkologicznego. Leczenie ortodontyczne
może zostać wznowione co najmniej rok po zakończeniu terapii przeciwnowotworowej [25]. Jeżeli podczas badania stomatologicznego zostanie
stwierdzona choroba dziąseł lub przyzębia, należy
jak najszybciej wdrożyć mechanoterapię wspomaganą płukankami zawierającymi chlorheksydynę.
Interesującym programem do profilaktyki OM
jest PSMA (Pro-Self: Mouth Care Aware) opisany
przez Larsona et al. [21]. Program PSMA składa
się z 3 części: informacji dotyczących utrzymywania prawidłowej higieny jamy ustnej, rozwoju
własnych umiejętności oraz kontroli i wsparcia
osoby sprawującej nadzór (lekarza, pielęgniarki
lub higienistki). Założeniem programu jest poprawa higieny jamy ustnej pacjenta, czego wynikiem
jest zmniejszenie częstości występowania oraz intensywności powikłań chemioterapii występujących w obrębie układu stomatognatycznego.
Dobre wyniki w prewencji OM można również otrzymać, stosując „terapię zimnem”. Miejscowe schładzanie śluzówki skutkuje obkurczeniem powierzchownych naczyń krwionośnych, co
prowadzi do zmniejszonego przepływu krwi przez
tkankę nabłonkową. Zmniejszone ukrwienie błony śluzowej powoduje mniejszą ekspozycję tkanek
miękkich na cytotoksyczne działanie chemioterapeutyków. Badania Sorensena et al. [26] sugerują,
iż stosowanie krioterapii jest skuteczne w ograniczaniu występowania oraz intensywności patologicznych zmian nabłonka.
Negatywne skutki związane z chemioterapią
są dla organizmu pacjenta dużym obciążeniem
i często przed wdrożeniem postępowania leczniczego należy podjąć specjalne środki ostrożności,
stosując profilaktyczną antybiotykoterapię z uzupełnieniem niedoboru trombocytów.
Leczenie oral mucositis
Zmiany pojawiające się w jamie ustnej podczas chemioterapii są przeważnie leczone miejscowo. El-Housseing et al. [27] wykazali, że stosowanie 100 mg witaminy E działa korzystnie na błonę śluzową i zmniejsza intensywność OM. Istnieje
wiele wątpliwości co do skuteczności profilaktycznego stosowania płukanek jamy ustnej [25]. Badania nad chlorheksydyną oraz innymi środkami
przeciwbakteryjnymi stosowanymi prewencyjnie
u pacjentów leczonych onkologicznie nie potwier-
74
B. Petkowicz, I. Jastrzębska, R. Jamrogiewicz
dzają jednoznacznie ich skutecznego działania.
Klinicznie jest przydatna benzydamina, pochodna
indazolu o działaniu przeciwobrzękowym, przeciwbólowym, przeciwzapalnym, miejscowo znieczulającym, przeciwbakteryjnym oraz przeciwgrzybicznym. Badania Kim et al. [28] wykazali, że
pacjenci leczeni chlorowodorkiem benzydaminy
zgłaszają zmniejszenie objawów związanych z patologicznymi zmianami rozwijającymi się w jamie
ustnej. Obiecujące są badania prowadzone nad zastosowaniem immunoglobulin. Autorzy Plevovaa
oraz Blazeek [29] opisali przypadki podania dożylnego immunoglobulin (w ilości 0,2 g/kg m.c.)
u pacjentów przyjmujących chemioterapię, czego wynikiem było znaczne zmniejszenie nasilenia
objawów OM.
Ze względu na częste nadkażenia grzybicze
oraz bakteryjne u pacjentów z obniżoną odpornością wiele badań zostało poświęconych skuteczności działania antybiotyków przeciwgrzybiczych
i przeciwbakteryjnych (tab. 3). Köstler et al. [5]
stwierdzili, iż miejscowe stosowanie antybiotyków polienowych (np. nystatyny) nie daje pożądanych rezultatów. Bardziej skuteczniejsze w działaniu okazały się leki imidazolowe (np. ketokonazol) stosowane miejscowo lub systemowo. Badania
Groll et al. [30] wskazują na porównywalnie wysoką skuteczność antybiotyków polienowych i flukonazolu w profilaktyce przeciwgrzybiczej. Spijkervet et al. [31] wykazali, że zastosowanie pastylek do ssania zawierających w swoim składzie
2 mg polimyksyny E, 1,8 mg tobramycyny i 10 mg
amfoterycyny B prowadzi do znaczącej eliminacji bakterii Gram (–) oraz drożdżaków z jamy ustnej, co skutkuje istotnym zmniejszeniem częstości
występowania patologicznych zmian w jamie ustnej. Barkvoll et al. [32] sugerują, iż nie należy stosować nystatyny łącznie z chlorheksydyną, gdyż
substancje te zaburzają wzajemnie swoje działanie. Podawanie tych leków należy rozdzielić z odstępem czasowym nie krótszym niż 1 godz. Jeżeli
zakażenie grzybicze wykryto u pacjenta używającego ruchome uzupełnienia protetyczne, to przed
ich wprowadzeniem do jamy ustnej powinny zostać pokryte mikonazolem (Daktarin) [33].
W leczeniu kserostomii działaniem terapeutycznym, łagodzącym jej objawy, jest stymulacja
gruczołów ślinowych za pomocą procesu żucia.
W tym celu stosuje się gumy do żucia zawierająTabela 3. Leki stosowane w zakażeniach grzybiczych
Table 3. Medicines used in fungal infections
Nystatyna
1 000 000 jednostek/ml, 5 ml, 4 × dziennie
Mikonazol
25 mg/ml, 5 ml, 4 × dziennie
Flukonazol
10 mg/ml, do 4 × dziennie
ce substytuty cukru. W czasie snu można używać
tłuszcz dietetyczny, który służy jako lubrykant
ochraniający błonę śluzową warg oraz języka,
a w czasie dnia są wskazane środki do płukania ust
o charakterze neutralnym lub słabo alkalizujące
(np. woda, bikarbonat sodu), pozbawione kwasów
bądź cukrów [34]. Pozytywne wyniki w leczeniu
suchości jamy ustnej można uzyskać, stosując substytuty śliny. Pacjenci posiadający własne uzębienie mogą używać płukanek, zawierających fluor,
który działa remineralizująco na szkliwo (np. Saliva Orthana) [35]. Środki, takie jak Glandosan
czy Salivix są polecane dla pacjentów bezzębnych,
gdyż zawierają kwasy, które mogą powodować
uszkodzenie twardych tkanek zębów oraz wystąpienie zwiększonej wrażliwości zębiny. Ze względu na wiele objawów ubocznych powodowanych
przez alkaloidy imidazolowe, np. pilokarpinę, należy rozważyć ich stosowanie [36].
W przebiegu OM istotnym problemem jest ból,
w leczeniu którego są stosowane środki miejscowo znieczulające, takie jak lidokaina czy ksylokaina [5]. Warto pamiętać, iż czas działania środków
znieczulających jest stosunkowo krótki, a ubocznym skutkiem działania są zaburzenia w percepcji
smaków. Z tych względów leki te nie powinny być
stosowane w profilaktyce OM, a jedynie w zwalczaniu silnych objawów bólowych towarzyszących
zapaleniu.
Obecnie prowadzi się badania nad możliwością miejscowego stosowania czynników wzrostu
w leczeniu OM. Szczególnie obiecujące są próby
dotyczące wykorzystania czynnika wzrostu keratynocytów (KGF). Badania przedkliniczne wykazały pozytywny wpływ KGF na proliferację
oraz zmniejszenie apoptozy komórek nabłonkowych. Palifermina, będąca czynnikiem wzrostu
o budowie przypominającej KGF, stymuluje rozwój komórek nabłonkowych. Palifermina wykazała ochronne działanie na śluzówki podczas
badań przeprowadzonych na zwierzętach poddanych radio- oraz chemioterapii [37]. Badania
przeprowadzone na ludziach wykazały, iż palifermina w istotny sposób zmniejszała częstość występowania ciężkiego OM u pacjentów poddanych
chemioterapii [38]. Preparaty zawierające paliferminę są stosowane w celu ograniczenia występowania oraz zmniejszenia nasilenia zapaleń błony
śluzowej jamy ustnej u pacjentów poddawanych
leczeniu mieloablacyjnemu. Palifermina jest podawana dożylnie w 6 dawkach – 3 dawki są podawane przed leczeniem mieloablacyjnym, kolejne
3 dawki przynajmniej po 4 dniach przerwy. Do
najważniejszych działań ubocznych leczenia tym
preparatem należą zaburzenia smaku, pogrubienie oraz przebarwienie śluzówki jamy ustnej oraz
uczulenia.
Zapalenie błony śluzowej jamy ustnej jako powikłanie w chemioterapii nowotworów
Prowadzi się również badania nad ochronnym
działaniem czynnika stymulującego tworzenie kolonii granulocytów i makrofagów (GM-CSF). Gordonet et al. [39] wykazali, że stosowanie GM-CSF
u pacjentów poddawany chemioterapii może skracać czas trwania OM. Nie wykazano jednak wpływu tego czynnika wzrostu na zmniejszenie ciężkości zapalenia błony śluzowej.
Należy podkreślić, iż czynniki wzrostu są podawane ogólnoustrojowo, ponieważ nie zaleca się
ich stosowania w terapii miejscowej. Istnieje jednak obawa, że czynniki te mogą w niektórych
przypadkach wzmagać aktywność podziałową komórek nowotworowych należących do krwiotwórczej linii mieloidalnej. Obawa ta wyzwala konieczność dalszych wnikliwych badań, które definitywnie wykluczyłyby taką możliwość [40].
Po zakończeniu chemioterapii należy regularnie monitorować stan zdrowia jamy ustnej pacjenta, ponieważ, jak wykazują badania, leczenie
to może powodować zaburzenia w formowaniu
tkanek zęba [41]. Z tego powodu należy dokładnie
obserwować proces wyrzynania się zębów u dzieci, a w razie ujawnienia się zaburzeń podejmować
wielospecjalistyczne leczenie stomatologiczne. Po
zakończeniu chemioterapii powraca zmysł smaku, choć zwykle pozostaje przez pewien czas zaburzony. Pacjenci znajdują ulgę w spożywaniu pokarmów o dużej zawartości cukru, co sprzyja rozwojowi próchnicy.
75
Podsumowanie
Powikłania występujące w jamie ustnej u pacjentów leczonych onkologicznie w związku z chemioterapią mają znaczący wpływ na ich stan ogólny i nie powinny być bagatelizowane. Pacjenci
powinni być przygotowywani przez lekarza stomatologa przed rozpoczęciem terapii przeciwnowotworowej i regularnie poddawani wizytom
kontrolnym. Niezwykle istotne jest pogłębianie
świadomości pacjentów leczonych onkologicznie,
informowanie ich o ewentualnych powikłaniach
chemioterapii objawiających się zmianami w jamie ustnej oraz sposobach stosowania odpowiedniej profilaktyki. Leczenie w pełni rozwiniętego
mucositis, rozległych zmian próchnicowych i zapaleń okołowierzchołkowych jest trudne i kosztowne. Obliczono, że pobyt pacjentów z obniżoną
odpornością powodowaną np. przeszczepem szpiku, cierpiących równocześnie na OM, jest średnio
dłuższy o 5 dni niż pacjentów, którzy nie przechodzą OM [24]. Wydłużony czas hospitalizacji jest
dodatkowym kosztem oraz niepotrzebnym stresem dla pacjenta. W świetle powyższych stwierdzeń za zasadne należy uznać włączanie lekarza
stomatologa do zespołu specjalistów zajmujących
się pacjentem leczonym onkologicznie.
Piśmiennictwo
[1]Doorenbos A.Z., Berger A.M., Brohard-Holbert C., Eaton L., Kozachlik S., LoBiondo-Wood G.,
Mallory G., Rue T., Varricchio C.: ONS research priorities survey. Oncol. Nurs. Forum 2008, 35, 100–107.
[2]Woo S.B., Somis S.T., Monopoli M., Sonis A.: A longitudinal study of oral ulcerative mucositis in bone marrow
trans plant recipients. Cancer 1993, 72, 1612–1617.
[3] Brown C.G., McGuire D.B., Peterson D.E., Beck S.L., Dudley W.N., Mooney K.H.: The experience of a sore
mouth and associated symptoms in patients with cancer receiving outpatient chemotherapy. Cancer Nurs. 2009,
32, 259–270.
[4] Barasch A., Peterson D.E.: Risk factors for ulcerative oral mucositis in cancer patients: unanswered questions.
Oral Oncol. 2003, 39, 91–100.
[5] Köstler W.J., Hejna M., Wenzel C., Zielinski C.C.: Oral mucositis complicating chemotherapy and/or radiotherapy: options for prevention and treatment. CA Cancer J. Clin. 2001, 51, 290–315.
[6] Sonis S.T.: Mucositis as a biological process: a new hypothesis for the development of chemotherapy-induced stomatotoxicity. Oral Oncol. 1998, 34, 39–43.
[7] National Cancer Institute: Oral complications of chemotherapy and head and neck radiation. http://www.cancer.
gov/cancertopics/pdq/supportivecare/oralcomplications/healthprofessional. Updated 2008.
[8] Bergmann O.J.: Oral infection and septicemia in immunocompromised patients with hematologic malignancies.
J. Med. Microbiol. 1988, 26, 2105–2109.
[9]Donnelly J.P., Bellm L.A., Epstein J.B., Sonis S.T., Symonds R.P.: Antimicrobial therapy to prevent or treat oral
mucositis. Lancet Infect. Dis. 2003, 3, 405–412.
[10]Galili D., Donitza A., Garfunkel A., Sela M.N.: Gram-negative enteric bacteria in the oral cavity of leukemia
patients. Oral Surg. Oral Med. Oral Pathol. 1992, 74, 459–462.
[11] Keefe D.M., Gibson R.R., Hauer-Jensen M.: Gastrointestinal mucositis. Semin. Oncol. Nurs. 2004, 20, 38–47.
[12] Brundage M.D., Pater J.L., Zee B.: Assessing the reliability of two toxicity scales: implications for interpreting toxicity data. J. Natl. Cancer Inst. 1993, 21, 1138–1148.
[13] Sonis S.T.: Pathobiology of mucositis. Nat. Rev. Cancer 2004, 4, 277–284.
[14] Menichetti F.: Infectious complications in neutropenic cancer patients. Intern. Emerg. Med. 2010, 5, Suppl 1,
21–25.
76
B. Petkowicz, I. Jastrzębska, R. Jamrogiewicz
[15]Gassas A., Grant R., Richardson S., Dupuis L.L., Doyle J., Allen U., Abla O., Sung L.: Predictors of viridans
streptococcal shock syndrome in bacteremic children with cancer and stem-cell transplant recipients. J. Clin. Oncol. 2004, 22, 1222–1227.
[16] Vento S., Cainelli F., Temesgen Z.: Lung infections after cancer chemotherapy. Lancet Oncol. 2008, 9, 982–992.
[17]Eisen D., Essell J., Broun E.R., Sigmund D., DeVoe M.: Clinical utility of oral valacyclovir compared with oral
acyclovir for the prevention of Herpes simplex virus mucositis following autologous bone marrow transplantation
or stem cell rescue therapy. Bone Marrow Transplantat. 2003, 31, 51–55.
[18] Hsu L.Y., Minah G.E., Peterson D.E., Wingard J.R., Merz W.G., Altomonte V., Tylenda C.A.: Coaggregation of oral Candida isolates with bacteria from bone marrow transplant recipients. J. Clin. Microbiol. 1990, 28,
2621–2626.
[19]Deslauriers N., Coulombe C., Carre B., Goutet J.P.: Topical application of a corticosteroid destabilizes the
host parasite relationship in a experimental model of the oral carrier state of Candida albicans. FEMS Immunol.
Med. Microbiol. 1995, 11, 45–46.
[20]Dens F., Boogaerts M., Boute P., Dederek D., Demuynck H., Vinckier F.: Quantitative determination of immunological components of salivary gland secretion in transplant recipients. Bone Marrow Transplant. 1996, 17,
421–423.
[21]Larson P.J., Miaskowski C., MacPhail L., Dodd M.J., Greenspan D., Dibble S.L., Paul S.M., Ignoffo R.: The
PRO-SELF Mouth Aware program: an effective approach for reducing chemotherapy-induced mucositis. Cancer
Nurs. 1998, 21, 263–268.
[22]Wood L.J., Nail L.M., Gilster A., Winters K.A., Elsea C.R.: Cancer chemotherapy-related symptoms: evidence
to suggest a role for proinflammatory cytokines. Oncol. Nurs. Forum 2006, 33, 535–542.
[23]Cheng K.F., Molassiotis A., Chang A.M., Wai W.C., Cheung S.S.: Evaluation of an oral care protocol intervention in the prevention of chemotherapy-induced oral mucositis in pediatric cancer patients. Eur. J. Cancer 2001,
37, 2056–2063.
[24]Reuscher T.J., Sodei A., Scrivani S.J., Kaban L.B., Sonis S.T.: The impact of mucositis of a-hemolytic streptococcal infections in patients undergoing autologous bone marrow transplantation for hematologic malignancies.
Cancer 1998, 82, 2275–2281.
[25] Sheller B., Williams B.: Orthodontic management of patients with haematological malignancies. Am. J. Orthod.
Dentofac. Orthop. 1996, 109, 575–580.
[26] Sorensen J.B., Skovsgaard T., Damstrup L., Ingeberg S.: Double-blind, placebo-controlled, randomized study
of chlorhexidine prophylaxis for 5-fluorouracil-based chemotherapy-induced oral mucositis with nonblinded randomized comparison to oral cooling (cryotherapy) in gastrointestinal malignancies. Cancer 2008, 112, 1600–1606.
[27]El-Housseiny A.A., Saleh S.M., El-Masry A.A., Allam A.A.: The effectiveness of vitamin E in the treatment of
oral mucositis in children receiving chemotherapy. J. Pediatr. Dent. 2007, 31, 167–172.
[28] Kim J.H., Chu F.C., Lakshmi V., Houde R.: Benzydamine HCl, a new agent for the treatment of radiation mucositis of the oropharynx. J. Can. Dent. Assoc. 1995, 61, 127–134.
[29] Plevovaá P., Blazeěk B.: Intravenous immunoglobulin as prophylaxis of chemotherapy-induced oral mucositis.
J. Natl. Cancer Inst. 1997, 89, 326–327.
[30] Groll A.H., Just-Nuebling G., Kurz M., Mueller C., Nowak-Goettl U., Schwabe D., Shah P.M., Kornhuber B.: Fluconazole versus nystatin in the prevention of candida infections in children and adolescents undergoing remission induction or consolidation chemotherapy for cancer. J. Antimicrob. Chemother. 1997, 40,
855–862.
[31] Spijkervet F.K., Van Saene H.K., Van Saene J.J., Panders A.K., Vermey A., Mehta D.M., Fidler V.: Effect
of selective elimination of the oral flora on mucositis in irradiated head and neck cancer patients. J. Surg. Oncol.
1991, 46, 167–173.
[32] Barkvoll P., Attramadal A.: Effect of nystatin and chlorhexidine digluconate on Candida albicans. Oral Surg.
Oral Med. Oral Pathol. 1989, 67, 279–281.
[33] Pemberton M.N., Sloan P., Ariyaratnam S., Thakker N.S., Thornhill M.H.: Derangement of warfarin nati
coagulation by miconazole oral gel. Br. Dent. J. 1998, 184, 68–69.
[34]Walizer E.M., Ephraim P.M.: Double blind cross-over controlled clinical trial of vegetable oil versus xerolube for
xerostomia. ORL Head Neck Nurs. 1996, 14, 11–12.
[35] Joyston-Bechal S., Kidd E.A.: The effect of three commercially available saliva substitutes on enamel in vitro.
Br. Dent. J. 1987, 163, 187–190.
[36] Johnson J.T., Ferretti G.A., Nethery W.J., Valdez I.H., Fox P.C., Nq D., Muscoplat C.C., Gallagher S.C.:
Oral pilocarpine for post-irradiation xerostomia in patients with head and neck cancer. N. Eng. J. Med. 1993, 329,
390–395.
[37] Barasch A., Epstein J., Tilashalski K.: Palifermin for management of treatment-induced oral mucositis in cancer patients. Biologics 2009, 3, 111–116.
[38] Horsley P., Bauer J.D., Mazkowiack R., Gardner R., Bashford J.: Palifermin improves severe mucositis, swallowing
problems, nutrition impact symptoms, and length of stay in patients undergoing hematopoietic stem cell transplantation. Supp. Care Cancer 2007, 15, 105–109.
[39]Gordon B., Spadinger A., Hodges E., Ruby E., Stanley R., Coccia P.: Effect of granulocyte-macrophage colony-stimulating factor on oral mucositis after hematopoietic stem-cell transplantation. J. Clin. Oncol. 1994, 12,
1917–1922.
Zapalenie błony śluzowej jamy ustnej jako powikłanie w chemioterapii nowotworów
77
[40]Rotolo S., Ceccarelli S., Romano F., Frati L., Marchese C., Angeloni A.: Silencing of keratinocyte growth
factor receptor restores 5-fluorouracil and tamoxifen efficacy on responsive cancer cells. PLoS One 2008, 25, 3,
2528.
[41]Duggal M.S., Curzon M.E., Bailey C.C., Levis I.J., Prendergast M.: Dental parameters in the long term survivors of childhood cancer compared with siblings. Oral Oncol. 1997, 33, 348–353.
Adres do korespondencji:
Beata Petkowicz
Samodzielna Pracownia Medycyny Jamy Ustnej UM
ul. Karmelicka 7
20-081 Lublin
tel.: 81 528 79 16
e-mail: [email protected]
Praca wpłynęła do Redakcji: 22.07.2011 r.
Po recenzji: 16.09.2011 r.
Zaakceptowano do druku: 7.02.2012 r.
Received: 22.07.2011
Revised: 16.09.2011
Accepted: 7.02.2012