strona 1/5
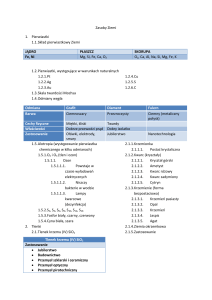
Surowce pochodzenia mineralnego
Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn
Treść podstawy programowej:
Surowce i tworzywa pochodzenia mineralnego: węgiel kamienny, ropa naftowa, gaz ziemny, wapień,
gips, szkło.
Zagadnienia do powtórki
1.
2.
3.
4.
5.
Surowce mineralne
Metale w służbie człowieka
Surowce energetyczne
Sole wapnia wykorzystywane w budownictwie
Wszechobecna krzemionka
Kompendium wiedzy
1. Surowce mineralne
Surowce mineralne to materiały pochodzenia naturalnego, które są wydobywane i przetwarzane
przez człowieka w celach użytkowych.
Gospodarka surowcami mineralnymi to bardzo ważna dziedzina polityki gospodarczej kraju. Powinna być prowadzona w sposób:
• oszczędny ze względu na nieodnawialność surowców mineralnych,
• odpowiedzialny ze względu na konsekwencje wynikające z ujemnych skutków wydobywania bogactw naturalnych.
W stanie wolnym (w postaci pierwiastków chemicznych) w skorupie ziemskiej występują tylko nieliczne metale (złoto, srebro oraz platynowce) i niemetale (siarka, węgiel w postaci grafitu lub diamentu).
Rudy, minerały to związki chemiczne lub ich mieszaniny, które powstały w skorupie ziemskiej i używane są bezpośrednio w życiu codziennym, w przemyśle lub stanowią surowiec do otrzymywania zawartych w nich pierwiastków lub związków chemicznych.
Data utworzenia: 2008-11-30
strona 2/5
2. Metale w służbie człowieka
Właściwości fizyczne metali:
•
•
•
•
•
•
•
•
w temperaturze pokojowej metale są ciałami stałymi (za wyjątkiem rtęci)
najczęściej mają srebrzysto-szarą barwę (z wyjątkiem złota i miedzi, cezu)
są dobrymi przewodnikami prądu i ciepła
posiadają różną twardość (sód jest miękki, a żelazo bardzo twarde),
posiadają charakterystyczny połysk,
są kowalne i ciągliwe (miedź, glin, srebro)
mają różne temperatury topnienia (najniższą rtęć, bardzo wysoką wolfram),
niektóre łatwo reagują z tlenem (metale nieszlachetne), inne są odporne na działanie tlenu i innych czynników (metale szlachetne – złoto, srebro, platyna).
Ze względu na właściwości fizyczne metale są w różnorodny sposób wykorzystywane przez
człowieka np.:
• miedź – do produkcji przewodów elektrycznych ze względu na dobre przewodnictwo elektryczne,
do produkcji rur rozprowadzających wodę ze względu na odporność chemiczną,
• stopy glinu – do wyrobu kabli elektrycznych ze względu na dobre przewodnictwo elektryczne
i dużą ciągliwość,
• rtęć – do wyrobu termometrów, ponieważ ma najniższą temperaturę topnienia i dużą rozszerzalność termiczną oraz do produkcji lamp jarzeniowych,
• wolfram – do produkcji żarówek, bo przewodzi prąd, a równocześnie ma bardzo wysoką temperaturę topnienia.
Metale otrzymywane są między innymi z rud w procesach utleniania i redukcji, np.
utlenianie
2PbO + C = 2Pb + CO2
redukcja
Tlenek ołowiu(II) pełni rolę utleniacza (oddaje tlen), a węgiel rolę reduktora (odbiera tlen).
Bardzo duże znaczenie w gospodarce człowieka mają stopy wykonane z różnorodnych metali.
Data utworzenia: 2008-11-30
strona 3/5
Stopy – to mieszaniny jednorodne otrzymane w wyniku stopienia pierwiastków, posiadają inne właściwości niż składniki, z których są otrzymane. Stopy to: stal (żelazo i węgiel), brąz (cyna i miedź),
mosiądz (cynk i miedź), duraluminium (glin, magnez, krzem, żelazo i mangan).
Korozja – proces chemiczny polegający na niszczeniu metali, przede wszystkim żelaza i jego stopów,
zachodzący pod wpływem czynników atmosferycznych: tlenu, wody, tlenków azotu, tlenku siarki(IV).
Pasywacja – to proces polegający na powstawaniu na powierzchni metalu cienkiej warstwy tlenku,
która chroni metal przed dalszym działaniem czynników atmosferycznych.
Patynowanie – powstawanie cienkiej warstwy patyny, czyli związków miedzi o barwie zielonej, na
powierzchni miedzi i jej stopów. Patyna jest mieszaniną wodorotlenku miedzi(II) Cu(OH)2 i węglanu
miedzi(II) CuCO3.
3. Surowce energetyczne
Tradycyjne źródła energii to:
• węgle kopalne (antracyt, węgiel kamienny, węgiel brunatny i torf)
• ropa naftowa
• gaz ziemny
Uzyskiwanie energii w sposób tradycyjny (spalanie węgla, ropy naftowej gazu ziemnego) wiąże się
z emisją do atmosfery tlenków węgla, siarki, azotu. Jeśli tradycyjne źródła energii będą eksploatowane
tak intensywnie jak dotychczas, to w niedługim czasie wyczerpią się.
Bardziej opłacalna jest przeróbka węgla kamiennego i ropy naftowej.
W wyniku suchej destylacji węgla kamiennego można otrzymać następujące produkty: gaz świetlny, wodę pogazową i koks. Wszystkie te substancje to podstawowe surowce w wielu dziedzinach
przemysłu.
W wyniku destylacji frakcjonowanej ropy naftowej (mieszaniny węglowodorów) otrzymuje się: gaz
opałowy, benzynę, benzynę ciężką, naftę, olej napędowy, olej opałowy, olej smarowy, mazut i asfalt.
Frakcje o wyższej temperaturze wrzenia np. benzynę ciężką, naftę, oleje poddaje się procesowi krakingu,
czyli rozbijaniu długich łańcuchów węglowodorowych na krótkie liczące od 5 – 10 atomów węgla.
Alternatywnymi źródłami energii są:
• energia słoneczna
• energia wodna
• energia wiatru
• energia biopaliwa
• energia geotermiczna
Data utworzenia: 2008-11-30
strona 4/5
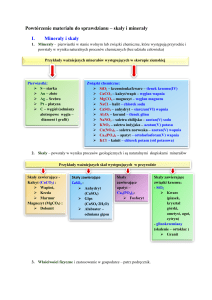
4. Sole wapnia wykorzystywane w budownictwie
Węglan wapnia CaCO3 jest głównym składnikiem skał wapiennych (wapieni, kalcytu, kredy, marmurów). Jest powszechnie stosowany w budownictwie zarówno jako kamień budulcowy, jak również
jako źródło otrzymywania wapna palonego, czyli tlenku wapnia CaO.
W piecach zwanych wapiennikami poddaje się wapienie termicznemu rozkładowi:
o
900 C
CaCO3 → CaO + CO2
Otrzymane wapno palone miesza się z wodą i otrzymuje się wapno gaszone, czyli w postaci stałej
wodorotlenek wapnia Ca(OH)2. Ten proces nazywany jest procesem gaszenia wapna. W trakcie gaszenia wapna do otoczenia wydziela się ciepło, jest to proces egzoenergetyczny. Powstająca substancja
ma właściwości żrące, dlatego należy zachować szczególną ostrożność.
CaO + H2O = Ca(OH)2
Wapno gaszone miesza się z piaskiem i wodą w celu otrzymania zaprawy murarskiej. Zaprawa murarska na wskutek oddziaływania z tlenkiem węgla(IV) zawartym w powietrzu twardnieje:
Ca(OH)2 + CO2 = CaCO3 + H2O
Powyższe równanie reakcji ilustruje proces twardnienia zaprawy murarskiej, jest również odpowiedzią na pytanie: dlaczego w nowo wybudowanym budynku czuje się wilgoć. Oprócz tlenku węgla(IV)
wiąże zaprawę murarską również piasek, którego głównym składnikiem jest tlenek krzemu(IV) SiO2:
Ca(OH)2 + SiO2 = CaSiO3 + H2O
Skały wapienne można wykryć spośród innych skał za pomocą roztworu kwasu np. popularnego octu
CaCO3 + 2CH3COOH = (CH3COO)2Ca + H2O + CO2↑
Na powierzchni skały wapiennej oblanej kwasem pojawiają się pęcherzyki wydzielającego się gazu
– tlenku węgla(IV).
Siarczan(VI) wapnia – woda 1/2, czyli CaSO4 ⋅ 2H2O, to główny składnik gipsu. Ozdobna odmiana
gipsu to alabaster. Związek będący głównym składnikiem gipsu należy do tzw. hydratów, czyli soli
uwodnionych, które w sieć krystaliczną mają wbudowane cząsteczki wody. W nazwie hydratu zawarta
jest informacja, ile cząsteczek wody przypada na określoną liczbę jonów tworzących sól, np. CaSO4 ·
2H2O to siarczan(VI) wapnia – woda 1/2, co oznacza, że na 1 kation wapnia Ca2+ i 1 anion SO42– przypadają 2 cząsteczki wody.
Data utworzenia: 2008-11-30
strona 5/5
Gips stosuje się w budownictwie – wyrównuje się ściany zaprawą gipsową, która po pewnym czasie
twardnieje. Zaprawa gipsowa to mieszanina gipsu palonego i wody. Gips palony otrzymuje się w trakcie rozkładu termicznego gipsu krystalicznego:
temperatura
2[CaSO4 ⋅ 2H2O] → (CaSO4)2 ⋅ H2O + 3H2O
W trakcie twardnienia zaprawy gipsowej zachodzi proces odwrotny – gips palony łączy się z wodą
i twardnieje. Proces ten wykorzystywany jest w medycynie do usztywniania złamanych kończyn.
5. Wszechobecna krzemionka
Tlenek krzemu(IV) czyli SiO2 to składnik piasku, zwyczajowo nazywa się go krzemionką. W przyrodzie występuje pod postacią:
• kwarcu tworzącego skały (granity, gnejs i piaskowce)
• barwnych odmian kwarcu: ametystu (fioletowy), cytrynu (żółty), kwarcu różowego
• bezpostaciowej ziemi okrzemkowej
• kamienia ozdobnego: opal
Krzemionka jest odporna na działanie czynników atmosferycznych. Stopiona z tlenkami metali
tworzy szkło, przezroczyste, bezpostaciowe ciało stałe:
• szkło kwarcowe (produkcja naczyń laboratoryjnych, elementów aparatury optycznej i lamp kwarcowych): SiO2
• szkło sodowe (wyrób przedmiotów codziennego użytku): SiO2, CaO, Na2O
• szkło potasowe (produkcja szkła laboratoryjnego): SiO2, CaO, K2O
• szkło ołowiowe (produkcja soczewek i kryształów): SiO2, PbO, K2O
Data utworzenia: 2008-11-30