Powtórzenie materiału do sprawdzianu – skały i minerały
I.
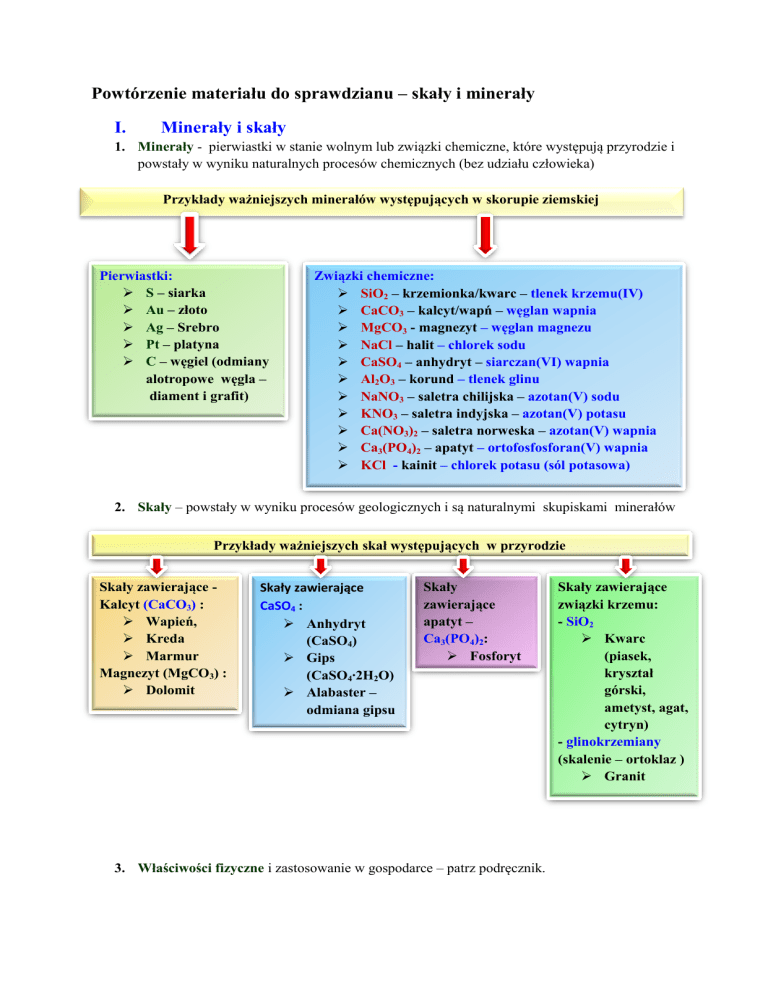
Minerały i skały
1. Minerały - pierwiastki w stanie wolnym lub związki chemiczne, które występują przyrodzie i
powstały w wyniku naturalnych procesów chemicznych (bez udziału człowieka)
Przykłady ważniejszych minerałów występujących w skorupie ziemskiej
Pierwiastki:
S – siarka
Au – złoto
Ag – Srebro
Pt – platyna
C – węgiel (odmiany
alotropowe węgla –
diament i grafit)
Związki chemiczne:
SiO2 – krzemionka/kwarc – tlenek krzemu(IV)
CaCO3 – kalcyt/wapń – węglan wapnia
MgCO3 - magnezyt – węglan magnezu
NaCl – halit – chlorek sodu
CaSO4 – anhydryt – siarczan(VI) wapnia
Al2O3 – korund – tlenek glinu
NaNO3 – saletra chilijska – azotan(V) sodu
KNO3 – saletra indyjska – azotan(V) potasu
Ca(NO3)2 – saletra norweska – azotan(V) wapnia
Ca3(PO4)2 – apatyt – ortofosfosforan(V) wapnia
KCl - kainit – chlorek potasu (sól potasowa)
2. Skały – powstały w wyniku procesów geologicznych i są naturalnymi skupiskami minerałów
Przykłady ważniejszych skał występujących w przyrodzie
Skały zawierające Kalcyt (CaCO3) :
Wapień,
Kreda
Marmur
Magnezyt (MgCO3) :
Dolomit
Skały zawierające
CaSO4 :
Anhydryt
(CaSO4)
Gips
(CaSO4∙2H2O)
Alabaster –
odmiana gipsu
Skały
zawierające
apatyt –
Ca3(PO4)2:
Fosforyt
3. Właściwości fizyczne i zastosowanie w gospodarce – patrz podręcznik.
Skały zawierające
związki krzemu:
- SiO2
Kwarc
(piasek,
kryształ
górski,
ametyst, agat,
cytryn)
- glinokrzemiany
(skalenie – ortoklaz )
Granit
4. Właściwości chemiczne
Identyfikacja skał węglanowych (zawierających kalcyt lub magnezyt)
Kwas węglowy jest kwasem bardzo słabym i jest łatwo wypierany z soli przez kwasy
mocniejsze [octowy – CH3-COOH, chlorowodorowy - HCl, siarkowy(VI) – H2SO4],
Kwas H2CO3 jest również kwasem nietrwałym i ulega rozkładowi na gazowy CO2 i
H2O, reakcja przebiega wg równania: H2CO3 H2O + CO2 ↑
W reakcji mocniejszego kwasu na sole kwasu węglowego wydziela się obficie
bezbarwny i bezwonny gaz (pienie się reagentów w probówce)
Przykładowe zad. 1
W 6 nieoznakowanych probówkach umieszczone 4 różne substancje stałe o barwie białej:
kwarc, anhydryt, apatyt, wapno palone, kalcyt i magnezyt. Dobierz odczynnik i zaproponuj
doświadczenie (opis lub schemat) umożliwiające identyfikacje kalcytu, podaj obserwacje,
zapisz odpowiednie równania reakcji chemicznych, skorzystaj z tabeli rozpuszczalności.
Przykładowe rozwiązanie:
Dobrany odczynnik : H2SO4
Do każdej probówki z w/w związkami należy dodać roztwór kwasu siarkowego(VI)
Kalcyt znajduje się w probówce gdzie po dodaniu kwasu zaobserwowano wydzielanie się
bezbarwnego i bezwonnego gazu i powstanie białego osadu.
SiO2 + H2SO4 reakcje nie zachodzi,
CaSO4 + H2SO4 Ca2+ + 2HSO4- (powolne roztworzenie białej substancji),
CaO + H2SO4 CaSO4↓ + H2O (reakcja zachodzi ale zmiany są niezauważalne),
CaCO3 + H2SO4 CaSO4↓ + CO2↑ + H2O (wydziela się obficie bezbarwny
i bezwonny gaz ale pozostaje biały osad),
Ca3(PO4)2 + 3H2SO4 3CaSO4↓ + 2H3PO4 (reakcja zachodzi i brak objawów
reakcji)
MgCO3 + H2SO4 Mg2+ + SO42- + CO2↑ + H2O (reakcja zachodzi, wydziela się
bezbarwny i bezwonny gaz ale następuje rozpuszczenie jednego z produktów reakcji
i powstanie bezbarwnego roztworu).
Przykładowe zad.2
Rośliny do wzrostu i rozwoju potrzebuje makroskładników (N, P, K, Ca, Mg), które
pobiera z roztworu glebowego. W intensywnej produkcji roślinnej stosuje się nawozy
mineralne, którymi mogą być przetworzone mechaniczne niektóre skały lub minerały.
Spośród skał/minerałów wskaż te, które mogą być źródłem
A) dwóch makroskładników
B) jednego makroskładnika
Przykładowe rozwiązanie:
Dwuskładnikowe: saletra norweska Ca(NO3)2 , saletra indyjska (KNO3),
apatyt Ca3(PO4)
Jednoskładnikowe: saletra chilijska NaNO3; magnezyt MgCO3,
kreda CaCO3.
Rozkład termiczny skał węglanowych i usuwanie wody krystalicznej z soli uwodnionych
– hydratów
Sole kwasu węglowego są nietrwałe i wyniku prażenia (termiczny rozkład) ulegają
rozkładowi do odpowiedniego tlenku metalu i tlenku węgla(IV)
Hydraty – sole uwodnione w wyniku prażenia ulegają dehydratacji – częściowemu
lub całkowitemu odwodnieniu z ewentualną zmianą barwy (np. CuSO4 ∙ 5H2O ma
barwę niebieską, a CuSO4 – jest bezbarwny, CoCl2 ∙ 6H2O – ma barwę czerwoną,
a CoCl2 – ma barwę granatową)
Przykładowe zad. 3
Zapisz równanie reakcji termicznego rozkładu kalcytu – otrzymywania wapna palonego
oraz oblicz ile kilogramów tego minerału należy rozłożyć aby otrzymać 100kg wapna
palonego.
Rozwiązanie:
T
CaCO3 CaO + CO2
(do wykonania drugiej części zadania niezbędna jest umiejętność obliczania masy
cząsteczkowej = suma mas atomowych pierwiastków w cząsteczce związku)
mczCaCO3 = mat Ca + mat C + 3matO = 40u + 12u + 3 ∙ 14u = 100u
mczCaO = matCa + matO = 40u + 16u = 56u
mczCO2 = matC + 2matO = 12u + 2 ∙ 16u = 44u
interpretacja masowa równania reakcji chemicznej;
CaCO3
CaO
+
CO2
100u
56u
+
44u
100g
56g
+
44g
100kg
56kg
+
44kg
Obliczenie z wykorzystaniem proporcji
100kg CaCO3
56kg CaO
x
100kg CaO
x
= 178,57kg CaCO3
Przykładowe zad. 4
Prażeniu (paleniu) poddano próbkę gipsu o masie 200g, jednym z produktów reakcji
jest woda a drugim jest gips palony. Oblicz masę otrzymanego gipsu palonego.
Rozwiązanie: (oblicz masy cząsteczkowe jak w zad.3)
T
2CaSO4 ∙ 2H2O (CaSO4)2 ∙ H2O + 3H2O
2 ∙ 172g
290g
54g
344g
290g
200g
x
x
= 168,6g gipsu palonego
Bierność chemiczna kwarcu (SiO2)
Kwarc jest bierny chemicznie, stąd większość odczynników chemicznych jest
przechowywana w naczyniach szklanych, jak i również aparatura chemiczna
jest wykona ze szkła. Wyjątek stanowi kwas fluorowodorowy i wodne
roztwory mocnych zasad (litowców i wapniowców), związki te reagują
z kwarcem – proces trawienia
Produktem reakcji kwarcu z kwasem fluorowodorowym jest czterofluorek
krzemu, a produktami reakcji z silnymi zasadami litowców są rozpuszczalne
w wodzie odpowiednie metakrzemiany(IV) lub ortokrzemiany(IV).
Przykładowe zad. 5
Zapisz równania reakcji wykazujące, że mocne zasady i kwas fluorowodorowy nie mogą
być przechowywane w naczyniach szklanych (przechowuje się je w pojemnikach
z tworzyw sztucznych), w rozwiązaniu zadania wykorzystaj tabelę rozpuszczalności.
Rozwiązanie:
SiO2 + 4HF SiF4↑ + 2H2O
SiO2 + 2K+ + 2OH- 2K+ + SiO32- + H2O
II.
Przeróbka skał i minerałów i ich zastosowanie
1. Zastosowanie kwarcu (krzemionki):
Produkcja szkła przez stapianie z dodatkiem węglanu sodu i węglanu wapnia, szkło
jest mieszaniną (kwarcu, metakrzemianu sodu i wapnia) bezpostaciową o
nieporządkowanej strukturze wewnętrznej i bez ściśle określonej temp. topnienia,
Szkło barwne otrzymuje się przez dodanie barwnych tlenków metali w trakcie
spiekania: zielone – Cr2O3; niebieskie – CoO; fioletowe – NiO; czerwone Cu2O;
mleczne – SnO; żółte-brązowe – Fe2O3.
Składnik zaprawy wapiennej, w mieszaninie w wapnem gaszonym i wodą
Przykładowe zad. 6
Zapisz równania reakcji chemicznych, które zachodzą:
a) w trakcie produkcji szkła krzemionkowego – do wyrobu szyb, naczyń szklanych
i elementów optycznych,
b) twardnienia (wiązania) zaprawy wapiennej
Rozwiązanie:
a) Skład mieszaniny reakcyjnej: SiO2 + Na2CO3 + CaCO3
SiO2 + 2NaCO3 Na2SiO3 + 2CO2↑
SiO2 + CaCO3 CaSiO3 + CO2↑
b) Skład mieszaniny reakcyjnej SiO2 + Ca(OH)2
SiO2 + Ca(OH)2 CaSiO3↓ + H2O
2. Zastosowanie wapna palonego
Wapno palonego przed użyciem do sporządzenia zaprawy wapiennej poddaje się
gaszeniu, w reakcji z wodą powstaje ciasto wapienne (wodorotlenek wapnia) o
właściwościach żrących, ciasto wapienne może być również stosowane do bielenia
ścian pełniąc jednocześnie środka odkażającego.
Pod wpływem CO2 zawartego w powietrzu atmosferycznych następuje wiązanie
zaprawy (twardnienie)
Przykładowe zad. 7
Oblicz, w jakim stosunku masowym nalży wymieszać wapno palone z wodą aby
całkowicie przeprowadzić proces gaszenia.
Rozwiązanie: (patrz zadanie 3 i 4)
CaO + H2O Ca(OH)2
56g + 18g 74g
m CaO : m H2O = 56g : 18g = 14 : 4,5
Przykładowe zad. 8
Zapisz równania reakcji chemicznych, które zachodzą w trakcie wiązania (twardnienia)
zaprawy murarsko-tynkarskiej jeżeli jest ona mieszaniną: kwarcu, wapna gaszonego
i wody.
Rozwiązanie:
SiO2 + Ca(OH)2 CaSiO3↓ + H2O
Ca(OH)2 + CO2 CaCO3 + H2O
3. Zastosowanie gipsu palonego
W budownictwie stosuje się gips budowlany zawierający praktycznie wyłącznie gips
palony, jest to zaprawa szybko wiążąca,
Oprócz gipsu budowalnego, do wykonywania gładzi tynkowych stosuje się gips
szpachlowy, który zawiera domieszki wapna gaszonego i węglanu wapnia, proces
twardnienia jest znacznie wolniejszy niż w przypadku gipsu budowlanego.
Przykładowe zad. 9
Zapisz równania reakcji chemicznych zachodzących w trakcie wiązania gipsu
budowalnego i gipsu szpachlowego i wyjaśnij przyczyny wolniejszego procesu
wiązania gipsu szpachlowego.
Rozwiązanie:
Gips budowlany: (CaSO4)2∙H2O + 3H2O 2CaSO4 ∙ 2H2O
Gips szpachlowy: (CaSO4)2∙H2O + 2H2O + Ca(OH)2 + CO2
2CaSO4 ∙ 2H2O + CaCO3 (proces wiązania spowolniony jest procesem
twardnienia zaprawy wapiennej pod wpływem CO2 zawartego w powietrzu
atmosferycznym, część wody niezbędna do krystalizacji gipsu powstaje w
trakcie twardnienia zaprawy wapiennej).
Przykładowe zad. 10
Oblicz, ile gramów wody należy dodać aby całkowicie utwardzić 0,5kg gipsu palonego.
Rozwiązanie: (skorzystaj z informacji z zad 3 i 4)
(CaSO4)2∙H2O + 3H2O 2CaSO4 ∙ 2H2O
290g
+ 3 ∙ 18g 344g
290g ---------------------- 54g wody
500g ---------------------- x
__________________________
x
93g wody
III.
Zjawisko krasu
Proces wietrzenia chemicznego skał węglanowych pod wpływem wody i rozpuszczonych
w niej tlenków kwasowych – głównie CO2.
Kalcyt i magnezyt są związkami praktycznie nierozpuszczalnymi w wodzie
W wyniku oddziaływana wody i CO2 minerały węglanowe przechodzą w
wodorowęglany, które są rozpuszczalne w wodzie
Przechodzące od roztworu kationy wapnia i magnezu nadaje wodzie twardość
węglanową (przemijającą)
CaCO3 + CO2 + H2O ↔ Ca2+ + 2HCO3 MgCO3 + CO2 + H2O ↔ Mg2+ + 2HCO3-
IV.
Procesy wieloetapowe
Przykład zad. 11
Zapisz równania reakcji chemicznych przedstawionych na poniższym schemacie
dobierając ewentualnie drugi substrat i warunki reakcji.
A)
d
CaCO3
a
CaO
b
Ca(OH)2
c
Rozwiązanie:
T
a)
b)
c)
d)
CaCO3 CaO + CO2
CaO + H2O Ca(OH)2
SiO2 + Ca(OH)2 CaSiO3↓ + H2O
Ca(OH)2 + CO2 CaCO3 + H2O
B)
SiO2
c
Na2SiO3
a
SiF4
b
CaSiO3
Rozwiązanie:
a)
b)
c)
d)
SiO2 + 4HF SiF4↑ + 2H2O
SiO2 + Ca(OH)2 CaSiO3↓ + H2O
SiO2 + 2NaOH Na2SiO3 + H2O
SiF4 + 2H2O SiO2 + 2H2O
d
SiO2
CaSiO3
V.
Właściwości gleby i jej ochrona
1. Odczyn i pH gleby
pH jest to ujemny logarytm dziesiętny ze stężenia molowego kationów
wodorowych w roztworze: pH = - log[H
[H+] = 10-5mol/dm3
to pH = -log 10-5 = 5 ; odczyn kwasowy
[H+] = 10-8mol/dm3
to pH = -log 10-8 = 8; odczyn zasadowy
[H+] = 10-7mol/dm3
to pH = -log 10-7 = 7; odczyn obojętny
Skala pH a odczyn
0
7
Wzrost kwasowości
14
Wzrost zasadowości
Odczyn obojętny
2. Nawozy a odczyn gleby
odkwaszające glebę: kalcyt, magnezyt, wapno palone, wapno gaszone, apatyty,
superfosfat potasowy -K3PO4, superfosfat wapniowy - Ca(H2PO4)2
nawozy zakwaszające glebę: salmiak - NH4Cl, siarczan(VI) amonu (NH4)2SO4,
nawozy obojętne: saletra potasowa, saletra sodowa, sól potasowa, superfosfat
amonowy - (NH4)3PO4, siarczan(VI) potasu - K2SO4 , mocznik - CO(NH2)2
3. Działanie nawozów odkwaszających:
Ca2+ + 2OH- + 2H+ Ca2+ + 2H2O
3K+ + PO43- + 3H+ 3K+ + H3PO4
4. Działanie nawozów zakwaszających:
NH4+ + Cl- + H2O NH3 ∙H2O + H+ + Cl 2NH4+ + SO42- + 2H2O 2NH3 ∙H2O + 2H+ + SO42Przykładowe zad. 12
A. Stężenie kationów wodorowych w roztworze glebowym wynosi 10-4mol/dm3.
Podaj odczyn gleby i dobierz nawóz umożliwiający do prowadzenie pH gleby
do pH = 6,5 (słabo kwasowego)
Rozwiązanie:
pH = - log [H+] = - log 10-4 = 4, odczyn kwasowy , aby podnieść odczyn gleby należy
zastosować nawóz odkwaszający: np. kredę, wapno palone lub wapno gaszone.
B. Na glebach o odczynie obojętnym lub zasadowym kwiaty hortensji mają barwę
różową, na glebach kwaśnych kwiaty maja barwę niebieską. Jakim nawozem
nalży nawozić glebę aby kwiaty hortensji zmieniły barwę z różowej na barwę
niebieską?
Rozwiązanie:
Należy zastosować nawozy zakwaszające np. siarczan(VI) amonu lub chlorek amonu.
5. Procentowy skład nawozów
Składniki pokarmowe zawarte w nawozach mineralnych przelicza się na:
N N; P P2O5; K K2O; Ca CaO; Mg MgO
Przykłady przeliczeń:
Zawartość % azotu w moczniku CO(NH2)2
mcz(moczniaka) = 12u + 16u + 2 ∙14u + 2 ∙ 1u = 60u , to jest 100%,
60u mocznika ------------------ 100%
28u azotu ----------------------- x
-----------------------------------------
x
46,66% azotu
Przykładowe zad. 13
Oblicz % udział składników pokarmowych w apatycie
Rozwiązanie:
Obliczenie masy cząsteczkowej Ca3(PO4)2 , związek do ustalenia
procentowego składu K i P należy traktować jako mieszaninę CaO i P2O5
Ca3(PO4) 3CaO + P2O5 , mcz = 3∙ 40u + 3 ∙ 16u + 2 ∙ 31u + 5 ∙ 16u =
168u + 142u = 310u to jest 100%
310u --------------- 100%
310u --------------------- 100%
168u CaO --------- x
-------------------------------
142u P2O5 ---------------- x
------------------------------------
x
x
Apatyt zawiera 54,2% tlenku wapnia i 45,8% tlenku fosforu(V), stosując 100kg tego nawozu wnosi
się go gleby 54,2kg tlenku wapnia i 45,8kg tlenku fosforu(V).