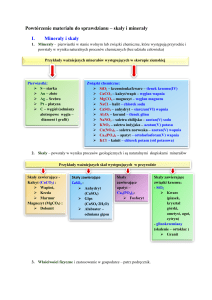
Węglowce – krzem
-występowanie,
-właściwości krzemu
-ważniejsze związki krzemu
Krzem – występowanie
• Krzem w przyrodzie występuje wyłącznie w postaci
związanej, główne minerały: krzemiany,
glinokrzemiany [skalenie (ortoklaz, albit, anoryt),
miki (muskowit, biotyt)], tlenek krzemu
[krzemionka, kwarc – kryształ górski bezbarwny,
ametyst (filetowy), opale, agaty]
• Minerały krzemu wchodzą w skład wielu skał:
granit, bazalt, piaskowiec, piaskowiec, skały luźne
jako produkty wietrzenia skał piasek, glina
K2O.Al2O3.6H2O + H2O + CO2
Al2O3.2SiO2.2H2O + K2CO3 + 4SiO2
Krzem – odmiany kwarcu
Kryształ górski
Ametyst
Krzem – odmiany kwarcu
Opal
Agat
Krzem – właściwości fizyczne
i otrzymywanie
• Właściwości fizyczne: ciało stałe, krystaliczne, twardy
ale kruchy, barwy szarej z metalicznym połyskiem,
gęstości większej od gęstości wody, jest
półprzewodnikiem
• Krzem w związkach występuje na stopniach utlenienia
+II i +IV,
• Otrzymywanie: redukcja krzemionki węglem lub
magnezem (glinem):
SiO2 + 2C Si + 2CO
SiO2 + 2Mg Si + 2MgO
3SiO2 + 2Al 3Si + 2Al2O3
Termiczny rozkład trichloromonosilanu (SiHCl3)
Krzem
Krzem – właściwości chemiczne
• Krzem jest pierwiastkiem o małej aktywności:
1. Reakcja z fluorem (temp. pokojowa)
Si + 2F2 SiF4(g)
2. W stanie stopionym (1410oC) reaguje
z pozostałymi fluorowcami, siarką, azotem
oraz stopionymi metalami, z tlenem (ok.
400oC)
Si + O2 SiO2
3. Krzem nie reaguje z wodą i kwasami
(reaguje z mieszaniną (HNO3 + HF(aq) )
Krzem – właściwości chemiczne cd
4. Reakcje krzemu z roztworami
wodorotlenków litowców z wydzieleniem
wodoru
Si + 2KOH + H2O K2SiO3 + 2H2
Si + 2OH- + H2O SiO32- + 2H2
5. Reakcje z wodorem – tworzy związki
binarne - krzemowodory (silany) np.
monosilan SiH4, jednak związki te mają
odmienne właściwości niż węglowodory
Krzem – właściwości chemiczne cd
• Silany - cd: różnice we właściwościach silanów
i węglowodorów wynikają z polaryzacji wiązania
z atomem wodoru, w przypadku węglowodorów
uwspólniona para elektronowa jest przesunięta
w kierunku atomu węgla, natomiast w silanach
w kierunku atomu wodoru, stąd mniejsza trwałość
i większa reaktywność chemiczna silanów, które
reagują z wodą:
SiH4 + 3H2O H2SiO3 + 4H2
Krzem – ważniejsze związki
• Tlenek krzemu(IV) – SiO2: jest układem
polimerycznym o wzorze (SiO2)n, o budowie
krystalicznej – tworzy kryształy jonowe, komórka
elementarna kryształu ma formę tetraedru,
twarde, ale kruche, nierozpuszczalne w wodzie
• Tlenek o właściwościach kwasowych, wchodzi
w reakcje z mocnymi zasadami litowców, powstają
sole – metakrzemiany(IV) lub ortokrzemiany(IV)
SiO2 + 2NaOH Na2SiO3 + H2O
SiO2 + 4NaOH Na4SiO4 + 2H2O
Krzem – ważniejsze związki - cd
• Krzemiany: otrzymuje się w reakcji SiO2
z roztworami wodorotlenków litowców lub
w procesie stapiania ich z tlenkiem krzemu,
krzemiany litowców, są rozpuszczalne w wodzie
SiO2 + Na2CO3 Na2SiO3(s) + CO2
• Stężone roztwory metakrzemianu sodu lub potasu
– szkło wodne (woda szklana) stosuje się jako
dodatek do betonów (izolacje przeciwwodne), do
impregnacji przeciwogniowej tkanin i drewna,
do produkcji smarów
Krzem – ważniejsze związki - cd
• Krzemiany litowców: w roztworach wodnych ulegają
hydrolizie anionowej, produktem jest mieszanina kwasów
krzemowych nie rozpuszczalnych w wodzie:
SiO32- + 2H2O H2SiO3 + 2OHSiO32- + 3H2O H4SiO4 + 2OH• Kwasy metakrzemowy i ortokrzemowy ulegają
kondensacji z wydzieleniem cząsteczki wody, powstają
kwasy polikrzemowe:
2H2SiO3 H2Si2O5 + H2O
2H4SiO4 H6Si2O7 + H2O
3H4SiO4 H8Si3O10 + 2H2O
Krzem – ważniejsze związki - cd
• Kwasy krzemowe – otrzymywanie:
Na2SiO3 + 2HCl H2SiO3 + 2NaCl
K2SiO3 + H2SO4 H2SiO3 + Na2SO4
Na2SiO3 + H2O + CO2 H2SiO3 + Na2CO3
H2SiO3 + H2O H4SiO4
• Kwasy krzemowe są praktycznie
nierozpuszczalne w wodzie, są bardzo słabymi
elektrolitami, słabszymi niż kwas węglowy
Krzem – ważniejsze związki - cd
• Czterofluorek krzemu – SiF4: gaz toksyczny, bezbarwny,
o nieprzyjemnej drażniącej woni otrzymuje się w reakcji
kwarcu z kwasem HF (H2F2), lub w reakcji krzemianu
z fluorowodorem
SiO2 + 4HF SiF4 + 2H2O
CaSiO3 + 6HF SiF4 + CaF2 + 3H2O
• Powyższe reakcje wykorzystuje się do trawienia szkła
i porcelany
• Hydroliza SiF4 : SiF4 + (n+2)H2O SiO2.nH2O + 4HF
Reakcja jest stosowane do impregnacji przeciwogniowych
tkanin i drewna.
Zastosowanie krzemu i jego
związków
• Zastosowanie krzemu: jako półprzewodnik nieelektronowy
stosowany jest do produkcji diod, triod, tranzystorów, baterii
słonecznych, dodatek do produkcji stali kwasoodpornej, kryształy
kwarcu mają właściwości piezoelektryczne, pod naciskiem następuje
naładowanie elektryczne (zapalniczki)
• Zastosowanie krzemionki: produkcja cementu, szkła, waty
szklanej do izolacji termicznej, światłowody, szkło kwarcowe
• Glinokrzemiany i kaolin: ceramika budowlana wyroby
garncarskie i ceglarskie, porcelana, fajans, kamionka
• Silany: impregnowanie tkanin, powłoki ochronne, produkcja olejów
i smarów, lakierów, środków wodoodpornych, implanty kosmetyczne,
środki polerujące