Wpływ pH i temperatury na aktywność enzymów na przykładzie
α-amylazy [EC 3.2.1.1.]
Szybkość katalizowanej przez enzym przemiany danego substratu w określony produkt
jest ściśle uzależniona od stężenia zarówno enzymu, jak i substratu (patrz ćwiczenie 4 i 5).
Nie są to jednak jedyne czynniki determinujące przebieg reakcji. na katalityczne działanie
enzymów mają również wpływ: stężenia jonów wodorowych (pH), temperatura reakcji, w
niektórych przypadkach potencjał redukcyjno - oksydacyjny środowiska, w którym zachodzi
reakcja, obecność rozmaitych związków niskocząsteczkowych (koenzymów, aktywatorów,
inaktywatorów), a także siła jonowa i stała dielektryczna środowiska.
Wpływ pH na aktywność enzymów
Enzymy jako białka charakteryzują się określonym stanem jonowym zależnym od pI i pH
środowiska. Mogą one występować w formie elektrododatniego kationu, elektroobojętnego
amfijonu lub elektroujemnego anionu. Ładunek cząsteczki białka enzymatycznego ma istotny
wpływ na jego czynność katalityczną, ponieważ determinuje siłę oddziaływań wodorowych i
jonowych, zarówno stabilizujących konformację molekuły, jak i umożliwiających powstanie
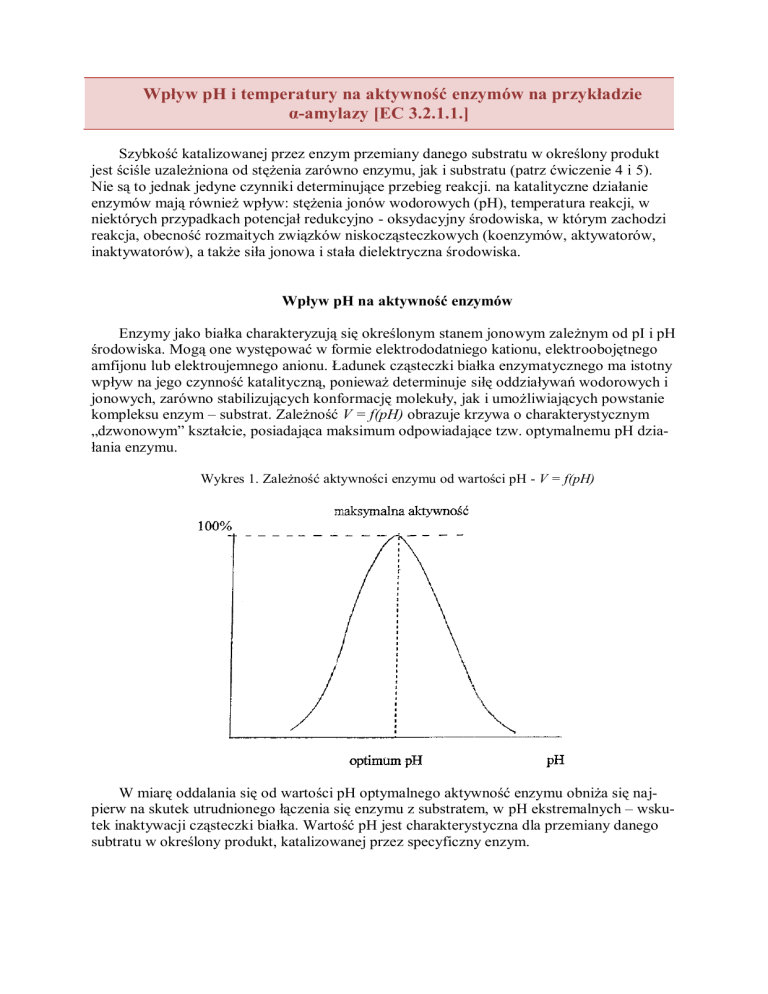
kompleksu enzym – substrat. Zależność V = f(pH) obrazuje krzywa o charakterystycznym
„dzwonowym” kształcie, posiadająca maksimum odpowiadające tzw. optymalnemu pH działania enzymu.
Wykres 1. Zależność aktywności enzymu od wartości pH - V = f(pH)
W miarę oddalania się od wartości pH optymalnego aktywność enzymu obniża się najpierw na skutek utrudnionego łączenia się enzymu z substratem, w pH ekstremalnych – wskutek inaktywacji cząsteczki białka. Wartość pH jest charakterystyczna dla przemiany danego
subtratu w określony produkt, katalizowanej przez specyficzny enzym.
Wpływ temperatury na szybkość reakcji enzymatycznej
Wzrost temperatury wywołuje wzrost szybkości reakcji każdej reakcji chemicznej, zgodnie z równaniem Arrheniusa:
V
k
k[ S ],
Ae
Ea
RT
Temperatura wpływa na wszystkie etapy reakcji enzymatycznej:
wzrost temperatury zwiększa kinetyczną energię substancji reagujących, a więc
prawdopodobieństwo ich skutecznych, to jest prowadzących do powstania produktu,
zderzeń
podwyższona temperatura osłabia, a po przekroczeniu pewnej wartości nawet
niszczy niektóre słabe oddziaływania (np. wodorowe) w molekule enzymu, co prowadzi do stopniowej denaturacji białka enzymatycznego
Te dwa przeciwstawne efekty powodują, że zależność V = f(T) jest obrazowana krzywa
dzwonową, posiadającą mniej lub bardziej ostre maksimum, nazywane najczęściej optymalną
temperaturą działania enzymu. Wielkość ta nie ma charakteru bezwzględnego: jest zależna od
czasu, w jakim zachodzi reakcja enzymatyczna. im czas reakcji krótszy, tym mniej rozległy
zasięg zmian denaturacyjnych w białku enzymatycznym poddanym działaniu danej temperatury. Wówczas maksimum krzywej V = f(T) przesuwa się ku wyższym wartościom temperatury.
Wykres 2. Zależność aktywności enzymu od temperatury V = f(T)
Przebieg enzymatycznej hydrolizy skrobi
α-Amylazy to szeroko rozpowszechnione w przyrodzie enzymy należące do klasy hydrolaz i podklasy hydrolaz glikozydowych. Wytwarzają je liczne drobnoustroje oraz organizmy
roślinne i zwierzęce. Ze względu na wartość produkcji i zapotrzebowanie, najważniejszymi
przemysłowymi preparatami tego enzymu są α-amylazy bakteryjne, wytwarzane przez szczepy z rodzaju Bacillus oraz roślinna α-amylazy ze słodu. U człowieka enzym amylaza występuje w ślinie, trzustce, surowicy krwi i moczu. Amylaza śliny i trzustki wykazuje aktywność
w roztworach lekko zasadowych, obojętnych i słabo kwasowych.
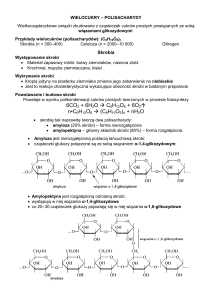
Skrobia jest wielkocząsteczkowym polimerem α-D-glukopiranozy. Znane są dwie frakcje
skrobi: nierozgałęziona amyloza, w której reszty glukozy połączone są wiązaniami
α-1,4-glikozydowymi w długie łańcuchy oraz amylopektyna, w której oprócz głównych wiązań α-1,4-glikozydowych występują także wiązania rozgałęziające α-1,6-glikozydowe.
α-Amylaza rozkłada tylko wewnętrzne wiązania α-1,4-glikozydowe, powodując stopniowe rozszczepienie łańcuchów skrobi na coraz krótsze fragmenty, zwane dekstrynami.
Przebieg tego etapu degradacji skrobi, zwanego etapem dekstrynowania, można śledzić
dzięki barwnej zarówno nierozłożonej skrobi, jak i dłuższych dekstryn z roztworem jodu w
jodku potasu. Nierozłożona skrobia w reakcji z tym odczynnikiem zabarwia się na kolor
ciemnoniebieski. Nieco krótsze od łańcuchów skrobi, łańcuchy powstałym pod działaniem
α-amylazy dekstryn (amylodekstryn) zabarwiają się z I 2 w KI na kolor fioletowy, a jeszcze
krótsze produkty hydrolizy – erytrodekstryny – barwią się podczas wspomnianej reakcji na
kolor czerwono-brunatny. α-Amylaza degraduje powstające erytrodekstryny do achrodekstryn, których łańcuchy są zbyt krótkie by mogło dojść do ich barwnej reakcji z roztworem jodu w jodku potasu. W drugim etapie hydrolizy, achrodekstryny są rozkładane przez
enzym do glukozy, maltozy i mieszaniny oligocukrów redukujących zawierających do 5 reszt
glukozy w cząsteczce, które również nie zabarwiają się w reakcji z jodem w jodku potasu.
Zasada oznaczania aktywności α-amylazy
W celu zaobserwowania przebiegu hydrolizy skrobi pod działaniem α-amylazy wykorzystuje się metody pozwalające na pomiar przyrostu stężenia cukrów redukujących uwalnianych
z substratu przez enzym. Są to między innymi metody: Fehlinga, Somogyi - Nelsona, oraz
Hagedorna – Jensena, w których stężenia cukrów redukujących oznacza się na podstawie ilości Cu2O powstającego na skutek redukcji jonów miedziowych przez wolne grupy redukujące
cukrów, oraz metoda Millera z kwasem 3’,5’-dinitrosalicylowym (DNS) stosowana w niniejszym ćwiczeniu.
W metodzie Millera aktywność enzymu oznacza się mierząc przyrost cukrów redukujących uwolnionych w czasie reakcji hydrolizy skrobi katalizowanej przez α-amylazę przebiegającej w przyjętych warunkach temperatury i pH. Cukry te oznacza się ilościowo stosując
alkaliczny roztwór kwasu 3’,5’-dinitrosalicylowego (DNS). W analogiczny sposób można
oznaczyć aktywność dowolnej hydrolazy glikozydowej, stosując odpowiedni dla niej substrat.
DNS nie tylko umożliwia oznaczenie stężenia cukrów redukujących, ale także pełni rolę inaktywatora enzymu, hamującego katalizowaną przez niego reakcję.
W środowisku alkalicznym i w temperaturze 100 °C DNS ulega redukcji pod działaniem
cukrów redukujących, dając pochodną aminową, zabarwioną w środowisku alkalicznym na
kolor pomarańczowy. Natężenie barwy, o maksimum absorbancji przy długości fali λ =
540 nm, jest proporcjonalne do stężenia cukrów redukujących w badanym roztworze.
Stężenie cukrów redukujących w próbie odczytuje się z krzywej wzorcowej A540 =
f(cmaltozy), przygotowanej w warunkach oznaczenia.
Wykres 1. Krzywa wzorcowa. Zależność absorbancji przy λ = 540 nm od stężenia maltozy A540 = f(cmaltozy)
Literatura:
Witwicki J., Ardelt W., Elementy enzymologii , Polskie Wydawnictwo Biochemiczne, 1984
Sivak M.N, Preiss J;. Starch: Basic Science to Biotechnology. Advances in Food and Nutrition Research, vol. 41. New York: Academic
Press, 1998
Miller G.L.; Use of dinitriosalicylic acid reagent for determination of reducing sugar, Anal. Chem., 31, 426–428, 1959
ODCZYNNIKI-MATERIAŁY-SPRZĘT
1% koloidalny roztwór skrobi
roztwory buforowe o pH: 3, 4, 5, 6, 7, 8
1% alkaliczny roztwór kwasu 3’,5’-dinitrosalicylowego (DNS)
woda destylowana
termobloki: 37, 50 oraz 100 °C
spektrofotometr
stoper
PROCEDURA
Przygotowanie roztworu śliny
1. Do probówki 50 ml wprowadzić 5 ml śliny.
2. Następnie rozcieńczyć ślinę wodą destylowaną 1:1.
3. Tak przygotowany roztwór enzymu użyć do wykonania kolejnych punktów ćwiczenia.
1.
2.
3.
4.
5.
6.
7.
Wpływ pH na aktywność α-amylazy
Do 6 probówek odmierzyć po 0,5 ml 1% koloidalnego roztworu skrobi (po uprzednim
dokładnym wymieszaniu) i po 0,25 ml buforów o różnych pH (3, 4, 5, 6, 7, 8). Zawartość dokładnie wymieszać. Równocześnie przygotować próbę odczynnikową zawierającą (0,5 ml 1% koloidalnego roztworu skrobi, 0,25 ml buforu o pH 7 oraz 0,25 ml
wody, UWAGA: do próby odczynnikowej nie dodajemy roztworu śliny)
Do każdej z probówek dodać po 0,25 ml roztworu śliny (oprócz próby odczynnikowej). Zawartość probówek natychmiast wymieszać i inkubować w temperaturze 37°C
w ciągu 20 minut.
Po upływie 20 minut, pobrać 0,2 ml mieszaniny reakcyjnej i przenieść ją do nowej
probówki, do której wprowadzić także 0,2 ml roztworu DNS. Zawartość probówek
wymieszać i inkubować w ciągu 10 minut w termobloku 100 °C.
Po 10 minutach probówki wyjąć, schłodzić do temperatury pokojowej pod bieżącą
wodą i dodać do mieszaniny po 0,6 ml wody destylowanej. Zawartość wymieszać.
Zmierzyć absorbancję roztworu przy λ=540 nm (A540) wobec próby odczynnikowej.
Z krzywej wzorcowej odczytać stężenie cukrów redukujących w mieszaninie reakcyjnej (mgmaltozy/ml). Wyniki umieścić w tabeli.
Na podstawie tabeli sporządzić wykres zależności stężenia cukrów redukujących
uwolnionych ze skrobi pod działaniem zastosowanego preparatu α-amylazy od pH
środowiska, w której przebiegała reakcja.
Wpływ temperatury na aktywność α-amylazy
1. Do 4 probówek odmierzyć po 0,5 ml 1% koloidalnego roztworu skrobi (po uprzednim
dokładnym wymieszaniu) i po 0,25 ml buforu o pH 7. Zawartość dokładnie wymieszać. Równocześnie przygotować próby odczynnikowe dla każdej temperatur zawierające (0,5 ml 1% koloidalnego roztworu skrobi, 0,25 ml buforu o pH 7 oraz 0,25 ml
wody, UWAGA: do prób odczynnikowych nie dodajemy śliny)
2. Każdą z probówek inkubować w ciągu 5 minut w następujących temperaturach: pokojowa, 5°C (lodówka), 37°C oraz 50 °C.
3. Po 5 minutach do każdej z probówek dodać po 0,25 ml roztworu śliny (oprócz prób
odczynnikowych). Zawartość probówek natychmiast wymieszać i inkubować w podanych powyżej temperaturach w ciągu 20 minut.
4. Po upływie 20 minut, pobrać 0,2 ml mieszaniny reakcyjnej i przenieść ją do nowej
probówki, do której wprowadzić także 0,2 ml roztworu DNS. Zawartość probówek
wymieszać i inkubować w ciągu 10 minut w termobloku 100 °C.
5. Po 10 minutach probówki wyjąć, schłodzić do temperatury pokojowej pod bieżącą
wodą i dodać do mieszaniny po 0,6 ml wody destylowanej. Zawartość wymieszać.
6. Zmierzyć absorbancję roztworu przy λ=540 nm (A540) wobec prób odczynnikowych.
7. Z krzywej wzorcowej odczytać stężenie cukrów redukujących w mieszaninie reakcyjnej (mgmaltozy/ml). Wyniki umieścić w tabeli.
8. Na podstawie tabeli sporządzić wykres zależności stężenia cukrów redukujących
uwolnionych ze skrobi pod działaniem zastosowanego preparatu α-amylazy od temperatury, w której przebiegała reakcja.