Zestaw zadań powtórzeniowych – sole – nazewnictwo i otrzymywanie
(Do rozwiązania zestawu możesz wykorzystać układ okresowy pierwiastków, tabelę rozpuszczalności
i szereg aktywności metali)
Podstawowe metody otrzymywania soli i powtórka z kwasów
1. metoda: kwas + zasada (wodorotlenek) → sól + woda (reakcja zobojętnienia)
np. HCl + KOH → KCl + H2O i jonowo H+ + Cl- + K+ + OH- → K+ + Cl- + H2O (H+ + OH- → H2O)
Ideą tej reakcji jest powstanie cząsteczki wody w wyniku połączenia kationu wodoru i anionu wodorotlenkowego. Reakcja
zobojętniania jest najbardziej popularną metodą otrzymywania soli.
2. metoda: kwas + aktywny metal → sól + wodór ↑ np. 2HCl + Zn → ZnCl2 + H2↑
W metodzie tej niezbędne jest skorzystanie z szeregu aktywności metali – metale zostały
uszeregowane wg wzrastającej aktywności chemicznej, którą określa się zdolnością do wypierania
wodoru z wody i roztworu kwasu. Korzystając z szeregu można określić aktywność metali wobec
wodoru oraz względem siebie, analogicznie jak ma to miejsce dla wodoru →
3. metoda: kwas + tlenek metalu → sól + woda np. H2SO4 + CaO → CaSO4 + H2O
4. metoda: sól rozp. I + sól rozp. II → sól rozp. III + sól słabo rozp. IV ↓
np. Pb(NO3)2 + 2KI → 2KNO3 + PbI2 ↓ (Pb2+ + 2NO3- + 2K+ + 2I- → 2K+ + 2NO3- + PbI2 ↓) lub
AgNO3 + KCl → KNO3 + AgCl ↓ (Ag+ + NO3- + K+ + Cl- → K+ + NO3- + AgCl ↓)
5. metoda: kwas I + sól kwasu II→ sól kwasu I (↓) + kwas II
np. AgNO3 + HCl → AgCl ↓ + HNO3 lub 2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
(CO2 + H2O → H2CO3)
6. metoda: zasada I + sól zasady II → sól zasady I + zasada II ↓
np. 2KOH + CuCl2 → 2KCl + Cu(OH)2 ↓
7. metoda: zasada + tlenek niemetalu → sól + woda np. 2KOH + CO2 → K2CO3+ H2O
8. metoda: metal + niemetal → sól np. Cu + S → CuS (jedynie sole kwasów beztlenowych)
9. metoda: tlenek metalu + tlenek niemetalu → sól np. CaO + CO2 → CaCO3 (jedynie sole kwasów tlenowych)
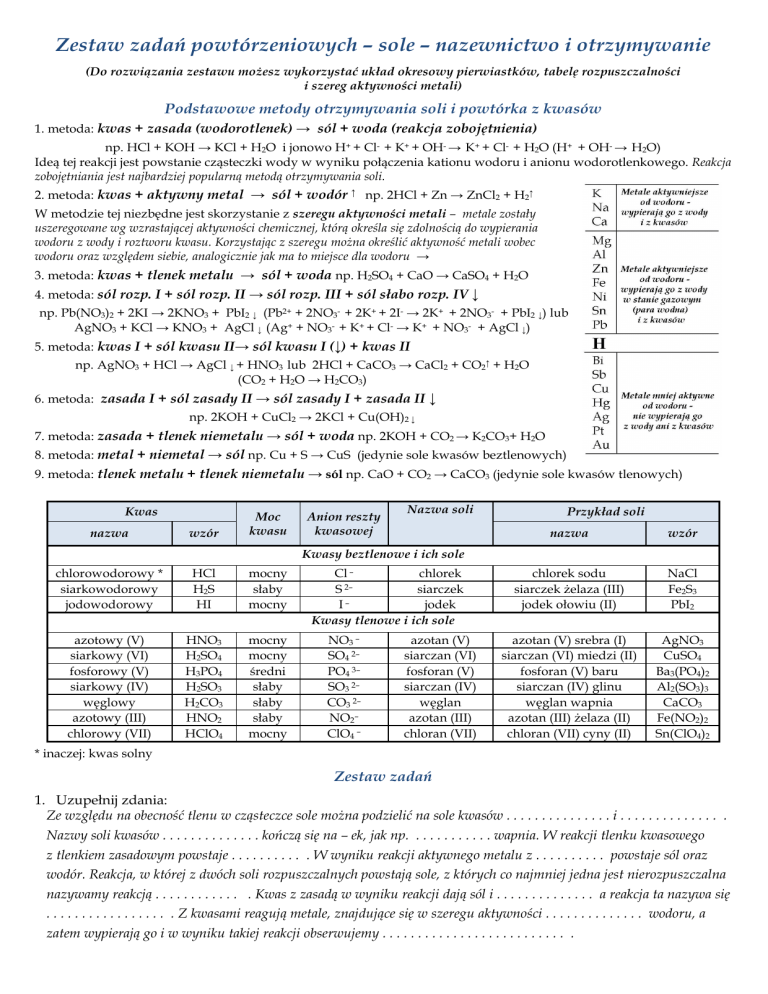
Kwas
nazwa
wzór
Moc
kwasu
Anion reszty
kwasowej
Nazwa soli
Przykład soli
nazwa
wzór
chlorek sodu
siarczek żelaza (III)
jodek ołowiu (II)
NaCl
Fe2S3
PbI2
azotan (V) srebra (I)
siarczan (VI) miedzi (II)
fosforan (V) baru
siarczan (IV) glinu
węglan wapnia
azotan (III) żelaza (II)
chloran (VII) cyny (II)
AgNO3
CuSO4
Ba3(PO4)2
Al2(SO3)3
CaCO3
Fe(NO2)2
Sn(ClO4)2
Kwasy beztlenowe i ich sole
chlorowodorowy *
siarkowodorowy
jodowodorowy
HCl
H2S
HI
mocny
słaby
mocny
azotowy (V)
siarkowy (VI)
fosforowy (V)
siarkowy (IV)
węglowy
azotowy (III)
chlorowy (VII)
HNO3
H2SO4
H3PO4
H2SO3
H2CO3
HNO2
HClO4
mocny
mocny
średni
słaby
słaby
słaby
mocny
Cl –
chlorek
S 2–
siarczek
I–
jodek
Kwasy tlenowe i ich sole
NO3 –
SO4 2–
PO4 3–
SO3 2–
CO3 2–
NO2–
ClO4 –
azotan (V)
siarczan (VI)
fosforan (V)
siarczan (IV)
węglan
azotan (III)
chloran (VII)
* inaczej: kwas solny
Zestaw zadań
1. Uzupełnij zdania:
Ze względu na obecność tlenu w cząsteczce sole można podzielić na sole kwasów . . . . . . . . . . . . . . . i . . . . . . . . . . . . . . .
Nazwy soli kwasów . . . . . . . . . . . . . . kończą się na – ek, jak np. . . . . . . . . . . . wapnia. W reakcji tlenku kwasowego
z tlenkiem zasadowym powstaje . . . . . . . . . . . W wyniku reakcji aktywnego metalu z . . . . . . . . . . powstaje sól oraz
wodór. Reakcja, w której z dwóch soli rozpuszczalnych powstają sole, z których co najmniej jedna jest nierozpuszczalna
nazywamy reakcją . . . . . . . . . . . . . Kwas z zasadą w wyniku reakcji dają sól i . . . . . . . . . . . . . . a reakcja ta nazywa się
. . . . . . . . . . . . . . . . . . Z kwasami reagują metale, znajdujące się w szeregu aktywności . . . . . . . . . . . . . . wodoru, a
zatem wypierają go i w wyniku takiej reakcji obserwujemy . . . . . . . . . . . . . . . . . . . . . . . . . . .
Zestaw soli do zadań nr. 2 – 7:
A
1
SnCl2
2
FeSO4
3
KOH
B
H3PO4
PbI2
Ag3PO4
C
Al(NO3)3
FeSO3
Na2CO3
D
Fe2(SO4)3
CuCl2
Ni(OH)2
E
HCl
Fe2S3
CuCO3
F
Au2(SO4)3
FePO4
KNO3
2. Nazwij sole z wiersza nr 1
3. Wskaż położenie substancji z wiersza nr 3, które nie są solami. Nazwij tą lub te substancje
4. Określ położenie w tabeli: węglanu miedzi(II), jodku ołowiu(II), chlorku cyny(II), fosforanu(V) żelaza(III).
5. Podziel sole w wierszu nr 2 powyższej tabeli ze względu na rozpuszczalność (praktycznie
nierozpuszczalne, słabo rozpuszczalne, dobrze rozpuszczalne, inne)
6. Zapisz czy z soli znajdujących się w powyższej tabeli na pozycjach B2, D2, E3, A2, C1 oraz F3 w wyniku
dysocjacji elektrolitycznej powstaną jony, a jeżeli tak to jakie?
7. Podziel sole w wierszu nr 3 powyższej tabeli ze względu na rozpuszczalność (praktycznie
nierozpuszczalne, słabo rozpuszczalne, dobrze rozpuszczalne, inne)
8. Tlenek magnezu wrzucony do roztworu kwasu siarkowego(VI) przereagował zgodnie z równaniem reakcji:
MgO + H2SO4 → MgSO4 + H2O i powstało 300 g soli. Oblicz ile tlenku zużyto do reakcji.
9. Uzupełnij zapis równań reakcji chemicznych:
a) . . HCl + . . Mg(OH)2 → . . MgCl2 + . . H2O
b) . . HNO3 + . . K2O → . . KNO3 + . . H2O
c) . . FeSO3 + . . KOH → . . K2SO3 + . . Fe(OH)2↓
d) . . Na3PO4 + . . ZnCl2 → . . Zn3(PO4)2 ↓ + . . NaCl
e) . . HNO3 + . . . . . . → . . Al(NO3)3 + . . H2↑
f)
. . BaCO3 + . . H2SO4 → . . BaSO4 + . . . . . . + . . . . . .
10. Zapisz wzory następujących soli: azotan(V) srebra(I), siarczek sodu, fosforan(V) żelaza(II), siarczan(VI)
miedzi(II), chlorek srebra(I), jodek wapnia,
11* Do 189 g 10-procentowego roztworu HNO3, wprowadzono 32,2 g Al2O3 zawierającego 5% zanieczyszczeń. Której
substancji było w nadmiarze i jaki odczyn miał roztwór po reakcji. Zapisz równanie reakcji i wykonaj obliczenia.
12. Wiedząc, że aktywniejsze chemicznie metale mogą wypierać mniej aktywne z ich soli zaproponuj
doświadczenie, które pozwoli sprawdzić który z trzech wybranych metali jest najbardziej a który najmniej
aktywny chemicznie. Metale wybierz posługując się szeregiem aktywności. Zapisz odpowiednie równania
reakcji do zadania.
13. Oblicz ile węglanu wapnia,
zawierającego 10%
zanieczyszczeń, potrzeba do
otrzymania 1,5 m3 dwutlenku
węgla w warunkach
normalnych. Jeżeli nie uda ci
się wykorzystać informacji o
warunkach normalnych
przyjmij gęstość dwutlenku
węgla 1,98 g/dm3. Załóż, że
zanieczyszczenia nie biorą
udziału w reakcji.
14. Ile 20% kwasu solnego
potrzeba, aby przereagował on
całkowicie z węglanem wapnia
z poprzedniego zadania. Załóż,
że zanieczyszczenia nie biorą
udziału w reakcji.
15. Zmieszano 200 g 30% roztworu
z 300 g 70% roztworu Pb(NO3)2.
Oblicz stężenie procentowe
otrzymanego roztworu. W jakiej tempera-turze roztwór otrzymany będzie roztworem nasyconym? Co
zrobić, aby otrzymany w zadaniu roztwór, w temperaturze 50 0C, był roztworem nasyconym? Wykonaj
potrzebne obliczenia.
Zestaw zadań powtórzeniowych dodatkowych – sole – nazewnictwo i otrzymywanie
16. Wybierz spośród soli nie znajdujących się w otrzymanym zestawie jedną sól dobrze rozpuszczalną
a jedną praktycznie nierozpuszczalną w wodzie i dla tych soli zapisz równania reakcji ich otrzymywania
poznanymi metodami.
17. Wiedząc, że aktywniejsze chemicznie metale mogą wypierać mniej aktywne z ich soli zaproponuj
doświadczenie, które pozwoli sprawdzić który z trzech wybranych metali jest najbardziej a który najmniej
aktywny chemicznie. Metale wybierz posługując się szeregiem aktywności. Zapisz odpowiednie równania
reakcji do zadania.
18. Oblicz ile węglanu wapnia, zawierającego 10% zanieczyszczeń, potrzeba do otrzymania 1,5 m3 dwutlenku
węgla w warunkach normalnych. Jeżeli nie uda ci się wykorzystać informacji o warunkach normalnych
przyjmij gęstość dwutlenku węgla 1,98 g/dm3. Załóż, że zanieczyszczenia nie biorą udziału w reakcji.
19. Ile 20% kwasu solnego potrzeba, aby przereagował on całkowicie z węglanem wapnia z poprzedniego
zadania. Załóż, że zanieczyszczenia nie biorą udziału w reakcji.
20. Zmieszano 200 g 30% roztworu z 300 g 70% roztworu Pb(NO3)2. Oblicz stężenie procentowe otrzymanego
roztworu. W jakiej temperaturze roztwór otrzymany będzie roztworem nasyconym? Co zrobić, aby
otrzymany w zadaniu roztwór, w temperaturze 50 0C, był roztworem nasyconym? Wykonaj potrzebne
obliczenia.
21*.Spośród soli wymienionych w tabeli na poprzedniej stronie trzy, praktycznie nierozpuszczalne
w wodzie, mają bardzo podobną barwę. Znajdź te sole w tabeli na poprzedniej stronie i określ ich
położenie w tej tabeli a następnie zaproponuj doświadczenie, które pozwoli Ci zidentyfikować każdą z
tych soli. Zapisz odpowiednie równania reakcji. Czy da się dokonać identyfikacji wszystkich trzech soli za
pomocą jednej substancji?
Przygotował: mgr inż. Bartosz Stasicki w oparciu o własny pomysł oraz o zadania zawarte w materiałach dla gimnazjalistów wydawnictw OE Pazdro, Nowa Era i WSiP