Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
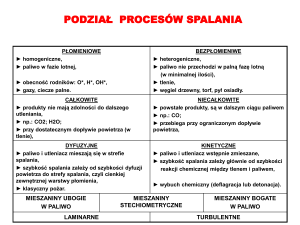
1. Możliwości gaśniczego oddziaływania na procesy spalania
1.1. Procesy w fazie gazowej – reakcje łańcuchowe
Spalanie gazów i par cieczy w powietrzu nie zachodzi w na drodze
bezpośredniego zderzania się cząsteczek paliwa i utleniacza, ale w sposób
pośredni. Przykładem może być spalanie wodoru w tlenie, które nie polega na
bezpośredniej reakcji H2 i O2, ale jest wynikiem wielu reakcji pośrednich z
udziałem wolnych rodników H, O oraz OH. Najważniejszą reakcją w łańcuchu
prowadzącym do powstania produktu końcowego – wody, jest reakcja
H + O2 → OH + O
W powyższej reakcji, pojedynczy atom H , wytworzony przez źródło zapłonu,
może reagować ze stabilną cząsteczką O2, tworząc dwa bardzo reaktywne
obiekty, OH oraz O. Rodnik hydroksylowy, OH, bardzo szybko reaguje z H2 :
OH + H2 → H2O + H
W tej reakcji OH jest zużywany, ale tworzy się atom H, który podtrzymuje
łańcuch reakcji. W tym samym czasie, atom O wytworzony w pierwszej reakcji
reaguje szybko z H2 tworząc dwa dodatkowe przenośniki łańcucha:
O + H2 → OH + H
W ten sposób pojedynczy atom H, wprowadzony do mieszaniny wodoru i tlenu
przy podwyższonej temperaturze, w wyniku serii bardzo szybkich reakcji
(zachodzących w ułamku milisekundy) powoduje utworzenie cząsteczek wody i
nowych wolnych atomów H. Każdy z tych nowych atomów H natychmiast
rozpoczyna nową serię reakcji i następuje rozgałęziona reakcja łańcuchowa. Po
wyczerpaniu reagentów, pozostałe rodniki O, H oraz OH rekombinują według
reakcji:
H + O → OH
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
H + OH → H2O
W ten sposób następuje zakończenie łańcucha reakcji prowadzących od
substratów do produktu końcowego
1.2. Przebieg spalania wodoru
Źródło zapłonu
(np. iskra elektryczna) powoduje rozerwanie wiązań w
cząsteczce H2 i powstanie wolnych atomów H, które następnie reagują ze
stabilnymi cząsteczkami tlenu:
Każdy wolny rodnik wodorowy (wolny atom wodoru) wprowadzony do
mieszaniny wodoru z tlenem powoduje serię bardzo szybkich reakcji
chemicznych prowadzących do powstania dwóch cząsteczek wody, czyli
produktu końcowego reakcji wodoru z tlenem, oraz trzech nowych wolnych
atomów H, z których każdy może natychmiast zapoczątkować nowy łańcuch
reakcji.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
1.3. Przebieg spalania metanu
W przypadku spalania metanu także bardzo ważny jest etap rozgałęziania, czyli
reakcja H + O2 → OH + O, ale seria reakcji prowadząca do końcowych
produktów jest znacznie bardziej złożona. Około 100 pojedynczych reakcji
pośrednich uważa się za ważne. Poniżej przedstawiono kilka najważniejszych
etapów reakcji spalania metanu:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Przed powstaniem CO2 musi powstać stabilny produkt pośredni CO. Jeśli gazy
w płomieniu ochłodzą się przed całkowitą przemianą CO w CO2 na drodze
utlenienia przez OH, w produktach spalania pojawi się CO, nawet przy pełnym
dostępie powietrza z otoczenia.
1.4. Powstawanie sadzy przy spalaniu węglowodorów
Przy dyfuzyjnym spalaniu substancji zawierających węgiel, cząsteczki paliwa
mogą ulegać dekompozycji termicznej przed dotarciem do strefy utleniania.
Zachodzi szereg reakcji prowadzących do powstania coraz większych
cząsteczek i utworzenia aromatycznych węglowodorów policyklicznych,
prekursorów cząstek sadzy:
Reakcje prowadzące do powstawania sadzy przy dyfuzyjnym spalaniu metanu
przedstawiono poniżej:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
1.5. Oddziaływanie na przebieg procesów wolnorodnikowych
Ogólna szybkość reakcji spalania może być duża tylko przy odpowiednio dużym
stężeniu wolnych rodników. Wymaga to utrzymywania odpowiednio wysokiej
temperatury środowiska reakcji. Obniżenie temperatury gazowego środowiska
reakcji zmniejsza szybkość reakcji wolnorodnikowych, w tym szczególnie
istotnej reakcji rozgałęziania łańcucha:
H + O2 → OH + O,
co powoduje zmniejszenie ilości dostępnych wolnych rodników. Na szybkość
reakcji rozgałęziania można wpływać także poprzez zmniejszenie stężenia jej
substratów, czyli H i O2. Możliwości bardzo szybkiego znacznego zmniejszenia
stężenia tlenu są jednak ograniczone, natomiast można doprowadzić do
szybkiego ograniczenia ilości wolnych rodników przez wprowadzenie do
płomienia inhibitorów spalania. Przykładem mogą być tu halony zawierające
brom, proszki gaśnicze i aerozole gaszące. Wprowadzony do płomienia
bromotrifluorometan (CF3Br, halon 1301) szybko reaguje z wolnymi rodnikami
według następującego schematu:
CF3Br + H → CF3 + HBr
H + Br → H2 + Br
Br + H + M → HBr + M
Cząsteczka halonu reaguje z wolnym rodnikiem tworząc bromowodór, który
reaguje z następnym wolnym rodnikiem wytwarzając nieaktywną cząsteczkę i
atom bromu. Atom bromu reaguje znów z wolnym rodnikiem odtwarzając
cząsteczkę
bromowodoru.
W
ten
sposób
jedna
cząsteczka
CF3Br
zapoczątkowuje łańcuch reakcji prowadzący do przekształcenia w nieaktywne
cząsteczki wielu tysięcy wolnych rodników. Bromowodór powstający po
wprowadzeniu halonu zawierającego brom do płomienia jest więc katalizatorem
rekombinacji wolnych rodników.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
W
chwili
obecnej
halony
zostały
praktycznie
wycofane
z
ochrony
przeciwpożarowej ze względu na stwierdzone działanie niszczące ozon
stratosferyczny. W stratosferze zachodzi fotodysocjacja halonu:
CF3Br → CF3 + Br
Powstałe atomy bromu reagują z ozonem:
Br + O3 → BrO + O2.
BrO reagując z następną cząsteczką ozonu odtwarza się i łańcuch reakcji może
rozpocząć się od nowa:
BrO + O3 → Br + 2O2.
Ryzyko niszczenia ozonu stratosferycznego przez halony gaśnicze zawierające
chlor lub brom wzrasta w wyniku ich bardzo długiego czasu życia w atmosferze,
co znacznie zwiększa prawdopodobieństwo dotarcia do stratosfery. Takiego
ryzyka nie niesie ze sobą zastosowanie innych chemicznych inhibitorów
procesów spalania płomieniowego – proszków i aerozoli.
1.6. Oddziaływanie na przebieg procesów wymiany ciepła
Jeżeli proces spalania jest ustalony (szybkość wydzielania się ciepła i
temperatura produktów spalania nie zmienia się w czasie), dla jednostki
objętości płomienia i jednostki czasu można dokonać bilansu ciepła:
ciepło
wytworzone
w reakcjach
spalania
+
ciepło
wniesione
z
reagentami
Przy ustalonym procesie spalania
=
ciepło
odprowadz
one z
produktami
+
ciepło
wypromienio
wane i
przekazane
do paliwa
szybkość wydzielania się ciepła i jego
odprowadzania z płomienia równoważą się. Dla wycinka płomienia o objętości
∆V ograniczonego powierzchnią ∆S strumień ciepła wydzielającego się jako
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
wynik reakcji spalania qwy można zapisać jako iloczyn objętościowego efektu
cieplnego spalania, objętości wycinka i ogólnej szybkości reakcji spalania :
q wy = Qspal ⋅ ∆V ⋅ f (c pal , cO 2 ) ⋅ e
−
EA
R⋅T
Wydzielone ciepło jest odprowadzane przez powierzchnię ∆S na drodze
przewodzenia i promieniowania. Strumień ciepła odprowadzanego można
ogólnie zapisać jako:
[ (
]
)
qod = ∆S ⋅ ε ⋅ σ T 4 − Tot4 + k (T − Tot )
T i Tot oznaczają temperatury odpowiednio spalania i otoczenia płomienia, ε współczynnik emisyjności, σ – stała Stefana-Boltzmana, k – współczynnik
przenikania ciepła. Strumień ciepła odprowadzanego do otoczenia zależy więc
nieliniowo
od
temperatury.
Wprowadzając
zastępczy
współczynnik
przenoszenia ciepła K, obejmujący wszystkie mechanizmy wymiany, można
przedstawić strumień odprowadzany jako funkcję liniową:
1
qod
= ∆S ⋅ K ⋅ (T − Tot )
Analizę zależności qwy i qod od temperatury przedstawić można w formie
graficznej. Na wykresie zależności strumieni ciepła od temperatury stabilnym
warunkom spalania odpowiada taki punkt przecięcia linii qwy i qod, dla którego
przy niewielkich odchyleniach temperatury układ samoczynnie powraca do
stanu równowagi. Jeżeli w punkcie Tsp1 obniżymy temperaturę o niewielką
wartość ∆T, w nowej temperaturze T – ∆T strumień ciepła spalania jest większy
niż strumień ciepła odprowadzanego do otoczenia i układ powraca do stanu
równowagi. Jeżeli zwiększone odprowadzanie ciepła utrzymuje się, ustala się
nowa,
nieco
niższa
temperatura
równowagi.
Zwiększanie
szybkości
odprowadzania ciepła, na przykład przez działanie na płomień rozproszonymi
prądami wody, może spowodować zgaszenie dopiero po obniżeniu temperatury
spalania do takiej wartości, przy której dla każdego dalszego obniżenia
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
temperatury strumień ciepła spalania będzie zawsze mniejszy od strumienia
ciepła odprowadzanego. Taką temperaturę układu określa się jako temperaturę
krytyczną spalania lub minimalną temperaturę propagacji płomienia. Na
wykresie odpowiada do krzywej qod kr.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Szybkość podawania środka gaśniczego, przy której temperatura spalania spada
do temperatury krytycznej nazywamy krytyczną szybkością podawania, a w
przeliczeniu na powierzchnię pożaru – krytyczną intensywnością podawania.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Zgaszenie pożaru wymaga obniżenia temperatury poniżej temperatury
krytycznej, którą można oszacować dla spalania większości substancji
organicznych w powietrzu, jeśli przyjmie się szereg upraszczających założeń
dotyczących: minimalnego efektu cieplnego potrzebnego dla rozprzestrzeniania
się płomienia w powietrzu, średniej pojemności cieplnej produktów spalania
oraz udziału promieniowania w bilansie ciepła, jak to przedstawiono powyżej.
Oszacowanie minimalnego objętościowego efektu spalania na podstawie
dolnych granic wybuchowości daje wartości zbliżone do siebie, można więc
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
przyjąć, że (w pewnym oczywiści przybliżeniu) krytyczne temperatury spalania
są takie same dla większości materiałów palnych. Na ogół przyjmuję się wartość
1300 K (1000
o
C). Jeśli nie uwzględniać strat ciepła płomienia na
promieniowanie, otrzymujemy wartość 1600 K.
Obniżenie temperatury spalania do wartości krytycznej jest możliwe także na
drodze zmniejszenia szybkości wytwarzania ciepła w płomieniu przy takiej
samej szybkości odprowadzania ciepła. Na wykresie q – T odpowiada to
przesunięciu krzywej qwy w prawo przy nie zmienionym położeniu qod:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Czas gaszenia przy szybkości podawania środka gaśniczego równej krytycznej
szybkości podawania byłby nieskończony (ograniczony oczywiście ilością
materiałów palnych). Podawanie środka gaśniczego z krytyczną szybkością
oznacza więc dopiero kontrolowanie pożaru. Zgaszenie pożaru w skończonym
czasie wymaga szybkości podawania większych od krytycznej wartości dla
danego pożaru.
Niezależnie od tego, czy działanie gaśnicze polega na zmniejszeniu szybkości
wytwarzania ciepła przez pożar, czy na zwiększaniu szybkości odbierania
ciepła, każdemu działaniu gaśniczemu można przypisać określony efekt
gaśniczy wyrażany w jednostkach strumienia cieplnego (kW, MW). Możliwość
uzyskania kontroli lub zgaszenia pożaru przy gaszeniu przy użyciu danego
środka gaśniczego podawanego z określoną szybkością zależy od przebiegu
zależności strumień ciepła – czas dla danego przypadku oraz czasu podjęcia
działań.
1.7. Oddziaływanie na gazowe środowisko spalania
Na szybkość rozprzestrzeniania się płomienia w mieszaninie gazów wpływają,
poza rodzajem i stężeniem gazowego paliwa, stężeniem utleniacza i
temperaturą, także parametry fizykochemiczne ośrodka gazowego.
Jeśli płomień rozprzestrzenia się w jednorodnej mieszaninie gazu palnego (lub
par cieczy) z powietrzem, można założyć, że przed frontem płomienia znajduje
się nie spalona mieszanina, za frontem płomienia – produkty spalania, a prawie
cały wzrost temperatury gazu od początkowej temperatury mieszaniny To do
temperatury spalania Tsp zachodzi w cienkiej warstewce o grubości s.
Przykładem może być płomień kinetyczny palnika gazowego, gdzie strefa
spalania jest nieruchoma, ponieważ mieszanina gaz powietrze napływa z
szybkością równą szybkości spalania. Profil temperatury w mieszaninie gazowej
przedstawia rysunek:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Z jednostki powierzchni strefy spalania (frontu płomienia) do świeżej
mieszaniny przekazywany jest przez przewodzenie strumień ciepła qprzew:
q przew =
λ
⋅ (Tsp − To )
s
Ciepło to jest zużywane na nagrzewania świeżej mieszaniny napływajacej z
szybkością u do temperatury spalania. Jeśli gęstość mieszaniny wynosi ρ, a
ciepło właściwe cp, strumień ciepła odbierany przez mieszaninę wynosi:
qodb = u ⋅ c p ⋅ ρ ⋅ (Tsp − To )
Wynika z tego, że szybkość spalania można dla tego modelu przedstawić jako:
u=
λ
ρ ⋅cp ⋅ s
Szybkość spalania jest tym większa, im większy jest współczynnik dyfuzyjności
cieplnej (wyrównywania temperatur) a:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
a=
λ
ρ ⋅cp
Ciepło wydzielane w reakcji spalania jest podczas rozprzestrzeniania się
płomienia w mieszaninie gazowej zużywane do nagrzewania świeżej
mieszaniny i częściowo rozpraszane w otoczeniu. Od parametrów mieszaniny
zależy „wykorzystanie” ciepła reakcji spalania do podniesienia jej temperatury.
W przypadku większego ciepła właściwego mieszaniny (np. po wprowadzeniu
gazu gaśniczego) ta sama ilość ciepła spowoduje mniejszy przyrost temperatury.
2. Działanie gaśnicze stosowanych obecnie środków gaśniczych
2.1.Wymagania stawiane nowoczesnym środkom gaśniczym
Wymagania stawiane nowoczesnym środkom gaśniczym przez normy branżowe
oraz względy ekologiczne można w skrócie przedstawić następująco:
• duża skuteczność gaśnicza w stosunku do określonych grup pożarów
• możliwość zastosowania przy użyciu typowego sprzętu
• możliwość długiego przechowywania bez pogorszenia właściwości
(odporność na starzenie)
• brak działania toksycznego i ekotoksycznego oraz bioakumulacji
• łatwa asymilacja w środowisku, jeżeli środek w wyniku działań
gaśniczych przedostaje się do gleby lub wody
• dla środków gazowych także krótki czas życia w atmosferze
2.2. Ogólny podział środków gaśniczych
Stosowane współcześnie środki chemiczne stosowane do gaszenia pożarów
można podzielić na dwie grupy:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
• substancje dodawane do wody, zwiększające jej skuteczność gaśniczą i
rozszerzające zakres zastosowania – w tym przypadku działanie
gaśnicze przynajmniej częściowo polega na chłodzeniu. Powstające
roztwory wodne i piany gaśnicze działają powierzchniowo, ich
zapotrzebowanie podaje się w stosunku do powierzchni pożaru.
Roztwory wodne i piany mają najwyższą skuteczność w stosunku do
pożarów grup A i B, nie mogą być jednak stosowane do gaszenia
urządzeń pod napięciem elektrycznym oraz substancji niebezpiecznie
reagujących z wodą.
• środki stosowane samodzielnie, nie zawierające wody – mechanizm
działania gaśniczego jest inny niż chłodzenie. Działają
powierzchniowo lub przestrzennie – w tym przypadku
zapotrzebowanie podaje się w stosunku do kubatury pomieszczeń.
Mogą być stosowane do gaszenia urządzeń pod napięciem oraz
substancji reagujących z wodą, ale w większości przypadków nie są
skuteczne w stosunku do pożarów grupy A.
2.3. Chłodzące działanie gaśnicze
Mechanizmy gaśnicze oparte na chłodzeniu (odbieraniu strumienia ciepła przez
czynniki zewnętrzne w stosunku do pożaru) można podzielić następująco:
• zwiększanie strat ciepła spalania do otoczenia – na przykład przez
zastosowanie mgłowych prądów wody do chłodzenia strefy spalania
• zmniejszenie szybkości zasilania płomienia parami cieczy lub
produktami pirolizy materiału stałego – schładzanie powierzchni
cieczy lub ciała stałego prądami wody (czystej lub z dodatkami) lub
wyciekającym z piany roztworem
• niedopuszczenie do nagrzania się materiałów palnych do temperatury
pirolizy – schładzanie prądami wody materiałów narażonych na
działanie promieniowania cieplnego
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
2.4. Działanie gaśnicze nie oparte na chłodzeniu
Wśród mechanizmów nie opartych na chłodzeniu można wyróżnić:
• oddzielanie powierzchni cieczy lub ciał stałych od płomienia i
powietrza – piany gaśnicze oraz proszki ABC i D
• zabezpieczanie powierzchni cieczy lub ciał stałych przed
nagrzewaniem przez promieniowanie cieplne – piany gaśnicze
• wypieranie gazów z ograniczonych przestrzeni – piany średnie i lekkie
• antykatalityczne działanie na płomień – proszki BC i ABC,
bromopochodne węglowodorów (halony), aerozole gaszące. Działanie
to polega na znacznym przyspieszaniu rekombinacji wolnych
rodników (są to reaktywne fragmenty cząsteczek przenoszące energię
w łańcuchu reakcji chemicznych zachodzących w płomieniu) przez
odnawiający się składnik aktywny, którym w przypadku proszków BC
i aerozoli gaszących są atomy lub wodorotlenki metali alkalicznych w
stanie gazowym, w przypadku proszków ABC – powierzchnia
ziarenek, w przypadku halonów – bromowodór
• działanie rozcieńczające – obojętne gazy gaśnicze, fluoropochodne
węglowodorów. Działanie to polega na obniżaniu stężenia tlenu oraz
na takiej zmianie parametrów termofizycznych atmosfery (ciepło
właściwe, współczynnik przewodnictwa cieplnego, dyfuzyjność
cieplna), żeby w uzyskanej mieszaninie gazów nie mogło zachodzić
spalanie płomieniowe.
2.5. Środki stosowane jako dodatki do wody
Dodatki do wody zwiększają skuteczność wody podawanej prądami gaśniczymi
oraz w formie zrzutów lotniczych lub, jeśli zostanie zastosowany odpowiedni
sprzęt, umożliwiają powstawanie pian gaśniczych, które można traktować jako
oddzielny środek gaśniczy, chociaż w przypadku najczęściej stosowanych pian
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
ciężkich i średnich działanie chłodzące wyciekającego roztworu jest ważnym
czynnikiem gaśniczym.
Środki dodawane do wody można podzielić następująco:
• środki pianotwórcze – ich 1 – 6 % roztwory wodne umożliwiają
wytwarzanie gaśniczych
• środki zwilżające – ich 0,1 – 1 % dodatek znacznie zwiększa szybkość
wnikania wody w hydrofobowe materiały porowate
• dodatki zwiększające lepkość, zmniejszające szybkość parowania i
retardanty – stosowane głównie przy pożarach lasów.
2.6. Środki gaśnicze nie mające działania chłodzącego
Następujące środki gaśnicze nie są oparte na wodzie i nie mają działania
chłodzącego w stosunku do palącej się substancji (lub jeśli ono występuje, jest
nieistotne w porównaniu z zasadniczym mechanizmem gaśniczym):
• proszki gaśnicze – działają chemicznie, antykatalitycznie na płomień
(BC) oraz fizycznie, izolująco na powierzchnie płonących materiałów
stałych (ABC, D)
• aerozole gaszące – obecnie w użyciu są aerozole wytwarzane
pirotechnicznie, działają antykatalitycznie oraz rozcieńczająco
(działanie fizyczne)
• obojętne gazy gaśnicze – gazy nie oddziałujące chemicznie z
płomieniem, działają rozcieńczająco. Obecnie są stosowane azot,
argon, dwutlenek węgla oraz mieszaniny tych gazów
• halony – działają chemicznie, antykatalitycznie na płomień, w
niewielkim stopniu rozcieńczająco. Największe zastosowanie znalazły
CF3Br, CF2ClBr oraz C2F4Br2. Obecnie nie są stosowane
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
• zamienniki halonów – działają fizycznie, rozcieńczająco. Są to
chlorowcopochodne węglowodorów nie zawierające bromu, przede
wszystkim fluoropochodne, na przykład C3F8, C3F7H, C4F10, C6F14
Aerozole gaszące, oraz gazy gaśnicze (poza dwutlenkiem węgla) są z definicji
przeznaczone do użycia w zamkniętych pomieszczeniach i podawane są ze
stałych urządzeń gaśniczych. Dwutlenek węgla jest stosowany w gaśnicach
śniegowych. Cięższe halony (CF3ClBr oraz C2F4Br2) oraz ich zamienniki (na
przykład C6F14) nadają się do zastosowania w gaśnicach.
2.7. Zakres zastosowania chemicznych środków gaśniczych
Chemiczne środki gaśnicze mogą być stosowane zarówno w działaniach
gaśniczych prowadzonych przez jednostki straży pożarnych jak i w stałych
instalacjach gaśniczych oraz w podręcznym sprzęcie gaśniczym:
• Działania jednostek straży pożarnych – wykorzystywane są przede
wszystkim środki pianotwórcze, z których wytwarza się piany ciężkie i
średnie, rzadziej lekkie. Piany ciężkie i średnie stosowane są do głównie
gaszenia pożarów cieczy palnych, ale coraz częściej także w przypadku
pożarów grupy A. W specjalnych sytuacjach, w przypadku konieczności
gaszenia urządzeń pod napięciem elektrycznym lub substancji
reagujących z wodą czy stopionych ciał stałych, stosuje się także proszki
gaśnicze podawane z samochodów proszkowych
• Stałe urządzenia gaśnicze – stosowane są zarówno środki pianotwórcze, w
postaci koncentratów lub gotowych roztworów jak i pozostałe środki
chemiczne. Roztwory środków pianotwórczych i piany gaśnicze stosuje
się przede wszystkim przy zagrożeniach pożarami grupy B stwarzanych
przez duże ilości cieczy palnych, zarówno w pomieszczeniach jaki na
zewnątrz. Środki działające przestrzennie, gazy i aerozole gaszące,
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
stosowane są w zamkniętych przestrzeniach, zwłaszcza w przypadkach
konieczności bardzo szybkiego zgaszenia pożaru w obecności
działających urządzeń elektrycznych i elektronicznych; zapewniają one
także uniknięcie strat związanych z niszczącym działaniem wody.
• Gaśnice i agregaty – stosuje się w nich środki pianotwórcze (w postaci
gotowego roztworu wodnego oraz jako koncentrat w oddzielnym
zbiorniku wewnątrz gaśnicy), proszki gaśnicze oraz dwutlenek węgla.
Gaśnice proszkowe zapewniają bardzo szybkie ugaszenie płomienia,
działanie gaśnic pianowych jest wolniejsze, ale piana zapewnia
zabezpieczenie powierzchni cieczy po zgaszeniu płomienia. Stosowane są
także gaśnice ze specjalnymi roztworami do gaszenia pożarów gorących
tłuszczów i olejów w urządzeniach kuchennych.
3. Podstawowe kryteria wyboru środków gaśniczych
Wybór najbardziej efektywnego oddziaływania gaśniczego dla konkretnego
przypadku musi obejmować przede wszystkim cel działania (zgaszenie pożaru
lub zabezpieczenie przed jego powstaniem) oraz rodzaj pożaru. W tym
kontekście pomocna jest klasyfikacja pożarów w zależności od rodzaju
materiału palnego przedstawiona w Polskiej Normie PN-EN 2. Wprowadzenie
grup pożarów A, B, C i D pozwala na ogólny wybór odpowiednich dla danej
grupy oddziaływań gaśniczych.
Dla grupy pożarów A skuteczne gaszenie zapewnia na ogół oddziaływanie
chłodzące, zwłaszcza na materiał palny, ale właściwe może także okazać się
działanie oddzielające materiał od płomienia i dostępu powietrza. Pożary grupy
B zwykle można efektywnie ugasić przez odcięcie dopływu par cieczy do
płomienia, chociaż, w zależności od rodzaju cieczy i sytuacji, skuteczne może
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
być też oddziaływanie antykatalityczne, rozcieńczające i chłodzące. W
przypadku pożarów grupy C nie ma możliwości zmniejszenia przy pomocy
oddziaływania gaśniczego zasilania płomienia paliwem, skuteczne gaszenie
może zapewnić oddziaływanie antykatalityczne, rozcieńczające lub chłodzące.
Pożary metali należące do grupy D można zgasić odcinając dopływ powietrza za
pomocą warstwy izolującej wytrzymującej bardzo wysoką temperaturę spalania
metalu.
Działania gaśnicze skuteczne dla poszczególnych grup pożarów można
zrealizować za pomocą różnych środków gaśniczych, dlatego uwzględnienie
rodzaju materiału palnego można nazwać dopiero pierwszym poziomem wyboru
środków gaśniczych. Wybór konkretnego środka gaśniczego dla danego
przypadku musi być poprzedzony analizą pozostałych kryteriów efektywności,
przy czym należy wziąć pod uwagę:
o wielkość pożaru w chwili działania i szybkość jego rozwoju,
o szczegółową charakterystykę materiału palnego i warunków
spalania,
o dodatkowe zagrożenia (urządzenia pod napięciem, niebezpieczne
substancje chemiczne),
o praktycznie dostępne metody podawania środka,
o praktyczny czas podjęcia działań,
o skutki działań dla środowiska przyrodniczego.
Powyższe czynniki powinny być wzięte pod uwagę w każdym przypadku
planowania zastosowania środka gaśniczego, zarówno w przypadku gaśnic
przenośnych i przewoźnych, jak i stałych instalacji gaśniczych oraz działań
operacyjnych jednostek ratowniczo – gaśniczych.
Rozpatrzmy to na przykładzie grupy pożarów A. Pożar należący do grupy A
zawsze można skutecznie zgasić przez ochłodzenie materiału palnego. Na ogół
wystarczy zastosowanie prądów wody, jeśli jednak materiał palny jest
hydrofobowy, drobnoporowaty lub z innego powodu woda nie może dotrzeć do
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
całej objętej spalaniem powierzchni materiału, trzeba zastosować roztwór
środka zwilżającego, w postaci prądu rozproszonego lub piany o niewielkiej
liczbie spienienia. Jednym z przykładów są tu pożary opon samochodowych,
bardzo trudne do zgaszenia przy stosowaniu prądów czystej wody ze względu
na hydrofobowość materiału i jego przestrzenne ułożenie.
Dodanie do wody 1 – 2 % syntetycznego środka pianotwórczego i zwiększenie
stopnia rozproszenia prądu wody znacznie przyspiesza czas gaszenia takiego
pożaru. Jeszcze lepsze efekty przynosi zastosowanie piany ciężkiej z roztworu
środka typu S lub piany z urządzeń typu CAFS. Innym argumentem
przemawiającym za stosowaniem roztworów zwilżających lub pian przy
gaszeniu niektórych pożarów grupy A jest możliwość znacznego skrócenia
czasu działań i ograniczenia ilości ścieków popożarowych, które mogą zawierać
toksyczne substancje. W określonych sytuacjach skrócenie czasu działań może
przynieść obniżenie ich całkowitego kosztu, mimo zużycia pewnej ilości
drogich środków pianotwórczych. Trzeba jednak z kolei wziąć pod uwagę
negatywny wpływ zawartych w środkach pianotwórczych i zwilżających
detergentów na środowisko wodne,
Jeśli pożar jest niewielki, lub obejmuje urządzenia pod napięciem elektrycznym
czy niebezpiecznie reagujące z wodą substancje chemiczne, do gaszenia można
zastosować proszki gaśnicze. Odpowiednio podany strumień proszku typu
zarówno BC jak i ABC szybko zgasi płomienie pożaru grupy A.
Jednak przy zastosowaniu proszku BC, który ma wyłącznie działanie
antykatalityczne, płomień powraca natychmiast po zakończeniu podawania
środka. Proszek typu ABC także działa inhibicyjne w płomieniu, ale dodatkowo
reaguje na gorącej zwęglonej powierzchni palącego się materiału wytwarzając
warstwę oddzielającą utrudniającą wydostawanie się na zewnątrz lotnych
produktów rozkładu materiału, które mogłyby zasilać płomień, oraz
ograniczającą dostęp powietrza do strefy spalania bezpłomieniowego i rozkładu
termicznego. Można w ten sposób osiągnąć zgaszenie pożaru mimo
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
praktycznego braku działania chłodzącego. Warunkiem powodzenia jest jednak
takie podawanie proszku, żeby dotarł on do wszystkich powierzchni materiału
objętych spalaniem. Ten warunek jest trudny do spełnienia nawet przy dość
luźnej strukturze płonącego materiału, trzeba się więc liczyć z możliwością
nawrotu palenia po pewnym czasie. Stosowany w tym przypadku proszek ABC
powinien mieć także wysoką zawartość fosforanu monoamonowego, ponieważ
właśnie ten składnik zapewnia powstawanie warstwy oddzielającej.
Podobną analizę można przeprowadzić dla przypadku pożarów grupy B. Tutaj
także trzeba wziąć pod uwagę szczegółową charakterystykę stwarzających
zagrożenie w danym przypadku cieczy palnych. Małe pożary wszystkich cieczy
palnych można szybko zgasić przy użyciu proszków gaśniczych, zarówno typu
BC jak i ABC. Możliwe jest też skuteczne zastosowanie silnie rozproszonych
prądów wody oraz, w pomieszczeniach, gazów gaśniczych. Jeśli jednak pożar
ma większe rozmiary, szybko się rozprzestrzenia lub zachodzi konieczność
zabezpieczenia rozlewiska przed ponownym zapaleniem, należy zastosować
piany gaśnicze. Wybór rodzaju środka pianotwórczego, typu piany i sposobu
podawania zależy przede wszystkim od właściwości cieczy, ale trzeba także
wziąć pod uwagę warunki spalania (płytkie lub głębokie rozlewisko, pożar
cieczy w zbiorniku, pożar cieczy wypływającej, na przykład z rurociągu).
Szybkie gaszenie pożarów rozlewisk niskowrzących cieczy węglowodorowych
zapewnia piana ciężka wytwarzana z roztworów wodnych środków typu AFFF,
a nawet roztwory tych środków podawane bez napowietrzania, jako prąd
rozproszony. Wysoką efektywność gaszenia osiąga się dzięki tworzeniu przez
roztwór zawierający perfluorowane środki powierzchniowo czynne cienkiej
warstewki („filmu wodnego”) na powierzchni paliwa. Jeśli jednak mamy do
czynienia z rozlewiskiem cieczy o charakterze polarnym (alkohole, ketony,
estry, itp.), nie ma możliwości powstania filmu wodnego, a sama piana jest
silnie niszczona w kontakcie z cieczą. Zgaszenie pożaru cieczy polarnej przez
pokrycie jej powierzchni pianą jest możliwe, jeśli zastosuje się do sporządzania
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
roztworu pianotwórczego specjalne alkoholoodporne środki pianotwórcze
(noszą one oznaczenia AR, APS lub ATC).
Piany tworzące film wodny mogą zawodzić także przy gaszeniu pożarów wyżej
wrzących cieczy węglowodorowych, których powierzchnia osiąga temperaturę
przekraczającą około 70 oC. W kontakcie z powierzchnią o takiej temperaturze,
jeżeli nie zostaje ona szybko obniżona, film wodny nie powstaje. W takich
warunkach można zastosować piany o podwyższonej odporności termicznej, na
przykład ze środków typy FP lub FFFP. Innym ograniczeniem dla pian typu
AFFF są pożary cieczy wypływającej lub tryskającej pod ciśnieniem. W takich
warunkach decydujący o ich skuteczności film wodny także nie powstaje.
W przypadku pożaru wewnętrznego, w czasie trwania I fazy pożaru
(kontrolowanej przez paliwo) zwykle następuje ciągły wzrost szybkości
wydzielania ciepła aż do rozgorzenia (flashover) w którym środowisko pożaru
osiąga II fazę (kontrolowaną przez wentylację) z maksymalną wartością
szybkości wydzielania ciepła. Podczas I fazy pożar może być tłumiony w
wyniku działania systemu gaśniczego w budynku (np. tryskacze) lub interwencji
straży pożarnej (podania środka gaśniczego). Straż pożarna może również
interweniować w II fazie pożaru po rozgorzeniu.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Qwk
oznacza
szybkość
wydzielania
ciepła
w
warunkach
pożaru
kontrolowanego przez wentylację, Qgasz jest szybkością wydzielania ciepła w
momencie podania środka gaśniczego i Qkontr oznacza maksymalną szybkość
wydzielania ciepła przy której pożar może być kontrolowany przy danym
sposobie gaszenia i intensywności podawania srodka..
Skuteczność działania środków gaśniczych zależy od :
wielkość pożaru w czasie zadziałania systemu gaśniczego w
budynku lub w czasie pierwszego natarcia,
rodzaj systemu gaśniczego lub rodzaj działań podjętych przez
jednostki straży,
geometria chronionej lub gaszonej przestrzeni,
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
obszar oddziaływania systemu (środka) gaśniczego.
Skuteczność gaszenia pożaru przez straż pożarną zależy od:
wielkości pożaru przy pierwszym natarciu,
ilości prądów gaśniczych
wyposażenia interweniujących jednostek.
Na podstawie powyższych czynników powinno dokonać się oszacowania:
maksymalnej szybkości wydzielania się ciepła
powierzchni pożaru,
które jeszcze mogą być kontrolowane przez straż pożarną. Jeżeli straż
przeprowadzi pierwsze natarcie poniżej granicy ( Qkontr), można założyć, że
pożar zostanie ugaszony lub uzyska się nad nim kontrolę.
Jeśli jednak gaszenie zostanie podjęte później, pożar pozostanie poza kontrolą
dopóki szybkość wydzielania ciepła nie opadnie poniżej tej granicy.
Efekty podjętych działań gaśniczych zależą od fazy rozwoju pożaru:
a). Pożar ugaszony.
Podanie środka gaśniczego zmniejsza szybkość wydzielania ciepła praktycznie
do zera w ciągu krótkiego czasu od kilkudziesięciu sekund (urządzenia
tryskaczowe) do kilku sekund (gazowe systemy gaśnicze). Przebieg gaszenia
zależy od rodzaju instalacji gaśniczej. Gazowe instalacje gaśnicze muszą być
zaprojektowane tak, aby zgaszenie nastąpiło w ciągu kilku sekund, co wynika z
działania gaśniczego gazów.
b). Pożar kontrolowany.
Zastosowanie środka gaśniczego hamuje wzrost szybkości wydzielania ciepła i
pożar pali się ze stałą szybkością.
c). Pożar niekontrolowany.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
System gaśniczy zawodzi. Podanie środka gaśniczego nie hamuje wzrostu
szybkości wydzielania ciepła. Gaszenie nie będzie skuteczne, jeśli szybkość
wydzielania ciepła przez pożar przy rozpoczęciu podawania przewyższa
maksymalną szybkość wydzielania ciepła Qkontr przy której pożar może jeszcze
być kontrolowany lub ugaszony przez system gaśniczy lub działania straży.
Jeśli pierwsze natarcie straży pożarnej lub aktywacja systemu gaśniczego
nastąpi po tym czasie, szybkość wydzielania ciepła będzie większa od Qkontr.
Możliwa jest wtedy jedynie częściowa kontrola pożaru.
Oszacowanie szybkości wydzielania ciepła w pożarze pozwala ocenić
nieprzekraczalny czas podjęcia działań przez jednostki straży pożarnej lub
nieprzekraczalny czas aktywacji systemu gaśniczego. Oceny takie zakładać
muszą określoną skuteczność zastosowanej metody gaszenia pożaru i środka
gaśniczego.
• Zastosowanie skuteczniejszych metod gaszenia oznacza możliwość jego
zgaszenia lub uzyskania kontroli po dłuższym czasie rozwoju pożaru.
• Skuteczniejszy środek gaśniczy może być z powodzeniem zastosowany
nawet po przekroczeniu przez rozwijający się pożar wartości Qkontr
obliczonej dla standardowej metody gaszenia.
• W przypadku pożarów wewnątrz budynków wartość Qkontr zależy przede
wszystkim od stopnia wykorzystania podanej wody do chłodzenia
materiałów palnych i gazów w pomieszczeniu.
Jeżeli potencjalne możliwości chłodzące środka gaśniczego wykorzystane w
większym stopniu do chłodzenia materiałów palnych, można przewidywać
podwyższenie wartości Qkontr, a więc także możliwość zgaszenia pożaru przy
wyższych Qgasz. Ten cel można osiągnąć na przykład przez:
stosowanie właściwie zaprojektowanych urządzeń tryskaczowych
zapewniających odpowiedni rozkład wielkości kropel wody
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
szczególnie dobre efekty przynosi jednak dopiero całkowicie inny
sposób podawania środka chłodzącego – na przykład w postaci
strumienia piany z urządzeń CAFS.
4. Gaszenie przez całkowite wypełnianie
Wypełnianie pomieszczenia (całkowite wypełnianie) – operacja polegająca na
wytworzeniu założonego stężenia gazu gaśniczego w całej objętości
pomieszczenia.
Skuteczne stężenia gazu gaśniczego (stężenia projektowe) – stężenia
inertujące, wyznaczone z obszaru palności paliwo-powietrze-gaz gaśniczy lub
stężenia gaszące, wyznaczone metodą palnika.
Przyjęte oznaczenia:
V [m3] – objętość wypełnianego pomieszczenia
ν [m3/kg] – objętość właściwa gazu gaśniczego
c [% obj.] – stężenie objętościowe gazu gasniczego
cO2 [% obj.] – stężenie objętościowe tlenu
τ [min] – czas
VS [m3/min] – strumień objętościowy gazu gaśniczego
VW [m3/min] – strumień objętościowy wentylacji
m [kg] – całkowite zużycie gazu gaśniczego
W [kg/m3] – zapotrzebowanie środka liczone na jednostkę objętości
pomieszczenia
Zapotrzebowanie gazu niezbędne do osiągnięcia w pomieszczeniu założonego
stężenia można obliczyć, przyjmując następujące założenia:
• bardzo szybkie mieszanie się gazu z powietrzem,
• stałość temperatury i ciśnienia podczas wypełniania,
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
• określony model mieszania się gazu z powietrzem wewnątrz
pomieszczenia,
oraz zakładając określoną wartość stężenia skutecznego gazu c i znając objętość
właściwą gazu gaśniczego w temperaturze wypełniania. Z dokładnością nie
mniejszą niż 5 % objętość właściwą gazu można obliczyć przekształcając
równanie stanu gazu doskonałego do postaci:
R ⋅T
ν=
M⋅p
gdzie: R – stała gazowa, T [K] – temperatura, M [kg/kmol] – masa molowa
gazu, p – ciśnienie w pomieszczeniu. Jeśli ciśnienie podstawiamy w atmosferach
fizycznych, wartość stałej gazowej wynosi 0,08205 m3·atm/kmol·K. Dla gazów
gaśniczych będących mieszaninami i składników w stężeniach xi i o masach
molowych Mi, można do obliczeń objętości właściwej użyć średniej masy
molowej, obliczanej jako:
M = ∑ xi ⋅ M i
i
Modele wypełniania pomieszczeń:
1. Wypełnianie bez strat środka
Gaz miesza się z częścią powietrza w pomieszczeniu wypychając nadmiar
powietrza. Cała objętość podanego gazu jest zużywana na przyrost stężenia.
Podczas wypełniania z pomieszczenia wypływa powietrze.
(przykład : bardzo szybkie rozładowanie instalacji w niewielkim pomieszczeniu
z dyszy umieszczonej po przeciwnej stronie niż wylot gazów; niskie stężenia
gazu)
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
2. Jednokrotny wypływ gazów po wymieszaniu
Gaz miesza się z całym powietrzem w pomieszczeniu, po wymieszaniu z
pomieszczenia wypływa nadmiar mieszaniny gazu z powietrzem.
(przykład : bardzo szybkie rozładowanie instalacji w niewielkim pomieszczeniu
z dyszy umieszczonej centralnie, niskie stężenia gazu)
3. Wentylacja naturalna
W miarę mieszania się gazu z powietrzem, przez cały czas podawania, z
pomieszczenia wypływa mieszanina gazu z powietrzem o rosnącym stężeniu
(przykład : podawanie gazu do dużego pomieszczenia; wysokie stężenia gazu)
4. Wentylacja wymuszona
W miarę mieszania się gazu z powietrzem, przez cały czas podawania, z
pomieszczenia wypływa mieszanina gazu z powietrzem o rosnącym stężeniu.
Podczas podawania środka do pomieszczenia dopływa powietrze.
(przykład : podawanie gazu do dużego pomieszczenia przy działającej
wentylacji nawiewnej; wysokie stężenia gazu).
4.1. Obliczanie zapotrzebowania dla modelu bez strat.
Gaz gaśniczy dopływa do pomieszczenia o objętości V z szybkością
objętościową Vs. Po upływie czasu τ do pomieszczenia dostarczono objętość
gazu równą Vs·τ. W tym samym czasie z pomieszczenia wypłynęła taka sama
ilość powietrza, co powoduje, że ciśnienie w pomieszczeniu nie zmienia się.
Stężenie objętościowe środka gaśniczego w pomieszczeniu po upływie czasu
podawania τ wynosi więc:
Vs ⋅ τ
c=
V
Tą samą objętość Vs·τ gazu gaśniczego można wyrazić jako iloczyn masy i
objętości właściwej m·ν, po podstawieniu :
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
m ⋅ν
c=
V
Po uwzględnieniu, że stosunek masy wprowadzonego gazu do objętości
pomieszczenia nazywamy zapotrzebowaniem środka W i przekształceniu
otrzymujemy zależność dla modelu nr 1:
c
W1 =
ν
Ponieważ w tym modelu zakłada się brak strat środka gaśniczego, obliczone
według niego zapotrzebowanie można nazwać minimalnym teoretycznym
zapotrzebowaniem środka gaśniczego.
4.2. Obliczanie zapotrzebowania dla modelu jednokrotnego wypływu
W tym modelu zakłada się, że objętość Vs·τ podanego gazu miesza się z całą
objętością powietrza w pomieszczeniu V i następnie z pomieszczenia wypływa
nadmiar mieszaniny gazu z powietrzem (o objetości takiej samej, jak objętość
podanego gazu) o takim samym stężeniu, jak stężenie mieszaniny pozostałej w
pomieszczeniu. Stężenie gazu obliczamy jako:
Vs ⋅ τ
c=
V + Vs ⋅ τ
Po wprowadzeniu zapotrzebowania ( Vs ⋅τ =m·ν) i przekształceniu otrzymujemy:
c
W2 =
ν (1 − c)
Zapotrzebowania W2 obliczone dla modelu II będą więc zawsze wieksze od
minimalnych teoretycznych zapotrzebowań W1.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
4.3. Obliczanie zapotrzebowania dla modelu wentylacji naturalnej
Podawaniu do pomieszczenia gazu z szybkością objętościową Vs towarzyszy
jednoczesny wypływ z pomieszczenia mieszaniny gazu z powietrzem o
rosnącym stężeniu. Stężenie gazu w pomieszczeniu także rośnie w miarę
podawania i jest takie samo, jak w strumieniu wylotowym.
Jeśli w pewnym momencie podawania stężenie w pomieszczeniu (i na wylocie)
wynosi c(τ), do po upływie różniczkowego czasu dτ do pomieszczenia
dodatkowo wpłynie objętość Vs· dτ gazu, z czego Vs· c(τ)· dτ opuściło
pomieszczenie. Jeśli w tym samym, różniczkowym czasie, stężenie gazu w
pomieszczeniu wzrosło o dc, to bilans środka można zapisać jako:
Vs ⋅ dτ = Vs ⋅ c(τ )dτ + V ⋅ dc(τ )
Jeśli strumień objętościowy środka jest stały, stężenie gazu w pomieszczeniu
zależy tylko od czasu i równanie bilansowe można przekształcić do postaci:
Vs
dc Vs
+ ⋅c − = 0
dτ V
V
Rozwiązanie tego równania przy warunku początkowym c = 0 dla τ = 0 daje
wynik:
Vs
c = 1 − exp − ⋅ τ
V
Po wprowadzeniu zapotrzebowania ( Vs ⋅τ =m·ν) i przekształceniu otrzymujemy:
c = 1 − exp (− W ⋅ν )
4.4. Obliczanie zapotrzebowania dla modelu wentylacji wymuszonej
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Założenia modelu są takie same, jak w przypadku wentylacji naturalnej,
dodatkowo zakłada się doprowadzanie do pomieszczenia powietrza w czasie
podawania gazu gaśniczego (w wypełnianym gazem pomieszczeniu działa cały
czas wentylacja nawiewna). Równanie bilansu środka przyjmuje dla takiego
przypadku postać:
Vs ⋅ dτ = Vw ⋅ c(τ )dτ + V ⋅ dc(τ )
gdzie Vw oznacza objętościową szybkość wentylacji pomieszczenia. Jeśli
strumienie objętościowe środka gaśniczego i wentylacji są stałe w czasie, bilans
można przekształcić do równania różniczkowego analogicznie, jak w modelu
III. Rozwiązanie równania ma postać:
Vs
c=
Vw
Vw
1 − exp − V ⋅ τ
Z powyższego rozwiązania wynika, że przy ustalonych wartościach strumienia
objętościowego środka i strumienia wentylacji, niezależnie od czasu podawania
gazu nie można będzie przekroczyć wartości stężenia gazu równej stosunkowi
Vs/Vw.
5. Skutki ekologiczne stosowania środków gaśniczych
5.1. Gazy gaśnicze
Odkrycie niebezpiecznego wpływu na warstwę ozonu chlorowcopochodnych
węglowodorów sprawiło, że gazy stosowane do gaszenia i inertowania
poddawane są obecnie bardzo wnikliwej ocenie. Najważniejsze stosowane
wskaźniki opisujące szkodliwe działanie gazów gaśniczych, związane z
toksycznością i negatywnym wpływem na atmosferę, zestawiono poniżej:
LC50 – Lethal Concentration50 – stężenie powodujące śmierć 50 % populacji
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
badanych zwierząt laboratoryjnych;
ALC – Approximate Lethal Concentration – przybliżone stężenie śmiertelne –
stężenie powodujące śmierć całej populacji badanych zwierząt;
NOAEL – No Observed Adverse Effect Level – najwyższe stężenie substancji,
przy którym nie zaobserwowano niekorzystnych skutków wpływu na
organizm;
LOAEL – Lowest Observed Adverse Effect Level – najniższe stężenie
substancji, przy którym zaobserwowano niekorzystne skutki wpływu na
organizm;
GWP – Global Warming Potential – potencjał globalnego ocieplenie klimatu –
wskaźnik liczony na 100 lat w stosunku do wzorca: CO2 = 1;
ODP – Ozone Depletion Potential – potencjał niszczenia ozonu
stratosferycznego w stosunku do Freonu 11 lub 12, dla których wskaźnik
ten równa się 1;
ALT – Atmospheric Life Time – czas życia w atmosferze;
W tabeli poniżej zestawiono najważniejsze parametry dla gazów obojętnych,
halonów i ich zamienników. Stężenia gaszące płomień w palniku dyfuzyjnym Cg
są podane w % objętościowych.
Wszystkie obecnie brane pod uwagę perfluorowane zamienniki halonów,
chociaż nie mają niszczącego wpływu na warstwę ozonową, mają wysokie
wartości GWP i długie czasy życia w atmosferze. Poprawę tych parametrów
można uzyskać pozostawiając jeden atom wodoru w cząsteczce (FM-200) lub
wprowadzając do cząsteczki grupy funkcyjne zwiększające podatność substancji
na degradację w atmosferze (Novec 1230 – CF3CF2COCF(CF3)2). Warto
zauważyć, że jedynym gazem gaśniczym o szerokim zastosowaniu i znacznej
toksyczności jest CO2. Wszystkie zamienniki halonów mają niską toksyczność,
jednak podczas gaszenia nimi pożaru mogą powstawać toksyczne produkty
rozkładu (HF).
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Nazwa
Skład
Cg LC50 ALC
[%] [%]
[%]
ODP
GWP
ALT
[lat]
Gazy obojętne
Azot
N2
34
–1)
–
nie dotyczy
Argon
Ar
38
–
–
nie dotyczy
CO2
24
10
–
Ar / N2
28
–
–
nie dotyczy
Ar/N2/CO2 29
–
–
nie dotyczy
Dwutlenek
węgla
Argonite
Inergen
0
1
–
Halony
Halon 1211
CF2ClBr
3,2
–
28
4
–
–
Halon 1301
CF3Br
2,9
–
83
13
5600
65
Halon 2402
C2F4Br2
2,2
–
8,5
–
–
–
Zamienniki halonów
FE – 13
CHF3
12,0
–
> 65
0
11700
264
CEA – 410
C4F10
5,9
> 80
–
0
7000
2600
CEA – 308
C3F8
7,3
> 11 > 81
0
–
–
CEA – 614
C6F14
4,0
> 80
–
0
–
–
FM – 200
C3HF7
5,8
–
> 80
0
2900
36,5
Novec 1230
C6F9O
5,0
>10
–
0
1
0,2
1)
„– ” oznacza brak danych
5.2. Piany i środki pianotwórcze
Piany wytwarzane w sposób tradycyjny powstają z roztworów środków
pianotwórczych o stężeniach 2 ÷ 6 %. Nowoczesne techniki wytwarzania pian i
nowoczesne środki pianotwórcze umożliwiają wytwarzanie pian z roztworów o
stężeniach 0,2 ÷ 2 %.
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Środki pianotwórcze wszystkich stosowanych obecnie typów zawierają
następujące składniki:
1. Substancje pianotwórcze
• substancje powierzchniowo – czynne pochodzenia naturalnego (białkowe)
– w środkach pianotwórczych typu P, FP, FFFP i proteinowych typu AR;
• detergenty syntetyczne – w środkach pianotwórczych typu S, A i
syntetycznych typu AR;
• detergenty syntetyczne fluorowane i perfluorowane – w środkach
pianotwórczych typu AFFF, FFFP, FP i typu AR tworzących film wodny.
2. Rozpuszczalniki organiczne
• alkohole – etylowy, propylowy, izopropylowy, butylowy, izobutylowy
• glikoetery – butylokarbitol, butylocellosolv
• stabilizatory piany
• wyższe alkohole ( C10 ÷ C14 )
• amoniakalne kompleksy soli kwasów tłuszczowych
3. Dodatki ułatwiające wzajemną rozpuszczalność składników
• mocznik
• toluenosulfonian sodu, ksylenosulfonian sodu
4. Dodatki obniżające temperaturę krzepnięcia
• glikole: etylenowy, propylenowy, heksylenowy
5 .Inhibitory korozji
Ze względu na zawartość w koncentracie i właściwości, istotny wpływ na
środowisko mają substancje powierzchniowo – czynne i rozpuszczalniki
organiczne.
Wpływ pian na środowisko trzeba rozpatrywać jako wpływ roztworów środków
pianotwórczych, z których piany te zostały wytworzone. Wpływ środków
pianotwórczych na środowisko zależne jest od ich stężenia w wodzie. W
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
czystych koncentratach syntetycznych znajduje się od kilku do dwudziestu
procent substancji powierzchniowo – czynnych i do 30 % rozpuszczalnika
organicznego. W roztworach o stężeniu 3 % znajduje się do 6 g substancji
powierzchniowo – czynnej w litrze i do 9 g rozpuszczalnika organicznego. Są to
stosunkowo wysokie stężenia (badania nad rozkładem biochemicznym
detergentów prowadzi się dla roztworów o stężeniach 0,5 ÷ 1 g/l). Przy użyciu
nowoczesnych technik piany wytwarza się z roztworów o stężeniach 0,2 ÷ 1,0
%, co odpowiada stężeniom czystych detergentów 0,4 ÷ 2 g/l.
Wpływ określonej substancji chemicznej na środowisko określa jej toksyczność
i biodegradowalność. Środki pianotwórcze są mało toksyczne dla zwierząt. Dla
najbardziej toksycznych środków typu S i AFFF dawka LD50 = 2 ÷ 5 g/kg (LD50
– dawka na kilogram masy ciała, która powoduje śmierć 50 % populacji
badanych zwierząt).
Dla roślin środki pianotwórcze są mało szkodliwe w roztworach o niskich
stężeniach (rzędu 0,5 %). Mogą powodować zahamowanie wzrostu jednych
roślin i przyspieszenie wzrostu innych. Przy wyższych stężeniach, w krótkim
czasie widać wyraźne różnice w wyglądzie roślin potraktowanych pianami w
porównaniu z próbą kontrolną. Wyraźnie mniej szkodliwe są środki proteinowe
– P, FP i FFFP.
Zdecydowanie negatywny wpływ mają środki pianotwórcze na organizmy
wodne. Toksyczne stężenia środków pianotwórczych typu S i A dla najbardziej
wrażliwych organizmów wodnych (pstrąg, rozwielitka) zaczynają się już od
7 ppm (LC50/96h – stężenie substancji w wodzie powodujące śmierć50 %
badanej populacji w ciągu 96 godzin ).
Toksyczność poszczególnych grup środków pianotwórczych w stosunku do
organizmów wodnych maleje od środków detergentowych do proteinowych:
S i A > AFFF > P > FP > FFFP
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
Szkodliwość
środków
pianotwórczych
dla
organizmów
wodnych
charakteryzowana jest także wskaźnikiem EC50 – jest to stężenie w wodzie
wywołujące
u
50
%
organizmów
wodnych
szczególną
reakcję (np.
znieruchomienie rozwielitki) lub 50 % redukcję czynności życiowych (np.
zahamowanie wzrostu alg). Dla środków pianotwórczych typu S EC50 osiąga
wartości 50 ÷ 100 ppm.
Wskaźnikami charakteryzującymi zdolność do rozkładu w środowisku są:
ChZT – chemiczne zapotrzebowanie tlenu – maksymalne, teoretyczne
zapotrzebowanie tlenu niezbędne do pełnej mineralizacji (przeprowadzenie w
produkty nieorganiczne) danego związku organicznego. ChZT wyznacza się
doświadczalnie lub oblicza teoretycznie na podstawie równania reakcji spalania.
BZT – biochemiczne zapotrzebowanie tlenu – niezbędna do rozkładu substancji
ilość tlenu pobrana ze środowiska. BZT wyznacza się doświadczalnie. W
nieskończenie długim czasie BZT = ChZT. Zwykle oznacza się BZT5 lub
BZT20 – biochemiczne zapotrzebowanie tlenu po 5 i 20 dniach.
Stopień
rozkładu
biochemicznego
zależny
jest
od
budowy
chemicznego. Dla substancji łatwo rozkładalnych biochemicznie
związku
stosunek
BZT20/ChZT > 0,5 ÷ 0,7. Związki powierzchniowo – czynne, znajdujące się
typowych środkach pianotwórczych typu S i A należą do najłatwiej
rozkładalnych biochemicznie. Ich stopień rozkładu wynosi 70 ÷ 100 %.
Najtrudniej
rozkładalne
są
związki
z
perfluorowanymi
łańcuchami
węglowodorowymi, znajdujące się w środkach pianotwórczych typu AFFF i
FFFP. Związki z niecałkowicie fluorowanym łańcuchem rozkładają się łatwiej,
ale znacznie trudniej niż liniowe detergenty węglowodorowe.
Rozpuszczalniki i dodatki, znajdujące się w środkach pianotwórczych
rozkładają się stosunkowo łatwo (za wyjątkiem toluenowych i ksylenowych
substancji hydrotropowych). Szybkość rozkładu biochemicznego zależy od
stężenia substancji i temperatury – zmniejsza się ze wzrostem stężenia i wzrasta
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
w wyższej temperaturze.
Szybkość rozkładu charakteryzuje wskaźnik BZT5 – jednocześnie jest to
wskaźnik chwilowego obciążenia ścieków lub akwenów.
5.3. Przenikanie środków pianotwórczych do środowiska
Podczas działań gaśniczych środki pianotwórcze mogą bezpośrednio dostawać
się do środowiska. Na ogół piany lub roztwory trafiają do gruntu – istnieje
wtedy możliwość skażenia wód gruntowych, a także możliwość wymywania z
gruntu nierozpuszczalnych w wodzie skażeń chemicznych i skażenia nimi wód
gruntowych. Z tego względu niewskazane jest polewanie miejsca podania piany
nadmiarem wody.
Piana lub roztwór trafiający do cieków wodnych może spowodować chwilowe,
lokalne obciążenie – następuje szybkie rozcieńczenie, tym szybsze, im większa
szybkość
przepływu
wody.
W
przypadkach
dostania
się
roztworów
pianotwórczych do wód stojących zachodzi zazwyczaj możliwość poważnego
zakłócenia ekosystemu, zależnie od wielkości skażenia.
Na terenach skanalizowanych, zależnie od ilości środków pianotwórczych, które
dostały się do kanalizacji może dojść nawet do poważnego zakłócenia pracy
oczyszczalni ścieków. W Anglii obowiązuje przepis, że substancja łatwo
rozkładalna biochemicznie (BZT5/ChZT > 0,65) może być skierowana do
kanalizacji po rozcieńczeniu wodą w stosunku 1 : 250.
5.4. Czynniki wpływające na zagrożenie środowiska pianami
Takim czynnikiem jest przede wszystkim wysokie stężenie roztworu środka
pianotwórczego, które powoduje:
• zmniejszenie szybkości biodegradacji;
• wzrost niszczącego oddziaływania na rośliny;
• zwiększenie rozmiarów skażenia wód;
• obciążenie oczyszczalni ścieków;
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
• wzrost poziomu skażeń ubocznych.
Wytworzenie stężenia roztworu o stężeniu innym niż robocze jest zwykle
spowodowane niesprawnością urządzeń dozujących środek pianotwórczy.
Jednak zbyt niskie w stosunku do roboczego stężenie środka pianotwórczego
powoduje pogorszenie jakości piany, co może powodować wydłużenie czasu
gaszenia,
a
przez
to
wzrost
skażenia.
Także
niesprawność
sprzętu
pianotwórczego i jego wady powodują wytworzenie piany o niższej liczbie
spienienia, co może przedłużyć czas akcji i zwiększyć skażenie.
Innym czynnikiem jest niewłaściwa taktyka działania:
• Niepotrzebne podanie piany
• Niewłaściwie dobrany środek pianotwórczy
• Niewłaściwy dobór intensywności podawania piany
• Niewłaściwa technika podawania piany
Zbyt duża intensywność powoduje niepotrzebne obciążenie środowiska i straty
środka pianotwórczego. Zbyt mała intensywność wydłuża czas gaszenia lub nie
zapewnia ugaszenia.
Czynnikiem zwiększającym zagrożenie może być także niska temperatura
otoczenia. Niska temperatura wody może spowodować spadek zdolności
pianotwórczej, a przez to wydłużyć czas akcji. W niskiej temperaturze
zmniejsza się także szybkość rozkładu biochemicznego.
W celu przeciwdziałania szkodliwym skutkom użycia pian należy wziąć pod
uwagę:
• Dbałość o sprawność wszystkich elementów pianowej linii gaśniczej;
• Wprowadzanie nowych technik wytwarzania i podawania pian;
• Przemyślane stosowanie pian w działaniach ratowniczych (unikać
niepotrzebnego stosowania pian);
• Podnoszenie poziomu wyszkolenia strażaków w zakresie taktyki
gaszenia pianami;
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
• Poszukiwanie nowych receptur środków pianotwórczych, działających
przy możliwie niskich stężeniach roboczych;
• Poszukiwanie innych skutecznych i proekologicznych sposobów
zwalczania pożarów.
6. Przykłady obliczeniowe
6.1. Obliczanie zapotrzebowania wody
1. Jaki strumień ciepła może odebrać strumień wody o temperaturze początkowej 15 oC
podawany z szybkością 400 dm3/min, jeżeli 40 % wody nie dociera do strefy pożaru,
pozostała część wody w 50 % odparowuje a w 50 % ogrzewa się do temperatury
końcowej 70 oC. Ciepło parowania wody przyjąć 2257 kJ/kg, ciepło właściwe 4,19
kJ/kg⋅K.
Jeśli 40 % wody nie dociera do strefy pożaru, to ogólny współczynnik wykorzystania
wody ww = 0,6. Współczynnik odparowania wo = 0,5, czyli połowa wody docierającwej
do pożaru ogrzewa się do 100 oC i odparowuje, a połowa tylko ogrzewa się do
temperatury 70 oC. Ciepło odbierane przez odparowującą wodę można zapisać:
q par = ww wo G (∆H + c p (100 − 15)) .
Woda, która nie odparowuje, a tylko ogrzewa się do temperatury 70 oC odbiera ciepło:
q ogrz = w w G (1 − w o )c p (70 − 15 )
Łączny strumień ciepła odbieranego przez wodę wyniesie więc:
[
]
q = wwG wo ∆H + wo c p (100 − 15) + (1 − wo )c p (70 − 15) =
400
(0,5 ⋅ 2257 + 0,5 ⋅ 4,19 ⋅ 85 + 0,5 ⋅ 4,19 ⋅ 55) = 4(1128,5 + 178,1 + 115,2) = 5687kW
= 0,6 ⋅
60
2. Obliczyć, jaki największy strumień ciepła może odebrać woda podawana z
szybkością 200 kg/min. Temp. początkowa wody to = 15 oC, ciepło parowania w
temp. 100 oC ∆Hpar = 2257 kJ/kg, ciepło właściwe cp = 4,19 kJ/kg·deg.
Strumień ciepła odbierany przez wodę będzie największy, jeśli cała podawana woda będzie
ogrzewała się do 100 oC i odparowywała (wykorzystanie i odparowanie wody wynosi 100 %):
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
ww = wo = 1
Maksymalna szybkość odbierania ciepła przez wodę podawaną z szybkością 200 kg/min
wynosi więc:
q max = 1 ⋅
200
(1⋅ 2257 + 1⋅ 4,19 ⋅ 85) = 3,333(2257 + 356,2) = 8710kW
60
3. Jaką objętość zajmie para wodna powstała przez całkowite odparowanie 100 kg
wody i ogrzanie pary do temperatury 227 oC?
Objętość określonej masy gazu lub pary zależy od ciśnienia i temperatury. Zakładamy, że
ogrzewana para wodna może swobodnie zwiększać objętość pod ciśnieniem atmosferycznym.
Przy temperaturze T = 273 + 227 = 500 K i pod ciśnieniem p = 1 atm (atmosfera fizyczna)
Objętość n moli pary wodnej obliczymy z równania stanu gazu doskonałego:
pV = nRT ,
gdzie R jest stałą gazową wynoszącą 8,31 J/mol·K. Dla uniknięcia przeliczania jednostek
podstawimy stałą gazową jako 0,082 m3·atm/kmol·K. Liczbę moli pary wodnej podstawimy
jako:
n=
m
,
M
gdzie m oznacza masę pary a M jest jej masą molową. Ostatecznie:
V =
mRT 100 ⋅ 0,082 ⋅ 500
=
= 227,8m 3
18 ⋅1
Mp
4. Jaki wzrost ciśnienia nastąpi w pomieszczeniu o objętości 100 m3 po odparowaniu w
nim 100 kg wody i ogrzaniu pary wodnej do 227 oC?
Podobnie jak poprzednio do obliczeń zastosujemy równanie stanu gazu, wiążące ze sobą
ciśnienie, temperaturę i objętość określonej masy gazu. Zakładamy, że początkowe ciśnienie
w pomieszczeniu wynosiło 1 atm, oraz, że pomieszczenie jest szczelne. Dodatkowe ciśnienie
wytworzone przez parę wodną wynosi:
p=
mRT 100 ⋅ 0,082 ⋅ 500
=
= 2,28atm .
MV
18 ⋅100
Ciśnienie w pomieszczeniu wzrośnie więc do 3,28 atm.
6.2. Obliczanie zapotrzebowania środka pianotwórczego
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
1. Obliczyć ilość środka pianotwórczego Deteor 1000M (stężenie robocze 3%) potrzebną do
wytworzenia warstwy piany o grubości 20 cm w zbiorniku o średnicy 20 m, jeśli sprzęt
pianotwórczy podaje pianę o Ls = 15.
•
Obliczamy objętość piany w warstwie:
πd 2
3,14 ⋅ 20 2
h=
• V piany = S ⋅ h =
⋅ 0,2 = 62,8m 3
4
4
• Obliczamy objętość roztworu pianotwórczego potrzebną do wytworzenia tej objętości
piany, jeśli liczba spienienia wynosi 15:
V piany 62,8
• Vroztw =
=
= 4,19m 3
LS
15
• Obliczamy objętość środka pianotwórczego potrzebnego do wytworzenia 4,19 m3
roztworu:
• Vśrodka = crobocze ⋅ Vroztw = 0,03 ⋅ 4,19 = 0,126 m 3 = 126 dm 3
2. Obliczyć czas wytwarzania 20 cm warstwy piany w zbiorniku o średnicy 20 m przy
użyciu dwóch działek DWP-24 podających pianę o Ls = 15.
•
Objętość warstwy piany w zbiorniku wynosi:
πd 2
3,14 ⋅ 20 2
h=
⋅ 0,2 = 62,8m 3
4
4
• Do wytworzenia tej objętości piany potrzebna była objętość roztworu:
V piany 62,8
Vroztw =
=
= 4,19m 3
LS
15
• Wydajność nominalna działka DWP-24 wynosi 2400 dm3/min, więc cza podawania 4,19
m3 roztworu wyniósł:
V
4,19
czas = roztw =
= 0,873 min = 52,4s
2 ⋅ 2,4 4,8
V piany = S ⋅ h =
3. Krytyczną intensywność podawania wody prądem rozproszonym dla pożarów grupy A
można ocenić na 0,3 dm3/m2 min. Jaka jest największa powierzchnia pożaru tej grupy,
który można na pewno ugasić przy użyciu dwóch prądów wody 150 dm3/min?
•
Podawanie środka gaśniczego z intensywnością krytyczną pozwala tylko na
kontrolowanie pożaru (patrz wykres czas gaszenia – intensywność podawania; czas
gaszenia przy Ikryt jest nieskończenie długi). Zgaszenie pożaru w określonym czasie
wymaga większej niż krytyczna intensywności podawania środka. Dla rozproszonych
prądów wody należy przyjąć praktyczną intensywność podawania przynajmniej
dziesięciokrotnie wyższą:
Iprakt = Ikryt · 10 = 0,3 · 10 = 3 dm3/m2·min
•
Podając wodę z szybkością 300 dm3/min możemy więc zgasić pożar o powierzchni:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
F=
*
Vwody
I prakt
=
300
= 100 m2
3
4. Krytyczna intensywność podawania piany typu AFFF przy gaszeniu pożaru oleju
napędowego wynosi 2,0 dm3(roztw.)/m2 min. Jaka jest największa powierzchnia
rozlewiska oleju, przy której można być pewnym zgaszenia tego pożaru, jeśli
dysponujemy dwoma prądami pianowymi z prądownic PP 2/15?
•
Podawanie środka gaśniczego z intensywnością krytyczną pozwala tylko na
kontrolowanie pożaru (patrz wykres czas gaszenia – intensywność podawania; czas
gaszenia przy Ikryt jest nieskończenie długi). Zgaszenie pożaru w określonym czasie
wymaga większej niż krytyczna intensywności podawania środka. Dla prądów piany typu
AFFF należy przyjąć praktyczną intensywność podawania co najmniej 4 dm3/m2·min
(patrz skrypt „Zastosowanie pian do gaszenia pożarów“, str. 74 – 76), a więc maksymalna
powierzchnia rozlewiska wynosi:
*
2 ⋅ Vroztw
2 ⋅ 200
F=
=
= 100 m2
4
I prakt
5. Obliczyć grubość warstwy piany, którą można wytworzyć w zbiorniku o powierzchni 300
m2, mając do dyspozycji samochód gaśniczy z 2,5 m3 wody i 100 dm3 środka
pianotwórczego Roteor (stężenie robocze 3 %) oraz prądownice PP 2/15.
•
Wykorzystanie 100 dm3 koncentratu środka stosowanego przy stężeniu 3 % pozwala
wytworzyć 3333 dm3 roztworu, a więc potrzebna ilość wody wynosiłaby 3233 dm3. W
danym przypadku ilość wykorzystanego koncentratu środka pianotwórczego, przy
całkowitym zużyciu wody z samochodu, można obliczyć na podstawie definicji stężenia
objętościowego c:
Vśrodka
c=
,
Vwody + Vśrodka
a po przekształceniu:
0,03
c
Vśrodka = Vwody ⋅
= 2500 ⋅
= 77,3 dm3
1− c
1 − 0,03
•
Objętość roztworu pianotwórczego, jaką można podać, wynosi więc 2577,3 dm3. Mając
do dyspozycji syntetyczny środek pianotwórczy, można przyjąć, że piana osiąga
nominalną dla zastosowanych prądownic liczbę spienienia 15. Wtedy objętość
wytworzonej piany wyniesie:
V piany = Ls ⋅ Vroztw = 15 ⋅ 2577,3 = 38659,5 dm3 = 38,66 m3.
Grubość warstwy piany w zbiorniku o powierzchni S = 300 m2 wyniosłaby:
h=
V piany
S
=
38,66
= 0,129 m = 12,9 cm.
300
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
•
W warunkach rzeczywistych liczba spienienia pian wytwarzanych z roztworów środków
syntetycznych przy użyciu prądownic podanego typu rzadko przekracza 10. Bezpieczniej
jest więc przyjąć objętość piany równą 10 · 2,5773 = 25,77 m3. W ty przypadku grubość
warstwy piany wyniosłaby:
V piany 25,77
h=
=
= 0,086 m = 8,6 cm.
S
300
6. Jaką powierzchnię rozlewiska oleju opałowego można pokryć 10 cm warstwą piany z
prądownic PP 2/15 dysponując samochodem gaśniczym z 3,0 m3 wody i 150 dm3 środka
pianotwórczego typu FP (stężenie robocze 6 %)?
•
150 dm3 środka przy zachowaniu stężenia 6 % obj. pozwala na uzyskanie
Vroztw =
Vśrodka 150
=
= 2500 dm3 = 2,5 m3 roztworu.
0,06 0,06
W tym przypadku wody wystarczy do całkowitego wykorzystania środka pianotwórczego.
•
Przy zastosowaniu środka typu FP nie można założyć, że powstająca piana osiąga
nominalną liczbę spienienia 15. W warunkach rzeczywistych liczba spieniania w tym
przypadku rzadko przekracza 6. Objętość piany należy więc obliczyć:
V piany = Ls ⋅ Vroztw = 6 ⋅ 2,5 = 15 m3
powierzchnia rozlewiska, którą można pokryć 10 cm warstwa piany wynosi więc:
S=
V piany
h
=
15
= 150 m2.
0,1
6.3. Obliczanie zapotrzebowania gazu gaśniczego
1. Obliczyć minimalne zapotrzebowanie w kg gazu CF3CHFCF3 (zamiennik halonu), do
wytworzenia w pomieszczeniu o kubaturze 200 m3 stężenia 7 % obj. przy temperaturze
23 oC. Masa molowa gazu M = 170 kg/kmol.
•
Minimalne zapotrzebowanie gazu potrzebne do osiągnięcia założonego stężenia c
odpowiada wypełnianiu bez strat, cała ilość gazu pozostaje w pomieszczeniu. Minimalne
zapotrzebowanie liczone na jednostkę objętości pomieszczenia obliczamy z zależności
wyprowadzonej dla modelu bez strat jako:
c
Wmin = = c ⋅ ρ
υ
•
Gęstość gazu o masie molowej 170 kg/kmol obliczamy na podstawie zależności
wyprowadzonej z prawa gazów doskonałych:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
ρ=
•
1⋅170
p⋅M
=
= 7,00 kg/ m3
R ⋅ T 0,082 ⋅ 296
Minimalne zapotrzebowanie gazu dla danej kubatury obliczamy jako iloczyn Wmin i
objętości pomieszczenia:
mmin = Wmin ⋅ V = c ⋅ ρ ⋅V = 0,07 ⋅ 7,00 ⋅ 200 = 98,06 kg.
2. Jakie największe stężenie gazu CF3CHFCF3 (zamiennik halonu) można uzyskać w
pomieszczeniu o kubaturze 200 m3 przy temperaturze 23 oC, zużywając 150 kg gazu?
Masa molowa gazu M = 170 kg/kmol.
•
Największe stężenie odpowiada pozostaniu całej ilości gazu w pomieszczeniu, czyli
wypełnianiu bez strat. stężenie objętościowe obliczymy jako:
c=
•
V pomieszcz
=
m ⋅υ
200
Objętość właściwą gazu o masie molowej 170 kg/kmol obliczamy na podstawie
zależności wyprowadzonej z prawa gazów doskonałych:
υ=
•
V gazu
R ⋅ T 0,082 ⋅ 296
=
= 0,143 m3/kg
p⋅M
1 ⋅170
Maksymalne stężenie przy wprowadzeniu 150 kg gazu do pomieszczenia o objętości 200
m3 wyniesie więc:
150 ⋅ 0,143
cmax =
= 0,107 = 10,7 %
200
3. Gęstość dwutlenku węgla w warunkach wypełniania pomieszczenia o kubaturze 500 m3
wynosi 1,8 kg/m3. Obliczyć zapotrzebowanie gazu w kg dla modelu wentylacji
swobodnej, jeśli trzeba uzyskać stężenie 35 % obj.
•
Zapotrzebowanie liczone na jednostkę objętości dla modelu wentylacji swobodnej
(naturalnej) wyprowadzamy z zależności stężenia od czasu wypełniania:
c = 1− e
•
Vs ⋅τ
V
= 1 − e −W ⋅υ
Po przekształceniach otrzymamy:
W=
•
−
1
1
1
⋅ ln
= ρ ⋅ ln
υ
1− c
1− c
Całkowite zużycie środka w kg wyniesie:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
m = V ⋅ W = V ⋅ ρ ⋅ ln
1
1
= 500 ⋅1,8 ⋅ ln
= 387,7 kg
1− c
1 − 0,35
4. Gęstość gazu C4F10 w warunkach wypełniania pomieszczenia o kubaturze 200 m3
wynosi 9,5 kg/m3. Obliczyć zapotrzebowanie gazu w kg dla modelu jednokrotnego
wypływu, jeśli trzeba uzyskać stężenie 8 % obj.
•
Zapotrzebowanie liczone na jednostkę objętości dla jednokrotnego wypływu wynosi:
W=
•
c
ρ ⋅ c 9,5 ⋅ 0,08
=
=
= 0,826 kg/m3.
υ (1 − c ) 1 − c 1 − 0,08
Całkowite zapotrzebowanie dla pomieszczenia o objętości 200 m3 wynosi:
m = W ⋅ V = 200 ⋅ 0,826 = 165,2 kg.
5. Obliczyć stosunek minimalnego zapotrzebowania Wmin dwutlenku węgla (gęstość 1,8
kg/m3, stężenie projektowe 34 % obj.) oraz C4F10 (gęstość 9,5 kg/m3, stężenie projektowe
7 % obj.).
•
Zapotrzebowanie minimalne, czyli obliczone przy założeniu braku strat środka, obliczamy
jako:
c
Wmin = = c ⋅ ρ
υ
•
Stosunek zapotrzebowania CO2 do zapotrzebowania C4F10 wynosi więc:
WCO 2 CCO 2 ⋅ ρ CO 2 0,34 ⋅1,8
=
=
= 0,92
WCF
CCF ⋅ ρ CF
0,07 ⋅ 9,5
6. Gęstość dwutlenku węgla w warunkach wypełniania pomieszczenia o kubaturze 2000
m3 wynosi 1,8 kg/m3, a gęstość CF3CHFCF3 7,0 kg/m3. Ile razy większe będzie
zapotrzebowanie CO2 (stężenie projektowe 34 % obj.) od zapotrzebowania CF3CHFCF3
(stężenie projektowe 7 % obj.), dla modelu jednokrotnego wypływu?
•
Zapotrzebowanie liczone na jednostkę objętości dla modelu jednokrotnego wypływu
wynosi:
W=
•
c
ρ ⋅c
=
υ (1 − c ) 1 − c
Stosunek zapotrzebowania CO2 do zapotrzebowania CF3CHFCF3 obliczamy jako:
Materiały do wykładu „Środki gaśnicze i neutralizujące” USM 19
WCO 2 ρ CO 2 ⋅ cCO 2 ⋅ (1 − cCF ) 1,8 ⋅ 0,34 ⋅ 0,93
=
=
= 1,76
WCF
ρ CF ⋅ cCF ⋅ (1 − cCO 2 ) 7,0 ⋅ 0,07 ⋅ 0,66