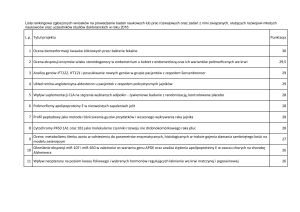
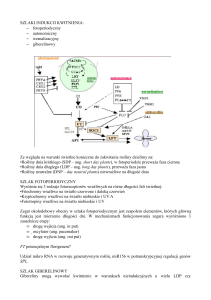
Uploaded by
weronika.wiktor3
Biologia Medyczna: Skrypt dla Studentów Lekarskich

Uniwersytet Medyczny w Łodzi Katedra Biologii i Mikrobiologii Medycznej Zakład Biomedycyny i Genetyki BIOLOGIA MEDYCZNA SKRYPT DLA STUDENTÓW KIERUNKU LEKARSKIEGO PRACA ZESPOŁOWA POD REDAKCJĄ: prof. dr hab. Ewy Brzeziańskiej-Lasoty Łódź, 2022 praca zespołowa pod redakcją: Ewy Brzeziańskiej-Lasoty, redaktor edytorski: Justyna Kiszałkiewicz Recenzenci: prof. dr hab. Gerard Drewa dr hab. Justyna Gatkowska Autorzy: dr hab. Joanna Błaszkowska, prof. UM1 prof. dr hab. Ewa Brzeziańska-Lasota2 dr Karolina Henryka Czarnecka-Chrebelska2 mgr Magdalena Dzikowiec2 dr Katarzyna Góralska1 dr Agnieszka Jaskółowska1 dr Katarzyna Khalid2 dr Justyna Kiszałkiewicz2 mgr Jolanta Kryczka2 dr Barbara Modrzewska2 mgr Justyna Olszewicz2 dr hab. Dorota Pastuszak-Lewandoska3 dr Anna Wójcik2 1Zakład Biologii i Parazytologii, Katedra Biologii i Mikrobiologii Medycznej, Uniwersytet Medyczny w Łodzi 2Zakład Biomedycyny i Genetyki, Katedra Biologii i Mikrobiologii Medycznej, Uniwersytet Medyczny w Łodzi 3Zakład Mikrobiologii i Laboratoryjnej Immunologii Medycznej, Katedra Biologii i Mikrobiologii Medycznej, Uniwersytet Medyczny w Łodzi ISBN 978-83-67198-15-8 Spis treści WSTĘP Część: Ekologia medyczna z elementami parazytologii i mykologii Ćwiczenie 1 Organizm żywy jako układ regulacji. Czynniki abiotyczne i biotyczne. ................................................ 7 Ćwiczenie 2 Wybrane organizmy o znaczeniu medycznym. ................................................................................. 31 Ćwiczenie 3 Aerosfera jako źródło czynników patogennych dla człowieka. Wektory chorób inwazyjnych obecne w aerosferze.............................................................................................................................................................. 53 Ćwiczenie 4 Hydrosfera i litosfera jako źródła czynników patogennych dla człowieka. ......................................... 73 Ćwiczenie 5 Środowisko domowe oraz żywność jako źródło czynników patogennych dla człowieka. .................. 92 Część: Biologia molekularna z elementami biotechnologii Ćwiczenie 1 Mikrobiota człowieka i czynniki wpływające na jej modyfikację ....................................................... 121 Ćwiczenie 2 Diagnostyka parazytologiczna i mykologiczna dawniej i dziś. ......................................................... 135 Ćwiczenie 3 Hodowle komórkowe – kluczowe narzędzie medycyny eksperymentalnej...................................... 156 Część: Genetyka medyczna Ćwiczenie 1 Genetyka mendlowska - wybrane cechy allelomorficzne i układy grupowe krwi. ............................ 171 Ćwiczenie 2 Chromosomy i cechy sprzężone z płcią. ......................................................................................... 198 Ćwiczenie 3 Mutacje genowe i chromosomowe. ................................................................................................. 215 Ćwiczenie 4 Cechy wieloczynnikowe. ................................................................................................................. 229 Ćwiczenie 5 Wybrane zagadnienia genetyki populacji. ....................................................................................... 252 ZAŁĄCZNIKI ....................................................................................................................................................... 270 WSTĘP “The biology is theoretic basement of medicine, that why it is important to study biology for future doctor…” Prof. O.Y.L. Bekish, 2003 Biologia medyczna jest wielodyscyplinarną nauką z obszaru biologii i medycyny. W badaniach i opisywaniu zjawisk, w zależności od profilu, korzysta z osiągnięć biochemii, biofizyki, biotechnologii, toksykologii czy biologii molekularnej. Znajduje zastosowanie nie tylko w medycynie ale także w ochronie zdrowia. Skrypt przeznaczony jest przede wszystkim dla studentów kierunku lekarskiego, ale również i dla innych kierunków medycznych. Wiedza i umiejętności zdobyte podczas nauczania biologii medycznej będą przydatne w praktyce medycznej. Ważnym elementem nauczania z zakresu biologii medycznej jest zwrócenie uwagi na metody eksperymentalne, które wykorzystuje się w badaniach funkcji układów biologicznych, ich molekularnych i biochemicznych podstaw funkcjonowania jak i podstaw diagnostyki chorób u człowieka. Skrypt zawiera trzy działy edukacji medycznej z zakresu: ekologii medycznej z elementami parazytologii i mykologii, podstaw biologii molekularnej z elementami biotechnologii oraz genetyki medycznej. W zakresie nauczania ekologii medycznej, opisane są biologiczne układy regulacji warunkujące zdrowie człowieka jak i stany zaburzenia homeostazy organizmu związane z chorobą. Opisano także czynniki abiotyczne i biotyczne wpływające na stan zdrowia człowieka. W tej części zwrócono uwagę na znaczenie problematyki parazytologicznej i mykologicznej w praktyce medycznej, opisując najczęściej występujące pasożyty u człowieka, ich wektory oraz wywołane przez nie choroby inwazyjne. Scharakteryzowano morfologię i fizjologię grzybów chorobotwórczych. Zajęcia z tego obszaru, są także okazją do poznania morfologicznych postaci rozwojowych pasożytów a także zasad diagnostyki niektórych, często spotykanych w praktyce medycznej gatunków. W części ekologicznej omówiono również znaczenie medyczne wybranych organizmów, pochodzenia roślinnego i zwierzęcego; zwracając szczególną uwagę na ich udział w etiopatogenezie chorób człowieka jak i ich wykorzystanie farmaceutyczne. W ramach nauczania biologii medycznej, istotne jest omówienie działania na organizm człowieka mykotoksyn i jadów zwierzęcych. Ma to znaczenie z punktu widzenia praktyki lekarskiej, szczególnie praktyki lekarza rodzinnego, mającego najczęściej pierwszy kontakt z pacjentem poszukującym pomocy medycznej. Zajęcia z biologii medycznej są także okazją do poznania przez przyszłego lekarza praktyka, środowiska zewnętrznego jako podstawowego źródła czynników patogennych dla człowieka. Istotne jest omówienie organizmów patogennych związanych z domem, jako środowiskiem życia człowieka oraz występujących w żywności – ich diagnostyka, chorobotwórczość, transmisja w środowisku. W kolejnej części ćwiczeń z zakresu biologii medycznej, zaplanowane zostało omówienie wpływu mikrobioty na zachowanie homeostazy organizmu jak i zjawiska dysbiozy jako czynnika w patogenezie wybranych chorób u człowieka. Szczególnie lekarz praktyk powinien mieć świadomość i dzielić się wiedzą z pacjentem, jak istotne znaczenie mają czynniki środowiskowe (styl życia, dieta; zanieczyszczenie środowiska i żywności) w utrzymaniu zdrowia. Kolejne ćwiczenia są poświęcone wybranym zagadnieniom z zakresu nanobiotechnologii medycznej, gdzie zostały omówione struktury o rozmiarach nanometrycznych oraz osiągnięcia tkankowej bioinżynierii materiałowej stosowane we współczesnej diagnostyce medycznej i terapii. Przybliżono także niektóre z rozwijających się metod molekularnej biologii medycznej, które są obecnie wykorzystywane w diagnostyce medycznej, w tym metodę amplifikacji kwasów nukleinowych, techniki immunohistochemiczne, mikromacierze ekspresyjne, analizy polimorfizmu sekwencji DNA; SNP (ang. single nucleotide polymorphism), czy sekwencjonowanie genomowe. Również w ramach ćwiczeń z biologii medycznej przybliżono zagadnienia z zakresu genetyki klasycznej oraz populacyjnej. Omówiono zasady dziedziczenia cech monogenowych: I i II prawo Mendla, jak i wybrane choroby autosomalne monogenowe, układy grupowe krwi czy genetyczne podstawy krwiolecznictwa. Zdefiniowano przeciwciała monoklonalne i ich zastosowanie. Tematy te rozszerzono w ramach wykładów. W ramach części genetyka, prowadzona jest także samodzielna analiza rodowodów, omawiane są zasady ich tworzenia i zastosowania. Studenci mają możliwość samodzielnego rozwiązywania zadań genetycznych: cechy monogenowe, grupy krwi, analiza rodowodów. Zajęcia z biologii medycznej pogłębiają wiedzę opartą na doświadczeniu, prowokując do samodzielnego myślenia przyczynowo-skutkowego, co ma niezwykle istotne znaczenie w praktyce lekarskiej. Ewa Brzeziańska-Lasota Część Ekologia medyczna z elementami parazytologii i mykologii Ćwiczenie 1 Temat: Organizm żywy jako układ regulacji. Czynniki abiotyczne i biotyczne. Omówienie regulaminów zajęć, bezpieczeństwa i higieny pracy oraz zasad mikroskopowania. Doświadczenia 1. Układ regulacji niestabilnej oparty na sprzężeniu zwrotnym dodatnim - komórka Traubego 2. Wybrane metody oceny sprawności układu regulacji - próba Ruffiera 3. Wpływ czynników abiotycznych na organizmy żywe - obserwacja czynności serca Daphnia sp. Obserwacja 1. Teratogenne działanie czynników chemicznych na organizm kręgowca Gallus sp.: a) skrzyżowany dziób i jednooczność po działaniu błękitem trypanu - prep. makr. utrw. w 4 % formalinie b) rozszczep powłok brzusznych po działaniu inhibitorem trypsyny wyizolowanym z Ascaris suum prep. makr. utrw. w 4 % formalinie c) niewciągnięty pęcherzyk żółtkowy po działaniu inhibitorem trypsyny wyizolowanym z Ascaris suum - prep .makr. utrw. w 4 % formalinie Zakres materiału do przygotowania przed zajęciami Podstawowe pojęcia ekologii medycznej (wymagana znajomość terminów z zakresu wiedzy szkoły średniej): - populacja, biocenoza, ekosystem, biom, biosfera, biotop, ontocenoza; - czynniki biotyczne i abiotyczne środowiska, czynnik ograniczający, tolerancja ekologiczna, eurybionty, stenobionty; - zależności (interakcje) wewnątrzgatunkowe i międzygatunkowe; - łańcuch troficzny, producenci, konsumenci, reducenci; produktywność poziomów troficznych, przepływ energii, krążenie materii, cykle biogeochemiczne, piramidy ekologiczne: biomas, liczebności, energii (produkcji); sukcesja pierwotna i wtórna; zanieczyszczenia; antropopresja; Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Układy regulacji – sprzężenie ujemne i dodatnie. Układ żywiciel-pasożyt. Metody analizy wpływu czynników abiotycznych na populacje. Ustrój człowieka jako układ regulacji – przykłady regulacji (utrzymanie stałego pH krwi, stężenia glukozy we krwi, proces krzepnięcia i trawienia; komórka Traubego – regulacja na zasadzie sprzężenia dodatniego). Ocena sprawności układu regulacji – testy obciążeniowe: wysiłkowe, kryteria rozpoznania cukrzycy - doustny test tolerancji glukozy. Ustrój człowieka jako układ regulacji ultrastabilnej – wytrenowanie, aklimatyzacja. Standardy jakości dla związków chemicznych obecnych w żywności (ADI, NOEL, DL50, CL50). Temperatura i woda jako czynniki ograniczające wzrost/rozwój organizmów („zero biologiczne”, reguła van`t Hoffa, anabioza (vita minima), liofilizacja). Czynniki fizyczne i chemiczne ograniczające występowanie mikroorganizmów (sterylizacja i dezynfekcja; rodzaje).Teratologia (dysmorfologia) – czynniki teratogenne, embriopatia alkoholowa (FAS), wady rozwojowe. 7 CZĘŚĆ TEORETYCZNA Organizm żywy jako układ regulacji Przetwarzanie i przenoszenie informacji Wszystkie zmiany zachodzące, zarówno w środowisku zewnętrznym, jak i wewnętrznym człowieka odbierane są przez receptory, w których zachodzi przetwarzanie danych i przekazywanie ich w sposób analogowy, cyfrowy lub mieszany. Przekaz analogowy Przetwarzanie, a następnie przenoszenie informacji w sposób ciągły (analogowy) odbywa się np. za pośrednictwem hormonów. W jednym narządzie, stanowiącym generator sygnałów, np. gruczole dokrewnym, wytwarzane są związki chemiczne (hormony) przenoszone za pośrednictwem krwi i układu sercowo-naczyniowego do innych narządów, na które oddziałują. Przykład - oddziaływanie treści pokarmowej dwunastnicy na trzustkę: 1. bodziec – kwaśna treść pokarmowa w dwunastnicy; 2. komórka wydzielnicza błony śluzowej (wydzielanie sekretyny); 3. sekretyna krążąca we krwi; 4. trzustka (część zewnątrzwydzielnicza) pobudzona przez sekretynę; 5. sok trzustkowy (ilość soku trzustkowego wydzielanego w jednostce czasu jest proporcjonalna do stężenia krążącej we krwi sekretyny). Przekaz cyfrowy Przetwarzanie, a następnie przenoszenie informacji w sposób cyfrowy (skokowy, impulsowy) zachodzi np. we włóknach nerwowych. Receptory przetwarzają odebrane informacje ze środowiska zewnętrznego lub wewnętrznego organizmu na impulsy przewodzone przez włókna nerwowe. Poszczególne impulsy nerwowe przewodzone przez to samo włókno nie różnią się między sobą. Informacja zakodowana jest w częstotliwości, z jaką impulsy przewodzone są przez włókno nerwowe. Przykład – generowanie impulsu nerwowego przez bodziec mechaniczny: 1. bodziec – ucisk na skórę; 2. receptor – ciałka blaszkowate (Paciniego) w skórze; 3. impulsy nerwowe dośrodkowe; 4. ciało komórki nerwowej; 5. impulsy nerwowe odśrodkowe – efektor. Przekaz analogowo – cyfrowy Przetwarzanie, a następnie przenoszenie informacji w sposób analogowo-cyfrowy występuje w przypadku, kiedy odebraną informację cyfrową komórka nerwowa zamienia na informację analogową w postaci zmian potencjału elektrycznego błony neuronu. Następnie ta sama komórka wysyła informację cyfrową do innych komórek nerwowych. Przykład - stymulacja wydzielania wazopresyny poprzez wzrost ciśnienia osmotycznego osocza: 1. bodziec - wzrost ciśnienia osmotycznego osocza, spadek objętości krwi; 2. osmoreceptor podwzgórza - impulsy nerwowe; 3. impulsy nerwowe – egzocytoza (uwolnienie) wazopresyny z przysadki (syntezowana przez neurony podwzgórza - neurosekrecja, magazynowana w tylnym płacie przysadki); 4. wazopresyna krążąca we krwi. 8 Działanie układu regulacji Każdy żywy organizm jest swoistym układem regulacji, którego celem jest zachowanie homeostazy. Warunkiem utrzymania stanu równowagi wewnętrznej jest wytworzenie i sprawne działanie układów regulacyjnych: kontrolujących, przetwarzających informacje i przywracających prawidłowe funkcje komórek, tkanek, narządów i układów. Proces sterowania wymaga przepływu informacji: przebieg sygnału następuje w dwóch kierunkach (rycina 1): 1) od układu regulującego do układu regulowanego – przepływ informacji jednokierunkowy (sterowanie w otwartym układzie regulacji) – rycina 2; 2) od układu regulowanego do regulującego - sygnał sprzężenia zwrotnego (sterowanie w zamkniętym układzie regulacji) - rycina 3, rycina 4 R - układ regulujący; Ur - układ regulowany; Sr - sygnał regulowany Rycina 1. Schemat przepływu informacji. Układ regulujący (sterujący) Układ regulowany (sterowany) Rycina 2. Przepływ informacji jednokierunkowy – kontrola jednokierunkowa. Układ regulujący generuje informacje odbierane przez układ regulowany. Układ regulowany Układ regulujący Komparator Sprzężenie zwrotne Rycina 3. Przepływ informacji zwrotny - sprzężenie zwrotne. Układ regulujący generuje informacje odbierane przez układ regulowany. Informacja wysyłana przez układ regulowany (dzięki sprzężeniu zwrotnemu) trafia do komparatora układu regulującego. Mechanizmy homeostazy – sprzężenie zwrotne W organizmie człowieka układy odpowiedzialne za stałość środowisk wewnętrznych działają głównie na zasadzie sprzężenia zwrotnego ujemnego, chociaż w warunkach fizjologicznych niektóre mogą funkcjonować na bazie sprzężenia zwrotnego dodatniego. 9 Komparator (sygnał normy) Zakłócenie Sygnał błędu Efektor Parametr kontrolowany Receptor Rycina 4. Schemat sprzężenia zwrotnego. Sprzężenie zwrotne ujemne pomiędzy układem regulującym (sterującym) i regulowanym (sterowanym) zapewnia stabilność funkcji fizjologicznych poprzez minimalizowanie sygnału błędu (powrót wartości regulowanej do wartości normy). Każde odchylenie od fizjologicznego poziomu regulacji sygnalizowane jest zwrotnie układowi regulującemu, którego zadaniem jest uruchomienie w organizmie reakcji przeciwdziałającej temu odchyleniu; tego typu sprzężenie utrzymuje dany parametr w zakresie normy – w granicach tolerancji. Jest to układ samo wyciszający zakłócenie zapewniający stabilność układowi regulacji (rycina 5); przykładem może być: utrzymywanie odpowiedniego stężenia glukozy we krwi, temperatury ciała i kwasowości płynów ustrojowych. Rycina 5. Minimalizacja sygnału błędu w sprzężeniu zwrotnym ujemnym. Mechanizm wygaszania zakłócenia powinien przebiegać stopniowo; najbezpieczniejsze dla organizmu jest tłumienie zakłócenia przez oscylacje o zmniejszającej się amplitudzie, ponieważ gwałtowne wyhamowanie – szybki powrót do wartości wyjściowej (fizjologicznej) może spowodować uszkodzenie układu. Także bardzo powolne oscylacje mogą wywierać niekorzystny wpływ na układ poprzez długotrwałą obecność zmienionego, nieprawidłowego parametru (np. przedłużony okres hipoglikemii w regulacji stężenia glukozy we krwi). Sprzężenie zwrotne dodatnie powoduje narastanie wartości odchylenia od poziomu równowagi; występują oscylacje aperiodyczne o zwiększającej się amplitudzie. W tego typu sprzężeniu odpowiedź organizmu wzmacnia działanie bodźca (wzrasta wartość sygnału błędu) - rycina 6. 10 Rycina 6. Narastanie sygnału błędu w sprzężeniu zwrotnym dodatnim. W organizmie człowieka występuje regulacja oparta za sprzężeniu zwrotnym dodatnim, przy czym w stanach fizjologicznych zachodzi ona rzadko, natomiast często w stanach patologicznych. Przykładami działania w warunkach fizjologicznych sprzężenia zwrotnego dodatniego mogą być: 1) krzepnięcie krwi w przypadku uszkodzenia naczynia – kaskadowa aktywacja czynników hemostazy kończąca się wytworzeniem fibryny wzmacniającej czop płytkowy (powstanie skrzepu ostatecznego); 2) lawinowe wnikanie jonów Na+ przez błonę komórek mięśniowych i neuronów w fazie depolaryzacji potencjału czynnościowego; 3) akcja porodowa (nasilające się skurcze macicy); 4) oddawanie moczu (skurcze pęcherza moczowego). W stanach patologicznych często dochodzi do przekształcania sprzężeń zwrotnych ujemnych w dodatnie, co powoduje zakłócenie homeostazy. W ten sposób uruchomione zostaje tzw. błędne koło stanowiące bardzo częsty mechanizm patofizjologiczny wielu chorób (np. nadciśnie tętnicze, schizofrenia) i uzależnień (alkoholizm, narkomania). Układ regulacji Większość procesów fizjologicznych w organizmie człowieka podlega regulacji dzięki sprzężeniom zwrotnym, tworzącym tzw. zamknięte pętle regulacyjne. Zamknięty układ regulacji jest układem rzeczywistym, który utrzymuje zadaną wielkość niezależnie od działających czynników środowiska (rycina 7). Komparator porównuje zmienną wartość parametru (Sr) wychodzącą z układu regulowanego (Ur) z zadanym poziomem regulacji (So), do którego dąży układ kompensujący zakłócenia – układ regulujący (R). W wyniku tego procesu dochodzi do wysyłania odpowiedniej informacji (Sb) z komparatora do regulatorów (r), które wpływają na układ regulowany (Ur). Regulacje fizjologiczne odnoszące się do mechanizmów, które przeciwdziałają zakłóceniom i utrzymują homeostazę są bardzo złożone, np. zdolność utrzymywania stałości pH krwi zależy od procesów metabolicznych w wątrobie, nerkach, mięśniach, a także od wymiany gazowej w płucach i obecności układów buforowych (układ wodorowęglanowy, białczanowy np. hemoglobinianowy, fosforanowy). Uszkodzenie mechanizmów regulacji prowadzi do zaburzenia układu i powstania choroby, a po przekroczeniu progu krytycznego nawet do śmierci organizmu. 11 Rycina 7. Schemat układu regulacji w ujęciu biofizycznym. Fizjologiczne systemy kontroli – układy regulacji stabilnej Utrzymanie homeostazy w organizmie wymaga zaangażowania licznych mechanizmów regulacji i kontroli najważniejszych parametrów środowiska wewnętrznego człowieka, takich jak: temperatura ciała, pH krwi i płynów ustrojowych, stężenie związków chemicznych w płynach ustrojowych, w tym stężenie glukozy we krwi, ciśnienie osmotyczne, objętość płynów ustrojowych, ciśnienie parcjalne tlenu i dwutlenku węgla we krwi, ciśnienie tętnicze krwi. Termoregulacja Dla zachowania równowagi termicznej organizmu nadmiar ciepła jest oddawany do otoczenia, natomiast w warunkach obniżonej ciepłoty ciała uruchomione zostają mechanizmy, dzięki którym ciepło zostaje zatrzymane i dodatkowo wytworzone. Rycina 8. Schemat regulacji temperatury ciała. Sr – sygnał regulowany; So – temperatura wewnętrzna-wartość zadana; Sb – sygnał błędu; ∑ - komparator; S1-S6 – sygnały z regulatorów; Z – zakłócenia zewnętrzne 12 Stałość temperatury wewnętrznej człowieka zapewniają dwie przeciwstawne grupy mechanizmów: 1. termoregulacja fizyczna - odpowiedzialna jest za oddawanie nadmiaru ciepła do otoczenia (ochrona przed przegrzaniem organizmu). Efektorami tych procesów są gruczoły potowe, których czynność pobudzana jest przez impulsy nerwowe włókien cholinergicznych oraz układ krążenia (rozszerzenie światła drobnych naczyń krwionośnych pod wpływem noradrenaliny) - rycina 8. Ciepło z organizmu do otoczenia może być oddawane przez skórę na drodze: konwekcji (przekazywanie ciepła od środowiska cieplejszego do chłodniejszego), promieniowania elektromagnetycznego i parowania potu; w temperaturze otoczenia wynoszącej 30°C, udział procentowy poszczególnych mechanizmów wynosi odpowiednio: konwekcja – 15%, promieniowanie – 49%, parowanie potu – 36%. Ponadto do strat ciepła dochodzi poprzez pogłębienie oddechów i oddawanie ciepła wraz z wydychanym powietrzem. 2. termoregulacja chemiczna - odpowiedzialna jest za wytwarzanie i zatrzymanie ciepła w organizmie (ochrona przed wychłodzeniem). Efektorami tych procesów są mięśnie szkieletowe, wątroba, nerki oraz tkanka tłuszczowa (rycina 8). Obniżenie temperatury otoczenia uruchamia mechanizmy: termogenezę drżeniową (wzrost napięcia mięśniowego i drżenie mięśniowe; dodatkowo skurcz mięśni przywłośnych) oraz termogenezę bezdrżeniową (zwiększenie aktywności układu adrenergicznego i uwolnienie szeregu hormonów o działaniu katabolicznym - aminy katecholowe, glukagon, hormony tarczycy, które stymulują tkanki i narządy do przemian metabolicznych). Procesy te powodują zwiększenie wytwarzania ciepła w organizmie. Wrażenia termiczne odbierane są i przetwarzane przez: 1. termoreceptory znajdujące się głównie w skórze (termoreceptory powierzchniowe), ponadto w mięśniach górnych dróg oddechowych, ścianach naczyń żylnych i w przewodzie pokarmowym (termoreceptory głębokich tkanek); termoreceptory przekazują zdobyte informacje w postaci impulsów nerwowych do podwzgórza – ośrodka termoregulacji. 2. termodetektory występujące w podwzgórzu, po obu stronach trzeciej komory mózgowej, oraz w szyjnej części rdzenia kręgowego; bodźcem do ich pobudzenia jest temperatura krwi oraz przyspieszenie lub zwolnienie czynności bioelektrycznej serca. Ośrodek termoregulacji położony w podwzgórzu składa się z dwóch części - przedniej (ośrodek eliminacji ciepła) i tylnej (ośrodek zachowania ciepła). Do ośrodka termoregulacji informacje przekazywane są dwoma kanałami: drogą nerwową z receptorów w skórze i na błonach śluzowych oraz drogą krwi przepływającej przez mózgowie. Neurony ośrodka, jako centrum integracji sygnałów zbierają informacje z termoreceptorów oraz termodetektorów i uruchamiają odpowiednie mechanizmy termoregulacji. W układzie termoregulacji, w warunkach fizjologicznych, podwzgórze pełni rolę komparatora; w nim dochodzi do porównania wartości zadanej tj. punktu nastawczego (temperatura odniesienia 37°C) z wartością sygnału dochodzącego z receptorów. W pewnych przypadkach przy sprawnych mechanizmach termoregulacyjnych może dojść do przesunięcia poziomu nastawczego temperatury wewnętrznej w górę (gorączka=pireksja) lub w dół (anapireksja). Naturalną odpowiedzią organizmu na infekcję jest wzrost temperatury ciała. Ośrodek termoregulacji podwyższa swój punkt nastawczy na wyższy poziom. Po podaniu leków przeciwgorączkowych punkt nastawczy obniża się, następuje chwilowa hipertermia z intensywną utratą ciepła. Anapireksja polega na obniżeniu temperatury nastawczej organizmu przy sprawnym układzie termoregulacji w warunkach m.in. dużego ubytku krwi, niedotlenienia; jest to działanie neuroprotekcyjne wynikające z konieczności oszczędnego gospodarowania tlenem. 13 W warunkach niesprawności i/lub niewydolności układu termoregulacji może dojść do hipertermii (przegrzanie organizmu) lub hipotermii (wychłodzenie organizmu). Regulacja stężenia glukozy we krwi Glukoza stanowi podstawowe źródło energii dla większości tkanek i ośrodkowego układu nerwowego. Stężenie glukozy we krwi jest ściśle regulowane; w warunkach fizjologicznych jej stężenie (na czczo) zależy od płci, wieku i zawiera się w przedziale 65-95 mg/100 mL. Mechanizmy regulujące stężenie glukozy we krwi i przystosowujące tempo jej wytwarzania do tempa wykorzystywania przez tkanki działają na poziomie substratowym, hormonalnym i nerwowym. Substratowy mechanizm regulacji stężenia glukozy we krwi polega na bezpośredniej kontroli przemian glukozy w tkankach, która zależy od jej dopływu do komórek oraz od dostępności innych substratów. W utrzymaniu odpowiedniego stężenia glukozy we krwi oraz regulacji gospodarki węglowodanowej główną rolę odgrywają dwa hormony trzustki – insulina i glukagon, wydzielane odpowiednio przez komórki wewnątrzwydzielnicze β i α wysp trzustkowych (Langerhansa). Najsilniejszym bodźcem odpowiedzialnym za uwalnianie insuliny z komórek β jest zwiększenie stężenia glukozy we krwi; przy prawidłowym jej stężeniu wynoszącym 4,44—5,0 mmol/L (80—90 mg%), wydzielanie insuliny jest nieznaczne (ok. 25 ng/kg mc./min), ale w warunkach 2-3 krotnego wzrostu stężenia glukozy dochodzi do gwałtownego wyrzutu insuliny z komórek β. Hormon ten obniża poziom glukozy we krwi poprzez zwiększenie jej transportu do wnętrza komórek, gdzie wzmaga glikolizę. Insulina także zwrotnie hamuje funkcję wydzielniczą komórek β (samoregulacja wydzielania insuliny). Antagonistycznie do insuliny działa glukagon, który zwiększa stężenie glukozy we krwi aktywując fosforylację w komórkach wątroby i pobudzając glikogenolizę (proces rozkładu glikogenu do glukozy) i glukoneogenezę (biosynteza glukozy z związków niecukrowych, np. kwasu mlekowego, aminokwasów, glicerolu). Hamujący wpływ na uwalnianie insuliny wywiera somatostatyna wydzielana przez komórki δ (delta) trzustki i działająca na nie w obrębie wysp trzustkowych na drodze parakrynnej (bez udziału układu krążenia tylko za pośrednictwem płynu międzykomórkowego). Ponadto wiele hormonów wydzielanych przez różne gruczoły dokrewne stymuluje wzrost stężenia glukozy we krwi; do najważniejszych należą: adrenalina, kortyzol, hormon wzrostu (rycina 9). Adrenalina poprzez βreceptory adrenergiczne wpływa bezpośrednio na podwyższenie stężenia glukozy we krwi, natomiast poprzez receptory α–adrenergiczne hamuje wydzielanie insuliny. Rycina 9. Układ regulacji stężenia glukozy we krwi. Sr – sygnał regulowany; Co – stężenie glukozy- wartość zadana Sb – sygnał błędu; ∑ - komparator; 14 Mechanizmy nerwowej regulacji stężenia glukozy we krwi związane są z aktywacją autonomicznego układu nerwowego. Układ przywspółczulny pobudza syntezę glikogenu w wątrobie i wydzielanie insuliny, przyczyniając się w ten sposób do obniżenia stężenia glukozy. Aktywacja tego układu następuje na drodze odruchowej inicjowanej przez bodźce węchowe i smakowe oraz obecność pokarmu w przewodzie pokarmowym. Zakończenia nerwów czuciowych w łożysku żyły wrotnej pełnią rolę obwodowych glukoreceptorów. Układ współczulny, poprzez wpływ na hepatocyty za pośrednictwem receptorów typu α, stymuluje glikogenolizę i bezpośrednio wpływa na podwyższenie stężenia glukozy we krwi. Pobudzenie układu współczulnego hamuje uwalnianie insuliny, co w warunkach np. stresu umożliwia uruchomienie substratów energetycznych (glukoza), które są niezbędne do przezwyciężenia sytuacji kryzysowej organizmu. W kontroli aktywności unerwienia autonomicznego biorą udział wyspecjalizowane neurony znajdujące się w ośrodkowym układzie nerwowym. W jądrze bocznoprzyśrodkowym podwzgórza znajdują się neurony spełniające rolę ośrodkowych glukodetektorów reagujących na zwiększony dopływ glukozy i insuliny, natomiast w części bocznej podwzgórza neurony reagujące na niedobór glukozy i sprzyjające aktywacji układu współczulnego. Zaburzenie mechanizmów regulacji poziomu glukozy we krwi może prowadzić do hiperglikemii. Prowadzenie badań przesiewowych w kierunku cukrzycy jest konieczne z uwagi na fakt, że u połowy chorych na początku hiperglikemii nie występują objawy. Cukrzyca jest to grupa chorób metabolicznych charakteryzująca się hiperglikemią wynikającą z defektu wydzielania i/lub działania insuliny. Przewlekła hiperglikemia wiąże się z zaburzeniem czynności, uszkodzeniem i niewydolnością różnych narządów, zwłaszcza oczu, nerek, nerwów, serca i naczyń krwionośnych. Układ regulacji ultrastabilnej Dzięki regulacjom fizjologicznym w wymiarze długoterminowym organizm adaptuje się do zmiennych warunków otaczającego środowiska. Z punktu widzenia możliwości adaptacyjnych człowieka, organizm można traktować jako układ ultrastabilny mający zdolność optymalnej samoregulacji i przystosowania się do nowych warunków otoczenia (rycina 10). S – komparator r – regulator (efektor) R – układ regulujący Ur – układ regulowany So – sygnał zadany=sygnał normy=wartość normy Sb – sygnał błędu S – sygnał nastawiający=regulujący Sr – sygnał regulowany A – przetwornik pamięci umożliwiający adaptację: przestrojenie komparatora i zmiany działania regulatorów Rycina 10. Schemat układu ultrastabilnego. 15 W skład układu regulacji wchodzi dodatkowo układ adaptujący (przetwornik pamięci), który umożliwia przestrojenie komparatora na nowy poziom (zmiana wartości nastawczej określonego parametru), wskutek powtarzającej się ekspozycji na różne czynniki pochodzące ze środowiska i/lub wewnątrzpochodne. Przykładem mogą być następstwa długotrwałych treningów o charakterze wytrzymałościowym, które w organizmie sportowców, w warunkach spoczynku, prowadzą do spadku częstości skurczów serca. Bradykardia spoczynkowa, w której liczba skurczów serca nie przekracza 50 uderzeń na minutę (spoczynkowy, fizjologiczny rytm serca u osoby niewytrenowanej – ok. 70 skurczów/min.), wynika ze zwiększenia spoczynkowego napięcia przywspółczulnego układu nerwowego (nerw błędny).Dodatkowo przykładem układu adaptacyjnego, może być fizjologiczne powiększenie sylwetki serca w odpowiedzi na wysiłek fizyczny tzw. „serce sportowca” (athlete’s heart). Ten rodzaj fizjologicznego przystosowania to zespół zmian adaptacyjnych, zarówno morfologicznych, jak i funkconalnych serca, będących wyrazem prawidłowej odpowiedzi serca na regularny i długotrwały wysiłek fizyczny. Co ciekawe, wykazano, ze u sportowców uprawiających dyscypliny z przewagą komponenty statycznej (np. podnoszenie ciężarów, judo, pchnięcie kulą) przebudowa serca ma charakter koncentryczny, podczas gdy u sportowców uprawiających dyscypliny dynamiczne (tenis ziemny, biegi długodystansowe, kolarstwo) — ekscentryczny. Wykorzystanie czynników abiotycznych w przeciwdziałaniu zakażeniom drobnoustrojami Dezynfekcja – użycie procesów fizycznych lub czynników chemicznych w celu zniszczenia większości form wegetatywnych drobnoustrojów na przedmiotach i powierzchniach użytkowych; przetrwalniki bakterii oraz wysoce oporne na działanie czynników chemicznych drobnoustroje (mykobakterie – prątki z rodzaju Mycobacterium, wirusy, grzyby) mogą przetrwać proces dezynfekcji. Środkami stosowanymi w dezynfekcji są: wilgotne ciepło, stężony nadtlenek wodoru, kwas nadoctowy oraz związki chloru (np. chloramina), alkohole, związki jodoforowe, związki fenolowe, czwartorzędowe związki amoniowe. Antyseptyka – użycie środków chemicznych na skórze, błonach śluzowych, ranach w celu zahamowania wzrostu lub zniszczenia drobnoustrojów; stosowanie tej procedury nie powoduje zniszczenia form przetrwalnikowych mikroorganizmów. Wadą tych zabiegów jest wysuszanie skóry spowodowane usuwaniem ochronnej warstwy lipidów. Środkami stosowanymi w anyseptyce są m.in.: spirytus salicylowy, woda utleniona, rivanol, jodyna, chlorheksydyna, kwas karbolowy, związki fenolowe. Aseptyka - sposób postępowania, którego celem jest zapobieganie zakażeniom tkanek i skażeniom jałowych powierzchni (sprzęt medyczny, powierzchnie abiotyczne). Czynniki abiotyczne w toksykologii Toksykologia to nauka zajmująca się szkodliwymi działaniami substancji chemicznych na organizmy żywe. W badaniach toksykologicznych analizowane są mechanizmy komórkowe, biochemiczne i molekularne oddziaływań oraz szacowane jest prawdopodobieństwo ich wystąpienia. Obejmują one różne obszary badań, wyróżniamy np.: toksykologię kliniczną - zajmującą się analizą chorób spowodowanych bezpośrednio substancjami chemicznymi lub jednoznacznie związanych z ich oddziaływaniem; toksykologię sądową - skupia się na medyczno-prawnych aspektach szkodliwego działanie substancji chemicznych na organizmy ludzi i zwierząt; łączy się ścisle z chemią analityczną; toksykologię środowiskową - bada wpływ środowiskowych zanieczyszczeń chemicznych na organizmy żywe (człowieka, zwierzęta, rośliny); wyodrębnia się tu także ekotoksykologię, która 16 szczególnie zajmuje się wpływem substancji toksycznych na dynamikę zmian populacyjnych w ekosystemie; toksykologię rozwojową - ocenia niepożądane działania czynników chemicznych lub fizycznych na rozwijający się organizm w okresie rozwoju płodowego, przed poczęciem (wynik narażenia na czynnik szkodliwy któregokolwiek z rodziców), lub po narodzinach aż do okresu dojrzewania; toksykologię reprodukcyjną - zajmuje się występowaniem efektów niepożądanych w męskim i żeńskim układzie rozrodczym, mogących wynikać z kontaktu z substancjami toksycznymi. Nową dziedziną, dynamicznie rozwijającą się, jest toksykogenomika, która umożliwia zidentyfikowanie organizmów bardziej wrażliwych genetycznie na określony szkodliwy czynnik środowiskowy. Pozwala ona na tworzenie indywidualizowaej terapii uwzględniającej „genetic makeup” czyli budowę i funkcję genomu danego organizmu. Teratologia Współczesna teratologia zajmuje się opisem i klasyfikacją wad wrodzonych, ich etiologią oraz mechanizmami powstawania, a także epidemiologią wad u ludzi. Wada wrodzona, wrodzona malformacja, albo zaburzenie rozwojowe, wrodzona anomalia – są terminami synonimicznymi służącymi do opisu nieprawidłowości (uszkodzenia, zaburzenia) strukturalnych, neurobehawioralnych i metabolicznych ujawnionych tuż po urodzeniu lub w okresie rozwoju postnatalnego. Wada może powstać w każdym okresie rozwoju prenatalnego. Teratogenem określa się czynnik środowiska zewnętrznego, który zaburza rozwój zarodka/płodu, wywołując wadę. Efekt działania teratogenu zależy od: rodzaju czynnika, dawki, wrażliwości organizmu i jego stadium rozwojowego, genotypu matki oraz genotypu zarodka. Zaburzenia rozwoju embriologicznego mogą być spowodowane: czynnikami genetycznymi, czynnikami środowiskowymi, nieokreślonymi; w 50 – 60% przypadków przyczyna wad jest nieznana. Szacuje się, że około 7–8% wad powstaje w wyniku działania czynników teratogennych: fizycznych (np. promieniowanie jonizujące), chemicznych (związki chemiczne, w tym leki np. cytostatyki) oraz biologicznych (np. Rubella virus, Cytomegalovirus, Toxoplasma gondii). Z punktu widzenia teratologicznego wyróżnia się trzy okresy rozwoju prenatalnego człowieka: okres przed różnicowaniem listków zarodkowych – intensywna proliferacja komórek (pierwsze 2 tyg. po zapłodnieniu) – działanie zasady „wszystko albo nic” (śmierć lub normalny rozwój); okres rozwoju zarodkowego i organogenezy (3-8 tyg.) – największe prawdopodobieństwo indukowania wady przez teratogen przypada na okres miedzy 18. a 60. dniem rozwoju zarodka (maksimum wrażliwości - na około 30. dzień rozwoju); w tym okresie zachodzą szybkie podziały komórkowe, dojrzewanie morfologiczno-czynnościowe narządów pierwotnych, powstawanie narządów ostatecznych - organogeneza. okres rozwoju płodu – mniejsza wrażliwość rozwijającego się organizmu, mogą jednak pojawiać się zaburzenia czynnościowe (upośledzenie w rozwoju umysłowym) lub zakłócenia w rozwoju narządu już wykształconego. Wrażliwość na działanie teratogenu spada wraz z rozwojem zarodka/płodu. Najczęstsze wady rozwojowe to wady serca i przepuklina oponowo-rdzeniowa odcinka lędźwiowego kręgosłupa (wada ta powstaje w pierwszych 4 tygodniach życia zarodkowego). Wykazano, że codzienne przyjmowanie przez kobietę 4 mg kwasu foliowego przez miesiąc przed spodziewanym zapłodnieniem, a następnie przez trzy pierwsze miesiące ciąży - zmniejsza o 75% ryzyko powstania wady cewy nerwowej u dziecka w rodzinach, w których wywiad wykazał, że są obciążone ryzykiem. Na 1000 żywych porodów 2-3 dzieci ma wady układu nerwowego, a umieralność z 17 powodu tych wad sięga 0,89 na 1000 żywo urodzonych niemowląt. Wady wrodzone mogą występować jako izolowane, bądź współistniejące w zespołach genetycznych: anencefalia – bezmózgowie, rozszczep wargi i podniebienia, syndaktylia – zrośnięcie dwóch lub więcej palców, ektrodaktylia – szczypce homara – malformacja kończyny polegająca na całkowitym lub częściowym braku palców stopy i/lub dłoni, arachnodaktylia (pająkowatośc palców) – nadmiernie cienkie i długie w stosunku do kości sródręcza i nadgarstka palce dłoni; cecha może wystepować jako współistniejaca, np. w zespole Marfana, lub jako cecha izolowana, syrenomelia – fuzja kończyn dolnych, fokomelia – brak bliższych części kończyn, skutkuje znacznym skróceniem rąk i nóg, amelia – brak kończyny lub kończyn. Talidomid – działanie teratogenne Talidomid został wprowadzony do lecznictwa w 1956 r. w Niemczech, jako lek o działaniu uspakajającym, nasennym i przeciwwymiotnym, który chętnie przyjmowany był przez kobiety ciężarne. Pod koniec lat pięćdziesiątych XX wieku w Europie Zachodniej (głównie w Niemczech i Anglii) urodziło się ponad 7000 dzieci z wadami wrodzonymi. Zespół talidomidowy charakteryzuje się różnym stopniem niedorozwoju lub brakiem kończyn górnych i/lub dolnych. Do wad dochodzi z powodu zaburzenia procesu angiogenezy w zawiązku narządu (rycina 11). Rycina 11. Talidomid – krytyczne okresy embriogenezy dla rozwoju kończyn (wg. Obican i Scialli 2011) Dla bezpieczeństwa potomstwa każdy lek musi być oceniany pod względem jego wpływu na rozwijający się zarodek/płód. Ocenę działania teratogennego związków przeprowadza się, na co najmniej trzech gatunkach zwierząt laboratoryjnych (np.: szczur, królik, mysz) z uwagi na różnice w budowie łożyska (różna transmisja leku przez łożysko) oraz różnice międzygatunkowe w biotransformacji leku. Substancja toksyczna (trucizna), jako substancja zdolna do wywołania szkodliwej odpowiedzi ze strony organizmu, jeśli wystąpi w wystarczającej ilości, może spowodować uszkodzenie lub ostatecznie śmierć organizmu. Efekty toksyczne w ustroju występują wówczas, gdy związek chemiczny lub produkty jego przemian metabolicznych (biotransformacji) dotrą do określonych miejsc w organizmie w 18 odpowiednim do ujawnienia objawów toksycznych stężeniu i czasie. Drogami, którymi substancje toksyczne dostają się do organizmu ze środowiska jest układ pokarmowy, oddechowy, skóra (miejscowo, przezskórnie, doskórnie). Badania toksyczności konkretnej substancji opierają się na ocenie efektów jej działania na zwierzęta laboratoryjne, a po właściwym ich zakwalifikowaniu mogą być odnoszone do ludzi. W celu uzyskania statystycznie istotnych wyników, pochodzących z badań małej grupy zwierząt laboratoryjnych, należy zwierzętom podać duże dawki substancji toksycznych, jako działanie niezbędne. Takie badanie umożliwi wykrycie zagrożenia dla ludzi, uwzględniając fakt, że efekt względnie dużej dawki będzie występował na tyle często, ze będzie go można zauważyć. Pierwszym badaniem toksycznosci w badaniach toksykologicznych dla nowej substancji chemicznej jest toksyczność ostra. Ważnym aspektem oceny toksyczności jest ustalenie zależności dawka-odpowiedź. Pozwala ona wykazać, że: odpowiedź zależy od podanej substancji chemicznej i jest to związek przyczynowo-skutkowy, wielkość odpowiedzi w rzeczywistości jest związana z dawką, istnieje zarówno wymierna metoda pomiaru, jak i precyzyjny sposób wyrażania toksyczności. Podana substancja chemiczna może wywoływać wiele zależności dawka-odpowiedź, z których każda dotyczy jednego konkretnego skutku toksycznego. Można mówić o toksyczności ostrej, podostrej podprzewlekłej czy tosyczności przewlekłej. Dla oceny i porównywania ostrych efektów toksyczności stosuje się parametr dawki śmiertelnej – DL (łać. dosis letalis lub ang. LD – lethal dose). Najczęściej określana jest DL50 - dawka substancji/związku chemicznego, która wprowadzona do organizmu (dawka pobrana) różnymi drogami (przez skórę, drogą pokarmową, inhalacyjną) wywołuje śmierć 50% populacji (tabela 1). Tabela 1. Klasyfikacja działania toksycznego substancji chemicznych po ich podaniu dożołądkowym. Zakres DL50 (mg/kg masy ciała) DL50 < 25 25 < DL50 < 200 200 < DL50 < 2000 2000 < DL50 Klasa toksyczności Bardzo toksyczna Toksyczna Szkodliwa Nieklasyfikowana Stężenie śmiertelne CL50 (łać. concetratio letalis), to stężenie substancji/związku chemicznego w medium środowiskowym, wywołujące śmierć 50% populacji. Do badań stosuje się jeden lub kilka gatunków zwierząt, najczęściej myszy i szczury. Badania toksyczności podostrej wykonywane są w celu uzyskania informacji dotyczącej toksyczności substancji chemicznej po podaniu wielokrotnym, a także jako badania wspomagające przy ustaleniu dawki do badań toksyczności podprzewlekłej. Czas badania wynosi zwykle 14 dni. Badanie toksyczności podprzewlekłej wykonuje się zazwyczaj na dwóch gatunkach zwierząt, drogą zamierzonego narażenia. Wykorzystywane są co najmniej trzy dawki. Prowadzona jest dokładna obserwacja zwierząt, odnotowuje się wszystkie przedwczesne zgony oraz przeprowadza się sekcję padłych zwierząt. Badanie trwa 90 dni, następnie, po uśmierceniu wszystkich pozostałych przy życiu zwierząt, wykonuje się ocenę makro- i mikroskopową tkanek, badania biochemiczne i hematologiczne krwi oraz analizę moczu zwierząt. Badania toksyczności podprzewlekłej, wykonuje się w celu: ustalenia najniższego poziomu narażenia wywołującego szkodliwe działanie (ang. Lowest Observed Adverse Effect Level, LOAEL) – najniższa dawka wywołująca objawy toksycznego działania. ustalenia najwyższego poziomu narażenia, przy którym nie występuje istotny wzrost częstości lub nasilenia efektów szkodliwych (ang. No Observed Adverse Effect Level , NOAEL) 19 najwyższa dawka badanej substancji/ związku nie wywołująca objawów szkodliwego działania u zwierząt doświadczalnych. oceny uszkodzenia konkretnego narządu lub narządów wywołanego przez badany związek po narażeniu wielokrotnym. Badania toksyczności przewlekłej mają na celu ocenę toksyczności skumulowanej i kancerogennego działania substancji chemicznych. Okres narażenia wynosi w tym przypadku od 6 miesięcy do 2 lat. Na podstawie wartości dawek NOAEL lub LOAEL określa się ADI (ang. Acceptable Daily Intake) dopuszczalne dzienne pobranie. ADI oznacza ilość substancji, wyrażoną w mg/kg masy ciała (mc)., która pobierana codziennie, przez całe życie człowieka ze wszystkich źródeł (m.in. żywność, woda, leki, kosmetyki) nie będzie szkodliwa dla organizmu. Wyliczone wartości ADI służą szczególnie do oceny ryzyka związanego z pobieraniem substancji szkodliwych z żywnością przez człowieka, do ustalania maksymalnych dopuszczalnych stężeń zanieczyszczeń (pozostałość pestycydów, leki weterynaryjne, metale ciężkie) oraz maksymalnych dawek substancji celowo dodawanych do żywności (konserwanty np. kwas benzoesowy, azotyn sodowy). Niektóre substancje toksyczne, niebędące składnikami odżywczymi, mogą wywołać korzystne lub stymulujące efekty, jeśli są przyjmowane w małych dawkach (zasada hormezy, omawiana w ramach biofizyki). Ogólnie, hormeza jest zjawiskiem dualnej reakcji organizmu na dawkę, polegającym na korzystnym działaniu, stymulującym organizm w zakresie małych dawek i działaniu niekorzystnym, szkodliwym w obszarze dużych dawek. Taką reakcję opisuje krzywa typu U. W biologii i medycynie hormezę definiuje się jako adaptacyjną odpowiedź komórek i organizmów na umiarkowany (zwykle przerywany) stres. Małe dawki substancji chemicznej mogą powodować stymulację odpowiedzi korzystnej lub ochronnej na przykład indukcję odpowiednich szlaków enzymatycznych, ochronną odpowiedź immunologiczną (Ryc 12.odpowiedź A). Jeśli próg działania zostaje przekroczony wraz ze zwiększeniem dawki, dochodzi do wystąpienia efektu szkodliwego, toksycznego (Ryc 12. odpowiedź B). Rycina 12. Hipotetyczna zależność dawka-odpowiedź. 20 Przykładem tego zjawiska jest przewlekłe picie alkoholu. W stosunkowo dużych dawkach alkohol, działając geno- i cyto- toksycznie, zwiększa ryzyko wystąpienia niektórych typów nowotworów np. raka przełyku, wątroby, trzustki, jelita. Z drugiej strony dane naukowe i medyczne (metaanaliza) wskazują, że niewielkie spożycie alkoholu (≤100 g/tydz.) wiązało się z mniejszym ryzykiem zawału mięśnia sercowego. Nie ustalono jednak precyzyjnie progu, poniżej ktorego przestawało się ono łączyć z niższym ryzykiem występowania innych zdarzeń sercowo-naczyniowych (nadciśnienie tętnicze, udar mozgu oraz niewydolność serca). Eksperci Europejskiego Towarzystwa Kardiologicznego (ESC) podkreślają, że najniższe ryzyko zdarzeń sercowo-naczyniowych występuje u abstynentów. Badania ostatnich lat pozwoliły na identyfikację komórkowych szlaków sygnałowych i mechanizmów molekularnych pośredniczących w odpowiedziach hormetycznych, które zazwyczaj obejmują m.in. aktywność takich białek jak kinazy, deacetylazy, oraz szereg czynników transkrypcyjnych. W rezultacie komórki zwiększają produkcję białek cytoochronnych, czynników wzrostu, enzymów fazy 2 biotransformacji ksenobiotyków i enzymów antyoksydacyjnych oraz białek opiekuńczych. Działanie hormetyczne niektórych związków zostało przeanalizowane na modelach zwierzęcych. W badaniach różnych modeli zawału mózgu (udaru niedokrwiennego) u myszy i szczurów wykazano, że nikotynamid ma działanie neuroprotekcyjne. Odpowiedź na dawkę nikotynamidu ma kształt litery U. Czynniki biotyczne zagrażające zdrowiu Ogólnie mówiąc o czynnikach biotycznych zagrażających zdrowiu, należy pamiętać, że interakcje pomiędzy organizmami żywymi można rozpatrywać jako odziaływania całych organizmów, ich części lub produkowanych metabolitów (np. toksyny). Składowe tych oddziaływań określane są jako czynniki biotyczne (biologiczne, ożywione, bądź pochodzące z organizmów żywych). W ocenie skali ryzyka związanego z czynnikiem biotycznym należy wziąć pod uwagę: naturalną wirulencję czynnika biologicznego, zdolność przetrwania czynnika biologicznego w środowisku, dawkę infekcyjną, drogę transmisji, indywidualną reakcję organizmu, dostępność profilaktyki i leczenia. Główne czynniki biotyczne zagrażające zdrowiu to czynniki biologiczne wywołujące choroby zakaźne i inwazyjne (np. priony, wirusy, bakterie, grzyby, pasożytnicze pierwotniaki, helminty i stawonogi) ale także: alergeny biologiczne (bakterie, grzyby, cząstki roślinne i zwierzęce); toksyny biologiczne w tym czynniki immunotoksyczne, nadmiernie pobudzające lub hamujące ważne składniki układu odpornościowego (endotoksyna bakteryjna, glukany grzybicze, lotne związki organiczne), toksyny roślinne (alkaloidy, glikozydy, toksalbuminy), jady zwierzęce (neurotoksyny), metabolity grzybów pleśniowych (mykotoksyny); wektory biologiczne (stawonogi przenoszące czynniki patogenne chorób transmisyjnych kleszcze, komary). Wprowadzono klasyfikację szkodliwych czynników biologicznych dla zdrowia w środowisku pracy (na podstawie załącznika nr 1 do Rozporządzenia Ministra Zdrowia z 22 kwietnia 2005 r.), wyszczególniając cztery grupy zagrożeń: Grupa 1 to czynniki, przez które wywołanie chorób u ludzi jest mało prawdopodobne: osłabione szczepy bakterii stosowane do produkcji szczepionek (atenuowane szczepionki) BCG (szczepionka przeciw gruźlicy) - atenuowany szczep Mycobacterium bovis MMRatenuowane wirusy odry, świnki i różyczki szczepy bakterii przeznaczone do celów laboratoryjnych (Escherichia coli K12) szczepy bakterii wykorzystywane w celach produkcyjnych (fermentacja mlekowa- Lactobacillus spp. i Bifidobacterium spp.) 21 drożdże stosowane w celach produkcyjnych np. Saccharomyces cerevisiae do produkcji wyrobów piekarniczych Grupa 2 to czynniki, które mogą wywoływać choroby u ludzi, mogą być niebezpieczne, ale rozprzestrzenienie ich w populacji ludzkiej jest mało prawdopodobne. Zazwyczaj istnieją w stosunku do nich skuteczne metody profilaktyki lub leczenia.140 gatunków bakterii, 56 wirusów, 60 gat. pasożytów, 20 gat. grzybów wirus grypy typu A, B, C HSV- 1 i 2 wirus opryszczki typu 1, 2 CMV – wirus cytomegalii Legionella pneumophila Neisseria gonorrhoeae Salmonella paratyphi Acanthamoeba castelanii Cryptosporidium parvum Strongyloides stercoralis Candida albicans Grupa 3 to czynniki, które mogą wywoływać u ludzi ciężkie choroby, a rozprzestrzenienie ich w populacji ludzkiej jest bardzo prawdopodobne; zazwyczaj istnieją w stosunku do nich skuteczne metody profilaktyki lub leczenia:28 gatunków bakterii, 57 wirusów, 10 pasożytów, 6 grzybów Mycobacterium tuberculosis – prątki gruźlicy Blastomyces dermatitidis wirus żółtej gorączki Grupa 3** zagrożenia – nie rozprzestrzeniają się drogą powietrzną (raczej droga pokarmowa) Shigella dysenteriae typu 1 Salmonella typhi Wirusy HIV, HBV (wirus zapalenia wątroby typu B) Escherichia coli szczepy patogenne 0157:H7, 0124 Echinococcus granulosus Naegleria fowleri Plasmodium falciparum Echinococcus multiocularis Taenia solium Grupa 4 to czynniki, które wywołują u ludzi ciężkie choroby, są niebezpieczne dla pracowników, a ich rozprzestrzenienie w populacji ludzkiej jest bardzo prawdopodobne; zazwyczaj nie istnieją w stosunku do nich skuteczne metody profilaktyki lub leczenia:12 gatunków wirusów, np.: wirus Ebola wirus Marburg wirus gorączki Lassa wirus ospy prawdziwej 22 Przykłady czynników biotycznych i wywoływanych przez nie chorób są zawarte w tabeli 2. Tabela 2. Przykłady czynników biotycznych i wywoływane przez nie choroby człowieka. Czynnik chorobotwórczy wirus odry wirus Ebola (EBOV) Klebsiella pneumoniae Shigella dysenteriae Blastomyces dermatitidis Clostridium difficile cytrynina pyłki traw Choroba Odra gorączka krwotoczna Ebola zapalenie płuc czerwonka bakteryjna choroba Gilchrista / blastomykoza północnoamerykańska nawracające biegunki; rzekomobłoniaste zapalenie jelita grubego. choroba żółtego ryżu alergiczny nieżyt nosa 23 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA 1. Układ regulacji niestabilnej oparty na sprzężeniu zwrotnym dodatnim - komórka Traubego Sterowanie jest to oddziaływanie jednego układu na drugi, które występuje w sprzężeniu szeregowym tych układów. Regulacja natomiast występuje gdy układ sterujący i regulowany są sprzężone zwrotnie. Ze względu na rodzaj przetwarzanej informacji rozróżnia się układy, których wejście stanowi ustalony skończony zbiór argumentów oraz układy przetwarzające wielkości ciągłe. W celu opisania takiego układu należy określić: liczbę wejść i wyjść zasadę działania układu opisującą zależność stanu wyjść od stanu wejść czas reakcji układu określający, po jakim czasie zmiana stanu na wejściu spowoduje odpowiadającą jej zmianę na wyjściu maksymalną prędkość zmiany stanu wyjścia, opisującą z jaką maksymalną szybkością może narastać lub opadać stan sygnału wyjściowego. Układ możemy uznać za stabilny gdy wzmocnienia układu regulowanego (K A) jak i regulatora (KB) będą wyrażone wzorem: KA KB < 1. Sposób dochodzenia układu do równowagi jest zależny od właściwości dynamicznych układu czyli od czasu przejścia sygnału przez układ jak i straty energii. Gdy sygnał regulacji przewyższa zakłócenie (skutek sumuje się z przyczyną) i zmienia jego działanie na przeciwne: KA KB > 1 dochodzi do powstania w układzie coraz większych oscylacji od wartości zadanej przez wzorzec - układ jest niestabilny. Przykładem tego typu regulacji może być struktura chemiczna - komórka Traubego, która powstaje w wyniku rozpuszczania kryształków żelazocyjanku potasu w roztworze siarczanu miedzi (CuSO4). Powstała struktura – „komórka” tworzy półprzepuszczalną błonę z żelazocyjanku miedziowego - w następstwie reakcji jonów Cu+2 i jonów żelazocyjankowych z kryształu (K4[Fe(CN)6] + 2CuSO4 Cu2[Fe(CN)6] + 2K2SO4). W wyniku różnicy stężeń po obu stronach błony (rozpuszczający się kryształ dostarcza nowych jonów, stężenie wewnątrz „komórki” wzrasta)), woda wnika ze środowiska hipotonicznego do wnętrza struktury powodując jej „wzrost”. Sztuczna komórka pęcznieje aż do rozpadu (wyczerpania układu – całkowite rozpuszczenie kryształu) układu demonstrując działanie układu niestabilnego. WYKONANIE Materiały i odczynniki: - 5% roztwór CuSO4, - kryształki żelazocyjanku potasu. Sprzęt i aparatura: - cylinder miarowy, - pęseta, Protokół doświadczenia: 1. Odmierzyć w cylindrze miarowym 50 cm3 5% roztworu CuSO4. 2. Do cylindra pęsetą delikatnie wrzucić kryształki żelazocyjanku potasu i pozostawić do obserwacji tworzenie się i „wzrost” komórki Traubego w czasie 30-60 minut. 3. Otrzymaną strukturę chemiczną porównać z preparatem makroskopowym glonu - Fucus sp. 4. Odnotować czas rozpadu komórki Traubego. 24 Wyniki: Wnioski: 2. Wybrane metody oceny sprawności układu regulacji - próba Ruffiera Organizm człowieka stanowiący złożony układ regulacji, którego głównym zadaniem jest utrzymanie homeostazy podlega ocenie z wykorzystaniem różnym metod opierających się na: monitorowaniu czasu reakcji układu regulującego (od momentu pojawienia się czynnika modulującego homeostazę do momentu zmiany wartości parametrów podlegających regulacji); określeniu największego odchylenia wartości parametru regulowanego od jego pierwotnej wartości; zbadaniu czasu powrotu wielkości regulowanej do normy po wytrąceniu układu ze stanu równowagi. Do monitorowania sprawności układu krążenia służą próby czynnościowe np. testy wysiłkowe oceniające głównie dwa elementy: wydolność tlenową (aerobowa) – VO2 max, MET; tolerancję wysiłkową. Wskaźnikiem wydolności fizycznej człowieka jest wydolność tlenowa, która jest najczęściej określana jako maksymalne pochłanianie tlenu VO2 max (ilość tlenu zużytego w czasie 1 min; maksymalny minutowy pobór tlenu, pułap tlenowy, ekwiwalent metaboliczny); jest to zdolność do wykonywania wysiłków długotrwałych bez znacznego narastania zmęczenia. Spoczynkowe zużycie tlenu wynoszące 3,5 ml/kg mc./min oznacza się jako 1 MET (jednostka metaboliczna). Liczba MET dla danego rodzaju wysiłku fizycznego pokazuje ile razy więcej energii zostanie zużyte na wykonanie wysiłku, niż podczas spoczynku (prawidłowy VO2 max u zdrowych ludzi oceniono na 13 MET; 5 MET = aktywność dnia codziennego). Im więcej organizm pobiera tlenu, tym więcej może wyprodukować energii; fakt ten ma ogromne znaczenie w sportach wytrzymałościowych. Wydolność fizyczna anaerobowa (beztlenowa) związana jest z krótką pracą, trwającą 30-60 sekund o dużej intensywności (układ krążeniowo-oddechowy nie nadąża z dostarczaniem tlenu do mięśni – następuje tzw. spalanie beztlenowe = glikoliza beztlenowa).Tolerancja wysiłkowa jest to zdolność do wykonania wysiłku bez istotnych zaburzeń homeostazy lub zmian w czynności narządów wewnętrznych. Miarą tolerancji wysiłkowej jest czas wykonywania pracy o określonej intensywności/wielkości obciążenia do momentu 25 pojawienia się zaburzeń (np. ból wieńcowy, duszność, sinica, zaburzenia równowagi, zawroty głowy, obniżenie odcinka ST w EKG, zaburzenia rytmu, hipertonia wysiłkowa). Ocenę pracy serca w trakcie wysiłku i wzrastającego zapotrzebowania na tlen można prowadzić za pomocą testów: statycznych; dynamicznych bez możliwości oznaczenia maksymalnego zużycia tlenu – próba Ruffiera, próba Mastera, test na bieżni ruchomej; dynamicznych z zastosowaniem bezpośrednich i pośrednich metod oznaczania maksymalnego zużycia tlenu. WYKONANIE Osoba badana Sprzęt i aparatura: - stoper, - metronom. Protokół doświadczenia: 1. Dokonać pomiaru tętna osoby badanej w spoczynku – p, a następnie bezpośrednio po wykonaniu 30 przysiadów (w ciągu 30 sekund) – p1. 2. Następnie wykonać kolejny pomiar tętna po upływie 1 minuty (od zakończenia wysiłku) – p2. 3. Otrzymane wyniki uwzględnić we wzorze, w celu oceny wydolności układu krążenia osoby badanej i obliczenia tzw. wskaźnika Ruffiera: 4. Wyniki zinterpretować na podstawie skali: Ocena wydolności układu krążenia - bardzo dobra - 0.0 punktów - dobra - 0.01 – 5.0 punktów - średnia - 5.01 – 10.0 punktów - słaba -10.01 – 15.0 punktów Wyniki: Wnioski: 26 3. Wpływ czynników abiotycznych na organizmy żywe - obserwacja czynności serca Daphnia sp. Rozwój istot żywych ograniczony jest przez fizyczne i chemiczne czynniki środowiska – czynniki abiotyczne (elementy nieożywione np. temperatura, woda, światło, ciśnienie, klimat, pole magnetyczne, ukształtowanie powierzchni terenu). Ograniczające działanie czynników ekologicznych na populację występuje gdy stężenie/natężenie czynnika abiotycznego przekracza określone granice (zasada tolerancji Shelforda 1913 r. sformułowana w oparciu o prawo Liebiga 1841 r.). W zakresie tolerancji wyróżnia się: minimum, optimum, maksimum, pessimum (strefa, w której organizm egzystuje na granicy przeżycia: pessimum górne i dolne). Granice tolerancji są zwykle szersze dla przeżywania niż dla rozrodu. WYKONANIE Materiały i odczynniki: - rozwielitki, - woda, - lód. Sprzęt i aparatura: - mikroskop lub lupa, - szkiełka z łezką, - zlewka, - pipety pasterowskie, - łaźnia wodna nastawiona na temp. 30°C, Protokół doświadczenia: 1. Przenieść rozwielitkę w kropli wody na szkiełko z łezką i umieścić na stoliku mikroskopu (pow. 25x,40x lub 100x). 2. Określić liczbę skurczów serca na minutę (temp. pokojowa ok. 20°C). 3. Następnie przenieść na szkiełko podstawowe kawałek lodu, po schłodzeniu szkiełka ponownie wyznaczyć liczbę skurczów serca rozwielitki/min. 4. W dalszej kolejności przenieść rozwielitkę do zlewki z wodą i ogrzewać w łaźni wodnej (5 min., temp. 30°C) i najszybciej jak to możliwe ponownie umieścić rozwielitkę na szkiełku ogrzanym w dłoni i określić liczbę skurczów serca w ciągu minuty. 5. Doświadczenie przeprowadzić na 2-3 rozwielitkach losowo pobranych z hodowli, a uzyskane wyniki po uśrednieniu zamieścić w tabeli. 6. W oparciu o uzyskane wyniki należy sporządzić wykres zależności liczby skurczów serca/min od temperatury Wyniki: Lp. 1. 2. 3. 4. 5. Temperatura [°C] - 4 (dolny punkt krytyczny w zakresie tolerancji temp.) 0 +20 +30 +33,5 (górny punkt krytyczny) Liczba skurczów serca/min 0 0 27 Liczba skurczów serca 400 350 300 250 200 150 100 50 0 -4 0 10 20 30 33,5 Temperatura [°C] Wnioski: Podpis prowadzącego ……………………………………… Data: …………………………… 28 ZADANIA DO SAMOKSZTAŁCENIA 1. Uzupełnij schemat układu regulacji stężenia glukozy we krwi wykorzystując podane poniżej hasła: glukagon, komórki β trzustki, rdzeń nadnerczy, glikokortykoidy, kora nadnerczy, komórki α trzustki, adrenalina, T3 i T4, przysadka mózgowa, somatotropina, tarczyca sb(+) sb(+) sb(+) sb(+) sb(+) co y i sb(-) insulin a sr 2. Wartość stężenia glukozy w surowicy krwi równa 189 mg/dl w 120 minucie doustnego testu tolerancji, pozwala na stwierdzenie: A. cukrzycy; B. nieprawidłowej tolerancji glukozy; C. prawidłowej glikemii; D. brak prawidłowej odpowiedzi. 3. Największy odsetek udziału w zdolności buforującej krwi posiada bufor: A. albuminy osocza krwi; B. fosforanowy; C. hemoglobina; D. wodorowęglanowy. 4. Zdefiniuj pojęcia: Reguła van 't Hoffa NOAEL Zero biologiczne Eurybiont 5. Wyjaśnij określenia podane w tabeli: anencefalia syrenomelia fokomelia polidaktylia syndaktylia 29 6. Hasłom podanym w tabeli przyporządkuj odpowiednie zdanie (A,B,C,D,E) Sterylizacja Pasteryzacja Dezynfekcja Antyseptyka Tyndalizacja A. Użycie procesów fizycznych lub czynników chemicznych w celu zniszczenia większości form drobnoustrojów na przedmiotach i powierzchniach użytkowych. B. Całkowite zniszczenie wszystkich drobnoustrojów (także wirusów) oraz ich przetrwalników / zarodników. C. Użycie środków chemicznych na skórze lub innych żywych tkankach w celu zahamowania wzrostu lub zniszczenia drobnoustrojów. D. Frakcjonowana pasteryzacja. E. Jednorazowe ogrzewanie produktu do temperatury powyżej 60°C. LITERATURA 1. Traczyk W. Fizjologia człowieka w zarysie. Wydawnictwo Lekarskie, Kraków 2002 2. Wolański N. Ekologia człowieka. Podstawy ochrony środowiska człowieka i zdrowia człowieka, Ewolucja i dostosowanie biokulturowe, Wydawnictwo Naukowe, Warszawa 2006. 3. Gromadzińska J. 2020. Współczesny biomonitoring narażenia i skutku zdrowotnego. W: Biomedycyna – wybrane aspekty. Brzeziańska-Lasota E (red.), Wydawnictwo Continuo. (str. 15-45). 30 Ćwiczenie 2 Temat: Wybrane organizmy o znaczeniu medycznym. Doświadczenia 1. Wpływ mykotoksyn na organizmy żywe - ocena wrażliwości Paramecium sp. na wyciąg z grzybni A. flavus. Obserwacja 1. Grzyby a) Candida albicans: - hodowla na podłożu stałym i płynnym Sabourauda, opis wzrostu - mikrohodowla utrw. etanolem, barw. barwnikiem Giemsy, pow. 100, 400/600x, (Olyvia) – rys. b) Alternaria sp.: - hodowla na skosie Sabourauda, opis wzrostu - zarodniki - prep. mikr. utrw. niebarw., pow. 100x, (Olyvia) – rys. c) Aspergillus fumigatus: - hodowla na skosie Sabourauda – opis wzrostu; - mikrohodowla - prep. mikr. utrw., barw. fuksyną, pow.100,400x, (Olyvia) – rys. - grzybniak kropidlakowy płuc, preparat mikroskopowy barwiony metodą PAS, pow.600x, (Olyvia) - opis - "orzeszki arachidowe”Arachis hypogea zarażone Aspergillus flavus – pokaz d) Cryptococcus neoformans: - hodowla na podłożu stałym Sabourauda, - opis wzrostu; - preparat z płynu mózgowo-rdzeniowego w tuszu chińskim, pow.1000x, (Olyvia) – rys. e) Claviceps purpurea: - sporysz (Secale cornutum) na kłosie żyta (Secale cereale) -prep. makr. suchy - opis f) Amanita phalloides - Muchomor zielonawy (m. sromotnikowy): - owocnik - prep. makr. utrw. 4% formaliną/prep. suchy, opis - zarodniki - prep. mikr. trwały, niebarw., pow. 100, 400/600 lub 1000x (immersja olejowa), (Olyvia) – rys. g) Paxillus involutus - Krowiak podwinięty (Olszówka): - owocnik - prep. makr. utrw. 4% formaliną, opis - zarodniki - prep. mikr. trwały, niebarw., pow. 100, 400/600 lub 1000x (immersja olejowa), (Olyvia) – rys. h) Russula emetica - Gołąbek wymiotny: - owocnik - prep. makr. utrw. 4% formaliną, opis - zarodniki - prep. mikr. trwały, niebarw., pow. 100, 400/600 lub 1000x (immersja olejowa), (Olyvia) – rys. 2. Rośliny naczyniowe a) Atropa belladonna - Pokrzyk wilcza jagoda: - owoce – prep. makr. w etanolu - pokaz b) Datura stramonium - Bieluń dziędzierzawa: - torebka nasienna – prep. makr. suchy - pokaz c) Digitalis purpurea - Naparstnica purpurowa: - łodyga z kwiatostanem - prep. makr. suchy - pokaz. 3. Zwierzęta jadowite a) Leiurus sp. - Skorpion - osobnik dorosły - prep. makr. suchy/utrw. w 4% formalinie – pokaz. 31 b) Apis mellifera - Pszczoła miodna: - imago - prep. makr. – pokaz - żądło - prep. mikr. utrw. etanolem, niebarw., pow.100 x, (Olyvia) – rys. c) Vespula vulgaris - Osa zwyczajna: - imago - prep. makr. – pokaz - żądło - prep. mikr. utrw. etanolem, niebarw., pow.100 x, (Olyvia) – rys. d) Vespa crabro - Szerszeń europejski (sz. groźny) - imago: - prep. makr. suchy – pokaz f) Bufo bufo - Ropucha szara: - osobnik dorosły - prep. makr. utrw. w 4% formalinie – pokaz g) Vipera berus - Żmija zygzakowata: - osobnik dorosły - prep. makr. utrw. w 4% formalinie – pokaz. Zakres materiału do przygotowania przed zajęciami Podstawowe pojęcia mykologii lekarskiej oraz pojęcia z morfologii i fizjologii grzybów; informacje o wymienionych organizmach Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Czynniki pochodzenia roślinnego i zwierzęcego w etiopatogenezie chorób człowieka oraz jako surowce farmaceutyczne; przykłady gatunków powodujących grzybice ludzi; mikotoksyny – definicja, podział, działanie na organizm człowieka i zwierząt; toksyny grzybów (działanie toksyn muchomora zielonawego, buławinki czerwonej - sporysz); jady zwierzęce (stawonogów – żądłówki, skorpiony, kręgowców – ropucha, żmija), roślinne surowce farmakologiczne (np. glikozydy nasercowe, skopolamina, atropina). 32 CZĘŚĆ TEORETYCZNA Grzyby Grzyby należą do organizmów cudzożywnych (nie posiadają chloroplastów), żyjących saprotroficznie lub pasożytniczo. Plechy ich składają się z komórek wegetatywnych i/lub ze strzępek. Rozmnażają się bezpłciowo przez różnego rodzaju zarodniki, a płciowo przez izogamię (pierwotna forma zapłodnienia, gamety są identyczne morfologicznie, różnią się fizjologicznie i genetycznie), anizogamię (gamety różnią się morfologicznie, fizjologicznie i genetycznie) i oogamię (rozmnażanie płciowe, w którym występuje duża nieruchoma komórka jajowa i mniejszy ruchliwy plemnik). Grzyby stanowią jedno z najliczniejszych królestw w obrębie organizmów żywych, liczące na świecie około 1,5 miliona gatunków obejmujących, zarówno grzyby mikroskopowe, jak i wielkoowocnikowe. Grzyby mogą wywoływać choroby ludzi, zwierząt i roślin. Szacuje się, że około 300 gatunków jest potencjalnie patogennych dla człowieka. Choroby powodowane przez grzyby: 1. Choroby alergiczne – nadwrażliwość na antygeny grzybicze np. wdychane z powietrzem zarodniki. 2. Grzybice (mycosis) – choroby roślin, zwierząt i człowieka wywołane przez mikroskopijne grzyby chorobotwórcze. 3. Mykotoksykozy - zatrucia ostre, przewlekłe, wywołane spożyciem toksyn grzybowych: grzybów mikroskopowych, najczęściej pleśniowych, zanieczyszczających żywność; „mykotoksykozy” (ostre lub przewlekłe); alkaloidów buławinki czerwonej (sporysz); obecnych w spożywanych owocnikach grzybów „kapeluszowych”. Choroby alergiczne – alergeny wziewne Choroby alergiczne stanowią rosnący problem medyczny w krajach rozwiniętych. Wykazano, że na przestrzeni ostanich 3 dekad częstość schorzeń alergicznych dynamicznie wzrasta zarówno u dzieci jak i dorosłych. Częstość chorób alergicznych u dzieci wynosi ok. 25 - 30%, w tym u ok. 10 - 20%, rozwija się w późniejszym okresie dzieciństwa (astma oskrzelowa, alergiczny nieżyt nosa i spojówek). Spośród alergenów wziewnych, zarodniki grzybów zajmują trzecie miejsce, pod względem częstości występowania, po pyłkach traw i alergenach roztoczy kurzu. Ponad 80 rodzajów grzybów może wywoływać u człowieka objawy alergii; największe znaczenie kliniczne mają: Alternaria, Aspergillus, Cladosporium, Mucor, Penicillium i Rhizopus. Powietrze stanowi ważny rezerwuar grzybów potencjalnie chorobotwórczych dla człowieka. Jednym z czynników warunkującym alergenność zarodników jest ich wielkość. W zależności od rozmiarów elementy bioareozolu (w tym zarodniki grzybów) mogą docierać do poszczególnych części górnych i/lub dolnych dróg oddechowych, wywołując charakterystyczne objawy chorobowe: pyłki traw, duże zarodniki grzybów (np. Alternaria sp.) zatrzymywane są w jamie nosowogardłowej – mogą powodować podrażnienie nosa i oczu, katar sienny; zarodniki takich grzybów jak Cladosporium sp., Mucor sp. lub Rhizopus sp. zatrzymywane są w oskrzelach – mogą wiązać się z rozwojem zapalenia oskrzeli/pęcherzyków płucnych, a także być związane z etiopatogenezą astmy oskrzelowej; większość bakterii i bardzo małe zarodniki grzybów (np. Aspergillus sp., Penicillium sp.) docierają do oskrzelików i pęcherzyków płucnych, wywołują alergiczne zapalenie pęcherzyków płucnych oraz astmę oskrzelową. Grzyby (zarodniki, elementy morfotyczne grzybni) obecne w powietrzu atmosferycznym, poza reakcją alergiczną, mogą także wywoływać grzybice, najczęściej u osób z osłabioną odpornością. Grzybice (mycoses, l.poj. mycosis) klasyfikujemy ze względu na czynnik etiologiczny (drożdże, grzyby pleśniowe, dermatofity), jego pochodzenie i lokalizację w organizmie człowieka (patrz wykłady). 33 Mykotoksyny Termin mykotoksyny został po raz pierwszy wprowadzony w 1962 r. po odnotowanym masowym pomorze indyków na farmach drobiowych w Anglii w 1960 r. Pierwsza zidentyfikowana mykotoksyna pochodziła z Aspergillus flavus i została zaklasyfikowana do grupy aflatoksyn. Obecnie znanych jest około 400 rodzajów mykotoksyn. Mykotoksyny (dawniej mikotoksyny) to drugorzędowe/wtórne metabolity grzybów mikroskopowych, które wykazują działanie toksyczne dla zwierząt (w tym człowieka), roślin, drobnoustrojów. Mogą one być magazynowane jako endotoksyny w grzybni i konidiach lub też wydzielane jako egzotoksyny do podłoża. Powodują zanieczyszczenie surowców i produktów przemysłu spożywczego, pasz oraz żywności pochodzenia zwierzęcego. Zdolność tworzenia mykotoksyn jest naturalną cechą wielu grzybów pleśniowych; najczęściej wytwarzane są one przez gatunki z rodzajów Penicillium, Aspergillus i Fusarium. Mykotoksyny cechuje niska masa cząsteczkowa, dobra rozpuszczalność w wodzie, a także niewrażliwość na wiele procesów technologicznych, takich jak gotowanie, smażenie, pieczenie.Podział metabolitów grzybów: zootoksyny – toksyczne dla zwierząt i człowieka – mykotoksyny (tabela 1); fitotoksyny – toksyczne dla roślin; antybiotyki – toksyczne dla drobnoustrojów (bakterie, grzyby, pierwotniaki). Tabela 1. Mykoksyny produkowane przez grzyby Rodzaj Mykotoksyna Aspergillus Aflatoksyna B1, G1, M1, ochratoksyna A, sterigmatocystyna, kwas cyklopiazonowy Penicillium Ochratoksyna A, cytrynina, patulina, kwas cyklopiazonowy, penitrem A Fusarium Trichoteceny (np. deoksyniwalenol, niwalenol, toksyna T-2, toksyna HT-2, diacetoksyscirpenol), zearalenon, fumonizyny, moniliformina Alternaria Kwas L-tenuazonowy, alternariol, alternariolmetyloeter Mykotoksyny charakteryzują się różnorodną aktywnością biologiczną; wykazują działanie: rakotwórcze (aflatoksyny, fumonizyny, ochratoksyna A), cytotoksyczne (aflatoksyny), embriotoksyczne (ochratoksyna A), teratogenne (ochratoksyna A) i mutagenne (aflatoksyny, sterigmatocystyna). Podział mykotoksyn w zależności od rodzaju wpływu na organizm człowieka: hepatotosyny - uszkadzają wątrobę [aflatoksyny (gł. aflatoksyna B1), sterigmatocystyna, rubratoksyna B, kwas penicylinowy]; nefrotoksyny - uszkadzają nerki (ochratoksyna A, cytrynina); kardiotoksyny - powodują choroby serca i układu krwionośnego (moniliformina); dermatotoksyny - prowadzą do uszkodzeń skóry i błon śluzowych (T-2 toksyna i inne trichoteceny); neurotoksyny - wywołują uszkodzenia układu nerwowego (fumonizyny - głównie fumonizyna B1); pulmotoksyny - powodują obrzęki płuc (fumonizyna B1); mykohormony - działające na regulację hormonalną, mające strukturę zbliżoną do hormonów (zearalenon); immunotoksyny grzybowe - obniżają odporność organizmu (trichoteceny i szereg innych mykotoksyn); rakotwórcze - udział w powstawaniu nowotworów (aflatoksyny, fumonizyny, ochratoksyny); genotoksyny - bezpośrednio uszkadzają materiał genetyczny (patulina); 34 o działaniu krwotocznym - trichoteceny; dermatotoksyczne - działające drażniąco na skórę i błony śluzowe (trichoteceny). Mykotoksykoza to zatrucie ostre lub przewlekłe, wywołane spożyciem toksyn grzybowych (głównie z produktami zbożowymi, warzywami, orzechami i innymi nasionami roślin oleistych i strączkowych, z owocami i przyprawami), a także wskutek inhalacji zarodników grzybów. Ważnym źródłem mikotoksyn jest pasza dla zwierząt hodowlanych, których mięso, mleko i jaja mogą stanowić poważne zagrożenie dla zdrowia człowieka. Przykłady mykotoksykoz u człowieka: zatrucie sporyszem – ergotyzm (patrz podrozdział Alkaloidy buławinki czerwonej); choroba żółtego ryżu – porażenie układu nerwowego i paraliż (podobna do beri-beri) – powodowana przez metabolity grzybów z rodzaju Penicillium (citreowirydyna, luteoskiryna, islanditoksyna, cytrynina i inne); żywieniowa białaczka toksyczna – porażenie układu nerwowego i zaburzenie czynności układu krwiotwórczego (śmiertelność 60%) – powodowana przez metabolity grzybów z rodzaju Fusarium, m.in. F. sporotrichioides i F. poae (trichoteceny, głównie toksyna T-2); nowotwory wątroby – długotrwałe spożywanie orzechów arachidowych zawierających aflatoksyny. Charakterystyka wybranych grup mykotoksyn: - aflatoksyny – wytwarzane m.in. przez Aspergillus flavus, Aspergillus fumigatus Działanie: hepatotoksyczne, rakotwórcze (rak wątroby), mutagenne, genotokstyczne (aflatoksyna B1), immunotoksyczne (wpływa na odpowiedź immunologiczną zależną od limfocytów CD4+). Nie ulegają rozkładowi w wysokiej temperaturze, ulegają degradacji pod wpływem światła nadfioletowego i tlenu atmosferycznego. Występowanie: orzeszki ziemne, nasiona roślin oleistych, ziarno kukurydzy, mleko, jaja kurze, figi, migdały, przyprawy (chili, papryka, gałka muszkatołowa, curry), mleko (aflatoksyna M1 i M2). - ochratoksyna A – wytarzana m.in. przez Aspergillus sp. (A. ochraceus), Penicillium sp. Działanie: neurotoksyczne, rakotwórcze, teratogenne, embriotoksyczne. Nie ulega rozkładowi podczas gotowania i smażenia. Występowanie: ziarna zbóż (pszenicy, owsa, jęczmienia, żyta, kukurydzy), ziarna kawy, źle wysuszone produkty zielarskie. - patulina – wytwarzana m.in. przez Penicillium sp., Aspergillus sp. Działanie: genotoksyczne. Występowanie: owoce, głównie jabłka (soki, musy, puree). - trichoteceny – produkowane przez Fusarium sp. (gatunki pasożytnicze roślin uprawnych) Działanie: krwotoczne, cytotoksyczne, dermatotoksyczne, hamują syntezę białek w komórkach. Występowanie: ziarna zbóż. Przykłady: deoksyniwalenol, toksyna T-2, HT-2, niwalenol. 35 - fumonizyny – wytwarzane przez Fusarium sp. (Fusarium moniliforme) Działanie: neurotoksyczne, hepatotoksyczne, pneumotoksyczne, rakotwórcze (rak przełyku, rak wątroby). Występowanie: kukurydza (ziarno, mąka, grysik). - zearalenon – wytwarzane przez Fusarium sp., Gibberella sp. Działanie: powodują zespół estrogenny u zwierząt (niepłodność samic, feminizacja samców). Występowanie: ziarna zbóż (owies, żyto, pszenica, ryż, kukurydza, sorgo). Alkaloidy buławinki czerwonej - Claviceps purpurea Przetrwalnik (ergot, sporysz, „rogate żyto”, Secale cornutum) tego workowca rozwija się w kłosach zbóż i traw; może stanowić zagrożenie dla ludzi i zwierząt w przypadku spożycia zanieczyszczonych przetworów zbożowych (mąki, paszy). Zawiera alkaloidy pochodne kwasu lizergowego porażające zakończenia nerwów współczulnych i pobudzające do skurczów mięśnie gładkie (macicy, obwodowych naczyń krwionośnych). Wyróżnia się dwie grupy alkaloidów: peptydowe (ergotamina, ergotoksyna); amidowe (ergometryna). W przypadku zatrucia alkaloidami sporyszu następuje pobudzenie ośrodkowego układu nerwowego. Objawami zatrucia są bóle brzucha, wymioty, biegunka, zawroty i bóle głowy, zaburzenia czucia i widzenia, drgawki, duszność, porażenie oddechu. U chorego należy sprowokować wymioty, podać węgiel aktywowany, przewieźć do szpitala. Alkaloidy sporyszu stosowane są jako składniki preparatów złożonych: w położnictwie, ginekologii, w nerwicach wegetatywnych, migrenach. Zatrucia grzybami wielkoowocnikowymi (kapeluszowymi) Substancje toksyczne owocników grzybów jadalnych to związki chemiczne o różnym mechanizmie działania na organizm człowieka. Owocniki grzybów zbierane w środowisku naturalnym mogą być przyczyną zatruć pokarmowych. Do grzybów określanych, jako śmiertelnie trujące zaliczane są: muchomor zielonawy (sromotnikowy) Amanita phalloides, muchomor jadowity, muchomor wiosenny, piestrzenica kasztanowata, zasłonak rudy, strzępiak ceglasty, hełmówki i niektóre gatunki z rodzaju czubajka. Zależnie od mechanizmu działania związków toksycznych wyróżnia się następujące grupy toksyn grzybów kapeluszowych: 1. o działaniu cytotoksycznym (czynniki toksyczne: amanityna, orelanina, gyromitryna) – uszkadzają narządy miąższowe (wątroba, nerki, ośrodkowy układ nerwowy); muchomor sromotnikowy, hełmówki, zasłonaki, piestrzenica kasztanowata; 2. blokujące metabolizm alkoholu etylowego (czynnik toksyczny: kopryna) – gatunki z rodzaju czernidłak – młode owocniki są jadalne, ale po konsumpcji alkoholu w 3 do 48 (a nawet 72) godzin po spożyciu tych grzybów mogą wystąpić objawy zatrucia a nawet zgon; 3. o działaniu cholinergicznym (czynnik toksyczny: muskaryna) – pobudzenie przywspółczulnego układu nerwowego w wyniku działania na receptory muskarynowe; strzępiaki, lejkówki, borowiki ponury i szatański (potocznie nieprawidłowo określany, jako: „borowik szatan”, który należy do gatunków wymarłych, lub mylony z goryczakiem żółciowym), muchomor czerwony; 4. o działaniu ośrodkowym atropinopodobnym (czynnik toksyczny: muscymol); muchomory plamisty także móchomor czerwony; 5. halucynogenne (czynniki toksyczne: psylocybina, psylocyna); gatunki z rodzajów kołpaczek i pierścieniak; 36 6. o działaniu gastroenterotoksycznym (różnorodne czynniki toksyczne) – krowiak podwinięty, wieruszka zatokowa, tęgoskór pospolity, pieczarka żółtawa, muchomor cytrynowy, gołąbek wymiotny, gąska tygrysowata. Grzyby z poszczególnych grup mogą wykazywać także działanie typowe dla innych grup. Zwykle wszystkie powodują zaburzenia żołądkowo-jelitowe. Amanita phalloides - muchomor zielonawy (sromotnikowy) Muchomor najczęściej mylony jest z: gołąbkami (Russula sp.), gąską żółtą zwaną też zielonką (Tricholoma flavovireus), czubajką kanią (Microlepiota procera) oraz z pieczarką polną (Agaricus campestris). Substancje toksyczne zawarte w muchomorze sromotnikowym to cyklopeptydy – amatoksyny (amanityny α, β, γ), które zakłócają transkrypcję DNA – blokada polimerazy RNA, uszkadzają błonę śluzową przewodu pokarmowego i powodują martwicę komórek wątroby i kanalików nerkowych oraz fallotoksyny i wirotoksyny. Wszystkie zaliczane są do substancji ciepłostabilnych – nie są wrażliwe na wysoką temperaturę (temperatura rozkładu fallotoksyn wynosi 280-282°C, amatoksyn 245°C). Dawka śmiertelna amatoksyn dla człowieka to 0,1 mg/kg masy ciała. Cechy morfologiczne owocnika: gładki żółtozielony lub oliwkowozielony kapelusz, białe blaszki, biały trzon, duży, słabo prążkowany pierścień na trzonie, bulwiasta, zgrubiała nasada trzonu otoczona wysoką odstającą pochwą, zarodniki eliptyczne z wyrostkiem (apikulem) bezbarwne, o gładkiej powierzchni, średnica 7-12 µm (znaczenie w diagnostyce sporologicznej wymiocin w przypadku zatrucia). Zatrucie śmiertelne może wystąpić już po spożyciu około 50 g grzyba (średniej wielkości owocnik). Toksyny wnikają do komórek w ciągu 4–6 h od spożycia; po 8-40 h pojawiają się nudności, bóle brzucha, wymioty, biegunka, następujące odwodnienie powoduje wstrząs sercowo-naczyniowy, tachykardię, spadek ciśnienia tętniczego; w 3–4 dniu pojawiają się objawy uszkodzenia wątroby: żółtaczka, skaza krwotoczna; niewydolność nerek, kwasica metaboliczna - może nastąpić zgon. Zatrucie muchomorem sromotnikowym prowadzi do wystąpienia zespołu sromotnikowego, który charakteryzuje się czterema okresami klinicznymi: 1. utajenia objawów; 2. ostrego nieżytu żołądkowojelitowego; 3. pozornej poprawy; 4. uszkodzeń narządowych. W przypadku zatrucia muchomorem postępowanie przedlekarskie obejmuje: podanie węgla aktywowanego i szybko działającego środka przeczyszczającego (skuteczność wątpliwa) oraz zabezpieczenie wymiocin do badania mykologicznego. Leczenie obejmuje: płukanie żołądka (ma znaczenie w pierwszych kilkudziesięciu minutach od spożycia grzyba), uzupełnianie elektrolitów, podawanie glukozy i witaminy K, hemodializy, a w przypadkach ciężkich uszkodzeń wątroby (zagrożenie życia) przeszczep wątroby (transplantację można przeprowadzić od 4 dnia zespołu sromotnikowego). Paxillus involutus - krowiak podwinięty; olszówka Do końca lat 80. XX w. olszówka uznawana była za grzyb jadalny; objawy zatrucia mogą się pojawić po kilku, kilkunastu (nawet 10-15) latach. Toksyna – inwolutyna - kumuluje się w organizmie i powoduje rozwój zespołu hemolitycznego (objawy anemii podobnej do zespołu białaczkowego). Rusulla emetica – gołąbek wymiotny Miąższ ma delikatnie owocowy zapach oraz gorzki, piekący i długo utrzymujący się w ustach smak. Jest trujący, po zjedzeniu nawet małej ilości powoduje bóle brzucha, mdłości i wymioty. 37 Rośliny o znaczeniu medycznym W bezpośrednim sąsiedztwie człowieka obecnych jest wiele gatunków trujących roślin, m.in. konwalia majowa, bluszcz pospolity, ligustr pospolity, cis pospolity, rącznik pospolity, oleander pospolity. Jest też spora grupa roślin, które posiadają właściwości zarówno trujące jak i lecznicze. Rośliny te zawierają bardzo zróżnicowane pod względem budowy chemicznej związki chemiczne, zwane substancjami czynnymi, wykazujące różnorodne oddziaływanie na organizm człowieka. W roślinach te związki działają toksycznie chroniąc przed zwierzętami roślinożernymi i pasożytami. U ludzi ten sam związek chemiczny w zależności od dawki może wywoływać pożądane skutki terapeutyczne lub zaburzyć funkcje życiowe organizmu, a nawet doprowadzić do zgonu. Wiedza dotycząca wykorzystywania roślin w lecznictwie - ziołolecznictwo (fitoterapia) - była przekazywana zpokoloenia na pokolenie. Obecnie, badaniem substancji czynnych roślin zajmuje się farmakognozja, Poznano już ok. 50 tysięcy, a 50% produkcji przemysłu farmaceutycznego opiera się na substancjach roślinnych. Najważniejszymi grupami metabolitów wtórnych roslin są: alkaloidy, glikozydy, saponiny, olejki eteryczne, kwasy organiczne oraz: glukozynolany, kumaryny i pochodne furanokumaryny, lektyny, a także fitoestrogeny. Alkaloidy to zasadowe związki organiczne, zawierające azot, wykazują zróżnicowaną aktywność biologiczną. Wyróżniamy 3 główne grupy: alkaloidy właściwe (stanowią największą grupę alkaloidów) – posiadają atom azotu w pierścieniu heterocyklicznym; ich prekursorami są aminokwasy lub aminy biogenne (np. nikotyna, kokaina, morfina strychnina); protoalkaloidy – posiadają atom azotu w łańcuchu bocznym, powstają z aminokwasów lub amin biogennych (np. efedryna, kapsaicyna, serotonina); pseudoalkaloidy – są zasadami roślinnymi, których azot nie pochodzi z aminokwasów – został wbudowany w trakcie biosyntezy do już istniejącego szkieletu; ich prekursorami są m.in. irydoidy, sterydy oraz terpeny (np. kolchicyna). Glikozydy to związki organiczne zbudowane z części cukrowej i aglikonowej (niecukrowy składnik glikozydów połączony z cukrem wiązaniem glikozydowym, np. alkohole, kwasy karboksylowe). Fitoncydy to substancje o charakterze lotnych olejków eterycznych wytwarzane przez rośliny wyższe wykazujące działanie bakteriostatyczne, bakteriobójcze, grzybobójcze i pierwotniakobójcze. Stosowane są w leczeniu górnych dróg oddechowych (drogą inhalacyjną i doustną), wykazują synergizm z antybiotykami. Szczególnie silnie działanie mają fitoncydy zawarte w olejkach: rumiankowym, tymiankowym, miętowym, lawendowym, bergamotowym, goździkowym, eukaliptusowym. Bardzo szerokie zastosowanie mają fitoncydy czosnku, które m.in.: wykazują działanie przeciwbakteryjne wobec bakterii Gram + i Gram – stosowane są w zwalczaniu infekcji (głównie układu oddechowego); mogą obniżać ciśnienie krwi i stężenie cholesterolu w krwi – zapobiegają chorobom serca; mają działanie immunomodulujące. Wybrane związki roślinne aktywne biologicznie są omówione w tabeli 2. 38 Tabela 2. Wybrane związki roślinne aktywne biologicznie. Działanie Występowanie (przykłady) śluzy roślinne osłaniające, zmiękczające, ochronne i przeciwzapalne nasiona lnu, korzeń i liść prawoślazu, porost islandzki, nasiona kozieradki, nasiona babki płesznik kumaryny (związki z grupy benzopironów, w roślinach występują jako glikozydy) przeciwnowotworowe, antyalergiczne, przeciwzapalne oraz przeciwzakrzepowe zielona herbata, malina nordycka, kawa, borówka amerykańska, brokuły, papryka, pomidory flawonoidy antyoksydacyjne, przeciwzapalne i przeciwalergiczne, estrogenne, obniżające ciśnienie, przeciwzakrzepowe, przeciwbakteryjne, przeciwwirusowe, przeciwgrzybicze czarna porzeczka (antocyjany), soja i rośliny strączkowe (izoflawony), herbata (flawonole) antranoidy (pochodne antracenu) przeczyszczające liść senesu irydoidy (pochodne irydodialu) uspakajające, hipotensyjne, przeciwzapalne korzeń kozłka, owoc derenia saponiny (glikozydy) wykrztuśne, pobudzające wydzielanie żółci i soków trawiennych, przeciwzapalne, przeciwobrzękowe i uszczelniające na naczynia włosowate lukrecja, kasztanowiec, żeń-szeń garbniki (pochodne fenoli) obkurczające drobne naczynia krwionośne, ograniczające stan zapalny, zmniejszające swędzenie i pieczenie kora dębu, owoce borówki czarnej, kłącze wężownika, kora oczaru, liść jeżyny glukozynolany (należą do tioglikozydów) przeciwnowotworowe, przeciwzapalne oraz ochronne przed stresem oksydacyjnym i reaktywnymi formami tlenu biała kapusta, rzepak, gorczyca, brukselka, brokuł Przykłady roślin o znaczeniu medycznym: Atropa belladonna - pokrzyk wilcza jagoda Alkaloidami występującymi w pokrzyku są: hioscyjamina (L-atropina), atropina, skopolamina, beladonina. Porażają one nerwy przywspółczulne autonomicznego układu nerwowego wywołując: rozkurcz mięśni gładkich – działanie parasympatykolityczne, przyspieszenie akcji serca - tachykardia, pobudzenie ośrodkowego układu nerwowego (pobudzenie psychoruchowe), rozszerzenie źrenic, 39 suchość w jamie ustnej, konwulsje, zaburzenia świadomości, drgawki. Objawy zatrucia pojawiają się w ciągu 15 minut: zaczerwienienie twarzy, wyschnięcie śluzówek, przyspieszenie tętna, rozszerzenie źrenic, niepokój, halucynacje, napady szału, śmierć w skutek paraliżu mięśni oddechowych.Atropina jest stosowana w leczeniu astmy oskrzelowej, zwalczaniu skurczów przewodu pokarmowego, występujących, np. w chorobie wrzodowej. Znalazła zastosowanie w zwalczaniu objawów choroby lokomocyjnej dzięki właściwościom przeciwwymiotnym. W okulistyce powoduje rozluźnienie mięśni okrężnych oka, stosowana jest w leczeniu stanów zapalnych naczyniówki i siatkówki oraz wykorzystywana w diagnostyce w celu długotrwałego rozszerzenia źrenic. Atropina stosowana jest w bradykardii, w celu przywrócenia prawidłowej akcji serca. Datura stramonium - bieluń dziędzierzawa Zawiera alkaloidy takie, jak Atropa belladonna, ale ma większe ilości skopolaminy działającej porażająco na ośrodkowy układ nerwowy i obwodowe nerwy przywspółczulne (działanie parasympatykolityczne). Objawy zatrucia: pobudzenie od stanów euforycznych po napady szału, mdłości, zaczerwienienie skóry, omamy, odurzenie, rozszerzenie źrenic, zaburzenie widzenia, śmierć w wyniku paraliżu mięśni oddechowych. Stosowany w medycynie jako środek przeciwastmatyczny łagodzi ataki choroby. Digitalis purpurea - naparstnica purpurowa Zawiera kardenolidy (glikozydy nasercowe m.in. purpureaglikozydy A i B, digitoksynę, werodoksynę, glukogitaloksynę). Podstawowym glikozydem jest digitoksyna, charakteryzująca się prawie 100% wchłanianiem z przewodu pokarmowego i zdolnością do silnego wiązania z białkami w surowicy krwi; jest powoli wydalana i wykazuje duży stopień kumulacji w organizmie. Digitalis lanata - naparstnica wełnista Zawiera kardenolidy (glikozydy nasercowe np. lanatozydy A,B,C,D,E, digitoksynę, digoksynę, diginatynę, acetylodigitoksynę).Kardenolidy wykazują działanie: „+” inotropowe i tonotropowe (wzrost siły skurczu i napięcia mięśnia sercowego); „-” chronotropowe i dromotropowe (spadek częstotliwości skurczów serca i przewodnictwa). Objawami zatrucia tymi glikozydami są: spadek częstotliwości uderzeń serca, mdłości, wymioty, kolki żołądkowo-jelitowe, zaburzenia widzenia, paraliż, skurcze; śmierć następuje wskutek zatrzymania akcji serca. Stosowany w medycynie w przypadku niewydolności krążenia, niewydolności mięśnia sercowego, zaburzeniach rytmu serca (migotanie przedsionków), w zawale mięśnia sercowego. Naturalne glikozydy nasercowe naparstnicy pupurowej z jednej strony stanowią źródło leków, zaś z drugiej po spożyciu mogą spowodować zatrucie. Już po 1,5-3 krotnym przekroczeniu dawki terapeutycznej, mogą wystąpić objawy zatrucia, często zagrażające życiu pacjenta. Obecnie w farmakoterapii wykorzystywane są głównie najbardziej stabilne farmakokinetycznie glikozydy kardenolidowe naparstnicy wełnistej (działają czterokrotnie silniej niż te pozyskiwane z liści naparstnicy purpurowej), które dzięki szybszemu wchłanianiu i wydalaniu z organizmu słabiej się kumulują. Convallaria majalis - konwalia majowa Najważniejszymi związkami czynnymi znajdującymi się w tej roślinie są glikozydy kardenolidowe (m.in. konwalatoksyna, konwalatoksol), które działają tonizująco na mięsień sercowy, wzmacniają siłę skurczu mięśnia i nieznacznie zwalniają tempo jego pracy. Glikozydy te słabo się kumulują – działają szybko i krótko (zmniejsza to prawdopodobieństwo nadmiernego nagromadzenia się i wystąpienia objawów toksycznych). Objawy zatrucia to głownie mdłości, wymioty, biegunka, zaburzenie rytmu serca, 40 najpierw zwiększenie, potem obniżenie ciśnienia krwi, osłabienie oraz zatrzymanie pracy serca. Stosowanny w osłabieniu mięśnia sercowego. Zwierzęta o znaczeniu medycznym – zwierzęta jadowite Szczególnie niebezpieczne dla człowieka są zwierzęta należące do gatunków jadowitych, które poza wytwarzaniem związków toksycznych mają możliwość ich aktywnego wprowadzania do tkanek innych zwierząt, w tym człowieka. Skorpiony Skorpiony to wolno żyjące pajęczaki o wielkości od 13 do ok. 200 mm długości występujące w krajach klimatu tropikalnego i subtropikalnego. Ciało tych zwierząt podzielone jest na głowotułów i odwłok (przedodwłok i zaodwłok z kolcem jadowym). Prowadzą nocny tryb życia, są żyworodne i mogą przetrwać niekorzystne warunki środowiska dzięki zdolności do hibernacji. Jady różnych gatunków skorpionów są mieszaniną związków (neurotoksyny, inhibitory enzymów, itp.) i powodują odmienny efekt (spośród ok. 2000 znanych gatunków, 5 zawiera jad zdolny zabić człowieka; u osób uczulonych na jad skorpiona obserwowana jest różna intensywność reakcji w zależności od wrażliwości organizmu). Leiurus quinquestriatus Gatunek skorpiona występujący w Afryce Północnej i na Bliskim Wschodzie. Jad zawiera neurotoksyny powodujące gwałtowne reakcje ogólne bez uprzednich reakcji miejscowych. Wartość DL50 jadu waha się od 0,16 do 0,50 mg/kg mc. W ciągu 24-48 godzin może dojść do śmierci z powodu niewydolności krążenia lub oddychania, głównie u dzieci. Żądłówki Żądłówki to owady należące do rzędu Hymenoptera (błonkoskrzydłe), m.in. pszczoły, trzmiele i osowate (osa, szerszeń, klecanka). Składnikami jadu żądłówek są: substancje niskocząsteczkowe (histamina, serotonina, acetylocholina, katecholaminy), peptydy (m. in. melityna, apamina, kininy), enzymy (hialuronidaza, fosfolipaza, fosfataza). Jady osy pospolitej (Vespula vulgaris) i pszczoły miodnej (Apis mellifera) różnią się, chociaż niektóre z ich składników mają bardzo zbliżoną budowę, jak enzymy: hialuronidaza czy, w mniejszym stopniu, fosfolipaza. Ważny peptyd silnie uszkadzający komórki – melityna – występuje jedynie w jadzie pszczoły, podczas gdy białko – antygen 5 – obecne jest tylko w jadzie osowatych. Istnieje bardzo duże podobieństwo pomiędzy składnikami jadu w obrębie rodziny pszczołowatych (pszczoły, trzmiele) i poszczególnych gatunków osowatych (tabela 3). Tabela 3. Porównanie składu jadu żądłówek. Jad osy bardziej immunogenny antygen 5 (główny alergen), fosfolipaza A, hialuronidaza, kininy Jad pszczoły mniej immunogenny melityna, apamina, peptyd MCD, fosfolipazy: A2 i kwaśna, hialuronidaza 41 Charakterystyka wybranych składników jadu: Fosfolipaza A2 (10-12% jadu pszczoły) wykazuje silne działanie alergizujące, niszczy erytrocyty, hydrolizuje fosfolipidy w błonach komórkowych, powoduje obniżenie ciśnienia krwi oraz blokuje procesy krzepnięcia krwi. Apamina powoduje zaburzenia gospodarki wodno-elektrolitowej, skurcze mięśni gładkich i poprzecznie prążkowanych. Melityna (50-55% jadu pszczoły) powoduje rozpad erytrocytów, stany zapalne, ból, skurcz oskrzeli, osłabienie krzepnięcia krwi, wywołuje lizę komórek, działa na ośrodkowy układ nerwowy, w wysokich dawkach powoduje m.in. bradykardię, upośledzone przewodzenie, arytmię, wzmaga perystaltykę jelit. Peptyd MCD (2-3% jadu pszczoły) powoduje uwolnienie z komórek tucznych heparyny i histaminy, odpowiada za ogólnoustrojowe skurcze mięśni, bóle i powoduje nadczynność ruchową. Hialuronidaza wykazuje silne działanie alergizujące, powoduje przekrwienie i zwiększa przepuszczalność naczyń krwionośnych, ułatwia rozprzestrzenianie się jadu w organizmie. Fosfatazy kwaśnie wykazują silne działanie alergizujące. Kininy silnie obniżają ciśnienie krwi, powodują ostre przekrwienie skóry i silny miejscowy ból (kininy jadu szerszenia działają słabiej niż występujące w jadzie osy) Wartość DL50 jest różna dla poszczególnych składników jadu pszczoły i wynosi od 3,5 mg/kg (melityna – najbardziej toksyczna) do 40 mg/kg (peptyd MCD) masy ciała. Średnia zawartość woreczka jadowego robotnic wynosi 0,3 mg jadu. Ilość jadu wprowadzonego do ciała ofiary podczas żądlenia przez pszczołę wynosi około 0,012 mg (dla porównania osa podczas żądlenia wprowadza około 0,0031 mg jadu). Warto zwrócić uwagę, że jad pszczoły jest 1,7 do 15 razy silniejszy od jadu szerszenia. Pszczoła - robotnica może użądlić tylko raz i po użądleniu ginie; pozostawia w skórze człowieka fragment odwłoka z aparatem żądłowym (żądło wraz z zawierającym jad woreczkiem jadowym, zwojem nerwowym oraz mięśniami działającymi jak pompka). Budowa i mechanizm działania żądła powodują dalsze jego zagłębianie się w skórze i wstrzykiwanie pozostałej w woreczku porcji jadu. Osy nie pozostawiają żądła w skórze, mogą żądlić wielokrotnie, a porcja jadu jest kilkakrotnie mniejsza niż w przypadku pszczoły. Aby usuwanąć żądło pszczoły najlepiej jest podważyć je np. ostrzem noża, paznokciem i wyciągnąć („zdrapać”) nie ściskając palcami (ściskając woreczek jadowy wprowadzamy dodatkową porcję jadu do ciała). Ważne jest jak najszybsze usunięcie jadu, ponieważ już po ok. 1 minucie uwalniana jest cała ilość jadu z aparatu żądłowego. Żądła osy i pszczoły posiadają harpunowato zagięte ku tyłowi ząbki; u osy są jednak znacznie mniejsze niż u pszczoły. Vespa crabro - szerszeń europejski Występuje powszechnie na całym świecie z wyjątkiem Australii, Nowej Zelandii i zimnych stref klimatycznych; pospolity na terenie całej Polski. Owad należy do rodziny osowatych (Vespidae), z grupy żądłówek. Użądlenie szerszenia jest boleśniejsze od użądleń pszczół czy os z powodu większego i głębiej penetrującego żądła. Skład jadu szerszenia zbliżony jest do jadu osy. Szerszeń podobnie jak pszczoła i trzmiel atakują tylko, jeśli są sprowokowane. Jedynie osa może użądlić niezaatakowana. Reakcje organizmu człowieka na jad żądłówek Użądlenie przez owady błonkoskrzydłe jest bolesne i w większości przypadków powoduje ograniczoną reakcję miejscową; szczególnie niebezpieczne są użądlenia w okolice głowy i szyi - skutki działania jadu na ośrodkowy układ nerwowy, w okolice krtani i gardła → obrzęk, uduszenie (tabela 4). U około 20% ludzi występują rozległe reakcje alergiczne (różne nasilenie: od pokrzywki, uczucia niepokoju, przez objawy ze strony układu pokarmowego, zamroczenie, duszności, obrzęki stawów). 42 Tabela 4. Objawy alergii na jad owadów błonkoskrzydłych (ocena nasilenia reakcji wg Müllera 1990). Silna reakcja miejscowa Obrzęk w miejscu użądlenia przekraczający 10 cm średnicy i trwający ponad 24 godziny Reakcje ogólne I stopień Objawy ogólne o niewielkim nasileniu: pokrzywka, świąd skóry, osłabienie, niepokój II stopień Reakcja ogólna: jakikolwiek z wyżej wymienionych objawów i co najmniej 2 z następujących: obrzęk naczynioruchowy, uczucie ucisku w klatce piersiowej, duszności, nudności, wymioty, biegunka, bóle brzucha, zawroty głowy III stopień Ostra reakcja ogólna: jakikolwiek z wyżej wymienionych objawów i co najmniej 2 z następujących: duszność, świszczący wydech, stridor, zaburzenia mowy, chrypka, osłabienie, splątanie, lęk przed śmiercią IV stopień Reakcja wstrząsowa: jakikolwiek z wyżej wymienionych objawów i co najmniej 2 z następujących: spadek ciśnienia tętniczego krwi, zapaść, utrata przytomności, nietrzymanie moczu i stolca, sinica Istnieją trzy rodzaje reakcji na użądlenia żądłówek: normalna – jest wynikiem działania niewielkiej ilości toksyn zawartych w jadzie, występuje u osób nieuczulonych; głównymi objawami są: ból, zaczerwienienie, niewielki obrzęk, uczucie gorąca w miejscu użądlenia. Reakcja tego typu trwa zazwyczaj kilkadziesiąt minut (rzadziej kilka godzin); toksyczna – występuje, gdy do organizmu dostaje się duża ilość substancji toksycznych zawartych w jadzie (m.in. wielokrotne użądlenia); pojawiają się objawy ogólne, m.in. skurcze mięśni, ból głowy, temperatura; alergiczna – występuje u osób uczulonych; wyróżnia się dwa rodzaje reakcji: duża reakcja miejscowa (w miejscu użądlenia pojawia się znaczny obrzęk, może obejmować całą kończynę i utrzymywać się kilka godzin, niekiedy dni) oraz reakcja uogólniona (obejmuje też inne części ciała poza miejscem użądlenia). U części chorych w wyniku użądlenia przez owady błonkoskrzydłe dochodzi do rozwoju rzadkich reakcji nietypowych, które pojawiają się w kilka godzin do kilku dni od użądlenia. Należą do nich: choroba posurowicza, zmiany neurologiczne, tj. uszkodzenie nerwów czaszkowych, obwodowych, napady padaczkowe, porażenie połowicze, zespół psychoorganiczny, ostra niewydolność nerek, skaza krwotoczna (trombocytopenia), zespół rozsianego wykrzepiania wewnątrznaczyniowego, zawał mięśnia sercowego, zaburzenia rytmu serca. Osoby nadwrażliwe powinny być zaopatrzone w ampułko-strzykawkę zawierającą adrenalinę = epinefrynę (Anapen, Fastject). Bardzo ważna jest znajomość biologii owadów, co pozwala na zastosowanie środków zmniejszających ryzyko ponownego użądlenia (niewykonywanie nagłych ruchów, nienoszenie ubrań w jaskrawych kolorach, nieużywanie perfum, których zapach drażni owady, 43 unikanie spożywania słodyczy na wolnym powietrzu). Należy pamiętać, iż wraz ze wzrostem temperatury i wilgotności powietrza owady stają się bardziej agresywne. Jadowite pająki w Polsce Meta menardi - sieciarz jaskiniowy Najbardziej jadowity pająk w Polsce, występuje w studzienkach kanalizacyjnych, telekomunikacyjnych, jaskiniach, piwnicach, a także u wylotów tuneli kolejowych. Gatunek ten osiąga pokaźne rozmiary – odwłok liczy jedynie 1,5 cm długości, ale wraz z odnóżami jego ciało ma około 5 cm. Jego jad nie stanowi zagrożenia dla życia człowieka, ale ukąszenie jest bolesne – porównuje się je do użądlenia przez szerszenia. Cheiracanthium punctorium - kolczak zbrojny Gatunek średniej wielkości pająka z rodziny zbrojnikowatych (Cheiracanthiidae). Osiąga około 10–15 mm długości, ma duże szczękoczułki. Występuje w Europie (głównie w Niemczech, Francji, Szwajcarii, Włoszech i dawnej Jugosławii, w Polsce - na południu kraju) i Azji; lubi wysokie temperatury. Poluje na owady ze swojej rurkowatej pajęczyny. Jest jednym z nielicznych pająków występujących w Polsce, których ukąszenie wywołuje objawy zatrucia. Po ukąszeniu pojawia się piekący ból i stan zapalny. Jad zawiera hemolizyny; jest śmiertelny dla owadów, natomiast u człowieka powoduje długotrwały ból, osłabienie i dreszcze. Objawy ukąszenia (przyspieszone bicie serca, omdlenia i wymioty) mogą utrzymywać się do dwóch tygodni. Nie odnotowano przypadków zgonów po ukąszeniu kolczaka. Krzyżaki Z reguły gatunki niegroźne dla człowieka; w przypadku ukąszenia w skrajnych przypadkach może na ciele wystąpić opuchlizna i martwica tkanek w postaci dwóch małych punktów. Płazy wytwarzające jad Bufo bufo - ropucha szara Jeden z największych płazów występujących w Polsce. W brodawkach skórnych znajdują się gruczoły jadowe wydzielające bufogeniny i bufoteniny. W niskich dawkach pobudzają one aktywność mięśnia sercowego, w wysokich – hamują. W tradycyjnej medycynie chińskiej suszone ropuchy były stosowane w leczeniu chorób serca. Jadowite węże w Polsce Vipera berus - żmija zygzakowata Jedyny jadowity wąż występujący w Polsce. Należy do zwierząt nocnych, ale poluje w dzień i w nocy. Ilość produkowanego jadu jest znikoma w stosunku do skutków, jakie pociąga za sobą. W Europie liczbę przypadków ukąszeń przez węże, głównie z rodziny żmijowatych (Viperidae), szacuje się na 15– 25 tys., a liczbę zgonów na około 30 rocznie. Większość przypadków ukąszeń przez żmiję zygzakowatą ma przebieg łagodny (70-80% bezobjawowo lub tylko objawy miejscowe). Zgony dotyczą dzieci, osób starszych i osób ze schorzeniami układu sercowo-naczyniowego. Śmiertelność wynosi poniżej 1%. W miejscu ukąszenia widoczne są dwa małe punkty po zębach jadowych, oddalone o około 1cm. Po ukąszeniu występuje zwykle silny ból i nasilający się bolesny obrzęk tkanki podskórnej rozprzestrzeniający się na 44 przylegającą część ciała. Skóra przyjmuje sinoczerwone zabarwienie; mogą pojawić się wybroczyny w skórze, martwica. Główne składniki jadu: hemoragina, która uszkadza ściany naczyń krwionośnych - powoduje krwawienia z nosa, krwiomocz, wynaczynienia krwi; hemolizyna, która powoduje rozpad erytrocytów – powoduje niedokrwistość i żółtaczkę; neurotoksyna, która poraża układ nerwowy – wywołuje zawroty głowy, nudności, wymioty; hialuronidaza (enzym trawiący polimer kwasu hialuronowego) – rozkłada główny składnik istoty podstawowej tkanki łącznej - ułatwia rozprzestrzenianie się jadu. Objawami uogólnionego zatrucia są: nudności, bóle brzucha, wymioty, biegunka, nadmierna potliwość, gorączka, pragnienie, zawroty głowy, krwawienia z dziąseł, krwiomocz, objawy wstrząsu: hipotensja, tachykardia, zimne poty, bladość, zaburzenia świadomości. U osób nadwrażliwych na składniki jadu może pojawić się pokrzywka, obrzęk naczynioruchowy i wstrząs anafilaktyczny. Pierwsza pomoc w ukąszeniu przez żmiję: ułożyć wygodnie osobę ukąszoną, przykryć ranę jałową gazą, unieruchomić kończynę, założyć szeroką elastyczną opaskę, kilka cm nad miejscem ukąszenia (zahamowanie odpływu krwi żylnej z okolic ukąszenia, ale nieutrudniony przepływ tętniczy – ryzyko martwicy tkanek), jak najszybciej umieścić chorego w szpitalu. Postępowanie szpitalne: powoli podać dożylnie (nie w chorą kończynę) antytoksynę jadu żmii (swoista końska immunoglobulina G – uzyskiwana z surowicy koni immunizowanych jadem europejskiej żmii zygzakowatej). Przed podaniem należy wykonać śródskórną próbę uczuleniową, a jeśli to niemożliwe podawać antytoksynę jadu żmii wraz ze środkami przeciwwstrząsowymi (wstrzyknięcie adrenaliny). Ze względu na obcogatunkowe białko wchodzące w skład preparatu, po podaniu antytoksyny mogą wystąpić odczyny anafilaktyczne do wstrząsu włącznie. Wczesne reakcje anafilaktyczne występują już w ciągu 10-180 minut od rozpoczęcia iniekcji: gorączka, świąd, pokrzywka, suchy kaszel, nudności i wymioty, biegunka, kolka brzuszna, tachykardia. U niektórych osób mogą wystąpić zagrażające życiu: skurcz oskrzeli, niedociśnienie, obrzęk naczynioruchowy. 45 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA 1. Wpływ mykotoksyn na organizmy żywe - ocena wrażliwości Paramecium sp. na wyciąg z grzybni A. flavus WYKONANIE: Materiały i odczynniki: - wodny wyciąg z grzybni Aspergillus flavus, - hodowla sianowa Paramecium sp., Sprzęt i aparatura: - lupa, - probówki, - pipety, - szkiełka z łezką. Protokół doświadczenia: 1. Kroplę z hodowli Paramecium sp. pobraną pipetą z górnej warstwy pożywki sianowej (geotaksja ujemna) przenieść na szkiełko podstawowe z łezką i oglądać w powiększeniu 25x. 2. Po stwierdzeniu aktywnego ruchu pierwotniaków, dodać jedną kroplę wodnego wyciągu z grzybni Aspergillus flavus i obserwować zachowanie się pantofelków bezpośrednio po jego dodaniu, po 3 min oraz po 1 godz. Za kryterium śmierci przyjąć brak ruchu pantofelków. Kontrola - do kropli hodowli Paramecium sp. i umieszczonej na szkiełku podstawowym z łezką zamiast wyciągu z grzybni Aspergillus flavus dodać 1 kroplę wody wodociągowej. 3. Wyniki zinterpretować na podstawie klasyfikacji toksyczności wyciągu z hodowli grzyba według Spieciwcewej: - silnie toksyczny - brak ruchu osobników populacji (śmierć) po około 3 min. - słabo toksyczny - brak ruchu po około 1-3 godz. - śladowe ilości toksyn - brak ruchu po około 16-24 godz. Wyniki: Wnioski: Wnioski: OBSERWACJA 46 OBSERWACJE Polecenia: po obejrzeniu każdego preparatu, wrysuj brakujące szczegóły budowy pasożyta w zaproponowany rysunek konturowy rysunki opisz odpowiednimi nazwami oceń w przybliżeniu długość i szerokość pasożytów zwracaj uwagę na zabarwienie elementów budowy pasożytów 1. Grzyby: a) Candida albicans – obserwacja/opis w programie Olyvia/mikroskop Na podłożu Sabourauda tworzy kremowe lśniące, gładkie, nieznacznie wypukłe ponad powierzchnię agaru, nie wrastające w podłoże kolonie, które w miarę starzenia ulegają pofałdowaniu. Komórka wegetatywna może być kulista, cylindryczna lub jajowata, wytwarza blastospory oraz pseudostrzępki. Kiełkujące blastospory, w teście filamentacji, w obecności surowicy, zwłaszcza ludzkiej, tworzą krótkie pseudostrzępki - tzw. „germ tubes”. C. albicans jest najczęstszym czynnikiem etiologicznym grzybic (candidosis) narządowych i uogólnionych. Gatunki z rodzaju Candida wywołują: · grzybice skóry, paznokci, błon śluzowych jamy ustnej, przewodu pokarmowego, narządów płciowych; · grzybice narządowe: układu oddechowego, dróg moczowo-płciowych, przełyku, otrzewnej, osierdzia, mięśnia sercowego, ośrodkowego układu nerwowego; · grzybice gałki ocznej (szczególnie u osób z obniżoną odpornością; mogą przebiegać z kandydemią). Kandydoza przełyku należy do najczęstszych objawów zespołu nabytego niedoboru odporności (AIDS) i jest uznawana za chorobę wskaźnikową zakażenia HIV. Zwróć uwagę na: chlamydospory, pseudostrzępki, blastospory b) Alternaria sp. – obserwacja/opis w programie Olyvia/mikroskop Alternaria alternata na podłożu Sabourauda tworzy ciemnobrązowe kolonie. Tworzy proste, nierozgałęzione konidiofory do 50 µm długości. Brunatne konidia, duże, wielokomórkowe, o grubej, nierównej ścianie są elipsoidalne z licznymi przegrodami układającymi się w równych płaszczyznach. Gatunek zaliczany jest do tzw. grzybów zewnątrzdomowych: rozwijają się na martwej materii organicznej, szczególnie w powierzchownej warstwie gleby. Mogą być jednak obecne także wewnątrz budynków. Szczyt sezonu zarodnikowania dla rodzaju Alternaria przypada na lipiec i sierpień-wrzesień. Zarodniki tych grzybów są uwalnianie do otoczenia biernie, zależnie od czynników meteorologicznych (głównie od prędkości wiatru). Alergeny zarodników Alternaria są spośród alergenów grzybów najczęstszą przyczyną alergicznego nieżytu nosa i astmy. Stężenie zarodników Alternaria alternata o wartości 100 w 1 m3 powietrza uważane jest za progowe stężenie odpowiedzialne za wystąpienie objawów chorobowych u osób uczulonych na ten alergen w Polsce. 47 Alternaria spp. staje się coraz częściej rozpoznawanym patogenem u pacjentów z obniżoną opornością. Najczęściej obserwowane są zmiany skórne, ale możliwe też są: zapalenie płuc, astma, zapalenie zatok. Zwróć uwagę na: konidiofory, konidiospory c) Aspergillus fumigatus – obserwacja w programie Olyvia/mikroskop;opis ryciny. Na podłożu Sabourauda wytwarza kolonie, poczatkowo białe, a w trakcie sporulacji (tworzenia konidiów) niebieskozielone, w miarę starzenia się ciemniejące, puszyste, kożuchowate, potem filcowate, zwarte, od strony podłoża żółte lub zielonkawe. Gatunek saprotroficzny, szeroko rozprzestrzeniony w środowisku. Jego wzrost następuje w temperaturze 37°C- 50°C (konidia przeżywają nawet do 70°C temperaturę występującą w kompostownikach). Zarodniki grzybów są małe o średnicy 2-3 mm, i stanowią najczęstszy czynnik etiologiczny aspergilozy. A. fumigatus należy do patogenów oportunistycznych (nie powoduje grzybicy u osób z prawidłową odpornością), który u osób o obniżonej odporności może wywoływać m.in. grzybicę kropidlakową (aspergilozę) płuc oraz alergiczne choroby układu oddechowego (np. alveolitis allergica) Zaznacz na rysunku: konidiofor, konidiospory (konidia), fialidy d) Cryptococcus neoformans – obserwacja w programie Olyvia - preparat z płynu mózgowordzeniowego w tuszu chińskim, pow.1000x, Na podłożu Sabourauda kolonie są beżowo-perłowe, śluzowe, lśniące, w miarę starzenia ulegające pofałdowaniu. Występuje pod postacią charakterystycznych okrągłych lub owalnych komórek pączkujących (średnica 2.5 µm do 10 µm), z otoczką polisacharydową. Spośród około siedemdziesięciu opisanych gatunków z rodzaju Cryptococcus tylko dwa: Cryptococcus neoformans (kosmopolityczny) i Cryptococcus gattii (endemiczny, w strefach subtropikalnych i tropikalnych) są chorobotwórcze dla człowieka i zwierząt. Najważniejsze znaczenie w patogenezie odgrywają: polisacharydowa otoczka, obecność melaniny oraz zdolność do wzrostu w 48 zakresie temperatur 35-40°C. W ustroju człowieka mogą występować pozakomórkowo i wewnątrzkomórkowo (fagocyty). Gatunki te są czynnikiem etiologicznym kryptokokozy - choroby o przebiegu podostrym lub przewlekłym, z zajęciem ośrodkowego układu nerwowego, płuc (grzybice narządowe, głębokie) lub skóry i tkanki podskórnej (grzybice powierzchowne). Kryptokokoza OUN jest chorobą wskaźnikową AIDS. Zwróć uwagę na: otoczkę polisacharydową e) Claviceps purpurea Zwróć uwagę na: kształt i umiejscowienie przetrwalników f) Amanita phalloides Zwróć uwagę na: białe blaszki, nieruchomy pierścień, bulwiastą nasadę trzonu otoczoną pochwą g) Paxillus involutus – opis Zwróć uwagę na: kapelusz szaro-żółtobrązowy, oliwkowobrązowy; brzeg kapelusza długo podwinięty i wyraźnie rowkowany; powierzchnia początkowo aksamitna, potem gładka z jedwabistym połyskiem. 49 h) Russula emetica – opis Zwróć uwagę na: kapelusz żywo zabarwiony, jaskrawoczerwony, brzeg kapelusza tępy, słabo podgięty, w starych owocnikach karbowany. 2. Zwierzęta wytwarzające jad: porównanie postaci imago: a) Apis mellifera, b) Vespula vulgaris, c) Vespa crabro Żądło Apis mellifera i Vespula vulgaris Zwróć uwagę na: harpunowato zagięte ku tyłowi ząbki charakterystyczne ząbkowane zakończenieosłonięte/nieosłonięte Podpis prowadzącego ……………………………………… Data: ……………………… 50 ZADANIA DO SAMOKSZTAŁCENIA 1. Spośród podanych zdań opisujących mykotoksyny wybierz prawidłowe: A. 1,4,3; B. 2,4,5 ; C.3,4,5; D. 1,3,5. 1. Mykotoksyny to lotne związki o charakterze olejków eterycznych. 2. Mykotoksyny charakteryzują się dobrą rozpuszczalnością w tłuszczach. 3. Mykotoksyny to drugorzędowe produkty przemiany materii grzybów mikroskopowych. 4. Przykładami mykotoksyn są aflatoksyny. 5. Mykotoksyny mogą mieć działanie rakotwórcze. 2. Spożycie przetrwalnika Claviceps purpurea może spowodować: A. uszkodzenie błony śluzowej przewodu pokarmowego; B. pobudzenie ośrodkowego układu nerwowego i rozkurcz mięśni gładkich; C. martwicę kanalików nerkowych; D. porażenie nerwów współczulnych i skurcze mięśni gładkich. 3. Spośród podanych odpowiedzi wybierz prawidłowe zestawienie dotyczące wpływu kardenolidów Digitalis lanata na czynność serca: A. 4,5; B. 1,6; C.1,2; D. 3,7. 1. „+” inotropowe i dromotropowe 2. „+” tonotropowe i chronotropowe 3. „+” inotropowe i chronotropowe 4. „+” inotropowe i tonotropowe 5. „-„ chronotropowe i dromotropowe 6. „-„ chronotropowe i tonotropowe 7. „-„ tonotropowe i dromotropowe 4. Hemolizyny zawarte w jadach zwierzęcych mogą być przyczyną: A. uszkodzenia ścian naczyń krwionośnych i krwawych wybroczyn; B. uszkodzenia błon komórkowych krwinek czerwonych, anemii i żółtaczki; C. zaburzeń funkcji neuronów; D. uszkodzenia tkanki łącznej, zaczerwienienia skóry i pokrzywki. 5. Uzupełnij tabelę Gatunek owada Toksyna Melityna Działanie powoduje zaburzenia gospodarki wodno-elektrolitowej, skurcze mięśni gładkich i poprzecznie prążkowanych peptyd MCD Hialuronidaza Vespula vulgaris silnie obniżają ciśnienie krwi, powodują ostre przekrwienie skóry i silny miejscowy ból 6. Podaj kilka przykładów wykorzystania jadu zwierząt w lecznictwie: 51 LITERATURA 1. Adamski Z., Batura-Gabryel H. 2007. Mykologia lekarska dla lekarzy i studentów. UM im. K. Marcinkowskiego, Poznań. 2. Kurnatowska. A., Kurnatowski P. 2018. Mykologia medyczna. Edra Urban&Partner, Wrocław. 52 Ćwiczenie 3 Temat: Aerosfera jako źródło czynników patogennych dla człowieka. Wektory chorób inwazyjnych obecne w aerosferze. Doświadczenia 1. Mikrobiologiczna ocena jakości powietrza - metoda sedymentacyjna Kocha Obserwacja 1. Zanieczyszczenia pyłowe i ich wpływ na organizm człowieka a) płuco człowieka z pylicą węglową (choroba zawodowa): - prep. makr. utrw. w 4 % formalinie, pokaz; - prep. mikr. utrw. formaliną, barw. hematoksyliną i eozyną, pow. 100x, (Olyvia) – rys. b) płuco zdrowego człowieka: - prep. makr. utrw. w 4 % formalinie, pokaz; - prep. mikr. utrw. formaliną, barw. hematoksyliną i eozyną, pow. 100x, (Olyvia) – rys. c) płuco człowieka z kurzem - prep. mikr. utrw. formaliną, barw. hematoksyliną i eozyną, pow. 100x, (Olyvia). 2. Wektory choróby infekcyjnych i inwazyjnych: a) Ixodes ricinus - Kleszcz pastwiskowy - postać dojrzała - prep. mikr. utrw., pow. 25,100x, (Olyvia) – rys.; - postać nassana - prep. makr. w etanolu; - nasiona Ricinus communis - prep. makr. suchy, pokaz. b) Anopheles maculipennis - Komar widliszek / Widliszek plamistoskrzydły - imago – prep. mikr., pow. 100x, pokaz (Olyvia); - larwa – prep. mikr., pow. 100x, rys. (Olyvia); - narządy gębowe – prep. mikr., pow. 100x, (Olyvia) – rys. c) Culex pipiens - Komar pospolity / Komar brzęczący / Komar kłujący - imago – prep. mikr., pow. 100x, pokaz (Olyvia); - poczwarka – prep. mikr., pow. 100x, pokaz (Olyvia); - larwa – prep. mikr., pow. 100x, rys. (Olyvia); - narządy gębowe – prep. mikr., pow. 100x, (Olyvia) – rys. d) Musca domestica - Mucha domowa - imago - prep. makr. suchy, pokaz; - poczwarka - prep. makr. suchy, pokaz; - larwa - prep. mikr. utrw. niebarw., pow. 100x, (Olyvia) – rys.; - jaja - prep. mikr. utrw. niebarw., pow. 100x, (Olyvia). e) Lucilia sericata - Mucha zielona - imago: prep. makr. suchy, pokaz. - larwy L. sericata – usuwanie larw u pacjenta z muszycą, prezentacja multimedialna. f) Sarcophaga haemorrhoidalis - Ścierwica - imago: prep. makr. suchy, pokaz. 3. Czynniki etiologiczne parazytoz człowieka, których wektory znajdują się w aerosferze. a) Plasmodium falciparum - Zarodziec sierpowaty - gruba kropla krwi – prep. mikr.,utrw. barwnikiem. Giemsy, pow. 1000x, pokaz (Olyvia) – pokaz.; - cienki rozmaz krwi – prep. mikr., utrw. barwnikiem. Giemsy, pow. 1000x, (Olyvia) – rys. b) Plasmodium vivax - Zarodziec ruchliwy - gruba kropla krwi – prep. mikr.,utrw. barwnikiem. Giemsy, pow. 1000x, pokaz (Olyvia). 53 c) Trypanosoma brucei gambiense - Świdrowiec gambijski - rozmaz krwi człowieka zarażonego, postać trypomastigota - prep. mikr., barwnikiem. Giemsy, pow. 1000x, (Olyvia) – rys. d) Trypanosoma cruzi - Świdrowiec amerykański - prep. mikr. krwi zarażonej myszy, utrw.70% etanolem, barwnikiem. Giemsy, pow.600,1000x, (Olyvia) – rys. e) Leishmania tropica - postać amastigota – prep. z rozmazu owrzodzenia skóry, utrw., barwnikiem. Giemsy,pow.600,1000x,(Olyvia) – rys.; - postać promastogota - prep. z hodowli, utrw. barwnikiem. Giemsy, pow. 600,1000x,(Olyvia) – rys. f) Loa loa - mikrofilarie - gruba kropla krwi, prep. mikr. utrw., barw. barwnikiem. Giemsy, pow. 100x, (Olyvia) - opis. Zakres materiału do przygotowania przed zajęciami Informacje o wymienionych organizmach: cykle rozwojowe, stadia rozwojowe, występowanie, drogi i sposoby rozprzestrzeniania (transmisja) w środowisku oraz wnikania do organizmu człowieka (sposób inwazji, wrota inwazji), postać inwazyjna, miejsce bytowania w organizmie człowieka, chorobotwórczość, objawy inwazji u człowieka, wykrywanie: metody, materiał badany i postacie wykrywane, profilaktyka inwazji. Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Charakterystyka aerosfery. Zanieczyszczenia aerosfery – naturalne i antropogeniczne, smog atmosferyczny; gazowe, pyłowe, biologiczne. Aerosfera jako aerozol biologiczny (skład, czynniki o działaniu alergizującym, chorobotwórczym – grzybice, szczególnie u osób z obniżoną odpornością, pylice, choroby układu oddechowego wywołane substancjami drobnoustrojów występującymi na pyłach organicznych – choroby zawodowe). Metody mikrobiologicznej oceny stopnia zanieczyszczenia biologicznego powietrza (metoda Kocha, zderzeniowa). Skutki antropopresji – degradacja warstwy ozonowej, zmiany klimatu (efekt cieplarniany), kwaśne deszcze. Aerosfera jako rezerwuar wybranych czynników etiologicznych chorób ludzi. Wektory chorób infekcyjnych i inwazyjnych. Pasożyty człowieka związane z aerosferą. 54 CZĘŚĆ TEORETYCZNA Aerosfera Na biosferę składają się aerosfera (środowisko powietrzne), hydrosfera (środowisko wodne) oraz litosfera (środowisko lądowe). Człowiek, tak jak wiele innych gatunków organizmów, żyje na pograniczu aerosfery i litosfery. Aerosfera jest najniższą warstwą atmosfery obejmująca troposferę i część stratosfery do wysokości ok. 22 km. Aerosfera stanowi nie tylko źródło tlenu dla żywych organizmów, ale także: środowisko bytowania wielu pasożytów w tym stawonogów jako pasożytów zewnętrznych człowieka oraz organizmów - rezerwuarów lub wektorów biologicznych i mechanicznych organizmów i mikroorganizmów pasożytniczych; miejsce okresowego przebywania mikroorganizmów – jest to środowisko niesprzyjające dla ich życia i rozwoju; ośrodek umożliwiający przemieszczanie się drobnoustrojów oraz form rozwojowych pasożytów - jaj lub cyst, nawet na bardzo duże odległości. Ruchy powietrza (wiatry) mogą transportować na różne odległości zanieczyszczenia występujące w aerosferze. Źródła zanieczyszczenia aerosfery dzielą się na: naturalne (wybuchy wulkanów, pożary lasów i stepów, unoszenie się z prądami powietrza cząstek gleby, piasku, a także pyły organiczne pochodzące z litosfery, zawierające patogeny będące czynnikiem etiologicznym wielu chorób u człowieka); antropogeniczne (związane z działalnością człowieka). Powietrze ma zdolność do samooczyszczania, którego podstawowym mechanizmem jest osiadanie zawiesiny drobnoustrojów pod wpływem sił grawitacyjnych. Ważnym czynnikiem wpływającym na naturalne oczyszczanie powietrza jest promieniowanie ultrafioletowe. Antropopresja – zanieczyszczenia fizyko-chemiczne Zanieczyszczenia powietrza są głównymi przyczynami globalnych i lokalnych zagrożeń środowiska. Skutkami antropopresji są: degradacja warstwy ozonowej, zmiany klimatu (efekt cieplarniany), kwaśne deszcze oraz smog. Zmiany klimatu związane z efektem cieplarniamym, stwarzają także ryzyko częstego występowania kataklizmów pogodowych takich jak huragany, powodzie, długotrwałe upały, co staje się zasadniczą przyczyną wymierania gatunków. Niszczenie ozonosfery – „dziura ozonowa” – jest drugim obok efektu cieplarnianego, globalnym zagrożeniem, związanym z zanieczyszczeniem atmosfery. Konsekwencją tego procesu jest brak zatrzymywania przez cząsteczki tlenu i ozonu promieniowania UV-C i UV-B, które w niezdegradowanej atmosferze ziemskiej dociera w bardzo małych ilościach, zaledwie w 1-4%. Za degradację warstwy ozonowej odpowiedzialne są przede wszystkim freony i halony, które powszechnie stosowane są m.in. w aerozolach, systemach chłodniczych lodówek i zamrażarek, w płynach do czyszczenia i jako środek porotwórczy przy produkcji tworzyw sztucznych. Cząsteczki freonów i halonów (uczestniczące w degradacji warstwy ozonowej) dostają się do niższych warstw atmosfery, gdzie pod wpływem promieniowania ultrafioletowego (głównie UV-B) ulegają degradacji. Niszczenie warstwy ozonowej sprzyja ekspozycji organizmów żywych na promieniowanie ultrafioletowe (UVR, Ultraviolet radiation), co może prowadzić do zakłócenia równowagi całych ekosystemów (m.in. zamieranie planktonu oraz wrażliwych na UV gatunków roślin uprawnych i przemysłowych). Może także zwiększać ryzyko występowania chorób u człowieka i zwierząt, przede wszystkim skóry (m. in. nowotworów skóry) i chorób oczu. Dla przykładu, promieniowanie UV-C, najdłuższe i o najwyższej energii może powodować silny rumień, oparzenia skóry jak i uszkodzenia DNA. Podobnie, ekspozycja na UV-B działa mutagennie i ma negatywny wpływ na komórki 55 Langerhansa, element układu immunologicznego skóry. Z kolei UV-A poza komórkami skóry właściwej, oddziałuje na melanocyty i keratynocyty. Skutkami oddziaływania tego rodzaju promieniowania są reakcje fotoalergiczne i fototoksyczne, a także wytwarzanie wolnych rodników, teleangiektazje (poszerzenie naczyń krwionośnych) oraz uszkadzanie białek strukturalnych i DNA, przez co promieniowanie UV wywołuje efekty kancerogenne i mutagenne. Z kolei oko ludzkie, łatwo absorbuje promieniowanie UV. Rogówka pochłania głównie promieniowanie UV-B, podczas gdy soczewka absorbuje głównie UV-A. Nadmierna ekspozycja na promieniowanie UV może zwiększać ryzyko niektórych chorób oczu (np. stan zapalny spojówki i rogówki na tle zespołu suchego oka, posłoneczne uszkodzenie plamki żółtej - retinopatia słoneczna, nowotwory powiek, spojówki i rogówki np. rak płaskonabłonkowy). Z innych szkodliwych czynników fizyko-chemicznych aerosfery, smog jest zjawiskiem atmosferycznym powstającym w określonych warunkach meteorologicznych (brak ruchów powietrza, inwersja termiczna, wysoka wilgotność) i przy dużej emisji zanieczyszczeń gazowych i pyłowych. W ostatnich latach odnotowuje się wzrost tworzenia się toksycznego smogu w powietrzu. Ze względu na miejsce, warunki powstawania oraz skład chemiczny, wyróżnia się dwa podstawowe rodzaje smogu: klasyczny (londyński – mgła przemysłowa, smog zawierający głównie dwutlenek siarki ze spalania paliw, powstający w warunkach nasycenia powietrza przez wodę; występuje w dużych miastach głównie strefy klimatu umiarkowanego) i fotochemiczny (typu Los Angeles – smog powstający przy dużej emisji spalin samochodowych w warunkach intensywnego promieniowania słonecznego; dochodzi do utleniania związków azotu przy udziale węglowodorów powstają silnie utleniające związki (m.in. nitroolefiny) z dużym udziałem ozonu; występuje w dużych miastach strefy klimatu gorącego, a także umierkowanego w miesiącach letnich). Zanieczyszczenia powietrza w sposób istotny wpływają na zdrowie ludzi, powodując wiele dolegliwości głównie układu oddechowego i krwionośnego. WHO szacuje, że odsetek zgonów związanych z zanieczyszczeniem powietrza wynosi 5-6% rocznie. Największy wpływ zanieczyszczeń powietrza na zdrowie ludzi obserwuje się w rejonach przemysłowych i zurbanizowanych. Wyróżnia się zanieczyszczenia gazowe oraz pyłowe (tabela 1). Tabela 1. Zanieczyszczenia chemiczno-fizyczne powietrza – podział. Gazowe Pyłowe dwutlenek siarki (SO2) tlenki azotu (NxOy) lotne związki organiczne (benzopireny) tlenek węgla (CO) dwutlenek węgla (CO2) rtęć gazowa benzen pył węglowy z krzemionką (SiO2) pył z włóknami azbestowymi pyły obojętne np. tlenek cyny, siarczan baru, tlenki żelaza pyły zawieszone PM10 pyły zawieszone PM2,5 W ramach monitoringu czystości powietrza ocenia się zawartość: tlenku węgla, ozonu, dwutlenku siarki, dwutlenku azotu, pyłów zawieszonych - PM10, PM2,5 oraz benzenu i rtęci w stanie gazowym. Na podstawie poziomu poszczególnych parametrów możliwe jest określenie indeksu jakości powietrza ocenę taką prowadzi się w stacjach pomiarowych, w których uzyskuje się pomiary automatyczne, manualne lub pasywne (z wykorzystaniem specjalnych poborników z substancją czynną).Zanieczyszczenia fizyko-chemiczne wykazują negatywne działanie na organizm człowieka: pyły zawieszone PM10 i PM2,5 – zwiększają częstość występowania chorób układu oddechowego, powodują zaostrzenie objawów astmy oskrzelowej, zwężenie dróg oddechowych i naczyń krwionośnych, zwiększają ryzyko występowania zawału serca i udaru mózgu; 56 lotne zanieczyszczenia organiczne (benzen, benzopiren) – zwiększają ryzyko wystąpienia nowotworów, benzopiren wykazuje silne działanie kancerogenne, mutagenne oraz teratogenne; ozon – przyczynia się do większej częstości występowania zakażeń układu oddechowego; dwutlenek siarki – powoduje podrażnienie górnych dróg oddechowych, a także zaostrzenie schorzeń objawiających się podrażnieniem spojówek i skóry; wysokie stężenia dwutlenku siarki mogą wywołać ostre choroby górnych dróg oddechowych; tlenki azotu – powodują upośledzenie czynności płuc, nasilenie objawów oddechowych, wzrost reaktywności dróg oddechowych, wzrost częstości chorób infekcyjnych układu oddechowego, obniżenie zdolności wysiłkowej, u dzieci przy ciągłej ekspozycji mogą powodować zaburzenia rozwojowe; tlenek węgla – powoduje niedotlenienie narządów, sprzyjając udarom mózgu i zawałom serca. pierwiastki (zaliczane do tzw. metali ciężkich np. rtęć, ołów, kadm). Zwiększona ilość ołowiu kumulowana w organizmie, powoduje efekt obkurczenia naczyń krwionośnych, podwyższając ciśnienie krwi. Rtęć nieorganiczna zakłóca integralność bariery krew-mózg (zwiększa jej przepuszczalność), doprowadzając do przenikania białek osocza przez ściany naczyń krwionośnych do tkanki mózgu. Kadm i ołów blokują kanały wapniowe,wiążąc kalmodulinę (wewnątrzkomórkowe białko wiążące wapń), co przyczynia się do zaburzenia przekazywania sygnałów w komórkach, związanych z regulacją wielu procesów biologicznych komórki (np. metabolizmu, gospodarki energetycznej, syntezy neurotransmiterów). Obecnie, niezwykle ważne jest monitorowanie jakości powietrza. Kategorie jakości powietrza i informacje zdrowotne przedstawia tabela 2. Tabela 2. Kategorie jakości powietrza a informacje zdrowotne przeznaczone dla ludności (wg GIOŚ, 2018). Kategoria jakości powietrza Bardzo dobra Dobra Umiarkowana Dostateczna Zła Bardzo zła Informacje zdrowotne Jakość powietrza jest bardzo dobra, zanieczyszczenie powietrza nie stanowi zagrożenia dla zdrowia, warunki bardzo sprzyjające do wszelkich aktywności na wolnym powietrzu, bez ograniczeń. Jakość powietrza jest zadowalająca, zanieczyszczenie powietrza powoduje brak lub niskie ryzyko zagrożenia dla zdrowia. Można przebywać na wolnym powietrzu i wykonywać dowolną aktywność, bez ograniczeń. Jakość powietrza jest akceptowalna. Zanieczyszczenie powietrza może stanowić zagrożenie dla zdrowia w szczególnych przypadkach (dla osób chorych, osób starszych, kobiet w ciąży oraz małych dzieci). Warunki umiarkowane do aktywności na wolnym powietrzu. Jakość powietrza jest dostateczna, zanieczyszczenie powietrza stanowi zagrożenie dla zdrowia (szczególnie dla osób chorych, starszych, kobiet w ciąży oraz małych dzieci) oraz może mieć negatywne skutki zdrowotne. Należy rozważyć ograniczenie (skrócenie lub rozłożenie w czasie) aktywności na wolnym powietrzu, szczególnie jeśli ta aktywność wymaga długotrwałego lub wzmożonego wysiłku fizycznego. Jakość powietrza jest zła, osoby chore, starsze, kobiety w ciąży oraz małe dzieci powinny unikać przebywania na wolnym powietrzu. Pozostała populacja powinna ograniczyć do minimum wszelką aktywność fizyczną na wolnym powietrzu – szczególnie wymagającą długotrwałego lub wzmożonego wysiłku fizycznego. Jakość powietrza jest bardzo zła i ma negatywny wpływ na zdrowie. Osoby chore, starsze, kobiety w ciąży oraz małe dzieci powinny bezwzględnie unikać przebywania na wolnym powietrzu. Pozostała populacja powinna ograniczyć przebywanie na wolnym powietrzu do 57 niezbędnego minimum. Wszelkie aktywności fizyczne na zewnątrz są odradzane. Długotrwała ekspozycja na działanie substancji znajdujących się w powietrzu zwiększa ryzyko wystąpienia zmian m.in. w układzie oddechowym, naczyniowo-sercowym oraz odpornościowym. Pył PM10 - zawiera cząstki o średnicy aerodynamicznej ziaren nie większej niż 10 μm. Składa się z mieszaniny cząstek organicznych i nieorganicznych zawieszonych w powietrzu. Ze względu na znaczny rozmiar na jego powierzchni mogą osadzać się substancje toksyczne, takie jak benzopiren. Dopuszczalne stężenie średnioroczne PM10, wg wytycznych WHO z 22.09.2021 r., wynosi 15 μg/m3 (poprzednio 20 μg/m3), w Polsce – 40 μg/m3; dobowe wartości: 45 (WHO) i 50 μg/m3 (Polska). Cząstki PM10 są absorbowane na powierzchni spojówek i górnych dróg oddechowych, co może wywoływać takie objawy jak kaszel, katar, zwiększenie ryzyka infekcji oraz powodować stany zapalne spojówek. Pył 2,5 - zawiera cząstki mniejsze niż 2,5 μm, które mogą docierać do dolnych dróg oddechowych, a po sfagocytowaniu przez makrofagi do płuc i układu krwionośnego, a następnie z krwią mogą być transportowane do wszystkich narządów i tkanek. Średnioroczna dopuszczalna zawartość PM2,5 w powietrzu, wg wytycznych WHO z 22.09.2021 r., wynosi 5 μg/m3 (poprzednio 10 μg/m3), w Polsce – 20 μg/m3. Głównym źródłem pyłów są spaliny z pieców domowych i komunikacja samochodowa, a także spalanie odpadów. Choroby układu oddechowego wywołane pyłami nieorganicznymi – choroby zawodowe Nagromadzenie się pyłu w płucach i wystąpienie reakcji płuc na jego obecność prowadzi do powstania pylicy płuc. Jest to przewlekła choroba układu oddechowego, wywołana długotrwałym wdychaniem pyłów. Charakteryzuje się występowaniem przewlekłego zapalenia oskrzeli i postępowej rozedmy płuc, z czasem dochodzi do powstania serca płucnego (przerost i niewydolność prawej komory serca) i niewydolności krążenia. Biorąc pod uwagę zmiany histopatologiczne, pylice można podzielić na kolagenowe i niekolagenowe (tabela 3). Tabela 3. Podział pylic (choroby zawodowe) ze względu na rodzaj działania biologicznego. PYLICE KOLAGENOWE Czynnik: pyły o właściwościach zwłókniających np. krzemionka, azbest, talk Działanie: cytotoksyczne na makrofagi, które wyzwalają w płucach proces włóknienia typu kolagenowego prowadzący do trwałego uszkodzenia lub zniszczenia pęcherzyków płucnych NIEKOLAGENOWE pyły obojętne o słabym działaniu zwłókniającym np. tlenek cyny, siarczan baru, tlenki żelaza reakcja jest nieznaczna i potencjalnie odwracalna: polega głównie na rozwoju włóknienia bez naruszenia struktury pęcherzyków płucnych Pylica górników kopalń węgla (dawniej określana jako pylica węglowa) Rozwija się po kilkunastoletniej ekspozycji na pył kopalniany, którego głównym składnikiem jest pył węglowy z krzemionką SiO2 (2-10%); przez długi okres czasu (lata) pylica przebiega bezobjawowo. Do głównych objawów należą: duszność (początkowo tylko wysiłkowa), kaszel, objawy przeciążenia prawej komory serca i niewydolność prawokomorowa. Na obrazie RTG widoczne zacienienia guzkowate pojedyncze lub mnogie, najczęściej w górnych i środkowych częściach płuc. 58 Pylica azbestowa Jest wynikiem wieloletniego wdychania włókien azbestu; dochodzi do silnego zwłóknienia płuc, często również i opłucnej oraz trwałego uszkodzenia pęcherzyków płucnych. W miarę rozwoju azbestozy, wzrasta ryzyko rozwoju chorób nowotworowych, jakich jak rak płuc, rak oskrzeli (ryzyko zwiększone około czterokrotnie) oraz międzybłoniaków opłucnej (prawie tysiąckrotnie zwiększone ryzyko). Do głównych objawów należą: narastająca duszność podczas wysiłku, suchy kaszel, ból w dolnych partiach klatki piersiowej, siny odcień skóry, palce przybierają charakterystyczny pałeczkowaty kształt i pokrywają się brodawkowymi zmianami skórnymi. Rokowanie jest niepomyślne, ponieważ uszkodzenie płuc jest nieodwracalne i może postępować nawet po przerwaniu ekspozycji. W Polsce stosowanie azbestu jest zabronione od 1997 roku na mocy ustawy (z 19 czerwca 1997 r. z późniejszymi zmianami - Dz.u. 2004.3.20), która ordynowała zakaz: wprowadzania na terytorium RP wyrobów zawierających włokna azbestu, produkcji wyrobów zawierających azbest, obrotu azbestem i wyrobami zawierającymi azbest. Zanieczyszczenia biologiczne - bioaerozol Zanieczyszczenia biologiczne występują w powietrzu w postaci tzw. aerozoli biologicznych. Odgrywają one ważną rolę w szerzeniu się chorób zakaźnych i powstawaniu epidemii, wywoływaniu objawów alergicznych oraz mają działanie toksyczne. Aerozol biologiczny jest układem dwufazowym. Fazę dyspersyjną stanowią para wodna lub drobne kropelki śliny, śluzu itp., natomiast fazę rozproszoną - żywe drobnoustroje lub ich formy przetrwalnikowe, a także metabolity lub fragmenty komórek bakteryjnych (np. endotoksyny) i grzybów (np. mykotoksyny). W skład bioaerozolu wchodzi materiał biologiczny unoszony samoistnie lub niesiony przez większe cząstki niebiologiczne (np. cząsteczki pyłu). Zanieczyszczenia biologiczne powietrza stanowią przede wszystkim pyłki roślin, grzyby (głównie zarodniki), bakterie i wirusy, a także formy inwazyjne niektórych pasożytów (cysty pierwotniaków lub jaja helmintów). Ze względu na skład gatunkowy mikroorganizmów zawartych w aerozolu biologicznym dzielimy go na: saprotroficzny (drobnoustroje niepatogenne dla człowieka), zakaźny (mikroorganizmy patogenne) oraz mieszany. Żywe komórki aerozolu biologicznego mogą wywoływać choroby infekcyjne. Spośród bakterii Gram-dodatnich dominują rodzaje Microccocus, Streptococcus, Staphylococcus, Bacillus, Mycobacterium, natomiast z bakterii Gram-ujemnych Pseudomonas, Escherichia, Enterobacter. Choroby zakaźne przenoszone za pośrednictwem powietrza bywają nazywane chorobami aerogennymi. W przypadku bakterii Gram-ujemnych zarówno występujące w ich ścianie komórkowej endotoksyny jak i wytwarzane enterotoksyny, mogą powodować różne stany chorobowe dróg oddechowych (zapalenia, toksyczne i alergiczne zapalenie płuc). Źródła aerozoli biologicznych: naturalne – gleba, woda, z których mikroorganizmy są wynoszone przez ruchy powietrza, a także organizmy, np. grzyby wytwarzające zarodniki roznoszone przez wiatr; bytowe (związane z działalnością człowieka) – rolnictwo i przemysł rolno-spożywczy, gospodarka ściekami i odpadami. Przykłady chorób, których czynniki etiologiczne przenoszone są drogą powietrzną: wirusowe: ospa wietrzna, grypa, różyczka, świnka (zapalenie przyusznic); bakteryjne: zapalenie oskrzeli i płuc, gruźlica płuc, błonica, krztusiec, płonica; grzybicze: aspergiloza płuc (kropidlakowa grzybica płuc), mukormykoza płuc, kryptokokoza płuc, grzybica tchawicy i oskrzeli, grzybicze zapalenie płuc, grzybica opłucnej, zatok, ucha wewnętrznego. 59 Bioaerozole stanowią od 5 do nawet 34% zanieczyszczeń powietrza wewnętrznego (powietrze otaczające człowieka w pomieszczeniach); mniejsze cząsteczki (o rozmiarach <5,0 μm) zazwyczaj przez długi czas pozostają zawieszone w powietrzu, natomiast duże najczęściej ulegają sedymentacji. Ze względu na małe rozmiary cząstki te mogą przedostawać się wraz z wdychanym powietrzem do różnych odcinków układu oddechowego (tabela 4) Tabela 4. Rozmiar cząstek bioaerozolu a ich osadzanie się w organizmie (Löndahl J.2014). Rozmiar cząstki 9 – 30 μm 5,5 – 9 μm 3,3 – 5,5 μm 1 – 3,3 μm 0,1 – 1 μm Lokalizacja gałka oczna jama nosowa i jama ustna, gardło krtań tchawica, oskrzela pierwszorzędowe i drugorzędowe oskrzeliki oddechowe i pęcherzyki płucne Przykłady pyłki traw, Alternaria spp., Fusarium spp. pyłki traw, Alternaria spp., Fusarium spp. Cladosporium spp. Aspergillus fumigatus, Penicillium spp. Termoactinomycetes, Nocardia spp. Cząsteczki aerozolu podlegają w powietrzu działaniu promieniowania ultrafioletowego i jonizującego, które niszczą drobnoustroje. Jednym z dalszych czynników decydujących o nietrwałości aerozolu biologicznego jest utrata wody. Dużą rolę w trwałości aerozolu odgrywają czynniki meteorologiczne, a szczególnie ciśnienie atmosferyczne, temperatura i wilgotność powietrza. Aerozol biologiczny stanowi zagrożenie dla człowieka powodując choroby infekcyjne i inwazyjne, choroby alergiczne, zatrucia (np. endotoksyny bakterii i mykotoksyny grzybów). Skład ilościowy i jakościowy mikroorganizmów w powietrzu zależy od: pory roku – najwięcej drobnoustrojów występuje latem (czerwiec-sierpień), najmniej zimą (grudzień-styczeń); warunków klimatycznych (np. powietrze przed deszczem zawiera więcej komórek drobnoustrojów niż po deszczu); usytuowania (najmniej zanieczyszczone jest powietrze nad górami, morzami, oceanami i lasami); zagospodarowania terenu (na ulicach miast znajduje się od kilku do kilkuset tysięcy komórek drobnoustrojów w 1 dm3 powietrza; ilość drobnoustrojów w pomieszczeniach, zwłaszcza o dużym zagęszczeniu ludzi i sprzętów, jest wielokrotnie większa niż w powietrzu w miejscach odkrytych). Koncentracja zanieczyszczeń w powietrzu wewnątrz pomieszczeń jest, w większości przypadków, znacznie wyższa niż w środowisku zewnętrznym. Jednocześnie skład zarówno ilościowy, jak i jakościowy powietrza w pomieszczeniach jest bardziej stabilny. Coraz więcej czasu spędzamy w pomieszczeniach zamkniętych, dlatego też jakość powietrza wewnętrznego jest ważna w odniesieniu do zdrowia człowieka. Szacuje się, że ludzie przebywają w budynkach od 80 do 95% czasu. Dorosły człowiek wykonuje ok. 20–22 tys. oddechów na dobę – wdychając w tym czasie ponad 10m3 powietrza (nawet do 20 m3) łącznie z wszystkimi zanieczyszczeniami w nim zawieszonymi. Standardy mikrobiologicznej jakości powietrza W prawodawstwie polskim, zgodnie z prawem Unii Europejskiej, opracowano kilka norm dotyczących oceny jakości powietrza w pomieszczeniach, głównie związane ze stanowiskiem pracy. Są to normy: PN-EN 13098:2007P, PN-EN 14042:2010, PN-EN 14583:2008, PN-EN ISO14698-1:2004 oraz PN-EN ISO14698-2:2004. Niestety w żadnej z norm nie podano wartości dopuszczalnej liczby drobnoustrojów oraz stężenia endotoksyn w powietrzu wewnętrznym. W 2004 r. Zespół Ekspertów ds. Czynników Biologicznych Międzyresortowej Komisji ds. Najwyższych Dopuszczalnych Stężeń (NDS) i Najwyższych Dopuszczalnych Natężeń (NDN) Czynników Szkodliwych dla Zdrowia w Środowisku Pracy 60 zaproponował wartości dopuszczalne dla mikroorganizmów w powietrzu wewnętrznym, jednak w dalszym ciągu nie zostały one zalegalizowane. W krajach Unii Europejskiej nie ma także odpowiednich aktów prawnych regulujących/określających dopuszczalne zawartości drobnoustrojów w powietrzu atmosferycznym. W wyniku dostosowywania prawa polskiego do prawa unijnego obowiązujące wcześniej w prawie polskim normy [PN-89/Z-04008/01; PN-89/Z-04008/08; PN-89/Z-04111/02; PN-89/Z-04111/03] dotyczące zanieczyszczenia powietrza atmosferycznego zostały uchylone w sierpniu 2015 r., jednak nie zostały zastąpione nowymi. Z tego powodu w celu interpretacji wyników oceny mikrobiologicznej jakości powietrza w dalszym ciągu stosuje się uchylone normy (tabela 5). Tabela 5. Kryteria oceny stopnia zanieczyszczenia powietrza atmosferycznego pod względem mikrobiologicznym (PN-89 Z04111/02 i PN89 Z-4111/03). Grupa mikroorganizmów Ogólna liczba bakterii Pseudomonas fluorescens Gronkowce wywołujące hemolizę α Gronkowce wywołujące hemolizę β Promieniowce Ogólna liczba grzybów Ogólna liczba mikroorganizmów w 1 m3 powietrza atmosferycznego niezanieczyszczone średnio silnie zanieczyszczone zanieczyszczone < 1000 1000-3000 >3000 brak <50 >50 brak <25 >25 brak <50 >50 10 3000-5000 10-100 5000-10000 >100 >10000 Metody oceny stopnia zanieczyszczenia biologicznego powietrza W ocenie składu mikrobiologicznego aerozoli uwzględnia się następujące bakterie: promieniowce – wskaźnik zanieczyszczenia powietrza cząstkami gleby; Pseudomonas fluorescens – wskaźnik zanieczyszczenia aerozolami biologicznymi pochodzącymi z wód powierzchniowych; bakterie hemolizujące β – indykatory aerozoli pochodzących z przewodu oddechowego ludzi i zwierząt. Do bakterii hemolizujących związanych z bioaerozolem zalicza się gronkowce. Spośród kilkudziesięciu gatunków z rodzaju Staphylococcus, najważniejszymi czynnikami etiologicznymi zakażeń gronkowcowych człowieka są: S. aureus, S. epidermidis i S. saprophyticus – gatunki, które mogą powodować zakażenia powierzchniowe (skóry) oraz układowe. S. aureus (gronkowiec złocisty) jest uznawany za najważniejszy czynnik zakażeń szpitalnych. Dane epidemiologiczne wskazują na fakt, że gronkowiec złocisty stale zasiedla błony śluzowe około 10% osób zdrowych, natomiast jako składnik mikrobioty przejściowej występuje u 70-90% ludzi. Do dziś nie ma jednej, skutecznej metody, umożliwiającej prowadzenie stałego monitoringu zanieczyszczenia mikrobiologicznego powietrza (metody takie istnieją w przypadku określania zanieczyszczeń pyłowych i gazowych). Obecne techniki pozwalają jedynie określić chwilowy stan zanieczyszczenia biologicznego powietrza. Najprostszą metodą używaną do określania w powietrzu liczebności mikroorganizmów (bakterii i grzybów) jest metoda Kocha - metoda sedymentacyjna (opadowa). Jest to tania, niewymagająca specjalistycznej aparatury technika, jednak pozwala ona na uzyskiwane jedynie mało dokładnych danych; za jej pomocą nie można wykryć drobnych cząstek bioaerozolu, które nie ulegają sedymentacji lub osiadają bardzo wolno, a objętość badanego powietrza jest tylko szacunkowa. Znacznie dokładniejsze wyniki oceny zanieczyszczenia mikrobiologicznego powietrza uzyskuje się stosując próbniki wolumetryczne (aspiratory, aeroskopy, impaktory), które umożliwiają pobranie i 61 przebadanie ściśle określonej objętości powietrza. W zależności od wykorzystanego urządzenia można wyróżnić metody: zderzeniowe, filtracyjne, płuczkowe, elektroprecypitacji, odśrodkowe oraz cytometrię przepływową. Zastosowanie metod wolumetrycznych pozwala na dokonanie wyboru oceny liczby drobnoustrojów w określonej objętości badanego powietrza stosując metody hodowlane lub niehodowlane, w tym mikroskopowe (mikroskopia kontrastowo-fazowa), biochemiczne (oznaczanie produktów metabolizmu drobnoustrojów, takich jak enzymy, ergosterol, toksyny), luminescencyjne (oznaczanie ATP), a także badania genetyczne (metoda PCR) i cytometrię przepływową. Metody oceny jakości mikrobiologicznej powietrza a) metoda sedymentacyjna Kocha – opis w części praktycznej; b) metody filtracyjne - filtracja powietrza przez sączki membranowe, na których zatrzymują się zanieczyszczenia mikrobiologiczne (filtry kładzie się bezpośrednio na pożywkę lub płucze się je, a następnie posiewa i inkubuje; filtry także barwi się i ogląda pod mikroskopem); c) metody zderzeniowe - zasysanie przez aspirator znanej objętości powietrza, które z dużą szybkością uderza w powierzchnię pożywek agarowych; powoduje to wychwycenie obecnych w powietrzu drobnoustrojów, które po określonym czasie inkubacji wytwarzają kolonie; d) elektroprecypitacja - opiera się na fakcie, że wszystkie cząstki, w tym również drobnoustroje, posiadają określony ładunek elektryczny; w aparatach zwanych precypitatorami płytki Petriego z pożywką podłączone są do źródła prądu, pełniąc tym samym rolę elektrod przyciągających cząstki, a więc także mikroorganizmy naładowane przeciwnie; e) cytometria przepływowa - jest techniką analityczną pozwalającą na szybki pomiar rozproszonego światła lub sygnałów fluorescencji emitowanych przez odpowiednio naświetlone komórki mikroorganizmów; f) luminescencja (ATP) - polega na oznaczeniu stężenia ATP, związku obecnego w każdej żywej komórce oraz materiałach biologicznych; pomiar ATP informuje o ilości obecnego zanieczyszczenia poprzez liczbową wartość tzw. umownych jednostek luminescencyjnych (RLU); g) PCR – określenie przynależności taksonomicznej szczepów bakterii/grzybów wyizolowanych z próbki badanego powietrza na podstawie uzyskanego z mikroorganizmów materiału genetycznego. 62 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA 1. Mikrobiologiczna ocena jakości powietrza - metoda sedymentacyjna Kocha. Najczęściej stosowaną metodą badawczą oceny stopnia zanieczyszczenia mikrobiologicznego powietrza jest metoda sedymentacyjna Kocha. Oparta jest na swobodnym osiadaniu pod wpływem sił grawitacji pyłków i drobinek kurzu niosących mikroorganizmy. Pobranie próby polega na otwarciu i pozostawieniu na ściśle określony czas szalki Petriego z jałową pożywką mikrobiologiczną. Do obliczenia wskaźnika biologicznego zanieczyszczenia powietrza (A) stosuje się empiryczny wzór przeliczeniowy, oparty na założeniu, że w ciągu 5 minut na powierzchnię 100 cm 2 opadają komórki mikroorganizmów znajdujące się w 10 dm3 powietrza (PN89 Z-4111/03), gdzie: gdzie: – średnia liczba kolonii r – promień szalki Petriego t – czas ekspozycji płytki A – ogólna liczba drobnoustrojów w 1 m3 powietrza wyrażona w JTK (jednostki tworzące kolonie – koloniotwórcze, ang. colony forming units CFU) [JTK/m3, CFU/m3]. WYKONANIE Materiały i odczynniki: - szalki Petriego z jałowym podłożem mikrobiologicznym (agar odżywczy, agar Sabourauda), Sprzęt i aparatura: - cieplarka. Protokół doświadczenia: 1. W wybranym pomieszczeniu umieścić otwarte szalki Petriego z jałowym podłożem mikrobiologicznym (słup powietrza nad szalką > 150 cm) na 10, 15, 20 lub 30 minut. 2. Zamknięte szalki po ekspozycji inkubować 24-48h w 37°C. 3. Makroskopowo ocenić wzrost drobnoustrojów (liczba kolonii) na pożywce i obliczyć wskaźnik mikrobiologicznego zanieczyszczenia powietrza wg empirycznego wzoru Omeliańskiego. 4. Porównać z wytycznymi dla pomieszczeń placówek ochrony zdrowia Klasa I – do 70 CFU/m3: sale operacyjne wysokoaseptyczne (transplantacja narządów, zabiegi na otwartym sercu i ortopedyczne), sale pacjentów w immunosupresji, pracownie rozpuszczania cytostatyków, część czysta centralnej sterylizatorni; Klasa II – do 300 CFU/m3: bloki operacyjne, oddziały intensywnej opieki, oddziały noworodków i wcześniaków, gabinety zabiegowe, gabinety endoskopii; Klasa III – do 700 CFU/m3: sale chorych, część brudna centralnej sterylizatorni. Wyniki: 63 Wnioski: OBSERWACJA OBSERWACJE Polecenia: po obejrzeniu każdego preparatu, wrysuj brakujące szczegóły budowy pasożyta w zaproponowany rysunek konturowy rysunki opisz odpowiednimi nazwami oceń w przybliżeniu długość i szerokość pasożytów zwracaj uwagę na zabarwienie elementów budowy pasożytów 1. Zanieczyszczenia pyłowe i ich wpływ na organizm człowieka a) płuco człowieka (bez i po ekspozycji na pyły nieorganiczne) - obserwacja/opis w programie Olyvia/mikroskop Zwróć uwagę na: strukturę pęcherzyków płucnych płuco człowieka zdrowego płuco człowieka z pylicą 2. Wektory przenoszące choroby infekcyjne i inwazyjne Liczne dorosłe stawonogi (pajęczaki i owady), dla których powietrze stanowi podstawowe środowisko życia są przenosicielami mechanicznymi bądź biologicznymi drobnoustrojów i pasożytów. Przenosicielami biologicznymi (wektorami biologicznymi) pasożytów człowieka są: kleszcze (rodzaj Ixodes dla np. Borrelia burgdorfei – choroba z Lyme i Babesia microti babesioza); pluskwiaki (rodzaj: Rhodnius, Triatoma i Panstrongylus dla Trypanosma cruzi – choroba Chagasa); komary (samice Anopheles maculipennis i Anopheles gambiae dla Plasmodium vivax i Plasmodium falciparum - malaria); 64 moskity (Phlebothomus dla Leishmania tropica – leiszmanioza/wrzód wchodni); muchy tse-tse (Glossina palpalis dla Trypanosoma brucei gambiense – śpiączka afrykańska); Krew człowieka stanowi siedlisko dla niektórych pasożytów człowieka: np. w osoczu występują postacie trypomastigota Trypanosoma brucei gambiense, a w krwinkach czerwonych postacie rozwojowe Plasmodium spp. (formy pierścienia, trofozoity, schizonty, merozoity, gametocyty). Obecność pasożytów we krwi określa się terminem parazytemia. Kosmopolityczne owady: mucha domowa, mucha zielona i ścierwica uczestniczą w biernej transmisji (przenoszenie) pierwotniaków (np.: Entamoeba histolytica, E. coli, Giardia intestinalis) i helmintów (jaja) pasożytujących w przewodzie pokarmowym człowieka, a także licznych grzybów oraz bakterii (np.: pałeczki duru brzusznego i durów rzekomych, przecinkowce cholery, prątki gruźlicy, pałeczki czerwonki, laseczki wąglika i tężca). a) Ixodes ricinus - obserwacja/opis w programie Olyvia/mikroskop Jest najbardziej rozpowszechnionym gatunkiem kleszcza występującym w Polsce, występuje także w całej Europie, północnej i zachodniej Afryce, a także Azji Mniejszej. Charakteryzuje się dużą plastycznością siedliskową (występuje w lasach mieszanych i liściastych). Jest także często spotykany w parkach, na działkach, w ogrodach botanicznych, na nieskoszonych trawinkach. Należy do kleszczy trójżywicielowych (każde stadium rozwojowe pasożytuje na innym żywicielu), a cykl rozwojowy trwa 2-3 lata w zależności od warunków klimatycznych. W miejscu żerowania kleszcza na skórze pojawiają się zmiany w postaci zaczerwienienia, obrzęku oraz reakcji zapalnej. Toksyny kleszcza mogą wywołać ogólne reakcje alergiczne, bóle głowy, złe samopoczucie. Gatunek ten jest wektorem wirusów (m.in. wirus kleszczowego zapalenia mózgu), bakterii (Borrelia burgdorferi, Anaplasma phagocytophilum, Brucella malitiens), oraz pierwotniaków (Babesia microti). Zaznacz na rysunku: hypostom, głaszczki, organ Hallera, tarcza grzbietowa: 65 b) Anopheles macullipennis – obserwacja/opis w programie Olyvia/mikroskop Tylko samice widliszka pobierają krew (samce odżywiają się nektarem); są najbardziej aktywne wieczorem, w nocy i o świcie. Wiosną wygłodniałe samice mogą atakować również w dzień na wolnym powietrzu, a latem pobierają krew człowieka nawet wewnątrz pomieszczeń. Rozwój odbywa się w zbiornikach naturalnych, zawierających czystą i dobrze natlenioną wodę stojącą. W klimacie umiarkowanym w ciągu roku rozwijają się 3-4 pokolenia. Ślina widliszka zawiera składniki drażniące, które u osób wrażliwych wywołują odczyny alergiczne. Jest przenosicielem biologicznym pierwotniaków z rodzaju Plasmodium wywołujących malarię. Zaznacz na rysunku: głaszczki, kłujkę, czułki: c) Culex pipiens – obserwacja/opis w programie Olyvia/mikroskop Gatunek kosmopolityczny najliczniej występujący w klimacie umiarkowanym i Afryce, pospolity w Polsce; zarówno w środowisku wiejskim jak i miejskim. Podobnie jak w przypadku komara widliszka tylko samice żywią się krwią, a samce nektarem roślinnym. Samice są aktywne przede wszystkim wieczorem i nocą; masowo kłują szczególnie często w sierpniu i na początku września. Ślina komara powoduje świąd, który u osób wrażliwych może wywołać stany zapalne skóry. C. pipiens może przenosić ornitozy oraz wirusy neurotropowe z ptaków domowych/dzikich m.in. na ludzi. Zaznacz na rysunku: głaszczki, kłujkę, czułki: 66 d) Musca domestica – obserwacja/opis w programie Olyvia/mikroskop Gatunek synantropijny, kosmopolityczny, najbardziej rozpowszechniony w klimacie umiarkowanym. Występuje w sąsiedztwie siedlisk człowieka (śmietniki, zabudowania gospodarskie). Postać dorosła jest szaroczarna, głowa spłaszczona z parą czerwonobrązowych oczu. Mucha domowa odgrywa ważną rolę jako przenosiciel mechaniczny duru brzusznego, prątków gruźlicy, pałeczek czerwonki bakteryjnej. Larwy mogą stać się przypadkowymi pasożytami człowieka i zwierząt powodując muszyce, kiedy jaja zostaną złożone w ranie lub naturalnych otworach ciała. Imago – rys. głowa, oko, aparat gębowy, skrzydła, nogi. 3. Czynniki etiologiczne parazytoz, których wektory znajdują się w aerosferze. a) Plasmodium falciparum obserwacja/opis w programie Olyvia/mikroskop - rozmaz krwi osoby z parazytemią Jest najczęściej występującym gatunkiem zarodźca w krajach o klimacie subtropikalnym i tropikalnym. Pasożyt wnika do wszystkich rodzajów erytrocytów (niezależnie od etapu erytropoezy). Zarażone krwinki nie są zmienione morfologiczne, często występuje zarażenie mnogie krwinek. Wektorem malarii tropikalnej/podzwrotnikowej są samice komarów z rodzaju Anopheles. Podczas pobierania krwi zarażona zarodźcem samica widliszka wprowadza do organizmu człowieka sporozoity. P. falciparum jest czynnikiem etiologicznym malarii podzwrotnikowej, która ma najcięższy przebieg wśród wszystkich rodzajów malarii. Okres inkubacji trwa 9-25 dni, napady gorączki występują co 3648h. W przebiegu parazytozy dochodzi do masowego rozpadu zarażonych erytrocytów, a także ich sekwestracji (tworzenie się skupisk - szczególnie niebezpieczne w naczyniach włosowatych mózgu i łożyska). Narysuj: prawidłowy erytrocyt Zaznacz na rysunku: postać pierścienia, gemetocyty; 67 b) Plasmodium vivax- obserwacja/opis w programie Olyvia/mikroskop - preparat grubej kropli krwi – gruby rozmaz krwi osoby z parazytemią Występuje najczęściej w Azji Południowo-Wschodniej, we wschodnim regionie basenu Morza Śródziemnego, Indiach, Pakistanie, Etiopii, w Europie głównie w Grecji i Turcji. P. vivax wykazuje szczególne powinowactwo do retikulocytów. W krwince powstają pojedyncze postacie rozwojowe od pierścienia do schizonta dojrzałego (meront). Pierścień z dużą grudką chromatyny zajmuje 1/3 średnicy krwinki, ma dużą wodniczkę otoczoną wąską cytoplazmą. Sposób rozprzestrzeniania się jest analogiczny do P. falicparium, innych gatunków tego rodzaju. Jest czynnikiem etiologicznym malarii trzeciaczki, której okres wylęgania wynosi najczęściej 11-13 dni. Jako pierwsze pojawiają się objawy grypopodobne, przechodzące w napady zimnicy. Okres napadów gorączki występuje co 48h. Po 3-8 tygodniach zimnica przechodzi w postać utajoną. Przed zarażeniem człowieka P.vivax chroni naturalna odporność - brak antygenu grupowego Duffy-ego na erytrocytach, które stanowią receptor dla zarodźca ruchliwego. Możliwe są nawroty objawowej zimnicy związane z tworzeniem form hipnozoitów w komórkach wątroby. Zaznacz na rysunku: postać pierścienia, trofozoit (w okresie merulacji): c) Trypanosma spp.– obserwacja/opis w programie Olyvia/mikroskop Trypanosoma brucei gambiense - świdrowiec gambijski Występuje w Afryce Zachodniej i Środkowej. Jest przenoszony z człowieka zarażonego na zdrowego za pośrednictwem wektora biologicznego muchy tse-tse. Świdrowce pasożytują we krwi, chłonce oraz płynie mózgowo-rdzeniowym człowieka i są czynnikiem etiologicznym śpiączki afrykańskiej. W początkowej fazie inwazji w miejscu wniknięcia na skórze powstaje kilkucentymetrowa zmiana – grudkowaty odczyn zapalny. Następnie pierwotniaki dostają się do naczyń krwionośnych i limfatycznych, którymi trafiają do różnych tkanek i narządów człowieka. Tryponasoma cruzi - świdrowiec amerykański Występuje endemicznie w Ameryce Południowej i Środkowej oraz w południowych stanach USA. Przenosicielami biologicznymi świdrowca amerykańskiego są pluskwiaki z rodzajów Triatoma, Rhodnius lub Panstrongylus. Pierwotniak ten wywołuje trypanosomozę amerykańską. Postacie trypomastigota pasożytują w osoczu krwi i chłonce, natomiast postacie amastigota głównie w komórkach mięśnia sercowego, przełyku, jelita. W miejscu wniknięcia pasożyta powstaje wrzodziejący naciek zapalny. Okres inkubacji trwa 1-2 tygodnie. Parazytoza może mieć przebieg ostry lub przewlekły. 68 Trypanosoma brucei gambiense i Tryponasoma cruzi - cienki rozmaz krwi osób z parazytemią Zwróć uwagę na: lokalizację we krwi formy trypomastigota i jej kształt dla obu gatunków; Zaznacz na rysunku: wić, jądro, kinetoplast, błonę falującą tej formy: d) Leishmania tropica – obserwacja/opis w programie Olyvia/mikroskop Wiciowce z rodzaju Leishmania to pasożytnicze pierwotniaki należące do rodziny świdrowców. Rodzaj obejmuje kilka gatunków, które powodują leiszmaniozę występującą pod postaciami: skórnośluzówkową (mucocutaneous leishmaniasis, MCL) głównie w Ameryce Południowej – powodowanej przez np. Leishmania mexicana complex, skórną (CL, cutaneous leishmaniasis) – przez L. tropica, L. major, L. aethiopica lub narządową (VL, visceral leishmaniasis, kala-azar) – L. donovani, L. infantum, L. chagasi. Przenosicielem biologicznym pasożyta są muchówki (moskity) z rodzajów Lutzomyia oraz Phlebotomus. Leiszmanioza skórna (tzw. wrzód wschodni) występuje w postaciach: ostrej – charakteryzującej się ogniskową martwicą mokrą (okres wylęgania 1-8 tygodni) i przewlekłej – ogniskowa martwica sucha (okres wylęgania 6-18 miesięcy). W miejscu ukłucia przez zarażoną muchówkę, najczęściej na odkrytych częściach ciała, pojawia się grudka, powiększająca się do rozmiarów guzka, który ulega owrzodzeniu i po wygojeniu pozostawia głębokie blizny. Zmianom skórnym mogą towarzyszyć objawy ogólne. Zaznacz na rysunku: - formy amastigota w komórkach skóry/tkanki podskórnej oraz formy promastigota w preparacie z hodowli; - w komórkach pierwotniaka: wici, jądro, kinetoplast: 69 e) Loa loa - obserwacja w programie/opis Olyvia/mikroskop - mikrofilarie w rozmazie/preparacie grubej kropli krwi Nicień występujący w krajach tropikalnych Afryki Zachodniej i Środkowej. Przenosicielami Loa loa są muchówki z rodziny bąkowatych, z rodzaju Chrysops. Nicień wywołuje loaozę (ang. loiasis). Postacie dojrzałe wędrują w tkance podskórnej. Obecność pasożyta powoduje krótkotrwałe, swędzące zmiany wypryskowe i rumieniowate. Pojawiają się okresowe, bolesne nacieki najczęściej w okolicy dużych stawów, zwane obrzękiem kalabarskim. Postacie dojrzałe mogą migrować do gałki ocznej powodując ból, świąd i łzawienie (ang. inna nazwa choroby African eye worm). Mikrofilarie – ruchliwe larwy pasożyta w przezroczystej osłonce (pozostałaść skorupki jajowej) mają dobową okresowość pojawiania się we krwi. Narysuj: larwy pomiędzy odpowiednimi krwinkami Zwróć uwagę na: ich wielkość i kształt Podpis prowadzącego ……………………………………… Data: …………………………………………………… 70 REPOZYTORIUM Tabela 1. Biologia pasożytniczych owadów i pajęczaków gatunek pasożyta rodzaj pasożytnictwa, stadium pasożytnicze aparat gębowy, odżywianie się Ixodes ricinus Anopheles maculipennis Culex pipiens Musca domestica Lucilia sericata Sarcophaga haemorrhoidalis Tabela 2. Przenosiciele patogenów patogen droga zarażenia/ źródła inwazji forma inwazyjna forma diagnostyczna przenosiciel/ żywiciel pierwotniaki Plasmodium falciparum Plasmodium vivax Tryponasoma cruzi Trypanosoma brucei gambiense nicienie Leishmania tropica Loa loa 71 ZADANIA DO SAMOKSZTAŁCENIA 1. Dopasuj (strzałkami) cechy charakterystyczne dla wymienionych zanieczyszczeń powietrza: Fotochemiczny Smog kwaśny typu londyńskiego Powstaje na bazie dużej emisji SO2 Składniki tego typu zanieczyszczenia są źródłem emisji promieniowania o charakterze korpuskularnym i elektromagnetycznym Smog utleniający typu Los Angeles Powstaje na bazie dużej emisji spalin w warunkach dużego nasłonecznienia Pochodzi z naziemnych eksplozji nuklearnych Pył promieniotwórczy Występuje w dużych miastach w klimacie strefy umiarkowanej 2. Określ postacie morfologiczne pasożytniczych pierwotniaków; uzupełnij poniższą tabelę: A Postać B Nazwa postaci morfologicznej Gatunek, w którego cyklu rozwojowym występuje C Miejsce bytowania w organizmie człowieka Nazwa choroby, którą wywołuje A B C 3.Podaj nazwę postaci oraz nazwy organelli zaznaczonych na rysunku: LITERATURA 1. Kurnatowska A, Kurnatowski P. (red.), 2018. Mykologia medyczna, Edra Urban&Partner, Wrocław, 2018. 2. Zmysłowska I. 2009. Mikrobiologia ogólna i środowiskowa, Wydawnictwo Uniwersytetu Warmińsko-Mazurskiego Olsztyn, 2009. 3. Pojmańska T. (red.) .2016. Leksykon Parazytologiczny, Polskie Towarzystwo Parazytologiczne, Instytut Parazytologii PAN, Warszawa. 4. Błaszkowska J, Ferenc T, Kurnatowski P. (red.). 2017. Zarys parazytologii medycznej, Edra Urban&Partner, Wrocław, 2017. 72 Ćwiczenie 4 Temat: Hydrosfera i litosfera jako źródła czynników patogennych dla człowieka. Doświadczenia 1. Ocena parazytologiczna gleby Obserwacja 1. Pasożyty, których cykl rozwojowy związany jest z wodą. a) Acanthamoeba castellanii: - trofozoity i cysty - prep. mikr. z badania autopsyjnego z mózgu, utrw,, barw. met. trójchromatyczną, pow. 1000x, (Olyvia) - rys; - trofozoity - prep. mikr., barw. barwnikiem Giemsy, pow. 1000x, (Olyvia) - rys. b) Entamoeba histolytica - Pełzak czerwonki: - trofozoit - prep. mikr. utrw., barw. met. trójchromatyczną, pow.1000x, (Olyvia) - rys; - trofozoit z pochłoniętymi erytrocytami (erytrocytofagia) - prep. mikr. utrw., barw. met. trójchromatyczną, pow.1000x, (Olyvia) - rys; - cysta – prep. utrw., barw. met. trójchromatyczną, pow.1000x, (Olyvia) – rys. c) Cryptosporidium parvum: - oocysty w rozmazie kału – prep. utrw., barw. met. Ziehl-Neelsena, pow.1000x, (Olyvia) – rys. d) Fasciola hepatica - Motylica wątrobowa: - osobnik dojrzały – prep. mikr.,utrw. w płynie Bouina, barw. karminem ałunowym, pow.25x,(Olyvia) – rys.; - jaja – prep. mikr., utrw., niebarw., pow.100,400/600x, (Olyvia) – rys.; - metacerkaria – prep. mikr., utrw., niebarw., pow.100, 400/600x, (Olyvia) – rys.; - Galba truncatula – Błotniarka moczarowa (żywiciel pośredni) – prep. makr. suchy - pokaz. e) Schistosoma mansoni: - osobniki dojrzałe – prep. mikr. utrw., barw. hematoksyliną, pow.100x, (Olyvia) – rys. - jaja – prep. mikr. utrw., niebarw., pow.100, 400/600x, (Olyvia) – rys. - furkocerkarie – prep. mikr. utrw. barw. eozyną, pow.100, 400/600x, (Olyvia) – rys. f) Diphyllobothrium latum - Bruzdogłowiec szeroki: - strobila – prep. makr. utrw. 4% formaliną; - proglotyd – prep. mikr., utrw. w płynie Bouina, barw. karminem, pow. 25x, (Olyvia) – rys.; - jaja – prep. mikr. utrw. etanolem, niebarw., pow.100, 400/600x, (Olyvia) – rys. 2. Pasożyty, których cykl rozwojowy związany jest z glebą: a) Echinococcus granulosus - Tasiemiec bąblowcowy: - osobnik dojrzały – prep. mikr. utrw. w płynie Bouina, barwiony karminem ałunowym, pow.25, 100x – pokaz (Olyvia) – rys.; - protoskoleksy z torbieli bąblowcowej – prep. mikr., utrw. 70% etanolem, niebarw., pow.100, 400/600x - pokaz (Olyvia) – rys.. - wynicowany protoskoleks - prep. mikr. utrw., barw. trichromem, pow.100, 400/600x (Olyvia) – pokaz. b) Echinococcus multilocularis – tasiemiec wieojamowy: - osobnik dojrzały – prep. mikr. utrw. w płynie Bouina, barw. karminem ałunowym, pow.25, 100x (Olyvia) - pokaz - torbiel z protoskoleksami u żywiciela pośredniego (mysz) – - prep. mikr. utrw., barw. trichromem, pow.100, 400/600x (Olyvia) – pokaz. c) Trichuris trichiura – Włosogłówka ludzka: 73 - osobniki dojrzałe: samica, samiec – prep. mikr. utrw. w płynie Bouina, barw. karminem ałunowym, pow.25, 100x (Olyvia) – pokaz/ rys; - jaja – prep. mikr. utrw. etanolem., niebarw., pow. 100, 400/600x, (Olyvia) – rys. d) Ascaris lumbricoides– Glista ludzka: - osobnik dojrzały – prep. makr. utrw. w 4% formalinie – pokaz; - jaja niezapłodnione, zapłodnione i inwazyjne – prep. mikr. z zawiesiny jaj w 4% formalinie, pow. 100, 400/600x, (Olyvia) – rys. e) Toxocara canis – Glista psia: - osobnik dojrzały – prep. makr. utrw. w 4% formalinie – pokaz; - jaja zapłodnione - preparat mikroskopowy, utrwalony 70% etanolem, niebarwiony, pow.100, 400x, pokaz (Olyvia) – rys. f) Ancylostoma duodenale - Tęgoryjec dwunastnicy: - osobnik dojrzały (samiec) – prep. mikr. utrw.,barw. karminem ałunowym, pow. 25x (Olyvia) pokaz; - osobnik dojrzały w jelicie cienkim żywiciela ostatecznego – prep. mikr. utrw., barw. hematoksyliną i eozyną, pow.100, 400/600x, (Olyvia) – rys. Zakres materiału do przygotowania przed zajęciami Charakterystyka hydrosfery i litosfery. Wykorzystanie zasobów wodnych i degradacja hydrosfery; oczyszczanie ścieków. Informacje o wymienionych pasożytach: cykle rozwojowe, stadia rozwojowe, występowanie, drogi i sposoby rozprzestrzeniania (transmisja) w środowisku oraz wnikania do organizmu człowieka (sposób inwazji, wrota inwazji), postać inwazyjna, miejsce bytowania w organizmie człowieka, chorobotwórczość, objawy inwazji u człowieka, wykrywanie: metody, materiał badany i postacie wykrywane, profilaktyka inwazji Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Wskaźniki oceny jakości wód (fizyczne, chemiczne, biologiczne, wymagania mikrobiologiczne dotyczące jakości wody przeznaczonej do spożycia przez ludzi). Mikroorganizmy gleby. Sanitarna ocena gleby – bakterie grupy coli, badanie helmintologiczne: metody flotacyjne i sedymentacyjne. Ocena jakości wód. Hydrosfera i litosfera jako rezerwuary wybranych czynników etiologicznych chorób ludzi i niektórych zwierząt. Pasożyty człowieka związane z hydrosferą i litosferą – cykle i stadia rozwojowe, ich cechy charakterystyczne ważne diagnostycznie, chorobotwórczość, transmisja w środowisku. 74 CZĘŚĆ TEORETYCZNA Hydrosfera Woda jest aktywnym czynnikiem przekształcania warunków środowiskowych, bierze udział w kształtowaniu klimatu, rzeźby terenu oraz jakości gleb. Wszystkie zasoby wody na Ziemi stanowią około 1,5 mld km3. Ponad 95% zasobów znajduje się w oceanach, a tylko ok. 3% (35 mln m3) stanowią zasoby wody słodkiej; szacuje się, że 70% wód słodkich uwięzionych jest w lodowcach i pokrywie śnieżnej, co znacznie zmniejsza ilość wody słodkiej użytecznej dla człowieka. Związki azotowe (azot amonowy NH4+, azotanowy NO3-, azotynowy NO2-) występujące w wodzie stymulują rozwój mikroorganizmów, w tym sinic, glonów, grzybów; przyczyniając się do obniżenia stężenia tlenu rozpuszczonego, mogą oddziaływać toksycznie na organizmy wodne, a także zmniejszać skuteczność chlorowania (dezynfekcja), co w konsekwencji ogranicza możliwość wykorzystania wody w celach konsumpcyjnych. Wysokie stężenie azotanów (V) w wodzie pitnej ma negatywny wpływ na zdrowie człowieka. Szkodliwość azotanów wynika z możliwości ich redukcji przez mikrobiotę przewodu pokarmowego do azotanów (III) – azotynów, które prowadzą do methemoglobinemii [obecność znacznych ilości methemoglobiny (żelazo na III stopniu utlenienia) zamiast hemoglobiny (żelazo na II stopniu utlenienia)], szczególnie niebezpiecznej dla niemowląt i kobiet w ciąży. Ponadto azotyny są prekursorami nitrozoamin, które wykazują działanie rakotwórcze, mutagenne i teratogenne. Związki zawierające fosfor mogą przedostawać się do wód powierzchniowych ze źródeł wewnętrznych (osadów dennych i organizmów) oraz zewnętrznych, takich jak ścieki miejskie (gł. środki piorące), przemysłowe oraz spływy powierzchniowe (gł. nawozy). W oczyszczonych ściekach główną formą fosforu są fosforany rozpuszczalne, które pobierają rośliny, przez co często w wodnych ekosystemach śródlądowych fosfor jest czynnikiem ograniczającym wzrost roślin. W wodzie pitnej nie bada się zawartości fosforu. Zanieczyszczenia chemiczne W wodzie pitnej i użytkowej występować mogą substancje toksyczne i także metale ciężkie, które mogą wykazywać działanie toksyczne na organizmy i środowisko. Szczególnie niebezpieczne są: arsen, miedź, kadm, ołów, rtęć, cynk, chrom, nikiel i selen. Arsen - przedostaje się do wody m.in. ze ściekami z zakładów farmaceutycznych, fabryk produkujących barwniki i wód kopalnianych. Może być składnikiem środków grzybobójczych, owadobójczych i chwastobójczych. Jego toksyczność zależna jest od postaci chemicznej, trójwartościowy jest bardziej toksyczny niż pięciowartościowy; dawka śmiertelna arsenu dla człowieka to 70-180 mg. Dopuszczalna zawartość arsenu w wodzie pitnej wynosi 10 μg/l. Kadm – źródłem jego emisji do środowiska są przede wszystkim zakłady produkujące barwniki, farby, baterie, akumulatory i środki ochrony roślin. Kadm przedostaje się do zbiorników wodnych z opadem pyłów atmosferycznych, a także poprzez transport rzeczny. Dopuszczalna zawartość tego pierwiastka w wodzie pitnej to 5 μg/l. Rtęć – przedostaje się do wód z opadów atmosferycznych, ze spływem wód gruntowych i powierzchniowych. Wszystkie formy rtęci są bardzo toksyczne dla organizmów wodnych i mogą kumulować się zarówno w roślinach, jak i zwierzętach. Ścieki zawierające związki rtęci źle wpływają na procesy biochemiczne w oczyszczalniach ścieków. Źródłem rtęci są odpady przemysłowe z produkcji baterii, środków ochrony roślin, pestycydów, z zakładów farmaceutycznych i petrochemicznych. Śmiertelna dawka rtęci wynosi około 1g, natomiast dopuszczalna zawartość wodzie pitnej - 1μg/l. 75 Zanieczyszczenia biologiczne Drobnoustroje występujące w zbiornikach wodnych można podzielić na dwie grupy: autochtoniczne – głównie bakterie autotroficzne; foto- i chemosyntetyzujące (nitryfikacyjne, siarkowe, żelazowe); allochtoniczne – przedostające się do wody z powietrza, gleby, ze ściekami przemysłowymi, komunalnymi – głównie saprobionty i mikroorganizmy chorobotwórcze. Wodnopochodne choroby infekcyjne i inwazyjne Infekcje wodnopochodne - choroby infekcyjne i inwazyjne człowieka, których czynniki etiologiczne występują w wodzie, a do zakażenia/ zarażenia dochodzi najczęściej: poprzez konsumpcję zanieczyszczonej wody, bezpośredni kontakt podczas korzystania z wodnych miejsc rekreacji (baseny, kąpieliska), podczas użytkowania wody do celów higienicznych i gospodarczych. Patogeny obecne w wodzie należą do różnych grup systematycznych (wirusy, bakterie, grzyby, pierwotniaki, płazińce, obleńce), dla niektórych z nich woda jest naturalnym środowiskiem stałego bytowania (wolnożyjące ameby np. Acanthamoeba spp.), a dla innych miejscem bytowania form rozwojowych (np. Schistosoma spp., Diphyllobothrium latum, Fasciola hepatica). Jednak większość chorobotwórczych mikroorganizmów stanowi allochtoniczną mikrobiotę zbiorników wodnych, do których dostaje się wraz ze ściekami komunalnymi (Escherichia coli, Salmonella spp., Shigella spp.). W łańcuchu epidemiologicznym wodnopochodnych chorób infekcyjnych i inwazyjnych można wyróżnić trzy podstawowe ogniwa (rycina 1): Środowisko wodne Populacja zakażona/zarażona Woda przeznaczona do: - spożycia - celów rekreacyjnych - użytku w gospodarstwach domowych Populacja podatna na zakażenie/zarażenie Rycina 1. Ogniwa łańcucha epidemiologicznego. Patogeny znajdujące się w wodzie, takie jak wirusy, bakterie, grzyby czy formy rozwojowe pasożytów, mogą pochodzić ze ścieków bytowo-gospodarczych, ze szpitali (głównie oddziałów chorób zakaźnych), z ferm hodowlanych, ze składowisk odpadów oraz wód opadowych i roztopowych (tabele 1 i 2). Tabela 1. Wybrane czynniki etiologiczne chorób infekcyjnych i inwazyjnych naturalnie występujące lub kontaminujące środowisko wodne. Czynnik wirusy bakterie grzyby pierwotniaki helminty Przykłady (rodzaje) Adenovirus, Rotavirus, Enterovirus (Coxackievirus, Poliovirus), Hepatovirus A, Orthohepevirus A, Norovirus Escherichia, Salmonella, Shigella, Campylobacter, Clostridium, Enterococcus, Leptospira, Listeria, Mycobacterium, Pseudomonas, Vibrio, Yersinia Aspergillus, Penicillium, Exophiala, Fusarium, Mucor, Rhizopus, Candida, Rhodotorula, Trichosporon Toxoplasma, Giardia, Cryptosporidium, Acanthamoeba, Naegleria, Balamuthia, Entamoeba Schistosoma, Ascaris, Trichuris, Dracunculus 76 Tabela 2.Wybrane wirusy i bakterie zanieczyszczające wodę oraz wywoływane przez nie choroby. Patogen Hepatitis A virus, Hepatitis E virus Poliovirus Rotavirus, Adenovirus Salmonella typhi Salmonella paratyphi Shigella flexneri Vibrio cholerae Helicobacter pylori Choroba wirusowe zapalenie wątroby choroba Heinego-Medina zapalenie żołądka i jelita cienkiego dur brzuszny dur rzekomy czerwonka bakteryjna cholera zapalenie błony śluzowej żołądka Czynniki sprzyjające występowaniu wodnopochodnych chorób pasożytniczych: zanieczyszczenie wód powierzchniowych i gruntowych (odchodami ludzkimi i zwierzęcymi); nieprawidłowości w przebiegu procesu uzdatniania wody; właściwości pasożyta: - szeroka specyficzność żywicielska (np. człowiek i ponad 80 gatunków ssaków są żywicielami Cryptosporidium parvum), - wysoka inwazyjność (niewielka liczba cyst pierwotniaków jelitowych wywołuje inwazję), - małe rozmiary form dyspersyjnych (cysty/oocysty – konieczne jest zastosowanie filtrów o odpowiednio małych porach; C. parvum – cysty mają średnicę 4,5-5,5 μm i mogą penetrować przez filtry piaskowe), - oporność na działanie czynników środowiskowych i środków dezynfekcyjnych (np. konwencjonalne chlorowanie wody niszczące bakterie jelitowe jest niewystarczające do zniszczenia cyst C. parvum, Giardia intestinalis i Entamoeba spp.). W ocenie czystości wody brane są pod uwagę wskaźniki fizyczne, chemiczne i biologiczne. Wskaźnikami biologicznymi zanieczyszczenia wód, wykorzystywanymi zwłaszcza w ocenie przydatności wody do celów konsumpcyjnych, są różne gatunki/rodzaje bakterii. Bezpośrednie wykrywanie w próbkach wody bakterii bezwzględnie chorobotwórczych (np. Salmonella, Shigella) jest trudne. Najczęściej korzysta się z metody pośredniej polegającej na wykrywaniu bakterii uznawanych za wskaźniki stanu sanitarnego (wskaźnik zanieczyszczeń typu fekalnego) – E. coli i inne spokrewnione z nimi pałeczki grupy coli (nieprzetrwalnikujące, względnie beztlenowe pałeczki Gram-ujemne, które posiadają zdolność do fermentacji laktozy z wytworzeniem produktów kwaśnych i gazowych w 48godzinnej hodowli w temperaturze 37°C, tzn. pałeczki z rodzajów: Enterobacter, Klebsiella, Citrobacter wszystkie z rodziny Enterobacteriaceae), rzadziej poszukuje się laktozo-dodatnich szczepów pałeczek z rodzaju Aeromonas (rodzina Areomonadacae). Obecnie rekomendowane są dwie metody oznaczania bakterii grupy coli w wodzie przeznaczonej do spożycia: EN ISO 9308-1 – metoda oznaczania ilościowego oparta na technice filtracji membranowej, a następnie z hodowlą na chromogennym podłożu agarowym dla bakterii grupy coli i określeniu liczby organizmów docelowych w badanej próbce; EN ISO 9308-2 – metoda oznaczania ilościowego polegająca na określeniu najbardziej prawdopodobnej liczby (NPL) Escherichia coli i bakterii grupy coli oparta jest na zdolności E. coli do wytwarzania enzymu β-D-glukuronidazy. Podstawową metodą oceny, czy woda lub żywność miały kontakt z odchodami jest określanie miana coli. Miano coli typu kałowego to liczba cm3 wody, na którą przypada jedna pałeczka okrężnicy Escherichia coli lub pokrewnych bakterii występujących w jelitach człowieka, np. Citrobacter sp., Enterobacter sp. (im wyższe miano coli tym woda bardziej czysta pod względem mikrobiologicznym). 77 Rutynowa analiza bakteriologiczna oceniająca stan sanitarny wody obejmuje także oznaczenie ogólnej liczby bakterii psychrofilnych (namnażają się w temperaturze -5 do +30°C, optimum 15-30°C) i mezofilnych (+15 do +45°C, optimum 37°C, są to głównie bakterie patogenne). Poza oceną mikrobiologiczną, ocena czystości wody w zbiornikach naturalnych obejmuje także metody hydrobiologiczne np.: indeks biologiczny (Bi). Jest to określenie stosunku liczbowego różnych grup organizmów mikroskopowych występujących w 1 ml wody Bi = 2P/(R+K) P- producenci, R- reducenci, K- konsumenci. Wymagania mikrobiologiczne dotyczące wody pitnej i wykorzystywanej do celów rekreacyjnych według Rozporządzenie Ministra Zdrowia z dnia 7 grudnia 2017r w sprawie jakości wody przeznaczonej do spożycia przez ludzi, „woda jest zdatna do użycia, jeżeli wolna jest od mikroorganizmów chorobotwórczych i pasożytów w liczbie stanowiącej potencjalne zagrożenie dla zdrowia ludzkiego, wszelkich substancji w stężeniach stanowiących potencjalne zagrożenie dla zdrowia ludzkiego oraz nie wykazuje agresywnych właściwości korozyjnych i spełnia wymagania mikrobiologiczne i chemiczne”. Do oczyszczania wody przeznaczonej do konsumpcji stosuje się osadniki i filtry, które usuwają zawiesiny, a po koagulacji domieszki koloidalne i znaczną część bakterii, w tym patogennych. Jeśli metody mechaniczno-chemiczne uzdatniania wody nie gwarantują w pełni usunięcia mikroorganizmów wodę poddaje się dezynfekcji wykorzystując ozon lub związki chloru. Ozon - najsilniejszy utleniacz, powoduje zwiększenie przepuszczalności ścian komórkowych i lizę komórek. Ozonowane powietrze wprowadzane jest pod ciśnieniem do wody przez porowate dno zbiornika; woda pozostaje ok. 18 min w kontakcie z ozonem dodawanym w stężeniach 1,7-3,5 mg/dm3, co pozwala na eradykację komórek E. coli do 99,6% i wirusów do 99,9%. Po dezynfekcji ozon rozkłada się samorzutnie, wzbogacając wodę w tlen. Związki chloru - po dodaniu do wody część chloru łączy się z zanieczyszczeniami obecnymi w wodzie, a część pozostaje jako tzw. chlor użyteczny, który działa bójczo na mikroorganizmy; najsilniejsze działanie wykazuje kwas podchlorawy, najsłabsze - chloraminy. Chlorowanie jest procesem pozwalającym na usunięcie z wody do 99,9% bakterii i wirusów. W praktyce zaleca się stosowanie dawki standardowej 1-2 mg wolnego chloru przez 20-30 min. Litosfera Litosfera będąc częścią biosfery związana jest z hydrosferą i aerosferą, a jej miąższość wynosi ok. 80-150 km. Obecny stan litosfery jest wynikiem oddziaływań: kosmicznych (m.in. oddziaływania Słońca, Księżyca, meteoryty), endogenicznych (m.in. ruchy górotwórcze, ruchy płyt tektonicznych, działalność wulkaniczna, trzęsienia ziemi), egzogenicznych (m.in. wietrzenie, erozja, sedymentacja) oraz antropogenicznych (m.in. eksploatacja zasobów, wpływ człowieka na procesy egzogeniczne). Zanieczyszczenia antropogeniczne i naturalne występujące w wodzie i powietrzu w miarę upływu czasu odkładane są na powierzchni litosfery i stopniowo wnikają w jej głębsze warstwy. Powierzchniowe warstwy litosfery w następstwie długotrwałych procesów fizyko-chemicznych i biologicznych są przekształcane ze skał w glebę. Procesy glebotwórcze trwają nieustannie. Pod wpływem antropogenicznej presji na litosferę dochodzi do coraz szybszej degradacji gleb. Wyróżniamy dwa rodzaje degradacji gleb: względną (przeobrażenie dotychczasowego układu w nowy) i bezwzględną (trwałe obniżenie lub utrata biologicznej aktywności środowiska glebowego); czasami dochodzi do zmęczenia gleb (zwolnienie funkcji i procesów glebowych). Bakterie występujące w glebie należą do: autochtonicznych - np. z rodzaju: Actinomycetes (promieniowce), Azotobacter, Rhizobium; 78 allochtonicznych - np. z rodzaju: Pseudomonas, Clostridium, Salmonella i Escherichia (opady, nawozy organiczne, osady ściekowe, odchody ludzkie i zwierzęce). Promieniowce stanowią ok. 10% mikrobioty gleby. Dominują głównie w urodzajnych i wilgotnych glebach stref tropikalnych i subtropikalnych. Poza glebą występują w wodach słodkich i słonych, kompostach i oborniku. Odgrywają dużą rolę w procesie rozkładu szczątków zwierzęcych i materiałów biologicznych, takich jak celuloza, chityna, lignina. Wytwarzają liczne enzymy: cellulazy, ksylanazy, a także lizozym, hydrolazy peptydylo-peptydowe, glukanazy, mannanazy oraz chitynazy biorące udział w lizie ścian komórkowych mikroorganizmów. Niektóre promieniowce np. z rodzaju Frankia wchodzą w symbiozę z roślinami wyższymi, wiążąc azot z powietrza, inne mają zdolność do produkcji barwników Promieniowce wytwarzają dużą ilość związków o aktywności biologicznej o różnym działaniu, m.in. przeciwbakteryjnym, przeciwwirusowym, przeciwnowotworowym, przeciwgrzybiczym i przeciwrobaczym. Ok. 80% poznanych antybiotyków pochodzenia naturalnego jest wytwarzanych przez promieniowce, zwykle 5–10% ich genomu stanowią geny odpowiedzialne za wtórny metabolizm. Najważniejsze znaczenie medyczne ma kosmopolityczny rodzaj Streptomyces (ok. 500 gatunków) wytwarzający blisko 80% wszystkich bioaktywnych metabolitów promieniowców. Te mikroorganizmy wytwarzają przeciwbakteryjne związki należące m.in. do antybiotyków: β-laktamy (karbapenemy – półsyntetyczne pochodne tienamycyny), aminoglikozydy (neomycyna, streptomycyna - wytwarza ją około 1% promieniowców), tetracykliny, glikopeptydy (np. wankomycyna), makrolidy (np. spiramycyna), aktynomycyna (tabela 3). Tabela 3. Antybiotyki produkowane przez promieniowce. Aktywność przeciwbakteryjna przeciwgrzybicza przeciwnowotworowa Gatunek Streptomyces griseus Streptomyces orientalis Streptomyces nodosus Streptomyces noursei Streptomyces antibioticus Streptomyces caespitosus Antybiotyk streptomycyna wankomycyna amfoterycyna B nystatyna aktynomycyna mitomycyna 79 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA 1. Ocena parazytologiczna gleby Ocena sanitarna gleby obejmuje badania bakteriologiczne i helmintologiczne. Badania bakteriologiczne pozwalają ustalić: intensywność zanieczyszczenia, pochodzenie zanieczyszczenia, czas kontaminacji, a także postęp procesu samooczyszczania się gleby. Obecność drobnoustrojów jelitowych świadczy o zanieczyszczeniu fekaliami: świeżym - Escherichia coli i inne pałeczki jelitowe (np. Salmonella - do 3 m-cy, Shigella - do kilkunastu dni); starszym - Enterobacter aerogenes (kilka miesięcy – do roku); najstarszym - Clostridium perfringens w formie przetrwalników (nawet do kilku lat). Miano coli lub miano C. perfringens to najmniejsza masa gleby, w której stwierdza się jeszcze obecność bakterii grupy coli lub przetrwalników C. perfringens. Badanie helmintologiczne gleby polega na poszukiwaniu stadiów rozwojowych pasożytów należących do płazińców i obleńców w badanych próbkach. Badanie helmintologiczne gleby polega na poszukiwaniu stadiów rozwojowych pasożytów należących do płazińców i obleńców w badanych próbkach. Źródłem zanieczyszczeń gleby postaciami inwazyjnymi helmintów są odchody ludzkie i zwierzęce, odpady zwierzęce z ubojni, ścieki komunalne oraz gnojowica. Gleby, w których wykazano obecność form rozwojowych pasożytów przewodu pokarmowego nie mogą być przeznaczone pod uprawy warzyw i owoców spożywanych w stanie surowym. W badaniach parazytologicznych gleby powszechnie stosowane są metody zagęszczające flotacja i sedymentacja, w których wykorzystuje się różnicę ciężarów właściwych cyst, oocyst i jaj pasożytów (zwykle 1,05-1,15) oraz użytych w badaniu odpowiednich płynów. Metody zagęszczające zwiększają wykrywalność pasożytów poprzez zagęszczenie ich postaci rozwojowych w ocenianym materiale. metody flotacyjne – wykorzystanie roztworów o większej gęstości niż gęstość cyst, oocyst, jaj. Postacie rozwojowe pasożytów wykrywa się na powierzchni płynu flotacyjnego. metody sedymentacyjne (np. dekantacja) - wykorzystanie roztworów o mniejszej gęstości niż gęstość cyst, oocyst, jaj. Postaci rozwojowych pasożytów poszukuje się w osadzie. WYKONANIE: Materiały i odczynniki: - próbka ziemi, - nasycony roztwór chlorku sodu (płyn flotacyjny) gęstość względna 1,2 g/cm3 (20°C) Sprzęt i aparatura: - parowniczka, - szklana bagietka, - cylinder miarowy, - szczypczyki, - szkiełka podstawowe i nakrywkowe, - mikroskop 80 Protokół doświadczenia: 1. Próbkę gleby o masie ok. 10 g umieszczoną w parowniczce porcelanowej zalać 50 cm3 nasyconego roztworu chlorku sodu, dokładnie rozdrobnić i wymieszać bagietką szklaną. 2. Na powierzchni płynu flotacyjnego umieścić kilka szkiełek nakrywkowych. 3. Po upływie 30-60 minut używając szczypczyków ostrożnie przenieść szkiełko nakrywkowe na podstawowe, sporządzając preparat bezpośredni, który należy ocenić pod mikroskopem (pow. 100 i 400x) poszukać postaci rozwojowych pasożytów jelitowych. Wyniki: Wnioski: OBSERWACJA Polecenia: po obejrzeniu każdego preparatu, wrysuj brakujące szczegóły budowy pasożyta w zaproponowany rysunek konturowy rysunki opisz odpowiednimi nazwami oceń w przybliżeniu długość i szerokość pasożytów zwracaj uwagę na zabarwienie elementów budowy pasożytów 81 1. Pasożyty, których cykl rozwojowy związany jest z wodą. a) Acanthamoeba castellanii – obserwacja/opis w programie Olyvia/mikroskop Pierwotniaki amfizoiczne (mogące przeżywać wewnątrz i poza żywicielem), występujące naturalnie w środowisku wodnym (wody ciepłe); mogą stanowić czynniki etiologiczne inwazji ośrodkowego układu nerwowego. Cysty pasożyta nie tracą inwazyjności w temperaturach -26 do +56ºC. Parazytozy wywołane przez te pierwotniaki charakteryzują się wysoką śmiertelnością (ponad 95%). Inwazje często wykrywane są dopiero w badaniach autopsyjnych (wykrywane są trofozoity i cysty). Narysuj: trofozoit, cystę Zaznacz na rysunku: jądro, kariosom, pseudopodium, cytoplazmę b) Entamoeba histolytica – obserwacja/opis w programie Olyvia/mikroskop Pełzakowica (ameboza) dotyczy ok. 500 mln ludzi na świecie; ok. 40-100 tyś. zgonów/rok. W Polsce prewalencja E. histolytica wynosi poniżej 1% (głównie przypadki przywlekane), natomiast powszechne jest zarażenie niepatogennym, morfologicznie identycznym pełzakiem Entamoeba dispar (częstość występowania E. histolytica i E. dispar to 1:9). Owrzodzenia powstające w przebiegu zarażenia E. histolytica mogą dochodzić do warstwy mięśniowej, są zwykle ostro odgraniczone o podminowanych brzegach i kształcie butelkowatym. Owrzodzenia rozwijają się najpierw w jelicie ślepym, potem w wyrostku robaczkowym, okrężnicy i prostnicy. Możliwe jest przebicie owrzodzenia z jelita grubego do otrzewnej (perforacja jelita). Nieleczona postać ostra przechodzi zwykle w postać przewlekłą. Powikłaniami pełzakowicy mogą być pełzakowe zapalenie wątroby i pełzakowy ropień wątroby, a także ropnie w płucu, ropnie opłucnej i worka osierdziowego, rzadziej w innych narządach lub w skórze (inwazja pasożyta drogą krwi i chłonki lub bezpośrednio z owrzodzeń jelita – pełzakowica pozajelitowa). Zaznacz na rysunku: trofozoit, cystę, jądro/a, położenie kariosomu, wodniczkę pokarmową, ciała chromatoidalne 82 c) Cryptosporidium parvum – obserwacja/opis w programie Olyvia/mikroskop- Oocysta Pasożyt wewnątrzkomórkowy występujący głównie w enterocytach jelita cienkiego. Zagrożenie dla człowieka może stanowić wiele gatunków z rodzaju Cryptosporidium ze względu na szeroką specyficzność żywicielską. Powodują kryptosporydiozę (największe znaczenie epidemiologiczne mają Cryptosporidium hominis – gatunek antropofilny i C. parvum – gatunek odzwierzęcy, którego głównym rezerwuarem i źródłem zarażenia dla człowieka są młode przeżuwacze – cielęta). Objawy choroby pojawiają się zwykle po 5 - 7 dniach od zarażenia i obejmują wodnistą biegunkę, bóle brzucha, nudności, wymioty, gorączkę i złe samopoczucie. Większość przypadków kryptosporydiozy odnotowuje się u dzieci poniżej 5 roku życia, głównie z powodu niedojrzałości przewodu pokarmowego i braku odporności śluzówkowej. U osób z obniżoną odpornością przebieg choroby jest burzliwy i może prowadzić do zgonu. Zwróć uwagę na: kształt i zawartość (sporozoity), grubość otoczki d) Fasciola hepatica – obserwacja/opis w programie Olyvia/mikroskop - osobnik dojrzały, jajo Kosmopolityczna przywra pasożytująca w przewodach żółciowych wielu ssaków. Fascjoloza przebiega w dwóch fazach: ostrej i przewlekłej. Czasami zdarza się, że pasożyty wraz z prądem krwi dostają się do płuc, mózgowia, mięśni, powodując nietypowe objawy (ektopowa lokalizacja pasożyta). W krajach arabskich, gdzie tradycyjnie spożywa się wątrobę w stanie surowym, występuje schorzenie halzoun („buccopharyngeal distomatosis”) polegające na obrzęku i zapaleniu błony śluzowej gardła i jamy ustnej, przebiegające z bólem, krwawieniem i obfitym wydzielaniem śluzu. Objawy te związane są z przyczepianiem się motylic (zwykle postaci młodocianych) do błony śluzowej gardła. Narysuj:metacerkarie Zaznacz na rysunku: a) osobnik dojrzałyprzyssawka gębowa, przyssawka brzuszna, b) jajo – wieczko, 83 e) Schistosoma mansoni – obserwacja/opis w programie Olyvia/mikroskop - osobniki dojrzałe, jajo Gatunek endemicznie występujący w Brazylii, Wenezueli, na Karaibach, w Afryce (głównie w dorzeczu Nilu) i Azji Południowo-Zachodniej (Półwysep Arabski). Inwazja przebiega w trzech etapach: I – penetracja furkocerkarii przez skórę – swędzące zmiany grudkowe na skórze („swimmer itch”), II – wędrówka larw w organizmie żywiciela – objawy toksyczno-alergiczne, III – faza traumatyczna, narządowa - zmiany: krwotoczne, polipowate, wrzodziejące błony śluzowej jelita cienkiego i grubego, jako następstwo mechanicznego uszkodzenia tkanek przez jaja pasożyta (zaopatrzone w ostry kolec) oraz miejscowej odpowiedzi immunologicznej żywiciela (reakcja zapalna i naciek eozynofilów); powiększenie wątroby i śledziony; jaja zawlekane z prądem krwi mogą powodować zatory naczyń żylnych wątroby, tworzenie ziarniniaków także w innych narządach wewnętrznych (płuca, mózg). Możliwa jest lokalizacja ektopowa parazytozy. Narysuj:furkocrkarię Zaznacz na rysunku: a) osobniki dojrzałe: samicę, samca; ich przyssawki gębowe i przyssawki brzuszne, rynienkę płciową; b) jajo –kolec; 84 f) Diphyllobothrium latum – obserwacja/opis w programie Olyvia/mikroskop -proglotyd dojrzały (maciczny) Tasiemiec, którego ogniska inwazji utrzymują się w regionach o rozpowszechnionym zwyczaju spożywania ryb w stanie surowym lub półsurowym (np.: Finlandia, pogranicze USA i Kanady, Alaska, Syberia, Włochy, Szwajcaria). Difylobotrioza długotrwała i nierozpoznana powoduje u ok. 40% zarażonych niski poziom witaminy B12, co u ok. 2% osób prowadzi do niedokrwistości megaloblastycznej. Narysuj jajo – zwróć uwagę na wielkość, kształt, obecność wieczka Zwróć uwagę na:kształt członu, położenie i kształt macicy, 2. Pasożyty, których cykl rozwojowy związany jest z glebą - osobnik dojrzały a) Echinococcus granulosus – obserwacja/opis w programie Olyvia/mikroskop Tasiemiec rozpowszechniony w Afryce (Kenia), Azji, krajach basenu Morza Śródziemnego oraz w Chile i Argentynie, którego występowanie szczególnie wiąże się z hodowlą owiec i obecnością psów pasterskich. W postaci dojrzałej występuje w jelicie cienkim psowatych (pies, wilk, lis); żywicielami pośrednimi są zwierzęta roślinożerne i wszystkożerne, najczęściej związane ze środowiskiem synantropijnym (domowym, gospodarczym). Człowiek jest przypadkowym żywicielem pośrednim – rozwijajaca się w organizmie larwa powoduje bąblowicę jednojamową (echinococcosis) z najczęstszą lokalizacją torbieli w wątrobie (ok. 80%) i w płucach (20% przypadków). W przypadku pęknięcia torbieli pasożyta może dojść do wstrząsu anafilaktycznego oraz wtórnego rozsiewu wskutek uwolnienia protoskoleksów i ich odróżnicowania do postaci larwy. Narysuj: protoskoleksy z torbieli bąblowcowej oraz wynicowany protoskoleks Zaznacz na rysunku: skoleks, haki, przyssawki, proglotyd maciczny, 85 b) Echinococcus multilocularis – obserwacja/opis w programie Olyvia/mikroskop osobnik dojrzały Tasiemiec występuje w wielu krajach Europy, na Syberii, Alasce, na północy Chin i Japonii. Postacie dojrzałe pasożytują w jelicie cienkim psowatych (głównie lisów); żywicielami pośrednimi są drobne gryzonie (nornica ruda, norniki, mysz leśna) odgrywające ważną rolę w cyklu życiowym tego tasiemca w środowisku sylwatycznym – leśnym. Jaja wydalone z kałem żywiciela ostatecznego, zanieczyszczające środowisko (ściółkę, liście, jagody) stanowią źródło zarażenia człowieka. Jaja wykazują oporność wobec niesprzyjających warunków środowiska; w temperaturze -27°C przeżywają 54 dni, a w -70°C tracą inwazyjność dopiero po 96 godzinach. Postać larwalna z połkniętego jaja przenika do narządów – najczęściej do wątroby (90% przypadków), rzadziej płuc i innych narządów, w tym mózgowia. Zespół objawów echinokokozy wielojamowej (alveococcosis) przypomina proces nowotworowy z jego następstwami. Narysuj: torbiel z protoskoleksami u żywiciela pośredniego – myszy Zwróć uwagę na: skoleks, 4 proglotydy c) Trichuris trichiura – obserwacja/opis w programie Olyvia/mikroskop -osobniki dojrzałe, jaja Kosmopolityczny nicień o najwyższej prewalencji w strefie klimatu ciepłego i wilgotnego, pasożytujący w jelicie grubym i ślepym człowieka. Do zarażenia dochodzi poprzez spożycie jaj inwazyjnych z zanieczyszczonym pokarmem. U dzieci czynnikiem sprzyjającym inwazji jest geofagia. Pełny rozwój zarodka do stadium inwazyjnego trwa w środowisku zewnętrznym od 17 dni w temp. 30°C do 21 dni w 24°C. Inwazja występuje w Polsce z częstością ok. 10%. Objawy kliniczne włosogłówczycy (trichuriozy) zależą od intensywności inwazji; w Polsce – przebiega w większości przypadków bezobjawowo. Zaznacz na rysunku: a)samicę i samca – zaznacz przednie i tylne końce ciała b) jaja – żółte, brązowe, czopy na obu biegunach: 86 d) Ascaris sp.– obserwacja/opis w programie Olyvia/mikroskop - osobnik dojrzały: samiec samica, jaja Kosmopolityczny nicień przewodu pokarmowego człowieka (jelito cienkie). Najwyższa prewalencja glistnicy notowana jest w krajach rozwijających się strefy równikowej i zwrotnikowej (wysoka wilgotność i temperatura). Rozwój larwy inwazyjnej następuje w środowisku zewnętrznym; jaja w świeżym kale zawierają bruzdkujące zarodki - nie zarażają żywiciela. W klimacie umiarkowanym jaja, nie tracąc inwazyjności, mogą przetrwać w glebie 6-9 lat; są oporne na niskie i wysokie temperatury otoczenia - od -27°C do +41°C; nie obumierają w wodzie o dużym zasoleniu, a także w 14% roztworze podchlorynu sodu i 4% formalinie. Objawy kliniczne glistnicy (askariozy) związane są z występującymi w organizmie człowieka stadiami rozwojowymi pasożyta: w okresie wędrówki (migracji) larw – kaszel, objawy odoskrzelowego zapalenia płuc, nacieki Löfflera w płucach, wykwity skórne, świąd skóry, eozynofilia; po osiedleniu pasożyta w jelicie – bóle brzucha, wzdęcia, mdłości, wymioty. Groźnym powikłaniem (w przypadku masywnych inwazji) jest niedrożność jelit spowodowana skłębionymi glistami, a także perforacja jelita i przedostanie się glist do otrzewnej. Ponadto nicienie te mogą wnikać do przewodów wyprowadzających trzustki i dróg żółciowych. Niekiedy pasożyty wydalane podczas odruchów wymiotnych mogą prowadzić do niedrożności dróg oddechowych. Zaznacz na rysunku: samice, samca, jaja – niezapłodnione, zapłodnione, inwazyjne (z larwą); Zwróć uwagę na grubość osłonki, kształt. e) Toxocara canis– obserwacja/opis w programie Olyvia/mikroskop Kosmopolityczny nicień bytujący w jelicie cienkim psowatych; u kotowatych bytuje T. cati. Postacie dojrzałe obu gatunków różnią się budową skrzydełek oskórkowych występujących na przedniej części ciała (szersze i krótsze u T. cati). W środowisku zewnętrznym w warunkach optymalnych w ciągu 10-15 dni następuje rozwój larwy w jaju - jajo zawierające larwę II stadium jest inwazyjne dla człowieka. Większość przypadków toksokarozy u ludzi (mało intensywna inwazja) przebiega bezobjawowo. W objawowej parazytozie obraz kliniczny może być bardzo różnorodny. Największe znaczenie kliniczne mają: „zespół larwy trzewnej wędrującej” (visceral larva migrans), toksokaroza oczna (ocular larva migrans) oraz neurotoksokaroza. W toksokarozie ocznej w wyniku uszkodzenia mechanicznego przez larwy narządu wzroku (zapalenie siatkówki i naczyniówki, nacieki komórkowe, ziarniniaki) może 87 występować leukokoria ujawniana w specjalistycznym badaniu okulistycznym, za pomocą retinoskopu; występuje biały refleks źreniczny zamiast prawidłowego czerwonego. Objaw ten wymaga różnicowania z innymi chorobami, np. z retinoblastomą. Narysuj: a) jaja – barwa i kształt b) samice, samca f) Ancylostoma duodenale – obserwacja/opis w programie Olyvia/mikroskop - osobniki dojrzałe Geohelmint występujący w Europie i Afryce (regiony śródziemnomorskie), Azji Południowej i Wschodniej, Ameryce Południowej i Środkowej. W Polsce stwierdza się nieliczne przypadki ankylostomozy, głównie przywlekane z krajów o klimacie ciepłym i wilgotnym. Postacie inwazyjne (larwy filariopodobne) przeżywają w wilgotnej glebie ok. 120 dni w temp. 24-30°C, natomiast 4 dni w temp. 24°C. Larwy aktywnie wnikają przez skórę żywiciela do naczyń krwionośnych i chłonnych. Do zarażenia może dochodzić także przez spożycie larw wraz z zanieczyszczoną wodą lub pokarmem. Typowe objawy ankylostomozy we wczesnym okresie to świąd, wykwity skórne; w okresie wędrówki larw w organizmie człowieka występuje eozynofilia, kaszel, objawy zapalenia płuc, a w fazie jelitowej – bóle brzucha, mdłości, osłabienie i cechy niedokrwistości. Opisano bardzo rzadkie przypadki zarażenia płodu, a także inwazji u noworodków karmionych mlekiem matki (larwy w mleku). Narysuj: torebkę gębową zaznaczając ząbki oskórkowe Zaznacz na rysunku: gardziel, torebka gębowa Zwróć uwagę na: dymorfizm płciowy, lokalizację pasożytów w śluzówce jelita Podpis prowadzącego ……………………………………… Data: ……………………………… 88 REPOZYTORIUM Tabela 1. Przenosiciele patogenów patogen droga zarażenia/ źródła inwazji forma inwazyjna forma diagnostyczna przenosiciel/ żywiciel pierwotniaki Acanthamoeba castellani Entamoeba histolytica Cryptosporidium parvum przywry Fasciola hepatica Schistosoma mansoni tasiemce Diphyllobothrium latum Echinococcus granulosus Echinococcus multilocularis nicienie Trichuris trichiura Ascaris lumbricoides Toxocara canis Ancylostoma duodenale 89 ZADANIA DO SAMOKSZTAŁCENIA 1. Podać nazwy gatunkowe pasożytów oraz nazwy ich postaci morfologicznych przedstawionych na fotografiach: A B A C B D C D Nazwa łacińska Nazwa polska Postać morfologiczna pasożyta 2. Wyjaśnić pojęcia: indeks biologiczny: miano coli: miano Clostridium perfringens: 3. Biegunkę podróżnych (obfitą, wodnistą) powoduje: A. Entamoeba coli; B. Naegleria fowleri; C. Cryptosporidium parvum; D. Entamoeba dispar. 4. Uzupełnij tabelę dotyczącą antybiotyków produkowanych przez wybrane gatunki promieniowców: GATUNEK S. griseus ANTYBIOTYK SPEKTRUM DZIAŁANIA S. aureofaciens 90 S. nodosus S. noursei S. antibioticus S. galilaeus 5. Jakie drobnoustroje dostające się do gleby z fekaliami świadczą o jej zanieczyszczeniu? świeżym: starszym: najstarszym: LITERATURA 1. Błaszkowska J., Ferenc T., Kurnatowski P.(red.) 2017. Zarys parazytologii medycznej. Edra Urban&Partner, Warszawa. 2. Deryło A. 2012. Parazytologia i akaroentomologia lekarska. PWN, Warszawa. 3. Pojmańska T. (red.) 2016. Leksykon Parazytologiczny. Polskie Towarzystwo Parazytologiczne, Instytut Parazytologii PAN, Warszawa. 4. Zmysłowska Z., 2009. Mikrobiologia ogólna i środowiskowa : teoria i ćwiczenia. UWM, Olsztyn. 91 Ćwiczenie 5 Temat: Środowisko domowe oraz żywność jako źródło czynników patogennych dla człowieka. Obserwacja 1. Pasożyty przenoszone poprzez kontakty bezpośrednie oraz występujące w środowisku „domowym”. a) Trichomonas tenax - Rzęsistek policzkowy: - trofozoit - hodowla na podłożu Simiča – prep. bezp., pow. 400/600x, (prezentacja multimedialna). b) Trichomonas vaginalis - Rzęsistek pochwowy: - trofozoit - preparat z hodowli, utrw., barw. barwnikiem Giemsy, pow. 400/600, 1000x, (Olyvia) – rys. c) Entamoeba gingivalis - Pełzak dziąsłowy: - trofozoit - hodowla na podłożu Pawłowej – prep. bezp., pow. 400/600x (prezentacja multimedialna). d) Enterobius vermicularis - Owsik ludzki: - osobnik dojrzały (samica) – prep. mikr. utrw. etanolem, niebarw., pow. 25x, (Olyvia) – pokaz - jaja – prep. mikr., utrw. etanolem, niebarw., pow.100, 400/600x, (Olyvia) – rys. e) Demodex spp. – Nużeniec: - osobnik dojrzały,– prep. mikr. utrw., niebarw., pow.100x, (Olyvia) – rys. f) Sarcoptes scabiei - Świerzbowiec ludzki: - osobnik dojrzały – przekrój przez nory świerzbowcowe z widocznymi fragmentami ciała pasożyta,– prep. mikr. utrw., barw., pow.100x, (Olyvia) - pokaz g) Pediculus humanus (samiec, samica)- Wesz ludzka: - imago – prep. mikr. utrw. niebarw., pow. 100x, (Olyvia) – rys./pokaz - jaja na włosach – prep. mikr. utrw. niebarw., pow. 100x, (Olyvia) – rys.. h) Pthirus pubis - Wesz łonowa: - imago – prep. mikr. utrw. niebarw., pow. 100x, (Olyvia) – rys./pokaz - jaja – prep. mikr., utrw., niebarw., pow. 100x, (Olyvia) – rys. i) Pulex irritans - Pchła ludzka: - imago – prep. mikr.utrw., niebarw., pow. 25x, (Olyvia) – rys./pokaz j) Cimex lectularius – Pluskwa domowa: - imago (samiec)– prep. mikr.utrw., niebarw., pow. 25x, (Olyvia) – rys./pokaz 2. Żywność jako rezerwuar pasożytów człowieka. a) Toxoplasma gondii: - trofozoity wewnątrzkomórkowe i pozakomórkowe (tachyzoity) w wysięku otrzewnowym myszy - prep. mikr, utrw., barw. barwnikiem Giemsy, pow.600, 1000x, (Olyvia) – rys. b) Taenia saginata - Tasiemiec nieuzbrojony: - strobila - prep. makr. utrw. w 4% formalinie - pokaz; - proglotyd maciczny – prep. mikr. utrw. w płynie Bouina, barw. karminem ałunowym, pow. 25x, (Olyvia) – rys. - jaja - prep. mikr. utrw. w 4% formalinie, niebarw., pow.100, 400x, (Olyvia) – rys. - cysticercus bovis w mięsie wołowym - prep. makr. utrw. w 4% formalinie - pokaz. c) Taenia solium - Tasiemiec uzbrojony: - skoleks – przezrocze, pokaz; 92 - proglotyd maciczny – prep. mikr., utrw. w płynie Bouina, barw. karminem ałunowym, pow.25x, (Olyvia) – rys. - cysticercus cellulosae w mięsie wieprzowym - prep. makr. utrw. w 4% formalinie, pokaz. d) Trichinella spiralis - Włosień kręty: - larwa w mięśniu poprzecznie prążkowanym człowieka – prep. mikr., utrw. w płynie Bouina, barw hematoksyliną i eozyną, pow. 100, 600x, (Olyvia) – rys. - larwa w mięśniu poprzecznie prążkowanym szczura - metoda trichinoskopii – wykonanie, pow.100x - (prezentacja multimedialna). Zakres materiału do przygotowania przed zajęciami Informacje o wymienionych organizmach: cykle rozwojowe, stadia rozwojowe, występowanie, drogi i sposoby rozprzestrzeniania (transmisja) w środowisku oraz wnikania do organizmu człowieka (sposób inwazji, wrota inwazji), postać inwazyjna, miejsce bytowania w organizmie człowieka, chorobotwórczość, objawy inwazji u człowieka, wykrywanie: metody, materiał badany i postacie wykrywane, profilaktyka inwazji. Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Organizmy patogenne związane z domem jako środowiskiem życia człowieka oraz występujące w żywności – cykle i stadia rozwojowe, ich cechy charakterystyczne ważne diagnostycznie, chorobotwórczość, transmisja w środowisku. Dermatofity - czynniki sprzyjające zarażeniu; pierwotniaki przenoszone poprzez kontakt bezpośredni i pośrednio; stawonogi jako wektory patogenów człowieka. Naturalne substancje toksyczne w żywności (solanina, SBI) i toksyny pochodzenia biologicznego (botulinowa, enterotoksyna, tetrodotoksyna). 93 CZĘŚĆ TEORETYCZNA Czynniki etiologiczne chorób inwazyjnych związane z domem jako środowiskiem życia człowieka Dom jest szczególnym siedliskiem człowieka, w którym spędza znaczącą część każdego dnia (wg badań w USA, ludzie spędzają do ok. 87% doby w pomieszczeniu zamkniętym: w domu, szkole, pracy, sklepach, restauracjach itp., a dodatkowo ok. 6% doby w zamkniętym pojeździe). W środowisku pomieszczenia zamkniętego (nazywanym umownie „domem”) oddziałują na każdego z nas specyficzne czynniki biotyczne i abiotyczne, jednocześnie jednak jesteśmy częściowo chronieni przed niekorzystnymi wpływami środowiska zewnętrznego. W środowisku „domowym” następuje transmisja międzyosobnicza patogenów – drogą bezpośrednią (droga kropelkowa, kontakt bezpośredni człowiek-człowiek, człowiek-zwierzę) lub pośrednią (pyły niosące patogeny, wspólnie użytkowane przedmioty, przybory higieniczne itp.). Specyficzne zagrożenia w pomieszczeniach zamkniętych mogą stanowić: patogenne bakterie (np. Legionella sp., Pseudomonas aeruginosa – urządzenia klimatyzacyjne), grzyby, roztocza (roztocza kurzu domowego, świerzbowce), owady (muchy, pchły, pluskwy, wszy, prusaki), sierść, naskórek zwierząt i człowieka, związki chemiczne (produkty utleniania: tlenek, dwutlenek węgla, tlenki azotu, węglowodory aromatyczne; lotne i półlotne związki organiczne: formaldehyd, benzen, aceton, chloroform, węglowodory alifatyczne i aromatyczne; insektycydy; polichlorobifenyle w meblach, farbach, materiałach odzieżowych, żywności – brak odpowiedniej wentylacji pomieszczeń), radon. Choroby związane z przebywaniem w budynkach W ostatnich dekadach, na podstawie związku przyczynowego objawów chorobowych, ustalono dwa rodzaje problemów zdrowotnych, odnoszących się do warunków panujących w budynkach nieprzemysłowych - mieszkalnych i biurowych: syndrom chorego budynku – SBS (Sick Building Syndrome); choroby związane z budynkiem - BRI (Building Related Illnesses). Występowanie dolegliwości u osób przebywających w pomieszczeniach zamkniętych, związane ze złą jakością powietrza spowodowało wprowadzenie (WHO 1987r.) określenia „Syndrom chorego budynku” (SBS): budynek można nazwać chorym, jeśli „20% użytkowników stwierdza, że przyczyną objawów złego samopoczucia jest budynek, tzn. że objawy chorobowe pojawiają się i nasilają tylko w czasie przebywania w tym budynku, zaś znikają prawie natychmiast po jego opuszczeniu”. Zespół chorego budynku został zdefiniowany jako zespół objawów dyskomfortu fizycznego i psychicznego, które są na tyle niespecyficzne, że nie można ich wystąpienia powiązać z określonym czynnikiem. Objawy związane z przebywaniem w zamkniętych pomieszczeniach to m.in: wysuszenie i podrażnienie błon śluzowych oczu, wysuszenie i podrażnienie gardła, suchy kaszel, niedrożny nos, ból w okolicy zatok, wysuszenie i podrażnienie skóry, ze złuszczaniem się naskórka, bóle i zawroty głowy, senność, przygnębienie, pogorszenie koncentracji, nudności, zgaga, bóle w klatce piersiowej, uczucie trudności w oddychaniu, zaostrzenie dolegliwości związanych z istniejącym schorzeniem, np. astmą. 94 Powyższe objawy wynikają z ograniczonej wymiany powietrza w pomieszczeniach, obecności czynników chemicznych – emisja zanieczyszczeń nieorganicznych i organicznych (produkty spalania, rozpuszczalniki, kleje, związki chloru itp.), zanieczyszczeń biologicznych (roztocza, owady, grzyby, bakterie, pyłki roślinne itp.) oraz obecności zwierząt domowych, a także hałasu i wibracji, zjawisk radiacyjnych, w tym jonizacji powietrza na skutek promieniowania radioaktywnego i zjawisk elektrostatycznych, działania pola elektromagnetycznego (PEM). W diagnostyce SBS istotne znaczenie mają następujące obserwacje: natychmiastowe ustąpienie lub zmniejszenie nasilenia objawów po opuszczeniu budynku, sezonowość dolegliwości (przegrzanie, wychłodzenie), wystąpienie podobnych objawów u współużytkowników mieszkania lub biura. W przypadku, gdy zachodzi dające się udowodnić powiązanie między objawami chorobowymi a czynnikami przyczynowymi bezpośrednio związanymi z zanieczyszczeniami w budynkach, dane schorzenie kwalifikuje się jako BRI. BRI zwana „chorobą mieszkaniową” lub też „chorobą szczelnego budynku” obejmuje: choroby wywołane czynnikami o działaniu toksycznym (zatrucie tlenkiem węgla, ekspozycja na radon - rak płuca), choroby infekcyjne (choroba Legionistów, gorączka Pontiac, „gorączka nawilżaczy”), choroby alergiczne (astma, alergiczne zapalnie pęcherzyków płucnych). Czynniki chemiczne występujące w środowisku domowym Spośród licznych zanieczyszczeń chemicznych tlenek węgla stanowi zagrożenie nie tylko dla zdrowia osób przebywających w pomieszczeniach mieszkalnych, ale także dla ich życia. Tlenek węgla Potocznie zwany czadem, jest gazem silnie trującym, bezbarwnym i bezwonnym, nieco lżejszym od powietrza, o ok. 250 razy większym powinowactwie do hemoglobiny erytrocytów krwi. Tworzy karboksyhemoglobinę, w której połączenie tlenku węgla z hemoglobiną jest trwalsze, niż połączenie tlenu z hemoglobiną w oksyhemoglobinie. Dochodzi do niedotlenienia tkanek, co może prowadzić do śmierci. Wdychanie powietrza ze stężeniem 0,16% objętościowego CO, powoduje zgon po dwóch godzinach. Tlenek węgla działa toksycznie, uszkadzając śródbłonek naczyń krwionośnych, sprzyja tworzeniu się płytki miażdżycowej. Tlenek węgla powstaje w wyniku niepełnego spalania wielu paliw (drewna, oleju, gazu, benzyny, nafty, propanu, węgla, ropy) spowodowanego brakiem odpowiedniej ilości tlenu. Brak dopływu świeżego (zewnętrznego) powietrza do urządzenia, w którym następuje spalanie, zanieczyszczenie, zużycie lub zła regulacja palnika gazowego, także przedwczesne zamknięcie paleniska pieca lub kuchni jest szczególnie groźne w mieszkaniach o oknach szczelnie zamkniętych lub uszczelnionych na zimę. Radon Szkodliwymi zanieczyszczeniami, naturalnie obecnymi w pomieszczeniach są radon 222Rn i produkty jego rozpadu. Radon jest naturalnie występującym, bezbarwnym i bezwonnym gazem szlachetnym; powstaje w wyniku rozpadu promieniotwórczego radu (226Ra). Nie sam radon, ale produkty jego rozpadu są źródłem wysoko energetycznego promieniowania alfa, które może być szkodliwe dla zdrowia użytkowników pomieszczeń; dodatkowo, są one stałymi metalami ciężkimi, które mogą łączyć się z cząstkami aerozolowymi obecnymi w powietrzu wewnętrznym i które mogą być wprowadzane do płuc człowieka poprzez oddychanie. Radon z gruntu może przenikać do piwnic budynków poprzez szczeliny w podłogach, ścianach i nieszczelności instalacyjne oraz dostawać się do pomieszczeń razem z gazem ziemnym i bieżącą wodą. Dodatkowo dzięki efektowi kominowemu 95 (unoszące się, ogrzane powietrze), jest on zasysany z piwnic na wyższe kondygnacje budynków. Duże znaczenie dla stopnia zanieczyszczenia powietrza mieszkań mają materiały budowlane, z jakich wykonane są ściany i stropy budynku oraz rodzaj ich wykończenia. Szczególnie radioaktywne są wszelkie surowce pochodzenia przemysłowego: lotny popiół, żużel, fosfogips i beton. Średnie stężenie radu w materiałach budowlanych wynosi około 100 Bq/kg. Radon, jak i produkty jego rozpadu są wdychane przez człowieka wraz z powietrzem atmosferycznym, dlatego też płuca są najbardziej narażone na ich oddziaływanie. Skutki mogą objawić się po latach w postaci raka płuc, a nawet białaczki. Według Międzynarodowej Komisji Radiologicznej długotrwałe narażenie na radon wewnątrz pomieszczeń na poziomie rzędu 100 Bq/m3 istotnie zwiększa ryzyko zachorowania na nowotwór płuc. Azbest Od roku 1997 w Polsce obowiązuje zakaz stosowania azbestu (obecny w eternicie - płyty cementowo-azbestowe), ale materiał ten wciąż znajduje się w wielu domach i w miarę niszczenia elewacji i pokrycia dachów stopniowo uwalnia się do środowiska domowego. Azbest znajduje się na liście substancji o udowodnionym działaniu rakotwórczym w warunkach narażenia zawodowego, dlatego obowiązują zalecenia zmierzające do utrzymania jego stężenia w powietrzu na możliwie najniższym poziomie. Najwyższe dopuszczalne stężenie (NDS) w miejscu pracy wynoszące 1 mg/m3 pozwala na znaczne ograniczenie ryzyka wystąpienia choroby nowotworowej, lecz w pełni go nie eliminuje. Ozon W wielu pomieszczeniach zamkniętych często są użytkowane takie urządzenia jak kserokopiarki, skanery i drukarki, które podczas pracy emitują szkodliwe substancje chemiczne np. ozon, tlenki azotu: NO i NO2. Może to powodować niekorzystne skutki zdrowotne, szczególnie u osób narażonych zawodowo w pomieszczeniach pozbawionych odpowiedniej wentylacji. NDS dla ozonu wynosi 0,15 mg/m3. Główną drogą wchłaniania ozonu do organizmu człowieka jest układ oddechowy. Objawy działania ozonu na organizm człowieka zależą od jego stężenia i czasu ekspozycji. Pierwszymi objawami krótkotrwałego narażenia na ozon są objawy ze strony układu oddechowego, takie jak podrażnienie gardła i kaszel, a także podrażnienie spojówek oka. Długotrwałe działanie małych stężeń ozonu może prowadzić do nieodwracalnych, rozległych zmian w płucach. W przypadku ostrych zatruć możliwe są obrzęki płuc, a nawet śmierć. Przy przewlekłym narażeniu na ozon obserwuje się podrażnienie i łzawienie oczu, pogorszenie jakości widzenia, bóle i zawroty głowy, duszności, nudności oraz obniżenie koncentracji. Wśród udokumentowanych skutków zdrowotnych narażenia na ozon są między innymi zwiększone ryzyko zachorowań i zgonów z powodu chorób układu oddechowego takich jak astma, przewlekła obturacyjna choroba płuc (POChP), oraz chorób układu krążenia. Głównymi skutkami działania ozonu na naczynia krwionośne sa zmiany patologiczne tętnic w płucach, obrzęk płuc. Czynniki biologiczne Grzyby mikroskopowe W środowisku domowym (zawilgocone pomieszczenia) często występują grzyby z rodzaju Penicillium, Aspergillus, Cladosporium, Alternaria, a także dermatofity. Dermatofity to grzyby, które mają zdolność do rozkładania keratyny (główną rolę w jej rozkładzie odgrywają enzymy keratynolityczne) oraz wzrostu w warstwie rogowej naskórka, we włosach i paznokciach. Mogą powodować infekcje skóry gładkiej i owłosionej, włosów i paznokci. Poznano ok. 40 gatunków grzybów zaliczanych do dermatofitów. Najważniejsze rodzaje należące do dermatofitów to Microsporum, Trichophyton i Epidermophyton. W klasyfikacji dermatofitów stosuje się często kryteria ekologiczne dzieląc dermatofity 96 ze względu na źródło ich pochodzenia na trzy grupy: antropofilne (izolowane od ludzi, mające zdolność wywoływania zakażenia, najczęściej w kontaktach człowiek-człowiek), zoofilne (występujące u zwierząt, mające zdolność wywoływania zakażenia w kontaktach zwierzę-człowiek) i geofilne (mające zdolność rozwijania się w litosferze i wywołujące u ludzi zakażenia po kontakcie z glebą) (rycina 1). Rycina 1. Rodzaje dermatofitów w zależności od źródła zakażenia. Epidermophyton floccosum Gatunek kosmopolityczny, bardzo częsty w krajach tropikalnych. Należy do gatunków antropofilnych. Na podłożu Sabourauda wzrasta w postaci kolonii niskich, pomarszczonych początkowo białoszarych, potem jasnożółtych lub żółtozielonych. Bardzo charakterystyczne są makrokonidia buławkowate o zaokrąglonych końcach, gładkościenne, grubościenne, 2-10- przegrodowe, układające się w skupieniach po 5-7 na szczytach strzępek zarodnikotwórczych. W starszych hodowlach często występują chlamydospory, nie tworzy mikrokonidiów. Chorobotwórczość: dermatomykozy skóry pachwin, podbrzusza, pomiędzy palcami, rzadko onychomykozy (grzybice paznokci). Microsporum canis Kosmopolityczny dermatofit należący do gatunków zoofilnych. Na podłożu Sabourauda tworzy kolonie puszyste, o postrzępionym brzegu, białe z czasem wytwarzające żółty lub różowy barwnik. Produkuje mikrokonidia (gruszkowate lub wydłużone) oraz duże, wrzecionowate makrokonidia podzielone na przegrody (zwykle 6-12) o chropowatej ścianie. Chorobotwórczość: dermatomykozy skóry gładkiej i owłosionej; często występuje u dzieci. Trichophyton mentagrophytes W obrębie gatunku wyróżniane są liczne odmiany, mi.in. Trichophyton mentagrophytes var. granulosum, T. mentagrophytes var. interdigitale. Na podłożu Sabourauda kolonie różnią się w zależności od odmiany. Wytwarza mikrokonidia (okrągłe lub owalne) i makrokonidia maczugowate lub wrzecionowate, cienkościenne, podzielone na komory (3-8). Chorobotwórczość: dermatomykozy skóry gładkiej, onychomykozy, dermatomykozy skóry owłosionej. Trichophyton rubrum Gatunek antropofilny, na podłożu Sabourauda rośnie w postaci puszystych kolonii, początkowo białych, potem purpurowo-czerwonych. Mikrokonidia są gruszkowate lub jajowate, makrokonidia maczugowate, cienkościenne, podzielone na komory (3-5). Chorobotwórczość: grzybice skóry gładkiej, onychomykozy, rzadko grzybice skóry owłosionej. 97 Dermatofitami można zarazić się: od osób chorych – gatunki antropofilne rozwijają się w ustroju człowieka w postaciach bezpłciowych (stadium anamorficzne); do transmisji ich dochodzi podczas kontaktów, pomiędzy człowiekiem chorym i zdrowym drogą bezpośrednią lub pośrednią (grzebienie, szczotki do włosów, czapki, bielizna pościelowa, ręczniki, dywany, itp.); od zakażonych zwierząt – naturalnym rezerwuarem gatunków zoofilnych są zwierzęta hodowlane lub dzikie; przez kontakt ze skażoną glebą - gatunki geofilne wykrywane są zwykle w ziemi, w której znajduje się materia organiczna, zawierająca keratynę ludzką i zwierzęcą, mogą być źródłem nie tylko zakażenia ludzi i zwierząt, lecz także drobnych gryzoni, pełniących istotną rolę w transmisji grzyba między różnymi gatunkami ssaków. Czynniki sprzyjające zarażeniu dermatofitami: warunki geograficzne, klimatyczne (sezonowość zarażenia), przegęszczenie populacji, nieodpowiednia higiena pomieszczeń, korzystanie ze wspólnych urządzeń sanitarnych i sportowych, noszenie obuwia i skarpet z tworzyw sztucznych, niewłaściwa higiena (szczególnie istotna w przypadku stóp), zaburzenia homeostazy ustroju żywiciela: - niedobory odporności: wrodzone, nabyte, - endokrynopatie (niewydolność nadnerczy, tarczycy, przytarczyc), - choroby alergiczne o podłożu atopowym, - uwarunkowania genetyczne (np. zaburzenia w budowie keratyny), właściwości szczepu grzyba: - zjadliwość szczepu m.in. zdolność adherencji, aktywność enzymów proteolitycznych. Dermatomykozy (historyczna nazwa dermatofitozy) Dermatofity wywołują infekcje dermatofitowe (dermatomykozy lub grzybice właściwe) określane terminem tinea z następującym łacińskim wyrazem określającym część ciała objętego procesem chorobowym (tabela 1). Przykłady czynników etiologicznych wywołujących dermatomykozy u ludzi: grzybice głowy (skóry owłosionej) i tułowia (Microsporum canis); grzybica skóry gładkiej – międzypalcowa, stopa mokasynowa/stopa atlety (Epidermophyton floccosum); grzybica skóry brody (Trichophyton rubrum). Tabela 1. Rodzaje dermatomykoz. Nazwa grzybicy Grzybica owłosionej skóry głowy Tinea capitis Grzybica brody Tinea barbae Grzybica skóry gładkiej Tinea corporis, Tinea cutis glabrae Grzybica pachwin Tinea inguinalis Grzybica rąk Tinea manus, manuum Grzybica stóp Tinea pedis, pedum Grzybica paznokci Tinea unguis, unguium Miejsce zakażenia Owłosiona skóra głowy Broda Tułów, skóra gładka Pachwiny Ręka, ręce Stopa, stopy Paznokieć, paznokcie 98 Roztocza kurzu domowego W środowisku domowym mogą występować liczne roztocza. Alergolodzy wyróżniają dwie grupy roztoczy: mieszkaniowe (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Euroglyphus maynei) obecne w kurzu, dywanach, kocach itp. oraz magazynowe (Acarus siro) występujące w różnych produktach mącznych. Dwa gatunki roztoczy kurzu domowego D. pteronyssinus i D. farinae stanowią główne źródło białek uczulających (alergeny obecne w odchodach roztoczy), wywołujących choroby alergiczne u ludzi, takie jak przewlekły nieżyt nosa, ataki astmy oskrzelowej oraz atopowe zapalenie skóry. Optymalne warunki rozwoju przedstawicieli tych gatunków obejmują wysoką wilgotność względną (80%) i temperaturę powietrza (ok. 25°C). Roztocza giną w temperaturze >55°C; pranie na sucho niszczy osobniki dorosłe, ale nie redukuje stężenia alergenu. Szacuje się, że wystarczy około 2 μg białek uczulających (białko Der p.1) w 1 gramie kurzu, by wywołać nadwrażliwość na alergeny roztoczy kurzu domowego. Przy ekspozycji >10 μg Der p.1 w 1 g kurzu istotnie wzrasta ryzyko rozwoju astmy oskrzelowej. Żywność jako źródło czynników patogennych dla człowieka. Skażenie żywności a zdrowie człowieka Jednym z podstawowych czynników wpływających na zdrowie ludzi jest jakość żywności. Zbilansowana żywość, dobrej jakości, ma zapewnić prawidłowe funkcjonowanie organizmu i jego rozwój. Według tzw. kodeksu żywnościowego (Codex alimentarius) ważne jest bezpieczeństwo żywności, czyli całokształt czynników które zapewnią bezpieczną dla zdrowia i życia człowieka żywność. Ustawowa konieczność dbania o bezpieczeństwo zdrowotne żywności (Dz. U. z 2017 r. poz. 149, Art. 3.3, pkt 5.), to kontrola takich czynników jak np: używanie w produkcji żywności substancji dodatkowych oraz aromatów, ilości substancji zanieczyszczających żywność, pozostałości pestycydów w żywności (głównie owoce, warzywa, zboża), środowiska napromieniania produktów spożywczych, Żywność jest złożoną mieszaniną substancji odżywczych i nie odżywczych (tj inne niż białka, węglowodany, tłuszcze czy witaminy i minerały). Może być ona także przyczyną zagrożeń zdrowia, ze względu na obecność szkodliwych substancji – związków chemicznych, zanieczyszczeń fizycznych (np. kamyki, kości, włosy) i zanieczyszczeń biologicznych (rycina 2) Rycina 2. Grupy zagrożeń związanych z żywnością 99 Zakłada się, ze żywność jest bezpieczna, jeśli nie zawiera substancji, które ją zanieczyszczają a spożycie produktu spożywczego może być zakazane tylko w przypadku gdy Agencja ds. Żywnosci i Leków (ang. Food and Drug Administration, FDA), przedstawi jednoznaczne dowody świadczące o istnieniu związku pomiędzy spożyciem tego typu żywności a wystąpieniem zgonu lub choroby. Szkodliwe zanieczyszczenia to także obecność zanieczyszczeń chemicznych czy fizycznych. Europejski Urząd ds. Bezpieczeństwa Żywności (European Food Safety Authority – EFSA) jest kluczowym organem Unii Europejskiej (UE) powołanym na mocy Rozporządzenia (WE) Nr 178/2002 Parlamentu Europejskiego i Rady z dnia 28 stycznia 2002 r. Opracowuje niezależne oceny ryzyka i opinie naukowe, na podstawie których powstają unijne normy w zakresie bezpieczeństwa żywności i pasz. Krajowym organem odpowiedzialnym za bezpieczeństwo żywności jest Główny Inspektorat Sanitarny. Wykazano, ze substancje szkodliwe, zawarte w żywności są przede wszystkim spowodowane obecnością w surowcach do jej produkcji substancji potencjalnie niebezpiecznych dla zdrowia człowieka (toksycznych) np. pozostałości pestycydów, wielopierścieniowych węglowodorów aromatycznych (wielopierscieniowe węglowodory aromatyczne; WWA), metali ciężkich, oraz leków (antybiotyków, leków hormonalnych), w produktach pochodzenia zwierzęcego. WWA powstają w żywności podczas jej przetwarzania termicznego, np. pieczenia, smażenia, grillowania czy wędzenia. Obecność WWA w produktach spożywczych może być również wynikiem prowadzenia upraw lub hodowli zwierząt w rejonach zurbanizowanych, czy pozyskiwaniem ryb ze skażonych łowisk .Wówczas następuje ekspozycja na nitro-WWA i ich pochodne. Metale ciężkie i ich związki mogą być zanieczyszczeniem produktu spożywczego lub naturalnym składnikiem żywności. Zwykle naturalna ich zawartość w pożywieniu jest niewielka, i dlatego nie mają istotnego wpływu na przebieg procesów fizjologicznych w organizmie. Jako zanieczyszczenie żywności, w dużych ilościach, są szkodliwe dla zdrowia i życia człowieka. Do takich zanieczyszczeń należą przede wszystkim ołów, rtęć, arsen, kadm i nikiel, a źródłem ich pochodzenia są głównie: opakowania żywności przemysł przewórczy zwierzęta i rośliny, które skumulowały w tkankach duże ilości toksycznych metali pochodzących ze środowiska. Szczególny rodzaj skażenia żywności stanowią izotopy radioaktywne. Spożycie przez człowieka skażonej nuklidami żywności i wody pozostaje potencjalnym problemem, szczególnie dla populacji zamieszkujących tereny gdzie zanieczyszczenia takie są bezpośrednio deponowane w środowisku. Generalnie rozwój energetyki jądrowej zwiększył globalny poziom promieniowania w środowisku. Istotnym problemem są opady radioaktywne związane z testowaniem wybuchów niewielkich bomb atomowych (atole na Pacyfiku) lub eksplozji wywołanych w celach pokojowych (kopalnie odkrywkowe, kopanie kanałów itp). Również źródłem skażeń naturalnymi substancjami promieniotwórczymi jest wydobywanie i spalanie węgla kamiennego. Tą drogą wprowadza się do gleby i wód kopalnianych np. 226 Ra, 228Ra czy 40K. Radionuklidy po związaniu z żelazem, krzemem, pyłami nieorganicznymi tworzą nierozpuszczalne cząstki. W tej postaci dostają się do łańcucha pokarmowego, bezpośrednio do poziomu roślinożerców, a następnie do konsumentów wyższego rzędu. Należy pamiętać, ze istnieje ciągła retencja radionuklidów w ekosystemie, ulegają one także rozpadowi lub są usuwane przez czynniki środowiskowe (np. nuklidy z krótkim ekologicznym okresem półtrwania). Istotne, w aspekcie monitorowania skażenia żywności, jest ocenianie obecności radioizotopów Sr czy Cs ( 90Sr, 137Cs, 134Cs). 90Sr jako wapniowiec, dobrze wchłania się z jelita i lokalizuje się głównie w tkance kostnej. Jako emiter cząstek β może powodować uszkodzenie komórek szpiku kostnego. Najpoważniejszym źródłem skażenia strontem jest mleko i ser podpuszczkowy. Z kolei 137Cs, którego połowiczny okres rozpadu wynosi ok. 30 lat, emituje głównie kwanty γ, a po dostaniu się do organizmu, kumuluje się głównie w tkankach mięśniowych, ale także w nerkach, śledzionie, płucach czy wątrobie. 100 Źródłem 137Cs w żywności są zboża, fasola, rośliny oleiste, ziemniaki, buraki i pomidory. Mięso i mleko są także źródłami 137Cs w diecie. Obecnie w wielu krajach Europy prowadzi się metodą spektrometrii promieniowania gamma monitorowanie zanieczyszczenia żywności izotopami 134Cs i 137Cs. Jako przykład z ostatnich kilku lat, można przytoczyć analizę radioaktywności tych nuklidów w próbkach żywności (owocach i warzywach) pochodzącej z niektórych regionów Japonii. Nadzór taki wprowadzono po awarii reaktora DAIICHI w 2011 roku w Fukushimie. Negatywny wpływ substancji/związków na organizmy żywe (nie tylko z żywności), może przejawiać się jako działanie toksyczne ostre i/lub przewlekłe, a także działanie: uczulające, rakotwórcze (karcinogenne), mutagenne, teratogenne, embriotoksyczne oraz szkodliwie wpływające na płodność i rozrodczość. Dla bezpieczeństwa konsumentów żywność poddaje się ocenie bakteriologicznej i toksykologicznej pod względem zawartości substancji dodatkowych i zanieczyszczeń (w tym, pestycydów i antybiotyków). W żywności poza zanieczyszczeniami chemicznymi występują zanieczyszczenia biologiczne (priony, wirusy, bakterie, grzyby, pierwotniaki, helminty) - stanowiące czynniki etiologiczne chorób zakaźnych i inwazyjnych (tabela 2). Tabela 2. Zakażenia pokarmowe. Rodzaj zakażenia pokarmowego Źródło Drobnoustrój Intoksykacja Żywność zawierająca toksyny bakteryjne lub metabolity grzybów pleśniowych Clostridium botulinum – jad kiełbasiany Aspergillus flavus – mykotoksyny Infekcja Żywność zanieczyszczona patogenami, które namnażają się głównie w przewodzie pokarmowym człowieka Escherichia coli Campylobacter jejuni Toksykoinfekcja Żywność zawierająca żywe komórki bakterii, które w przewodzie pokarmowym człowieka wytwarzają/ uwalniają enterotoksyny Escherichia coli – wybrane serotypy Clostridium perfringens Bacillus cereus Zagrożenia mikrobiologiczne w skali globalnej stanowią aktualny i istotny aspekt związany z bezpieczeństwem żywności. Najczęstsze czynniki etiologiczne chorób przenoszone przez żywność to: bakterie: Campylobacter spp., Salmonella spp., Listeria spp. i Escherichia spp., wirusy: Norovirus, Rotavirus i Hepatovirus A, toksyny wytwarzane przez mikroorganizmy chorobotwórcze, takie jak Staphylococcus aureus, Bacillus cereus i Clostridium perfringens. Główną przyczyną zatruć pokarmowych pochodzenia mikrobiologicznego są zatrucia obecnymi w żywności bakteriami i ich toksynami, co wiąże się z brakiem przestrzegania sanitarnych zasad przygotowania i prawidłowego przechowywania żywności. Są to zatrucia pokarmowe wywołane: bakteriami chorobotwórczymi, które mają zdolność rozwoju i namnażania się w przewodzie pokarmowym człowieka (bakterie z rodzaju Salmonella, Shigella), toksynami bakteryjnymi, które są obecne w produktach spożywczych (np. enterotoksyna gronkowcowa, jad kiełbasiany). Toksyny bakteryjne są czynnikiem wirulencji bakterii, czyli jej zjadliwości, co definjuje się jako zdolność drobnoustroju patogennego do wywołania choroby. Klasyfikacja toksyn bakteryjnych jest zróżnicowana, jednak najczęściej ich klasyfikacja opiera się na ich chemicznym składzie, działaniu na komórkę eukariotyczną oraz fakcie czy toksyna jest stałym elementem strukturalnym komórki, czy też jest aktywnie wydzielana do środowiska. Z biologicznego punktu widzenia toksyna jest substancją 101 związaną z procesami metabolicznymi bakterii a po kontakcie z tkankami gospodarza ma zdolność do zaburzenia prawidłowego metabolizmu komórki gospodarza. Przyjmuje się, że najbardziej podstawowy podział toksyn dotyczy ich właściwości, czy substancja ta stanowi integralną część strukturalną komórki (endotokyna), czy jest aktywnie wydzielana przez bakterie do środowiska (egzotokyna). Endotoksyny – to toksyny będące kompleksami liposacharydowymi, występujące w błonie zewnętrznej bakterii Gramujemnych. Są trwałe chemicznie i odporne na ogrzewanie w temp. 60 °C przez kilka godzin. Na organizm człowieka działają mniej toksycznie niż egzotoksyny. Egzotoksyny to silne toksyny białkowe wydzielane do środowiska przez żywe komórki bakteryjne, wytwarzane głównie przez bakterie Gram-dodatnie m.in. laseczkę tężca (Clostridium tetani) i inne bakterie z rodzaju Clostridium (np. C. botulinum) czy gronkowca złocistego (Staphylococcus aureus), oraz rzadziej bakterie Gram-ujemne, np. przecinkowiec cholery (Vibrio cholerae). Charakterystyka wybranych toksyn zawartych w żywności: Toksyna botulinowa Egzotoksyna botulinowa to neurotoksyna (zwana również jadem kiełbasianym), która jest wytwarzana przez bakterie Clostridium botulinum (laseczka jadu kiełbasianego).Przetrwalniki tej bakterii są powszechnie obecne w glebie. Botulina jest przyczyną botulinizmu, w następstwie spożywania zanieczyszczonego botulinami mięsa, mleka i jego produktów, jak i źle przechowywanej żywności. Zródłem zatruć są nie tyłko przetwory mięsne, lecz również przetwory warzywne i rybne. Ponieważ toksyna może przenikać przez błonę śłuzową do układu pokarmowego, do zatrucia jadem kiełbasianym dochodzi głównie drogą pokarmową. Toksyna wchłaniana w jelitach, przenika do układu krwionośnego i łimfatycznego. Po przejściu do naczyń krwionośnych a następnie do przestrzeni międzykomórkowej, oddziałuje z chołinergicznymi komórkami nerwowymi. Clostridium botulinum ma charakter neurotoksyny, zaburza neuroprzekaźnictwo w obwodowych synapsach cholinergicznych przez zahamowanie uwalniania acetylocholiny, powodując porażenie wiotkie. Do typowych symptomów botulinizmu zalicza się podwójne widzenie, suchość jamy ustnej spowodowane upośledzeniem wydzielania śliny, porażenie perystałtyki jelit, zaburzenie mowy i połykania, porażenie mięśni oddechowych a w ostateczności śmierć. Enterotoksyna gronkowcowa Enterotoksyny to rodzaj egzotoksyn, które są wytwarzane m.in. przez niektóre gatunki bakterii chorobotwórczych (np. Staphylococcus aureus – gronkowiec złocisty, Escherichia coli – pałeczka okrężnicy, Vibrio cholerae – przecinkowiec cholery czy rodzaj Shigella). Wsród enterotoksyn znajdujących się w żywności, szczególnie enerotoksynom gronkowcowym (wytwarzanym przez niektóre szczepy gronkowca złocistego), przypisuje się udział w ostrych zatruciach pokarmowych i alergiach. Są one czynnikiem etiologicznym wstrząsu toksycznego. Toksyny gronkowcowe, o stabilnej strukturze i znacznej odporności na działanie niskiego pH i wysokich temperatur (nie ulegaja inaktywacji w obróbce termicznej żywności), zachowują biologiczna aktywność przechodząc przez układ pokarmowy. Obecność enterotoksyn w żywnosci w ilości 0,5-1 ng/g żywności ma zdolność wywołania objawów zatrucia pokarmowego. Najczęściej, przypadki zatruć gronkowcowych koreluje się z zanieczyszczeniem biologicznym: mięsa czerwonego, drobiowego, wyrobów cukierniczych, sałatek, przetworów mlecznych i wyrobów garmażeryjnych. Wykazano, że enterotoksyny gronkowcowe w stężeniach kilku pg/ml mogą aktywować limfocyty T, które w odpowiedzi, wydzielają znaczne ilości prozapalnych i immunomodulujących cytokin, klinicznie objawiając się jako zespół wstrząsu toksycznego (ang. toxic shock syndrome; TSS). 102 Enterotoksyna Vibrio cholerae (choleragen) Wytwarzana jest przez przecinkowca cholery Vibrio cholerae. Występuje w zanieczyszczonej odchodami chorego lub nosiciela wodzie i żywności (niedogotowane warzywa, owoce morza, niepasteryzowane napoje). Powoduje obfite, groźne dla życia biegunki (śmiertelność w przypadku nieleczonej cholery wynosi ~60%). Toksyny naturalnie występujące w żywności: Sojowy inhibitor trypsyny (SBI ) Sojowy inhibitor trypsyny (trypsyna – enzym odpowiedzialny za trawienie białek) występuje w nasionach roślin strączkowych – soja, fasola, bób, groch. Jest substancją białkową i ulega denaturacji pod wpływem temperatury. W soi stanowi 6%, a w fasoli 2,5% wszystkich białek. Wyniki badań wskazują, że częste spożywanie inhibitorów trypsyny powoduje powiększenie i chroniczne schorzenie trzustki. Tetrodotoksyna (TTX) Zawarta w gonadach i wątrobie ryb z rodzaju Sphoeroides (rozdymkokształtne, np. ryba fugu, wykorzystywana w kuchni japońskiej), także w pewnych gatunkach rozgwiazd, krabów, ośmiornic, traszek i salamander. TTX jest termostabilna, ma także niską dawkę śmiertelną (DL50 wynosi 334 μg/kg dla myszy per os, 8 μg/kg mysz, dożylnie). Powstaje przy udziale bakterii symbiotycznych z rodzaju Pseudomonas i Vibrio; mechanizmy wytwarzania i kumulacji TTX nie zostały jeszcze dokładnie poznane. Mimo starannego oczyszczania ryb, szacuje się, że w wyniku spożycia "fugu" rocznie umiera około 100 osób, a śmiertelność przy zatruciach sięga 50-80%. Objawy wywoływane zatruciem TTX można podzielić na 4 stadia (ze względu na ilość przyjętej toksyny): 1. Parestezja – wrażenie drętwienia, mrowienia lub kłucia; 2. Drętwienie twarzy i języka, słabe zaburzenia psychomotoryczne; 3. Osłabienie siły mięśni, zaburzenia oddechowe, afonia (brak możliwości wytworzenia dźwięku); 4. Niedotlenienie, bradykardia, arytmia, śpiączka, śmierć. Zatrucia pokarmowe mogą także wiązać się z obecnością mykotoksyn wytwarzanych przez grzyby pleśniowe. W podsumowaniu, patogeny zanieczyszczające żywność przedstawia tabela 3. Tabela 3. Zanieczyszczona (skażenie) patogenami żywność jako źródło zatruć. Toksyny Patogen enterotoksyna T, enterotoksyna FM, cytotoksyna K, cereulidyna Bacillus cereus toksyna CDT Campylobacter Okres inkubacji (czas między spożyciem a wystąpieniem objawów) 1-6 h 6-24 h 2-5 dni Objawy Produkty spożywcze –źródło infekcji * nagłe wystąpienie ciężkich nudności i wymiotów; skurcze brzucha, nudności i wodnista biegunka gotowany ryż/makaron przechowywany w nieodpowiednich warunkach termicznych mięso, gulasz, sosy gorączka, nudności, skurcze brzucha i biegunka (czasami krwawa) surowy lub niedogotowany drób, niepasteryzowane mleko i 103 zanieczyszczona woda fosfolipaza C Clostridium perfringens 6-24 h skurcze brzucha, wodnista biegunka i nudności mięso, drób, sosy, suszona lub poddana obróbce termicznej żywność toksyna botulinowa Clostridium botulinum od kilku godzin do 14 dni (zależne od dawki) mięso, mleko i jego produkty, przetwory mięsne, przetwory warzywne i rybne shiga Escherichia coli - w tym (shigatoksyczne-STEC) 2-10 dni, najczęściej 3 - 4 dni osłabienie, zmęczenie, zawroty głowy, suchość w jamie ustnej, objawy ze strony układu nerwowego: porażenie mięśni gładkich, trudności z mówieniem, połykaniem biegunka (często krwawa), skurcze brzucha - Hepatovirus A 2-7 tygodni żółtaczka, zmęczenie, utrata apetytu, nudności surowe lub półsurowe owoce morza zebrane z zanieczyszczonych wód, gotowe do spożycia produkty spożywcze po kontakcie z osobą zakażoną - Listeria monocytogenes 3 dni-10 tygodni zapalenie opon mózgowych, posocznica, gorączka miękkie sery, niepasteryzowane mleko, wędliny - Norovirus 24-48 h gorączka, nudności, wymioty, skurcze brzucha, biegunka i bóle głowy surowe lub półsurowe skorupiaki, gotowe do spożycia produkty po kontakcie z osobą zakażoną - Salmonella spp. 6-72 h, najczęściej 12-36 h ból głowy, gorączka, skurcze brzucha, biegunka, niedogotowany drób, surowe jajeczne desery i majonez, 104 surowa lub niedogotowana wołowina, niepasteryzowane mleko i soki, kiełki roślin i zanieczyszczona woda wymioty i nudności kiełki roślin, tahini enterotoksyna A Staphylococcus aureus 0,5-8 h nagłe wystąpienie ciężkich nudności i wymiotów i skurcze brzucha kremowe desery i ciastka, sałatka ziemniaczana enterotoksyna gronkowcowa Staphylococcus aureus 0,5-8 h ból głowy, nudności i gwałtowne wymioty, bóle brzucha, biegunka, dreszcze, ogólne osłabienie organizmu wędliny, potrawy mięsne, sałatki, ciastka, mleko i przetwory mleczne, kremy, chałwy, lody termostabilna Vibrio 4-30 h nudności, wymioty, hemolizyna, parahaemolyticus najczęściej 12-24 h skurcze brzucha i hemolizyna wodnista biegunka antygenowo spokrewniona z TDH * Żywność podana w tabeli stanowi udokumentowane źródło wymienionych patogenów. niedogotowane lub surowe owoce morza W krajach europejskich obserwuje się zwiększoną częstość występowania bakteryjnych czynników patogennych, np. Escherichia coli serotyp O157:H7 czy Listeria monocytogenes. Coraz poważniejszym zagrożeniem staje się antybiotykooporność występujących w pożywieniu patogenów. Do zakażenia/zarażenia człowieka patogenami występującymi w żywności dochodzi poprzez: spożywanie żywności niewiadomego pochodzenia, spożywanie żywności nieodpowiednio obrobionej termicznie, spożywanie niemytych warzyw i owoców, picie nieprzygotowanej wody, brak higieny procesu przygotowywania posiłków oraz nieprzestrzeganie zasad higieny osobistej. Działania prewencyjne zapobiegające szerzeniu się chorób infekcyjnych i inwazyjnych przenoszonych drogą pokarmową polegają na: dokładnym myciu surowców poddawanych procesom przetwórczym oraz spożywanych na surowo, stosowaniu odpowiedniej obróbki termicznej żywności, zapewnieniu ludności odpowiednich warunków sanitarno-higienicznych, zapobieganiu nawożeniu gleby ludzkimi fekaliami i stosowaniu osadów ściekowych niepoddanych kontroli sanitarnej, dbałości o zdrowie publiczne, z uwzględnieniem zakazów dotyczących spożywania mięsa niepoddanego urzędowej kontroli, edukacji społeczeństwa w zakresie epidemiologii chorób związanych ze spożyciem skażonej żywności. Długotrwałe przechowywanie żywności sprzyja także namnażaniu drobnoustrojów rozkładających składniki pokarmowe i zmieniających cechy produktów (smak, wygląd, zapach, zawartość składników odżywczych, wartość energetyczna itp.). Metabolizm drobnoustrojów powoduje psucie się żywności, co skutkuje stratami ekonomicznymi, ale także może sprzyjać występowaniu 105 zatruć pokarmowych. Wśród mikroorganizmów uznawanych za wskaźniki zepsucia żywności można wyróżnić trzy grupy powodujące rozkład: białek, węglowodanów oraz tłuszczy. Poziom psucia produktów można ocenić na podstawie poziomu związków chemicznych, które powstają w żywności w wyniku aktywności metabolicznej drobnoustrojów. Pasożyty w żywności Pasożyty, których stadia inwazyjne występują w sposób naturalny w surowym pożywieniu: w rybach: Przywra chińska - Clonorchis sinensis (metacerkarie), Anisakis - Anisakis simplex (larwy), Bruzdogłowiec szeroki - Diphyllobothrium latum (larwy); w krabach: Przywra płucna - Paragonimus westermani (metacerkarie); w mięsie wieprzowym: Włosień kręty -Trichinella spiralis (otorbione larwy), Tasiemiec uzbrojony - Taenia solium (larwy), Toksoplazma - Toxoplasma gondii (cysty tkankowe); w mięsie wołowym: Tasiemiec nieuzbrojony - Taenia saginata (larwy), Toksoplazma - T. gondii (cysty tkankowe); w innym mięsie zwierząt hodowlanych (baranina, drób) – Toksoplazma - T. gondii (cysty tkankowe); na roślinach: Motylica wątrobowa - Fasciola hepatica (metacerkarie). Pasożyty, których stadia inwazyjne mogą stanowić zanieczyszczenie pożywienia: żywność/woda zanieczyszczona kałem ludzi i/lub zwierząt: Pełzak czerwonki - Entamoeba histolytica (cysty), Giardia - Giardia intestinalis (cysty), Cryptosporidium parvum (oocysty); żywność zanieczyszczona kałem psów i psowatych: Tasiemiec bąblowcowy jednojamowy Echinococcus granulosus i Tasiemiec bąblowcowy wielojamowy - E. multilocularis (jaja), Glista psia - Toxocara canis (jaja); żywność zanieczyszczona kałem kotów: Toksoplazma - T. gondii (oocysty), Glista kocia Toxocara cati (jaja). Alergeny w pożywieniu Działaniem niepożądanym żywności lub składników pożywienia może być wywołanie u człowieka nadwrażliwości na pokarmy (alergie) jako reakcji organizmu uruchamiajacej układ odpornościowy. Według danych Światowej Organizacji Alergii (WAO) z 2013 roku problem alergii pokarmowej dotyczy w Europie 11-26 milionów osób. Reakcja alergiczna organizmu, wywołana za pośrednictwem immunoglobulin klasy E (IgE) może dotyczyć jednego lub kilku objawów (rycina 3). 106 skórne: pokrzywka, egzema, wysypka, zapalenie skóry, świąd oddechowe: astma, świszczący oddech, nieżyt nosa, skurcz oskrzeli żołądkowo-jelitowe: nudności, wymioty, biegunka, skurcze w jamie brzusznej inne: niedociśnienie, obrzęk języka i krtani, wstrząs anafilaktyczny, świąd podniebienia Rycina 3. Możliwe objawy reakcji alergicznej organizmu. Objawy skórne i reakcja anafilaktyczna (szybko rozpoczynająca się, uogólniona, zagrażająca życiu reakcja nadwrażliwości organizmu w odpowiedzi na dany czynnik) są najpowszechniejszymi objawami związanymi z alergią pokarmową. Każde białko pokarmowe może być potencjalnym alergenem (tabela 4). Tabela 4. Przykłay znanych alergenów białkowych: Pokarm Mleko krowie Białko jaja Żółtko jaja Pszenica Dorsz Białko alergizujące kazeina, β-laktoglobulina, α-laktoglobulina owomukoid, owoalbumina liwetyna gluten, gliadyna, globulina, albumina białko gad c 1 Owomukoid - występuje przede wszystkim w białku jaja, uważany obecnie za najważniejszy alergen w IgE- zależnym uczuleniu na jajka; odporny na denaturację i trawienie enzymatyczne, nie traci swoich właściwości alergizujących po obróbce termicznej. Owoalbumina - stanowi drugi główny alergen jaja, występuje niemal wyłącznie w białku jaja; owoalbuminy jaja kur mogą reagować krzyżowo z mięsem drobiu. Liwetyna - główny alergen żółtka jaj; białko tylko częściowo termostabilne, dlatego niektórzy chorzy mogą spożywać żółtka jaja gotowane lub pieczone, a reagują silnie na surowe. Gluten - jest umowną nazwą mieszanin białek zapasowych (prolamin i glutenin) znajdujących się w ziarnach zbóż; odznacza się zdolnością wiązania wody, warunkuje wartość wypiekową mąki. Podstawowe białka glutenowe to: gliadyna w pszenicy, sekalina w życie, hordeina w jęczmieniu. Gliadyna - białko prolaminowe, jedna z białkowych składowych glutenu; powszechnie występuje w nasionach pszenicy, żyta i jęczmienia. 107 Gad c 1 – białko parwalbumina dorsza bałtyckiego, glikoproteina; ponad 95% osób uczulonych na ryby reaguje na parwalbuminę, która występuje u wszystkich praktycznie gatunków ryb - jest panalergenem (alergen obecny w niespokrewnionych organizmach - prefiks „pan” – z greki znaczy wszystko; w swojej budowie panalergeny posiadają wysoce konserwatywne regiony sekwencji aminokwasów oraz podobną strukturę trójwymiarową, a zatem spełniają wymagania dotyczące wzajemnego, krzyżowego rozpoznawania przez IgE). Problem alergii pokarmowej na mięso ryb, jest istotny ze względu na częstość występowania (najwyższy odsetek przypadków po alergii na alergeny jaj, mleka, orzeszków ziemnych i skorupiaków), ze względu na możliwy bardzo ciężki przebieg reakcji (łącznie z anafilaksją, nawet w przypadku ujemnych testów skórnych). Alergia nie cofa się z wiekiem, alergeny cechuje termostabilność . Ponadto mączka rybna stanowi dodatek do różnych form żywności stanowiąc ukryty czynnik sprawczy reakcji. Niepożądane reakcje organizmu występujące po spożyciu pokarmów, które są dobrze tolerowane przez osoby zdrowe, można podzielić na reakcje o podłożu immunologicznym (alergie pokarmowe) oraz nieimmunologicznym (nietolerancje pokarmowe). Do nieimmunologicznych nadwrażliwości pokarmowych zalicza się nietolerancje enzymatyczne, farmakologiczne oraz idiopatyczne za które odpowiadają między innymi barwniki i konserwanty spożywcze (z greckiego idios – własny, pathos – cierpienie, czyli "choroba sama z siebie"; powstająca spontanicznie albo mająca niejasne lub nieznane podłoże). Nietolerancje enzymatyczne mogą być spowodowane wtórnym lub pierwotnym (warunkowanym genetycznie) brakiem enzymów odpowiedzialnych za wchłanianie węglowodanów. Wśród najczęstszych przyczyn wtórnego niedoboru laktazy wymienia się stany zapalne jelit (nieswoiste i także o etiologii wirusowej, bakteryjnej, pasożytniczej) oraz alergię pokarmową (rycina 4). Rycina 4. Typy i mechanizmy nadwrażliwości pokarmowej (wg Wasilewska E, Ziętarska M, Małgorzewicz S. Immunologiczna nadwrażliwość na pokarm, Forum Zaburzeń Metabolicznych 2016, tom 7, nr 4, 152–161). Alergia pokarmowa to nieprawidłowa reakcja układu immunologicznego na składniki pokarmu. Wśród reakcji alergicznych przeważają reakcje IgE-zależne. Objawy mogą się pojawiać już w wieku niemowlęcym. Dominujące alergeny w tej grupie wiekowej to białka mleka krowiego, z kolei u młodzieży, podobnie jak i u dorosłych – orzechy i owoce morza. W diagnostyce zarówno nietolerancji pokarmowych, jak i alergii pokarmowej spektrum objawów może być podobne. Niektóre pokarmy mogą wywoływać objawy nietolerancji zarówno w mechanizmie immunologicznym, jak i nieimmunologicznym, dlatego w różnicowaniu obu typów reakcji zasadnicze znaczenie mają ustalenie związku przyczynowoskutkowego między spożytym pokarmem a objawami niepożądanymi, badanie przedmiotowe oraz badania pomocnicze. 108 W mechanizmie alergii pokarmowej u pacjentów z dolegliwościami z przewodu pokarmowego bierze się pod uwagę nie tylko mechanizmy immunologiczne, ale także tak zwane zwiększenie przepuszczalności bariery jelitowej i zaburzenia składu flory jelitowej określanego mianem mikrobiomu (patrz ćwiczenie 7). Nietolerancje farmakologiczne i/lub chemiczne spowodowane są substancjami farmakologicznymi i/lub chemicznymi zawartymi w żywności. Dużą grupą związków wywołujących objawy nietolerancji pokarmowej są związki dodawane do konserwowania i przetwarzania żywności, tak zwane food additives. Przykładem może być skurcz oskrzeli wywołany działaniem siarczynów zawartych w winie. Kolejną grupę nietolerancji pokarmowych tworzą niepożądane reakcje na aminy biogenne (tzw. reakcje pseudoalergiczne), gdy mediatory reakcji alergicznych, na przykład histamina, dostarczana jest w znacznych ilościach w spożytym pokarmie (np. szpinak, pomidory), lub gdy spożycie pokarmów powoduje uwalnianie endogennej histaminy (np. przez czekoladę, truskawki). Także spożycie żółtych serów i niektórych ryb może być przyczyną takich reakcji. Ryby, np. makrela, morszczuk, tuńczyk, zawierają w tkance mięśniowej spore ilości aminokwasu histydyny, ulegającego przemianie do histaminy dzięki działaniu enzymów pochodzenia bakteryjnego. Histamina odznacza się wysoką termostabilnością - nie ulega rozkładowi podczas prowadzonej obróbki cieplnej, typu smażenie czy pieczenie. Metaboliczne reakcje pokarmowe różnią się od pozostałych kategorii reakcji niepożądanych tym, że dotyczą żywności powszechnie konsumowanej, wykazującej toksyczne właściwości jedynie po nadmiernym spożyciu lub nieodpowiednim przetworzeniu. Przykłady substancji będących przyczyną metabolicznych reakcji pokarmowych: lukrecja (roślina z rodziny bobowatych) - zwiera kwas glicyryzynowy, który naśladuje działanie mineralokortykoidów; może być przyczyną nadciśnienia, powiększenia serca, zatrzymania sodu; gorzkie migdały, pestki moreli i brzoskwini – zawierają glikozydy cyjanogenne uwalniające cyjanek w następstwie kontaktu z kwasem żołądkowym powodujący sinicę; rzepa, kapusta, rzodkiew, rzepak, gorczyca – zawierają glukozynolany, i produkty ich degradacji – izotiocyjaniany, związki o działaniu antykancerogennym; jednak nadmierne ich spożywanie może zaburzać wchłanianie jodu i doprowadzić do nieprawidłowości funkcji tarczycy (działanie wolotwórcze). 109 CZĘŚĆ PRAKTYCZNA OBSERWACJA Polecenia: po obejrzeniu każdego preparatu, wrysuj brakujące szczegóły budowy pasożyta w zaproponowany rysunek konturowy rysunki opisz odpowiednimi nazwami oceń w przybliżeniu długość i szerokość pasożytów zwracaj uwagę na zabarwienie elementów budowy pasożytów 1. Pasożyty przenoszone poprzez kontakty osobnicze i występujące w środowisku „domowym”. a) Trichomonas tenax – obserwacja/opis w programie Olyvia – trofozoit Kosmopolityczny pasożyt jamy ustnej, którego inwazja następuje w wyniku transmisji człowiekczłowiek. Zarażenie u osób immunologicznie kompetentnych przebiega bezobjawowo. Rzęsistkowica (trychomonoza=trichomonoza, trichomonosis) jamy ustnej może objawiać się suchością, zaburzeniami smaku, pieczeniem, rzadziej samoistnymi bólami przy przełykaniu. Mogą występować ogniska zapalne w błonie śluzowej, zapalenie języka, kieszonki patologiczne (zmienione kieszonki dziąsłowe). U pacjentów z obniżoną odpornością – w starszym wieku, z chorobą nowotworową, alkoholizmem, opisano przypadki rzęsistkowicy z objawami zapalenia narządów takich jak; oskrzela, płuca, ślinianki, a nawet wątroby i gruczołów mlekowych. Opisz: sposób poruszania się pierwotniaka Zaznacz na rysunku: jądro, wici, aksostyl, b) Trichomonas vaginalis – obserwacja/opis w programie Olyvia/mikroskop - trofozoit Kosmopolityczny wiciowiec, występujący tylko w postaci trofozoitu w narządach moczowopłciowych człowieka. Inwazja T. vaginalis następuje najczęściej w wyniku stosunku płciowego, może nastąpić zarażenie pośrednie poprzez wspólnie używane przedmioty kąpielowe, bieliznę, a także w ciepłych wodach solankowych. Może dotyczyć rodzącego się dziecka - zarażenie rzęsistkiem podczas 110 porodu (od matki z nieleczoną rzęsistkowicą). Możliwe są inwazje bezobjawowe, 4-6 krotnie częstsze u mężczyzn. Inwazje rzęsistkiem mogą mieć charakter inwazji rodzinnych. Zaznacz na rysunku: jądro, aksostyl, kinetosom, wici c) Entamoeba gingivalis – obserwacja/opis w programie Olyvia/mikroskop – trofozoit Kosmopolityczny pierwotniak o niepotwierdzonej patogenności, bytujący w jamie ustnej człowieka (w przestrzeniach międzyzębowych, kieszonkach dziąsłowych i na migdałkach). Częściej wykrywany jednak u ludzi ze zmianami błony śluzowej jamy ustnej, zapaleniem zatok przynosowych lub migdałków podniebiennych. Zaznacz na rysunku: jądro, kariosom, wodniczka pokarmowa d) Enterobius vermicularis – obserwacja/opis w programie Olyvia/mikroskop - osobnik dojrzały, jajo Kosmopolityczny nicień, pasożyt jelita grubego, występujący głównie w regionach o klimacie umiarkowanym. Rozprzestrzenianiu sprzyjają bliskie kontakty (np. w szkołach i grupach rodzinnych), a także nieodpowiednia higiena osobista i społeczna. Zarażeniu i jego przewlekłemu utrzymywaniu się sprzyjają autoegzoinwazja, retroinwazja, autoendoinwazja oraz możliwość przeniesienia jaj inwazyjnych do organizmu człowieka ze środowiska drogą inhalacyjną. Enterobioza – to najczęstsza parazytoza u dzieci w Polsce. Według oficjalnych danych (PZH), w latach 2007-2008 liczba zachorowań rocznie wyniosła 5-6 tys. przy współczynniku zapadalności 13,5/100 tys. mieszkańców. Wydaje się jednak, że faktyczna częstość zarażeń jest o wiele wyższa (badania dzieci w regionie lubelskim w okresie 19762000 potwierdziły obecność pasożyta u 40,5% dzieci). Migracja ektopowa E. vermicularis może powodować inwazję żeńskich narządów płciowych – ziarniniaki macicy, jajników i jajowodów oraz otrzewnej. 111 Zaznacz na rysunku: kształt, wielkość, przedni i tylny koniec ciała; jajo: kolor otoczki e) Demodex spp. – obserwacja/opis w programie Olyvia/mikroskop - osobnik dojrzały Spośród ponad 100 różnych gatunków należących do rodzaju Demodex tylko dwa pasożytują u człowieka - D. folliculorum i D. brevis. Nużeńce są ektopasożytniczymi pajęczakami bytującymi w rejonach skóry szczególnie bogatych w gruczoły łojowe (nos, policzki, czoło, broda); mogą również występować w przewodzie słuchowym zewnętrznym, na skórze klatki piersiowej lub okolic genitalnych. Wzrost populacji nużeńców powyżej 5 osobników/cm2 prowadzi do pojawienia się objawów klinicznych. Przy niewielkiej liczebności populacji pasożyta nużyca jest bezobjawowa; w postaci skąpoobjawowej występują zmiany skórne, takie jak świąd, wypryski, okresowe ropne krostki, czerwone plamy oraz podrażnienia oczu (uczucie łaskotania powiek); w nużycy objawowej - przewlekły stan zapalny skóry twarzy, krosty i grudki zapalne, rozszerzenie naczyń krwionośnych skórnych, ropnie, swędzenie skóry na policzkach, pod oczami i wokół nosa, a także przewlekły stan zapalny powiek, spojówek oraz obfite wypadanie rzęs i brwi. Inwazje nużeńcem, często współistnieją z licznymi schorzeniami dermatologicznymi (np. trądzik różowaty, trądzik grudkowo-krostkowy, pokrewne jednostki chorobowe). Największy problem terapeutyczny stanowi demodekoza oczna. Nużeńce drażnią mechanicznie cebulkę włosową, naczynia skóry powiek i mieszków włosowych, dochodzi do hiperplazji nabłonka i powstaje charakterystyczny keratynowo-tłuszczowy mankiet u podstawy rzęsy, następuje zmiana kierunku wzrostu rzęsy i ich wypadanie. D. brevis występujący na powiekach powoduje objawy charakterystyczne dla zespołu suchego oka (uczucie suchości i obecności ciała obcego, „piasku” w oku, nadmierne łzawienie, swędzenie, podrażnienie i zaczerwienienie oczu, nadwrażliwość na światło); może dojść do zmętniania i guzowatych blizn rogówkowych skutkujących znaczną utratą wzroku. Bakteria wyizolowana z przewodu pokarmowego nużeńca – Bacillus oleronius – produkuje białka antygenowe, które powodują rozwój stanu zapalnego w tkance okołomieszkowej. Prewalencja D. folliculorum wzrasta wraz z wiekiem żywiciela, jest najwyższa u osób po 60 r.ż. (w starczym wieku nawet do 90%); nie stwierdza się inwazji u noworodków i małych dzieci. Pasożyty rozprzestrzeniają się wraz z kurzem, poprzez bezpośredni kontakt z zakażoną osobą lub przy użyciu wspólnych przyborów kosmetycznych, ręczników i ubrań. Jaja pasożyta szczególnie łatwo przylegają do tłustych powierzchni, a następnie roztocza wnikają w pory skóry. Zaznacz na rysunku: gnatostoma, podosoma z odnóżami, opistosoma, odnóża (4 pary) 112 f) Sarcoptes scabiei – obserwacja/opis w programie Olyvia/mikroskop - samica Kosmopolityczny pajęczak drążący kanały (do 15 mm długości) w zrogowaciałej warstwie naskórka. Wywoływane przez świerzbowce zmiany to świerzb - choroba dobrze znana już w starożytności. Obecnie na świecie zarażonych jest ok. 200 mln (WHO) ludzi; odsetek zarażonych wynosi od 0,2% do 71% zależnie od statusu higienicznego i ekonomicznego oraz od klimatu. W 2017r. świerzb został zaliczony do tzw. zaniedbanych chorób tropikalnyche (Neglected Tropical Diseases NTDs). Parazytoza stanowi istotny problem medyczny z powodu dużego rozpowszechnienia, ale również ze względu na powikłania spowodowane intensywnym drapaniem się, powodujących zakażenia bakteryjne, które mogą doprowadzić do posocznicy i infekcji narządowych. W Polsce notuje się około 11 tys. przypadków/rok. Rozpoznanie potwierdzamy badaniem mikroskopowym zeskrobin ze skóry i zawartości korytarzy („nory świerzbowcowe”) w obrębie wykwitów skórnych. Transmisja pasożyta następuje najczęściej w wyniku kontaktu bezpośredniego, możliwa jest także po kontakcie pośrednim (spanie w jednym łóżku, czy używanie tej samej odzieży). Roztocza mogą przetrwać poza skórą żywiciela do 2 dni (metoda zwalczania - odłożenie bielizny i pościeli np. do worków foliowych na 3-4 dni). Świerzbowce zwierzęce (np. psi) nie drążą korytarzy w skórze człowieka, natomiast mogą powodować odczyny alergiczne. Zaznacz na rysunku: odnóża - przylgi na przedstopiu pierwszych dwu par, g) Pediculus humanus – obserwacja/opis w programie Olyvia/mikroskop – imago Kosmopolityczny owad – stały pasożyt zewnętrzny człowieka. Jest wektorem dla bakterii: riketsji duru epidemicznego (Rickettsia prowazekii), pałeczek gorączki okopowej (Bartonella quintana) oraz krętków duru powrotnego (Borrelia recurrentis). Powoduje wszawicę głowy (pediculosis capitis) i wszawicę odzieżową (pediculosis vestimenti). Pasożytuje głównie w okolicy skroniowej i potylicznej głowy (na włosach widoczne są jaja – gnidy, nimfy i postacie dorosłe), nakłuwanie skóry przez owada wywołuje świąd, drapanie się, powstawanie przeczosów i strupów. Duże znaczenie epidemiczne ma zjawisko opuszczania przez owady ciała żywiciela przy temperaturze 40oC. Współczynnik zapadalności na wszawicę (na 100 000 mieszkańców) w Polsce wzrósł z 1,39 w 2004r. do 6,96 w 2008 – ostatniego roku rejestracji danych. Narysuj gnidy na włosach: sposób przytwierdzenia do włosa, kształt, wieczko Narysuj: samicę Zwróć uwagę na: kształt ciała, aparat gębowy, czułki, odnóża zakończone pazurami, odwłok, narząd kopulacyjny u samca 113 h) Pthirus pubis – obserwacja/opis w programie Olyvia/mikroskop - imago Kosmopolityczny owad drażniący skórę, miejsca ukłucia widoczne przejściowo jako niebieskie plamki; nie uczestniczy w transmisji riketsji. Może umiejscawiać się na rzęsach i być przyczyną blepharitis – zapalenia powiek; może także powodować zapalenie spojówek. Narysuj: gnidy na włosie Zwróć uwagę na: kształt ciała, dorysuj aparat gębowy, odnóża zakończone pazurami/narządy chwytne, i) Pulex irritans – obserwacja/opis w programie Olyvia/mikroskop - imago Owad kosmopolityczny żywiący się krwią człowieka oraz ssaków drapieżnych i sporadycznie gryzoni; w rozwoju którego występuje przeobrażenie zupełne. Jest wektorem dla: riketsji duru wysypkowego szczurzego (Rickettsia mooseri), pałeczki dżumy (Yersinia pestis), pałeczki tularemii (Francisella tularensis) oraz bywa żywicielem pośrednim tasiemców: Dipylidium caninum, Hymenolepis nana, Hymenolepis diminuta. Samce i samice odżywiają się krwią – ukłucia są dokuczliwe i wywołują odczyny alergiczne. Obok pchły ludzkiej na człowieku mogą pasożytować także gatunki zwierzęce: Ctenocephalides canis – pchła psia, C. cati – pchła kocia i Xenopsylla cheopis – pchła szczurza dżumowa. 114 Zaznacz na rysunku: narząd gębowy kłująco-ssący, odnóża (3 pary), czułki, segmentację ciała j) Cimex lectularius – obserwacja/opis w programie Olyvia/mikroskop - imago Owad kosmopolityczny najbardziej rozpowszechniony w krajach o klimacie umiarkowanym i subtropikalnym. Bytuje przeważnie w mieszkaniach i pomieszczeniach gospodarskich; jest nocnym pasożytem czasowym. Krwią człowieka oraz zwierząt żywią się samica, samiec i wszystkie stadia nimfalne. Po ukłuciu pozostawia na skórze czerwone, swędzące plamki o nieregularnym kształcie. Wydzielina gruczołów wonnych może powodować podrażnienia błon śluzowych i napady kaszlu. Nie potwierdzono udziału pluskwy w transmisji chorobotwórczych drobnoustrojów. Zaznacz na rysunku: narząd gębowy kłująco-ssący, odnóża (3 pary), czułki, zredukowane skrzydła, segmentację ciała 2. Żywność jako źródło pasożytów człowieka. a) Toxoplasma gondii – obserwacja/opis w programie Olyvia/mikroskop - trofozoity Pierwotniak kosmopolityczny, pasożytujący we wszystkich komórkach organizmu człowieka z wyjątkiem erytrocytów. Głównym rezerwuarem T. gondii dla człowieka są cysty tkankowe (zawierające bradyzoity) pasożyta w mięśniach i narządach miąższowych zwierząt rzeźnych, a także oocysty wydalane z kałem kotowatych do środowiska. Możliwe jest zarażenie płodu tachyzoitami z organizmu matki (toksoplazmoza wrodzona), poprzez transfuzję krwi i przeszczepy narządów. Człowiek w cyklu rozwojowym jest żywicielem pośrednim stanowiąc jego ślepe ogniwo. 115 Toksoplazmoza nabyta występować może w różnych postaciach klinicznych: węzłowej, ocznej, jako neurotoksoplazmoza, toksoplazmoza kobiet ciężarnych oraz osób z obniżoną odpornością. Obraz kliniczny toksoplazmozy wrodzonej jest zróżnicowany i uzależniony od okresu ciąży, w którym nastąpiło zarażenie płodu. Zaznacz na rysunku: jądro Zwróć uwagę na: kształt komórek Taenia spp.– obserwacja/opis w programie Olyvia/mikroskop; porównanie T. saginata i T. solium Kosmopolityczne tasiemce, pasożyty człowieka, bytujące jako dojrzałe postacie w jelicie cienkim (tenioza), oraz w przypadku Taenia solium – także w tkance podskórnej, mięśniach szkieletowych, mięśniu serca, gałce ocznej, mózgu, płucach, narządach jamy brzusznej. W różnicowaniu diagnostycznym obu gatunków uwzględnia się budowę proglotydów macicznych. Jaja obu gatunków nie wykazują różnic morfologicznych (embriofor z onkosferą). b) Taenia saginata Narysuj/opisz: jajo, Opisz larwę: w mięsie wołowym Zaznacz: charakterystyczne narządy czepne (skoleks) Zaznacz: liczbę odgałęzień pierwotnych macicy (proglotyd maciczny) c) Taenia solium Narysuj/opisz: jajo, Opisz: larwę w mięsie wieprzowym Zaznacz: charakterystyczne narządy czepne (skoleks) Zaznacz: liczbę odgałęzień pierwotnych macicy proglotyd maciczny) 116 d) Trichinella spiralis – obserwacja/opis w programie Olyvia/mikroskop - larwa w mięśniu żywiciela Źródło zarażenia dla człowieka to surowe, niedogotowane mięso (świni, dzika, konia, niedźwiedzia, nutrii). Dojrzałe pasożyty rozwijają się w jelicie cienkim żywiciela z połkniętych larw w ciągu 3 dni; w 5. dobie od zarażenia samice rodzą żywe larwy bezpośrednio do naczyń chłonnych i krwionośnych, które osiedlają się ostatecznie wyłącznie w komórkach mięśni poprzecznie prążkowanych. Dalszy rozwój pasożyta jest możliwy jedynie w przypadku zjedzenia larw zawartych w tkance mięśniowej przez nowego żywiciela. Przebieg trichinellozy zależy od wielu czynników, możliwa jest zarówno postać bezobjawowa, jak również bardzo ciężka kończąca się śmiercią. W fazie ostrej włośnicy obserwuje się: gorączkę, obrzęki wokół oczu i często twarzy, wylewy dospojówkowe, wybroczyny do łożysk podpaznokciowych tzw. drzazgi podpaznokciowe, bóle mięśniowe. Zaznacz na rysunku: torebkę łącznotkankową, narysuj larwy Podpis prowadzącego ……………………………………… Data……………………………… Ilość punktów……………………….. 117 REPOZYTORIUM Tabela 1. Biologia pasożytniczych owadów i pajęczaków gatunek pasożyta rodzaj pasożytnictwa, stadium pasożytnicze aparat gębowy, odżywianie się Pediculus humanus owady Pthirus pubis Pulex irritans Cimex lectularius pajęczaki Demodex spp Sarcoptes scabiei Tabela 2. Charakterystyka pasożytów tasiemce pierwotniaki pasożyt droga zarażenia/ źródła inwazji forma inwazyjna forma diagnostyczna zajmowany narząd materiał pobierany do badań parazytologicznych Toxoplasma gondii: Taenia saginata Taenia solium nicienie Enterobius vermicularis Trichinella spiralis 118 ZADANIA DO SAMOKSZTAŁCENIA 1. Podaj definicję pojęcia: Toksyna botulinowa Enterotoksyna SBI ( soybean inhibitor) Tetrodotoksyna 2. Połącz typ dermatomykozy z najczęstszym czynnikiem etiologicznym: 1 grzybica odzwierzęca (psy, koty) 2 grzybica skóry gładkiej (odmiana międzypalcowa), stopa mokasynowa /stopa atlety 3 grzybica owłosionej skóry brody 1 2 3 A B Trichophyton rubrum Epidermophyton flocossum C Microsporum canis 3. Podaj nazwę gatunkową i stadium rozwojowe pasożytów widocznych na zdjęciach: 4. Drążący skórę pasożyt rozprzestrzeniający się głównie w dużych skupiskach ludzi o niskim poziomie higieny to: A. Pulex irritans; B. Sarcoptes scabiei; C. Ixodes ricinus; D. Pediculus humanus. 5. Typowym dermatofitem antropofilnym jest: A. Epidermophyton floccosum; B. Microsporum canis; C. Microsporum gypseum; D. Trichophyton mentagrophytes var. granulosum. 6. Czynnikiem etiologicznym cysticerkozy jest: C. Giardia intestinalis; D. Taenia solium. A. Diphylobothrium latum; B. Taenia saginata; 7. Surowe/niedogotowane mięso wołowe może być źródłem zarażenia: A. Taenia solium; saginata; C. Echinococcus granulosus; D. Diphyllobothrium latum. 8. Organizm przedstawiony na zdjęciu może być żywicielem następujących pasożytów: B. 1, 3, 4; C. 1, 4, 5; D. 2, 3, 4. B.Taenia A. 1, 2, 5; 119 1. Hymenolepis nana; 2. Toxocara cati; 3. Dipylidium caninum; 4. Hymenolepis diminuta; 5. Diphyllobothrium latum; 6. Taenia solium. LITERATURA 1. Błaszkowska J., Ferenc T., Kurnatowski P. (red.). 2017. Zarys parazytologii medycznej. Edra Urban&Partner, Wrocław. 2. Kurnatowska A., Kurnatowski P. (red.). 2018. Mykologia medyczna. Edra Urban&Partner, Wrocław. 3. Klaassen C.D,Watkins J.B.( 2014). Redakcja wydania I polskiego: Zielińska-Psuja B., Sapota A. Podstawy toksykologii. MedPharma,, Wrocław. 120 Część Biologia molekularna z elementami biotechnologii Ćwiczenie 1 Temat: Mikrobiota człowieka i czynniki wpływające na jej modyfikację Doświadczenia 1. Ocena zróżnicowania mikrobioty człowieka - posiew wymazu z jamy ustnej oraz do wyboru ucha, nosa, skóry na podłoże mikrobiologiczne (agar odżywczy i agar Sabourauda) 2. Oszacowanie żywotności drobnoustrojów probiotyku i/lub produktu fermentowanego przed i po inaktywacji z kwasem solnym 3. Ocena wpływu wybranych produktów spożywczych na żywotność drobnoustojów mlekowych i probiotycznych 4. Ocena obecności składników stabilizujących w produktach mleczarskich wytwarzanych przemysłowo/komercyjnych (określanych jako „naturalne”), w produktach probiotycznych i fermentowanych Zakres materiału do przygotowania przed zajęciami Biotechnologia – podstawowe pojęcia i definicje; podział biotechnologii. Probiotyki, prebiotyki, synbiotyki – definicja, funkcja, skład, udział w regulacji homeostazy organizmu, działanie prozdrowotne. Żywność funkcjonalna – definicja, rodzaje, przykłady, działanie prozdrowotne. Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Mikrobiom człowieka – definicja, kształtowanie, funkcje; metabolom, mikrobiota, metagenom; interakcje między mikrobiotą a organizmem człowieka. Wpływ mikrobioty na zachowanie homeostazy. Zaburzenia w funkcjonowaniu mikrobiomu – dysbioza (przyczyny i skutki dla organizmu człowieka). Mikrobiom jelita – funkcjonowanie, rola, interakcje z organizmem gospodarza, udział w utrzymaniu homeostazy. Udział mikrobiomu w patogenezie wybranych chorób. Oś jelitowo-mózgowa – zasada funkcjonowania, regulacja stanu zdrowia i choroby. Udział mikrobiomu w patogenezie wybranych chorób metabolicznych (otyłości, cukrzycy), immunologicznych (reumatoidalne zapalenie stawów), neurologiczno-psychiatrycznych (autyzm, schizofrenia, depresja). Udział mikrobioty w procesach uczenia się. 121 CZĘŚĆ TEORETYCZNA Mikrobiota człowieka Prawidłowe funkcjonowanie organizmu człowieka jest uzależnione nie tylko od materiału genetycznego i homeostazy procesów fizjologicznych, ale także od równowagi pomiędzy organizmem a zasiedlającymi go mikroorganizmami. Wszystkie mikroorganizmy zasiedlające organizm człowieka określane są jako mikrobiota i mogą do nich należeć: bakterie (najliczniejsza grupa: 10-100 miliardów komórek), Archeobacteria, wirusy – w tym bakteriofagi i wirusy olbrzymie oraz grzyby, które stanowią 0,1% i pełnią istotną rolę w utrzymaniu równowagi mikrobiologicznej. Z tego powodu organizm człowieka traktuje się jako swoisty ekosystem zamieszkały przez liczne drobnoustroje. Wszystkie mikroorganizmy razem z ich materiałem genetycznym i produktami metabolizmu określane są jako mikrobiota. W pewnych ujęciach przyjmuje się rozróżnienie pojęć mikrobiota i mikrobiom, ten pierwszy termin stosując do zespołu organizmów, a drugi do zespołu ich genomów. Genomy wszystkich mikroorganizmów (złożone z genoforu i plazmidów) w organizmie człowieka składają się z ~3,3 mln genów, przy czym aż w 80-90% różnią się u poszczególnych osób, natomiast genom człowieka zawiera tylko ~22000 genów (w 99,9% identyczny u wszystkich ludzi). Zespół genów mikroorganizmów wraz z materiałem genetycznym człowieka określany jest terminem metagenom. Dynamika mikrobioty W rozwoju osobniczym człowieka następują dynamiczne zmiany struktury mikrobioty. Organizm noworodka jest zasiedlany już w trakcie porodu, przy czym w pierwszych 20 minutach życia skład mikrobioty skóry przypomina skład gatunkowy mikrobioty dróg rodnych matki (poród naturalny) lub skóry matki (cesarskie cięcie), następnie na jego skórze osiedlają się paciorkowce (Streptococcus salivarius, S. mitis, S. oralis), a w przewodzie pokarmowym względne beztlenowce (Esherichia coli, Enterococcus feacalis). Proces ten jest uzależniony od czynników genetycznych, rodzaju porodu, wieku ciążowego, warunków środowiskowych, stosowanej diety. Dojrzały mikrobiom (szczególnie mikrobiom jelita) kształtuje się około 2 roku życia dziecka, w tym okresie przypomina składem mikrobiotę osób dorosłych. Do niedawna uważano, że łożysko jest narządem sterylnym i że kolonizacja organizmu noworodka następuje dopiero w trakcie porodu. W badaniach z wykorzystaniem NGS wykazano obecność bakterii w płynie owodniowym, a także w warstwie podstawowej łożyska. Stwierdzono również obecność bakterii w smółce (łac. meconium) - głównie z rodziny Enterobacteriaceae (Escherichia spp. czy Enterobacter spp.), oraz bakterii produkujących kwas mlekowy Lactobacillus spp., Leuconostoc spp., Enterococcus spp., i Lactococcus spp. Na każdym etapie życia osobniczego na strukturę i liczebność mikrobioty wpływają czynniki środowiskowe takie jak: styl życia czy dieta: żywienie w okresie niemowlęcym, składniki pokarmowe u dzieci, niedożywienie itp., stosowanie antybiotyków w leczeniu chorób infekcyjnych lub stan fizjologiczny organizmu. W populacji osób dorosłych w skład mikrobioty wchodzą mikroorganizmy należące do bardzo wielu gatunków, których liczebność jest względnie stała. Największa liczbę jednostek taksonomicznych (najliczniejsza ontocenoza) stwierdzono w przewodzie pokarmowym człowieka, choć poszczególne jego odcinki różnią się składem ilościowym i jakościowym mikroorganizmów. Najbardziej liczebną w taksony ontocenozę stanowi jelito grube (1011-1012 CFU/g treści jelitowej). Rola mikrobioty w funkcjonowaniu organizmu człowiek Mikrobiota reaguje na sygnały chemiczne i fizyczne pochodzące od makroorganizmu, takie jak dostępność substratów pokarmowych czy pH produktów metabolizmu gospodarza. Z drugiej strony mikroorganizmy mogą regulować ekspresję genów gospodarza, decydując o licznych procesach 122 fizjologicznych organizmu. Naturalna mikrobiota odgrywa więc znaczącą rolę w funkcjonowaniu organizmu człowieka. Tworzy konkurencję dla patogenów oraz działa przeciwdrobnoustrojowo przez produkcję bakteriocyn i nadtlenku wodoru. Odpowiada za stymulację układu immunologicznego poprzez produkcję inwazyn i impedyn oraz pobudza produkcję interleukin: m.in. IL-17, IL-22 i IL -23 przez leukocyty, a także reguluje dojrzewanie limfocytów typu Th. Mikrobiota jelitowa stymuluje proliferację komórek nabłonka jelita. Bierze udział w trawieniu/rozkładzie węglowodanów (np. laktozy, błonnika-celulozy), białek (np. kazein), kwasów tłuszczowych (np. cholesterol), bierze udział w syntezie witamin (np. grupa B, K), wspomaga absorpcję soli mineralnych. Mikrobiom jelita reguluje ruchy perystaltyczne jelita. Ze względu na fakt, ze prawidłowy mikrobiom jest elementem bariery jelitowej, wspiera procesy trawienne, reguluje pH wewnętrznego środowiska makroorganizmu, reguluje funkcje immunologiczne oraz produkuje związki odżywiające komórki nabłonkowe jelit (np. maślan).Pomaga także regulować przepuszczalność nabłonka jelit. Mikrobiom przewodu pokarmowego uczestniczy w usuwaniu toksyn i substancji potencjalnie kancerogennych zawartych w żywności. Drobnoustroje jelitowe wykazują różną zdolność wiązania i/lub rozkładu związków kancerogennych, mutagennych i genotoksycznych. Dla przykładu, bakterie kwasu mlekowego mają zdolność wiązania kancerogenów oraz indukują enzymy biorące udział w ich metabolizmie ( np. Lactobacillus spp. rozkłada nitrozaminy – związki mutagenne zawarte z peklowanym mięsie i wędzonych rybach). Jednak z drugiej strony w wyniku przemian metabolicznych, indukowanych przez mikrobiotę jelitową mogą powstać substancje toksyczne czy rakotwórcze. Niektóre gatunki E.coli, Clostridium perfringens, Bacterioides fragilis czy Enterococcus faecalis za pośrednictwem enzymów fekalnych β-glukuronidazy i β-glukozydazy rozkładają glikozydy do aglikonów. Enterococcus faecalis produkuje nadtlenki uszkadzajace DNA. Dowiedziono, że E. faecalis może powodować także zatrzymanie cyklu komórkowego oraz nieprawidłową segregację chromosomów w komórkach nabłonka jelita grubego. Z kolei Bacteroides fragilis została powiązana z występowaniem raka jelita grubego, poprzez jej zdolność do wytwarzanie toksycznej, ciepłowrażliwej metaloproteinazy cynkowej (toksyna BFT) - co ma związek z zaburzeniem cyklu komórkowego i aktywacją onkogenów. Karcynogeny powstające lub przekształcane w jelicie grubym przez mikroorganizmy jelitowe to głównie fenole, krezole, indole, skatole, aglikony flawonoidowe, barwniki azowe.Mikroorganizmy jelitowe mogą enzymatyczne aktywować związki prokarcynogenne – tj. związki rakotwórcze wymagające wstępnej aktywacji metabolicznej, które dostają się do organizmu wraz z dietą. Mogą także metabolizować substancje endogenne do karcynogenów lub promotorów (związków o aktywności promującej powstawanie nowotworu). Wyniki wielu badań wskazują, że nadmierne stosowanie antybiotyków we wczesnym okresie życia, a tym samym nieprawidłowy rozwój mikrobioty, może w życiu dorosłum mieć wpływ m.in. na wystąpienie chorób przewlekłych. Dodatkowo wykazano, że zaburzenia w składzie i funkcji drobnoustrojów - czyli stan dysbiozy - można powiązać z rozwojem wielu schorzeń u człowieka (np. z niswoistym zapaleniem jelit, zespołem jelita drażliwego, rakiem jelita grubego, chorobami alergicznymi, cukrzycą, otyłością czy nawet autyzmem), choć zaburzenia jakościowe i ilościowe mikrobioty stanowią jeden z wielu czynników etiologicznych tych chorób. We wszystkich przypadkach dysbiozy, nie udokumentowano jej związku przyczynowo-skutkowego z ich rozwojem. Skład mikrobioty W poszczególnych częściach organizmu człowieka stwierdzono różną liczbę i skład gatunkowy mikroorganizmów stanowiących naturalną mikrobiotę. Na powierzchni skóry i błony śluzowej (jamy ustnej, dróg moczowo-płciowych, przewodu pokarmowego itp.) tworzą one zwartą strukturę - biofilm. Jednym z naturalnie występujących biofilmów w organizmie człowieka jest płytka nazębna. Do dobrze poznanych ontocenoz w organizmie człowieka należy mikrobiota skóry. Jest ona zróżnicowana w zależności od części ciała: miejsca o wyższej temperaturze i większej wilgotności (np. pachwiny, pachy) zasiedlają pałeczki Gram- i Staphylococcus aureus, rejony obfite w gruczoły łojowe 123 (np. skóra twarzy, pleców, klatki piersiowej) zasiedlają bakterie Propionibacterium spp., Staphylococcus spp. oraz grzyby z rodzaju Malassezia, natomiast rejony suche (np. przedramię) obfitują w βProteobacteria i Flavobacteriales. Wśród gatunków komensalnych można wyróżnić mikrobiotę autochtoniczną, czyli prezentowaną głównie przez Staphylococcus epidermidis i inne gronkowce koagulazo-ujemne, Acinobacteria (Corynebacterium, Brevibacterium, Propionibacterium, Micrococcus) oraz mikrobiotę allochtoniczną (przejściową), do której należą m. in. potencjalnie chorobotwórcze Staphylococcus aureus, Streptococcus pyogenes i Pseudomonas aeruginosa. Negatywy wpływ na stan mikrobioty mogą mieć: czynniki endogenne: - zaburzenia funkcjonowania pęcherzyka żółciowego, - niedobór kwasu żołądkowego, dieta : - bogata w cukier i tłuszcze, - bogata w wysoko przetworzone produkty, zawierające konserwanty i toksyny przemysłowe, - uboga w błonnik, leki: - antybiotyki, - środki przeczyszczające, - leki antykoncepcyjne, infekcje grzybicze i bakteryjne jelit, wysoki poziom stresu. Modyfikacje mikrobioty Obecnie coraz częściej w leczeniu chorób człowieka wykorzystuje się różne metody modyfikacji mikrobioty, m. in. przeszczepianie mikrobioty jelitowej (ang. fecal microbiota transplantation, FMT) (tabela 1). Procedura FMT polega na przeniesieniu kału zdrowego dawcy do przewodu pokarmowego biorcy, głównie w formie przyjmowanych doustnie zamrożonych kapsułek, choć treść kałowa może być również podawana do dwunastnicy przy wykorzystaniu endoskopu. Tabela 1. Przykłady skuteczności zastosowania przeszczepiania mikrobioty jelitowej (FMT) u osób z dysbiozą jelitową (wg. Skonieczna-Żydecka et al. 2017). Kliniczne zastosowanie przeszczepiania mikrobioty jelitowej Skuteczność potwierdzona w randomizowanych Skuteczność potwierdzona przy zdiagnozowaniu ( badaniach klinicznych opisy przypadków w literaturze) Zakażenia Clostridioides difficile* Choroba Parkinsona Choroba Leśniowskiego-Crohna Dystonia miokloniczna Wrzodziejące zapalenie jelita grubego^ Fibromialgia Cukrzyca typu 1 Małopłytkowość samoistna u pacjenta z wrzodziejącym Insulinooporność/cukrzyca typu 2 zapaleniem jelita Stwardnienie rozsiane (SM) Zaburzenia ze spektrum autyzmu Czynnościowe zaburzenia jelit Zespół jelita nadwrażliwego (IBS) Zespół metaboliczny Zespół przewlekłego zmęczenia *rekomendacja kliniczna (ESCMID = European Society of Clinical Microbiology and Infectious Diseases ) w przypadku zakażenia opornego na standardowe leczenie ^ skuteczność potwierdzona w randomizowanych badaniach klinicznych, rekomendacja w toku 124 W ostatnich latach na całym świecie prowadzone są liczne badania nad metodami diagnostyki w kierunku dysbiozy w przewodzie pokarmowym m. in. u pacjentów z cukrzycą, chorobą Leśniowskiego-Crohna i innymi chorobami związanymi ze stanem zapalnym błony śluzowej jelita. Możliwe jest określenie składu gatunkowego mikrobioty w badaniach kału prowadzonych z zastosowaniem zaawansowanych metod molekularnych, np. wykrywanie 16S rRNA metodą qPCR (metoda omówiona w rozdziale Diagnostyka mykologiczna i parazytologiczna) czy analiza składu mikrobioty metodą NGS. Eksperymentalnie prowadzone są także badania nad zaburzeniem składu jakościowego mikrobioty jelitowej w oparciu o wykrywanie materiału genetycznego i metabolitów drobnoustrojów (np. kwas masłowy, kwas mlekowy), które mogą przenikać do krwi w przypadku zwiększenia przepuszczalności ściany jelita w wyniku dysbiozy. Probiotyki Innym sposobem modyfikacji własnej mikrobioty przewodu pokarmowego jest stosowanie probiotyków, czyli żywych mikroorganizmów, które wywierają korzystny efekt na zdrowie poprzez ilościowy i jakościowy wpływ na mikrobiotę jelitową i/lub modyfikację układu immunologicznego (WHO 2004). Do najczęściej stosowanych probiotyków zaliczane są bakterie z rodzaju: Lactobacillus i Bifidobacterium oraz Saccharomyces boulardii. Większość gatunków probiotycznych jest także wykorzystywana w technologii żywności. Liczebność drobnoustrojów probiotycznych wskazywana przez wielu producentów probiotyków to wskaźnik istotny, choć niewiele mówiący o biofunkcjonalności danego produktu. Istotnym jest aby żywe, aktywne wyselekcjonowane szczepy drobnoustrojów wytwarzały metabolity i aktywne związki o udowodnionych właściwościach prozdrowotnych. Do prozdrowotnych efektów działania probiotyków na organizm człowieka należy: korzystna modyfikacja mikrobioty jelita, poprawa trawienia laktozy (zmniejszanie objawów nietolerancji laktozy), zmniejszanie ryzyka otyłości, obniżenie stężenia cholesterolu we krwi, aktywacja odpowiedzi immunologicznej (swoistej i nieswoitsej), zapobieganie zaparciom, skrócenie czasu trwania biegunek rotawirusowych i o innej etiologii, wzrost przyswajalności składników pokarmowych i absorpcji składników mineralnych, obniżanie aktywności enzymów fekalnych, ochrona przed nowotworami jelita grubego, detoksykacja karcynogenów, hamowanie wzrostu i translokacji patogenów, redukcja ryzyka infekcji jelitowych, hamowanie nawracających infekcji grzybiczych. Do immunomodulacyjnego działania probiotyków można zaliczyć: podwyższanie stężenia cytokin:np. IFNγ, TNFα oraz IL-6 zwiększenie liczby i funkcji limfocytów T regulatorowych oraz stężenia cytokin: IL-10 i TGFβ, wzrost ilości czynników przeciwzapalnych i krótkołańcuchowych kwasów tłuszczowych (ang. short-chain fatty acids, SCFA); zmniejszanie nacieków zapalnych, aktywację komórek fagocytujących patogeny i produkcję bakteriocyn, obniżenie adhezji patogenów do błony śluzowej i nabłonka, obniżanie stężenia cytokin: IL-4, IL-5, IL-1, 125 wzmocnienie bariery nabłonkowej i wzrost poziomu ekspresji białek, zmniejszenie translokacji bakteryjnej, wzrost poziomu wydzielniczych IgA, wzrost stężenia IgG, obniżenie stężenia IgE. Udowodniono prozdrowotne działanie pałeczek kwasu mlekowego, polegające na: hamowaniu rozwoju i namnażania się bakterii chorobotwórczych, ułatwianiu trawienia i wchłaniania substancji odżywczych (m. in. witamin i soli mineralnych), przyspieszaniu pasażu jelitowego (zapobieganie wzdęciom i zaparciom), udziału w trawieniu mleka i jego przetworów (m. in. kazeiny i laktozy), immunostymulacji (pobudzanie układu immunologicznego), immunomodulacji (stymulacja układu immunologicznego, mająca na celu regulację odpowiedzi immunologicznej), syntezie witamin, utrzymaniu odpowiedniego pH w świetle przewodu pokarmowego. Modyfikację mikrobioty za pomocą stosowania probiotyków coraz częściej uznaje się w postępowaniu terapeutycznym w chorobach czynnościowych, szczególnie w zespole jelita nadwrażliwego (IBS). Potwierdzono też skuteczność probiotykoterapii w leczeniu zakażenia Helicobacter pylori, czy w przypadku biegunki wywołanej zakażeniem Clostridium difficile, podkreślając poprawę tolerancji stosowanej antybiotykoterapii. Wykazano, że obserwowana poprawa tolerancji leczenia ma związek z obniżaniem ryzyka działań niepożądanych antybiotykoterapii. Zaleca się jednak, by konkretne szczepy probiotyczne wybierać tylko na podstawie wykazanej skuteczności klinicznej. Najlepiej udokumentowane działanie wykazano dla Saccharomyces boulardii, gatunku z grupy drożdżaków, które posiadają właściwości przywracające prawidłowy skład mikrobioty jelitowej. Prebiotyki Możliwe jest podawanie samodzielnie lub razem ze szczepami probiotycznymi składników pokarmowych, które modulują zespół mikroorganizmów jelitowych i tym samym korzystnie wpływają na zdrowie gospodarza. Takie składniki określa się jako prebiotyki; należą do nich między innymi: inulina, celuloza, oligofruktoza. Preparaty zawierające jednocześnie mikroorganizmy probiotyczne i prebiotyk są określane jako synbiotyki. Udowodniono, że stosowanie synbiotyków zwiększa aktywność bakterii probiotycznych i skuteczniej reguluje skład naturalnej mikrobioty jelita. Składnik prebiotyczny pozytywnie reguluje aktywność mikrobioty jelitowej i podanego szczepu probiotycznego, jednocześnie szczep probiotyczny stymuluje mikroorganizmy komensalne (rycina 1). Rycina 1. Interakcje między probiotykami/prebiotykami a składem i aktywnością mikrobioty jelitowej. 126 Zastosowanie szczepów probiotycznych jako formy profilaktyki jest najczęściej stosowane w trakcie i po terapii antybiotykami przeciwbakteryjnymi. Jednak jak wskazują liczne doniesienia probiotyki, prebiotyki i synbiotyki mają znacznie więcej zastosowań praktycznych. Trwają również liczne badania nad poszukiwaniem nowych substancji, które mogłyby zostać wykorzystane jako prebiotyki. Powinny one spełniać określone kryteria: nie ulegać trawieniu przez endogenne enzymy gospodarza, stanowić selektywny substrat dla jednej lub ograniczonej liczby komensalnych szczepów bakterii bytujących w okrężnicy, a produkty ich rozkładu przez bakterie jelitowe powinny obniżać pH treści pokarmowej. Prebiotyki powinny jednocześnie stymulować wzrost i aktywność korzystnej dla zdrowia mikrobioty przewodu pokarmowego oraz wywoływać korzystne dla gospodarza skutki miejscowe w świetle przewodu pokarmowego lub efekty układowe. Podstawową cechą prebiotyków musi być znana i udokumentowana budowa chemiczna oraz łatwość uzyskania ich na skalę przemysłową. Najbardziej znaną substancją prebiotyczną jest inulina – polisacharyd, węglowodan z grupy fruktanów, zbudowany z reszt fruktozowych połączonych wiązaniami β-(2,1)-glikozydowymi. W dużych ilościach inulina może występować w świeżej masie roślinnej, co przekłada się na jej łatwe pozyskiwanie oraz wprowadzenie do diety człowieka: bulwa topinamburu – 14-20%, korzeń cykorii – 15-20%, łodyga agawy – 15-20%, główka czosnku – 9-16%, liście mniszka lekarskiego – 12-15%, por – 3-10%, pędy kwiatowe karczocha – 3-10%, cebula – 2-6%, korzeń łopianu – 3,5-4%, ziarno jęczmienia – 0,5-1,5%, ryż – 0,5-1%, banan – 0,3-0,7%. Żywność funkcjonalna Probiotyki i prebiotyki zaliczane są do tzw. żywności funkcjonalnej. Może ona być zdefiniowana jako żywność o naukowo udowodnionym wpływie na stan fizjologiczny organizmu i udowodnionych korzyściach zdrowotnych (efekt żywieniowy). Żywność taka, podobna do konwencjonalnej, posiada składniki powodujące poprawę jednej lub więcej funkcji organizmu człowieka, wpływa korzystnie na stan zdrowia i samopoczucie i/lub ma zdolność ograniczania ryzyka rozwoju chorób przewlekłych. Można wyróżnić kilka typów żywności funkcjonalnej: ze względu na sposób oddziaływania fizjologicznego w organizmie: - żywność zmniejszającą ryzyko chorób krążenia, chorób nowotworowych czy osteoporozy, - żywność regulującą właściwe funkcjonowanie przewodu pokarmowego, - żywność przeznaczoną dla osób obciążonych stresem; ze względu na przeznaczenie: - dla sportowców, - kobiet w ciąży, - niemowląt, - młodzieży w okresie dojrzewania, - osób w starszym wieku; ze względu na typy produktów: 127 - żywność naturalną – bogatą w określony składnik odżywczy, - żywność wzbogaconą, w której składniki prozdrowotne zostały dodane, - żywność wolną od czynników antyżywieniowych. Możliwe jest zastosowanie żywności funkcjonalnej, o aktywności obniżającej poziom lipidów, w zapobieganiu i leczeniu chorób układu krążenia. Taka żywność powinna obniżać poziom cholesterolu, wzmacniać układ odpornościowy i przywracać właściwe działanie układu pokarmowego. Produkcja żywności funkcjonalnej polega na wzbogacaniu środków spożywczych w substancje bioaktywne lub/oraz eliminacji związków niepożądanych, lub na stosowaniu ich zamienników, np. tłuszczu. Do najczęściej spotykanych tego typu produktów należą fermentowane produkty mleczne lub zawierające dodatek bakterii probiotycznych, tłuszcze do smarowania pieczywa zawierające estry fitosteroli i fitostanoli, napoje wzbogacone o zawartość witamin A, C i E lub wapń i magnez, wołowina wzbogacona w skoniugowany kwas linolowy (CLA), jaja wzbogacone w wielonienasycone kwasy tłuszczowe z rodziny n-3. Przykładem żywności funkcjonalnej może być produkt wzbogacony w wapń i hamujący rozwój osteoporozy lub produkt zawierający zwiększoną ilość błonnika, co może przeciwdziałać rozwojowi nowotworu jelita grubego (tabela 2). Tabela 2. Główne grupy składników żywności funkcjonalnej (opracowanie własne). Składniki żywności funkcjonalnej Probiotyki Przykłady Bakterie kwasu mlekowego, Bifidobacterium spp. Prebiotyki Oligosacharydy (frukto-, galakto-, ksylo-) skrobia i pektyny Witaminy Kwas foliowy, B6, B12, D, K Minerały Wapń, magnez, cynk Przeciwutleniacze Tokoferole (np. witamina E), witamina C, karotenoidy, flawonoidy, polifenole zielonej herbaty Tripeptydy pochodzące z białek mleka (kazeiny, β-laktoglobuliny i α-lakto-albuminy) Omega-3 kwasy tłuszczowe, GLA, CLA Proteiny, peptydy i aminokwasy Kwasy tłuszczowe Fitozwiązki Fitosterole, β-glukan, izoflawonoidy, ligniny Korzyści zdrowotne Regulują mikrobiotę jelitową, zmniejszają objawy biegunki/ zaparć, wzmacniają układ immunologiczny, obniżają poziom cholesterolu, zmniejszają ryzyko rozwoju choroby jelita grubego i nowotwory Korzyści zdrowotne podobne jak probiotyków, ale również podwyższają absorpcję wapnia i magnezu (zmniejszają osteoporozę) Zmniejszają ryzyko chorób układu sercowonaczyniowego oraz osteoporozy Obniżają ryzyko osteoporozy, wzmacniają układ immunologiczny Zmniejszają ryzyko miażdżycy i rozwoju nowotworów, obniżają tlenowe uszkodzenia DNA i opóźniają procesy starzenia, wykazują działanie przeciwzapalne Obniżają ciśnienie krwi i mogą wpływać na funkcje fizjologiczne i psychiczne Obniżają ryzyko chorób sercowo-naczyniowych i nowotworowych, łagodzą symptomy zapalenia stawów oraz problemy klimakteryczne Obniżają poziom cholesterolu oraz regulują gospodarkę hormonalną podczas menopauzy 128 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA 1. Ocena zróżnicowania mikrobioty człowieka - posiew wymazu z jamy ustnej oraz do wyboru ucha, nosa, skóry na podłoże mikrobiologiczne (agar odżywczy i agar Sabourauda) WYKONANIE: Materiały i odczynniki: - sterylna wymazówka, - podłoże mikrobiologiczne na szalce Petriego (agar odżywczy lub agar Sabourauda), Sprzęt i aparatura: - cieplarka. Protokół doświadczenia: 1. Sterylnymi wymazówkami pobrać wymaz z powierzchni błony śluzowej jamy ustnej oraz do wyboru ucha, nosa, skóry 2. Nanieść pobrany materiał biologiczny na powierzchnię jałowego podłoża mikrobiologicznego. 3. Płytki inkubować w temperaturze 37°C przez 24-48h. 4. Makroskopowo ocenić liczbę i cechy morfologiczne uzyskanych kolonii (opisać: kształt, barwę, połysk, odbarwienie/zabarwienie podłoża). Wyniki: odczytujemy na ćwiczeniach numer 7 2. Oszacowanie żywotności drobnoustrojów probiotyku i/lub produktu fermentowanego przed i po inaktywacji z kwasem solnym WYKONANIE: Materiały i odczynniki: - preparat probiotyczny lub produkt fermentowany (jogurt, kefir, kiszonka, mleko itp.), - 1% kwas solny, - sól fizjologiczna, - barwnik - błękit metylenowy. Sprzęt i aparatura: - probówki, - pipety pasterowskie, - ezy (jednorazowe), - szkiełka podstawowe i nakrywkowe, - mikroskop. 129 Protokół doświadczenia: 1. Przygotować zawiesinę preparatu probiotycznego w soli fizjologicznej (1 kapsułka w 5 ml soli fizjologicznej. Produkt fermentowany nie wymaga rozcieńczenia). 2. Do dwóch opisanych (kontrola, eksperyment) probówek dodać po 1 ml badanego produktu. 3. Z probówki kontrolnej pobrać ezą produkt i nanieść do kropli soli fizjologicznej na szkiełku podstawowym. Dodać kroplę błękitu metylenowego. Preparat zamknąć szkiełkiem nakrywkowym. Pod mikroskopem, pow. 100 i 400x. oszacować liczebność i żywotność komórek bakteryjnych (komórki żywe – niewybarwione, komórki martwe – zabarwione na intensywny niebieski kolor). 4. Do probówki eksperymentalnej dodać 1 ml 1% kwasu solnego (uzyskujemy stężenie 0,5% - takie jak w treści żołądkowej). Inkubować co najmniej 10 min. 5. Z probówki eksperymentalnej wykonać ezą preparat bezpośredni barwiony błękitem metylenowym. Obserwować pod mikroskopem, pow. 100 i 400x. 6. Ocenić stosunek liczby komórek żywych (niewybarwionych) do martwych (wybarwionych) w warunkach kontrolnych i po inaktywacji z kwasem solnym. Wyniki: Wnioski: Wnioski: 3. Ocena wpływu wybranych produktów spożywczych na żywotność drobnoustojów mlekowych i probiotycznych WYKONANIE: Materiały i odczynniki: - preparat probiotyczny lub produkt fermentowany (jogurt, kefir, kiszonki, mleko itp.), - badany produkt – sok owocowy, kawa, mleko itp., - sól fizjologiczna, - błękit metylenowy, 130 Sprzęt i aparatura: - probówki, - pipety pasterowskie, - ezy (jednorazowe), - szkiełka podstawowe i nakrywkowe, - mikroskop. Protokół doświadczenia: 1. Przygotować zawiesinę preparatu probiotycznego w soli fizjologicznej (1 kapsułka w 5 ml). Produkt fermentowany nie wymaga rozcieńczenia. 2. Do probówki dodać po 1 ml badanego produktu fermentowanego i 1ml soku (lub inny badany płyn). Inkubować min. 10 min. 3. Z probówki pobrać ezą produkt i nanieść do kropli soli fizjologicznej umieszczonej na szkiełku podstawowym. Barwić błękitem metylenowym. Preparat zamknąć szkiełkiem nakrywkowym. 4. Obserwować pod mikroskopem, pow. 100 i 400x. Ocenić stosunek liczby komórek żywych (niewybarwionych) do martwych (wybarwionych). Wyniki: Wnioski: 4. Ocena obecności składników stabilizujących w produktach „naturalnych” w produktach probiotycznych i fermentowanych – wykonanie 131 4. Ocena obecności składników stabilizujących w produktach mleczarskich wytwarzanych przemysłowo/komercyjnych (określanych jako „naturalne”), w produktach probiotycznych i fermentowanych WYKONANIE: Materiały i odczynniki: - preparat probiotyczny lub produkt fermentowany (wytwarzany przemysłowo/komercyjnie: (jogurt, kefir, mleko zsiadłe itp.), - płyn Lugola. Sprzęt i aparatura: - ezy (jednorazowe), - szkiełka podstawowe i nakrywkowe, - mikroskop, Protokół doświadczenia: 1. Przygotować zawiesinę preparatu probiotycznego w soli fizjologicznej (1 kapsułka w 5 ml). Produkt fermentowany nie wymaga rozcieńczenia. 2. Z probówki pobrać ezą produkt i nanieść do kropli soli fizjologicznej na szkiełku podstawowym. Barwić płynem Lugola. Preparat zamknąć szkiełkiem nakrywkowym. 3. Obserwować pod mikroskopem, pow. 100 i 400x. Ocenić obecność ziaren skrobi. Wyniki: Wnioski: Wnioski: Podpis prowadzącego ……………………………………… Data……………………………………… 132 ZADANIA DO SAMOKSZTAŁCENIA 1. Wymień czynniki wpływające na „zmienny zespół mikrobioty jelitowej”: 2. Do prebiotyków zaliczamy: A. Bifidobacterium sp.; B. Lactobacilllus sp.; C. oligofruktozę; D. jogurty 3. Podaj definicje terminów: Oś mózgowo-jelitowa Metabolom Dysbioza 4. Do czynników negatywnie wpływających na mikrobiotę jelita można zaliczyć: A. tylko 1; B. 2, 4, 5; C. 1, 2, 3, 5; D. wszystkie wymienione. 1. stosowanie antybiotyków; 2. stosowanie środków przeczyszczających; 3. wysoki poziom stresu; 4. stosowanie synbiotyków; 5. spożywanie produktów zawierających konserwanty 5. Wymień przykłady żywności funkcjonalnej i jej zastosowania: 133 LITERATURA 1. Binek M. 2012. Mikrobiom człowieka - Zdrowie i choroba. Postępy Mikrobiologii. 51 (1): 27–36. 2. Błaszkowska J., Góralska K. 2020. Dieta, mikrobiom a zdrowie. W: Brzeziańska-Lasota E. (red.) Biomedycyna – wybrane aspekty. Continuo, Wrocław. 77-119. 3. Fiedurek J. 2014. Mikrobiom a zdrowie człowieka. Wydawnictwo UMCS. Lublin. 4. Góralska K., Dzikowiec M. 2018. Role of microbiota in maintaining the homeostasis in the human body. Postępy Mikrobiologii. 57 (1): 5–11. DOI 10.21307/PM-2018.57.1.005. 5. Skonieczna-Żydecka K., Łoniewski I., Marlicz W., Karakiewicz B. 2017. Mikrobiota jelitowa jako potencjalna przyczyna zaburzeń funkcjonowania emocjonalnego człowieka. Medycyna Doświadczalna i Mikrobiologia. 69: 163 - 176 6. Stinson LF, Boyce MC, Payne MS, Keelan JA. 2019. The Not-so-Sterile Womb: Evidence That the Human Fetus Is Exposed to Bacteria Prior to Birth. Frontiers in Microbiology. 10: 1124. DOI 10.3389/fmicb.2019.01124. 7. Wołkowicz T., Januszkiewicz A., Szych J. 2014. Mikrobiom przewodu pokarmowego i jego dysbiozy jako istotny czynnik wpływający na kondycję zdrowotną organizmu człowieka. Medycyna Doświadczalna i Mikrobiologia. 66: 223 – 235. 8. Zhang C., Wohlhueter R., Zhang H. 2016. Genetically modified foods: a critical review of their promise and problems. Food Science and Human Wellness. 5: 116-123. DOI 10.1016/j.fshw.2016.04.002. 134 Ćwiczenie 2 Temat: Diagnostyka parazytologiczna i mykologiczna dawniej i dziś. Doświadczenie 1. Wykrywanie obecności drobnoustrojów metodami molekularnymi – przeprowadzenie reakcji łańcuchowej polimerazy PCR. Obserwacja 1. Ocena posiewów z wybranych ontocenoz wykonanych na poprzednich zajęciach 2. Porównanie form morfologicznych istotnych w diagnostyce grzybic: komórki wegetatywne, strzępki, typy zarodnikowania, struktury tworzące zarodniki – schematy i preparaty bezpośrednie z kolonii drobnoustrojów z posiewów wykonanych na poprzednich zajęciach. Zakres materiału do przygotowania przed zajęciami Wykorzystanie metod amplifikacji genów w metodach molekularnych. Przebieg reakcji łańcuchowej polimerazy (PCR) oraz jej składniki. Rodzaje materiałów biologicznych pobieranych do badań mykologicznych i parazytologicznych, zasady pobierania, przechowywania i transportu materiału biologicznego Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Podstawowe pojęcia diagnostyki metodami klasycznymi (rodzaje i zastosowanie preparatów mikroskopowych w mykologii i parazytologii, metody hodowlane w mykologii i parazytologii; metody biochemiczne w mykologii). Wykrywanie obecności i identyfikacja grzybów i pasożytów: Metody klasyczne: rodzaje i zastosowanie preparatów mikroskopowych w mykologii i parazytologii metody hodowlane w mykologii i parazytologii etody biochemiczne w mykologii Metody serologiczne i molekularne: serologiczne (test aglutynacji lateksowej; reakcja precypitacji w żelu; testy immunofluorescencji; Western Blot; ELISA) molekularne oparte na wstępnej multiplikacji/amplifikacji DNA w reakcji PCR lub jej odmianach (gniazdowy PCR) molekularne stosowane do wykrywania mutacji zdefiniowanych (Real-time PCR) Wskazania do zastosowania metod serologicznych i molekularnych. Możliwości diagnostyki mykologicznej i parazytologicznej (przykłady zastosowania omawianych metod). 135 CZĘŚĆ TEORETYCZNA Pobranie materiału biologicznego: rodzaje materiałów biologicznych pobieranych do badań mykologicznych i parazytologicznych, zasady pobierania, przechowywania i transportu materiału biologicznego. Algorytm diagnostyczny Metody stosowane w diagnostyce zakażeń grzybiczych i zarażeń pasożytniczych można podzielić na klasyczne (techniki oparte na diagnostyce mikroskopowej, metody hodowlane) oraz serologiczne i molekularne. W rutynowej diagnostyce powinny być brane pod uwagę wyniki pochodzące jednocześnie z kilku metod (rycina 1). Pierwszym, wstępnym etapem do identyfikacji drobnoustroju jest prawidłowe pobranie materiału biologicznego od pacjenta. Rycina 1. Schemat algorytmu diagnostycznego w mykologii medycznej (opracowanie własne). Pobranie materiału biologicznego Pobranie materiału powinno być wykonane aseptycznie (jałowo). Wszystkie pobrane materiały diagnostyczne muszą być jak najszybciej dostarczone do laboratorium mikrobiologicznego ponadto należy zapewnić właściwe warunki przechowywania i transportu materiału diagnostycznego (właściwa temperatura, podłoża transportowe). Rodzaje pobieranych materiałów biologicznych są zestawione w tabeli 1. 136 Tabela 1. Materiał biologiczny wykorzystywany w badniach mykologicznych (opracowanie własne na podstawie Dynowska M 2011). Miejsce zakażenia Skóra i przydatki skórne Układ moczowopłciowy Układ pokarmowy Ośrodkowy układ nerwowy Układ oddechowy Narząd słuchu Narząd wzroku (gałka oczna) Układ krwiotwórczy szpik kostny Grzybica uogólniona Grzybice narządowe Rodzaj materiału łuski naskórkowe, opiłki paznokci, zeskrobiny skórne, zmienione chorobowo włosy mocz, wymazy z cewki moczowej, wymazy z cewników u pacjentów cewnikowanych, wymaz z żołędzi, wymazy z pochwy kał, treść żołądkowo-jelitowa, żółć płyn mózgowo-rdzeniowy choroby płuc i oskrzeli: plwocina, wymazy z nosa, gardła i krtani, popłuczyny pęcherzykowo-oskrzelowe choroby laryngologiczne: wydzieliny z zatok przynosowych, popłuczyny z jamy ustnej, wymaz z języka, dziąseł, podniebienia wymazy i zeskrobiny z przewodu słuchowego zewnętrznego wymazy z worka spojówkowego, wymazy z rogówki szpik kostny pobrany na drodze biopsji krew badania histopatologiczne: pobrane na drodze biopsji punktaty, fragmenty tkanek, płyny z klatki piersiowej, jamy brzusznej, stawów, owrzodzeń, wycinki tkanek badania serologiczne: surowica, mocz, płyn mózgowordzeniowy Ogólne zasady pobierania, przechowywania i mykologicznych/parazytologicznych zestawiono w tabeli 2. transportu materiału do badań Tabela 2. Zasady pobierania, przechowywania i transportu materiału biologicznego (opracowanie własne na podstawie Dynowska M 2011). Materiał biologiczny Skóra i przydatki Krew Surowica krwi Wymazy Sposób pobrania pobranie materiału (np. wymaz, zeskrobiny, ścinki/opiłki paznokci, włosy) na podłoże transportowo-hodowlane Mycoline do badania serologicznego - pobrana z żyły w ilości około 5 ml, na skrzep; przechowywać w szczelnie zakorkowanej probówce do 24 godzin w temp. od + 2°C do + 8°C do badania serologicznego - przechowywać w temp. - 20°C przez okres 14 dni; do laboratorium powinna być dostarczona w stanie zamrożenia - wymaz z nosa, oka, ucha, rany powinien wykonywać lekarz, pobierając go na mikrobiologiczny zestaw transportowy - wymaz okołoodbytniczy pobrać zaraz po przebudzeniu, przed wypróżnieniem i przed myciem. Materiał uzyskuje się: • przy użyciu zestawu komercyjnego wg metody Halla (NIH) - pobranie materiału na bagietkę z tomofanem (celofanem) • wg metody Grahama przy użyciu przylepca celofanowego (taśmy klejącej). 137 Mocz Kał - wymaz z gardła/nosa - sterylną szpatułką należy unieruchomić język, jałową wymazówką z mikologicznego zestawu transportowego pobrać materiał ze zmienionych zapalnie okolic tylnej ściany gardła, podniebienia lub migdałków mocno pocierając wacik lub wykonując nim ruch obrotowy pobrać przed rozpoczęciem leczenia antybiotykami lub 5-7 dni po zakończonej terapii antybiotykami/chemioterapeutykami; - środkowy strumień moczu, (około 50 ml) pobrać rano do jałowego pojemnika po uprzednim dokładnym umyciu pacjenta, przesłać do laboratorium w ciągu 4 godzin, do tego czasu przechowywać w temp. od + 2°C do + 8°C; mocz pobrany w powyższy sposób można posiać na podłoże transportowo-wzrostowe (Uromedium, Uriline, Uricult) zgodnie z instrukcją producenta; dostarczyć w ciągu 24 godzin, do czasu transportu przechowywać w temperaturze +37°C - na podłoże transportowe pobrać zanurzając wymazówkę w kale, a następnie w podłożu transportowym, dostarczyć w ciągu 48 godzin od pobrania, przechowywać w temp. od +5°C do +25°C - pobrać z kilku miejsc, uwzględniając miejsca patologiczne (krew, śluz) - od osób chorych pobrać przed rozpoczęciem leczenia lub 5 dni po zakończonej antybiotykoterapii - pobrać szpatułką do naczynka kałowego w ilości ⅓ objętości pojemnika i szczelnie zamknąć. W przypadku kału płynnego pobrać około 1ml. Próbkę dostarczyć do badania w ciągu kilku godzin, a do tego czasu przechowywać w temp. od + 2°C do + 8°C 2. Porównanie metod klasycznych i molekularnych w diagnostyce inwazji grzybiczych i pasożytniczych I. Metody klasyczne 1. Preparaty mikroskopowe Mykologia W mykologii często stosuje się preparaty bezpośrednie niebarwione lub barwione wykonane niezwłocznie po pobraniu materiału od pacjenta. Pozwalają one na stwierdzenie obecności komórek grzybów w danym materiale biologicznym, wstępne określenie przynależności taksonomicznej (drożdże lub pleśnie), w przypadku drożdży pozwalają na określenie fazy rozwojowej (Y – yeast, komórki pączkujące lub M – mycelium, pseudostrzępki lub strzepki), oraz na ocenę stosunku liczebności populacji grzybów do liczebności innych mikroorganizmów. Jednocześnie ułatwiają wybranie dalszego, właściwego toku diagnostycznego. Preparaty wykonane z hodowli (po uzyskaniu kolonii czystych kultur mikroorganizmu) pozwalają na określenie charakterystycznych struktur morfologicznych grzybów i identyfikację czynnika etiologicznego. Cechami wykorzystywanymi w ocenie mikroskopowej są: kształt i budowa strzępek/pseudostrzępek, morfologia struktur zarodnikotwórczych i typ zarodnikowania oraz rodzaje produkowanych zarodników bezpłciowych i płciowych. Preparaty bezpośrednie/mikroskopowe wykonuje się kilkoma technikami (rycina 2): preparaty niebarwione przyżyciowe (wykonane w wodzie jałowej lub soli fizjologicznej) – stwierdzenie obecności i oszacowanie liczebności grzybów; preparaty barwione (np. błękitem metylenowym) – ocena żywotności komórek grzybów; preparaty w 40% KOH lub KOH z DMSO (rozpuszczają keratynę i rozjaśniają obraz) oraz w laktofenolu (fenol: zabija żywe organizmy; kwas mlekowy: utrwala struktury grzybów, cottonblue: barwi chitynę w ścianach komórek grzybów)– stosowane w przypadku podejrzenia grzybicy skóry/naskórka lub inwazji włosów dermatofitami (przy zastosowaniu laktofenolu preparaty z hodowli grzybów strzępkowych można podbarwić błękitem anilinowym); 138 preparaty utrwalone barwione: • preparat w tuszu chińskim – w diagnostyce inwazji Cryptococcus sp.; • barwione metodą Grama – grzyby wybarwiają się na granatowo (fioletowo), określenie stosunku liczby komórek grzybów do bakterii; • barwione metodą Giemsy – grzyby wybarwiarwiają się na granatowo (fioletowo); • barwione metodą Schaeffera-Fultona – stwierdzenie fazy rozwojowej (blastospory – czerwone, askospory – zielone); • preparaty histopatologiczne: o barwione hematoksyliną i eozyną (HE); o barwione srebrem i metenaminą wg Gomoriego (GMS) – standardowo stosowane w diagnostyce Pneumocystis sp.; o reakcja z kwasem nadjodowym i odczynnikiem Schiffa (PAS) – wybarwia polisacharydy występujące w m.in. ścianach komórkowych grzybów o Rycina 2. Preparaty stosowane w diagnostyce mykologicznej: (a) preparat w 40% KOH - kanały perforacyjne we włosie porażonym dermatofitem (pow. 100x, fot. A. Wójcik); (b) preparat w 40% KOH - sporangiofor Syncephalastrum racemosum (pow. 400x, fot. K. Góralska); (c) bezpośrednie barwienie błękitem metylenowym – komórki Candida spp: żywe (niezabarwione) i martwe (zabarwione na niebiesko). (pow. 400x, fot. K. Góralska); (d) barwienie metodą Grama - blastospory i pseudotrzępki Candida parapsilosis (pow. 1000x, fot. K. Góralska); (e) preparat w tuszu chińskim - komórki Cryptococcus neoformans z otoczką polisacharydową w rozmazie płynu mózgowordzeniowego (pow. 400x, fot. K. Góralska); (f) barwienie błękitem anilinowym w laktofenolu - strzępki grzybów pleśniowych (pow. 400x, fot. K. Góralska). Parazytologia W diagnostyce inwazji pasożytniczych niezwykle istotne jest wykrycie postaci rozwojowej pasożyta w organizmie. W ocenie materiału biologicznego pobranego od pacjenta często wykonuje się preparaty bezpośrednie pozwalające np. na wykrycie rzęsistka pochwowego w nasieniu, treści pochwowej lub w osadzie moczu. Formy rozwojowe pasożytów przewodu pokarmowego stwierdzane są w preparatach bezpośrednich z kału, podbarwionych płynem Lugola, w KOH i/lub DMSO lub wybarwionych zielenią malachitową. W przypadku pierwotniaków diagnostyka i identyfikacja opiera się na stwierdzeniu obecności formy morfologicznej pasożyta (trofozoit, cysta, oocysta), natomiast w 139 przypadku helmintów (przywry, tasiemce, obleńce) możliwe jest stwierdzenie obecności jaj w kale pacjenta (typowych dla rodzaju/gatunku), a dodatkowo w przypadku tasiemców – proglotydów. Często stosowane są metody zagęszczające: flotacyjne i sedymentacyjne (patrz ćw. Hydrosfera i litosfera). Pasożyty występujące w krwi obwodowej wykrywane są w preparatach barwionych najczęściej metodą Giemsy. Preparaty wykonuje się dwoma technikami: cienki rozmaz krwi (barwienie utrwalonego rozmazu) i gruba kropla krwi (barwienie grubej warstwy krwi bez utrwalania). Niezbędna jest ocena co najmniej 3 preparatów i powtórzenie badania kilkakrotnie w ciągu doby. Cienki rozmaz umożliwia ocenę stadiów rozwojowych np. Plasmodium spp. oraz ocenę cech zarażonych erytrocytów; pozwala to rozpoznać gatunek zarodźca. Gruba kropla pozwala na częstsze wykrycie inwazji, np. malarii, filarioz, co jest ważne przy niskiej parazytemii. Niektóre pasożyty tkanek/organów można stwierdzić również w preparatach histologicznych barwionych hematoksyliną i eozyną. Stawonogi występujące w skórze (nużeńce, świerzbowce) są wykrywane w preparatach rozjaśnionych z zeskrobin skórnych rozpuszczanych w KOH lub laktofenolu (rycina 3 i 4). Rycina 3. Preparaty stosowane w diagnostyce pierwotniaków: (a) barwienie trichromem –cysty Entamoeba histolytica w rozmazie kału (pow. 1000x, fot. K. Góralska); (b) barwienie metodą Giemsy –postacie trypomastigota Trypanosoma cruzi w cienkim rozmazie krwi obwodowej (pow. 1000x, fot. M. Dzikowiec); (c) barwienie płynem Lugola –trofozoit Balantidium coli w rozmazie kału (pow. 400x, fot. M. Dzikowiec). Rycina 4. Preparaty stosowane w diagnostyce inwazji wywołanych przez heliminty i stawonogi:(a). preparat z wody pochodzącej z hodowli ślimaków - barwienie hematoksyliną i eozyną – furkocerkarie Schistosoma mansoni (pow. 100x, fot. K. Góralska); (b). preparat histopatologiczny – wycinek skóry barwiony trichromem – Sarcoptes scabiei w przekroju skóry (pow. 400x, fot. M. Dzikowiec); (c). preparat bezpośredni rozjaśniony laktofenolem – Demodex folliculorum przy rzęsach (pow. 100x, fot. M. Dzikowiec). 140 2. Metody hodowlane Mykologia Metody hodowlane są w dalszym ciągu podstawą diagnostyki mykologicznej w większości laboratoriów (rycina 2). Wyhodowanie grzybów świadczy o ich obecności w organizmie pacjenta oraz pozwala na uzyskanie odpowiedniej ilości materiału do przeprowadzenia identyfikacji metodami mikroskopowymi lub biochemicznymi. Podłoża stosowane w mykologii medycznej można podzielić ze względu na funkcje na: namnażające: • agar Sabourauda– najczęściej stosowane w wykrywaniu, namnażaniu, izolacji wstępnej i hodowli drożdży (Candida, Saccharomyces), często z dodatkiem gentamycyny i chloramfenikolu, które hamują wzrost bakterii; wybiórczo-namnażające: • podłoże z różem bengalskim – stosowane w wykrywaniu drożdży; wzrost grzybów pleśniowych jest zahamowany; • agar Czapek-Doxa – stosowane w wykrywaniu grzybów pleśniowych; • agar PDA (glukozowo-ziemniaczany) – stosowane w wykrywaniu grzybów pleśniowych, szczególnie z rodzaju Fusarium; wybiórczo-różnicujące: • CHROMagar Candida (podłoże chromogenne) – stosowane do różnicowania grzybów z rodzaju Candida (poszczególne gatunki wzrastają w różnych barwach), ma ograniczone zastosowanie do 4-5 gatunków z rodzaju Candida (np. CHROMagar™ Candida Plus) specjalne: • podłoże Nickersona (identyfikacyjne) – stosowane do mikrohodowli drożdży, grzyby są identyfikowane na podstawie charakterystycznego wzrostu, zdolności do tworzenia strzępek/pseudostrzępek, kształtu blastospor i artrospor oraz wytwarzania chlamydospor; • podłoże agarowe z ryżem – stymuluje wytwarzanie chlamydospor przez izolaty grzybów mające taką zdolność; • bulion Sabourauda bez glukozy – podłoże przygotowujące izolaty grzybów do badań biochemicznych; • podłoże do auksanogramu – podłoże do badań biochemicznych: badanie zdolności asymilacji – np. przyswajania węgla z węglowodanów, azotu z różnych związków azotowych; • podłoże do zymogramu – podłoże do badań biochemicznych: badanie zdolności do wytwarzania enzymów uczestniczących w procesie fermentacji związków węglowodanowych (z oceną wytwarzania CO2). • inne: z arbutyną – zdolność rozszczepiania arbutyny, Christensena – zdolność rozkładania mocznika dzięki wytwarzaniu ureazy. 141 Rycina 5. Hodowle grzybów: (a). na płytce na podłożu Czapek-Doxa – Trichophyton interdigitale; (b). na skosie na podłożu Sabourauda – Rhodotorula rubra (pomarańczowe) i Candida albicans (kremowe); (c). na podłożu chromogennym – Candida dubliniensis; (d). na podłożu chromogennym – Candida glabrata (fot. K. Góralska). Parazytologia Metody hodowlane są stosunkowo rzadko stosowane w podejrzeniu inwazji pasożytniczych. Najczęściej wykorzystuje się podłoża do namnażania pierwotniaków, m.in. podłoże Pawłowej czy podłoże Siimča służące do wykrywania pełzaka dziąsłowego, rzęsistka policzkowego i rzęsistka pochwowego (wyższa czułość w porównaniu z innymi metodami). Do innych testów hodowlanych można zaliczyć: założenie hodowli kału dla wykazania obecności larw nicieni jelitowych (rodzaje: Strongyloides, Trichostrongylus, Ancylostoma, Necator), bądź pierwotniaków jelitowych (E. histolytica sensu lato, Balantidium coli) - w przypadku powrotu pacjenta ze strefy tropikalnej lub subtropikalnej, a w przypadku podejrzenia strongyloidozy (wywoływanej przez węgorka jelitowego), także u osób pochodzących z regionu południowo-wschodniego Polski, test wylęgania miracydiów (hatching test) na obecność żywych jaj Schistosoma spp. w kale lub moczu w przypadku osób powracających z terenów endemicznych schistosomozy. 3. Metody biochemiczne Mykologia Do badań biochemicznych niezbędne jest wcześniejsze wyizolowanie z materiału biologicznego aksenicznego szczepu grzyba na podłożu mykologicznym. Identyfikacja drobnoustroju oparta na właściwościach biochemicznych wykorzystuje różnice w metabolizmie na podstawie: wymagań tlenowych, właściwości fermentacyjnych, zdolności do asymilacji węgla lub azotu z różnych związków wytwarzania siarkowodoru, wytwarzania różnych enzymów np. katalazy, ureazy, wymagań osmotycznych, zapotrzebowania na witaminy, rozkładu tłuszczy, kwasów nukleinowych, wytwarzania metabolitów pierwotnych i wtórnych (toksyny, barwniki, aminokwasy). 142 Obecnie w diagnostyce mikologicznej dostępne są liczne komercyjne biochemiczne testy diagnostyczne, stosowane w większości laboratoriów (rycina 6), np.: API 20 C AUX– dla drożdży (oznaczenie izolatu drożdży do gatunku/szczepu), API Candida – dla grzybów z rodzaju Candida, ID32 – dla drożdży, API Zym – dla drożdży, ocena zdolności do wytwarzania enzymów (ocena wirulencji). (a) (b) Rycina 6. Testy biochemiczne: (a) identyfikacyjny API 20 C AUX, (b) aktywności enzymatycznej API-Zym (fot. K. Góralska). (b) 4 . Metody serologiczne Metody serologiczne były stosowane już od dekad, ale w ciągu ostatnich lat, ich zastosowanie w szerszym zakresie weszło do rutynowej diagnostyki mykologicznej/parazytologicznej. Oceniamy w nich swoistą odporność gospodarza (głównie humoralną) oraz poszukujemy antygenów czynnika patogennego: antygeny rozpuszczalne grzybów, wydalniczo-wydzielnicze (E/S) pasożytów w płynach ustrojowych. Współczesna diagnostyka serologiczna grzybic (głównie inwazyjnych) obejmuje wykrywanie w surowicy i/lub innych płynach ustrojowych: antygenów rozpuszczalnych, swoistych przeciwciał przeciwgrzybiczych oraz określanie ich miana. Z kolei do metod wykorzystywanych obecnie w komercyjnych testach laboratoryjnych zalicza się: aglutynację lateksową (LA), metody immunofluorescencyjne: bezpośrednie (DIF) oraz pośrednie (IIF), metody immunoenzymatyczne: jakościowe (EIA) oraz ilościowe (ELISA). Są to metody stosunkowo proste w wykonaniu i w porównaniu do metod hodowlanych bardzo szybkie. Jednak diagnostyka z ich wykorzystaniem ma pewne ograniczenia. U pacjentów z niedoborami odporności wynik ujemny nie wyklucza zarażenia (wyniki fałszywie ujemne). Antygeny krążące w organizmie pacjenta mogą występować w ilościach poniżej progu detekcji dla stosowanych metod, mogą być też szybko eliminowane z ustroju. Zalety i wady metod przedstawiono w tabeli 3. 143 Tabela 3. Zalety i wady metod serologicznych (Kalinowska K 2011) Zalety metod serologicznych Wady metod serologicznych wykrywanie antygenu na wczesnym etapie zakażenia/zarażenia szybka detekcja wysoka czułość wysoka swoistość wyniki fałszywie dodatnie lub fałszywie ujemne ze względu na: niski poziom przeciwciał u pacjenta brak przeciwciał u osób z obniżoną odpornością reakcje krzyżowe podobieństwo antygenowe między mikroorganizmami długo utrzymujące się przeciwciała lub pozostający w organizmie pacjenta antygen po przebytej inwazji Czułość metody – stosunek wyników prawdziwie dodatnich do sumy prawdziwie dodatnich i fałszywie ujemnych; określa zdolność testu do wykrywania osób chorych (czułość 100% oznaczałaby, że wszystkie osoby chore zostaną rozpoznane). Swoistość metody – stosunek wyników prawdziwie ujemnych do sumy prawdziwie ujemnych i fałszywie dodatnich; określa zdolność testu do wykrywania osób zdrowych - poprawnego wykluczenia choroby (swoistość 100% oznaczałaby, że wszyscy ludzie zdrowi zostaną oznaczeni jako zdrowi). W przypadku grzybów, najczęściej wykrywanymi antygenami są polisacharydy ścian komórkowych: D-glukan, mannan, galaktomannan, rzadziej składniki cytoplazmy: enzym enolaza, białko szoku cieplnego (HSP90). W przypadku pasożytniczych pierwotniaków, można wykorzystywać całe komórki (np. zawiesina żywych tachyzoitów Toxoplasma gondii – tzw. odczyn Sabina-Feldmana, obecnie stosowana jako test referencyjny dla technik nowo opracowywanych), a także specyficzne białka (np. bogate w histydynę białko II czy enzym dehydrogenaza mleczanowa Plasmodium falciparum i P. vivax). Specyficzne antygeny helmintów to np.: antygeny krążące Trichinella sp., białka i glikoproteiny zewnętrznej warstwy torbieli Echinococcus granulosus i E. multiocularis – oznaczane odpowiednio jako antygeny Em1 i Em2 czy antygen 5 (Ag5) pochodzący z treści torbieli E. granulosus. Rekomendowaną metodą wykrywania cyst/oocyt Giardia intestinalis i Cryptosporidium spp. jest metoda immunofluorescencji bezpośredniej (MeriFluor). Metody serologiczne powinny być stosowane: w podejrzeniu grzybicy przewlekłej, układowej, szczególnie u chorych z nowotworami układu krwiotwórczego; w każdym przypadku podejrzenia parazytozy pozajelitowej lub jako uzupełnienie diagnostyki przy ujemnym badaniu koproskopowym; przy niemożliwości wykonania badania mikroskopowego; do potwierdzenia nabycia parazytozy zawleczonej (importowanej) z krajów tropikalnych lub subtropikalnych. Do metod serologicznych, które znalazły zastosowanie w diagnostyce mykologicznej i parazytologicznej można zaliczyć: test aglutynacji lateksowej -reakcja składnika badanego (przeciwciało lub antygen) ze składnikiem detekcyjnym: • aglutynacja bezpośrednia – wykrywanie antygenu, • aglutynacja pośrednia – wykrywanie przeciwciał, Zastosowanie w diagnostyce: wykrywanie Candida, Aspergillus i Cryptococcus: 144 - Pastorex®Candida – mannan, - Pastorex®Aspergillus – galaktomannan, - Pastorex®crypto-Plus – glukuronoksylomannan, wykrywanie Paracocidioides brasiliensis, wykrywanie pierwotniaków z rodzaju Leishmania w moczu; testy immunofluorescencji -zastosowanie przeciwciał znakowanych barwnikami fluorescencyjnymi: izotiocyjanian fluoresceiny i izotiocyjanian tetrametylorodaminy: • test immunofluorescencji bezpośredniej, • test immunofluorescencji pośredniej, Zastosowanie w diagnostyce: wykrywanie grzybów z rodzajów : Candida, Aspergillus, Alternaria, Pneumocystis, wykrywanie pasożytów z rodzajów: Leishmania, Giardia, Cryptosporidium, Entamoeba, Plasmodium, Trypanosoma, Echinococcus, Toxocara, Ascaris, Schistosoma; ELISA (ang. enzyme-linked immunosorbent assay) – test immunoenzymatyczny, zastosowanie przeciwciał wyznakowanych enzymem (np. peroksydazą chrzanową), detekcja zmiany barwy w wyniku reakcji enzymu z substratem; Zastosowanie w diagnostyce: wykrywanie grzybów z rodzajów: Candida, Aspergillus: - Platelia®Candida – mannan, - Platelia®Aspergillus – galaktomannan, wykrywanie pierwotniaków z rodzajów: Toxoplasma (IgA, IgG), Giardia (IgG), Entamoeba (IgG), Cryptosporidium (IgG), wykrywanie helmintów z rodzajów: Echinococcus (Em2+, Em1, IgG), Taenia solium (wągrzyca, IgG), Trichinella (IgG), Dirofilaria, Toxocara (IgA, IgG); WESTERN BLOT -rozdzielenie białek w żelu poliakrylamidowym (SDS-PAGE - ang. SDS poliacrylamide gel electrophoresis), następnie przeniesienie ich na membranę nitrocelulozową i związanie z przeciwciałami z badanej surowicy, Zastosowanie w diagnostyce: - wykrywanie grzybów z rodzajów: Candida, Aspergillus, Cryptococcus, Histoplasma, - wykrywanie pasożytów z rodzajów: Toxoplasma (surowica matki i noworodka, IgG), Giardia, Entamoeba, Cryptosporidium, Echinococcus, Taenia solium (wągrzyca), - wykrywanie chorób odkleszczowych (np. borelioza) – na podstawie stężenia przeciwciał i stosunku IgM do IgG, można oszacować czas zakażenia. Różne gatunki kleszczy z rodzajów Ixodes i Dermacentor występują licznie na terenie Polski. Ukąszenia kleszczy stanowią nie tylko problem parazytologiczny, ale także mikrobiologiczny. Kleszcze stanowią istotny rezerwuar wielu gatunków bakterii chorobotwórczych dla człowieka. Bardzo dobrze poznane są krętki z rodzaju Borrelia, odpowiadające za boreliozę z Lyme. Diagnostyka tej choroby opiera się głównie na metodach serologicznych, przy czym technika Western Blot jest uznawana za najlepszą. W trakcie badania wykrywane są przeciwciała przeciw antygenom krętków związane ze ścianą komórkową (Osp) oraz wicią (Flagellin) i oznaczane jest ich stężenie/miano. Oprócz badań w kierunku boreliozy z Lyme wiele laboratoriów analitycznych oferuje panele diagnostyczne innych chorób odkleszczowych, m.in. odkleszczowe wirusowe zapalenie opon mózgowych i mózgu, babesioza, tularemia. 145 II. Metody molekularne Opisane poniżej metody molekularne stosowane są w diagnostyce mikrobiologicznej (wirusologia, bakteriologia, mykologia) i parazytologicznej człowieka i zwierząt. Elementem analizowanym w metodach molekularnych jest ocena obecności w badanym materiale sekwencji DNA (lub RNA w niektórych metodach) charakterystycznych dla poszukiwanego gatunku drobnoustroju podejrzewanego o wywołanie zakażenia. Sekwencje takie określane są jako sondy molekularne. Diagnostyka molekularna opiera się na poszukiwaniu określonych sekwencji w materiale genetycznym i mogą to być: obszary wysoko zmienne – sekwencje mini- i mikrosatelitarne; zastosowanie - różnicowanie szczepów lub osobników; sekwencje umiarkowanie zmienne – transkrybowalne sekwencje rozdzielające zespoły genów rybosomalnych (ITS wewnętrzne sekwencje transkrybowane; ang. internal transcribed spacer oraz ETS zewnętrzne sekwencje transkrybowane ang. external transcribed spacer), geny mitochondrialne (podjednostka oksydazy cytochromowej); zastosowanie - różnicowanie gatunków; sekwencje konserwatywne – RNA (rybosomalne 16S RNA) małej podjednostki 30S rybosomu DNA małej podjednostki rybosomalnego RNA, geny kodujące białka; zastosowanie różnicowanie wyższych poziomów taksonomicznych. Wskazanie do zastosowania metod molekularnych: ciężkie grzybice układowe; negatywne wyniki hodowli i ujemne wyniki badań mikroskopowych (grzyby); dochodzenie epidemiologiczne ogniska zakażenia szpitalnego; niska intensywność zarażenia, poniżej progu wykrywanego mikroskopowo (pasożyty); różnicowanie gatunków podobnych; badania potwierdzające inwazję; określenie lekooporności pasożyta. Metody molekularne można wstępnie podzielić na: 1. Metody niewymagające multiplikacji DNA, opierające się na hybrydyzacji kwasów nukleinowych, czyli łączeniu się kwasów nukleinowych o komplementarnej sekwencji. Łączenie to może następować zarówno pomiędzy DNA i DNA, DNA i RNA oraz RNA i RNA. – FISH (hybrydyzacja fluorescencyjna in-situ) hybrydyzacja sondy zawierającej znacznik fluorescencyjny do sekwencji chromosomu (tabela 6). Metody micro-chipowe z wykorzystaniem specyficznych sond molekularnych, zazwyczaj fluorescencyjnych. Sondami molekularnymi są krótkie odcinki DNA lub RNA o znanej sekwencji nukleotydowej oraz lokalizacji na chromosomie, które łączą się z badanym DNA lub RNA na zasadzie komplementarności kwasów nukleinowych. Sondy mogą być wyznakowane fluorescencyjnie lub radioizotopowo w celu ich wizualizacji w badanym materiale biologicznym, co umożliwia analizę wyników. 2. Metody oparte na wstępnej multiplikacji/amplifikacji DNA w reakcji PCR (ang. Polymerase Chain Reaction – łańcuchowa reakcja polimerazy) lub jej odmianach, stosowane są w celu zwielokrotnienia sekwencji przeznaczonej do dalszej diagnostyki. Metoda polega na powielaniu wybranego fragmentu DNA in vitro. Taka zamplifikowana sekwencja może być następnie analizowana przy użyciu enzymów restrykcyjnych. Amplifikacja genów in vitro: wymaga zastosowania odpowiednich metod naśladujących proces amplifikacji zachodzący wewnątrz komórki (in vivo); 146 wykorzystuje enzym polimerazę (wyizolowany po raz pierwszy z bakterii termofilnych Thermus aquaticus) mającą zdolność syntetyzowania nici komplementarnej na matrycy jednoniciowego łańcucha DNA. Izolacja materiału genetycznego Zasadniczym etapem pracy z DNA/RNA jest prawidłowe wyselekcjonowanie, a następnie pobranie materiału biologicznego, jego izolacja i przechowywanie. Materiałem biologicznym najczęściej wykorzystywanym jest krew obwodowa, fragmenty tkanek czy komórki uzyskiwane z hodowli komórkowych (w przypadku człowieka i zwierząt), w przypadku roślin - liście i młode siewki, natomiast w przypadku bakterii i grzybów - mycelium oraz komórki z zawiesiny. Obecnie istnieje wiele metod izolacji DNA i RNA, jednak wszystkie polegają na zniszczeniu struktur komórkowych i wyodrębnieniu materiału genetycznego z mieszaniny zanieczyszczeń i inhibitorów reakcji enzymatycznych. Początkowo stosowano przygotowywane samodzielnie bufory, które powodowały lizę komórek i wstępne wytrącenie zanieczyszczeń (np. białek). Kolejnym etapem było wytrącenie materiału genetycznego, przy pomocy alkoholu w niskiej temperaturze. Tak uzyskane DNA/RNA wirowano, suszono, a następnie rozpuszczano w wodzie. Izolacja DNA Obecnie stosowane metody izolacji można podzielić na 3 główne grupy: zastosowanie mieszaniny fenol : chloroform (rozpuszczalniki organiczne służą do oddzielania kwasów nukleinowych od związanych z nimi białek; fenol powoduje denaturację białek, ponadto nie doprowadza do całkowitego hamowania RNaz, chloroform ułatwia rozdzielanie fazy wodnej i organicznej), wysolenie białek z otrzymanych lizatów komórek, wykorzystanie nośnika, który wiąże DNA, następnie odmycie zanieczyszczeń i uwolnienie związanego DNA. Izolacja RNA Wśród metod izolacji RNA, wyróżnia się: izolację specyficznego RNA poprzez frakcjonowanie całkowitego RNA komórki izolację poli(A)RNA, izolację RNA z polirybosomów, izolację całkowitego RNA komórki, a w kolejnym etapie uzyskiwanie poprzez odwrotną transkrypcję na matrycy jednoniciowego RNA (ssRNA) matrycowego RNA (mRNA) komplementarnego DNA tzn. cDNA z zastosowaniem metody odwrotnej transkrypcji. Dobrej jakości RNA można uzyskać stosując szybkie i skuteczne metody hamowania działania rybonukleaz (enzymów degradujących RNA). Rybonukleazy obecne są we wszystkich żywych komórkach i bardzo szybko degradują cząsteczki RNA, dlatego stosowane odczynniki oraz sprzęt muszą być wolne od (pozbawione) rybonukleaz. Etapy izolacji RNA (uproszczona procedura): pozyskanie materiału biologicznego: krew (bądź inny materiał wyjściowy), liza komórek w obecności buforów denaturujących oczyszczanie preparatu poprzez usunięcie fragmentów DNA ekstrakcja RNA oraz selektywne wiązanie RNA do membrany filtra wirowanie, wytrącanie RNA, 147 wirowanie, rozpuszczanie RNA, elektroforeza w żelu agarozowym i ocena jakościowa/ilościowa RNA. Pomimo znanych wielu metod izolacji wciąż za najlepszą uznawana jest technika z zastosowaniem mieszaniny fenolu i chloroformu (wg R.Słomskiego), ponieważ zapewnia wysoki stopień czystości produktu reakcji. Preparat wysokiej czystości można z powodzeniem stosować w analizie molekularnej np. do analizy restrykcyjnej, klonowania czy reakcji PCR. Izolacja RNA/DNA z bakterii i grzybów Izolacja RNA/DNA z bakterii i grzybów jest procesem wymagającym dodatkowych etapów lizy liza enzymatycznej (np. enzmy BacL Buffer) wraz z proteinazą K w celu dezintegracji ściany komórkowej grzybów, degradacji błon i białek komórkowych. Ponadto w celu otrzymania DNA wolnego od RNA stosuje się RNazę A. Po dodaniu soli chaotropowych (związki charakteryzujące się zdolnością do przecinania wiązań wodorowych, znajdujących się między makrocząsteczkami i wodą; denaturują białka - odbiałczają, ułatwiają rozpad błon komórkowych i są silnym inhibitorem rybonukleaz), lizat przenoszony jest do minikolumny ze złożem. Dwustopniowe przemywanie DNA związanego do złoża ma na celu usunięcie pozostałych zanieczyszczeń i/lub inhibitorów reakcji enzymatycznych. Oczyszczone kwasy nukleinowe eluowane (wymywane) są ze złoża buforem o niskiej sile jonowej lub wodą (pH 7,0-9,0) i gotowe są do bezpośredniego wykorzystania w technikach biologii molekularnej (takich jak PCR, qPCR) lub mogą być przechowywane do późniejszego użycia. Reakcja PCR Reakcja PCR jest jednym z podstawowych narzędzi pracy w laboratorium molekularnym. Aby polimeraza mogła syntetyzować komplementarną nić wymagany jest dwuniciowy odcinek starterowy. Składniki reakcji PCR 1. polimeraza DNA – enzym, który ma zdolność syntetyzowania nici komplementarnej na podstawie jednoniciowego łańcucha DNA - katalizuje reakcję, 2. bufor – zapewnia odpowiednie środowisko reakcji dla enzymu (pH, siła jonowa), 3. Mg2+ – kofaktor polimerazy DNA, 4. dNTP – trifosforany wszystkich deoksyrybonukleotydów: dATP, dCTP, dGTP, dTTP - substraty do budowy nowych nici DNA, 5. DNA – matryca do budowy nowych nici (matrycą może być DNA wyizolowane z każdego rodzaju organizmu, zarówno DNA genomowe, mitochondrialne, plazmidowe jak i cDNA przepisane z mRNA), 6. oligonukleotydy starterowe (startery) – syntetyzowane chemicznie (na zamówienie) sekwencje DNA o długości 15-30 par zasad, które otaczają miejsce amplifikacji, komplementarne do nici DNA. Dzięki starterom polimeraza DNA może rozpocząć syntetyzowanie nici komplementarnej. Ważną cechą jest posiadanie wolnego końca 3’ do syntezy nowych nici przez polimerazę DNA, 7. woda dejonizowana – musi być wolna od enzymów trawiących DNA (DNaz), czy biologicznego zanieczyszczenia. 148 Tabela 4. Przebieg reakcji PCR (opracowanie własne na podstawie Raszka A i wsp. 2009.) Każda reakcja łańcuchowa polimerazy składa się z wielu cykli następujących po sobie etapów: denaturacji - podgrzewania próbki do 95 °C w celu rozplecenia podwójnej helisy (następuje rozerwanie wiązań wodorowych), po rozpleceniu każda z nici pełni rolę matrycy. obniżania temperatury w celu przyłączenia sekwencji starterów do matrycowej nici DNA (ang. annealing = hybrydyzacja odcinków starterowych); temperatura, którą stosuje się w etapie annealingu zależy od długości starterów oraz zawartość par GC. wydłużania (elongacja) – synteza komplementarnej nici przez polimerazę; właściwy proces amplifikacji sekwencji. Sterowanie procesem amplifikacji polega na właściwym dobraniu temperatur i ilości cykli powtórzeń. W trakcie trwania reakcji nie dodaje się żadnych składników, substratów do reakcji. Produkt powstały w jednym cyklu reakcji zostaje użyty jako matryca w następnych cyklach – stąd określenie reakcja łańcuchowa. Obserwujemy wykładniczy przyrost produktów amplifikacji (ang. exponential amplification). Tabela 5. Zalety i wady reakcji PCR. Zalety wysoka czułość – możliwe powielenie pojedynczej cząsteczki DNA, selektywność– powielana jest tylko wybrana sekwencja szybkość – amplifikacja badanego genu w czasie 2-3 godzin wysoka wydajność– 106 – 109 kopii badanego genu w wyniku 1 reakcji prostota wykonania Wady ryzyko kontaminacji – np. materiałem genetycznym osoby wykonującej analizy lub w przypadku analiz mikrobiologicznych możliwość kontaminacji bakteriami z bezpośredniego otoczenia laboratorium konieczność pracy w warunkach jałowych konieczność dobrania właściwych starterów do reakcji – znajomość sekwencji genu konieczność wykonania dodatkowych analiz w celu obrazowania uzyskanych efektów (rozdział na żelu, trawienie enzymami restrykcyjnymi, wybarwianie) 149 Odmianą reakcji PCR, o której warto wspomnieć, ze względu na jej wykorzystanie w diagnostyce patogenów (bakterii, wirusów i grzybów) jest ilościowa reakcja PCR (ang. quantitative PCR, qPCR) z analizą w czasie rzeczywistym (real-time qPCR). Reakcja taka daje mozliwośc oszacowania ilości amplifikowanego produktu w każdym cyklu reakcji . Tego typu metoda, umożliwia szybkie wykrywanie kwasów nukleinowych patogenu a także obserwację przebiegu reakcji w czasie jej trwania. W metodzie tej wykorzystuje się wyznakowane fluorescencyjnie sondy. Technika ta w oparciu o dane krzywej wzorcowej pozwala także na oznaczenie liczby kopii patogenu w mieszaninie na początku oraz przyrost ilości produktu/kopii amplifikowanego kwasu nukleinowego badanego patogenu w czasie. Podczas przebiegu reakcji aparat do real-time qPCR mierzy zmiany we fluorescencji badanej próbki podczas każdego cyklu reakcji. Emisja sygnału fluorescencji jest proporcjonalna do ilości produktu powstałego w każdym cyklu reakcji. Real-time qPCR jest cennym narzędziem diagnostycznym dającym możliwość monitorowania etapów zakażenia, czy oceny skuteczności zastosowanej terapii. Istotne znaczenie w medycynie (np. transplantologia, onkologia) ma diagnostyka grzybic inwazyjnych. Ostatnio, EORTC/IFI (European Organization for Research and Treatment of Cancer/Invasive Fungal Infections), zrewidowało zalecenia dotyczące definiowania grzybic inwazyjnych. Według zaleceń, dodatni wynik badania wykonanego metodami biologii molekularnej lub serologicznymi jest jednym z kryteriów zdiagnozowania prawdopodobnej (ang. probable) grzybicy inwazyjnej. Dlatego też metody niehodowlane stanowią istotny element laboratoryjnej diagnostyki zakażeń grzybiczych, jednak izolacja i hodowla patogenów jest „złotym standardem„ - pozostaje metodą najbardziej miarodajną. Zgodnie z ustaleniami EORTC/IFI, wyizolowanie czynnika patogennego z materiału jałowego w warunkach fizjologicznych, jest jedynym kryterium mikrobiologicznym umożliwiającym zdefiniowanie pewnej (ang. proven) grzybicy inwazyjnej. Warto podkreślić także, że pomimo zwiększenia czułości i specyficzności w diagnostyce, jaka została osiagnieta dzięki wprowadzeniu technik biologii molekularnej (szczególnie dzięki zastosowaniu reakcji real-time qPCR), techniki te mają w diagnostyce patogenów (szczególnie grzybów) wiele ograniczeń. Wynika to przede wszystkim z trudności w izolacji DNA, wynikającej z rozbijania ściany komórkowej grzybów oraz kłopotów ze znalezieniem specyficznych i konserwatywnych sekwencji docelowych w genomie grzybów patogennych. Kolejne problemy związane są z walidacją metod i ich standaryzacją pomiędzy laboratoriami oraz określeniem parametrów kliniczno-diagnostycznych. Dlatego też, w diagnostyce mykologicznej oznaczenia z użyciem testów PCR i real-time qPCR mają w większości charakter naukowo-badawczy i są najczęściej wykorzystywane do analizy pokrewieństwa genetycznego izolatów grzybów w badaniach epidemiologicznych. Jednak z drugiej strony wprowadzono już na rynek zestawy komercyjne oparte na technice real-time PCR: test MycAssay®, wykrywający w surowicy krwi DNA grzybów z rodzaju Aspergillus; test SeptiFast® dedykowany do próbek krwi pełnej i wykrywający Aspergillus fumigatus oraz grzyby z rodzaju Candida: C. albicans, C. krusei, C. parapsilosis, C. glabrata i C. tropicalis; a także test FilmArray® BC, wykrywający i różnicujący C. albicans z czterema innymi klinicznie istotnymi drożdżakami z rodzaju Candida, co znacznie przyspiesza diagnostykę i możliwość monitorowania przebiegu kandydozy. Ujemną stroną badań z zakresu diagnostyki mykologicznej z zastosowaniem techniki PCR jest możliwość uzyskania fałszywie dodatniego wyniku. Wynika to z powszechnej obecności grzybów w środowisku (patogeny ze środowiska mogą być przyczyną kontaminacji próbki klinicznej). Dlatego też, wynik badania molekularnego wykonanego z określonej tkanki należy skorelować z obecnością objawów klinicznych i/lub innych badań dodatkowych. Należy także dbać o należyte, sterylne pobranie materiału biologicznego do badań. Dodatkowo, hodowla, metody serologiczne oraz uzupełniająco techniki PCR zawsze powinny być wykonywane jednocześnie i wielokrotnie powtarzane. 150 CZĘŚĆ PRAKTYCZNA OBSERWACJA Wyniki: Wnioski: Wnioski: DOŚWIADCZENIA 151 DOŚWIADCZENIE 1. Wykrywanie obecności Candida spp. metodami molekularnymi – przeprowadzenie reakcji łańcuchowej polimerazy PCR. 1a.Pozyskanie wzorcowego genomowego DNA Candida – ekstrakcja DNA (przygotowane przed ćwiczeniami) Szczepy Candida hodowano na agarze Sabouraud z dekstrozą przez 24 godziny. Komórki zebrano i wyekstrahowano genomowy DNA. Gęstą zawiesinę C. albicans (200 μl) zmieszano z 300 μl buforu do lizy (10 mM Tris-HCl, 10 mM EDTA, 50 mM NaCl, 0,2% dodecylosiarczan sodu). Następnie dodano proteinazę K do końcowego stężenia 20 mg/ml, inkubowano przez 30 min w 56°C, gotowano przez 4 min, a następnie trzymano na lodzie przez 5 min. Uzyskany DNA oczyszczono przez ekstrakcję fenol-chloroform i wytrącono etanolem, stężenie zmierzono przy 260 nm w spektrofotometrze. Około 3 ng oczyszczonego DNA szczepów drożdży dodano do mieszaniny PCR – uniwersalna pozytywna kontrola w reakcji PCR . 1b. Wykonanie reakcji PCR Startery oligonukleotydowe pochodzą z genów rRNA grzybów i mogą być stosowane do uniwersalnej grzybowej PCR. Primer przedni ITS3 (5'-GCA TCG ATG AAG AAC GCA GC-3') odpowiada genowi 5.8S rRNA, a starter wsteczny ITS4 (5'-TCC TCC GCT TAT TGA TAT GC-3') odpowiada genowi 28S rRNA. Biotynylowana sonda użyta do hybrydyzacji (5′-ATT GCT TGC GGC GGT AAC GTC C-3′) została zaprojektowana tak, aby wiązała się specyficznie z regionem ITS2 C. albicans, zlokalizowanym pomiędzy genem 5.8S rRNA a genem 28S rRNA. Startery i biotynylowaną sondę zakupiono w TIB MolBiol (Berlin, Niemcy). W przypadku kontroli pozytywnej i negatywnej, odpowiednio 30 µl zawierające 3 ng oczyszczonego DNA Candida lub 30 µl wody destylowanej dodano do 200 µl surowicy ujemnej i poddano obróbce w celu ekstrakcji DNA za pomocą zestawu QIAamp do krwi. WYKONANIE: Materiały i odczynniki: 2µM mix dNTPs mix 2,5 µM MgCl2 polimeraza Hot Start (5U/µl) 10x bufor dla polimerazy 10 mM startera F 10 mM startera R Matryca DNA (do 1000 ng) – próba badana – dodawana osobno woda wolna od nukleaz (dopełnić H20 do objętości 12,5 µl mieszaniny reakcyjnej) Mieszanina na 1 próbkę 0,75 µl 1,0 µl 0,25 µl 1,25 µl 1,0 µl 1,0 µl 1 μl 6,25 µl Na 10 próbek* - *Przy przygotowaniu mieszaniny reakcyjnej należy założyć 10% strat w odczynnikach co związane jest z pipetowaniem bardzo małych objętości. Dlatego przygotowując mieszaninę reakcyjną dla 10 próbek, należy przemnożyć x 11 (110%). Sprzęt i aparatura: - rękawiczki - pipety automatyczne - tipy (końcówki do pipet automatycznych) - eppendorfy - mini wirówka - termocyker 152 Protokół doświadczenia: 1. W probówce typu eppendorf (1,5 ml) wykonać mieszaninę reakcyjną. 2. Do próbówki typu eppendorf (20 µl) dodać 1µl matrycowego DNA. 3. Następnie dodać 11,5µl przygotowanej mieszaniny reakcyjnej. 4. Tak przygotowane próbki wstawić do termocyklera według poniższych warunków: Temperatura Czas Etap1wstępna aktywacja 95°C Etap 2 denaturacja Etap 3 hybrydyzacja Etap 4elongacja 95°C 72°C 5 min 30 sek 45-60 °C w zależności od starterów 1 min 35- 40 cykli Etap 5 – końcowa elongacja 72°C 1 min 10 min Etap 6 4°C ∞ Notatki: Wyniki zostaną uzyskane po wykonaniu rozdziału elektroforetycznego na ćwiczeniu nr 8. Podpis prowadzącego ……………………………………… Data…………………………………… 153 ZADANIA DO SAMOKSZTAŁCENIA 1. Metody rozpoznawania infekcji grzybiczych i inwazji pasożytniczych – uzupełnić tabelę: Infekcja/ Inwazja grzybicza pasożytnicza Metoda: ELISA / posiew Używane podłoże lub wykrywany parametr diagnostyczny Gatunek/rodzaj rodzaj Aspergillus rodzaj Candida Candida albicans rodzaj Cryptococcus rodzaj Fusarium swoiste IgM – wczesne zarażenie swoiste IgG – starsze zarażenie (2 przykłady) swoiste IgA antygen Em 1 antygen Em 2 test wylęgania miracydiów pełzak dziąsłowy, rzęsistek policzkowy 2. Porównać metody klasyczne i molekularne w diagnostyce chorób infekcyjnych i inwazyjnych Metody klasyczne Metody molekularne Zalety Wady 154 3. Procedura izolacji kwasów nukleinowych. LITERATURA 1. Adamski Z., Batura-Gabryel H. Mikologia lekarska. Wyd.UM. Poznań 2007. 2. Bal J.Biologia molekularna w medycynie. Elementy genetyki klinicznej. Wyd. Nauk. PWN Warszawa 2001. 3. Drewa G., Ferenc T. Genetyka medyczna, Elsevier Urban&Partner, Wrocław, 2011; Rozdział 3 – Kwasy nukleinowe; Rozdział 27 – Metody molekularne badania genomu. 4. Dynowska M., Ejdys E. Mikologia laboratoryjna. Przygotowanie materiału badawczego i diagnostyka. Wyd. UWM. Olsztyn 2011. 5. Dzierżanowska D. Rozdział 6, Zakażenia grzybicze – wybrane zagadnienia, alfa-medica press, Bielsko-Biała 2006 6. Genetyka Medyczna G. Drewa, Edra Urban &Partner, Wrocław 2011. rozdział 27.3 7. Genetyka Krótkie wykłady- H. Fletcher, I. Hickey, Warszawa 2010, Wydawnictwo PWN, sekcja E- Technologia rekombinacji DNA (E.1 - Techniki Badania DNA, E.2 Techniki badania RNA) 155 Ćwiczenie 3 Temat: Hodowle komórkowe – kluczowe narzędzie medycyny eksperymentalnej. Doświadczenia 1. Rozdział elektroforetyczny produktów PCR Zakres materiału do przygotowania przed zajęciami Podstawowe pojęcia z zakresu chemii białek i kwasów nukleinowych, biotechnologii: elektroforeza, czynniki warunkujące ładunek elektryczny cząsteczek i ich ruch w polu elektrycznym, bufor, anoda, katoda, żel Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Hodowle komórkowe (podstawowe wyposażenie laboratorium, media hodowlane, klasyfikacja hodowli). Hodowle komórkowe w medycynie – zastosowanie hodowli komórek ludzkiej skóry, chondrocytów, komórek nowotworowych, macierzystych; pozyskiwanie białek stosowanych w terapii. Hodowla tkanek; rozwój i znaczenie hodowli tkanek; wkład hodowli tkanek do nauki. Hodowla narządów – organoidy. 156 CZĘŚĆ TEORETYCZNA Hodowle komórkowe Hodowle komórkowe in vitro są jedną z najczęściej stosowanych technik laboratoryjnych we współczesnej biologii. Inkubacja i/lub namnażanie komórek roślinnych i zwierzęcych poza organizmem pozwala na ścisłe kontrolowanie warunków doświadczalnych i daje stosunkową łatwość modyfikacji właściwości mikrośrodowiska, w którym pozostają komórki (poprzez wprowadzanie np. substancji biologicznie czynnych). Stosowanie hodowli komórek in vitro umożliwia prowadzenie całych cykli doświadczeń przy użyciu takiego samego materiału biologicznego, stwarza także warunki do porównywania wyników badań prowadzonych przez różne pracownie. Próby utrzymania przy życiu komórek in vitro były prowadzone już pod koniec XIX w. (pionierem był Wilhelm Roux). Jednak próby te kończyły się niepowodzeniem zwykle po kilku dniach. W 1951 r. u 30-letniej kobiety zdiagnozowano nowotwór szyjki macicy. Wykonując biopsję pobrano komórki tkanki prawidłowej szyjki macicy oraz komórki guza. Materiał został przekazany do Tissue Culture Laboratory działającego w John Hopkins Hospital (Baltimore, Maryland USA), gdzie pracował George Otto Gey prowadzący badania nad hodowlami tkanek. Naukowiec wykorzystał medium hodowlane, w skład którego wchodziła mieszanina osocza kurczęcia, ekstraktu cielęcych embrionów oraz ludzkiej krwi pępowinowej i zaobserwował, że komórki uzyskane z guza charakteryzowały się nieograniczoną liczbą podziałów komórkowych. Wyizolowane komórki linii nowotworowej zostały nazwane HeLa od pierwszych liter imienia i nazwiska kobiety, od której zostały pobrane - Henrietty Lacks (zmarła 4 października 1951 r.). Późniejsze badania wykazały, że komórki HeLa zawierają DNA wirusa brodawczaka ludzkiego (HPV) 18, wirusa o wysokim potencjale onkogennym. Wyprowadzenie linii komórkowej HeLa okazało się dużym sukcesem. Od tego czasu wyhodowano ponad 50 mln ton komórek Henrietty Lacks. Linia komórkowa HeLa jest wciąż najczęściej wykorzystywana jako model badawczy i stwierdza się, że jest najczęściej „cytowaną” linią komórkową w pracach naukowych. Umożliwiła rozwój technik hodowli komórkowych, co posłużyło do wytłumaczenia wielu zagadnień dotyczących biologii komórek nowotworowych. Do najważniejszych odkryć z wykorzystaniem komórek HeLa należą: odkrycie szczepionki przeciwko polio, poznanie liczby i struktury chromosomów, odkrycie mechanizmów infekcji wirusa HIV, HPV i jego roli w transformacji nowotworowej, wykrycie telomerazy w komórkach HeLa. Klasyfikacja hodowli komórkowych ze względu na: a) b) pochodzenie komórek i okres prowadzenia hodowli: Hodowle pierwotne – hodowle komórek z materiału biologicznego pobranego bezpośrednio z organizmu: ze świeżo pobranych fragmentów tkanki/narządów i/lub zawiesiny powstałej w wyniku enzymatycznego rozproszenia tkanki. Jest to hodowla trwająca do pierwszego pasażu. Hodowle wtórne – hodowle komórek po pierwszym pasażu. fizjologiczne właściwości prowadzonej hodowli: Hodowle komórek adherentnych – hodowle komórek przylegających: • hodowle komórek rosnących w monowarstwie (2D) – hodowle, które wymagają pasażowania w momencie osiągnięcia konfluencji, czyli w momencie zajęcia przez komórki dostępnej przestrzeni do wzrostu. Zaliczamy do nich: 157 • • hodowle z wykorzystaniem standardowych naczyń hodowlanych (np. butelki hodowlane, szalki Petriego, płytki wielodołkowe) opłaszczonych warstwą adhezyjną naturalną (np.: kolagen) lub sztuczną (np. Nunclon™ Delta Surface). hodowle na mikronośnikach – hodowle prowadzone m.in. na kulkach dekstranowych, żelatynowych lub szklanych, które to zapewniają dużą powierzchnię wzrostu dla komórek przy małej objętości pożywki. Hodowle takie są często wykorzystywane w biotechnologii. Hodowle przestrzenne (3D) – hodowle, w których dochodzi do odtworzenia wzajemnych przestrzennych kontaktów między komórkami (wzrost komórek/tkanek w trójwymiarze). Zaliczamy do nich: • agregaty - zbudowane są z jednego/kilku typów komórek. Funkcjonalnie przypominają tkankę (posiadają macierz zewnątrzkomórkową i połączenia międzykomórkowe). Optymalna średnica agregatu wynosi 250 – 500 µm. • sferoidy – powstają z agregatów, które przekroczyły krytyczną średnicę: 500-800 μm. W sferoidach, komórki odtwarzają wzajemne połączenia i swoiste mikrośrodowisko, odpowiadające swoistym tkankom. Sferoidy można otrzymać metodą hodowli „wiszącej kropli” (na skutek grawitacji komórki z zawiesiny komórkowej opadają na dół wiszącej kropli), oraz w naczyniach rotacyjnych w wyniku stymulowania mikrograwitacji. • hodowle prowadzone na stelażach trójwymiarowych – 3D scaffold, tzw. rusztowaniach tkankowych czyli trójwymiarowych, mikroporowatych strukturach dzięki czemu umożliwiają wsparcie mechaniczne dla rozrastających się komórek, zapewniają również lepsze dostarczanie substancji odżywczych, jonów, antybiotyków, czy lepszą dyfuzję gazów. Praca z hodowlami komórkowymi wymaga sterylnych, kontrolowanych warunków, które gwarantują odpowiednio wyposażone laboratoria. Do podstawowego wyposażenia pracowni hodowli komórkowej należą:komora z laminarnym przepływem sterylnego powietrza, umożliwiająca pracę w warunkach sterylnych (rycina 1,2); inkubator CO2 pozwalający na utrzymanie stałych warunków, zarówno temperatury, wilgotności stężenia CO2 jak i pH (np. 37°C, 5% CO2); mikroskop świetlny (prześwietleniowy), odwrócony (do monitorowania komórek); licznik komórek/hemocytometr; lodówki, zamrażarki -20°C, -80°C – do przechowywania sterylnych odczynników, podłóż hodowlanych; naczynie Dewara z ciekłym azotem, zamrażarki -150°C do przechowywania zamrożonych komórek, przeciwciał itp.; lampy UV; system do oczyszczania wody; łaźnia wodna o temp. 36,5°C (do podgrzewania m.in. pożywek, odczynników, próbek biologicznych); wirówki, mieszadło magnetyczne, pH-metr, waga (z dokładnością przynajmniej 0,1 mg), miniwytrząsarki uniwersalne; autoklaw; drobny sprzęt laboratoryjny tj. naczynia hodowlane, pipety, skrobaczki (skrobaki), filtry itp. 158 a b d e c Rycina 1. Aparatura laboratoryjna wykorzystywana w pracy z hodowlami komórkowymi: a) System do oczyszczania wody; b) Naczynie Dewara; c) Licznik komórek; d) Komora laminarna; e) Zamrażarka niskotemperaturowa -150°C (fot. J. Kryczka) Rycina 2. Drobny sprzęt laboratoryjny: a) pipeta serologiczna, b) skrobaczka, c) filtr strzykawkowy, d) butelka hodowlana 75 cm2 , e) butelka hodowlana 25 cm2, f) płytka hodowlana 6-dołkowa, g) płytka hodowlana 12-dołkowa (fot. J. Kryczka) 159 Wymagania odżywcze i metabolizm komórek w hodowlach Pożywki hodowlane są źródłem m.in. składników odżywczych, budulcowych, substratów dla metabolizmu energetycznego, witamin. Poszczególne typy komórek mają swoiste wymagania odżywcze niezbędne do prawidłowego funkcjonowania. Środowisko hodowlane wymaga często suplementacji niektórych składników np. hormonów. Wyróżniamy dwa podstawowe typy pożywek hodowlanych: naturalne (m.in. limfa, osocze krwi, surowica, wyciąg zarodkowy) i o określonym składzie chemicznym (m.in. DMEM, RPMI, Fischera, F12). Do najważniejszych składników pożywek należą: węglowodany (najczęściej glukoza, galaktoza, fruktoza), aminokwasy, białka i lipidy – substancje odżywcze, energetyczne i budulcowe; surowica – zawiera czynniki i hormony stymulujące wzrost komórek; dzięki silnym właściwościom buforującym, neutralizuje substancje toksyczne, zapobiega zmianom środowiska (pH). sole mineralne – biorą udział w utrzymywaniu ciśnienia osmotycznego, potencjału błonowego; pełnią ważną funkcję w oddziaływaniu komórek z macierzą zewnątrzkomórkową (ang. extracellular matrix, ECM). Media hodowlane bywają wzbogacane o sole pierwiastków, które uczestniczą w usuwaniu wolnych rodników tlenowych np.: selen, miedź, cynk i żelazo,. witaminy – są kofaktorami enzymów komórkowych; zazwyczaj do pożywek dodaje się witaminy z grupy B: ryboflawina, biotyna, tiamina. antybiotyki (penicylina, streptomycyna, chloramfenikol, mykostatyna) – działają przeciwbakteryjnie i przeciwgrzybicznie. Oddychanie komórek hodowlanych zachodzi głownie na drodze glikolizy rzadziej na drodze cyklu kwasu cytrynowego (bez udziału tlenu; w inkubatorze przeznaczonym do hodowli komórek stężenie CO2 wynosi 5 – 10%). Tempo metabolizmu świeżo wyizolowanych komórek jest stosunkowo szybkie, jednakże z upływem czasu trwania hodowli spada. Etapy prowadzenia hodowli komórkowych: 1. Inicjowanie hodowli komórkowych (izolacja komórek) 2. Hodowla komórkowa (liczenie komórek, pasażowanie, sporządzanie zawiesin o określonej gęstości komórek). 3. Prowadzenie doświadczeń/ przechowywanie komórek (mrożenie) Przed rozpoczęciem hodowli komórkowych podejmujemy decyzję, jaki materiał wykorzystamy w badaniach: z tkanki bezpośrednio pobranej od pacjenta bądź z ogólnodostępnych banków komórek tj. ECACC (European Collection of Authenticated Cell Cultures), ATCC (American Type Culture Collection). Banki komórek (ECACC, ATCC) oferują szeroki wachlarz linii komórkowych prawidłowych i nowotworowych pochodzących z różnych narządów i reprezentujących odmienne właściwości (przykłady w tabeli 1). 160 Tabela 1. Charakterystyka wybranych nowotworowych linii komórkowych. Linia komórkowa Pochodzenie Morfologia Charakterystyka Komórki nowotworowe nabłonka gruczołowego płuc wyizolowane od 58letniego mężczyzny rasy kaukaskiej Komórki epitelialne, adherujące do podłoża Zdolne do syntezy lecytynę i zawierają wysoki poziom nienasyconych kwasów tłuszczowych LNCaP Komórki nowotworowe pochodzące z lewego węzła chłonnego wyizolowane od 50-letniego mężczyzny rasy kaukaskiej Komórki epitelialne, adherujące do podłoża Charakteryzują się powolnym wzrostem PC3 Komórki nowotworowe pochodzące z nowotworu przerzutowego do kości wyizolowane od 62-letniego mężczyzny rasy kaukaskiej Komórki androgenoniezależne Charakteryzują się dużą inwazyjnością MeWo Komórki nowotworowe pochodzące z węzła chłonnego wyizolowane od 78letniego mężczyzny rasy kaukaskiej Fibroblasty, adherujące do podłoża Produkują melaninę HeLa Komórki nowotworowe pochodzące z tkanki nabłonkowej szyjki macicy wyizolowane od 31-letniej Afroamerykanki Komórki epitelialne, adherujące do podłoża Charakteryzują się wybitnie szybkim tempem proliferacji A549 Linia komórkowa powstaje z hodowli pierwotnej (po pierwszym pasażu). W czasie wzrostu komórki adherentne (komórki przylegające do powierzchni naczynia hodowlanego), namnażają się w monowarstwie, zagęszczają się stopniowo, zapełniając powierzchnię wzrostu podłoża hodowlanego (rycina 3). Linia komórkowa o dużym zagęszczeniu komórek (80% konfluencji), szybko zużywa składniki odżywcze obecne w medium hodowlanym, dlatego też, wymaga ona szybkiego przepasażowania. Komórki powinno się pasażować przed osiągnięciem pełnej konfluencji, ponieważ dochodzi wówczas do kontaktowego zahamowania wzrostu. Rycina 3. Hodowla linii komórkowej A549: a) konfluencja około 60%, b) konfluencja 100% (fot J. Kryczka) 161 Pasażowanie komórek przylegających do podłoża polega na oderwaniu i przeniesieniu części komórek do następnego naczynia hodowlanego. W tym celu stosuje się zazwyczaj enzym - trypsynę w stężeniu 0,025%-0,5%, który trawi białka adhezyjne umożliwiające komórkom przyczepianie się do dna i ścianek naczynia. Proces trypsynizacji przeprowadza się w 37ᵒC przez 3-5 min lub w temperaturze pokojowej przez 5-10 min. Czas inkubacji komórek z trypsyną jest niezwykle istotny, ponieważ enzym ten należący do endopeptydaz serynowych, które trawią również białka błony komórkowej, prowadząc do rozpadu komórek. W następnym etapie zawiesinę komórek rozcieńcza się w określonym stosunku i przenosi do nowego (sterylnego) naczynia hodowlanego zawierającego świeże medium hodowlane. W celu zahamowania aktywności trypsyny do nowej pożywki dodaje się inhibitory tego enzymu. Po kilku/kilkunastu godzinach od pasażowania komórki ulegają ponownej adhezji do powierzchni naczynia hodowlanego. Do określenia dokładnej liczby komórek w hodowli wykorzystuje się komory do liczenia komórek np. komorę Bürkera. Po trypsynizacji odpowiednią objętość zawiesiny komórek wybarwia się barwnikiem – 0,4% błękitem trypanu, a następnie nanosi się na komorę Bürkera. W trakcie prowadzenia hodowli komórkowej dochodzi do samoistnej selekcji komórek o większej sile proliferacyjnej. Zazwyczaj po trzecim pasażu, linia staje się stabilna. W 1965 r. Leonard Hayflick wykazał, że prawidłowe ludzkie fibroblasty płucne wykazują określoną liczbę podziałów. Maksymalną liczbę podziałów komórkowych nazwano — od nazwiska odkrywcy — limitem Hayflika. Po przekroczeniu limitu Hayflika komórki ulegają apoptozie (tzw. proces programowanej śmierci komórki). Natomiast im bliżej limitu, komórki wykazują zmiany fenotypowe (powiększenie rozmiarów, spłaszczenie, utrata kształtu) powodujące upośledzenie ich funkcji np. zdolności wydzielania określonych substancji. Według aktualnego stanu wiedzy uważa się, że replikacyjne starzenie się komórek (z wyczerpania limitu podziałowego) jest związane ze skracaniem się i zmianami budowy telomerów natomiast starzenie przyspieszone – z indukującym je wpływem czynników środowiskowych. Do najważniejszych czynników środowiskowych odpowiadających za starzenie komórek należy stres oksydacyjny. Proces starzenia się jest odpowiedzią komórek na rozległe i zazwyczaj nienaprawialne uszkodzenia DNA. Linie komórkowe pierwotnych komórek (wyprowadzenie z komórek prawidłowych) mają ograniczoną liczbę podziałów komórkowych (liczbę pokoleń hodowli). Ilość pasaży odzwierciedla liczbę pokoleń linii komórkowej. Zwykle komórki w hodowli osiągają od 20 do 80 pokoleń, potem linia komórkowa zamiera. Czas życia komórek w hodowli zależy m. in. od wieku organizmu, z którego komórki były pobrane oraz od rodzaju tkanki, z której pochodzą. Dodatkowym czynnikiem są warunki hodowli. Istnieją również linie komórkowe o nieograniczonym czasie życia (linie ciągłe) - głównie linie komórek nowotworowych, które mają nieograniczoną liczbę podziałów komórkowych i które można pasażować nieskończoną ilość razy. 162 Rycina 4. Etapy zakładania hodowli komórkowej. Komórki, a także tkanki, embriony, nasiona roślin można przechowywać zamrożone w ciekłym azocie w temperaturze między -79°C a -196°C (tzw. krioprezerwacja). W takich warunkach procesy metaboliczne komórek ustają (procesy biochemiczne w -130oC, metaboliczne w -196oC), a uszkodzenia są zminimalizowane. Stosowane procedury zamrażania i rozmrażania różnią się nieco w zależności od rodzaju materiału biologicznego, ale wszystkie zachowują pewne ogólne zasady. Najważniejszą z nich jest zasada: powolnego zamrażania i szybkiego rozmrażania komórek. Szybkość zamrażania komórek powinna być na tyle wolna, aby pozwolić na dehydratację komórki. Jednocześnie na tyle szybka, żeby zabezpieczyć komórki przez uszkodzeniami wynikającymi z dehydratacji. Zbyt duże odwodnienie komórek może powodować wytrącanie się zagęszczonych składników cytozolu, wypadanie jonów, wysalanie białek, zmianę pH oraz wiele innych, niekorzystnych zjawisk. W czasie zamrażania komórek szczególnie szybko powinno przejść się przez zakres temperatur od – 2 do – 5oC, ponieważ wówczas tworzą się kryształy lodu mechanicznie uszkadzające komórki. Doświadczalnie wykazano, że w czasie zamrażania komórek optymalnie temperatura (zapewniająca najlepszą żywotność po rozmrożeniu) powinna spadać z szybkością 1 – 3oC na minutę. Takie tempo mrożenia uzyskuje się dzięki zastosowaniu specjalnych pojemników do zamrażania materiału biologicznego wypełnionych alkoholem izopropylowym lub formaldehydem. Dodatkowo komórki, które mają zostać zamrożone powinny znajdować się w fazie logarytmicznego wzrostu oraz nie powinny być zainfekowane mikrobiologicznie. W celu uniknięcia zniszczenia komórek/organelli komórkowych na skutek tworzących się kryształów, do mrożenia komórek stosuje się bufory z dodatkiem krioprotektantów tj. glicerolu lub DMSO (dimetylosulfotlenek). DMSO (w stężeniu 5 do 15 % v/v) jest częściej stosowany w takich buforach ze względu na jego łatwość penetracji komórek, jednak przechowywanie komórek w buforach z jego dodatkiem w temperaturze powyżej 4ᵒC wywołuje efekt toksyczny. Ważne jest, żeby komórki w środowisku suplementowanym DMSO były jak najszybciej przeniesione do temperatury mrożenia. Fazy wzrostu komórek w hodowli FAZA LAG (faza adaptacji komórek) – faza zaczyna się bezpośrednio po wysianiu komórek na podłoże. W tym czasie komórki odbudowują glikokaliks (warstwa zewnętrzna błony komórkowej), który uległ 163 uszkodzeniu podczas procesu trypsynizacji. Komórki rozpłaszczają się i ulegają adhezji do podłoża (w procesie uczestniczy cytoszkielet). W tej fazie wzrostu hodopwli komórki nie dzielą się, a nawet często dochodzi do zmniejszenia ich liczby, gdyż część komórek uszkodzonych obumiera. Komórki w tym okresie wchodzą w fazę G1 cyklu komórkowego. FAZA LOG (faza logarytmicznego wzrostu komórek) – okres intensywnego wzrostu liczby komórek. Komórki dzielą się dynamicznie (stają się okrągłe i odrywają się od podłoża, a po podziale ponownie się przyczepiają). Faza ta kończy się osiągnięciem stanu konfluencji (zazwyczaj jednym lub dwoma podwojeniami populacji komórek). Cechami charakterystycznymi fazy log jest duża żywotność i wysokie tempo metabolizmu komórek. Długość tej fazy zależy od gęstości wysianych komórek. FAZA PLATEAU (faza stacjonarna) - czas, w którym komórki osiągają konfluencję, dochodzi do kontaktowego zahamowania wzrostu (tyle samo komórek proliferuje, co obumiera). Faza ta charakteryzuje się szybkim wykorzystaniem składników medium. FAZA UTRATY KOMÓREK – faza, w której komórki obumierają z powodu braku dostępnych składników odżywczych, gromadzenia się toksycznych produktów metabolizmu komórkowego, a w konsekwencji obniżenia pH środowiska. Transformacja i immortalizacja komórek Uzyskanie stałej linii komórkowej zabezpiecza dostęp do niezmiennego genotypowo i fenotypowo materiału badawczego, który w przyszłości można wykorzystać w kolejnych badaniach. Stan immortalizacji, czyli inaczej „nieśmiertelności” to nabycie przez komórkÍ zdolności do nieograniczonej liczby podziałów. Unieśmiertelnienie komórek może zachodzić w sposób spontaniczny lub indukowany. Komórki immortalizowane często są używane jako doskonałe modele badawcze dla opracowywania nowych metod diagnostycznych i strategii leczenia nowotworów. Zbyt duże zagęszczenie komórek w hodowli linii komórek prawidłowych może prowadzić do niestabilności genetycznych, czego konsekwencją są spontaniczne transformacje. Jeżeli w odpowiednim czasie linia komórkowa nie zostanie przepasażowana, wówczas komórki osiągają zbyt dużą gęstość i przestają podlegać zahamowaniu kontaktowemu. Komórki zaczynają rosnąć warstwowo, tworząc kolonie. Następuje utrata kontroli wzrostu komórek - immortalizacja (unieśmiertelnienie), jest to istotna faza rozwoju komórek nowotworowych. Jednakże w hodowlach pierwotnych taka immortalizacja spontaniczna występuje bardzo rzadko.Przykładem jest linia HMT-3522, wyizolowana z hodowli pierwotnej nabłonka gruczołu mlekowego człowieka. Jednakże hodowla ta została wyprowadzona z tkanek nie w pełni zdrowych, od kobiety z mastrofią (dysplazja włóknisto-torbielowata sutka). Transformację indukowaną w hodowli in vitro można wywołać przez traktowanie linii komórkowych kancerogennymi związkami chemicznymi i/lub promieniowaniem jonizującym oraz poprzez transfekcję onkogenami tj. antygenem-T wirusa SV-40 (Simian virus-40), adenowirusem E1A i E1B, zmutowanym onkogenem p53, onkogenem ha-ras czy poly T-antygenem. Onkogen SV-40 T-anty jest jednym z najczęściej wykorzystywanych induktorów w procesie immortalizacji komórek. Koduje on antygen T, mający zdolność łączenia się w nieaktywne kompleksy z białkiem p53, przez co kompleks ten traci zdolność hamowania cyklu komórkowego czy też indukcji apoptozy. Wprowadzenie SV40 powoduje pojawienie się transformowanego fenotypu komórek. Inną metodą unieśmiertelnienia jest wprowadzenie wirusa HPV do komórek nabłonka. Skutkuje to aktywacją onkogenów E6 i E7, których działanie powoduje zmianę ekspresji regulatorów cyklu komórkowego tj. białka p53 i Rb9 (retinoblastomy). Innym sposobem jest wymuszenie ekspresji genu telomerazy poprzez wprowadzenie genu hTERT, który koduje podjednostkę katalityczną telomerazy, lub wyciszenie ekspresji genu kodującego białko 14-3-3 sigma, które jest negatywnym regulatorem cyklu komórkowego. 164 Hodowle komórkowe można wyprowadzić z różnych materiałów biologicznych pochodzenia zwierzęcego/ludzkiego m.in. z tkanek prawidłowych/nowotworowych np. pobranych podczas zabiegów operacyjnych, z komórek śródbłonka naczyń żyły pępowinowej podczas porodu. Korzyściami wynikającymi z zastosowania tego rodzaju materiału jest szybki wzrost komórek, intensywnie zachodzące podziały komórkowe oraz podobieństwo funkcjonalne do komórek zdrowych. Zalety i ograniczenia prowadzenia hodowli komórek Zalety prowadzenia hodowli komórek 1. Łatwa kontrola środowiska hodowlanego (pH, temperatura, ciśnienie tlenu i dwutlenku węgla, ciśnienie osmotyczne), 2. Możliwość bezpośredniego prowadzenia badań na materiale biologicznym, 3. Możliwość bezpośredniego badania in vitro interakcji, właściwości i funkcji komórek wchodzących w skład tkanek/narządów, 4. Możliwość powtarzania, odtwarzania wyników badań, 5. Niskie koszty prowadzenia badań (w porównaniu do modeli zwierzęcych), 6. Łatwy do pozyskania materiał (banki komórek oferują komórki pochodzące z różnych typów tkanek, z różnych organizmów). Ograniczenia hodowli komórkowych: 1. Konieczność pracy w ściśle sterylnych warunkach (materiał bardzo wrażliwy na zakażenia), 2. Niedokładne odwzorowanie środowiska in vivo (składniki mikrośrodowiska, interakcje pomiędzy komórkami różnych typów), 3. Brak stabilności genetycznej, 4. Konieczność stosowania dodatkowych substancji odżywczych czy ochronnych np. antybiotyków. Przykłady zastosowań hodowli komórkowych Hodowle komórkowe stały się podstawowym narzędziem pracy w wielu dziedzinach badań, z zakresu biologii molekularnej, biotechnologii, immunologii i wielu innych. Przykłady zastosowań hodowli komórkowych: badanie wpływu różnych związków chemicznych na komórki np. badanie cytotoksyczności związków chemicznych i oporności na chemioterapeutyki, badanie cytotoksyczności związków chemicznych i oporności na chemioterapeutyki (ocena wpływu różnych związków chemicznych na komórki), badanie markerów inwazyjności w komórkach nowotworowych, badanie wpływu inhibitorów na cykl komórkowy. badanie mechanizmów przerzutowania (mechanizmów kontrolnych cyklu komórkowego, badania oddziaływań międzykomórkowych), otrzymywanie przeciwciał monoklonalnych, produkcja szczepionek, insuliny, interferonu czy hormonu wzrostu, namnażanie wirusów w celu diagnozowania zakażeń wirusowych. 165 CZĘŚĆ PRAKTYCZNA DOŚWIDCZENIA I. Rozdział elektroforetyczny produktów PCR. Rozdział elektroforetyczny Techniki elektroforetyczne stosowane są do rozdziału cząsteczek (białek, DNA) na podstawie szybkości (zależna od ładunku i masy cząstek) poruszania się ich w polu elektrycznym. Cząsteczki DNA w buforach o pH bliskim neutralnego obdarzone są ładunkiem ujemnym i poruszają się w stronę anody (dodatniej elektrody). Techniki te umożliwiają ustalenie wielkości analizowanych cząstek, ustalenie degradacji preparatu oraz określenie ewentualnych zanieczyszczeń takich jak inne białko czy RNA. Do rozdziału kwasów nukleinowych wykorzystuje się dwa typy żelów: agarozowy i poliakrylamidowy. W obu przypadkach gęstość żelu dobiera się w zależności od wielkości analizowanych cząsteczek (tj. w zależności od ich masy cząsteczkowej). Elektroforeza poliakrylamidowa (PAGE) służy do rozdzielania małych cząstek, przede wszystkim białek i kwasów nukleinowych (5 –1000 pz). Żel poliakrylamidowy jest popularny w biologii molekularnej ze względu na dobre właściwości optyczne, obojętność elektryczną (brak grup naładowanych elektrycznie), możliwość uzyskania różnego stopnia porowatości. Elektroforeza na żelu agarozowym pozwala na rozdział fragmentów o wielkości nawet do 20 kpz. Agaroza to frakcja agaru pochodzącego z krasnorostów. Jest to polisacharyd zbudowany z około 800 reszt galaktozy. Rozpuszcza się łatwo w wodzie i pozostaje w postaci płynnej do około 40°C, co pozwala na łatwe operowanie roztworem i tworzenie żeli o wybranych rozmiarach. Stosując różne stężenia roztworów agarozy można regulować porowatość żelu a przez to stopień rozdziału w zależności od rozmiaru rozdzielanych cząstek. „Wizualizacja” rozdzielonych frakcji – „prążków” dokonuje się z wykorzystaniem odpowiednich barwników, najczęściej fluorescencyjnych. Najpopularniejszym jest bromek etydyny, który umożliwia wizualizację już nawet 10 ng DNA. Niestety, wykazuje on silne właściwości mutagenne i kancerogenne. Obecnie, wykorzystuje się barwniki fluorescencyjne (SYBR), które nie wykazują tak dużej szkodliwości. Rozdział elektroforetyczny wykorzystuje się w eksperymentach z zakresu biologii molekularnej takich jak: sekwencjonowanie, foot-printing (technika umożliwiająca badanie oddziaływań DNA–białko), analizy produktów PCR, diagnostyka parazytologiczna, diagnostyka mykologiczna. WYKONANIE Materiały i odczynniki: - żel agarozowy, - bufor TBE, - bufor obciążający (obciążnik), - produkt PCR przygotowany na wcześniejszych zajęciach . - parafilm. Sprzęt i aparatura: - aparat do elektroforezy, - pipety, - rękawiczki, Protokół doświadczenia: 166 1. Umieścić żel agarozowy w aparacie. 2. Zalać żel buforem TBE (żel nie może być całkowicie zalany). 3. Nałożyć na żel wzorzec 5 µl (przed nałożeniem wymieszać na parafilmie 3 µl wzorca i 1,5 µl buforu obciążającego). 4. Nałożyć na żel badane próbki 6,5 µl (przed nałożeniem wymieszać na parafilmie 5 µl badanej próbki i 1,5 µl obciążnika). 5. Zalać buforem TBE żel, tak aby cały był przykryty w całości. 6. Uruchomić elektroforezę na około 30-40 minut. Wyniki: Wnioski: Podpis prowadzącego ……………………………………… Data Ilość punktów……………………….. 167 ZADANIA DO SAMOKSZTAŁCENIA 1. Wyróżniamy różne systemy hodowli tkanek lub komórek, w zależności od ich naturalnych zdolności do wzrostu. Dopasuj nazwy typów hodowli do opisu: I. Hodowle w zawiesinie II. Hodowle komórek adherentnych III. Hodowle pierwotne IV. Hodowle wtórne A. Hodowle komórek po pierwszym pasażu. B. Hodowle komórek z materiału biologicznego pobranego bezpośrednio z organizmu. C. Hodowle komórek, których wzrost jest niezależny od adhezji do podłoża. D. Hodowle z wykorzystaniem standardowych naczyń hodowlanych (np. butelki hodowlane, szalki Petriego, płytki wielodołkowe) opłaszczonych warstwą adhezyjną naturalną (np.: kolagen) lub sztuczną (np. Nunclon™ Delta Surface). I II III IV 2. Czym jest trypsynizacja? Jaka substancja odgrywa rolę w tym procesie? Czemu służy proces trypsynizacji? Trypsynizacja 3. W trakcie starzenia się komórki macierzyste podlegają określonym zmianom morfologicznym i funkcjonalnym. Zdecyduj, czy wymienione poniżej procesy ulegają zwiększeniu czy obniżeniu. Wstaw odpowiednio znak ↑ lub ↓: Poziom ekspresji genów związanych z metabolizmem komórki; Ekspresja genów kodujących białka odpowiedzialne za przyleganie komórek; Zdolność naprawy DNA; Wielkość komórki; Potencjał do różnicowania; Zdolności regeneracyjne; Tendencja do transformacji nowotworowej 4. Wymień możliwości badań jakie oferuje model tkankowy, np. model mięśnia sercowego: 1. 2. 3. 4. 5. 168 5. W zależności od odległości od środka sferoidu obserwuje się gradientowy rozkład stężenia metabolitów (np. mleczanu) i substancji odżywczych (glukoza, tlen). Z tym zjawiskiem wiążą się efekty działania chemioterapeutyków, które są niejednorodne w obrębie struktury sferoidu. W poniższych zdaniach podkreśl właściwy wyraz: W coraz głębszych warstwach sferoidu obserwuje się: a) wzrastające/malejące stężenie składników odżywczych b) wzrastające/malejące stężenie tlenu c) wzrastające/malejące stężenie mleczanu d) wzrastające/malejące tempo proliferacji e) wzrastające/malejące stężenie podawanych leków. LITERATURA 1. Olszewska-Słonina DM, Drewa TA, Styczyński J, Czajkowski R. 2006. Hodowla komórek, inżynieria tkankowa i medycyna regeneracyjna. Część II. Wiadomości lekarskie59(9-10): 732737. 2. Stokłosowa S. red. Hodowla komórek i tkanek. Wydawnictwo Naukowe PWN, Warszawa, 2011. 3. Genetyka Medyczna G. Drewa, Edra Urban &Partner, Wrocław 2011. rozdział 27.3 4. Genetyka Krótkie wykłady- H. Fletcher, I. Hickey, Warszawa 2010, Wydawnictwo PWN, sekcja E- Technologia rekombinacji DNA (E.1 - Techniki Badania DNA, E.2 Techniki badania RNA) 169 Część Genetyka medyczna Ćwiczenie 1 Temat: Genetyka mendlowska - wybrane cechy allelomorficzne i układy grupowe krwi. Doświadczenia 1. Heteroaglutynacja erytrocytów człowieka surowicą końską. 2.Wykrywanie antygenu A układu ABO na powierzchni erytrocytów człowieka z zastosowaniem fitoaglutynin z nasion Dolichos biflorus – określanie podgrupy w obrębie grupy A. 3. Wykrywanie substancji grupowej układu ABO w ślinie 4. Wykrywanie antygenu D układu Rh na powierzchni erytrocytów człowieka. Zadania genetyczne Zakres materiału do przygotowania przed zajęciami Podstawowe pojęcia genetyczne: gen, kwasy nukleinowe (DNA, RNA – rodzaje, funkcje), kod genetyczny. Replikacja, transkrypcja, translacja. Antygen, przeciwciało. Zasady dziedziczenia cech monogenowych: I i II prawo Mendla (dominacja, kodominacja). Wybrane choroby autosomalne monogenowe: anemia sierpowata, mikrosferocytoza, fenyloketonuria, alkaptonuria, albinizm - zasady dziedziczenia, charakterystyczne objawy. Układy grupowe krwi (podstawowe informacje): AB0, Rh Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć: Współdziałanie genów (epistaza, plejotropia, komplementacja, penetracja, poligeny), Choroby monogenowe człowieka – charakterystyka, diagnostyka, leczenie. Układy grupowe krwi człowieka – zasady dziedziczenia, antygeny i ich identyfikacja, konflikt serologiczny – przyczyny choroby hemolitycznej noworodka. Genetyczne podstawy krwiolecznictwa. Przeciwciała monoklonalne: definicja, zastosowanie. Rodowody: definicja, zasady tworzenia, zastosowanie. Zadania genetyczne: cechy monogenowe, grupy krwi, rodowody. 171 CZĘŚĆ TEORETYCZNA Genetyka mendlowska Definicje Dominacja zupełna Sytuacja, gdy w obecności allelu dominującego nie ujawni się cecha determinowana przez allel recesywny, a w efekcie fenotyp heterozygoty będzie taki sam jak homozygoty dominującej. Dominacja niezupełna Sytuacja, gdy allel dominujący nie maskuje w pełni efektów ekspresji allelu recesywnego (w fenotypie heterozygot ujawnia się cecha pośrednia między cechą homozygoty dominującej, a cechą homozygoty recesywnej). Kodominacja (współdominowanie) Polega na występowaniu alleli, które nie są związane stosunkiem dominacja – recesywność. Produkty tych alleli są wytwarzane jednocześnie i niezależnie, każdy z alleli ma odbicie w fenotypie. Poligeny (geny kumulatywne, polimeryczne) Należą do różnych par alleli, zajmując różne loci na chromosomach. Wpływają na wytworzenie tej samej cechy. Efekty ich działania się sumują. Epistaza – geny epistatyczne i hipostatyczne Zjawisko kiedy produkt ekspresji jednego z genów (gen epistatyczny) wpływa na ujawnienie fenotypowe innego, nieallelicznego genu (hipostatycznego). Plejotropia Zjawisko, które polega na warunkowaniu przez jeden gen kilku pozornie nie związanych z sobą cech fenotypowych (np. produkt genu plejotropowego reguluje kilka szlaków metabolicznych). Poligenia Cecha jest determinowana przez kilka/kilkadziesąt/klikaset różnych genów. Sprzężenia genów Tendencja alleli genów do przechodzenia razem w kolejnych pokoleniach, co wynika z położenia genów na tym samym chromosomie (ich loci są synteniczne); odległość jaka je dzieli jest na tyle mała, że prawdopodobieństwo wystąpienia rekombinacji – θ (theta) jest niskie θ<0,05. • Ekspresywność zmienna (różnorodna) Określa, w jakim stopniu cecha determinowana przez określony układ alleli w danym locus, ujawnia się fenotypowo, w efekcie osobniki o tym samym genotypie wykazują zróżnicowane nasilenie cechy uwarunkowanej przez ten gen (np. wskutek zmian polimorficznych w regionach niekodujących genu). Penetracja (przenikliwość) genu Jest częstością, z jaką dany gen (allel) dominujący lub allele recesywne w układzie homozygotycznym ujawniają się w fenotypie. 172 Allele wielokrotne Występowanie więcej niż dwóch form/odmian genu leżących w tym samym locus na chromosomach homologicznych; w danym organizmie mogą występować tylko dwa allele, natomiast w puli genowej populacji może być ich wiele. • Allele letalne Gen (allel) powodujący śmierć organizmu; allel letalny dominujący wywołuje śmierć homozygot dominujących i heterozygot; allel letalny recesywny powoduje śmierć homozygot recesywnych. • Fenokopia Wywołane przez środowisko naśladowanie cechy/choroby uwarunkowanej genetycznie. Podstawy współczesnej genetyki stanowią prace Grzegorza Mendla, który w 1866 r. opublikował wyniki swoich obserwacji grochu zwyczajnego (Pisum sativum) w artykule „Badania nad mieszańcami roślin” i zaproponował teorię jednostek dziedziczenia. Sformułował on zasady dziedziczności określane jako prawa Mendla (reguły): I - prawo czystości gamet, II - prawo niezależnej segregacji alleli. Jednostki dziedziczenia, dziś nazywane genami, mogą występować w dwóch formach - allelach (genach allelomorficznych) leżących w tym samym locus (miejscu) na chromosomach homologicznych. Komórki somatyczne zawierają jedną parę takich alleli na każdą cechę, natomiast komórki generatywne zawierają po jednym z alleli. Cechy warunkowane jedną parą alleli genów na chromosomach nazywane są cechami jednogenowymi (monogenowymi, mendlowskimi). U człowieka takimi cechami są liczne choroby, dziedziczące się dominująco lub recesywnie - autosomalnie bądź sprzężone z chromosomem X lub Y. Badania genetyczne prowadzone przez wielu uczonych w kolejnych latach doprowadziły do sformułowania chromosomowej teorii dziedziczności (T. Morgan i wsp., 1915), poznania genów kumulatywnych (Nilsson-Ehle, 1908), interakcji między genami nieallelicznymi np. epistaza, hipostaza, komplementacja, oraz zjawisk: kodominacja, niepełna dominacja, allele wielokrotne, plejotropia, sprzężenie genów, zróżnicowana ekspresja i penetracja genów, dziedziczenie mitochondrialne. Proste przełożenie jednego genu na jedną cechę fenotypową (jak u Mendla) zdarza się rzadko. Na powstanie wielu cech wpływają interakcje wielu różnych genów. Powstają złożone sieci współzależności – złożoność budowana przez oddziaływania i kombinacje, a nie liczbę elementów składowych. Ogólnie, mówiąc o relacjach między genami i o kształtowaniu cech fenotypowych można założyć, że istnieje różnorodne współdziałanie pomiędzy genami: 1.alleliczne (współdziałanie alleli z jednego locus): dominacja zupełna, dominacja niezupełna, kodominacja, naddominowanie, 2. niealleliczne (współdziałanie niezależnych par alleli z różnych loci, które niejako wspólnie kształtują daną cechę: komplementarność, epistaza, poligenia. Oznaczenia stosowane w analizach genetycznych: P – Parentes (łac. rodzice); pokolenie rodzicielskie, rodzice w sensie genetycznym: osobniki linii czystych wykazujące przeciwstawne cechy; homozygoty przeciwstawne: dominująca i recesywna; F1 – Filius, Filia (łac. syn, córka; liczba mnoga filii – dzieci, potomkowie); pierwsze pokolenie mieszańcowe; heterozygoty; F2 – drugie pokolenie mieszańcowe; Fn – dalsze pokolenia. Oznaczenia genów: para genów allelomorficznych: np. A – allel dominujący, a – allel recesywny; 173 Zapis genotypu: homozygota dominująca: AA lub A/A lub heterozygota Aa lub A/a lub ; recesywna aa lub a/a lub ; ; zapis dwu genów położonych na różnych chromosomach AA BB lub A/A B/B lub ; zapis dwu różnych genów na tym samym chromosomie (geny sprzężone): homozygota w obu parach genów AB/AB lub ; ab/ab, (układ powiązania genów); o także Ab/Ab, - ; aB/aB, heterozygota w obu parach genów AB/ab lub (układ odpychania genów); ; także Ab/aB, Krzyżówki mendlowskie (tabela 1): krzyżówka Parentes AA x aa krzyżówka F1 Aa x Aa krzyżówki wsteczne (odwrotne): osobnik z pokolenia P krzyżuje się z osobnikiem z pokolenia F1: AA x Aa oraz aa x Aa (testowa); krzyżówka testowa to krzyżówka osobnika wykazującego cechę dominującą z homozygotą recesywną (aa), w celu wykazania genotypu osobnika dominującego: wynik krzyżówki AA x aa to 100% dominujących, czyli krzyżówka Parentes, natomiast wynik krzyżówki Aa x aa to 50% osobników dominujących i 50% recesywnych – to jest krzyżówka testowa. Tabela 1. Dziedziczenie zgodnie z prawami Mendla – typy krzyżówek. Krzyżówka Parentes (P) AA gamety A A pokolenie pierwsze (F1) Aa Aa x aa a Aa a Aa 100% potomstwa z cechą dominującą fenotyp Krzyżówka typu F1 Aa x gamety A a pokolenie drugie (F2 ) AA Aa Aa rozkład genotypowy 1 2 rozkład fenotypowy 3 75% potomstwa z cechą dominującą , 25% - z cechą recesywną Aa A a aa 1 1 Wybrane cechy chorobowe człowieka dziedziczące się monogenowo (jednogenowo). Cechy monogenowe (zwane mendlowskimi) - są uwarunkowane jedną parą alleli. Cecha dominująca, jest uwarunkowana allelem dominującym, który ujawnia się u wszystkich heterozygotycznych osobników w pokoleniu F1, po skrzyżowaniu dwóch homozygotycznych linii (dominującej i recesywnej). Cecha recesywna, uwarunkowana allelem recesywnym jest maskowana przez cechy dominujące, nie ujawnia się w pokoleniu F1. 174 Sferocytoza wrodzona (HS - ang. hereditary spherocytosis, łac. anaemia haemolytica microspherocytica congenita), Mikrosferocytoza wrodzona, choroba Minkowskiego-Chauffarda, wrodzona niedokrwistość sferocytowa). Jest najczęstszą wrodzoną niedokrwistością hemolityczną, częstość 1:5000 (w Europie Północnej częstość występowania ok. 1:1000 urodzeń). Wywołana jest mutacjami w genach kodujących białka błony komórkowej erytrocytów, powodującymi niedobory ilościowe lub nieprawidłową budowę spektryny - głównego elementu szkieletu błonowego. Podłożem molekularnym dziedzicznej sferocytozy są, poza mutacjami spektryny α i spektryny β, także mutacje w genach kodujących inne białka szkieletu błony erytrocytu. W zależności od rodzaju mutacji choroba ta może być dziedziczona w sposób autosomalny recesywny (25% przypadków, gorsze rokowanie, cięższy przebieg kliniczny,) albo autosomalny dominujący (75% przypadków, lepsze rokowanie, łagodniejszy przebieg kliniczny). W przebiegu sferocytozy wrodzonej, w wyniku zaburzonej stabilności dwuwarstwowej błony erytrocytu, we krwi obwodowej obok normocytów występują sferocyty, charakteryzujące się: kulistym kształtem, małą średnicą ( ok. 2/3 średnicy normocytów), mniejszym stosunkiem powierzchni do objętości krwinki, większą zawartością hemoglobiny, zmniejszoną opornością osmotyczną krwinek, krótszym czasem życia. Sferocyty niszczone są w śledzionie, co jest przyczyną splenomegalii, niedokrwistości hemolitycznej i zwiększonego stężenia bilirubiny w surowicy. Częstym powikłaniem mikrosferocytozy wrodzonej jest kamica pęcherzyka żółciowego. W ciężkiej postaci sferocytozy wrodzonej (ok. 5% przypadków) występują zaburzenia rozwojowe kośćca (najbardziej typowe: czaszka wieżowata, podniebienie gotyckie). Choroby metaboliczne W organizmie człowieka procesy biochemiczne są katalizowane przez enzymy, które wykazują zmienność aktywności wynikającą ze zmian w materiale genetycznym. W efekcie może następować zablokowanie szlaku metabolicznego (blok metaboliczny) z nagromadzeniem substratu lub produktu pośredniego, braku produktu końcowego. Dotyczy to np. węglowodanów (galaktozemia, wrodzona nietolerancja fruktozy), aminokwasów (hiperfenyloalaninemie, tyrozynemia, choroba syropu klonowego), lipidów (hiperlipoproteinemie). Wynikiem zaburzenia przemiany aminokwasów aromatycznych może być: fenyloketonuria, tyrozynemia, alkaptonuria czy albinizm. Hiperfenyloalaninemie - defekty w metabolizmie fenyloalaniny (Fen) W obrębie hiperfenyloalaninemii powodowanej mutacjami w genie PAH – gen hydroksylazy fenyloalaninowej (ang. phenylalanine hydroxylase), wyróżnić można trzy podstawowe postacie kliniczne charakteryzujące się różną aktywnością hydroksylazy fenyloalaninowej i różnymi stężeniami fenyloalaniny we krwi: fenyloketonurię klasyczną o ostrym przebiegu, fenyloketonurię o łagodnym przebiegu, łagodną hiperfenyloalaninemię. Nietypowe postacie fenyloketonurii wynikają z niedoboru kofaktora hydroksylacji wspólnego dla 3 aminokwasów: fenyloalaniny, tyrozyny i tryptofanu. W 97% przypadków u podłoża fenyloketonurii leżą mutacje punktowe (ponad 460 mutacji) genu zlokalizowanego na długim ramieniu 12 chromosomu (12q23.3), odpowiedzialnego za całkowity lub częściowy brak aktywności PAH, enzymu wątrobowego, który katalizuje przemianę fenyloalaniny do tyrozyny. W 3% przypadków fenyloketonurii, defekt dotyczy 175 enzymów związanych z syntezą lub regeneracją niebiałkowego kofaktora reakcji przekształcania fenyloalaniny w tyrozynę - tetrahydrobiopteryny BH4. Częstość fenyloketonurii różni się znacząco wśród poszczególnych ras i grup etnicznych. W Polsce PKU (z ang. Phenylketonuria) występuje u 1 na ok. 7 000 noworodków; rocznie rodzi się blisko 60 dzieci z fenyloketonurią, a co 46 zdrowa osoba jest nosicielem zmutowanego genu PAH. Stężenie fenyloalaniny w osoczu krwi osób z klasyczną nieleczoną postacią PKU zwykle przekracza 20 mg/dl. Hiperfenyloalaninemia (powyżej 2 mg/dl osocza) ma działanie toksyczne dla organizmu, powoduje wtórne zaburzenia przemian aminokwasów tyrozyny i tryptofanu, poprzez hamowanie ich hydroksylacji. Mniej tyrozyny i tryptofanu dostaje się do mózgu co zmniejsza syntezę neurotransmiterów - dopaminy i serotoniny, dla których są one prekursorami. Nadmiar fenyloalaniny wpływa na transport innych aminokwasów przez błony komórkowe i barierę krew-mózg, hamuje syntezę i przemiany mieliny oraz z jest głównym czynnikiem neurotoksycznym. Stężenie metabolitów fenyloalaniny – kwasu fenylopirogronowego i ortohydroksyfenylooctowego, nie są tak wysokie, aby mogły oddziaływać toksycznie na człowieka. Pochodne fenyloalaniny są także prekursorami hormonów tarczycy (jodowane pochodne tyrozyny). Objawy fenyloketonurii klasycznej (PKU) podwyższone stężenie we krwi oraz płynach ustrojowych (pot, mocz) fenyloalaniny i produktów jej przemiany; nieodwracalne uszkodzenie ośrodkowego układu nerwowego wynikające z zaburzeń wzrostu mózgu i tworzenia osłonek mielinowych nerwów; upośledzenie umysłowe i różnorodne zaburzenia neurologiczne, zwiększone lub zmniejszone napięcie mięśni, napady padaczkowe, stereotypia ruchowa, zachowanie przypominające autyzm, niemożność mówienia, nadmierne pocenie się, zmiany skórne, słaba pigmentacja skóry, hipoplazja szkliwa, „mysi” zapach moczu, jasna karnacje skóry, jasnoblond włosy, niebieskie tęczówki. Płód z fenyloketonurią rozwija się prawidłowo, ponieważ jego deficyt enzymatyczny jest wyrównany dostatecznie wysoką aktywnością enzymu heterozygotycznej matki. Dziecko z PKU rodzi się pozornie zdrowe. Opóźnienie rozwoju umysłowego może rozwijać się powoli i niepostrzeżenie przez kilka pierwszych miesięcy życia. Rozwój umysłowy dziecka z fenyloketonurią zależy od tego jak szybko zdiagnozowano chorobę i rozpoczęto leczenie. Fakt, że fenyloalanina jest aminokwasem egzogennym pozwala na regulacje jej zawartości w organizmie przez zmiany jej podaży w pożywieniu. Hiperfenyloalaninemia zaburza ważne procesy komórkowe w mózgu, powodując ciężkie upośledzenie umysłowe. Jednocześnie fenyloalanina jest aminokwasem niezbędnym do normalnego wzrostu i rozwoju organizmu, jej całkowity brak może prowadzić do śmierci. Dlatego należy utrzymywać właściwą równowagę między dostarczaniem odpowiednich białek a fenyloalaniną. W tym celu stosuje się restrykcyjną dietę ubogofenyloalaninową ze ściśle określoną zawartością aminokwasu fenyloalaniny. Wprowadzenie jej w pierwszych dniach życia noworodka, zapewnia prawidłowy rozwój intelektualny i fizyczny dziecka. Obecnie w Polsce przeprowadza się obowiązkowo badania przesiewowe noworodków w celu wczesnego wykrycia fenyloketonurii przed wystąpieniem objawów klinicznych i szybkiego wdrożenia odpowiedniej diety, aby zapobiec nieodwracalnemu uszkodzeniu ośrodkowego układu nerwowego. Noworodki z podejrzeniem choroby poddawane są dalszej, szerszej diagnostyce. Badania są obowiązkowe i bezpłatne. Badania próbek krwi na bibule metodą tandemowej spektrometrii mas – współcześnie stosowane badanie umożliwia oznaczanie ilościowe związków mało- i średnio-cząsteczkowych w złożonych mieszaninach, bez konieczności uprzedniej ich separacji. Pozwala ono na oznaczanie profilu estrów karnityny i wybranych aminokwasów, które są nieprawidłowe w ponad 20 wrodzonych chorobach metabolicznych (np. fenyloketonuria – fenyloalanina, tyrozynemia – tyrozyna, choroba syropu klonowego - leucyna). Krew pobiera się z pięty dziecka na bibułę nie wcześniej niż po 24 godz. od urodzenia (w Polsce zaleca się w 3 dobie). Wyniki ze stężeniem 176 fenyloalaniny <2,8 mg/dl uznawane są za prawidłowe; natomiast powyżej tej wartości wymagają powtórnego oznaczenia. Test moczowy (pieluszkowy) – pierwszy test pozwalający na wykrycie w moczu chorych osób kwasu fenylopirogronowego. Test ten polegał na dodaniu do zakwaszonego moczu kilku kropli 10% roztworu chlorku żelaza. U osób chorych na PKU następowała zmiana barwy moczu na kolor niebiesko-zielony. Test umożliwiał rozpoznanie tej wady metabolicznej dopiero w 4 – 5 tygodniu życia dziecka. Test Guthriego – jest to półilościowy test mikrobiologiczny (stosowany do 1997), służący do oznaczania poziomu fenyloalaniny w suchej kropli krwi pobranej na bibułę. Test polegał na wzrokowej ocenie wielkości wzrostu mutantów bakterii Bacillus subtilis wokół krążka bibuły z próbką krwi noworodka ułożoną na podłożu mikrobiologicznym pozbawionym fenyloalaniny, zawierającym czynnik hamujący wzrost bakterii (β-2-tienylalanina). Jeśli stężenie fenyloalaniny w próbce krwi było wysokie, powyżej 4%, aminokwas przechodził do podłoża, znosił działanie czynnika hamującego i umożliwiał wzrost bakterii. Średnica powstałej w ten sposób kolonii koreluje ze stężeniem fenyloalaniny w badanej próbce krwi i porównana z odpowiednim wzorcem kontrolnym informuje o stężeniu aminokwasu. Fenyloketonuria matczyna (ang. maternal phenylketonuria, MPKU) polega na występowaniu licznych embriopatii i fetopatii, spowodowanych utrzymującym się wysokim stężeniem fenyloalaniny we krwi ciężarnej matki. MPKU występuje w przypadku kiedy matki chore na PKU, niestosujące diety, rodzą dzieci ze znacznym upośledzeniem umysłowym; dzieci te nie chorują na fenyloketonurię (nie są homozygotami recesywnym). Szacuje się, że dla płodu bezpieczne stężenie fenyloalaniny we krwi matki wynosi 1,2 – 2,5 mg/dL; fenyloalanina jest aktywnie transportowana przez łożysko do płodu osiągając stężenie ok. 1,5 - 2,0 razy wyższe, niż u ciężarnej kobiety z PKU. U kobiety z fenyloketonurią, ciąża powinna być dokładnie zaplanowana, a podstawą takiego przygotowania jest stosowanie 3 miesiące przed zapłodnieniem diety ubogofenyloalaninowej, która skutecznie obniża stężenie tego aminokwasu do poziomu 2-4 mg/dL. Stężenie fenyloalaniny przez całą ciążę powinno utrzymywać się na poziomie 1-4 mg/dl (w zależności od trymestru). Dieta ustalana jest indywidualnie, w zależności od osobniczej tolerancji tego aminokwasu i od okresu ciąży. Objawy zespołu fenyloketonurii matczynej u noworodków: hipotrofia wewnątrzmaciczna, małogłowie, wady serca, upośledzenie rozwoju umysłowego; zrośnięcie przełyku, przetoka tchawiczno-przełykowa, wady układu moczowego, zaćma; cechy dysmorficzne twarzy (niedorozwój żuchwy i szczęki, płaska nasada nosa, wydłużona rynienka podnosowa, wąska górna warga). Pacjenci z fenyloketonurią (PKU) w przypadkach, w których stężenie fenyloalaniny w surowicy krwi noworodka przekracza ≥10 mg/dl leczeni są od urodzenia dietą ograniczającą podaż fenyloalaniny. Za optymalny czas wprowadzenia diety, po wykonaniu pełnej diagnostyki, uważa się okres od 7 do 10 doby życia noworodka. Podstawą tej diety są preparaty z ograniczoną ilością fenyloalaniny, będące syntetyczną mieszaniną aminokwasów, uzupełnioną w różnym stopniu składnikami odżywczymi (związki mineralne, witaminy), które mają na celu zapewnienie prawidłowego rozwoju fizycznego i umysłowego dziecka. Leczenie podlega tzw. „kontroli ciągłej” opartej na systematycznym oznaczaniu fenyloalaniny i „kontroli okresowej” obejmującej ocenę rozwoju psychicznego, somatycznego oraz wybranych wskaźników biochemicznych krwi. W Polsce, w zależności od wieku chorego, zaleca się utrzymanie stężeń fenyloalaniny w surowicy krwi u dzieci do 12 roku życia w zakresie 2-6 mg/dl (optymalnie 4 mg/dl), a powyżej 12 roku życia, u młodzieży i dorosłych w zakresie 2-12 mg/dl (optymalnie < 10 mg/dl). Normalizacja stężenia fenyloalaniny we krwi na skutek stosowania właściwej diety eliminacyjnej zapobiega pogłębianiu się zaburzeń neurologicznych. Zalecany czas leczenia dietą to okres całego życia, co zapewnia optymalny 177 rozwój dzieciom i dorosłym. U osób po 30 roku życia, nie kontynuujących diety, zaobserwowano częste występowanie problemów neurologicznych, skórnych, depresji, różnorodnych fobii i chorób psychicznych. U odnotowano także: pogorszenie zdolności uwagi, koncentracji, spowolnienie czasu reakcji. Albinizm (bielactwo) Albinizm spowodowany jest mutacjami w genach związanych z prawidłowym działaniem komórek barwnikowych. Może występować jako składowa licznych zespołów albo jako izolowane zaburzenie. Choroba jest zazwyczaj dziedziczona w sposób autosomalny recesywny lub też sprzężony z płcią. Rodzaje albinizmu: 1. albinizm oczno-skórny tyrozynazoujemny typ I (OCA1) – cecha autosomalna recesywna; przyczyną jest mutacja genu tyrozynazy mającego locus 11q14; występuje brak aktywności (typ IA) lub obniżona aktywność tyrozynazy (typ IB) – enzymu przekształcającego aminokwas tyrozynę (Tyr) w jeden z prekursorów melaniny; w skórze, włosach i oczach brak lub występuje obniżona ilość melaniny. Chorzy z typem I A rodzą się z jasną skórą, mają białe włosy, a jeśli występują znamiona barwnikowe, są one blade lub czerwone; tęczówki są jasnoniebieskie lub różowe, ostrość wzroku zmniejszona. W drugiej postaci (typ IB) melanosomy skóry zawierają nieznaczną ilość melaniny, której z wiekiem przybywa. Włosy mają kolor żółty, jasnobrązowy lub rudy, skóra jest różowo-biała albo kremowa, a oczy żółte lub nawet brązowe. W obu typach występuje nadmierna wrażliwość na promieniowanie słoneczne. Częstość albinizmu typu I jest zróżnicowana; średnio wynosi 1:35 000 osób. 2. albinizm oczno-skórny tyrozynazododatni typ II (OCA2) – cecha autosomalna recesywna; przyczyną są różne mutacje genu (locus 15q12-q13) kodującego integralne białko błonowe melanosomów; występuje enzym tyrozynaza, a cechy fenotypowe wykazują dużą zmienność. W chwili urodzenia skóra jest bardzo jasna, natomiast w ciągu życia stopień pigmentacji może wzrastać (do kremowej), szczególnie u chorych rasy czarnej. Pacjenci zwykle mają żółtobrązowy kolor włosów, niebieską lub żółtobrązową tęczówkę, a piegi i znamiona melanocytowe są ciemniej zabarwione. Częstość albinizmu typu II u osób rasy kaukaskiej wynosi 1:38000, u osób rasy czarnej 1:15000. U Indian północnoamerykańskich Navajo częstość jest wyższa, i waha się pomiędzy 1:1500 a 1:2000. W Tanzanii wynosi - około 1:1400 osób, w Nigerii – 1:1100. Przypuszcza się, że w Afryce fakt ten jest wynikiem częstych związków pomiędzy osobami blisko spokrewnionymi. Istnieje również hipoteza sugerująca ochronne działanie genu OCA2 u heterozygot, w zakażeniu człowieka przez Mycobacterium leprae i rozwoju trądu. 3. albinizm oczno-skórny tyrozynazododatni typ III (OCA3) – cecha autosomalna recesywna; spowodowana mutacją genu TYRP1, locus 9p23, warunkującego powstawanie białka-1 związanego z tyrozynazą. U osób rasy czarnej skóra i włosy są miedziano-czerwone, tęczówki jasnobrązowe lub szare. Może występować piegowata skóra i rude włosy oraz czerwone refleksy w źrenicy (obserwowane u ciemnoskórych mieszkańców Puerto Rico). 4. albinizm oczny (OA1) – cecha recesywna sprzężona z chromosomem X, locus Xp22; najczęstsza forma albinizmu ocznego; różne warianty spowodowane ponad 110 różnymi mutacjami genu GPR143 kodującego białko receptorowe błon organelli wewnątrzkomórkowych melanocytów i nabłonka barwnikowego siatkówki. OA1 charakteryzuje się hipopigmentacją tęczówki, oczopląsem, nasiloną fotofobią, zmniejszoną ostrością widzenia u mężczyzn. Szacowana częstość występowania wynosi ok. 1 na 60 000 wśród żywo urodzonych noworodków płci męskiej. 178 Albinizm oczno-skórny i oczny to bardzo heterogenne grupy chorób o zróżnicowanym podłożu genetycznym. Opisywane są także bardzo rzadkie przypadki albinizmu, w których stwierdzano dominujący typ dziedziczenia (albinoidism). Ogółem częstość występowania albinizmu wśród ludzi wynosi średnio od 1:5 000 do 1:17 000 osób; częstość nosicieli szacuje się na 1:70. Warianty albinizmu występują z odmienną częstością w różnych populacjach świata. Warto pamiętać, że albinosi w Afryce poddani są silnej ekspozycji na promieniowanie UV; ze względu na defekt genetyczny są w wysokim stopniu narażeni na rozwój raka skóry i najczęściej umierają przed osiągnięciem 20-30 r.ż. Także ich sytuacja społeczna stanowi ogromne zagrożenie dla ich życia – ciała albinosów uznawane są za źródło drogocennych talizmanów. Rodowody niektórych cech człowieka – rys. drzewa genealogicznego i oznaczenie genotypów Rodowód jest to graficzne przedstawienie poszczególnych członków rodziny, jak i następujących po sobie pokoleń danej rodziny wraz z zaznaczeniem za pomocą odpowiednich symboli graficznych danych klinicznych dotyczących występowania cechy czy choroby w rodzinie na przestrzeni lat. Umożliwia określenie sposobu dziedziczenia cechy/choroby i oszacowanie genetycznego ryzyka wystąpienia czy prawdopodobieństwa powtórzenia się choroby w rodzinie. Pozwala także ustalić, którzy z członków rodziny ponoszą zwiększone ryzyko genetyczne wystąpienia u nich cechy/choroby oraz podjąć decyzję co do rodzaju i zakresu badań diagnostycznych. Właściwa konstrukcja i analiza rodowodu jest istotnym elementem w praktyce poradnictwa genetycznego. W rodowodzie strzałką wskazuje się probanta - pierwszego członka rodziny, u którego wykryto chorobę genetyczną (tzn. osobę, z powodu której przeprowadza się analizę). Probant jest także czasem określany jako przypadek wskaźnikowy (propositus/proposita). Przedstawienie w rodowodzie tylko pojedynczego rodzica oznacza, że partner jest zdrowy, lub nie jest istotny dla analizy. Przygotowując rodowód, rysowanie i analizowanie rozpoczyna się od dołu, od najmłodszego pokolenia przesuwając się ku pokoleniom wcześniejszym. Członków tego samego pokolenia umieszcza się w linii poziomej. W rodowodzie należy uwzględnić wszystkich członków rodziny, a także poronienia, zgony okołoporodowe, dzieci oddane do adopcji, osoby zmarłe. Symbole stosowane w konstruowaniu rodowodów przedstawia tabela 2. 179 Tabela 2. Symbole stosowane w konstruowaniu rodowodów (wg Drewa 2011): Utrudnienia w analizie rodowodów: heterogenność genetyczna – pojawianie się tego samego fenotypu przy odmiennych genotypach (różne podłoże genetyczne), np. albinizm, wielotorbielowatość nerek (cecha autosomalna dominująca warunkowana mutacją w chromosomie 4 (PKD2) lub chromosomie 16 (PKD1) – klinicznie choroby identyczne); fenokopie – wywołane przez środowisko naśladowanie cechy/choroby uwarunkowanej genetycznie, np. dziecko z fenyloketonurią prawidłowo leczone jest fenokopią dziecka zdrowego; rzadkie przypadki w mało licznych rodzinach; niepewność ojcostwa. 180 W chorobach monogenowych i aberracjach chromosomowych ryzyko wystąpienia choroby u potomstwa danej pary rodzicielskiej jest stałe i nie zmienia się w zależności od liczby już posiadanych dzieci zdrowych lub chorych. Np. w dziedziczeniu autosomalnym recesywnym, ryzyko powtórzenia się choroby u rodzeństwa wynosi zawsze 25%, ponieważ rodzice dziecka są heterozygotami; w dziedziczeniu autosomalnym dominującym, jeśli jedno z rodziców jest chore (heterozygota), ryzyko wyniesie zawsze 50%; w chorobie warunkowanej przez recesywny gen sprzężony z chromosomem X – jeśli matka jest heterozygotą – ryzyko posiadania chorego syna wyniesie 50%. W podanych przypadkach zawsze należy także pamiętać o możliwej nowej mutacji, niewystępującej dotychczas w badanej rodzinie. Grupy krwi Pierwsze próby leczenia przetoczeniami krwi zaczęto podejmować w XVII wieku, kiedy angielski lekarz William Harvey po raz pierwszy opisał w sposób naukowy krążenie krwi w ludzkim organizmie (1667 r. Jean Baptiste Denis - nadworny lekarz Ludwika XIV, przetoczył około 270 ml krwi tętniczej jagnięcia chłopcu, znajdującemu się w ciężkim stanie po licznych „leczniczych” krwioupustach, którymi próbowano wyleczyć go z gorączki; chłopiec przeżył ten zabieg, a nawet wyzdrowiał). Odkrycie układu grupowego ABO (Karl Landsteiner, 1901) i opisanie zjawiska aglutynacji (zlepiania się) krwinek czerwonych w zetknięciu z przeciwciałami obecnymi w osoczu krwi grup o odmiennej strukturze antygenowej, a także pokonanie trudności związanych z krzepnięciem krwi (rok 1914) dzięki zastosowaniu cytrynianu sodu (będącego do dziś podstawowym składnikiem większości roztworów konserwujących krew i jej składniki), rozpoczęło nowy rozdział w dziedzinie transfuzjologii. W wyniku przetoczenia krwi niezgodnej grupowo następuje, często przy udziale dopełniacza (zespół kilkudziesięciu białek obecnych w osoczu, spełniających ważną rolę w mechanizmach odpowiedzi odpornościowej), wewnątrznaczyniowe niszczenie krwinek czerwonych. Wcześniejsze rozpoznanie grup krwi warunkuje możliwość zapobiegania takiemu zjawisku. Na powierzchni ludzkich krwinek czerwonych występują liczne, warunkowane przez polimorficzne geny, glikoproteiny i glikolipidy. Stanowią one antygeny grup krwi, których specyficzność jest określana głównie przez sekwencję oligosacharydów lub aminokwasów. Wykrywane były początkowo jedynie testami serologicznymi, obecnie także metodami technik molekularnych oraz z wykorzystaniem procesu klonowania, np. dla antygenów wielu układów grup krwi stosowane są przeciwciała monoklonalne, mAb (od ang. monoclonal antibody) – otrzymywane z jednego klonu limfocytów B. Techniki te umożliwiły wykrycie 43 głównych układów grupowych krwi człowieka obejmujących 345 antygenów krwinek czerwonych zdeterminowanych przez 48 genów oraz ponad 30 antygenów, które nie pasują do żadnego systemu lub kolekcji [ISBT International Society of Blood Transfusion (Międzynarodowe Towarzystwo Przetaczania Krwi), czerwiec 2021). Antygeny układów grupowych erytrocytów dziedziczą się zgodnie z prawami Mendla, jednak w dziedziczeniu występują także zjawiska współdziałania genów, sprzężenia autosomalnego, czy sprzężenia z chromosomem X (układ Xg), a także polimorfizmu genów. Poniżej przedstawiamy dziedziczenie wybranych układów grup krwi człowieka. układ ABO Antygeny układu ABO występujące na błonach erytrocytów i innych komórek organizmu człowieka (z wyjątkiem hepatocytów i komórek tkanki nerwowej) warunkowane są przez obecność 3 głównych alleli: IA, IB, i (I0) zajmujących locus w chromosomie 9 oraz alleli H, h mających locus w chromosomie 19. Antygeny A, B, H mogą występować w płynach ustrojowych i wydzielinach ciała człowieka. Wydzielanie jest warunkowane przez allel dominujący Se mający locus na chromosomie 19 (sprzężony z allelem H). 181 Antygeny układu ABO mają budowę węglowodanową – nie są bezpośrednimi produktami genów. Produktami wszystkich wymienionych wyżej alleli są enzymy – glikozylotransferazy przenoszące odpowiedni końcowy cukier na określony typ łańcucha oligosacharydowego tworzący antygen: H, gdy α-2-L-fukozylotransferaza przenosi L-fukozę; A, gdy α-3-N-acetylo-D-galaktozaminotransferaza przenosi N-acetylogalaktozaminę; B, gdy α-3-D-galaktozylotransferaza przenosi galaktozę. Antygen H jest niezbędny do powstania antygenów A i B. Na błonach komórkowych erytrocytów jest on tworzony wskutek działania α-2-L-fukozylotransferazy (FUT1) kodowanej przez gen H. Natomiast w komórkach nabłonków wydzielniczych tworzona jest rozpuszczalna forma antygenu H. Jest to zależne od genu Se warunkującego wytworzenie α-2-L-fukozylotransferazy (FUT2), różniącej się pod względem sekwencji aminokwasów od FUT1 (oba geny wykazują 70% homologii nukleotydowej; najprawdopodobniej powstały wskutek duplikacji). Brak antygenu H występuje u ok. 0,0004% (4:1 000 000) populacji ludzkiej (w Indiach 0,01% populacji). Po raz pierwszy taki przypadek opisano w 1952 r. w Bombaju u kobiety wymagającej transfuzji krwi (rycina 1). Brak antygenów A i B na erytrocytach wskazywał na grupę krwi 0. Jednak jedno z rodziców pacjentki miało grupę AB, a dzieci grupy A, B i AB. Stwierdzono, że kobieta ta była homozygotą hh (recesywna mutacja genu H) i miała genotyp: IBi hh, który określono jako fenotyp Bombay 0h. Rycina 1. Rodowód rodziny, w której wystąpił „fenotyp Bombay”. Obecnie rozróżniamy klasyczny fenotyp Bombaj i para-Bombaj (tabela 3). Tabela 3. Porównanie fenotypu Bombaj i para-Bombaj. Klasyczny fenotyp Bombaj Brak ekspresji antygenu H na erytrocytach Brak antygenu H w ślinie (w płynach ustrojowych i wydzielinach ciała człowieka) Obecność przeciwciał anty-H, anty-A, anty-B w osoczu Genotyp: hh sese Fenotyp para-Bombaj Brak ekspresji antygenu H na erytrocytach Obecność antygenu H w ślinie (zależnie od genotypu możliwa obecność antygenów H, A i B w ślinie, a także w osoczu i ich adsorpcja na erytrocytach) Obecność przeciwciał anty-H w osoczu Genotyp: hh Sese / hh SeSe O obecności antygenów A,B i H w wydzielinach i płynach ustrojowych decyduje odziedziczenie przynajmniej jednego allela dominującego Se – tzw. allel genu wydzielania antygenów grupowych (SeSe, Sese) (tabela 4). Przykład: Rodzice biologiczni – oboje wydzielacze, matka o grupie AB, ojciec A. Genotypy: ♀ IAIB Hh Sese x IAi Hh Sese ♂ Fenotypy: ♀ AB x A ♂ Potomstwo: 182 Genotypy Fenotypy AB wydzielacz AB niewydzielacz A wydzielacz A niewydzielacz B wydzielacz B niewydzielacz O wydzielacz O niewydzielacz IAIB Hh Sese IAIB Hh SeSe IAIB HH Sese IAIB HH SeSe IAIB Hh sese IAIB HH sese IA i Sese IA i SeSe IAIA Sese IAIA SeSe IA i Hh sese IA i HH sese IAIA HH sese IAIA Hh sese IB i Sese IB i SeSe IB i Sese IB i SeSe IB i Hh sese IB i HH sese IA i hh Sese IA i hh SeSe IB ihh Sese IB ihh SeSe IA IB SeSe IA IB Sese IAIA hh Sese IAIA SeSe IA i hh sese IB ihh sese IAIA hh sese IA IB hh sese Hh Hh HH HH Hh Hh HH HH „para-Bombaj” „Bombaj” hh hh hh Polimorfizm genów układu ABO warunkuje występowanie odmian antygenów (oznaczanych A 1, A2, A3, Ax, Am, Ael, Aend i in.), które mają odpowiednio coraz słabszą ekspresję antygenu A. Podobnie, choć rzadziej, słabe odmiany wykrywane są u osób z grupą B (np. B3, Bx, Bm, Bw). Allele tych podgrup wykazują polimorfizmy typu zamiany pojedynczego nukleotydu (SNP – ang. single nucleotide polymorphism) w eksonach czy w regionach promotorowych lub zawierają mutacje powodujące podstawienia aminokwasowe lub przesunięcia ramki odczytu, których wynikiem jest obniżenie aktywności enzymatycznej glikozylotransferaz, co przekłada się na zmniejszenie liczby cząsteczek antygenu na erytrocytach. AB0 to jedyny układ, w obrębie którego występują naturalne przeciwciała przeciwko antygenom, nieobecnym na własnych krwinkach. Przeciwciała układu AB0: anty-A i anty-B produkowane są w wieku niemowlęcym (nie wcześniej niż w 4 miesiącu życia) i noszą nazwę przeciwciał naturalnych (regularnych). Należą do klasy IgM; nie przechodzą przez śródbłonek i łożysko. układ Rh Antygeny układu Rh, to polipeptydy transbłonowe występujące tylko na erytrocytach. Warunkowane są przez dwa geny RHD i RHCE znajdujące się na krótkim ramieniu chromosomu 1 (1p36.11). Układ Rh jest najbardziej polimorficznym układem antygenowym krwinek czerwonych. Wykryto 54 antygeny tego układu, jednak klinicznie istotnych jest 5 antygenów: D, C, c, E, e. Gen RHD koduje antygen D i jego odmiany, natomiast RHCE – pozostałe. Determinanty antygenu D stanowią składnik jednego polipeptydu, a determinanty C, c, E i e są umiejscowione na innym łańcuchu polipeptydowym. Różnice pomiędzy antygenami C i c oraz E i e wynikają z mutacji punktowych, które powodują zmiany pojedynczych aminokwasów. Najsilniejszym immunogenem, także spośród wszystkich poznanych antygenów erytrocytów innych układów, jest antygen D, którego obecność warunkuje fenotyp Rh+. Delecja genu RHD i w efekcie brak antygenu D na powierzchni erytrocytów zapisujemy jako genotyp dd i fenotyp Rh-. Fenotyp ten spotyka się dość często w Europie u przedstawicieli rasy kaukaskiej (ok. 15%-30% populacji). Oprócz Europy fenotyp ten występuje w Azji Środkowej i Ameryce Południowej (16-20%). Niezwykle rzadko spotykany jest w Azji Wschodniej. Zastosowanie odczynników diagnostycznych (odczynniki monoklonalne) o swoistościach antyD, -C, -c, -E, -e pozwoliło na wyodrębnienie 18 fenotypów Rh. Ponieważ wszystkie geny układu Rh leżą w jednym chromosomie mówimy, że fenotyp jest warunkowany przez dwa haplotypy pochodzące od rodziców. 183 układ Duffy Antygenem układu Duffy jest adhezyjna glikoproteina transbłonowa DARC (Duffy Antigen Receptor for Chemokines) warunkowana przez gen ACKR1 FY (locus 1q23). Jest ona receptorem chemokin – cytokin chemotaktycznych, cząsteczek istotnych w aktywacji oraz migracji komórek układu odpornościowego. Występuje na powierzchni erytrocytów, komórek śródbłonka naczyń krwionośnych, nabłonka pęcherzyków płucnych, kanalików nerkowych, a także niektórych komórek mózgu, jelita grubego, śledziony i tarczycy. U ludzi stwierdzono cztery fenotypy układu Duffy: Fy(a+b+), Fy(a+b−), Fy(a−b+) i Fy(a−b−) wynikające z obecności/braku dwu podstawowych alleli kodominujących: FyA , FyB. Wykryto również inne allele np. Fy3, Fy4, Fy5, Fy6, FYA(null), Fy(bwk)=Fy(x). Pasożytnicze pierwotniaki Plasmodium knowlesi i P. vivax, wywołujące malarię, w celu wniknięcia do erytrocytów przyłączają się do antygenów Duffy. Stwierdzono całkowitą oporność na inwazję tych pasożytów u osób z fenotypem Fy(a-b-), który wynika z polimorfizmu w promotorze genu ACKR1 (mutacja powoduje powstanie nieaktywnego allela FY*O). Zjawisko to uważane jest za przyczynę odmiennej częstości występowania fenotypów układu Duffy w różnych rejonach świata. Konflikt matczyno-płodowy (konflikt serologiczny) Konflikt serologiczny zwany też konfliktem matczyno-płodowym to zjawisko wytwarzania przez kobietę w ciąży przeciwciał skierowanych przeciwko antygenom płodu, które dziecko odziedziczyło po ojcu, a matka ich nie posiada. Antygeny występują na powierzchni różnych komórek krwi, takich jak erytrocyty, płytki czy granulocyty. Układ odpornościowy matki niszczy komórki płodu, co może doprowadzić do powikłań tj. niedokrwistości hemolitycznej, obrzęku uogólnionego płodu oraz nawet do zgonu wewnątrzmacicznego płodu - choroba hemolityczna płodu i /lub noworodka (pol. ChHPN, ang. Haemolytic Disease Of The Fetus And Newborn HDFN) - niszczenie krwinek czerwonych płodu i hamowanie erytropoezy. Najczęściej konflikt występuje w układzie Rh. Kobiety pozbawione antygenu RhD, czyli z grupą krwi Rh minus [Rh(-)] mogą ulegać tzw. alloimmunizacji (powstawanie przeciwciał w wyniku immunizacji, czyli kontaktu z antygenem pochodzącym z innego osobnika tego samego gatunku) przez antygen RhD obecny u płodu (kiedy płód jest Rh dodatni). Konflikt zachodzi w końcowym okresie ciąży (np. po interwencjach zabiegowych wykonywanych w czasie ciąży) lub najczęściej w czasie porodu, gdy erytrocyty płodu dostaną się do krwiobiegu matki. Dla zapoczątkowania odpowiedzi immunologicznej u matki (immunizacji) wystarcza przedostanie się ok 0,1-0,5 ml krwi płodu do krwiobiegu matki (przeciek matczyno-płodowy). Konflikt Rh i choroba hemolityczna płodu/noworodka dotyczą zwykle drugiej ciąży, w której dziecko również dziedziczy od ojca gen dla antygenu RhD [Rh(+)]. Przeciwciała klasy IgG antyRhD, wytworzone w trakcie/po pierwszej ciąży, utrzymujące się w krwiobiegu matki, przechodzą przez łożysko i w krwiobiegu płodu łączą się z antygenem RhD jego erytrocytów. Erytrocyty połączone z przeciwciałami - „opłaszczone” - są niszczone przez komórki układu fagocytarnego (dawna nazwa układ siateczkowo-śródbłonkowy), co prowadzi do niedokrwistości, a w skrajnych przypadkach do śmierci płodu lub noworodka. Dla zapobieżenia konfliktowi opracowano w roku 1966 immunoprofilaktykę, w ramach której, matkom z grupą Rh-, u których nie wykryto przeciwciał anty-RhD, podaje się w czasie do 72 godz. po porodzie dziecka Rh(+) immunoglobuliny IgG anty-D (zniszczenie krwinek z antygenem D). Wprowadzenie tej rutynowej profilaktyki poporodowej pozwoliło na zmniejszenie ryzyka wystąpienia w następnej ciąży choroby hemolitycznej płodu i noworodka. Obecnie, częstość występowania konfliktu RhD zmniejszyła się dzięki temu do 0,02 :1000 porodów. Jeśli w krwi ciężarnej kobiety obecne są przeciwciała przeciwko czerwonym krwinkom jej dziecka, ich poziom kontroluje się dodatkowo w 28., 32. i 36. tygodniu ciąży. Dodatkowo, co 2-3 tygodnie lekarz przeprowadza USG, dzięki któremu sprawdza, czy dziecko rozwija się prawidłowo. Przy 184 niskim mianie przeciwciał żadna interwencja najczęściej nie jest konieczna, przy bardzo wysokim – ciąża może zostać zakończona wcześniej, a krew u dziecka poddana jest transfuzji wymiennej. W przypadku konfliktu serologicznego płodu możliwe jest także przetoczenie wewnątrzmaciczne. Transfuzję wymienną u noworodka wykonuje się najczęściej z powodu zagrażającej życiu hiperbilirubinemii, niedającej się obniżyć fototerapią i zazwyczaj towarzyszącej chorobie hemolitycznej płodu/noworodka. Stosuje się krew pełną od pojedynczego dawcy lub preparat przygotowany z koncentratu krwinek czerwonych i świeżo mrożonego osocza lub 5% roztworu albuminy. Poza antygenem Rh, przyczyną konfliktu serologicznego i choroby hemolitycznej płodu i noworodka mogą być też inne antygeny, odpowiedzialne za grupy krwi (ABO, Kell, Kidd, Duffy). Konflikt może dotyczyć także innych krwinek, np. płytek (1:1500 ciąż) – wtedy wytwarzane przez matkę przeciwciała prowadzą do małopłytkowości u dziecka lub granulocytów (1:6000 ciąż), co skutkuje granulocytopenią. Transfuzja krwi Wskazania do podania preparatów krwi zależą od wielu czynników, takich jak rozpoznanie choroby, etap i rodzaj leczenia, stan kliniczny i wiek chorego. Obecnie w lecznictwie stosuje się głównie środki krwiopochodne, natomiast do minimum ogranicza się stosowanie krwi pełnej. Decyzja o przetoczeniu preparatu krwiopochodnego np. krwinek czerwonych, powinna być podjęta po wyczerpaniu wszystkich innych możliwości leczenia. Stosowanie krwi pełnej powinno być ograniczone tylko do następujących sytuacji: masywne krwawienia z utratą ponad 25% objętości krwi krążącej, transfuzja wymienna u noworodków. Należy przetaczać krew zgodną w zakresie antygenów układu AB0 oraz antygenu D (układ Rh), po potwierdzeniu serologicznej zgodności biorcy i dawcy. Z przetoczeniem krwi związane jest ryzyko przeniesienia chorób wirusowych. Krew od zdrowego dawcy jest pobierana do sterylnego pojemnika z tworzywa sztucznego, zawierającego płyn konserwujący. Jedna jednostka to 450 ml krwi pełnej (±10%), zmieszanej z 63–70 ml płynu konserwującego. Zawiera wszystkie składniki krwi, które zachowują niezmienione właściwości tylko przez pewien czas. Krew pełna nie powinna zawierać nieregularnych przeciwciał o znaczeniu klinicznym. Krew pełna jest źródłem składników otrzymywanych podczas jej preparatyki (osocze, krwinki czerwone, granulocyty, płytki krwi, albuminy, immunoglobuliny, czynniki zespołu protrombiny - czynniki krzepnięcia). Do obowiązujących w transfuzjologii badań serologicznych należy rutynowe oznaczanie cech grupowych układu AB0, Rh i wykrywanie przeciwciał nieregularnych. Rozróżnia się dwa rodzaje przeciwciał: naturalne (regularne) oraz odpornościowe. Pierwsze z nich - przeciwciała naturalne, występują u każdego człowieka, pojawiają się w sposób naturalny w ciągu pierwszego roku po urodzeniu i są obecne we krwi przez całe życie; są to przeciwciała dla antygenów grup głównych: przeciwko antygenowi A (anty-A) i przeciwko antygenowi B (anty-B). Drugi rodzaj przeciwciał przeciwciała odpornościowe (produkowane są przez organizm człowieka w wyniku wywołania odpowiedzi odpornościowej na obce krwinki, które znalazły się w krążeniu (np. po przetoczeniu krwi). U wszystkich krwiodawców pełne badanie grup krwi układu AB0 i antygenu D z układu Rh, jak również wszystkich innych antygenów wykonuje się dwukrotnie z próbek krwi pobranych w różnym czasie. U wszystkich dawców pierwszorazowych oraz stałych, którzy byli leczeni krwią w okresie roku poprzedzającym oddanie krwi oraz u kobiet z ciążą w wywiadzie, należy wykonać wykrywanie i identyfikację przeciwciał odpornościowych. Przetacza się krew zgodną w układzie AB0 z krwią biorcy. Ponadto biorca Rh- ujemny tzn. nie posiadający w krwinkach antygenu D, może wyłącznie otrzymać krew Rh- ujemną. 185 Bezpośrednio przed przetoczeniem krwi wykonywana jest każdorazowo tzw. próba krzyżowa próba zgodności serologicznej krwi biorcy i krwi dawcy, mająca potwierdzić zgodność krwi w grupach głównych, czyli w układzie AB0 i Rh, oraz sprawdzenie ewentualnej obecności w surowicy krwi biorcy przeciwciał dla krwinek czerwonych dawcy krwi. Podczas próby tej przeprowadza się następujące badania: 1. kontroluje się antygeny grup AB0 biorcy i dawcy; sprawdza się obecność antygenu RhD u biorcy (kiedy jest on RhD- ujemny, sprawdza się antygen D u dawcy, aby nie przetoczyć krwinek RhD (+) osobie z RhD (-), 2. przeprowadza się testy na obecność odpornościowych przeciwciał w surowicy biorcy, 3. wykonuje się próbę zgodności serologicznej między surowicą biorcy a krwinkami czerwonymi dawcy. Próba krzyżowa ważna jest 48 godzin od wykonania, gdyż uważa się, że w ciągu tego czasu może dojść do immunizacji (w przypadku niezgodności biorcy i dawcy) i wytworzenia przeciwciał u biorcy. Po tym czasie próbę krzyżową należy powtórzyć. Przetoczenie niezgodne (przetoczenie składników krwi zawierających co najmniej jeden antygen, który nie występuje u biorcy) może dotyczyć antygenów komórkowych krwi, jak i antygenów białek osocza. Powstają przeciwciała odpornościowe, tzw. alloprzeciwciała, które powodują hemolityczną reakcję poprzetoczeniową. W immunizacji poprzetoczeniowej największe kliniczne znaczenie mają: antygen D (układ Rh), antygen K (układ Kell), u biorców D dodatnich antygeny E, c, Cw (układ Rh). Należy zwrócić uwagę, iż u osób wymagających wielokrotnego przetaczania krwi ze względów leczniczych, istnieje duże prawdopodobieństwo wytwarzania przeciwciał odpornościowych (kontakt z wieloma antygenami różnych krwinek czerwonych i innych składników krwi - koncentrat krwinek czerwonych zawsze zawiera niewielką liczbę leukocytów i płytek krwi). Powikłania po przetoczeniu krwi niezgodnej grupowo występują średnio raz na 3-5 tysięcy przetoczeń (wczesne do 24 godzin od transfuzji - 0,1% chorych i późne - 1%). W wyniku takiego przetoczenia może dojść do wstrząsu hemolitycznego o różnym nasileniu, u ok. dwudziestu procent chorych występuje skaza krwotoczna, która w ok. 50% przypadków prowadzi do śmierci. Trzecim w kolejności najczęściej występującym powikłaniem jest potransfuzyjna ostra niewydolność oddechowa (TRALI – ang. transfusion-related acute lung injury) stanowiąca 7% wszystkich powikłań poprzetoczeniowych.Typowe reakcje poprzetoczeniowe u osób bez poważnych schorzeń, w 75% przypadków nie prowadzą do zgonu. Przez długi czas poszukiwano uniwersalnego dawcy, osoby, której materiał biologiczny mógłby zostać użyty do transfuzji do dowolnego odbiorcy. Za uniwersalną krew uważa się krwinki grupy 0 Rhzawieszone w osoczu AB (nie zawiera przeciwciał anty-A i anty-B) lub zawieszone w osoczu jednoimiennym z grupą biorcy. Obecnie w wielu laboratoriach prowadzone są prace nad sztuczną krwią/erytrocytami (próby tworzenia np.: „uniwersalnej krwinki” poprzez zmianę antygenów powierzchniowych, syntetycznych substytutów krwi - nośników tlenu z wykorzystaniem hemoglobiny tzw. HBOCs czy perfluorowęgli (PFC). 186 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA Aglutynacja Podstawową metodą identyfikacji antygenów grupowych krwi oraz skierowanych przeciwko nim przeciwciał jest reakcja aglutynacji (łac. agglutino - przyklejam, zlepiam). Wystąpienie jej zależy od liczby i lokalizacji antygenów na powierzchni erytrocytu oraz stężenia odpowiednich przeciwciał. Na błonie erytrocytu znajduje się około miliona cząsteczek antygenów układu AB0 łatwo dostępnych dla przeciwciał, bo umieszczonych zewnątrzkomórkowo, natomiast antygeny układu Rh to ok. 50 tys. cząsteczek umieszczonych wewnątrzkomórkowo (śródbłonowo) trudniej dostępnych, trudniej więc wywołać aglutynację. W wielu organizmach roślinnych, zwierzęcych oraz mikroorganizmach występują białka, które specyficznie rozpoznają i odwracalnie wiążą cukrowe części glikoprotein i glikolipidów na powierzchni komórek. Nazywane są one lektynami. Mają one zdolność do zlepiania (czyli aglutynacji) erytrocytów, a także innych komórek ludzkich i zwierzęcych. Ze względu na pochodzenie określamy je jako aglutyniny - białka wyizolowane z bakterii, bezkręgowców, ryb i ssaków (herteroaglutyniny – jako substancje obcogatunkowe), oraz fitoaglutyniny lub fitohemaglutyniny - wyizolowane z roślin. Lektyny roślinne są stosowane do wykrywania niektórych antygenów układów grupowych krwi o budowie wielocukrowej dzięki wiązaniu z ich swoistymi determinantami antygenowymi. Przykłady zastosowania lektyn pochodzących z roślin z rodziny bobowatych (motylkowatych): 1. wykrywanie antygenów układu AB0 np.: antygen A – lektyna z indyjskiej rośliny Dolichos biflorus; antygen H – lektyna z europejskiej rośliny Ulex europeaus; 2. wykrywanie antygenów układu MNS np.: antygen N – lektyna z rośliny występującej na półkuli północnej Vicia graminea. Lektynę z Dolichos biflorus stosuje się dla odróżnienia antygenu A1 od jego odmian np. A2, które słabiej bądź w ogóle nie ulegają aglutynacji w obecności lektyn. Lektyny z D. biflorus wiążą α-N-acetylo-Dgalaktozaminę (antygen A). 1. Heteroaglutynacja erytrocytów człowieka surowicą końską. WYKONANIE: Materiały i odczynniki: - 5% zawiesina krwinek czerwonych człowieka w roztworze 0,85% NaCl, - surowica końska, - 0,85% roztwór NaCl Sprzęt i aparatura: - szkiełka podstawowe z łezką, - pipety, - komora wilgotna, - rękawiczki, - marker. 187 Protokół doświadczenia: 1. Na szkiełku podstawowym z łezką umieścić kroplę 5% zawiesiny krwinek czerwonych człowieka w 0,85% roztworze NaCl a następnie dodać kroplę surowicy końskiej. 2. Równolegle wykonać preparat kontrolny: kropla 5% zawiesiny krwinek czerwonych człowieka w roztworze 0,85% NaCl i kropla 0,85% roztworu NaCl. 3. Oba preparaty inkubować w komorze wilgotnej, 10 min. w temperaturze pokojowej. 4. Oceniając wynik doświadczenia należy odróżnić aglutynację erytrocytów od ich agregacji – przy poruszaniu szkiełkiem agregaty rozpadają się. Wyniki: Wnioski: 2. Wykrywanie antygenów układu ABO na powierzchni erytrocytów człowieka z zastosowaniem fitoaglutynin z nasion Dolichos biflorus. WYKONANIE: Materiały i odczynniki: - 5% zawiesiny krwinek czerwonych człowieka grupy A1 i A2 w roztworze 0,85% NaCl, - preparat Dolichotest Sprzęt i aparatura: - szkiełka podstawowe z łezką, - pipety, - komora wilgotna, - rękawiczki, - marker. Protokół doświadczenia: 1. Na szkiełkach podstawowych z łezką umieścić kroplę 5% zawiesiny krwinek czerwonych człowieka grupy A1 i A2 w 0,85% roztworze NaCl, a następnie dodać po kropli preparatu Dolichotest. 2. Oba preparaty inkubować w komorze wilgotnej, 3 min. w temperaturze pokojowej. 3. Wynik odczytać lekko poruszając szkiełkiem. Aglutynacja świadczy o obecności na erytrocytach antygenu A1. Wyniki: 188 Wnioski 3. Wykrywanie substancji grupowej układu ABO w ślinie WYKONANIE: Materiały i odczynniki: - ślina wzorcowa od osoby z grupą krwi A, - 0,85% roztwór NaCl, - odczynnik zawierający przeciwciała monoklonalne anty-A, - 5% zawiesina krwinek czerwonych człowieka grupy A w roztworze 0,85% NaCl, Sprzęt i aparatura: - probówki, - pipety, - wirówka, - rękawiczki, - marker. Protokół doświadczenia: 1. Do odpowiednio oznakowanych probówek (badana i kontrola) dodać po dwie krople (80 μl) odczynnika zawierającego przeciwciała monoklonalne anty-A, a następnie do pierwszej probówki – kroplę śliny wzorcowej, do drugiej – kroplę 0,85% roztworu NaCl, wymieszać. 2. Do obu probówek dodać po 2 krople 5% zawiesiny krwinek czerwonych grupy A. 3. Zamieszać zawartość, obie probówki inkubować 2 min. w temp. pokojowej i odwirować z prędkością 1000 obr./min. przez 60 sek. 4. Wynik odczytać lekko wstrząsając probówkami. Wyniki: Wnioski: Wnoski: 189 4. Wykrywanie antygenu D układu Rh na powierzchni erytrocytów człowieka. WYKONANIE: Materiały i odczynniki: - 3% zawiesina krwinek czerwonych człowieka w zbuforowanym fosforanami roztworze 0,85% NaCl (PBS), - odczynnik zawierający przeciwciała monoklonalne anty-D, Sprzęt i aparatura: - probówki, - pipety, - wirówka, - rękawiczki, - marker. Protokół doświadczenia: 1. Do probówki dodać dwie krople (80 μl) odczynnika zawierającego przeciwciała monoklonalne anty-D, a następnie dodać 1 kroplę 3% (40 μl) zawiesiny krwinek czerwonych człowieka w zbuforowanym 0,85% roztworze NaCl (PBS). 2. Zamieszać i inkubować w temperaturze pokojowej 1 min. 3. Odwirować z prędkością 1000 obr./min. przez 60 sek. 4. Wynik odczytać lekko poruszając probówką. Aglutynacja świadczy o obecności antygenu D na krwinkach – krwinki Rh+. Wyniki: Wnioski: Podpis prowadzącego ……………………………………… Data……………………………………… 190 REPOZYTORIUM Genetyka klasyczna Mendlowska Jakie jest prawdopodobieństwo urodzenia się dziecka o jasnych włosach, piegowatego, wykazującego fenyloketonurię, jeżeli oboje rodzice (rodzice biologiczni) są zdrowi, mają włosy ciemne, matka jest piegowata? Podane cechy dziedziczą się niezależnie. Oznaczamy: W – allel dominujący dla włosów ciemnych w – allel recesywny dla włosów jasnych P – allel dominujący piegowatości p – allel recesywny braku piegów f – allel braku enzymu hydroksylazy fenyloalaninowej F – allel prawidłowy Krzyżówki dla poszczególnych cech: Barwa włosów: ♀ W xW ♂ dziecko będzie miało włosy jasne tylko wtedy gdy oboje rodzice będą heterozygotami: Ww x Ww, z takiej krzyżówki P( w )=1/4 Występowanie piegów: ♀ ♂ P x p matka może być homozygotą (1) lub heterozygotą (2): 1) PP x pp z takiej krzyżówki wszystkie dzieci będą miały genotyp – Pp – piegowate, P( P )=1 2) Pp x pp z takiej krzyżówki połowa dzieci będzie miała genotyp – Pp – piegowate P( P )=1/2, a połowa będzie niepiegowata P( p )=1/ Obecność enzymu hydroksylazy fenyloalaninowej: ♀ Ff x Ff ♂ oboje rodzice muszą być heterozygotami – tylko wtedy może urodzić się dziecko z fenyloketonurią, P(ff)=1/4 Prawdopodobieństwo równoczesnego ujawnienia się tych cech u dziecka wynosi: P( ) = 1/4 x 1/2 x 1/4 = 1/32 = 3,125% Odpowiedź. Prawdopodobieństwo urodzenia się takim rodzicom dziecka o jasnych włosach, piegowatego, wykazującego fenyloketonurię wynosi 3,125% . 191 ZADANIA GENETYCZNE 1. Kiedy jest możliwe i jakie jest prawdopodobieństwo urodzenia syna rudego, chorego na fenyloketonurię, jeżeli oboje rodzice są zdrowi, matka jest ruda, a ojciec ciemnowłosy (podaj możliwe genotypy rodziców i syna). 2. Jakie jest prawdopodobieństwo fenotypu , jeżeli rodzice należą do pokolenia F1? 3. Jakie jest prawdopodobieństwo urodzenia się dziecka rudego o oczach niebieskich, rodzicom ciemnowłosym o oczach piwnych przy założeniu, że rodzice biologiczni mają genotypy spełniające kryteria krzyżówki wstecznej? 4. Oblicz prawdopodobieństwo urodzenia się zdrowego syna z grupą krwi A 3B, jeżeli matka ma grupę krwi A1, jest nosicielką genu mukowiscydozy, a ojciec ma grupę krwi A2B. 5. Podaj prawdopodobieństwo urodzenia się zdrowej córki o grupach 0 Rh(-), niewydzielacz, której matka choruje na mukowiscydozę i ma grupy krwi A2 Rh(+), jest wydzielaczem, ojciec ma grupy B Rh(+), jest wydzielaczem. 192 6. Piegowata kobieta ma grupę krwi B Rh(-), wykazuje sierpowatość krwinek czerwonych; mężczyzna o grupie krwi A Rh(+) obciążony jest genem choroby Taya-Sachsa. Rodzicami którego z dzieci i z jakim prawdopodobieństwem może być ta para (uzasadnij podając genotypy dzieci i rodziców): I. piegowaty syn o grupie AB Rh(-), zdrowy klinicznie i genetycznie; II. niepiegowata córka o grupie 0 Rh(+) z anemią sierpowatą; III. niepiegowaty syn o grupie B Rh(+) wykazujący sierpowatość krwinek czerwonych i chorobę TayaSachsa. 7. Przeanalizuj przedstawione drzewa rodowe, wskaż najbardziej prawdopodobny typ dziedziczenia, uzasadnij wybór; podaj możliwe genotypy członków analizowanej rodziny i wskaż przykład choroby/cechy: A. B. C. 193 D. E. F. 194 ZADANIA SAMOKSZTAŁCENIA 1. Na przedstawionym poniżej schemacie strzałką oznaczono cukry przenoszone przez odpowiednie glikozylotransferazy na łańcuchy prekursorowe błony erytrocytów warunkujące powstanie antygenów grupowych H, A, B. Podaj nazwy cukrów charakterystyczne dla tych antygenów. antygen H: antygen A: antygen B: 2. Plejotropia oznacza: A. dopełniające się działanie produktów różnych genów; B. warunkowanie przez jeden gen kilku pozornie niezwiązanych ze sobą cech fenotypowych; C. występowanie wielu genów warunkujących wytworzenie tej samej cechy; D. stopień ujawnienia się produktu danego genu, odpowiedzialnego za daną cechę. 3. Antygeny układu ABO znajdują się: A. tylko w błonie erytrocytów; B. na wszystkich komórkach organizmu ludzkiego; C. na wszystkich komórkach organizmu ludzkiego za wyjątkiem komórek układu immunologicznego; D. na wszystkich komórkach organizmu ludzkiego za wyjątkiem komórek układu nerwowego. 4. Prawdziwe zdania dotyczące genu H to: A. 1,3,5; B. 2,4,5; C. 3,4,5; D. 1,3,4.. 1. allel H koduje powstanie substancji prekursorowej dla antygenów A i B; 2. gen H jest sprzężony z genami locus ABO; 3. allel H ma locus na innym chromosomie niż allele IA, IB, i; 4. allel H warunkuje powstanie enzymu fukozylotransferazy; 5. gen H ma locus 9q. 5. Prawdziwe dane opisujące sferocyty to: A. 1, 4; 6; B. 1, 2, 4; 1. mają mniejszą średnicę od normocytów; 2. zawierają więcej hemoglobiny niż normocyty; 3. mają dłuższy czas życia; 4. szybciej ulegają rozkładowi w śledzionie; 5. mają większą średnicę komórki niż normocyty; 6. komórki bezjądrowe, dwuwklęsłe. C. 2, 3, 5; D. 2, 4, 3. 6. W albinizmie ocznym u chorych obserwuje się: A. w chwili urodzenia skórę całkowicie białą, u dorosłych kolor oczu niebieski, piegowatość całego ciała; B. fotofobię, całkowity brak melaniny w 195 tęczówce oka, żółtobrązowy kolor włosów; C. światłowstręt, hipopigmentację tęczówki, zmniejszoną ostrość widzenia u mężczyzn; D. włosy miedziano-czerwone, tęczówki jasnobrązowe, przebarwienia skóry, zaburzenia ostrości widzenia. 7. Charakterystyczne dla fentylketonurii są: A. 1, 2, 5; B. 3, 4, 6; C. 1, 2, 6; D. 2, 3, 5. 1. podwyższone stężenie fenyloalaniny we krwi oraz płynach ustrojowych; 2. upośledzenie umysłowe i różnorodne zaburzenia neurologiczne; 3. odkładanie w tkance łącznej, w twardówce produktów oksydacji o zabarwieniu niebieskawoczarnym; 4. niedokrwistość hemolityczna, zwiększone stężenie bilirubiny w surowicy; 5. pojawiające się napady padaczkowe, stereotypia ruchowa, zachowanie przypominające autyzm; 6. zwiększona synteza neurotransmiterów - dopaminy i serotoniny, nasilona synteza osłonek mielinowych. 8. Przypadek. Konflikt serologiczny w układzie Rh (konflikt matczyno-płodowy): Pacjentka 24 lat, o grupie krwi BRh- w drugiej ciąży; mąż ma grupę 0Rh+. Pierwsza ciąża pacjentki zakończyła się poronieniem w 6 tygodniu; po zabiegu łyżeczkowania podano pacjentce immunoglobulinę IgG anty-RhD. Przez całą obecną ciążę kontrolowano przeciwciała. Pacjentka urodziła dziecko z grupą BRh+. A. Czy zawsze w sytuacji matka Rh-, ojciec Rh+ pojawia się konflikt serologiczny? B. Wyjaśnij pojęcie alloimmunizacji przez antygen RhD. C. Na czym polega i jakie jest działanie immunoprofilaktyki stosowanej po porodzie u kobiet Rh-, które urodziły pierwsze dziecko o grupie Rh+? 196 LITERATURA 1. Fabijańska-Mitek J. (red). 2007. Immunologia krwinek czerwonych. Grupy krwi. Biblioteka diagnosty laboratoryjnego, Wyd.I. ONIPHARMA Sp. Z o. o. Warszawa. 1-168. 2. Narodowe Centrum Krwi. 2014. Wytyczne w zakresie leczenia krwią i jej składnikami oraz produktami krwiopochodnymi w podmiotach leczniczych, Wyd.II. E-book. Wojskowy Instytut Medyczny, Warszawa. Dostępne online: https://www.gov.pl/web/nck/e-book-wytyczne-wzakresie-leczenia-krwia-i-jej-skladnikami-oraz-produktami-krwiopochodnymi-w-podmiotachleczniczych (18.11.2020). 3. Drewa G, Ferenc T (red.). 2011. Genetyka medyczna. Podręcznik dla studentów. Elsevier Urban & Partner Sp. z o.o., Wrocław. 1-935. Rozdział 2 – Genetyka klasyczna - cały Rozdział 10 – Dziedziczenie jednogenowe u człowieka : Podrozdział 10.1.1 Podrozdział 10.2.1 Podrozdział 10.2.4 Podrozdział 10.2.12 Podrozdział 10.2.13 Rozdział 13 – Grupy krwi Podrozdział 13.1 Podrozdział 13.1.1 Podrozdział 13.1.2 Podrozdział 13.1.3 Podrozdział 13.1.4 Podrozdział 13.1.5 Podrozdział 13.1.6 Podrozdział 13.1.8 Podrozdział 13.2 Podrozdział 13.2.1 Podrozdział 13.2.2 Podrozdział 13.2.3 Podrozdział 13.2.4 Podrozdział 13.3 Podrozdział 13.3.1 Podrozdział13.3.2 Podrozdział 13.4.5 Rozdział 24 – Poradnictwo genetyczne Podrozdział 24.4 Podrozdział 24.5 4. Bennett RL, Steinhaus French K, Resta RG, Lochner Doyle D. 2008. Standardized human pedigree nomenclature: update and assessment of the recommendations of the National Society of Genetic Counselors. J Genet Couns 17 (5), 424-33. DOI: 10.1007/s10897-008-91699. 197 Ćwiczenie 2 Temat: Chromosomy i cechy sprzężone z płcią. Obserwacja 1. Mitoza i mejoza: a) Allium sp.– różne fazy mitozy w komórkach stożka wzrostu korzenia: - prep. mikr. utrw. pow. 100, 400/600, 1000x (Olyvia). b) Lilium sp. - komórki macierzyste pyłku w I i II podziale mejotycznym: - prep. mikr. utrw. pow. 100, 400/600, 1000x (Olyvia). 2. Chromosomy politeniczne w śliniankach: a) larwy Drosophila sp.: - prep. mikr. utrw. metanolem, niebarw. pow. 100x (Olyvia). b) larwy Chironomus sp.: - prep. mikr. utrw. metanolem, barwiony orceiną, pow. 100, 400/600x (Olyvia). 3. Chromosomy: a) człowieka Homo sapiens - z hodowli limfocytów: - prep. mikr. barw. barwnikiem Giemsy, pow. 1000x – pokaz(Olyvia). b) myszy Mus sp. - z komórek szpiku kostnego: - prep. mikr. barw. barwnikiem Giemsy, pow. 1000x – pokaz(Olyvia). 4. Płeć chromatynowa człowieka: a) żeńska - „pałeczka dobosza” - prep. mikr. utrw. barwiony met. Pappenheima, pow. 1000x, (Olyvia). b) żeńska – ciałko Barra - prep. mikr. utrw. barwiony met. Pappenheima, pow. 1000x, (Olyvia). c) męska - ciałko Y w limfocytach i granulocytach - fot. – pokaz. Zadania genetyczne Zakres materiału do przygotowania przed zajęciami Chromosomy – struktura (poziomy organizacji chromatyny), budowa chromosomu metafazowego (chromatyda, telomer, kinetochor, centromer), rodzaje chromosomów. Podziały komórkowe (rodzaje, przebieg, rola): mitoza, mejoza, crossing over. Cykl komórkowy, fazy S, G1, G2, G0; zmiany ilości materiału genetycznego i liczby chromosomów w cyklu, różnicowanie komórek. Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Chromosomy politeniczne – powstawanie, występowanie, wykorzystanie w badaniach genetycznych. Heterosomy: chromosom X – budowa, chromatyna płciowa (definicja, wykrywanie), hipoteza Lyon; chromosom Y – budowa, chromatyna Y (definicja, wykrywanie), dziedziczenie holandryczne. Regiony pseudoautosomalne heterosomów. Wybrane cechy dziedziczące się w sprzężeniu z płcią (rodzaje, zasady dziedziczenia, objawy, metody diagnostyki): hemofilia; zaburzenia widzenia barw; dystrofie mięśniowe Duchenne`ą i Beckera. Zadania genetyczne – cechy sprzężone z płcią, sprzężenie autosomowe. 198 CZĘŚĆ TEORETYCZNA Chromosomy Chromosomowa teoria dziedziczności opracowana przez Tomasza Morgana (1910) powstała dzięki badaniom chromosomów politenicznych. Występują one w gruczołach ślinowych larw owadów dwuskrzydłych (Diptera) np. u Drosophila melanogaster i Chironomus sp., a także w innych tkankach sekrecyjnych tych owadów (cewki Malpighiego, komórki nabłonka jelita grubego, komórki odżywcze jajnika). Chromosomy politeniczne to chromosomy interfazowe, powstające w wyniku replikacji DNA bez podziału jądra komórkowego (średnio występuje 10 cykli replikacyjnych, powstaje 210 chromatyd, tzn. 1024 kopie). Powstające chromatydy pozostają ułożone równolegle, co powoduje, że chromosomy są ponad 100-krotnie większe niż typowe chromosomy mitotyczne. Techniki barwienia chromosomów politenicznych ujawniają wzór jasnych i ciemnych prążków, odpowiadających występowaniu euchromatyny i heterochromatyny. Obszary występowania aktywnej transkrypcji DNA widoczne są jako jasne zgrubienia nazywane pierścieniami Balbianiego lub pufami. Liczba i rozkład puf jest charakterystyczny dla określonych stadiów larwy i podlega zmianom w trakcie jej rozwoju. Te zjawiska pozwoliły wykorzystać chromosomy politeniczne w badaniach genetycznych: w mapowaniu genów, wykrywaniu aberracji chromosomowych, w badaniach struktury jądra komórkowego, a także regulacji ekspresji genów. Prawidłowa liczba chromosomów w komórkach człowieka została wykazana w 1956 r. (Joe Hin Tjio i Albert Levan). Chromosomy są widoczne tylko podczas podziałów komórkowych – są najbardziej skondensowaną formą chromatyny jądrowej. Kompleks kwasy nukleinowe - białka jest nazywany chromatyną. Wykazuje ona zróżnicowany stopień zagęszczenia czyli kondensacji: duży stopień kondensacji to heterochromatyna, mniej skondensowana – euchromatyna. Liczba chromosomów jest stała i charakterystyczna dla danego gatunku, podobnie jak wielkość, cechy morfologiczne związane z położeniem centromeru i układ prążków widocznych po zastosowaniu określonej techniki barwienia. Zapis zestawu chromosomów typowy dla danego osobnika – zapis kariotypu, podaje ogólną liczbę chromosomów, a po przecinku składu chromosomów płci. W przypadku stwierdzonych aberracji chromosomowych liczby czy struktury również opisuje się te nieprawidłowości stosując odpowiednie symbole zgodnie z International System of Chromosome Nomenclature (ISCN). Metody cytogenetyki klasycznej opierają się na analizie obrazu prążków na chromosomach, uzyskanego przy wykorzystaniu konkretnego barwienia i porównaniu go z dostępnym wzorcem badanej osoby/gatunku. Dla oceny kariotypu danej osoby, niezbędne jest pobranie z jej organizmu komórek jądrzastych, pobudzenie ich do wejścia w proces mitozy, a następnie zahamowanie podziału na etapie metafazy w celu uzyskania obrazu chromosomów płytki metafazowej. Metody cytogenetyczne opierające się na barwieniu różnicowym, umożliwiają identyfikację aberracji o wielkości nie mniejszej niż 5 milionów par zasad. W barwieniu konwencjonalnym stosuje się barwnik Giemsy, który łączy się z ujemnymi resztami fosforanowymi na całej powierzchni chromosomu. W wyniku barwienia uzyskuje się obraz prążków ciemniejszych (prążki „pozytywne”) i jaśniejszych („negatywne”), charakterystyczny dla danego chromosomu. W przypadku diagnostyki bardzo małych aberracji strukturalnych chromosomów, często stosuje się połączenie metod cytogenetycznych z metodami molekularnymi. Metody biologii molekularnej stosowane do analizy aberracji struktury i liczby chromosomów są także szczególnie przydatne do badania poszczególnych loci genów. Spośród tych technik diagnostycznych warto wymienić: FISH ; Fluorescence in situ hybridization, hybrydyzacja fluorescencyjna in-situ; CGH; Comparative Genomic Hybridization, porównawcza hybrydyzacja genomowa; aCGH; array Comparative Genomic Hybridization, porównawcza hybrydyzacja genomowa dla mikromacierzy; 199 qPCR; quantitative PCR, ilościowy PCR; MLPA; Multiplex Ligation-dependent Probe Amplification; NGS; Next Generation Sequencing, sekwencjonowanie nowej generacji. Prawidłowy kariotyp człowieka: 23 pary chromosomów: 22 pary autosomów i 1 para heterosomów, 46,XY – mężczyzna i 46,XX – kobieta (zapis bez przecinka 44XX oznacza 44 autosomy i dwa chromosomy płci; podanie 46XX oznacza, że jest w komórce 46 autosomów i dwa chromosomy płci, czyli razem 48 chromosomów – zapis błędny dla kariotypu człowieka). Płeć chromatynowa człowieka Chromosomy płciowe człowieka (heterosomy, chromosomy X i Y) Chromosom X Pod względem wielkości i położenia centromeru chromosom X jest podobny do chromosomów z grupy C (submetacentryczny, średniej wielkości). Chromosom X obejmuje około 1,8x10 8 par zasad, co stanowi około 5 % całkowitego DNA w komórkach. Aktualne dane (marzec 2021) bazy OMIM (Online Mendelian Inheritance in Man, http://omim.org) podają o identyfikacji 1203 pozycji genów na chromosomie X. Szacuje się, że chromosom X zawiera 800 do 900 genów kodujących białka funkcjonalne. Na wczesnym etapie rozwoju embrionalnego jeden z dwóch chromosomów X jest losowo i trwale inaktywowany w komórkach innych niż komórki jajowe. Zjawisko to nazywa się inaktywacją X lub lionizacją (wyciszenie epigenetyczne). Geny ważne dla determinacji i różnicowania płci zlokalizowane są na ramionach długich chromosomu X. Są to geny kodujące białkowe receptory jądrowe i cytoplazmatyczne, które pośredniczą w odpowiedzi komórek docelowych na działanie androgenów - testosteronu i dihydrotestosteronu. Na tych ramionach znajduje się także centrum inaktywacji chromosomu X (region XIC - Xq13.2). Na krańcach ramion krótkich i ramion długich chromosomu X znajdują się regiony pseudoautosomalne, odpowiednio PAR1 i PAR2. Są to regiony obecne również na chromosomie Y, homologiczne w obu chromosomach. Podczas mejozy w spermatogenezie możliwa jest koniugacja chromosomu X i Y i w tych regionach może zachodzić crossing-over. Regiony pseudoautosomalne zawierają geny kodujące cechy dziedziczące się tak jak cechy autosomalne (np. gen AMELX kodujący białko strukturalne emalii zębowej). Ważnym genem chorobowym w regionach pseudoautosomalnych jest gen SHOX (SHORT STATURE HOMEBOX), którego utrata czynnościowa jest przyczynowo związana z różnymi stanami niskiego wzrostu i zaburzeniami rozwoju kości. Gen ten, zlokalizowany w regionie PAR1 chromosomów płciowych X (Xpter-p22.32) i Y (Ypter-p11.2), odgrywa znaczącą rolę w rozwoju szkieletu, a zwłaszcza przedramion i podudzi. Fenotyp pacjenta z brakiem jednego z alleli genu SHOX zwykle charakteryzuje niskorosłość. Lionizacja Hipoteza inaktywacji chromosomu X została po raz pierwszy sformułowana w 1961 przez angielską genetyk Mary Lyon. Proces inaktywacji (kondensacji) jednego z chromosomów X określany jako "lionizacja" jest: niezależny, losowy i nieodwracalny w każdej komórce somatycznej. Jest to mechanizm kompensacyjny, wyrównujący poziom ekspresji genów zlokalizowanych na chromosomach płciowych (osobnik XX ma taką sama liczbę aktywnych kopii genów sprzężonych z chromosomem X jak osobnik XY). Inaktywacji nie podlegają geny regionu pseudoatosomalnego i niektóre geny zajmujące proksymalną część ramion długiego i krótkiego. 200 Oba chromosomy X są aktywne w stadium wczesnego zarodka. Następnie w komórkach zarodka żeńskiego, około 16 dnia życia zarodkowego, dochodzi do losowej inaktywacji jednego chromosomu X. Zmiany te są przekazywane podczas podziałów mitotycznych. Oba chromosomy X mogą być inaktywowane z jednakowym prawdopodobieństwem. Inaktywacja jest procesem trwałym, dotyczy całego pokolenia danej komórki, tzn. ten sam chromosom X pozostaje nieaktywny we wszystkich komórkach potomnych. Tak więc organizm kobiety pod względem chromosomu X jest mozaiką składającą się z komórek zawierających nieaktywny chromosom X ojcowski (Xpat) lub matczyny (Xmat). Nieaktywny chromosom X jest reaktywowany podczas oogenezy. Lionizacja (losowa inaktywacja chromosomu X) jest przykładem udziału różnych mechanizmów molekularnych preferencyjnie inaktywujących chromosom X, w tym mechanizmu wyciszania epigenetycznego. Wykazano, że jednym z efektów tego procesu jest modyfikacja wzoru metylacji DNA, dotycząca nukleotydów cytozynowych (głównie wysp CpG, co wiąże się z hamowaniem transkrypcji genu). Inne mechanizmy, oprócz zmian wzoru metylacji DNA, pozwalające utrzymać inaktywację chromosomu X w kolejnych pokoleniach komórek, dotyczą modyfikacji histonów jak i regulacji ncRNA (non-coding RNA, niekodujący RNA). W tym ostatnim przypadku, istotne znaczenie ma gen XIST, kodujący ncRNA, który odpowiada za inaktywację chromosomu X. Wykazano, że proces inaktywacji chromosomu X u kobiet jest inicjowany w określonym miejscu chromosomu X, w tzw. centrum inaktywacji (XIC), zlokalizowanym w regionie Xq13 (Layon 1986). Chromosom Y Mały, akrocentryczny, podobny do chromosomów z grupy G (wielkość może się różnić w szerokim zakresie). Wielkość chromosomu Y to 58 Mpz, co stanowi około 1 % całkowitego DNA genomowego. Geny sprzężone z chromosomem Y – przekazywane wyłącznie z ojca na syna – nazywane są genami holandrycznymi (sprzężenie holandryczne). Liczba genów na chromosomie Y szacowana jest, zależnie od metod badawczych, na 78-200 genów, w tym 45-73 genów kodujących białka). Wśród genów na chromosomie Y zidentyfikowano np: gen SRY (ang. Sex determining Region of Y), inicjujący w rozwoju zarodkowym różnicowanie się pierwotnej gonady w kierunku jądra, determinujący rozwój zarodka w kierunku męskim. geny kodujące czynniki zaangażowane w kontrolę spermatogenezy – np. AZF (ang. azoospermia factor region). gen KDM5D, dawniej nazywany HY lub SMCY, kodujący białko, którego krótki fragment jest słabym antygenem zgodności tkankowej (może prowadzić do odrzucenia u biorcy przeszczepu męskich komórek dawcy). geny metabolizmu podstawowego. Pod względem struktury chromatyny można wyróżnić 2 regiony chromosomu Y: heterochromatynowy i euchromatynowy. Region euchromatynowy obejmuje całe ramię krótkie, okolicę przycentromerową i część proksymalnego ramienia długiego. Region ten zawiera wszystkie dotychczas zidentyfikowane geny na chromosomie Y (rycina 2b). Region przycentromerowy zawiera grupę genów odpowiedzialnych za spermatogenezę. Heterochromatyna konstytutywna (regiony praktycznie nieulegające ekspresji, lecz pełniące wyłącznie funkcje strukturalne) zawiera repetytywne satelitarne DNA i obejmuje dystalny odcinek Yq przylegający do Yq12 (regionu PAR2). Na końcach obu ramion znajdują się regiony pseudoautosomalne PAR1 i PAR2, obejmujące ok. 5% par zasad chromosomu Y. Pozostała część chromosomu Y, obejmująca regiony eu- i heterochromatynowe (95% par zasad), tworzy region NRY (non-recombining Y). NRY nie ulega rekombinacji, dlatego jest przekazywany w stanie zwykle niezmienionym z ojca na syna –obydwaj mają ten sam profil polimorfizmu związanego z chromosomem Y (ten sam zestaw alleli, dziedziczonych razem czyli haplotyp). Haplotypy chromosomu Y różnią się między populacjami różnych regionów geograficznych, co wiąże się z pojawianiem się mutacji de novo w różnych lokalizacjach regionu NRY. 201 Dlatego ich analiza jest ważna w procesie ustalania pochodzenia człowieka (poszukiwanie Ychromosomalnego Adama) i szlaków migracji gatunku ludzkiego. Należy podkreślić, że gen SRY (Yp11), znajduje się bardzo blisko regionu PAR1. W wyniku nieprawidłowo przebiegającego crossing-over między chromosomami X i Y w czasie spermatogenezy u ojca, może nastąpić przeniesienie fragmentu ramion krótkich zawierającego gen SRY na chromosom X. W efekcie może dojść do niezgodności między płcią chromosomową a fenotypową (mężczyzna 46,XX). Chromatyna X (ciałko X, ciałko Barra) i chromatyna Y (ciałko Y) W 1949 r Barr i Bertram zaobserwowali, że w jądrach interfazowych osobników żeńskich wybarwia się ciemniejsza grudka zasadochłonnej chromatyny, przylegająca do błony jądrowej. Tę część chromatyny jądrowej nazwano ciałkiem Barra lub ciałkiem X. Odpowiada ona nieaktywnym chromosomom X w komórce z więcej niż jednym chromosomem X, unieczynnionym w procesie lionizacji, u gatunków z determinacją płci XY. Ciałka Barra są obecne w komórkach niemal wszystkich tkanek. Nie występują w prawidłowych komórkach męskich i w żeńskich komórkach linii płciowej. Badane są w rozmazach nabłonka jamy ustnej i w komórkach płynu owodniowego. U kobiet chromatyna X widoczna jest w od 20 do 70% komórek, a o wyniku dodatnim – płeć chromatynowa żeńska – świadczy obecność ciałek Barra w co najmniej 20% jąder. Liczba ciałek Barra będzie zawsze o 1 mniejsza od liczby chromosomów X (tabela 1). W granulocytach obojętnochłonnych, po odpowiednim wybarwieniu, chromatyna X uwidacznia się w postaci „wyrzuconych” poza obręb jądra – ale pozostających z nim w kontakcie – grudek chromatyny, tzw. pałeczek dobosza (widoczne w 1-10% komórek). Chromatyna Y została wykryta w 1970 r. przez Pearsona, stosującego metody fluorescencyjne w badaniu komórek. Jest to jasno świecąca grudka chromatyny widoczna w jądrze interfazowym odpowiadająca dystalnej, heterochromatynowej części długich ramion chromosomu Y (Yq12). Liczba ciałek Y jest równa liczbie chromosomów Y (tabela 1). Ciałko Y stwierdza się w 30-50% badanych komórek męskich, m.in. plemniki (23,Y), limfocyty, komórki nabłonka jamy ustnej. Badanie chromatyny płciowej stosowane do niedawna w diagnostyce klinicznej (określenie płci chromatynowej, zaburzeń rozwoju cielesno-płciowego, diagnostyka aberracji liczbowych X), obecnie jest zastępowane analizą kariotypu oraz technikami hybrydyzacji in situ ze specyficznymi sondami molekularnymi np. metoda FISH. Tabela 1. Liczba ciałek chromatynowych w jądrze diploidalnej komórki somatycznej Chromosomy płci 45,X 46,XX 46,XY 47,XXX 47,XXY 47,XYY 48,XXXX 48,XXXY 48,XXYY 49,XXXXX 49,XXXXY 49,XXXYY Maksymalna liczba ciałek chromatynowych w jądrze diploidalnej komórki somatycznej Ciałka X Ciałka Y 0 1 0 2 1 0 3 2 1 4 3 2 0 0 1 0 1 2 0 1 2 0 1 2 202 Dziedziczenie cech sprzężonych z płcią Dziedziczenie holandryczne - przekazywanie cechy odbywa się tylko na linii ojciec-syn (rycina 1). Rycina 1. Schemat dziedziczenia holandrycznego (opracowanie własne). Dziedziczenie cechy recesywnej sprzężonej z chromosomem X Tabela 2. Genotypy i fenotypy cechy recesywnej sprzężonej z chromosomem X KOBIETY MĘŻCZYŹNI GENOTYP XAXA FENOTYP zdrowa genetycznie XAXa zdrowa klinicznie, nosicielka XaXa chora XAY zdrowy XaY chory Tabela 3. Dziedziczenie cechy recesywnej sprzężonej z chromosomem X Genotyp: Gamety: Potomstwo: Mężczyzna zdrowy x Kobieta zdrowa XAY XAXa A X Y XA Xa połowa synów choruje, połowa córek jest nosicielkami Genotyp: Gamety: Potomstwo: Mężczyzna chory x Kobieta zdrowa XaY XAXA a X Y XA XA wszyscy synowie zdrowi, wszystkie córki są nosicielkami Hemizygota – mężczyzna ma tylko jeden chromosom X i tylko jedną kopię każdego genu sprzężonego z chromosomem X (tabela 2). Chorują głównie hemizygotyczni mężczyźni, heterozygotyczne kobiety ze zmutowanym genem nie chorują (nosicielki). Bardzo rzadko występuje układ gdy oba chromosomy X mają zmutowany gen (układ homozygotyczny) – tylko wtedy kobiety chorują. Kobiety nosicielki (heterozygoty) zmutowanego genu przekazują go z 50% prawdopodobieństwem zarówno córkom, jak i synom (tabela 3). Ze związku kobiety nosicielki (heterozygoty) i zdrowego mężczyzny 50% synów będzie chorych i 50% zdrowych, wśród córek 50% będzie nosicielkami i 50% będzie zdrowych. 203 Chory mężczyzna (hemizygota) nie przekazuje choroby synom natomiast wszystkie córki będą nosicielkami choroby. Dziedziczenie cechy dominującej sprzężonej z chromosomem X Hemizygota – mężczyzna ma tylko jeden chromosom X i tylko jedną kopię każdego genu sprzężonego z chromosomem X (tabela 4). Chorują zarówno hemizygotyczni mężczyźni, jak i heterozygotyczne kobiety. Heterozygotyczne kobiety z nieprawidłowym genem mają zazwyczaj łagodną postać choroby, natomiast hemizygotyczni mężczyźni – ciężką. Chory mężczyzna (hemizygota) nie przekazuje choroby synom natomiast wszystkie córki będą chore. Kobiety chore (heterozygoty) przekazują zmutowany gen z 50% prawdopodobieństwem zarówno córkom, jak i synom (tabela 5). Patologiczny gen dominujący (na chromosomie X) u mężczyzn jest często letalny. Tabela 4. Genotypy i fenotypy cechy dominującej sprzężonej z chromosomem X KOBIETY MĘŻCZYŹNI GENOTYP XAXA FENOTYP chora, najczęściej genotyp letalny XAXa chora XaXa zdrowa XAY chory, często cecha letalna XaY zdrowy Tabela 5. Dziedziczenie cechy dominującej sprzężonej z chromosomem X Mężczyzna chory x Kobieta zdrowa Genotyp: Gamety: Potomstwo: XAY XA XaXa Y Gamety: Potomstwo: Xa Wszystkie córki chore, synowie zdrowi Mężczyzna zdrowy Genotyp: Xa XaY x Kobieta chora XAXa Xa Y XA Xa 50% córek zdrowych, 50% córek chorych, 50% synów zdrowych, 50% synów chorych Wybrane choroby dominujące sprzężone z chromosomem X krzywica hipofosfatemiczna (XLH) gen: PHEX, locus Xp21 zespół Retta, gen: MECP2, locus Xq28. zespół Martina-Belli, gen: FMR1, locus Xq27 204 Choroby recesywne sprzężone z chromosomem X Hemofilia Wrodzone zaburzenia krzepnięcia krwi (skazy krwotoczne osoczowe). Podłożem molekularnym są mutacje w genach: • F8C, locus Xq28 (czynnik VIII) - hemofilia A (HA) • F9, locus Xq27 (czynnik IX) - hemofilia B (HB) Częstość występowania: HA – 1:10 tys.- 1:20 tys. urodzeń (w Polsce ok. 7:100 000); HB – 1:30 tys. urodzeń (w Polsce 1:100 000). Klinicznie hemofilia A i B nie różnią się od siebie (tabela 6). Objawy pojawiają się we wczesnym dzieciństwie – zwykle na przełomie 1 i 2 roku życia; podczas narodzin krwawienia na ogół nie występują. Śmiertelność chorych jest 2x wyższa niż u mężczyzn populacji ogólnej. Hemofilia A Za hemofilię A odpowiedzialne są mutacje w genie F8, których wynikiem jest brak syntezy czynnika VIII, ograniczenie syntezy bądź powstanie nieprawidłowego białka. Zwykle choroba ma cięższy przebieg kliniczny, jeżeli przyczyną są mutacje, w których efekcie dochodzi do utraty większego fragmentu genu lub przedwczesnego wprowadzenia do sekwencji kodonu „stop”, ponieważ zmiany te prowadzą do skrócenia łańcucha białkowego. Ok. 45% przypadków ciężkiej postaci choroby jest wynikiem inwersji i translokacji eksonów. W literaturze opisano kilka niezwykle rzadkich przypadków kobiet z objawową HA, co może się zdarzyć: w przypadku skrajnej lionizacji (nieprawidłowej inaktywacji chromosomu X pochodzącego od jednego z rodziców); w zespole Turnera (monosomia chromosomu X); u córki urodzonej ze związku nosicielki HA i chorego na HA; w przypadku translokacji zrównoważonej z udziałem locus Xq28. Hemofilia B Najczęściej (74% wszystkich mutacji) wykrywa się podstawienia pojedynczych nukleotydów — mutacje zmiany sensu i mutacje nonsensowne, rzadziej splicingowe i inne. Pozostałe identyfikowane zmiany w genie F9 to małe (< 50 pz) delecje) duplikacje lub insercje oraz większe (> 50 pz) rearanżacje genowe. Tabela 6. Postacie kliniczne hemofilii A i B (Źródło: Drewa G, Ferenc T. Genetyka medyczna) Postać kliniczna, poziom czynnika VIII lub IX w osoczu Objawy Łagodna (5-40% normy) Epizody krwawienia – głównie po operacjach i po dużych urazach; samoistnie nie występują Umiarkowana (1-5% normy) Przedłużone krwawienia – po lżejszych urazach, operacjach, ekstrakcjach zębów; Wylewy śródstawowe – rzadko, średnio nasilone Ciężka (<1% normy) Ciężkie krwawienia – w wyniku urazów, mikrourazów, po operacjach; Samoistne krwawe wylewy domięśniowe, śródstawowe i okołostawowe; Rozległe i nawracające wylewy podśluzówkowe i podskórne; Krwawienia zewnętrzne i wylewy wewnątrzczaszkowe 205 Dystrofie mięśniowe Duchenne’a (DMD) i Beckera (BMD) DMD to najczęstsza i najcięższa z postaci dystrofii mięśniowych, częstość występowania DMD: 1:3 600 żywo urodzonych chłopców; częstość występowania BMD (odmiana alleliczna DMD o lżejszym przebiegu klinicznym) – 1:30 000 urodzeń. W DMD najwcześniejszymi objawami są trudności z wchodzeniem po schodach, chód kaczkowaty, częste upadki; pacjenci zgłaszają się z tymi objawami w wieku 2–3 lat. W wieku około 10–12 lat większość jest zależna od wózków inwalidzkich, a około 20 r.ż. wymaga wspomaganej wentylacji. Przy optymalnej opiece większość pacjentów z DMD umiera między 20 a 40 rokiem życia z powodu niewydolności serca i / lub układu oddechowego. Przyczyną choroby są mutacje w genie kodującym białko dystrofinę, locus Xp21. Białko to uczestniczy w organizacji elementów strukturalnych błony komórkowej miocytów mięśni szkieletowych, serca, mięśni gładkich oraz niektórych neuronów. Najczęstszym typem mutacji są delecje (ponad 60%), mutacje punktowe są mniej częste (25-35%). Zaburzenia widzenia barw Widzenie barwne u człowieka (widzenie trichromatyczne, trichromatyzm) możliwe jest dzięki obecności w siatkówce oka trzech typów fotoreceptorów – czopków, zawierających chromofor (11-cisretinal) oraz białka opsyny o różnej maksymalnej wrażliwości na fale świetlne określonych długości. Geny kodujące białka barwników wzrokowych to: OPN1LW – gen protanu, locus Xq28 – koduje opsynę fotoreceptorów wrażliwych na kolor czerwony; OPN1LMW – gen deutanu, locus Xq28 – koduje opsynę fotoreceptorów wrażliwych na kolor zielony; OPN1SW – gen tritanu, locus na autosomie 7q31-q32 – koduje opsynę fotoreceptorów wrażliwych na kolor niebieski. Podstawowe rodzaje zaburzeń związanych z widzeniem barw: achromatyzm (achromatopsja) – całkowity brak czopków siatkówki, całkowita niezdolność do rozpoznawania barw; monochromatyzm – całkowity brak dwóch rodzajów czopków, widzenie jednobarwne zredukowane do czerni, bieli i szarości; dichromatyzm – całkowity brak jednego rodzaju czopków, widzenie dwubarwne; anomalny trichromatyzm – obecne wszystkie trzy rodzaje czopków, nieprawidłowa sekwencja aminokwasów białkowej części pigmentów czopków. Dichromatyzm to całkowity brak wrażliwości na fale o długości odpowiadającej jednej z barw podstawowych. Wyróżnia się: protanopię – nierozpoznawanie barwy czerwonej (lub mylenie jej z barwą zieloną), kolor różowy i fioletowy widziane jako niebieski (cecha dziedziczona w sposób sprzężony z chromosomem X). deuteranopię – nierozpoznawanie barwy zielonej (lub mylenie jej z barwą czerwoną); brak rozróżnienia koloru czerwonego, pomarańczowego, żółtego i zielonego (cecha dziedziczona w sposób sprzężony z chromosomem X). tritanopię – nierozpoznawanie barwy żółtej i niebieskiej; brak czopków czułych na barwę niebieską (cecha dziedziczona autosomalnie). 206 Anomalny trichromatyzm to zaburzenie widzenia barw wynikające z różnic wrażliwości jednego z rodzajów czopków; różnice w sekwencji aminokwasów w pigmentach czopków ludzkiego oka prowadzą do niedowidzenia barwy. Wyróżnia się: protanomalię – niedowidzenie barwy czerwonej (dziedziczenie sprzężone z chromosomem X); deuteranomalię – niedowidzenie barwy zielonej (dziedziczenie sprzężone z chromosomem X); tritanomalię – niedowidzenie barwy niebieskiej (dziedziczenie autosomalne, chromosom 7). Uszkodzenia genów protanu i deutanu prowadzące do zaburzeń widzenia barw osi czerwień-zieleń polegają najczęściej na częściowej lub całkowitej delecji w obrębie genów. Bliskie położenie obydwu genów na chromosomie X oraz wysoki stopień ich identyczności (w 96%) są przyczyną częstego występowania niehomologicznego crossing-over między dwoma chromosomami X podczas gametogenezy u kobiet. Efektem jest zmiana liczby genów deutanu, całkowita delecja OPN1MW lub powstawanie genów hybrydowych, które kodują nieprawidłowe opsyny, czego skutkiem jest protanomalia lub deuteranomalia, protanopia lub deuteranopia. W rzadkich przypadkach przyczyną zaburzeń widzenia barw w zakresie czerwień-zieleń mogą być mutacje punktowe w obrębie genu deutanu. Stwierdzono, że geny niedowidzenia barw (anomalii) dominują nad całkowitym niewidzeniem (anopią) – występuje dziedziczenie hierarchiczne alleli: allel normy w chromosomie X dominuje nad allelem protanomalii X P1 , a ten dominuje nad allelem protanopii XP2 : X > XP1> XP2 podobnie allel normy w chromosomieX dominuje nad allelem deuteranomalii X d1 , a ten dominuje nad allelem deuteranopii Xd2 : X > Xd1> Xd2 Kobiety mogą być podwójnie obciążone genami nieprawidłowego widzeniem barw. Stwierdzono, że w przypadku gdy w każdym chromosomie X występuje gen nieprawidłowości dotyczący odmiennej barwy, kobieta widzi prawidłowo. Przykłady genotypów i fenotypów przedstawia tabela 7. Tabela 7. Genotypy i fenotypy widzenia barw Genotyp Fenotyp XP1 XP2 protanomalia Xd1Xd2 deuteranomalia XP2 XP2 protanopia Xd1Xd1 deuteranomalia Xd1Xp2 prawidłowe widzenie X Xd1 prawidłowe widzenie Xd2Xp2 prawidłowe widzenie 207 Przykład krzyżówki: ♀ XXP1 córka widząca prawidłowo (obciążona genem protanomalii) XP1Xd1 x XY ♂ XP1Y X Xd1 syn córka z protanomalią widząca prawidłowo (obciążona genem deuteranamalii) Xd1Y syn z deuteranamalią Zaburzenia widzenia barw najczęściej czerwonej i zielonej spowodowane nieprawidłową ilością barwników wzrokowych są nazywane potocznie daltonizmem (nazwa pochodzi od angielskiego chemika Johna Daltona, który w 1794 roku na własnym przypadku opublikował jej opis). Dla sprawdzenia zdolności widzenia barwnego i oceny zaburzeń widzenia w zakresie barw czerwonej i zielonej (tzw. osi czerwono-zielonej) stosowane są tablice pseudoizochromatyczne Ishihary (Shinobu Ishihara, japoński okulista, 1917). Nie można wykryć za pomocą tego badania zaburzeń widzenia barwy niebieskiej. Pełny test Ishihary polega na pokazaniu pacjentowi 36 tablic; wersje przesiewowe liczą 14 lub 24 tablice. Pierwsza tablica widziana jest nawet przez osoby z zaburzeniami widzenia barwnego. Za pomocą kolejnych tablic wykrywa się różne stopnie (od upośledzenia postrzegania do całkowitej ślepoty na barwę) zaburzeń widzenia barwy czerwonej oraz barwy zielonej. Badanie prowadzi się pokazując tablice w świetle dziennym, w ciągu 3 sek. z odległości 75 cm. Na 21 kolejno pokazanych tablic (1-21) osoba prawidłowo rozróżniająca barwy odczytuje 17, zaś osoby z zaburzeniem - 13. Kolejne tablice o numerach 22-25 pozwalają na odróżnienie protanopii od deuteranopii; kolejne 26-36 na odróżnienie niedowidzenia barwy czerwonej i zielonej. Inne testy oceniające widzenie barwne: Test z wykorzystaniem tablic Hardy’ego, Randa i Rittnera – umożliwia zbadanie zaburzeń widzenia barwy czerwonej, zielonej i niebieskiej. W Polsce tablice te nie są popularne. Test Farnswortha D-15 – test przesiewowy oceniający widzenie barwy czerwonej, zielonej i niebieskiej. Polega na ułożeniu w odpowiedniej kolejności barwnych klocków tak, aby ich kolory płynnie przechodziły jeden w drugi. 208 CZĘŚĆ PRAKTYCZNA OBSERWACJA 1. Mitoza i mejoza a) Allium sp.– różne fazy mitozy w komórkach stożka wzrostu korzenia- obserwacja w programie Olyvia/mikroskop Zwróć uwagę na: charakterystyczne ułożenie chromosomów, określ fazę podziału komórkowego b) Lilium sp. - komórki macierzyste pyłku w I i II podziale mejotycznym - obserwacja w programie Olyvia/mikroskop Zwróć uwagę na: charakterystyczne ułożenie chromosomów, określ fazę podziału komórkowego 2. Chromosomy politeniczne w śliniankach Chromosomy politeniczne w śliniankach – obserwacja/rysunek w programie Olyvia/mikroskop. Zwróć uwagę na: wielkość i charakterystyczną strukturę chromosomów larwy Drosophila, larwy Chironomus 209 4. Chromatyna płciowa X – obserwacja/rysunek w programie Olyvia/mikroskop a) pałeczka dobosza b) ciałko Barra c) męska - ciałko Y w limfocytach i granulocytach - fot. – pokaz/opis Podpis prowadzącego ……………………………………… Data ……………………………… 210 REPOZYTORIUM Jakie jest prawdopodobieństwo urodzenia się zdrowego syna, jeżeli matka jest obciążona genem hemofilii? oznaczamy: X H – chromosom X zawierający gen prawidłowego krzepnięcia krwi X h - chromosom X zawierający gen hemofilii ♀ X HX h córka zdrowa klinicznie obciążona XHX h x X hY syn z hemofilią X HY ♂ X HX H córka zdrowa klinicznie i genetycznie X HY syn zdrowy P(♂, zdrowego) = 1/2 x 1/2 = 1/4 = 25% Odpowiedź. Zdrowi synowie będą stanowili 25% potomstwa, czyli połowa synów będzie zdrowa. ZADANIA GENETYCZNE 1. Ojciec wykazuje deuteranopię, a matka obciążona jest protanomalią, oboje wykazują też sierpowatość krwinek. Jakiej jest prawdopodobieństwo urodzenia się im zdrowego syna? 2. Podaj prawdopodobieństwo urodzenia się zdrowego syna z grupą krwi A2B, jeżeli matka jest obciążona genem dystrofii Duchenne’a i ma grupę krwi A1, a ojciec ma grupę krwi A2B. 211 3. Wykaż, czy możliwe jest urodzenie się dziecka zdrowego, jeżeli ojciec ma brachydaktylię, a matka obciążona jest zanikiem mięśni typu Duchenne'a? 4. Matka z dołkami w policzkach, jest obciążona genem deuteranopii, a ojciec z siwym kosmkiem włosów wykazuje zaburzone widzenie barwy czerwonej. Jakie jest prawdopodobieństwo urodzenia się im córki prawidłowo widzącej barwy, z dołkami w policzkach i siwym kosmkiem? 5. Matka jest nosicielką recesywnego genu letalnego sprzężonego z chromosomem X, ma rude włosy i nos orli. Ojciec jest ciemnowłosy i ma nos prosty. Z jakim prawdopodobieństwem urodzi się im zdrowy, ciemnowłosy syn z nosem orlim? 6. Matka jest obciążona genem hemofilii, ojciec nie widzi barwy zielonej. Podaj genotypy i fenotypy potomstwa tych rodziców. 212 ZADANIA DO SAMOKSZTAŁCENIA 1. Podpisz struktury widoczne na zdjęciach: A B C 2. Prawdziwe zdania dotyczące chromosomu Y to: A.1, 3, 5; B. 1, 4, 5; C. 2, 3. 5; D. 1, 3, 4. 1. jest akrocentryczny; 2. jest submetacentryczny; 3. zawiera fragment, który bierze udział w crossing-over między chromosomami płciowymi; 4. zawiera fragment euchromatynowy w ramionach krótkich; 5. w ramieniu długim zawiera geny receptorów jądrowych i cytoplazmatycznych dla androgenów. 3. Chromosomy politeniczne: A. 3, 4, 6; B. 2, 3, 4; C. 1, 4, 5; D. 1, 2, 6. 1. powstają w wyniku tzw. endoreplikacji; 2. występują tylko w śliniankach owadów; 3. geny w nich są nieaktywne transkrypcyjnie; 4. są znajdowane u postaci larwalnych owadów w cewkach Malpighiego; 5. największa ekspresja genów zachodzi w puffach; 6. są 2 - 10 razy większe od normalnych chromosomów danego organizmu. 4. Rodowód cechy sprzężonej z chromosomem X - hemofilia Przeanalizuj rodowód brytyjskiej rodziny królewskiej przedstawiający dziedziczenie hemofilii. Podaj genotypy poszczególnych członków rodziny. 213 LITERATURA Drewa G, Ferenc T. 2011. Genetyka medyczna, Wydawnictwo Elsevier Urban & Partner Sp. z o.o., Wrocław. Rozdział 10.3 – Wybrane choroby uwarunkowane genami recesywnymi sprzężonymi z chromosomem X : • Podrozdział 10.3.1; • Podrozdział 10.3.2; • Podrozdział 10.3.2.1 • Podrozdział 10.3.2.2 • Podrozdział 10.3.3 • Podrozdział 10.3.5 Rozdział 18.6 – Chromosomy płci Rozdział 18.7 – Chromatyna płciowa • Podrozdział 18.7.1 • Podrozdział 18.7.2 • Podrozdział 18.7.3 214 Ćwiczenie 3 Temat: Mutacje genowe i chromosomowe. Obserwacja 1. Mutacje genowe: a) Drosophila sp. – typ dziki: - samica - prep. mikr. utrw. etanolem, niebarwiony, pow. 100x – pokaz, (Olyvia). - samiec - prep. mikr. utrw. etanolem, niebarwiony, pow. 100x – pokaz, (Olyvia). b) mutanty Drosophila sp.: - white - prep. mikr. utrw. etanolem, niebarw., pow. 100x – opis, (Olyvia). - bar- prep. mikr. utrw. etanolem, niebarw., pow. 100x – opis, (Olyvia). - nub2 - prep. mikr. utrw. etanolem, niebarw., pow. 100x – opis, (Olyvia). - yellow- prep. mikr. utrw. etanolem, niebarw., pow. 100x – opis, (Olyvia). - ebony – prep. makr. utrw. etanolem, niebarw., pow. 100x – opis, (Olyvia). 2. Aberracje chromosomowe w komórkach nowotworowych: a) raka płaskonabłonkowego szyjki macicy (He-La): - prep. mikr. z hodowli tkankowej, utrw. etanolem z kw. octowym, barw. barwnikiem Giemsy, pow. 1000x– pokaz, (Olyvia). b) NK/Ly (Nemeth-Kellner Lymphoma) myszy Mus sp. - prep. mikr. barw. met. May-Grunwald-Giemsa-Romanovsky, pow. 1000x – pokaz, (Olyvia). Zadania genetyczne Zakres materiału do przygotowania przed zajęciami Rodzaje mutacji: genowe (mutacja punktowa: tranzycja, transwersja, duplikacja, delecja; mutacja cicha, mutacja nonsensowna, mutacja synonimiczna i niesynonimiczna; przesunięcie ramki odczytu); chromosomowe (aberracje) - strukturalne (inwersja, translokacja, duplikacja, delecja, insercja; chromosom kolisty, chromosom dicentryczny, izochromosom) i liczbowe (aneuploidie, euploidie). Czynniki mutagenne (chemiczne, fizyczne, biologiczne). Kariotyp, kariogram – definicje. Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Mutacje genowe i chromosomowe – rodzaje, definicje, mechanizmy powstawania, skutki fenotypowe u człowieka. Mutacje u organizmów modelowych (muszka owocowa). Zespoły: Turnera, Klinefeltera, zespół XXX, zespół XYY, zespół Downa, Edwardsa, Patau, cri-du chat (przyczyny powstawania zespołów, rodzaje aberracji, kariotypy, częstość występowania, charakterystyczne objawy). Zadania genetyczne – nondysjunkcja, translokacja. 215 CZĘŚĆ TEORETYCZNA Mutacje Mutacja – to utrwalona w wyniku podziałów komórkowych zmiana w materiale genetycznym komórki. W ogólnym ujęciu wyróżniamy mutacje genowe oraz chromosomowe. Mutacje genowe - zmiana sekwencji zasad nukleotydowych w pojedynczym genie, Mutacje chromosomowe – zmiana struktury lub liczby chromosomów (aberracje liczbowe; mutacje genomowe). Wyróżniamy następujące główne rodzaje mutacji zachodzących na różnych poziomach organizacji materiału genetycznego (rycina 1): Rycina 1. Podział mutacji (wg. Drewa i Ferenc, 2011, zmodyfikowano). 1. Mutacja genowa – zmiana w sekwencji zasad nukleotydowych w pojedynczym genie. Istnieją mutacje punktowe (zmiany pojedynczej zasady) lub większe (zmiana więcej niż jednej zasady). Wyróżnia się cztery podstawowe typy mutacji punktowych: substytucja – zastąpienie jednej zasady azotowej inną, wyróżniamy: • tranzycję (puryna zastępowana jest inną puryną lub pirymidyna pirymidyną np. A/G lub C/T), • transwersję (zamianę zasady purynowej na pirymidynową lub odwrotnie np. A/T lub C przez G). delecja – utrata jednego lub kilku par nukleotydów. insercja – wstawienie jednego nukleotydu lub kliku par nukleotydów. inwersja – zmiana kolejności nukleotydów. Mutacje mogą powodować różnorodne skutki fenotypowe, zmiany strukturalne i/lub funkcjonalne w białku kodowanym przez dany gen (tabela 1). 216 Tabela 1. Skutki fenotypowe mutacji genowych. Nazwa mutacji Opis zmiany na poziomie struktury mRNA Obserwowany efekt fenotypowy Mutacja zmiany sensu (ang. missense mutation) = mutacja niesynonimiczna zmiana pojedynczej zasady, co powoduje zmianę kodonu i/lub ominięcie kodonu terminacji translacji. Mutacje takie występują zwykle w jednej z dwóch pierwszych zasad kodonu Może prowadzić do zmiany struktury i funkcji białka poprzez wbudowanie innego aminokwasu; zmutowany fenotyp Mutacja typu nonsens (ang. nonsense mutation) zmiana pojedynczego nukleotydu, która powoduje zmianę kodonu aminokwasowego na kodon terminujący (stop), co skutkuje powstaniem sygnału terminacji translacji mRNA Zatrzymanie syntezy białka Mutacja cicha = mutacja synonimiczna (ang. silent mutation) zmiana pojedynczego nukleotydu (zmiana trzeciej zasady kodonu), nie powodująca zmiany aminokwasu w kodowanym białku (różne kodony dla tego samego aminokwasu) brak znaczenia funkcjonalnego, przydatne w identyfikacji osobniczej (polimorfizmów) i badaniach ewolucyjnych Mutacja zmiany ramki odczytu (ang. frameshift mutation) delecja lub insercja nukleotydu w rejonie kodujacym, powodująca przesunięcie w ramki odczytu; zmiana wszystkich kodonów sekwencji aminokwasowych Tworzenie dysfunkcyjnego białka, możliwe zatrzymanie syntezy białka; powstanie zmutowanego fenotypu Mutacje sekwencji repetytywnych (amplifikacja trójnukleotydowego motywu powtórzeń w części kodującej lub niekodującej genu) najczęściej bez znaczenia z wyjątkiem tzw. mutacji dynamicznych (wydłużenie powtórzeń trójnukleotydowych związanych z genem powyżej ich krytycznej liczby może prowadzić do choroby jednogenowej) Przyczyna wielu chorób neurodegeneracyjnych i nerwowomięśniowych spowodowanych ekspansją powtórzeń trinukleotydowych (ang. Triplet Repeat Expansion Diseases) Mutacje dynamiczne Zwielokrotnienie liczby powtórzeń sekwencji nukleotydowej, najczęściej dwu/trójnukleotydowych motywów w sekwencji genu. Występują w części niekodującej lub kodującej genu. Liczba powtórzeń u osób chorych wzrasta w kolejnych pokoleniach (mutacje niestabilne). Mutacje te mogą powodować zaburzenia prawidłowego przebiegu transkrypcji; w efekcie mutacji choroba genetyczna spowodowana jest niskim stężeniem białka, nieprawidłową jego strukturą/funkcją lub całkowitym jego brakiem jak np.: zespół Fra X lub ataksja Friedreicha, Choroba Huntingtona. W zależności od miejsca powstawania, mutacje dzielimy na mutacje somatyczne i mutacje w komórkach rozrodczych (germinalne): w komórkach somatycznych (mutacje somatyczne; w komórkach ciała) - nie są dziedziczone przez potomstwo (np. inna barwa lewego i prawego oka); ich nagromadzenie może przyczyniać się do rozwoju procesu nowotworzenia (często mutacje genów kontrolujących cykl komórkowy). 217 w komórkach rozrodczych (mutacje germinalne) – dziedziczone z pokolenia na pokolenie; lub powstają de novo w procesie oogenezy lub spermatogenezy. Wszystkie komórki powstałego po zapłodnieniu organizmu posiadają zmienioną informację genetyczną. Mogą być przyczyną chorób jednogenowych. Natomiast ze względu na czynnik wywołujący, mutacje dzielimy na spontaniczne i indukowane: mutacje spontaniczne wynikają z przypadkowych błędów w replikacji DNA lub transkrypcji RNA i procesie naprawy, powstają bez działania określonych przyczyn zewnętrznych; mutacje indukowane wywołane są przez mutageny - różne czynniki fizyczne, chemiczne lub biologiczne (tabela 2). Częstość mutacji spontanicznych jest porównywalna dla wielu organizmów, niezależnie od stopnia organizacji (od bakterii do człowieka) i wynosi 10 -4 – 10-6 na 1 locus na 1 pokolenie (średnia częstość mutacji - 10-5 na 1 locus na 1 pokolenie). Tabela 2. Czynniki mutagenne (fizyczne, chemiczne, biologiczne) oraz efekty ich oddziaływania na poziomie komórkowym (zmiany materiału genetycznego). Czynnik mutagenny Oddziaływanie – powstająca mutacja Fizyczny Promieniowanie jonizujące Fragmentacja chromosomów → aberracje chromosomów Promieniowanie UV Podstawianie dimerów tyminy i cytozyny → mutacje punktowe Wysoka temperatura Pęknięcia chromosomów; zaburzenia replikacji DNA Kwas azotowy HNO2 Usuwa grupę aminową z zasad azotowych w DNA → mutacje punktowe Hydroksylamina NH2OH Reaguje z cytozyną → mutacje punktowe; interferuje z aktywnością wybranych enzymów Czynniki alkilujące, np. diepoksybutan Alkilowanie azotu → mutacje punktowe zasad azotowych Analogi zasad azotowych, np. 5-bromouracyl Włączone do DNA → mutacje punktowe Barwniki akrydynowe Włączenie do łańcucha DNA → mutacje: delecje i insercje w trakcie replikacji Kolchicyna Dezorganizacja wrzeciona mitotycznego → poliploidia Streptomycyna Mutacje DNA mitochondrialnego Retrowirusy (wirus HIV, Mutacja insercyjna → wstawienie materiału genetycznego wirusa do genomu komórki → powolna, długotrwała transformacja komórki Chemiczny Biologiczny wirus mięsaka-Rousa) Wirus zapalenia wątroby typu B Wirus Epsteina-Barr Zawierają onkogeny w materiale genetycznym → silna ekspresja → szybka transformacja komórkowa Ze względu na zmiany w produkcie translacji, mutacje można podzielić na: mutacja typu utraty funkcji (ang. loss-of-function) – mutacja powodująca powstanie produktu białkowego pozbawionego normalnej funkcji. mutacja typu nabywania funkcji (ang. gain-of-function) – mutacja prowadząca do powstawania produktu białkowego mającego nowe właściwości (np. zmieniona, niska aktywność). mutacja w obszarach regulacyjnych genu – zmiany w ekspresji genu. 218 mutacja w miejscu splicingu (ang. splice-site mutation)- zmiana w sekwencji DNA występująca na granicy eksonu i intronu; może zakłócić składanie (splicing) RNA powodując utratę egzonów lub zaburzać wycinanie intronów i w efekcie zmienić sekwencję kodującą białko. Istotnym elementem różnorodnosci funkcjonalnej i strukturalnej produktu białkowego jest m.in. zjawisko polimorfizmu genetycznego – czyli występowanie w genomach zmienności allelicznej (tj. różne odmiany tego samego genu). Allele te warunkują różne fenotypy. Przyczyną polimorfizmu genetycznego jest mutacja, jednak nie każda mutacja jest mutacja polimorficzną. Mutacje polimorficzne – to mutacje punktowe w genie, warunkujące zmienność alleliczną, występujące w populacji z częstością większa niż 1%. Przykładem mutacji polimorficznych może być polimorfizm pojedynczego nukleotydu (ang. Single Nucleotide Polymorphism, SNP), który jest podstawą powstawania nowych alleli i odpowiada za około 90 % całej zmienności występującej w ludzkim materiale genetycznym. Służy do określania różnorodności genetycznej w badaniach populacyjnych. Mutacja nie musi ujawniać się w momencie powstania. Może ujawnić się gdy zaistnieją warunki fenotypowej ekspresji zmutowanego genu – relacja genom/środowisko (zmiany ekogenetyczne). Przykładem może być dziedzicznie uwarunkowana zdolność do wyczuwania cyjanowodoru czy fenylotiomocznika ujawniająca się w momencie występowania, któregoś z tych związków w środowisku. Brak katalazy (akatalazja = akatalazemia, cecha autosomalna recesywna) ujawnia się, gdy krew osoby chorej zabarwi się na brunatno pod wpływem kontaktu z wodą utlenioną np. podczas przemywania skaleczenia. U osób z xeroderma pigmentosum (skóra pergaminowata barwnikowa), zmiany skórne występują tylko pod wpływem promieniowania słonecznego. Każda mutacja wiąże się ze zmianą materiału genetycznego. Często są to zmiany niekorzystne dla organizmu, ale zdarzają się obojętne lub wręcz korzystne. Te dwie ostatnie możliwości mają duże znaczenie w ewolucji i są przyczyną zmienności organizmów. Mutacje genowe muszki owocowej Drosophila melanogaster Thomasa Hunt Morgan, eksperymentując na muszce owocowej, stwierdził występowanie różnych mutantów. Pierwszą zauważoną była mutacja „white” - biała barwa oka, mutacja recesywna w chromosomie X. Typ (szczep) dziki muszki ma oczy czerwone (tzw. czerwień sztandarowa). Obecnie znamy bardzo wiele mutacji u muszki owocowej, opracowano mapy genetyczne chromosomów i określono lokalizacje danych genów. Przykłady mutantów u Drosophila melanogaster: ebony (ciemna barwa ciała) - mutacja recesywna w autosomie pary 3, nub2 (silnie zredukowane skrzydła) - mutacja recesywna w autosomie pary 2, yellow (żółta barwa ciała) - mutacja recesywna w chromosomie X, white (biała barwa oka) - mutacja recesywna w chromosomie X, Bar (wąskie oczy) - zredukowana liczbie fasetek oka, duplikacja genu w chromosomie X, ultra Bar - triplikacja genu w chromosomie X; powstaje w wyniku nieprawidłowej koniugacji chromosomów podczas mejozy i nierównego crossing-over, Aberracje/mutacje chromosomowe Aberracje struktury chromosomów pojawiają się najczęściej podczas podziałów komórkowych jako efekt pęknięcia chromosomu/chromatydy, nieprawidłowego podziału centromeru lub błędów powstających podczas wymiany crossing-over. Wśród tych aberracji wyróżniamy: 219 1. Delecję (deficjencję), czyli utratę fragmentu chromosomu z części dystalnej (delecja terminalna) lub środkowej (delecja interstycjalna). Utrata zbyt dużej ilości materiału genetycznego (powyżej 3%) powoduje śmierć zmutowanych komórek. 2. Duplikację, czyli zwielokrotnienie fragmentu chromosomu. Zazwyczaj nie zaburza ona funkcjonowania organizmu lecz prowadzi do utworzenia tzw. pseudogenów. 3. Inwersję, do której dochodzi na skutek nieprawidłowej naprawy pękniętych fragmentów chromosomu, które ulegają odwróceniu o 180°. Zmiana pozycji genów może wpływać na ich ekspresję. Wyróżnia się dwa typy tej mutacji: inwersję pericentryczną, która obejmuje fragment chromosomu zawierający centromer oraz paracentryczną – dotyczącą odcinka bez centromeru. 4. Translokację, która polega na przeniesieniu fragmentu jednego chromosomu na drugi chromosom: niehomologiczny (translokacja interchromosomalna, zewnętrzna) lub homologiczny (translokacja intrachromosomalna, wewnętrzna). Translokacja, podczas której dochodzi do wzajemnej wymiany odcinków między chromosomami niehomologicznymi to translokacja wzajemna. Natomiast w translokacji robertsonowskiej (fuzja centryczna, dotyczy chromosomów akrocentrycznych) następuje połączenie ramion długich dwóch chromosomów i powstaje jeden, często z centromerami obu chromosomów. Krótkie ramiona tych chromosomów są najczęściej eliminowane z komórki (utrata materiału genetycznego). Do aberracji chromosomowych strukturalnych zalicza się także powstanie pary chromosomów telocentrycznych, które tworzą się podczas pęknięcia centromeru (podział centryczny) w chromosomie o dwóch ramionach. Przy poprzecznym podziale centromeru mogą także powstawać izochromosomy – chromosomy składające się z dwóch identycznych ramion (długich lub krótkich). W wyniku utraty (delecja) końcowych odcinków chromosomu (jednego lub kilku) i połączeniu się ze sobą powstałych w ten sposób zakończeń może tworzyć się tzw. chromosom kolisty. Ze względu na skutki fenotypowe aberracje strukturalne dzieli się na zrównoważone – w czasie których nie doszło do utraty lub zwiększenia ilości materiału genetycznego, i niezrównoważone – ze zmianami ilości materiału genetycznego. Odcinki niektórych chromosomów, charakteryzują się szczególną łamliwością (tzw. miejsca kruche genomu np. 2q13, 10q25.2, region Xq27.3). Miejsca te są szczególnie podatne na działanie mutagenów i kancerogenów. Odziaływanie tych czynników w miejscach kruchych genomu w efekcie może prowadzić do złamań chromosomowych, delecji i określonych skutków fenotypowych – utraty informacji genetycznej (utrata genów sąsiedzkich) jak i letalności, gdy delecje obejmują duże fragmenty chromosomów.Przykłady aberracji struktury chromosomów u człowieka: translokacja pomiędzy chromosomami pary 8 i 14 – onkogen C-MYC z ramion długich chromosomu 8q przeniesiony w regiony regulatorowe genów na chromosomie 14q co powoduje aktywację onkogenu i proliferację komórek limfoidalnych – występuje w chłoniaku Burkitta; translokacja wzajemna między ramionami długimi chromosomu 9q i 22q – powstaje tzw. chromosom Philadelphia (chromosom Filadelfia, chromosom Ph); występuje w ponad 95% przypadkach przewlekłych białaczek szpikowych; a także w ostrych białaczkach limfoblastycznych; niezrównoważona translokacją robertsonowska – przeniesienie na chromosom z grupy D (najczęściej 14) ramienia długiego chromosomu 21; nadmiar informacji genetycznej: obok prawidłowych dwóch chromosomów 21 pary, chromosom translokacyjny zawiera ramiona długie chromosomu 21; całkowita liczba chromosomów w genomie człowieka wynosi 46 – zespół Downa translokacyjny; zrównoważona translokacja robertsonowska – między chromosomami grupy D (najczęściej 14) i chromosomem pary 21;występuje jeden prawidłowy chromosom 21 oraz chromosom translokacyjny zbudowany z 14q i 21q, całkowita liczba chromosomów w genomie człowieka wynosi wówczas 45 – nosiciel translokacji zrównoważonej, bez objawów klinicznych. 220 Mutacje genomowe (zmiana liczby chromosomów) Do aberracji liczbowych można zaliczyć: aneuploidie (odchylenia liczby w poszczególnych parach chromosomów - obecność dodatkowego lub zubożenie o jeden lub więcej chromosomów): • nullisomię (2n-2) – brak jednej pary chromosomów, • monosomię (2n-1) – brak jednej kopii danego chromosomu, • trisomię (2n+1) – trzy kopie jednego chromosomu, • tetrasomie (2n+2) – cztery kopie jednego chromosomu, • podwójne monosomie (2n-1-1) – brak chromosomów z dwóch par, • podwójne trisomie (2n+1+1) – dodatkowe chromosomy z dwóch par, poliploidie (euploidie) – zmiany liczby całego garnituru chromosomów: obecność więcej niż dwu kompletnych haploidalnych zestawów chromosomów (triploidia-3n, tetraploidia-4n, oktaploidia8n). Euploidie mogą tworzyć się wskutek nieprawidłowych podziałów komórkowych i objawiać zwielokrotnieniem homologicznego zestawu chromosomów (genów) u jednego organizmu autopoliploidu. Allopoliploidem nazywamy zaś organizm u którego zwielokrotniony garnitur chromosomowy ma pochodzenie mieszańcowe - powstaje w wyniku połączenia się gamet pochodzących od osobników należących do blisko spokrewnionych ze sobą gatunków. Aberracje liczbowe chromosomów - są wynikiem nondysjunkcji. Można ją zdefiniować jako brak rozdziału lub nierównomierne rozdzielenie się chromosomów homologicznych (w czasie mejozy) lub chromatyd siostrzanych (w czasie mitozy i/lub mejozy), w wyniku czego następuje ich nierównomierna segregacja do komórek potomnych, a także utrata chromosomów w anafazie spowodowana uszkodzeniem wrzeciona kariokinetycznego. Do nondysjunkcji mejotycznej najczęściej dochodzi w gamecie matczynej, podczas oogenezy (90% przypadków), rzadziej nondysjunkcja występuje w trakcie spermatogenezy. Zjawisko nondysjunkcji jest związane z wiekiem matki (efekt wieku) – u kobiet między 20-29 rokiem życia ryzyko jest stałe, natomiast po ukończeniu 30 roku życia ryzyko nondysjunkcji sukcesywnie rośnie wraz z wiekiem matki. Ryzyko związane z wiekiem jest takie same dla kobiet, które wcześniej urodziły dziecko, jak i dla kobiet, dla których jest to pierwsza ciąża.Nondysjunkcja może wystąpić w wyniku: depolaryzacji wrzeciona mejotycznego, przedwczesnej segregacji chromatyd siostrzanych, spontanicznej nondysjunkcji, stymulowania promieniowaniem, zaburzeń systemów naprawczych w trakcie podziałów komórkowych, braku napięcia kinetochoru. Specyficzną formą aberracji chromosomowych jest mozaicyzm. Dochodzi do niego już po zapłodnieniu, podczas pierwszych podziałów zygoty, w wyniku nondysjunkcji w trakcie podziału mitotycznego. 221 Tabela 3. Przykłady aberracji chromosomowych u człowieka (opracowanie własne na podstawie Ferenc i in. 2011). Nazwa jednostki chorobowej Typowy kariotyp/kariotypy Podstawowe objawy kliniczne / cechy dysmorficzne Częstość występowania w populacji ludzkiej (wg. Drewa, Ferenc 2011) Aberracje liczbowe heterosomów Zespół Turnera (monosomia) 45,X Zespół Klinefeltera (trisomia) 47,XXY Zespół XXX (trisomia X) Zespół XYY/ trisomia niski wzrost, szczątkowe jajniki, słabo rozwinięte sutki, niedorozwój wtórnych cech płciowych, pierwotny brak miesiączki sylwetka typu kobiecego, ginekomastia, dysgenezja jąder, atrofia kanalików nasiennych (brak spermatogenezy) 47,XXX prawidłowy fenotyp 47,XYY prawidłowy fenotyp 1:2500-3000 urodzonych dziewczynek 1:660-1000 urodzonych chłopców 1:1000 urodzonych dziewczynek 1:1000 urodzonych chłopców Aberracje liczbowe autosomów Zespół Edwardsa (trisomia) 47,XX,+21 47,XY,+21 translokacje chromosomu 21 z innymi chromosomami 47,XX,+18 47,XY,+18 Zespół Patau (trisomia) 47,XX,+13 47,XY,+13 Zespół Downa (trisomia) fałd mongolski, duży pobrużdżony język, plamki Brushfielda na tęczówce, hipotonia, upośledzenie umysłowe liczne wady wrodzone, upośledzenie umysłowe liczne wady rozwojowe, szczególnie OUN i narządu wzroku, upośledzenie umysłowe 1:700 urodzeń (do 1:30 dla matek w wieku 45 lat) 1:8000 urodzeń 1:8000-12000 urodzeń Aberracje strukturalne autosomów Zespół Cri-du Chat 46,XX,del5p 46,XY,del5p Zespół PraderaWilliego 46,XX,del15q 46,XY,del15q Zespół Filadelfia t(9:22)(q34:q11) niedorozwój krtani, nieprawidłowości budowy twarzy, niedorozwój umysłowy hipotonia, hipogonadyzm, otyłość, niedorozwój umysłowy przewlekła białaczka szpikowa lub ostra białaczka limfoblastyczna 1:37000-50000 urodzeń 1:15000-30000 urodzeń Zapadalność roczna przewlekła białaczka szpikowa 1-1,5:100000 (wg. Szczeklik 2017) 222 CZĘŚĆ PRAKTYCZNA OBSERWACJA 1. a) Drosophila sp. – typ dziki - obserwacja/opis w programie Olyvia/mikroskop samiec/samica ! Zwróć uwagę na cechy charakterystyczne dla płci żeńskiej i męskiej: wielkość odwłoka (liczba segmentów), występowanie „grzebienia płciowego” na pierwszej parze nóg u samca oraz na barwę ciała, wielkość i barwę oczu, długość skrzydeł b) Mutanty Drosophila sp. – white, bar – obserwacja/porównianie w programie Olyvia/mikroskop ! Zwróć uwagę na: barwę oka, liczbę fasetek oka i płeć osobnika, u którego te cechy występują c) Mutanty Drosophila sp. – nub2 – obserwacja/opis w programie Olyvia/mikroskop ! Zwróć uwagę na: rozmiar skrzydeł d) Mutanty Drosophila sp. – yellow, ebony – obserwacja/porównanie w programie Olyvia/mikroskop ! Zwróć uwagę na: barwę ciała 2. a) Komórki/chromosomy raka płaskonabłonkowego szyjki macicy (He-La) – obserwacja/opis w programie Olyvia/mikroskop ! Zwróć uwagę na: liczbę chromosomów b) Komórki/chromosomy NK/Ly (Nemeth-Kellner Lymphoma) myszy Mus sp. – obserwacja/opis w programie Olyvia/mikroskop ! Zwróć uwagę na: liczbę chromosomów i nieprawidłowe figury mitotyczne Podpis prowadzącego ……………………………………… Data………………………… 223 REPOZYTORIUM Wykazać, że zdrowi rodzice mogą mieć dziecko z zespołem Turnera. kariotypy zdrowych rodziców: 46, XX i 46, XY prawidłowe gamety posiadałyby zestaw chromosomów: matka: 23, X 23, X ojciec: 23, X 23, Y 1) Non-dysjunkcja heterochromosomów u matki; Gamety: Matka: 24, XX 22 Ojciec: 23, X 23, Y Po połączeniu gamet powstają zygoty o kariotypach: 47, XXX zespół kobiety z trzema X 47, XXY zespół Klinefeltera 45, X zespół Turnera 45, Y przypadek letalny - poronienie Odpowiedź. Zdrowi fenotypowo rodzice mogą mieć dziecko z zespołem Turnera z prawdopodobieństwem 1/3, jeśli podczas tworzenia gamet zajdzie non-dysjunkcja heterochromosomów u matki. 2) Non-dysjunkcja heterochromosomów u ojca: Gamety: Matka: 23, X 23,X Ojciec: 24, XY 22 Po połączeniu gamet powstają zygoty o kariotypach: 45, X zespół Turnera 47, XXY zespół Klinefeltera 45, X zespół Turnera 47, XXY zespół Klinefeltera Odpowiedź. Zdrowi fenotypowo rodzice mogą mieć dziecko z zespołem Turnera z prawdopodobieństwem 1/2, jeśli podczas tworzenia gamet zajdzie non-dysjunkcja heterochromosomów u ojca. ZADANIA GENETYCZNE 1. Udowodnij, że zdrowi rodzice mogą mieć dziecko z zespołem Edwardsa. Przeanalizuj wszystkie przypadki – podaj prawdopodobieństwo wystąpienia zespołu. 224 2. Jakie jest prawdopodobieństwo, że zdrowi rodzice będą mieli córkę z zespołem Turnera, jeśli nondysjunkcja zaszła w gametach matki? 3. Jakie jest prawdopodobieństwo, że matka z niezrównoważoną translokacją robertsonowską der(14;21) i zdrowy ojciec będą mieli dziecko z zespołem Downa? 225 4. Jakie kariotypy (i z jakim prawdopodobieństwem) będą miały dzieci matki ze zrównoważoną translokacją robertsonowską der(15q,21q) i zdrowego ojca? 226 ZADANIA DO SAMOKSZTAŁCENIA 1. Przeanalizuj kariotyp widoczny na schemacie. Podaj zapis kariotypu oraz rodzaj aberracji, który przedstawia. 2. Plamki Brushfielda na tęczówce oka są typowe dla osób z zespołem: A. Patau; B. Downa; C. Klinefeltera; D. Turnera. 3. Mutacja typu yellow (żółta barwa ciała) u muszki owocowej dotyczy genu zlokalizowanego na chromosomie: A. 1; B. 2; C. 3; D. X. 4. Z wymienionych cech charakterystyczne dla zespołu Turnera są: A. koślawe łokcie, obniżone IQ, wysoki wzrost; B. niedorozwój gonad, obecność chromatyny płciowej, wady wrodzone układu krążenia; C. niedorozwinięte zewnętrzne narządy płciowe, szeroka klatka piersiowa z szeroko rozstawionymi brodawkami sutkowymi; D.niska linia włosów na karku, wąskie biodra; prawidłowy rozwój gonad. 4. Zespół Edwardsa charakteryzuje się: A. długą szyją i dużą głową, niedorozwojem przełyku; B. rozszczepem wargi i wadami gałek ocznych i serca; C. ginekomastią i wysokim wzrostem, zaburzonym rozwojem ruchowym; D. zniekształceniem stóp, wadami nerek i małogłowiem. 5. Przypadek: Chłopiec urodzony w 37 tygodniu ciąży, rodzice starsi – po 40 roku życia. W wieku 5 lat dziecko skierowano do Poradni Endokrynologicznej z powodu niezstąpienia jąder (wnętrostwa). Klinicznie u chłopca zaobserwowano następujące cechy fenotypowe: hypertyloryzm, szeroką nasadę nosa, deformację trzecich palców stóp, płaskostopie, koślawość łokci, ubogie linie papilarne, skoliozę, wady zgryzu, zmiany próchnicze w uzębieniu, wysoko wysklepione podniebienie. W trakcie wizyty w Poradni Endokrynologicznej zwracały uwagę wyraźne cechy psychotyczne (duży poziom lęku, słaby kontakt z otoczeniem, niemożność skupienia uwagi). USG jąder: w obrębie worka mosznowego, kanałów pachwinowych, jamy brzusznej nie stwierdzono obecności jąder. Zaproponuj rodzaj dodatkowych badań, które należało by wykonać u tego dziecka w celu zdiagnozowana najprawdopodobniej przyczyny (jakiej ?) powyższych zmian fenotypowych. 227 LITERATURA 1. Ahmad M., Silvera-Rolando C., Rodriquez M.H. 2010. Nondisjunction and chromosomal anomalies. Salud Uninorte. Barranquilla. 26(1): 117-133. 2. Bal J. (red) 2017. Genetyka medyczna i molekularna. Wydawnictwo Naukowe PWN, Warszawa. 3. „Genetyka medyczna” red. G. Drewa, T. Ferenc, Wrocław 2011: Rozdział 16 – Zmienność i mutacje • Podrozdział 16.1 • Podrozdział 16.3 • Podrozdział 16.3.1 • Podrozdział 16.4 • Podrozdział 16.4.1 • Podrozdział 16.4.1.1 • Podrozdział 16.4.1.2 • Podrozdział 16.4.1.3 • Podrozdział 16.4.1.4 • Podrozdział 16.4.1.5 • Podrozdział 16.4.1.6 • Podrozdział 16.4.1.7 • Podrozdział 16.4.1.8 • Podrozdział 16.5 • Podrozdział 16.5.1 • Podrozdział 16.5.2 • Podrozdział 16.6 Rozdział 19 – Zespoły aberracji chromosomowych • Podrozdział 19.1 • Podrozdział 19.2 • Podrozdział 19.3.1 • Podrozdział 19.3.1.1 • Podrozdział 19.3.1.2 • Podrozdział 19.3.2 • Podrozdział 19.3.3 • Podrozdział 19.4.2 • Podrozdział 19.6.2 • Podrozdział 19.6.3 • Podrozdział 19.6.3.1 • Podrozdział 19.6.3.2 • Podrozdział 19.6.5 228 Ćwiczenie 4 Temat: Cechy wieloczynnikowe. Doświadczenie 1. Model rozkładu cechy wieloczynnikowej ilościowej w populacji - krzywa rozkładu w aparacie Galtona. 2. Badanie cechy wieloczynnikowej ilościowej w populacji człowieka - zdolności umysłowe: - test powtarzania liczb wprost i wspak, - badanie zdolności rozumowania arytmetycznego, - badanie zakresu wiadomości, - opis testów i przeliczenie wyników według skali Wechslera 3. Analiza daktylogramu – typ wzoru, wskaźnik RC, porównanie wzorów prawej i lewej dłoni. Zadania genetyczne Zakres materiału do przygotowania przed zajęciami Cechy poligenowe ilościowe (barwa ciała, wzrost, masa ciała) i jakościowe (wady rozwojowe, choroby przewlekłe). Zakres materiału do przygotowania: Dziedziczenie poligenowe ilościowe i jakościowe – definicja, zasady dziedziczenia, rozkład cechy w populacji. Odziedziczalność, transgresja, dziedziczenie u potomstwa. Układ linii papilarnych – dermatoglify: sposób dziedziczenia, wzory/układy dermatoglifów. Inteligencja (skala Wechslera, IQ). Zadania genetyczne – sprzężenie autosomowe, cechy poligenowe. 229 CZĘŚĆ TEORETYCZNA Cechy wieloczynnikowe W organizmach żywych, zarówno roślinnych jak i zwierzęcych, najwięcej cech to tzw. cechy wieloczynnikowe (określane także jako kompleksowe), występujące u każdego osobnika, ale ujawniające się w fenotypie z różnym natężeniem. Cechy te są determinowane przez współdziałanie wielu par genów z różnych loci (geny niealleliczne), z których każdy wykazuje mały, ale addytywny efekt warunkujący predyspozycję genetyczną do wystąpienia danej cechy. Dodatkowo, cechy te determinowane są poprzez wpływ czynników środowiskowych. Każda z danej pary genów determinujących cechę wieloczynnikową dziedziczy się zgodnie z prawami Mendla. Komponenta środowiskowa to szeroko rozumiany wpływ środowiska, tzn. czynników takich jak: dieta, uwarunkowania geograficzne w tym klimat, zanieczyszczenie środowiska itp. Zmienność genetyczna warunkuje predyspozycję genetyczną; oddziaływanie czynników środowiskowych na tle genetycznym powoduje ujawnienie cechy wieloczynnikowej o określonej wartości (dziedziczenie wieloczynnikowe) lub wystąpienie objawów choroby. Jeśli rozważamy wyłącznie czynniki genetyczne (pewna liczba genów nieallelicznych), wówczas dziedziczenie określa się jako wielogenowe (poligenowe), a geny je warunkujące określa się jako poligeny, geny sumujące się, addytywne. Cechy wieloczynnikowe - wykazują zmienność populacyjną i wewnątrzrodzinną. Genetyczna predyspozycja dla cech wieloczynnikowych jest dziedziczona od obojga rodziców. Rozpoznanie dziedziczenia wieloczynnikowego związane jest z wykluczeniem innych typów dziedziczenia. Cechy kliniczne chorób wieloczynnikowych mogą nie różnić się od zaburzeń spowodowanych innymi przyczynami (np. rozszczep wargi i/lub podniebienia mogą spowodować czynniki teratogenne środowiska, może to być cecha w zespołach aberracji chromosomowych, może to być wada izolowana o dziedziczeniu wieloczynnikowym). Zwyczajowo wyróżniamy wśród nich cechy wieloczynnikowe ilościowe i cechy wieloczynnikowe jakościowe. Cechy wieloczynnikowe ilościowe Cechy te wykazują zmienność ciągłą w populacji – rozkład fenotypów jest rozkładem normalnym z określoną wartością średnią arytmetyczną cechy w populacji i z możliwością podania odchylenia wartości indywidualnej od średniej (Rycina 1). W każdej populacji są osobniki o skrajnym (minimalnym i maksymalnym) natężeniu danej cechy, ale większość osobników wykazuje jej pośrednie (przeciętne) natężenie. Przykłady takich cech, które można zmierzyć, wyrazić liczbowo, to np.: wzrost, masa ciała, inteligencja (iloraz inteligencji), liczba listewek skórnych w różnych układach linii papilarnych, liczba erytrocytów, wartość ciśnienia tętniczego krwi, stężenie cholesterolu czy glukozy w surowicy krwi, wymiary ciała (oceniane na podstawie pomiarów antropometrycznych), podatność na infekcje (np. wynikająca ze stężenia w surowicy wytwarzanych immunoglobulin). Skrajną manifestacją cechy wieloczynnikowej ilościowej może być stan patologiczny np.: otyłość, nadciśnienie tętnicze. Stopień odchylenia od wartości średniej cechy (zwykle wyrażany krotnością odchylenia standardowego) może być podstawą do wyodrębniania w populacji grup wykazujących np. karłowatość lub gigantyzm czy upośledzenie umysłowe lub wybitną inteligencję. W analizach natężenia cech wieloczynnikowych ilościowych rozpatrujemy w genotypach liczbę genów aktywnych („dominujących”) o efektach sumujących się i genów neutralnych („recesywnych”). 230 Rycina 1. Krzywa rozkładu cechy wieloczynnikowej ilościowej w populacji. (a) Rozkład normalny (uwzględniająca wyłącznie wpływ genów), (b) Rozkład rzeczywisty - rozkład wysokości ciała 21-letnich poborowych, podana w werszkach (werszek – dawna rosyjska miara długości, wynosząca 1¾ cala angielskiego; tj. ok. 4,45 cm) (źródło: Budowa fizyczna człowieka na ziemiach polskich wczoraj i dziś. red. M. Kopczyński, A. Siniarska, Muzeum Historii Polski, Warszawa 2017, s.111-122). Rozkład natężenia cechy zależy od liczby genów polimerycznych warunkujących daną cechę i jeżeli liczba ta wzrasta, to rozkład dwumianowy częstości fenotypów zbliża się do krzywej rozkładu normalnego – krzywej Gaussa. Rycina 1 przedstawia rozkład natężenia cechy zależny jedynie od czynników genetycznych (a), oraz rozkład (histogram) zależny od czynników genetycznych i środowiskowych (b). Cechy ilościowe, które u zdrowych osób mają zmienność ciągłą, mogą wykazywać znaczne odchylenia wskutek wpływu innych czynników genetycznych lub środowiskowych, np. achondroplazja może bardzo ograniczyć wzrost dziecka, które normalnie mogłoby osiągnąć wzrost przeciętny. Dziecko wysokich rodziców prawdopodobnie będzie wyższe od dziecka niższych rodziców, ale niewłaściwe odżywianie może ograniczyć wzrost każdego z tych dzieci. Na nadciśnienie tętnicze, oprócz czynników genetycznych, wpływają m. in. poziom lipidów, otyłość i stres, które je podwyższają. Dzieci mają tendencję do przypominania swoich rodziców pod względem cech fizjologicznych, determinowanych przez czynniki genetyczne. W przypadku fizjologicznych cech wieloczynnikowych ilościowych dzieci mają tendencję do osiągania średniej z wartości cech swoich rodziców, a także przekraczania zakresu cechy wyznaczonego przez pokolenie rodzicielskie. Dzieci rodziców, u których występują skrajne wartości cechy wieloczynnikowej, mają tendencję do osiągania wartości bardziej przeciętnych – określane to jest jako tzw. regresja do średniej. U dzieci rodziców o natężeniu cechy poniżej przeciętnej obserwuje się takie samo zjawisko, a tendencja do wyrównywania do średniej jest tym bardziej widoczna, im większe jest odchylenie cechy rodziców od średniej populacyjnej. Natomiast, tzw. transgresję (dodatnią, bądź ujemną) stwierdzamy gdy wartość cechy u dziecka jest znacząco wyższa lub niższa niż u rodziców. W populacji człowieka przykładami transgresji mogą być: dzieci Mulatów o barwie skóry jaśniejszej lub ciemniejszej niż ich rodzice, dzieci wyższe lub niższe od rodziców, bardziej lub mniej inteligentne lub bardziej lub mniej odporne na choroby zakaźne, ale także dzieci z chorobą uwarunkowaną wieloczynnikowo, która nie występowała u rodziców. 231 Wybrane cechy wieloczynnikowe ilościowe: Inteligencja (Raymond B. Cattell): 1. płynna: zależy od struktur i funkcji mózgu, które warunkują: koncentrację uwagi, szybkość kojarzenia, tempo pracy umysłowej, ujawnia się głównie w rozwiązywaniu testów bezsłownych (ujmowanie stosunków pomiędzy elementami), poziom najwyższy osiąga w wieku 18 – 21 lat, spada w konsekwencji starzenia się mózgu; 2. skrystalizowana: rozwija się na bazie inteligencji płynnej w wyniku uczenia się i nabywania doświadczenia (rozumienie zadań, wykrywanie analogii, definiowanie znaczenia słów), jest zdefiniowana kulturowo, rozwija się do wieku starczego. Pionierem badań naukowych nad inteligencją był Francis Galton. Pozostając pod wpływem Karola Darwina, twierdził (1883), że inteligencja to podstawowa zdolność umysłu, decydująca o sukcesie jednostki w „walce o byt”. Definicje inteligencji - przykłady: Jean Piaget – inteligencja to rozwinięta forma adaptacji biologicznej (koncepcja rozwoju intelektualnego). Rozwój umysłowy polega na coraz lepszym przystosowaniu, któremu towarzyszy wzrost złożoności i efektywności struktur poznawczych. Robert Sternberg – inteligencja to zjawisko indywidualne, należące do świata wewnętrznego jednostki jako zjawisko zdeterminowane przez świat zewnętrzny i odzwierciedlające się w doświadczeniach jednostki (triarchiczna teoria inteligencji). Iloraz inteligencji IQ - miara inteligencji (zdolności umysłowych), wartość liczbowa testu psychometrycznego; wskaźnik oceniający stopień rozwoju umysłowego: dzieci - iloraz wieku umysłowego do wieku życia, pomnożony przez 100, dorośli - iloraz inteligencji tzw. dewiacyjny opracowany przez D. Wechslera. Iloraz inteligencji dewiacyjny oznaczany jest w skali, w której wynikowi przeciętnemu dla danej populacji przypisuje się umowną wartość 100, a odchyleniu standardowemu od przeciętnej - umowną wartość 15. Tak obliczony wskaźnik, matematycznie pozwala ocenić poziom intelektualny jednostki na tle całej populacji. Skala Inteligencji Wechslera – 11 testów: 6 słownych: wiadomości, rozumienie, arytmetyka, powtarzanie cyfr, podobieństwa, słownik; 5 bezsłownych: porządkowanie obrazków, braki w obrazkach, układanki, klocki, symbole cyfr. Ocenia się, że 95% populacji wykazuje IQ 70-130, 68% ma IQ pomiędzy 85-115, 2% ma IQ poniżej 70 i powyżej 130, natomiast 0,1% ma IQ poniżej 55 i powyżej 145 (Rycina 2). 232 Rycina 2. Rozkład ilorazu inteligencji (IQ) w populacji (opracowanie własne). Jedynym warunkiem kwalifikującym do członkostwa w Mensie (międzynarodowym stowarzyszeniu zrzeszającym osoby o wysokim ilorazie inteligencji; nazwa od łacińskiej nazwy mensa - stół, nawiązująca do idei okrągłego stołu, przy którym nie ma miejsc ważniejszych i mniej ważnych) jest zdanie organizowanego przez Mensę testu badającego inteligencję z wynikiem umieszczającym osobę zdającą w 2% populacji o najwyższym ilorazie inteligencji. Testy grupowe organizowane są co pewien czas w większych miastach, istnieje też możliwość badań indywidualnych u psychologów Mensy. Warunkiem przystąpienia do testu jest udokumentowany wiek powyżej 15 lat. Zadania do testu przygotowują Amerykanie, testy są tajne. Testy Mensy nie zawierają typowych zadań z matematyki. Pytania zmieniają się średnio co 5 lat. Piszący mają 20 minut, żeby rozwiązać 45 zadań. Wynik testu jest objęty tajemnicą – nie jest nigdzie publikowany. Statystycznie test zdaje ok. 30% piszących osób. Linie papilarne – dermatoglify Charakterystyczny układ naskórkowych listewek, rozdzielonych równolegle biegnącymi rowkami (tzw. bruzdy), występujących w szczególności na opuszkach palców rąk, ale również na wewnętrznych powierzchniach dłoni oraz na palcach i powierzchni oporowej stóp u człowieka i innych naczelnych. Listewki spełniają funkcje czuciowe w organizmie (bodźce dotykowe) i mechaniczne (wspomagają przyczepność dłoni i stopy do podłoża). Układ linii papilarnych uwarunkowany jest prawdopodobnie przez 3 pary genów współdziałających (cechy jakościowe), zlokalizowanych na różnych chromosomach. Wzór linii dziedziczy się jako cecha jakościowa, natomiast liczba listewek skórnych jako cecha ilościowa. Układ linii papilarnych, uwarunkowany genetycznie, modyfikowany jest przez czynniki „środowiska wewnętrznego” ustroju, stąd wynikają różnice wzoru papilarnego odpowiadających sobie palców dłoni prawej i lewej. Dermatoglify rozwijają się u człowieka w 13 – 19 tygodniu życia płodowego (3-5 miesiąc życia płodowego), pod koniec 6 miesiąca życia płodowego ich układ jest ukształtowany. W czasie procesów rozwojowych następuje rozrastanie linii: zwiększenie długości, wysokości i szerokości, bez naruszenia proporcji budowy listewek. Na dłoniach i stopach w miejscach załamania ich powierzchni występują bruzdy zgięciowe. Główne bruzdy zgięciowe powstają także w czasie życia płodowego i pozostają niezmienne przez całe życie. Trzy prawa sformułowane przez Francisa Galtona głoszą, że linie papilarne są: indywidualne - podobnie jak genom, są różne nawet u bliźniąt monozygotycznych, niezmienne, niezniszczalne. 233 Daktylogram jest odwzorowaniem układu linii papilarnych (odbitka linii papilarnych). Jest on cechą niepowtarzalną i prawie niezniszczalną. Elementem klasyfikacji jest tzw. delta = trójramiennik = trójpromień. Wyróżnia się dwa typy delty: rozwidlona (nietypowa) - powstaje na skutek rozwidlenia jednej linii papilarnej, typowa - powstaje na skutek rozwidlenia dwóch biegnących obok siebie linii papilarnych. Wyróżnia się trzy podstawowe typy wzorów: łukowy – wzór otwarty bezdeltowy, listewki przebiegają od jednej strony palca do drugiej, z lekkim uniesieniem w środku, pętlicowy – wzór otwarty jednodeltowy, listewki rozpoczynają i kończą swój przebieg po tej samej stronie w stosunku do otwartej części wzoru (w zależności od kierunku pętla może być łokciowa lub promieniowa), wirowy – wzór zamknięty, co najmniej jedna z linii wykonuje obrót dookoła swej osi, dwudeltowy – dwa indeksy RC, przy obliczaniu TRC uwzględniamy listewki po tej stronie wzoru, której wartość liczbowa jest większa. Szczegółowa klasyfikacja wzorów listewek skórnych na palcach rąk: łuk, łuk namiotowy, pętla, pętla rakietowa, pętla muszlowa, wir, wir wielospiralny, wir dwucentryczny kolisty, wir dwucentryczny eliptyczny, pętla podwójna, pętla gamma, wzór złożony, wir atypowy. Analiza daktylogramu – ocena indeksów RC i TRC Łącząc rozwidlenie delty ze środkiem wzoru papilarnego linii papilarnych otrzymujemy linię Galtona. Liczba linii papilarnych przecinających linię Galtona (z pominięciem linii delty) stanowi indeks RC (z ang. ridge count), a suma indeksów RC dla 10 palców – to indeks TRC (z ang. total ridge count). Częstość i rodzaj wzorów są różne w zależności od płci: kobiety nieco częściej mają wzory łukowe, rzadziej wzory wirowe w porównaniu do mężczyzn. TRC dla kobiety (46, XX) wynosi ≈ 129, a dla mężczyzny (46, XY): ≈ 146. Podstawą identyfikacji daktyloskopijnej są: wzory linii papilarnych, minucje, cechy poroskopijne i krawędzioskopijne (występowanie śladów kanalików potowych, cechy krawędzi linii papilarnych) i bruzdy zgięciowe (tzw. białe linie). Minucje to rzadko występujące elementy linii papilarnych, np.: początek, zakończenie, rozwidlenie pojedyncze, rozwidlenie podwójne, rozwidlenie potrójne, złączenie pojedyncze, złączenie podwójne, złączenie potrójne, haczyk, oczko pojedyncze, oczko podwójne, mostek pojedynczy, mostek bliźniaczy, punkt, odcinek, styk boczny, linia przechodząca, skrzyżowanie, trójnóg, linia szczątkowa, minucja typu „M”, „m”. Zmiany wzorów dermatoglificznych, podobnie jak anomalie szkieletowe, są uważane za czuły wskaźnik zaburzeń zachodzących w okresie płodowym. Charakterystyka układów dermatoglifów w zespołach chorobowych: zespół Turnera – zwiększona liczba listewek na opuszkach palców (podwyższone TRC ≈ 165), zwykle przewaga wzorów wirowych, wyższe położenie trójpromienia osiowego (dystalne lub pośrednie); zespół Downa – częstsze występowanie pętlic łokciowych na opuszkach palców (zespół Downa: > 82%; 46,XX i 46,XY: ok. 65%), wiry występują rzadziej, (zespół Downa: 13,4% ; 46,XX i 46,XY: ok. 24%), dystalne ułożenie trójpromienia osiowego w 86% (a u osób zdrowych ułożenie proksymalne w 64%), w obrębie kłębu palca V układ listewek skórnych jest bogatszy we wzory, przy czym najczęstszym wzorem jest pętlica łokciowa, czteropalcowa bruzda zgięciowa (tzw. bruzda poprzeczna) u 50-70% osób, na dłoniach i stopach występuje nadmierna wiotkość skóry, a przez to zwiększona liczba bruzd zgięciowych; na stopach występują układy wysepkowe i wysepkowo-listewkowe, tzw. dysocjacje (zamiast typowych listewek skórnych występują ich formy bardzo skrócone: segmenty i wysepki rozmieszczone chaotycznie), rzadko spotykane u osób zdrowych. 234 Bardzo rzadką cechą jest adermatoglifia, która charakteryzuje się brakiem naskórkowych listewek na dłoniach i podeszwach stóp, co skutkuje brakiem odcisków palców i wiąże się z mniejszą liczbą ujść gruczołu potowego i w konsekwencji zmniejszoną potliwością dłoni i stóp. Całkowity brak listewek powoduje trudności w chwytaniu lub trzymaniu przedmiotów. Pojawiają się łagodne nadmierne rogowacenie dłoni oraz modzele na obciążonych obszarach podeszw. Jest to cecha dziedziczona autosomalnie dominująco, spowodowana mutacją heterozygotyczną w genie SMARCAD1 zlokalizowanym w chromosomie 4q22. Dermatoglify i bruzdy zgięciowe można zaobserwować już trakcie badania USG płodu. Możliwe jest zaobserwowanie zmian w przypadku zaburzeń rozwoju, np. obecność bruzdy poprzecznej (Rycina 3). Rycina 3. (a) Dłoń osoby bez bruzdy poprzecznej, (b) dłoń osoby z bruzdą poprzeczną http://www.handresearch.com/news/the-real-hillary-clinton.htm). (wg W Polsce w populacji zdrowych osób bruzda poprzeczna występuje u 1% na obu dłoniach i u 4% na jednej dłoni, u osób z zespołem Downa u około 40%. Cechy wieloczynnikowe jakościowe Cechy te mają w populacji charakter nieciągły. Ich występowanie nie odzwierciedla rozkładu zgodnego z krzywą Gaussa. Wyjaśnienie, w jaki sposób wieloczynnikowa predyspozycja do choroby lub wady rozwojowej może powodować wystąpienie cechy jakościowo różnej od stanu prawidłowego, stanowi model progowy (Rycina 4). Zgodnie z tym modelem wszystkie czynniki predysponujące, osobnicze (genetyczne i niegenetyczne), decydują o podatności danej osoby na chorobę. Ta podatność w populacji podlega rozkładowi normalnemu, ale choroba wystąpi, gdy przekroczony zostanie pewien próg genetycznej predyspozycji (próg podatności); im bardziej próg ten jest przekroczony, tym większe jest nasilenie wady/choroby. Osoby znajdujące się po lewej stronie rozkładu podatności są w niewielkim stopniu narażone na wystąpienie danej choroby (tzn. mają niewiele alleli kształtujących skłonność do jej wystąpienia lub są poddane wpływom niewielu czynników środowiskowych), a osoby znajdujące się bliżej prawego końca rozkładu mają więcej genów predysponujących do ujawnienia się choroby i ulegają większej liczbie czynników środowiskowych, a zatem istnieje u nich większe prawdopodobieństwo wystąpienia choroby. Próg podatności może mieć różną wartość dla płci (Rycina 4.), co jest związane z faktem, że do wywołania konkretnej choroby potrzeba u obu płci różnej liczby genów podatności. Niższy próg u mężczyzn niż u kobiet oznacza mniejszą liczbę genów u mężczyzn potrzebną do ujawnienia się choroby, przy tym samym narażeniu środowiskowym obu płci. 235 Rycina 4. Model progowy w chorobach wieloczynnikowych jakościowych z uwzględnieniem różnic płci. (a) Mężczyżni, (b) Kobiety. W przypadku zwężenia odźwiernika – dla mężczyzn próg jest niższy, a dla kobiet wyższy (mężczyźni chorują ok 5 razy częściej niż kobiety) (wg Jorde i in. 1995, zmodyfikowano). Dziedziczenie wieloczynnikowe jakościowe jest częstą przyczyną wad wrodzonych lub chorób przewlekłych. Dziedziczona jest predyspozycja do danego schorzenia/wady, a jej ujawnienie się zależy od wielu loci genowych kształtujących skłonność oraz od rodzaju i siły działania czynnika środowiskowego (czynnik wyzwalający). Przykłady cech wieloczynnikowych jakościowych: a) wrodzone wady rozwojowe: rozszczep wargi i/lub podniebienia, pewne formy wrodzonych wad serca, wady cewy nerwowej (rozszczep kręgosłupa, bezmózgowie), zniekształcenie stopy, zwężenie odźwiernika, wrodzone zwichnięcie stawu biodrowego; b) choroby wieku dorosłego: reumatoidalne zapalenie stawów, stwardnienie rozsiane, cukrzyca (typu I i II), przedwczesna miażdżyca naczyń, choroba wieńcowa serca, astma oskrzelowa, udar, nadczynność tarczycy, padaczka, schizofrenia, choroba Alzheimera, choroba afektywna dwubiegunowa, niektóre nowotwory. W przypadku nieciągłych cech wieloczynnikowych ryzyko dla członków rodziny obciążonych występowaniem choroby jest wyższe niż ryzyko populacyjne i wyraźnie spada dla dalszych krewnych, zbliżając się do ryzyka populacyjnego (Rycina 5). W praktyce proband manifestujący nieciągłą cechę wieloczynnikową jest często jedyną chorą osobą w rodzinie . Rycina 5. Model progowy w chorobach wieloczynnikowych dla członków rodziny obciążonych występowaniem choroby (wg Passarge, 1995, zmodyfikowano). 236 W przeciwieństwie do chorób jednogenowych, analiza rodowodu nie może dostarczyć dowodów na dziedziczenie wieloczynnikowe i konieczne jest prowadzenie badań zgodności bliźniąt i korelacji rodzinnych (w celu odróżnienia cech wieloczynnikowych od jednogenowych lub spowodowanych czynnikami niegenetycznymi). Badania zgodności bliźniąt Bliźnięta są zgodne, jeśli wykazują obecność tej samej cechy nieciągłej, zaś niezgodne, jeśli tylko jedno z nich ma tę cechę. W odniesieniu do cech ciągłych wartość danej cechy jest bezpośrednio porównywana pomiędzy bliźniętami. Ponieważ bliźnięta zazwyczaj wzrastają w tych samych warunkach rodzinnych, trudne może być odróżnienie wpływu czynników środowiskowych i genetycznych na rozwój danej cechy wieloczynnikowej. Z tego względu największą wartość mają badania zgodności bliźniąt monozygotycznych (MZ), które zostały oddane do adopcji i rozdzielone w wieku niemowlęcym. Zgodność występowania cech wieloczynnikowych u bliźniąt dizygotycznych (DZ) jest znacznie mniejsza niż u bliźniąt MZ i zwykle podobna do ryzyka powtórzenia się choroby u pozostałego rodzeństwa. Dla każdej cechy wieloczynnikowej zgodność bliźniąt MZ przekracza tę wartość stwierdzaną dla bliźniąt DZ, chociaż zakres zgodności wśród bliźniąt MZ waha się od 6 do 100%. Zakres ten odzwierciedla stopień odziedziczalności choroby: im większa jest zgodność bliźniąt MZ, tym większy jest udział czynników genetycznych w wystąpieniu cechy i większa jest odziedziczalność. Pomimo że badania bliźniąt dostarczają wartościowej informacji, są one obciążone pewnymi błędami, np. mutacje somatyczne podczas podziałów mitotycznych komórek embrionalnych mogące dotyczyć tylko jednego z pary bliźniąt, czy różnice w środowisku macicznym. Problem wynikający z większego stopnia podobieństwa środowiskowego w przypadku bliźniąt monozygotycznych można przynajmniej częściowo wyeliminować poprzez badanie bliźniąt monozygotycznych wychowywanych w różnych środowiskach. Badania dzieci adoptowanych: Polegają na porównywaniu cech fenotypowych dzieci adoptowanych z cechami rodziców biologicznych i przybranych. Metoda ta jest szczególnie przydatna w porównywaniu cech poligenowych jakościowych, jednak tak, jak w przypadku metody analizy bliźniąt, istnieją pewne czynniki, które mogą powodować błędy w wynikach tych badań (prenatalne wpływy środowiska mogące wywierać długotrwałe skutki na zdrowie adoptowanego dziecka; adoptowanie dzieci kilkuletnich, na które otoczenie biologicznych rodziców mogło wywrzeć pewien wpływ; dobieranie przybranych rodziców podobnych do biologicznych przez agencje adopcyjne). Badania korelacji rodzinnych: Jeśli dana cecha podlega dziedziczeniu wieloczynnikowemu, krewni powinni wykazywać jej obecność proporcjonalnie do wzajemnego podobieństwa genetycznego. Badanie te są rozszerzeniem techniki badania zgodności bliźniąt, zaś podobieństwo krewnych pod względem danej cechy jest określane mianem ich zgodności; podobieństwo to przedstawia się na skali od 0 do 1, gdzie 1 oznacza identyczność. Im bliższe jest spokrewnienie dwojga krewnych, tym wyższy jest współczynnik zgodności dla cech uwarunkowanych genetycznie. Częstość występowania cech nieciągłych u krewnych osoby chorej spada wraz z malejąca proporcją genów wspólnych, jednak dla wszystkich krewnych pozostaje wyższa od częstości stwierdzanej w populacji ogólnej. Badania zgodności bliźniąt i korelacji rodzinnych mogą dostarczyć dowodów na wieloczynnikowe dziedziczenie danej cechy, niezależnie od tego, czy jest to cecha ciągła, czy nieciągła. Ponadto obserwowane częstości występowania takich cech u krewnych są podstawą do określenia ryzyka empirycznego, na którym opiera się poradnictwo genetyczne w chorobach wieloczynnikowych. Ponieważ czynniki ryzyka są odmienne w różnych chorobach, empiryczne ryzyko ponownego wystąpienia schorzenia jest specyficzne dla każdej choroby wieloczynnikowej. 237 Określenie względnego wpływu czynników genetycznych i środowiskowych na powstanie cechy wieloczynnikowej mogłoby pomóc w lepszym poznaniu etiologii wielu chorób oraz w zastosowaniu określonych działań prewencyjnych w ramach strategii zdrowia publicznego. Chorobom, w przypadku których wpływ czynników dziedzicznych jest stosunkowo niewielki (np. rak płuc) można najskuteczniej zapobiegać poprzez zmianę trybu życia (zaprzestanie palenia tytoniu). Natomiast, gdy choroba zależy głównie od czynników genetycznych (np. rak piersi), oprócz zmian w stylu życia należy także przeprowadzić analizę historii choroby w rodzinie. Dla cech/chorób wieloczynnikowych istotne jest, jaka część zmienności fenotypowej uwarunkowana jest czynnikami genetycznymi, a jaka zależy od środowiska. W tej ocenie wykorzystuje się wskaźnik odziedziczalności. Wartość tego wskaźnika zawiera się w przedziale od 0 do 1; 0 – oznacza, że cała zmienność fenotypowa jest zależna od środowiska, 1 – cała zmienność fenotypowa jest warunkowana przez czynniki genetyczne. Wartości odziedziczalności są charakterystyczne dla populacji, w której są określane. Matematycznie odziedziczalność wyraża się wzorem: gdzie: VG – wariancja zależna od genotypu VS – wariancja zależna od środowiska VC – wariancja związana z błędem pomiaru VG+VS+VC – całkowita wariancja fenotypowa. Odziedziczalność jest szacowana na podstawie podobieństwa fenotypowego pomiędzy krewnymi pierwszego stopnia: rodzice-dziecko, rodzeństwo lub bliźnięta monozygotyczne i dizygotyczne. Ryzyko ponownego wystąpienia choroby i schematy jej przekazywania W przeciwieństwie do większości chorób jednogenowych, ryzyko ponownego wystąpienia chorób wieloczynnikowych może różnić się znacznie w różnych populacjach. Niektóre cechy wieloczynnikowe występują częściej u osób jednej płci, np. zwężenie odźwiernika jest 5-krotnie częstsze u chłopców, a wrodzone zwichnięcie stawu biodrowego - ok. 7-krotnie częstsze u dziewczynek. Ryzyko ponownego wystąpienia tej samej choroby w rodzinie jest takie samo dla wszystkich krewnych mających taką samą część wspólnych genów i spada gwałtownie w miarę oddalania się pokrewieństwa względem osoby chorej. Ryzyko powtórzenia się choroby u krewnych pierwszego stopnia jest w przybliżeniu równe pierwiastkowi kwadratowemu częstości występowania choroby w populacji ogólnej (nie jest to bezwzględną zasadą, ale wiele chorób wieloczynnikowych jej podlega). Choroby wieloczynnikowe są znacznie częstsze wśród dzieci spokrewnionych rodziców, ponieważ mają więcej wspólnych genów predysponujących do rozwoju choroby. Ryzyko powtórzenia się choroby jest wyższe, jeśli więcej niż jeden z bliskich krewnych jest chory, jest wyższe dla krewnych tych probantów, których płeć jest rzadziej dotykana chorobą, a także jest wyższe, jeżeli ekspresja choroby u probanta jest silniejsza (cięższa postać choroby). Czynniki środowiskowe w najwyższym stopniu wpływają na wystąpienie choroby u osoby mającej predyspozycje genetyczne, co oznacza, że identyfikacja czynników środowiskowych predysponujących do wystąpienia choroby powinna być najłatwiejsza u osób predysponowanych genetycznie i również u takich osób sterowanie czynnikami środowiskowymi w celu zapobieżenia chorobie może być najskuteczniejsze. Należy pamiętać, że możliwe jest też występowanie heterogenności genetycznej, która sprawia, że niektóre przypadki choroby dziedziczone są w sposób mendlowski, inne zaś mają przyczyny niegenetyczne lub wieloczynnikowe. 238 CZĘŚĆ PRAKTYCZNA DOŚWIADCZENIA 1. Model rozkładu cechy wieloczynnikowej ilościowej w populacji - krzywa rozkładu w aparacie Galtona WYKONANIE: Sprzęt i aparatura: - aparat Galtona, - szkiełko podstawowe, - 205 kulek. Protokół doświadczenia: 1. Wszystkie kulki (reprezentujące osobniki hipotetycznej populacji) umieszczamy w komorze trójkątnej aparatu Galtona zamkniętej przez szkiełko podstawowe. Po otwarciu komory (usunięcie szkiełka) kulki zderzają się z licznymi gwoździkami (symbolizującymi czynniki środowiskowe) i losowo wpadają do 11 komór. 2. Liczymy kulki w każdej z 11 komór aparatu, a następnie porównujemy uzyskany rozkład liczbowy kulek (krzywa Galtona) z rozkładem dla wartości z 10 rzędu trójkąta Pascala podzielonych przez 5 (rozkład zbliżony do krzywej Gaussa). Uwaga: Suma 11 współczynników z 10 rzędu trójkąta Pascala wynosi 1024, zatem tyle powinno być kulek umieszczanych w aparacie Galtona. Aby ułatwić ich liczenie, wykorzystuje się jednak 205 kulek, czyli w tylko 1/5 (1024 : 205 ≈ 5). W konsekwencji każdy współczynnik 10 rzędu trójkąta Pascala musi być podzielony przez 5, aby można było porównywać obie krzywe – Galtona i Gaussa Współczynniki 10 rzędu trójkąta Pascala: 1 10 45 120 210 252 210 120 45 10 1 Współczynniki 10 rzędu trójkąta Pascala / 5: 0 2 9 24 42 51 42 24 9 2 0 3. Sporządzić dwa wykresy: krzywej Galtona i krzywej Gaussa. Wyniki: 239 Liczba kulek/liczba osobników 60 50 40 30 20 10 0 1 2 3 4 5 6 7 8 9 10 Numer komory/klasy natężenia cechy ilościowej 11 Wnioski: 2. Badanie cechy wieloczynnikowej ilościowej w populacji człowieka WYKONANIE: Sprzęt: - poduszka z tuszem daktyloskopijnym, - osoba badana, - lupa. Protokół doświadczenia: 1. Odcisnąć wybrane (te same) opuszki palców obu dłoni na poduszce z tuszem daktyloskopijnym, a następnie wykonać odciski w karcie pracy (proszę zwrócić uwagę na częste boczne położenie delt na opuszkach i konieczność odpowiedniego „bok-środek-bok” ułożenia opuszki przy jej odciskaniu). 2. Przeprowadzić analizę następujących parametrów: typ wzoru, rodzaj delty oraz obliczyć indeks RC. 3. Porównać uzyskane wyniki dla odcisków obu palców. Wyniki: 240 Analiza wzoru: Typ wzoru: Liczba delt: Indeks RC Wnioski: Podpis prowadzącego ……………………………………… Data………………………… 241 REPOZYTORIUM Rozkład natężenia cechy zależy od liczby genów polimerycznych warunkujących daną cechę i jeżeli liczba ta wzrasta, to rozkład dwumianowy częstości fenotypów zbliża się do krzywej Gaussa (rycina 1). Krzywa ta obrazuje rozkład natężenia cechy ilościowej, będący wynikiem genotypu oraz oddziaływania czynników środowiska. Częstości identycznych fenotypów dla liczby dominujących alleli są wartościami współczynników liczbowych przy kolejnych wyrazach rozwiniętego dwumianu Newtona: (a + b)n, gdzie „a” i „b” to częstości genów w populacji, a „n” to liczba genów. Współczynniki liczbowe rozwiniętego dwumianu Newtona najłatwiej wyliczyć posługując się trójkątem Pascala (podaje współczynniki dwumianu Newtona zależnie od wartości n): W genetyce współczynniki trójkąta Pascala stosujemy wyłącznie dla pokolenia drugiego (F 2); oznaczają one liczbę osobników w kolejnych klasach natężenia cechy wieloczynnikowej ilościowej, tzn. o stopniowo zwiększającej się liczbie alleli predysponujących do większego natężenia danej cechy w zależności od ogólnej liczby alleli cechy (n). W miarę zwiększania się liczby par nieallelicznych genów warunkujących daną cechę, rozkład częstości fenotypów zbliża się do rozkładu normalnego. Liczba genotypów jest określona wzorem: 3a, gdzie „a” oznacza liczbę par alleli. Liczba fenotypów jest mniejsza od liczby genotypów. Liczba różnych fenotypów równa się liczbie pojedynczych genów dominujących (n) plus 1 (n + 1). Skrajne fenotypy cechy wieloczynnikowej ilościowej występują z częstością (1/2)n, gdzie „n” jest liczbą pojedynczych genów nieallelicznych. Jeżeli np. cecha zależy od 3 par genów polimerycznych, to rozpatrujemy 6 alleli, czyli korzystamy z szeregu 6, w którym rozkład jest następujący: 1 6 15 20 15 6 1 a więc liczba osobników o natężeniu cechy: maksymalnym (6 alleli predysponujących do wysokiego wzrostu) - 1; większym niż średnim, ale mniejszym niż maksymalnym (5 alleli) - 6; większym niż średnim, ale mniejszym niż maksymalnym (4 allele) - 15; średnim (3 allele) - 20; większym niż minimalnym, ale mniejszym niż średnim (2 allele) - 15; większym niż minimalnym, ale mniejszym niż średnim (1 allel) - 6; 242 minimalnym (0 alleli predysponujących do wysokiego wzrostu) - 1. Można również rozpisać gamety tworzone przez każdego z osobników i wypełnić tabelę Punnetta: F2: Gamety A'B'C' A'b'C' a'B'C' A'B'c' a'B'c' A'b'c' a'b'C' a'b'c' A'B'C' 6 5 5 5 4 4 4 3 A'b'C' 5 4 4 4 3 3 3 2 a'B'C' 5 4 4 4 3 3 3 2 A'B'c' 5 4 4 4 3 3 3 2 a'B'c' 4 3 3 3 2 2 2 1 A'b'c' 4 3 3 3 2 2 2 1 a'b'C' 4 3 3 3 2 2 2 1 a'b'c' 3 2 2 2 1 1 1 0 W tabeli wpisujemy tylko sumę alleli zwiększających natężenie cechy - fenotypy zależą od liczby alleli predysponujących do wyższego wzrostu - tzn. warunkują klasy natężenia cechy: Liczba genów dominujących warunkujących daną cechę ilościową: 6 5 4 3 2 1 0 Liczba osobników w klasie natężenia 1 : 6 : 15 : 20 : 15 : 6 : 1 cechy: W pokoleniu drugim kombinacja 8 różnych gamet od każdego z rodziców daje nam możliwość 64 genotypów (osobników potomnych w pokoleniu F2). Podać prawdopodobieństwo urodzenia się w pokoleniu genetycznym drugim dziecka wykazującego wzrost większy niż średni, przy założeniu, że wzrost zależy od 3 par genów polimerycznych. P A'A'B'B'C'C' x 6 - genów zwiększających natężenie cechy F1 a'a'b'b'c'c' 0 genów zwiększających natężenie cechy A'a'B'b'C'c 100% osób o wzroście przeciętnym (3 allele A'B'C' to czynniki predysponujące do wyższego wzrostu) A'a'B'b'C'c F2 Gamety A'B'C A'b'C' a'B'C' A'B'c' a'B'c' A'b'c' a'b'C' a'b'c' A'B'C' 6 5 5 5 4 4 4 3 A'b'C' 5 4 4 4 3 3 3 2 a'B'C' 5 4 4 4 3 3 3 2 x A'B'c' 5 4 4 4 3 3 3 2 A'a'B'b'C'c a'B'c' 4 3 3 3 2 2 2 1 A'b'c' 4 3 3 3 2 2 2 1 a'b'C' 4 3 3 3 2 2 2 1 a'b'c' 3 2 2 2 1 1 1 0 W tabeli wpisujemy tylko sumę alleli zwiększających natężenie cechy - fenotypy zależą od liczby alleli predysponujących do wyższego wzrostu - tzn. warunkują klasy natężenia cechy: 243 Suma alleli warunkujących wysokość 6 5 4 3 2 1 0 Liczba osób w klasie natężenia cechy 1 : 6 : 15 : 20 : 15 : 6 : 1 W pokoleniu drugim jest 64 osób (= możliwych różnych genotypów uwzględniając allele pochodzące od każdego z rodziców). P (>3) = (15 + 6 + 1) : 64 = 22/64 = 34,4% Dla rozwiązania tego zadania można wykorzystać trójkąt Pascala (podaje współczynniki dwumianu Newtona (a + b)n zależnie od wartości n). W genetyce współczynniki trójkąta Pascala stosujemy wyłącznie dla pokolenia drugiego (F2); oznaczają one liczbę osób w kolejnych klasach natężenia cechy wieloczynnikowej ilościowej, tzn. o stopniowo zwiększającej się liczbie alleli predysponujących do większego natężenia danej cechy w zależności od ogólnej liczby alleli cechy (n). W podanym zadaniu rozpatrujemy 6 alleli, czyli korzystamy z szeregu 6, w którym rozkład jest następujący: 1 6 15 20 15 6 1 a więc liczba osób o natężeniu cechy: maksymalnym (6 alleli predysponujących do wysokiego wzrostu) - 1; większym niż średnim, ale mniejszym niż maksymalnym (5 alleli) - 6; większym niż średnim, ale mniejszym niż maksymalnym (4 allele) - 15; średnim (3 allele) - 20; większym niż minimalnym, ale mniejszym niż średnim (2 allele) - 15; większym niż minimalnym, ale mniejszym niż średnim (1 allel) - 6; minimalnym (0 alleli predysponujących do wysokiego wzrostu) - 1. Odpowiedź. Prawdopodobieństwo urodzenia się w pokoleniu drugim dziecka o wzroście większym niż średni wynosi 34,4%. 244 ZADANIA GENETYCZNE 1. Jakie jest prawdopodobieństwo, że rodzice (wybierz dowolne genotypy – rodzice biologiczni) o barwie skóry jaśniejszej niż pośrednia będą mieli dziecko o skórze barwy pośredniej przy założeniu, że barwa skóry zależy od 3 par genów kumulatywnych? 2. Jakie jest prawdopodobieństwo urodzenia się w pokoleniu drugim córki o masie ciała mniejszej niż przeciętna, przy założeniu, że masa ciała zależy od 6 genów polimerycznych? Skorzystaj z trójkąta Pascala. 3. Z jakim prawdopodobieństwem rodzice o przeciętnej inteligencji, ale różnych genotypach będą mieli genialne dziecko przy założeniu, że inteligencja zależy od 8 genów kumulatywnych? 245 4. Podaj rozkład fenotypów potomstwa matki o genotypie: D’d’E’E’F’F’ i ojca o genotypie: d’d’E’e’F’f. 5. Wykaż, czy możliwe jest, że matka o najmniejszym wzroście i ojciec o największym wzroście będą mieli dziecko o takim samym wzroście jak matka, przy założeniu, że wzrost zależy od 4 par genów polimerycznych. 6. Matka ma grupę krwi AB Rh+, a ojciec A Rh+ i oboje wykazują przeciętne ciśnienie tętnicze, ale różne genotypy. Jakie jest prawdopodobieństwo, że urodzi im się syn o grupie krwi A Rh- i ciśnieniu większym niż średnie zakładając, że ciśnienie tętnicze zależy od 2 par genów polimerycznych. 7. Jakie jest prawdopodobieństwo urodzenia się córki zdrowej o włosach kędzierzawych i stężeniu cholesterolu w surowicy krwi poniżej przeciętnej, jeżeli rodzice wykazują przeciętne stężenie cholesterolu (genotypy: A’A’B’b’d’d oraz a’a’B’B’D’d), a ponadto matka jest obciążona hemofilią i ma włosy kędzierzawe, a ojciec choruje na hemofilię i ma włosy proste? 246 ZADANIA SAMOKSZTAŁCENIA 1. Rozpisz trójkąt Pascala do 8 rzędu, zaznacz współczynniki rzędów wykorzystywanych w ocenie częstości różnych genotypów cech wieloczynnikowych w pokoleniu F2. 2. Porównaj definicje: dziedziczenie wieloczynnikowe i wielogenowe. 3. Podaj definicje poniższych pojęć: Transgresja: Odziedziczalność: 4. Wyjaśnij na czym polega model progowy dziedziczenia cechy wieloczynnikowej: 247 5. Inteligencja płynna: A. ujawnia się w rozwiązywaniu testów bezsłownych; B. jest zdefiniowana kulturowo; C. rozwija się do wieku starczego; D. rozwija się w wyniku uczenia się i nabywania doświadczeń. 6. Ryzyko ponownego wystąpienia choroby wieloczynnikowej jakościowej (zaznacz wszystkie prawidłowe odpowiedzi): A. jest takie samo dla osób obu płci; B. jest takie samo dla wszystkich krewnych mających taką samą część wspólnych genów; C. spada w miarę zbliżania się pokrewieństwa względem osoby chorej; D. jest niezależne od stopnia pokrewieństwa rodziców; E. jest wyższe, jeśli więcej niż jeden z bliskich krewnych jest chory; F. jest wyższe, jeżeli probant ma ciężką postać choroby. 7. Nazwij typy wzorów linii papilarnych: A B C 8. Wymień prawa dotyczące dermatoglifów sformułowane przez Francisa Galtona: 9. Charakterystyka układu linii papilarnych w różnych zespołach chorobowych. A. Wymień charakterystyczne cechy dermatoglifów w zespole Turnera: B. Wymień charakterystyczne cechy dermatoglifów w zespole Downa 248 10. Wpływ czynników środowiskowych na IQ dzieci: na podstawie: Archita Makharia, Abhishek Nagarajan, Aakanksha Mishra, Sandeep Peddisetty, Deepak Chahal, and Yashpal Singh. Effect of environmental factors on intelligence quotient of children. Ind Psychiatry J. 2016 Jul-Dec; 25(2): 189–194. doi: 10.4103/ipj.ipj_52_16. Studenci medycyny z Indii oceniali iloraz inteligencji IQ (intelligence quotient) 1065 dzieci w wieku 12 – 16 lat (średnia wieku 14.1 ± 1.3 lat, 596 (56.1%) badanych stanowili chłopcy) ze szkół państwowych i prywatnych pochodzących z 5 miast, 6 miasteczek i 2 wsi z różnych części Indii. Z badania wykluczono dzieci wykazujące opóźnienia w nauce. Dzieci przed badaniem wypełniały kwestionariusz obejmujący pytania dotyczące różnych czynników środowiskowych w ich rodzinach: wykształcenie rodziców, wykonywany przez nich zawód, zarobki, aktywność fizyczna badanego. Wartość IQ oceniano na podstawie wyniku testu Ravena – używając Ravens Standard Progressive Matrices. Jest to rodzaj bezsłownego testu wielokrotnego wyboru składającego się z sześćdziesięciu pytań. Wyniki IQ podzielono na trzy grupy: poniżej normalnego IQ (0-79), normalne IQ (80-119) i wysokiego IQ (powyżej 120). Dane analizowano za pomocą oprogramowania SPSS. Wyniki: Czynnik środowiskowy Wartość Wieś Miejsce zamieszkania n=1065 Miasteczko Miasto Ćwiczenia (wysiłek fizyczny) n=1065 < 5h / tydzień > 5h / tydzień <10 000 rupii / miesiąc Dochody rodziny n=1053 10 000 – 50 000 rupii / miesiąc 50 000 – 100 000 rupii / miesiąc >100 000 rupii / miesiąc Wyższe (bachelor`s degree, doctor) Uzyskany dyplom po 10 lub 12 Wykształcenie ojca klasach szkoły średniej n=1065 Szkoła średnia lub podstawowa Brak formalnego wykształcenia Wyższe (bachelor`s degree, doctor) Wykształcenie matki n=1065 Uzyskany dyplom po 10 lub 12 klasach szkoły średniej Szkoła średnia lub podstawowa Brak formalnego wykształcenia Iloraz inteligencji IQ niski norma wysoki 51 72 3 (1,8%) (21,4%) (10,8%) 142 286 69 (58,8%) (43,1%) (42,3%) 47 306 91 9 (19,7%) (46,1%) (55,8%) 62 205 77 (26,1%) (30,9%) (47,2%) 176 459 86 (73,9%) (69,1%) (52,8%) 89 66 5 (3,1%) (37,9%) (10,1%) 77 222 51 (32,8%) (33,9%) (31,3%) 27 132 38 (11,5%) (20,2%) (23,3%) 42 235 69 (17,9%) (35.9%) (42,3%) 111 506 137 (46,6%) (76,3%) (84,6%) 84 131 24 (35,3%) (19,8%) (14,8%) 36 22 (3,3%) 1 (0,6%) (15,1%) 7 (2,9%) 4 (0,6%) 0 89 423 118 (37,7%) (64,0%) (72,4%) 65 161 37 (27,5%) (24,4%) (22,7%) 53 65 (9,8%) 6 (3,7%) (22,5%) 29 12 (1,8%) 2 (1,2%) Suma 126 (11,8%) 495 (46,5%) 444 (41,7%) 344 (32,3%) 721 (67,7%) 160 (15,2%) 350 (33,2%) 197 (18,7%) 346 (32,9%) 754 (70,9%) 239 (22,5%) 59 (5,6%) 11 (1,0%) 630 (59,4%) 263 (24,8%) 124 (11,7%) 43 (4,1%) 249 Zawód ojca (wykonywany) n=1065 Wolny zawód, specjalista inne (12,3%) 95 (39,9%) 143 (60,1%) 447 (67,3%) 217 (32,7%) 120 (73,6%) 43 (26,6%) 662 (62,2%) 403 (37,8%) *rupie indyjskie (INR): 10 000 rupii ≈ 530 zł Oceń, które z czynników środowiskowych mają największy wpływ na kształtowanie inteligencji u dzieci. 250 LITERATURA 1. Bal J. (red). 2017. Genetyka medyczna i molekularna. Wydawnictwo Naukowe PWN, Warszawa. 2. Budnik A. 1992. Cechy dermatoglificzne człowieka. Przegląd koncepcji i metod badań. Przegląd Antropologiczny. 55, 3 – 26. 3. Drewa G, Ferenc T. 2011. Genetyka medyczna. Wydawnictwo Elsevier Urban & Partner Sp. z o.o., Wrocław. Rozdział 12 – Cechy uwarunkowane wieloczynnikowo • • • • • • • • • • • Podrozdział 12.1 Podrozdział 12.2 Podrozdział 12.3 Podrozdział 12.4 Podrozdział 12.5 Podrozdział 12.5.1 Podrozdział 12.5.2 Podrozdział 12.6 Podrozdział 12.7 Podrozdział 12.7.1 Podrozdział 12.8 Podrozdział 32.1 – Dziedziczenie inteligencji 4. Friedman JM, Dill FJ, Hayden MR, McGillivray BC. 2000. Genetyka. Wydanie I polskie pod red. J. Limona. Urban&Partner Wydawnictwo Medyczne, Wrocław. 5. Grzeszyk C. 1991. Daktyloskopia. Wydawnictwo Naukowe PWN, Warszawa. 6. Jorde LB., Carey JC, Bamshad MJ, White RL. (red) 2000. Genetyka medyczna (red. wyd. polskiego: J. Wojciechowski). Wydawnictwo CZELEJ Sp. z o.o., Lublin. 251 Ćwiczenie 5 Temat: Wybrane zagadnienia genetyki populacji. Doświadczenia 1. Dryf genetyczny - analiza na modelu – doświadczenie, protokół Praca w grupach 1. Częstość niektórych alleli w populacji człowieka: a) warunkujących cechy allelomorficzne autosomowe – tabela częstości fenotypów; - obliczanie częstości genów i genotypów na podstawie prawa Hardy’ego-Weinberga. b) wielokrotnych – obliczanie częstości grupy AB. c) recesywnych sprzężonych z płcią – obliczanie częstości zaburzeń widzenia barw u kobiet d) selekcja allela recesywnego w populacji – zadanie Zadania genetyczne Zakres materiału do przygotowania przed zajęciami Prawo Hardy`ego-Weinberga. Dryf genetyczny – definicja, efekt szyjki od butelki, efekt założyciela. Selekcja (dobór naturalny), mutacja. Zakres materiału którego znajomość jest wymagana po zakończeniu zajęć Genetyka populacji – populacja panmiktyczna (w stanie równowagi). Prawo Hardy`ego-Weinberga – postać matematyczna. Obliczanie rzeczywistej częstości alleli w populacji. Czynniki zmieniające skład genetyczny populacji. Zastosowanie prawa Hardy`ego-Weinberga dla oceny genetycznego profilu populacji. Wybrane cechy wykorzystywane w genetyce populacyjnej. Zadania genetyczne – prawo Hardy-ego-Weinberga, dryf genetyczny. 252 CZĘŚĆ TEORETYCZNA Genetyka populacji Genetyka populacji analizuje zjawiska dziedziczności w odniesieniu do populacji (właściwie puli genowej populacji) organizmów rozmnażających się płciowo. Podstawę genetyki populacji stanowi prawo Hardy’ego-Weinberga określające częstość alleli i częstość genotypów w populacji oraz zmiany ich występowania pod wpływem czynników ewolucyjnych. Sformułowane w 1908 r. niezależnie przez angielskiego matematyka Godfrey‘a Hardy’ego i niemieckiego lekarza Wilhelma Weinberga, mówi, że w populacji znajdującej się w stanie równowagi genetycznej (zrównoważona populacja stacjonarna) częstość występowania genotypów zależy wyłącznie od częstości alleli i jest stała z pokolenia na pokolenie. Populacja panmiktyczna (mendlowska) cechuje się: bardzo dużą (w teorii nieskończoną) liczebnością, swobodnym krzyżowaniem się ze sobą wszystkich osobników (osobniki diploidalne, rozmnażające się płciowo) w populacji (panmiksja) – osobniki mają równe szanse na posiadanie potomstwa (brak wybiórczości w związkach rozrodczych); przy losowym kojarzeniu równowaga genetyczna osiągana jest w czasie jednego pokolenia; brakiem czynników zaburzających równowagę genetyczną (powodujących zmiany częstości alleli w puli genowej): migracji (przepływu genów), mutacji, selekcji, dryfu genetycznego. W naturalnych populacjach obserwujemy zachodzenie wielu procesów demograficznych i działanie ww. czynników powodujących zmiany ilościowe zaburzające równowagę genetyczną (tzw. pierwotną równowagę genetyczną) – będących przyczyną zmian ewolucyjnych. Model populacji mendlowskiej pozwala na zrozumienie procesu ewolucji organizmów, genów i genomów, ocenę bioróżnorodności, a także prowadzenie programów hodowlanych dla gatunków zagrożonych oraz rekonstrukcję pokrewieństw między organizmami na wszystkich poziomach taksonomicznych. Populacja znajduje się w stanie równowagi genetycznej jeśli spełniony jest warunek: p + q = 1 i p2 + 2pq + q2 = 1 gdzie: p - częstość allela dominującego q - częstość allela recesywnego, p2 - częstości genotypów: homozygoty dominujące, q2 - homozygoty recesywne, 2pq - heterozygoty Jak określić stan równowagi dla populacji? Należy porównać częstość alleli i genotypów w badanej populacji wynikającą z obserwowanej rzeczywistej częstości fenotypów z częstością alleli i genotypów wyliczonych z prawa Hardy’egoWeinberga: jeśli ogólna liczba osobników w populacji wynosi N, ogólna liczba alleli danego genu w populacji wynosi 2N, liczba osobników homozygotycznych: dominujących AA = D, recesywnych aa = R, osobników heterozygotycznych Aa = H, to D + H + R = N, a liczba alleli dominujących P wynosi 2D+H, liczba alleli recesywnych Q wynosi 2R+H; 253 Przykład: w populacji liczącej 250 osobników mamy 25 AA, 145 Aa, 80 aa (Σ=250), ogólna liczba alleli wynosi 500 stąd obliczmy częstości poszczególnych genotypów: D=f(AA)=25/250=0,1, H=f(Aa)=145/250=0,58, R=f(aa)=80/250=0,32, liczba alleli dominujących: P=2x25+145=195, recesywnych: Q=2x80+145=305, a częstości alleli wynoszą: f(A)=195/500=0,39; f(a)=305/500=0,61. W stanie równowagi genetycznej częstość homozygot dominujących powinna wynieść 0,392=0,15, heterozygot 2x0,39x0,61=0,48, a homozygot recesywnych 0.612=0,37 co jest niezgodne z danymi obserwowanymi w populacji. Badana populacja nie jest w stanie równowagi genetycznej. Ocena odchyleń od równowagi Hardy'ego-Weinberga (zmiana częstości alleli) jest wykorzystywana w populacyjnych badaniach asocjacji genetycznych (badanie u poszczególnych osób wariantów genetycznych w całym genomie, głównie polimorfizmów pojedynczych nukleotydów SNPs, dla wykazania ich asocjacji z określoną cechą; badania GWAS (genome-wide association study GWAS study). Niestety badania takie nie zawsze wskazują na właściwe korelacje alleli i cechy/choroby. Prawo Hardy'ego-Weinberga może być wykorzystane: dla cech sprzężonych z chromosomem X - przyjmuje postać dla populacji mężczyzn: p+q=1 częstość mężczyzn wykazujących cechę dominującą P(XHY)=p, częstość mężczyzn wykazujących cechę recesywną P(XhY)=q]; dla populacji kobiet: p2+2pq+q2=1 gdzie P(XHXH)=p2, P(XHXh)=2pq, P(XhXh)=q2; dla alleli wielokrotnych i cech nimi uwarunkowanych – np. dla 3 par alleli ma postać: p+q+r=1, (p+q+r)2=1, p2+2pq+2pr+2qr+q2+r2=1. Odstępstwa od prawa Hardy’ego-Weinberga świadczące o zachodzeniu procesów demograficznych zmieniających frekwencje (częstość) i rozkład alleli mogą być oceniane w oparciu o analizę sekwencji mtDNA (genom mitochodrialny, głównie gen cytochromu b) i msDNA (mikrosatelitarny DNA). Allele mikrosatelitów (warianty długości jednego locus) są kodominujące i dziedziczą się w sposób mendlowski. Mitochondrialny DNA dziedziczy się wyłącznie w linii matczynej, w związku z czym jego analiza dostarcza informacji dotyczących jedynie części populacji (samic lub kobiet). W zależności od charakteru badań wykorzystuje się jeden lub obydwa wyżej opisane markery molekularne. Koalescencja Metoda pozwalająca na szacowanie genealogicznego powiązania pomiędzy sekwencjami nukleotydowymi (genami) – na podstawie odtwarzania kolejności pojawiania się poszczególnych mutacji w haplotypie (haplotyp to grupa ściśle sprzężonych alleli różnych genów leżących w jednym chromosomie i dziedziczonych razem jako blok DNA; określany również jako układ wielu polimorficznych pozycji, np. SNP, sekwencje mikrosatelitarne, w danym chromosomie.). Polega na analizie linii genealogicznych sekwencji „cofając się w czasie”. W miarę cofania się w czasie linie łączą się stopniowo aż do całkowitego zejścia się w jednym punkcie w przeszłości – w sekwencji najbliższego wspólnego przodka. Teoria koalescencji weryfikuje genealogiczne powiazania miedzy genami. Zgodnie z tą teorią, wszystkie allele obecne w danej puli genowej populacji muszą pochodzić od pojedynczego allelu. Na podstawie przykładowej liczby genów, wykorzystując matematyczną analizę, można 254 oszacować liczbę odległych genów, które istniały w określonym czasie, w określonej liczbie generacji. W oparciu o tą metodę, na przykładzie analizy polimorfizmu alleli HLA (ang. human leucocyte antigene) i szacowanej ilości zmian mutacyjnych w przeliczeniu na znana liczbę generacji, obliczono, że populacja założycielska H. sapiens sapiens musiała liczyć około 131 000 osobników. Badania populacyjne z wykorzystaniem markerów DNA znalazły zastosowanie w badaniach nad ewolucją człowieka i migracjami grup ludzkich. Przeprowadzenie takich badań znacząco ułatwiła analiza mitochondrialnego DNA (mtDNA) oraz nieulegających rekombinacji sekwencji DNA chromosomu Y czy też analizy polimorfizmów pojedynczych nukleotydów (ang. single nucleotide polymorphism , SNP) w obrębie całego genomu ludzkiego. Genetyczna różnorodność rdzennych Afrykanów jest obecnie dużo większa niż migrujących daleko populacji (np. Indian amerykańskich). Na każdym etapie migracji tylko pewna podgrupa wyrusza w wędrówkę „zabierając” tylko część genetycznej różnorodności z wyjściowej populacji. Analizy mitochondrialnego i jądrowego DNA pozyskanego ze szczątków form przed- i praludzkich, porównanie z mtDNA współczesnego człowieka wskazuje na drogi ewolucji. Stosowanie techniki analizy koalescencji pozwoliło na odtworzenie i ustalenie powiązań pomiędzy sekwencjami oraz odtworzenie kolejności pojawiania się poszczególnych mutacji w haplotypie linii genealogicznych. W miarę cofania się w czasie linie sekwencji niosące nowy allel powstały w wyniku mutacji łączą się stopniowo aż do zejścia się w jednym punkcie przeszłości, w sekwencji „najbliższego wspólnego przodka” (ang. MRCA – most recent common ancestor). Kształt drzewa koalescencyjnego analizowanych sekwencji zależy m.in. od historycznych zmian w strukturze i wielkości populacji. Im mniejsza jest populacja tym szybciej zbiegają się linie genealogiczne sekwencji. Drzewa koalescencyjne z zaznaczonymi na nich mutacjami dobrze ilustrują zależność między historią demograficzną populacji a jej spodziewaną różnorodnością genetyczną (rycina 1). czas Kierunek koalescencji MRCA Pokolenie współczesne - „najbliższy wspólny przodek” - osobniki dla których szukamy „najbliższego wspólnego przodka” Rycina 1. Koalescencja: współczesne pokolenie znajduje się u dołu schematu – w miarę cofania się ku wcześniejszym pokoleniom (ku górze) linie genealogiczne dwóch osobników łączą się w punkcie odpowiadającym sekwencji „najbliższego wspólnego przodka” (MRCA) w 6 wcześniejszym pokoleniu. Każda kropka symbolizuje indywidualną kopię genu, a każda linia łączy kopię genu z przodkiem poprzedniej generacji (opracowanie własne). W genetyce populacji wciąż ważne jest określenie w jaki sposób i w jakim czasie populacja przodków rozdziela się, dając początek odrębnym subpopulacjom. Istniejące metody szacowania czasu dywergencji populacji różnią się pod względem metodologicznym, założeń demograficznych oraz wymagają różnego rodzaju danych genetycznych jako danych wejściowych. Przykładem analizy metod szacowania czasu do ostatniego wspólnego przodka (TMRCA - the time to the most recent common 255 ancestor) jest praca wykorzystująca dane z sekwencjonowania genomu dla określenia czasu rozejścia się populacji Malajów z Azji Południowo-Wschodniej i Hindusów z Azji Południowej. Czynniki zaburzające równowagę genetyczną populacji Mutacje Są przyczyną powstawania nowych alleli; zmieniają częstości genów, mogą wpływać na fenotyp i zaburzać ważne funkcje życiowe organizmu, obniżając żywotność, płodność, a nawet powodować śmierć. Wynikiem różnego rodzaju mutacji są polimorfizmy wpływające na różnorodność genetyczną populacji. Nie wszystkie mutacje ujawniają się w danym pokoleniu i nie wszystkie zostają przekazane następnym pokoleniom. Zmiana właściwości przystosowawczych organizmu wskutek mutacji, może prowadzić do utrwalenia tej mutacji w wyniku selekcji. Wartość mutacji (i związana z tym szansa przeżycia, wydania potomstwa) jest zależna od warunków środowiska oraz od tła genetycznego np. heterozygoty z sierpowatością krwinek HbAHbS na terenach występowania malarii. Genom współczesnych gatunków jest zapisem zmian, które zachodziły w prowadząc do ich ukształtowania w toku ewolucji. Selekcja (dobór) Zjawisko polegające na eliminowaniu (selekcja negatywna) lub preferowaniu (selekcja pozytywna) pewnych osobników (tym samym pewnych alleli, lub/i genotypów) populacji, uniemożliwianiu pozostawiania potomstwa (przekazywania swoich genów następnemu pokoleniu), lub faworyzowaniu określonych osobników. Prowadzi do zmniejszenia różnorodności genetycznej populacji. Może działać na poziome gamet, indywidualnych osobników lub całych populacji. Siłą sprawczą doboru są zmiany środowiskowe oraz konkurencja wewnątrz- i międzygatunkowa. Przykład: Selekcja pozytywna – wyższa częstość heterozygot z sierpowatością krwinek (niedokrwistością sierpowatokrwinkową) HbAHbS na terenach endemicznego występowania malarii tropikalnej spowodowanej przez Plasmodium falciparum; uprzywilejowanie heterozygot w porównaniu z homozygotami HbAHbA (chorują na malarię) i HbSHbS (wykazują anemię sierpowatą – ciężką niedokrwistość hemolityczną). Hemoglobina sierpowata HbS indukuje ekspresję enzymu oksygenazy hemowej HO-1, która rozkłada hem i powoduje wytwarzanie m.in. tlenku węgla CO (produkt uboczny reakcji), który z kolei hamuje objawy malarii mózgowej. Hemoglobina sierpowata wykazuje także wpływ immunomodulujący. Innym przykładem może byś zwiększona częstość fenotypu Fy(a-b-) na obszarach zagrożonych malarią. Częstość alleli układu ABO w pierwotnych (natywnych) populacjach świata wykazuje ogromne zróżnicowanie, co wiązane jest z podatnością tych populacji na choroby infekcyjne (np. dżumę i ospę). Najwyższa częstość allela O występuje w Ameryce Południowej i Środkowej – nienawiedzanych przez epidemie dżumy. Natomiast w krajach Azji, zwłaszcza w centralnej i południowej części kontynentu – jest znacząco niższa. Krwinki grupy O zawierają antygen H, którego obecność wykazuje także pałeczka dżumy. Organizm osoby z grupą O nie wykrywa antygenu powodującego dżumę jako obcego, nie wytwarza przeciwciał, jest więc selekcyjnie upośledzony. Z kolei wirus ospy budową antygenową przypomina antygen A, co selekcyjnie upośledza osoby z grupą krwi A. Migracje, przepływ genów Emigracja - przemieszczanie się osobników z badanej populacji na zewnątrz: każdy osobnik zabiera ze sobą dwa allele badanego genu. Imigracja – przemieszczanie się osobników z zewnątrz do badanej populacji: każdy osobnik przynosi ze sobą dwa allele badanego genu. Populacje rzadko 256 pozostają całkowicie izolowane od siebie, równocześnie występują w nich subpopulacje, oddzielone barierami etniczno-kulturowymi, ekonomicznymi czy geograficznymi. W populacjach izolowanych i mało licznych ujawnia się działanie dryfu genetycznego. Dryf genetyczny Dryf genetyczny to losowa zmiana częstości alleli w kolejnych pokoleniach w wyniku przypadkowych fluktuacji (nieregularne wahania liczebności populacji). Wynika on z losowego przekazywania alleli potomstwu oraz różnych przypadkowych zdarzeń mogących eliminować pewne osobniki z populacji. Uwidacznia się szczególnie w mało licznych populacjach, w których prawdopodobieństwa zdarzeń wykazują znaczne odstępstwa od prawa wielkich liczb (prawo Bernoulliego: „z prawdopodobieństwem dowolnie bliskim 1 można się spodziewać, iż przy dostatecznie wielkiej liczbie prób częstość danego zdarzenia losowego będzie się dowolnie mało różniła od jego prawdopodobieństwa”). Częstość występowania genu może znacząco odchylać się w różnych generacjach takiej populacji. Jest to niewidoczne w populacjach dużych liczebnie. Dryf genetyczny może zwiększać albo zmniejszać częstość genów powodujących choroby. Dryf nie powoduje jednak znaczących odchyleń od prawa Hardy’ego-Weinberga przy występowaniu losowego kojarzenia, choć zmienia częstości alleli w populacji. Rzadkie choroby genetyczne mogą być obserwowane dość często lub rzadziej w małoliczebnych populacjach. Fenyloketonuria i mukowiscydoza, częste w populacji kaukaskiej, są stosunkowo rzadkie w Finlandii (populacja fińska została założona przez małą grupę ludzi około 100 pokoleń temu). W Europie zidentyfikowano 29 mutacji genu hydroksylazy fenyloalaniny (PAH). Spektrum mutacji występujących w poszczególnych regionach wynika z połączenia wielu czynników, w tym efektu założycielskiego, rozszerzenia zasięgu i migracji, dryfu genetycznego i prawdopodobnie przewagi (naddominacji) heterozygot. Skład genetyczny współczesnych populacji jest warunkowany przez poprzednie pokolenia. Szczególnym przypadkiem dryfu genetycznego są sytuacje gdy w przeszłości nastąpiło znaczące obniżenie liczebności populacji do której dochodzi w wyniku efektu założyciela (np. wskutek migracji niewielkiej liczby osobników i założenia przez nich nowej populacji) oraz efektu „szyjki od butelki” (ang. bottleneck - nieselektywnego drastycznego zmniejszenia liczebności populacji wskutek nagłego zdarzenia: klęska żywiołowa, pandemia). Przypadek powoduje, że taka populacja będzie miała znacząco odmienną i zubożoną pulę genetyczną w stosunku do populacji wyjściowej. Z biegiem czasu może dochodzić do kumulacji alleli powodujących wystąpienie chorób, np.: achromatopsja – niedowidzenie barw w populacji wyspy mikronezyjskiej Pingelap; syndrom Ellis-van Creveld’a u Amiszów z Lancaster, Pensylwania USA, częstość 1:200, a w populacji ogólnej USA 1:60 000 urodzeń (McKusick V. 2000); autosomalny recesywny zespół wad wrodzonych o charakterze dysplazji ektodermalnej: chondrodystrofia, niskorosłość, wady kośćca, wady zębów, patologiczne zmiany naczyniowe i wady serca, deformacje układu moczowo-płciowego, polidaktylia. Przykłady cech autosomalnych u człowieka, dla których częstości alleli mogą być analizowane z wykorzystaniem prawa Hardy'ego-Weinberga Prawo Hardy'ego-Weinberga jest wykorzystywane w analizach polimorfizmu wielu populacji różnych gatunków, w tym także gatunku H. sapiens sapiens. Istnienie kilku alleli danego genu warunkuje występowanie polimorfizmu morfologicznego, etologicznego, fizjologicznego czy biochemicznego. 257 Lateralizacja (stronność, przewaga czynnościowa jednej strony ciała nad drugą, ang. handedness) Cecha autosomalna dominująca lub wieloczynnikowa. Ważnym elementem rozwoju ruchowego dziecka jest prawidłowy przebieg procesu lateralizacji, który u większości dzieci zostaje zakończony między 6 a 10 rokiem życia. Wraz z ustaleniem się dominacji prawej strony ciała kształtuje się dominacja lewej półkuli mózgu, w przypadku dominacji lewej strony ciała – rolę nadrzędną będzie pełniła prawa półkula mózgowa. Występuje istotne zróżnicowanie funkcji półkul mózgowych: lewa półkula funkcjonuje w sposób analityczny, np. różnicuje litery, zauważa w nich „ogonki, kreski”, układa informacje sekwencyjnie, tj. element po elemencie, jest odpowiedzialna za odbiór czasu, odbiera i rozpoznaje dźwięki mowy, a także dokonuje złożonych operacji werbalnych. Prawa półkula funkcjonuje w sposób globalny, całościowy, przetwarza bodźce nowe, rozpoznając je, kieruje się podobieństwem fizycznym „całego” bodźca, a nie jego elementów, przetwarza i przechowuje informacje matematyczne i muzyczne (tabela 1). Osoby zorientowane lewostronnie (lewa ręka, oko, ucho, noga) i częściej korzystające z prawej półkuli mózgowej są w dużo trudniejszej sytuacji, kiedy muszą w sposób charakterystyczny dla lewej półkuli nauczyć się czytania, pisania, ortografii, czy matematyki. Osoby, które mają lateralizację skrzyżowaną, tzn. niektóre dominujące narządy są po prawej stronie (np. ręka), a niektóre – po lewej (np. oko) mają trudności ze skoordynowaniem działania ręki i oka. Oburęczność = ambidekstria - może mieć charakter pierwotny – częściej występuje u ludów prymitywnych lub wtórny – efekt ćwiczeń ręki mniej uprzywilejowanej. Tabela 1. Asymetria czynności mózgu – specjalizacja półkul mózgowych. półkula lewa matematyka rozumienie treści logiczne myślenie pisanie czytanie mowa analiza cyfry symbole np. nuty sekwencyjność percepcji półkula prawa spostrzeganie twarzy wyobraźnia rozumienie muzyki rzeźbienie przestrzenność biegłość w tańcu synteza obraz, figury geometryczne muzykalność jednoczesność percepcji W celu ustalenia wzorca lateralizacji należy przeprowadzić badanie wykorzystania nogi, ręki, oka i ucha obserwując dziecko podczas wykonywania codziennych czynności oraz przedstawionych wybranych „zabawowych” zadań (np. badanie dominującej ręki - wrzucanie koralików, małych klocków do wąskiej butelki, odkręcanie słoiczków; badanie dominującego oka - patrzenie przez dziurkę wyciętą w kartonie; badanie dominującej nogi - kopanie piłki, stanie na jednej nodze; badanie dominującego ucha - słuchanie grającego małego radia). Wzorzec lateralizacji ustalamy stwierdzając, którą ręką i nogą dziecko wykonuje zadania oraz którym okiem patrzy i uchem słucha. W przypadku dziecka z zaburzeniem komunikacji (np. dziecko z autyzmem) dla ustalenia wzorca lateralizacji należy przeprowadzić diagnozę u specjalisty. Badanie dominacji stronnej można przeprowadzić od 3 roku życia. Terapią powinny być objęte te dzieci, które po ukończeniu 3 roku życia mają: lateralizację lewostronną, lateralizację skrzyżowaną, lateralizację nieustaloną. Większa sprawność prawej lub lewej ręki nie jest cechą typowo ludzką - ponad 30% szympansów to tzw. mańkuty. Leworęczni to największa mniejszość na świecie. Stanowią 10% ludzkości. Dziecko, które rozpoczyna naukę szkolną może mieć duże trudności w nauce, jeśli proces ustalania lateralizacji, nie został zakończony. Trudności mogą dotyczyć czytania – nie tylko nauki czytania, ale również umiejętności czytania ze zrozumieniem (umiejętności te zależą głównie od lewej 258 półkuli mózgowej – ośrodki warunkujące umiejętność sekwencyjnego rozpoznawania liter, sylab i słów, a następnie składania ich w zdania i rozumienia ich znaczeń). Prawa półkula odpowiedzialna jest za odbiór wrażeń całościowych - widzianych wcześniej struktur lingwistycznych. W słowie rozpoznawany jest całościowy obraz, mogą nie być „widziane” kropki i „ogonki”, np. zamiast słowa dom jest czytane bom, albo zamiast słowa bąbel - babel. Lewa półkula mózgowa odpowiada za ortografię i gramatykę; gdy „zajmuje się” nimi prawa półkula mózgowa, popełniamy wiele błędów, przestawiamy litery, mylimy końcówki fleksyjne. Zdolność odczuwania smaku fenylotiomocznika W populacji człowieka, a także małp człekokształtnych, można wyróżnić 2 klasy: odczuwających inieodczuwających gorzki smak PTC/PROP (fenylotiokarbamid = fenylotiomocznik = = PTC z ang. Phenylthiocarbamide) – organiczny związek chemiczny z grupy aromatycznych związków azotowych jest odpowiedzialny za charakterystyczny gorzki smak. Jest stosowany, obok 6-npropylotiouracylu (PROP), jako marker w badaniach populacyjno-genetycznych, w testowaniu czucia smaku gorzkiego. Jest to cecha allelomorficzna - dominujący jest allel wrażliwości T. Częstość alleli i fenotypów jest różna w różnych populacjach. Rozkład zmienności fenotypowej wrażliwości na smak PTC w populacji ludzkiej wykazuje rozkład dwumodalny - inna jest odczuwanie u homozygot (TT), inna u heterozygot (Tt). W wyniku występowania w genie TAS2R38 w trzech miejscach SNPów obserwuje się występowanie 5 haplotypów zróżnicowane fenotypy wrażliwości na smak fenylotiokarbamidu. W odczuwaniu gorzkiego smaku pośredniczy grupa białek receptorowych, które znajdują się na powierzchni komórek w kubkach smakowych języka. Niewielkie różnice w strukturze tych białek warunkują różne stopnie wrażliwości na gorzki smak. U Europejczyków i Azjatów występują zwykle tylko dwie formy genu, który pozwala wykrywać gorzki fenylotiomocznik (PTC) oraz zbliżone do niego smakiem substancje, np. goitrynę, która występuje w warzywach z rodziny krzyżowych (kapusta, brokuł, brukselka itp.). U rdzennych mieszkańców Afryki gen dla PTC występuje w większej liczbie odmian niż w innych populacjach. Oznacza to, że w populacji mieszkańców Afryki występuje większa zmienność wyczuwania gorzkiego smaku. Biolodzy ewolucyjni tłumaczą to korzyściami płynącymi z odróżniania roślin jadalnych od trujących, które często bywają gorzkie, co w pradawnych społecznościach łowieckozbierackich miało kluczowe znaczenie dla przetrwania. Z drugiej strony, jadalne rośliny zawierające związki o gorzkim smaku są z reguły bogate w witaminy. Częstość osób wrażliwych na PTC w różnych populacjach: Autochtoni australijscy - 27%, Europejczycy – 72-75%, Chińczycy - 93%, Indianie północno-amerykańscy - 97%. Istnieje korelacja między wrażliwością na PTC, a skłonnością do niektórych chorób. Wykazano, że osoby niewrażliwe na PTC częściej chorują na wole z niedoczynnością tarczycy, a wśród odczuwających gorzki smak PTC częściej występuje nadczynność tarczycy. Nałóg palenia tytoniu występuje częściej wśród osób niewrażliwych na PTC, a rzadziej wśród odczuwających smak PTC. Częstość osób niewrażliwych na PTC jest szczególnie duża m.in. wśród osób z niedorozwojem umysłowym powstałym w wyniku wrodzonej niedoczynności tarczycy. Wrażliwi na PTC rzadziej chorują na: cukrzycę, wole guzowate tarczycy, wole z niedoczynnością tarczycy. Elementy genetyki populacyjnej – zastosowanie praktyczne w medycynie Współczesne populacje, także populacja ludzka, wykazują różnorodność genetyczną obrazującą proces zmienności w wyniku zachodzenia mutacji, działania dryfu genetycznego i selekcji. Czynnikami wpływającymi na kształtowanie się różnorodności genetycznej są także procesy demograficzne i historyczne: wielkość i struktura populacji, migracje, przepływ genów między populacjami. Poznanie współczesnej różnorodności genetycznej populacji ludzkich - genetycznego 259 profilu populacji (populacyjnej częstości występowania określonych alleli: neutralnych, zmutowanych) pozwala więc na badanie genetycznej historii gatunku i odtworzenie zależności między tymi populacjami i osobnikami. Ma także znaczenie dla diagnostyki chorób czy identyfikacji osób oraz ich przynależności populacyjnej. Genetyczne ryzyko zachorowania na choroby rzadkie Schorzenia występujące nie częściej niż 5 osób na 10 000 określane są jako choroby rzadkie. Ok. 80% tych chorób ma podłoże genetyczne; zaliczają się do nich także nietypowe nowotwory i choroby autoimmunologiczne. Są to choroby o przewlekłym i ciężkim przebiegu, w większości dotykają dzieci i zwykle prowadzą do fizycznego i umysłowego upośledzenia (choroby spichrzeniowe np.: mukopolisacharydozy, choroba Gauchera, choroba syropu klonowego, mukowiscydoza, fenyloketonuria, choroba Taya-Sachsa; choroby krwi i szpiku np.: hemofilia, szpiczak mnogi; choroby neurologiczne np. pląsawica Huntingtona; choroby immunologiczne). Uważa się, że każdy człowiek jest nosicielem około 5-10 genów recesywnych, które odpowiadają za powstawanie rzadkich chorób; przyczyną chorób mogą być także mutacje genowe w komórce jajowej lub plemniku. Ocena ryzyka genetycznego zachorowania na choroby rzadkie jest istotnym elementem poradnictwa genetycznego. Informacja o możliwości wykonania badania diagnostycznego powinna być przekazana zainteresowanym przed planowaną ciążą. Na zwiększenie ryzyka genetycznego chorób rzadkich ma wpływ wiele czynników – obciążenie podawane w wywiadzie rodzinnym, pokrewieństwo między rodzicami, a także – przynależność do tej samej grupy etnicznej. Do niedawna diagnostyka chorób rzadkich oparta była o metody biochemiczne – głównie rozpoznawanie produktu genu możliwe jedynie w nieco ponad 100 wrodzonych wadach metabolicznych. Obecnie diagnostyka chorób rzadkich (dla ponad 3000 jednostek chorobowych) jest możliwa na podstawie analizy DNA - identyfikacji mutacji bądź analizy, w danej rodzinie, sposobu przekazywania określonego markera genetycznego. Podstawową cechą markera musi być jego polimorfizm, to znaczy występowanie w danym locus więcej niż jednego allela. Może to być marker dwualleliczny - sekwencja DNA obejmująca polimorfizm pojedynczego nukleotydu rozpoznawana przez określony enzym restrykcyjny (taki typ polimorfizmu jest określany jako zmienność długości fragmentów restrykcyjnych RFLP (ang. restriction fragment length polymorphism). Markerem mogą być także powtarzające się motywy sekwencji – marker wieloalleliczny np. sekwencje mikrosatelitarne; polimorfizm długości prostych sekwencji (ang. simple sequence lenght polymorphism; SSLP), czyli allele różniące się między sobą liczbą powtarzalnych jednostek. Mogą mieć one wiele różnych wariantów długości. Wśród SSLP wyróżnić można dwa podstawowe typy: minisatelity – charakteryzujące się zmienną liczbą kilkudziesięcionukleotydowych tandemowych powtórzeń (ang. variable number of tandem repeats; VNTR), zlokalizowanych głownie na końcach chromosomów; oraz mikrosatelity – które zawierają proste tandemowe powtórzenia (ang. simple tandem repeats, STR) dwu, trzy lub czteronukleotydowych fragmentów. Mutacje dynamiczne Zjawisko antycypacji polega na tym, że w kolejnych pokoleniach choroba ma cięższy przebieg i często pojawia się we wcześniejszym wieku. W niektórych z tych chorób ma to związek ze wzrostem liczby powtórzeń sekwencji wraz z transmisją mutacji w genie do następnego pokolenia. Badanie zmienności odzwierciedlającej szybkość mutacji czy rekombinacji umożliwia analiza haplotypu. Pozwala ona prześledzić genealogię sekwencji, ustalić kolejność pojawiania się nowych alleli w poszczególnych pozycjach. Dostarcza informacji dotyczących wieku i pokrewieństwa haplotypów. 260 Genetyczny profil populacji a choroby złożone Choroby złożone to choroby, w których etiologii mają znaczenie czynniki genetyczne, epigenetyczne i środowiskowe. Nowotwory, cukrzyca typu 2, otyłość, choroby układu krążenia (np. nadciśnienie, choroba wieńcowa), astma, pewne formy niepłodności, osteoporoza – to przykłady takich chorób złożonych. Hipoteza „powszechna choroba – powszechny wariant” (ang. common disease – common variant) głosi, że schorzenia te są wynikiem działania wielu genów o małych efektach, a w związku z tym są uwarunkowane allelami występującymi w znacznej częstości także w populacji zdrowej. Utrudnia to identyfikację genów zaangażowanych w kształtowanie fenotypu. Również współdziałanie rzadkich alleli podatności w wielu loci, często o ograniczonym, wskutek mutacji, dryfu czy selekcji działającej regionalnie, występowaniu geograficznym, może powodować takie choroby. Badania populacji mające na celu poznanie genetycznego podłoża chorób złożonych oparte są na porównywaniu grup niespokrewnionych osób chorych i zdrowych pod względem współwystępowania objawów badanej patologii i obecności określonych markerów genetycznych (analiza profilu różnorodności genetycznej, profilu nierównowagi sprzężeń populacji, badania polimorfizmów SNP oraz ocena warunków środowiskowych). Medycyna sądowa Genetyczna różnorodność populacji jest wykorzystywana w analizach mających na celu ustalenie ojcostwa, określenie pokrewieństwa osób, wyjaśnienie śladów kryminalistycznych czy identyfikacji szczątków ofiar katastrof i przestępstw. Do identyfikacji populacji i pochodzenia osób wykorzystywane są markery wykazujące istotne różnice w częstości alleli pomiędzy różnymi grupami etnicznymi – AIMs (ang. ancestry informative markers). Markery te, stanowiące genetyczne dziedzictwo grupy, muszą wykazywać tę samą sekwencję i pochodzić od wspólnego przodka. Najczęściej wykorzystywane są polimorfizmy typu SNP, ze względu na ich dużą liczbę w genomie ludzkim oraz możliwość oceny w nawet mocno zdegradowanym materiale ludzkim. Innymi markerami mogą być np.: mtDNA, mikrosatelity, haplogrupy chromosomu Y. W sądownictwie mogą być także wykorzystywane białka, które można porównywać przy pomocy technik immunologicznych. Farmakogenetyka Farmakogenetyka zajmuje się genetycznie uwarunkowaną zmiennością reakcji organizmu na leki, a także na inne ksenobiotyki (związki chemiczne, które są obce dla organizmu żywego, nie są przez niego wytwarzane, a które jednocześnie wykazują aktywność biologiczną). Zmienność ta, odzwierciedla zróżnicowanie międzyosobnicze w populacji, różnice między populacjami, rasami ludzkimi i jest wykorzystywana w medycynie do optymalizacji farmakoterapii. Lek w organizmie ludzkim podlega kolejnym procesom: uwolnienie, wchłanianie, rozmieszczenie, metabolizm (biotransformacja), wydalanie/usuwanie. W metabolizmie leków biorą udział białka enzymatyczne, które przeprowadzają procesy biotransformacji. W pierwszej fazie (reakcje I fazy) – powodują one oksydację, hydrolizę, acetylację co zmienia chemiczną reaktywność cząsteczki leku (dzięki powstałym grupom funkcyjnym cząsteczki stają się bardziej polarne), a w drugiej fazie – następuje acetylacja, sprzęganie z aminokwasami, kwasem glukuronowym czy siarkowym, w wyniku których powstają związki nieczynne szybko ulegające wydaleniu z ustroju wraz z moczem lub żółcią. Podstawowe znaczenie w biotransformacji leków ma cytochrom P450, który uczestniczy w ponad 95% procesów oksydacji leków. Związany jest z błoną retikulum endoplazmatycznego gładkiego w wątrobie i niemal wszystkich pozostałych narządach i tkankach za wyjątkiem erytrocytów i mięśni poprzecznie prążkowanych. W genomie ludzkim poznano około 150 różnych genów (CYP) kodujących różne cytochromy P450 – izoenzymy. Sekwencja aminokwasów tych cytochromów wykazuje podobieństwo w 30-98%. Każdy gen kodujący izoenzym wykazuje polimorfizm – np. gen CYP2D6 izoenzymu cytochromu P-450 2D6 ma poznane 53 odmiany alleli u Europejczyków. Poszczególne 261 warianty alleli warunkują odmienną aktywność metaboliczną izoenzymu. Częstość występowania tych alleli w różnych populacjach warunkuje odmienne częstości osób określanych jako: „słabo metabolizujące”, „szybko metabolizujące”, czy „ultraszybko metabolizujące” określone związki. Badania genotypowania różnych populacji określające częstość alleli poszczególnych genów CYP pozwalają także na ocenę pokrewieństwa ewolucyjnego tych populacji i ich heterogenności. Z klinicznego punktu widzenia bardzo istotna jest możliwość fenotypowania pacjentów w kierunku aktywności cytochromu P-450 czy innych enzymów biorących udział w biotransformacji leków. Ma to szczególne znaczenie gdy są stosowane leki, np.: w formie proleku lub których metabolit ma istotne znaczenie farmakologiczne/terapeutyczne, leki mające możliwość alternatywnego metabolizmu, prowadzącego do powstania związku toksycznego, leki wykazujące znaczne efekty uboczne. Podawany jest pacjentom określony związek chemiczny (lek), a następnie oznaczane są w moczu z ośmiogodzinnej zbiórki określone związki – niezmieniony związek chemiczny (lek) i jego metabolity. Wyliczony współczynnik metaboliczny pozwala ocenić typ osoby metabolizującej. Jednym z najlepiej zbadanych enzymów i farmakogenów metabolizujących leki jest CYP2D6. Wykazuje wysoce polimorficzny charakter i ma duży udział w metabolizmie i bioaktywacji wielu leków stosowanych klinicznie. Badania częstości alleli CYP2D6 i przewidywanych fenotypów w populacjach ludzkich, stanowią ważne źródło danych dla klinicystów i badaczy. Opracowane są testy genotypowania, które mogą być stosowane jako pomoc w określaniu strategii terapeutycznej dla leków metabolizowanych przez produkt genu CYP2D6, np.: zestaw xTAG® CYP2D6 Kit v3, (© 2020 Laboratory Corporation of America® Holdings and Lexi-Comp Inc.), test CYP2D6 (© 2021 ARUP Laboratories). 262 CZĘŚĆ PRAKTYCZNA DOŚWIDCZENIA 1. Dryf genetyczny - analiza na modelu – doświadczenie, protokół Ocena działania dryfu genetycznego (ocena zmiany częstości allela dominującego) w pięciu kolejnych pokoleniach populacji liczącej 20 osobników (40 alleli), w której częstość allela dominującego wynosi wyjściowo 20%, a allela recesywnego 80%. WYKONANIE Materiały i odczynniki: - urna zawierająca 32 kulki białe i 8 kulek czerwonych, - zapas kulek białych i czerwonych, - pusta urna. Protokół doświadczenia: 1. Z urny usuwamy losowo, po jednej kulce, 20 kulek (w modelu populacji – 50% populacji ginie losowo). 2. Wśród pozostałych w urnie kulek obliczamy odsetek kulek białych i czerwonych, a następnie podwajamy ich liczbę (rozmnażanie – podwajanie puli genowej populacji). Losowanie powtarzamy jeszcze cztery razy, za każdym razem oceniamy częstość allela dominującego i recesywnego w każdym pokoleniu. 3. Obliczamy także wielkość dryfu, którego miarą jest odchylenie standardowe częstości allela w populacji: gdzie p – częstość allela dominującego, q – częstość allela recesywnego, N – liczebność populacji; wartość dryfu jeśli rośnie dla jednego allela, to równocześnie maleje dla drugiego stąd znak plus lub minus. Wyniki: Wnioski: Podpis prowadzącego ……………………………………… Data……………… Ilość punktów……………………….. 263 REPOZYTORIUM Jakie jest prawdopodobieństwo urodzenia się zdrowych dzieci z krzyżówki testowej, jeżeli w danej populacji zespołu Marfana nie wykazuje 16% osób? oznaczamy: p - częstość allela zespołu Marfana (M) w populacji; P (M) = p q- częstość allela prawidłowego (m) w populacji; P (m) = q q2- częstość osób zdrowych (mm) w populacji; P (mm) = q2 P (mm) = q2 = 16% = 0,16 --→ q = 0,4 p + q = 1 --→ p = 0,6 Krzyżówka testowa - między homozygotą recesywną a heterozygotą, a więc w populacji są dwie ewentualności: ♀ mm x Mm ♂ i ♀ Mm x mm ♂, czyli P (mm x Mm) + P (Mm x mm) = 2 x q2 x 2pq = 4p q3 W krzyżówce testowej zdrowe dzieci rodzą się z prawdopodobieństwem 1/2, bo Mm mm x Mm mm Mm mm Zdrowe dzieci w krzyżówce testowej w tej populacji będą się rodziły z prawdopodobieństwem: P (mm) = 1/2 x 4p q3 = 1/2 x 4 x 0,6 x 0,43 = 0,0768 = 7,68% Odpowiedź. Zdrowe dzieci w krzyżówce testowej w tej populacji będą się rodziły z prawdopodobieństwem 7,68% ZADANIA GENETYCZNE 1. Częstość występowania fenyloketonurii w danej populacji wynosi 9%. Oblicz częstość poszczególnych genotypów w tej populacji oraz prawdopodobieństwo krzyżówki między osobnikami nie wykazującymi tej cechy (rozpatrz wszystkie typy krzyżówek)? 264 2. Częstość występowania mukowiscydozy w danej populacji wynosi 1%. Oblicz częstość nosicieli tej cechy w populacji oraz prawdopodobieństwo krzyżówki między osobnikami tej populacji nie wykazującymi tej cechy? 3. W danej populacji liczącej 800 osób u 480 stwierdzono obecność wolnego płatka ucha. Jakie jest prawdopodobieństwo krzyżówki matki z wolnym płatkiem i ojca z przyrośniętym płatkiem ucha w tej populacji? 4. Oblicz częstość urodzenia się zdrowej dziewczynki rodzicom wykazującym brachydaktylię, jeżeli w danej populacji cechy tej nie wykazuje 96% osób. 5. W danej populacji anemia sierpowata występuje z częstością 1%. Podać częstość rodzenia się dzieci z sierpowatością w tej populacji (rozpatrzyć wszystkie możliwe krzyżówki). 265 6. W danej populacji częstość osobników o grupie krwi 0 wynosi 9%, a homozygot z grupą krwi B - 16%. Podać z jakim prawdopodobieństwem będą się rodziły w tej populacji dzieci z grupą krwi AB (rozpatrzyć wszystkie możliwe krzyżówki). 266 ZADANIA DO SAMOKSZTAŁCENIA 1. Nazwij przedstawione na rycinach cechy, określ sposób ich dziedziczenia i podaj cechę przeciwstawną: A B C 2. Wrażliwość na PTC a skłonność do niektórych chorób – wypisz choroby, które częściej obserwowane są u osób odczuwających i nieodczuwających gorzki smak fenylotiomocznika: WRAŻLIWI NA PTC NIEWRAŻLIWI NA PTC 3. Z wymienionych poniżej zjawisk genetyczną różnorodność populacji zwiększają: C.2,3,5; D. wszystkie zjawiska. 1. dryf genetyczny; 2. mutacje; 3. rekombinacja mejotyczna; 4. nierównowaga sprzężeń; 5. przepływ genów między populacjami. A.1,4; B.2,4,5; 4. Fałszywe stwierdzenie to: A. tylko 2; B. 2,3,4; C.2,5; D. wszystkie są prawidłowe. Populacja mendlowska to populacja: 1. w której spełnione jest prawo Hardy`ego-Weinberga; 2. w której migracje, mutacje i selekcja równoważą się; 3. charakteryzująca się bardzo dużą (w teorii nieskończoną) liczebnością; 4. w stanie równowagi genetycznej; 5. w której nowe mutacje występują ze stałą częstością. 5. Przepływ genów w następstwie migracji lub połączenia subpopulacji w ramach metapopulacji może prowadzić do: A. zmniejszenia homozygotyczności; B. zwiększenia homozygotyczności; C. selekcji negatywnej; D. ujawnienia „efektu założyciela”. 6. Efekt mutacji zmiany szóstego aminokwasu w łańcuchu hemoglobiny ludzkiej „chroniącej” przed malarią wywołaną przez Plasmodium falciparum jest przykładem: A. selekcji promującej heterozygoty; B. selekcji promującej homozygoty; C. selekcji negatywnej; D. dryfu genetycznego. 267 7. Najczęściej (ok. 8%) daltonizm występuje w populacji mężczyzn: A. pochodzenia azjatyckiego; B. odmiany czarnej z Afryki; C. Europejczyków rasy białej; D. rdzennej ludności Ameryki Południowej. 8. Określ czy populacja licząca 10 000 osobników, w której stwierdzono 600 homozygot dominujących, 5800 heterozygot i 3600 homozygot recesywnych znajduje się w stanie równowagi genetycznej. 268 LITERATURA 1. Bal J. (red.) 2017. Genetyka Medyczna I molekularna. Wydawnictwo Naukowe PWN SA Warszawa. Rozdział IV, Genetyczna różnorodność współczesnych populacji ludzkich, 51-71. 2. Drewa G, Ferenc T (red.) 2011. Genetyka medyczna. Podręcznik dla studentów. Elsevier Urban & Partner Sp. z o.o., Wrocław. Rozdział 34. Podstawy genetyki populacyjnej i wybrane zagadnienia z genetyki ewolucyjnej człowieka. 854-881: • Podrozdział 34.1 • Podrozdział 34.2 • Podrozdział 34.3 • Podrozdział 34.4 • Podrozdział 34.5 • Podrozdział 34.6 3. Gaedigk A, Sangkuhl K, Whirl-Carrillo M, Klein T, Leeder JS. 2017. Prediction of CYP2D6 phenotype from genotype across world populations. Genetics in Medicine 19(1):69-76. DOI: 10.1038/gim.2016.80. 4. Moonesinghe R, Yesupriya A, Chang M, Dowling NF, Khoury MJ, Scott AJ, for the CDC/NCI NHANES III Genomics Working Group. 2010. A Hardy-Weinberg Equilibrium Test for Analyzing Population Genetic Surveys With Complex Sample Designs, American Journal of Epidemiology, 171(8), 932–941. 269 ZAŁĄCZNIKI Instrukcja do programu Olyvia 1. Ze strony http://olyvia.software.informer.com/download/ ściągnąć program Olyvia w wersji 2.4 i zainstalować na komputerze. 2. Uruchomić program. 3. Z zakładki „Database” wybrać pole „Open” 4. Pojawi się okno „Open Database” - W polu „Database Name” wpisać: „Zak_Biomed_Genet” - W polu „Server” wpisać: „vm.cdum.umed.pl” - W polu „Authentication” wybrać: „SQL Authentication” - W polu “Name” wpisać: “student” - W polu „Password” wpisać: „student” - Zatwierdzić „Ok” 5. Po uruchomieniu bazy danych wybrać folder „Biologia medyczna” (dwukrotne kliknięcie lewym klawiszem myszy). Następnie wybrać folder wybranego ćwiczenia. 6. Wybrać preparat (dwukrotne kliknięcie lewym klawiszem). Otworzy się obraz preparatu, na którym należy zlokalizować okno aktywne. Powiększyć obraz okna aktywnego do uzyskania właściwego obrazu. 7. Powrót do bazy danych: wybrać zakładkę „Database” w prawym górnym rogu 270