2015-06-04
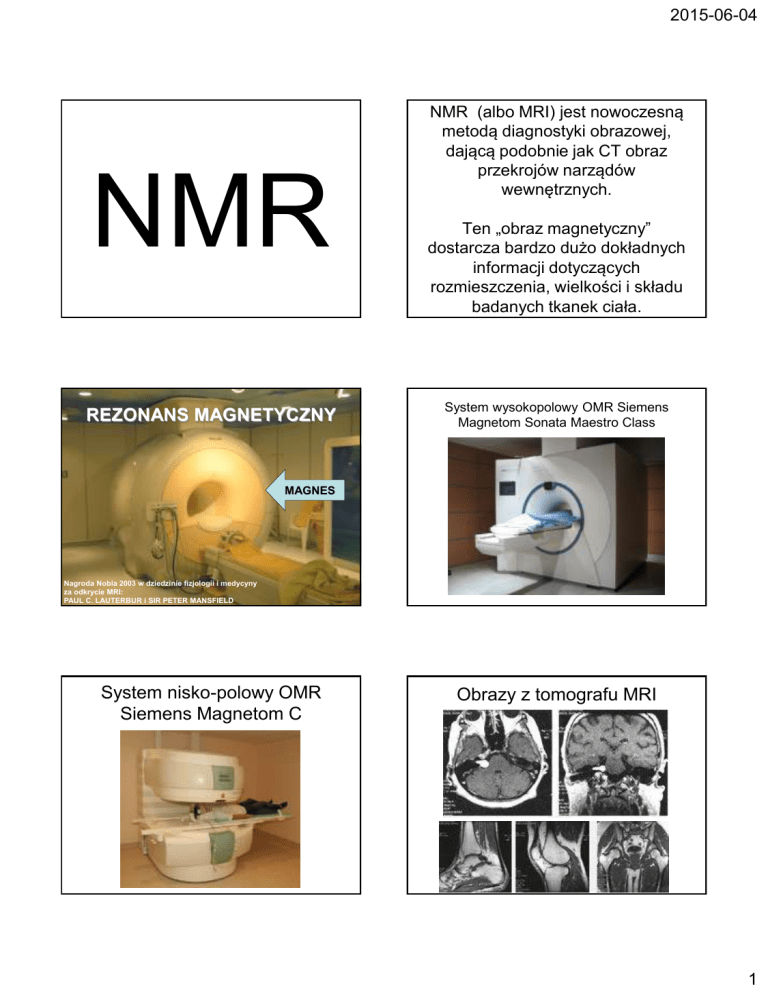
NMR
REZONANS MAGNETYCZNY
NMR (albo MRI) jest nowoczesną
metodą diagnostyki obrazowej,
dającą podobnie jak CT obraz
przekrojów narządów
wewnętrznych.
Ten „obraz magnetyczny”
dostarcza bardzo dużo dokładnych
informacji dotyczących
rozmieszczenia, wielkości i składu
badanych tkanek ciała.
System wysokopolowy OMR Siemens
Magnetom Sonata Maestro Class
MAGNES
Nagroda Nobla 2003 w dziedzinie fizjologii i medycyny
za odkrycie MRI:
PAUL C. LAUTERBUR i SIR PETER MANSFIELD
System nisko-polowy OMR
Siemens Magnetom C
Obrazy z tomografu MRI
1
2015-06-04
Zasadniczą zaletą NMR (MRI)
jest dobre różnicowanie
w tej metodzie obrazowania
tkanek zdrowych i tkanek
zmienionych nowotworowo.
Na następnym slajdzie
pokazane są obrazy NMR
mózgu osoby zdrowej
i osoby z guzem mózgu.
Teoretyczne podstawy
magnetycznego rezonansu
jądrowego znane od roku 1945
po raz pierwszy zostały
wykorzystane do obrazowania
organizmów żywych przez
Paula Lauterbura w 1973 roku.
MRI nie wykorzystuje promieni
rentgenowskich, lecz oparta jest na
właściwościach magnetycznych atomów,
z których składa się ludzkie ciało.
W silnym polu magnetycznym wytwarzanym przez skaner MRI,
pobudzone impulsem magnetycznym jądra atomów
tworzących tkanki wysyłają sygnały elektromagnetyczne.
Takie sygnały odbierają detektory umieszczony wokół
pacjenta. Intensywność sygnałów jest różna, w zależności od
typu tkanki.
Komputer przyporządkowuje sygnały odpowiednim punktom
w badanych rejonach ciała i przetwarza je na obraz
widoczny na ekranie.
Uproszczony schemat aparatury NMR
Zobrazowanie magnetycznego rezonansu jądrowego (ang.
MRI – Magnetic Resonance Imaging)
W technice tej wykorzystuje się trzy pola magnetyczne:
pole służące do ukierunkowania momentów magnetycznych protonów,
które jest polem stałym o natężeniu 0.2 – 2.5 Tesli.
pola gradientowe, które mają za zadanie wybranie jednej z trzech warstw
będącej przedmiotem rekonstrukcji i wyznaczenie współrzędnych obrazu
tej warstwy.
W MRI wykorzystano promieniowanie
pochodzące z atomów wodoru (63%).
Różne tkanki mogą być
identyfikowane dzięki różnym czasom
relaksacji.
2
2015-06-04
Ogólny schemat tomografu NMR
(przekrój boczny).
Jakie substancje widzi MRI?
Tkanki bogate w tłuszcze i kwasy tłuszczowe
1 – główny magnes, 2 – cewki korekcyjne, 3 – cewki gradientowe,
4 – cewki odbiorcze, 5 – badany pacjent
Jak działa Magnetyczny Rezonans?
Tkanki bogate w ATP
Tkanki bogate w wodę
(jądra fosforu P)
Jak działa Magnetyczny Rezonans?
Wirujące protony
zachowują się jak małe
magnesy
Gdy brak pola
magnetycznego
momenty magnetyczne jąder
(strzałki) są rozłożone
przypadkowo
Magnetyczny Rezonans Jądrowy działa na jądra atomowe
Szczególne na jądra wodoru (H)
Jak działa Magnetyczny Rezonans?
Schemat wzajemnej orientacji stałego pola magnetycznego
B0 i pola w.cz. B1 wytwarzanego przez cewkę pobudzającą
protony
WWirujące
zewnętrznym
polu
zachowują
się jak małe
magnetycznym
magnesy się
porządkują
Silne pole magnetyczne
wytworzone przez magnes
Rezonansu Magetycznego
porządkuje momenty
magnetyczne jąder
(ustawiają się zgodnie lub
przeciwlegle do linii pola)
3
2015-06-04
Jak działa Magnetyczny Rezonans?
WWirujące
zewnętrznym
protony
polu
zachowują
magnetycznym
się jak małe
porządkują
magnesy się
Fala radiowa daje protonom
energię, żeby ustawiły się
wbrew działającemu na nie
polu magnetycznemu.
Jak działa Magnetyczny Rezonans?
protony
WWirujące
zewnętrznym
polu
zachowują
się jak małe
magnetycznym
magnesy się
porządkują
Jak działa Magnetyczny Rezonans?
protony
WWirujące
zewnętrznym
polu
zachowują
się jak małe
magnetycznym
magnesy się
porządkują
Kiedy fala przestaje działać,
protony wracają z powrotem do
„wygodniejszej” dla siebie
„pozycji”. W czasie tego
powrotu protony emitują falę
radiową, czyli „świecą”
promieniowaniem radiowym.
Detektor w MR wykrywa to
promieniowanie i tworzy obraz.
Uproszczony schemat konstrukcyjny
skanera NMR
Kiedy fala przestaje działać,
protony wracają z powrotem do
„wygodniejszej” dla siebie
„pozycji”. W czasie tego
powrotu protony emitują falę
radiową, czyli „świecą”
promieniowaniem radiowym.
Detektor w MR wykrywa to
promieniowanie i tworzy obraz.
Widok elementów składowych
tomografu NMR
Porządkowanie spinów protonów przez
zewnętrzne pole magnetyczne
4
2015-06-04
Widok skanera NMR
Parametry sterowania skanera NMR
lp.
akronim
nazwa angielska
nazwa polska
objaśnienie
Kąt odchylenia zbiorczego
1.
FA
Flip angle
2.
FOV
Field of View
3.
NEX
Kąt odchylenia
wektora magnetyzacji M od
namagnesowania
kierunku pola magnetycznego
wywołanego przez impuls RF
Number of
excitations
Pole obrazowania
Liczba wzbudzeń
Dwuwymiarowa przestrzeń
kodowania obrazu
Ilość linii przestrzeni k
rejestrowanych podczas skanu
Czas od momentu wzbudzenia
4.
TE
Echo time
Czas echa
impulsem RF do uzyskania
sygnału echa
Czas elementarnej sekwencji,
5.
TR
Time to repeat
Czas repetycji
pomiędzy dwoma
(powtórzeń)
powtarzanymi impulsami echa
spinowego
Przykładowe parametry badania
NMR mózgu
MRI świetnie nadaje się do badania
mózgu
Badanie lokalizacyjne wykonano w projekcji strzałkowej przy
następujących parametrach:
TR 150,0 ms, TE 2,2 ms, FA 70, FOV 24x24 cm, NEX 2
Badanie strukturalne wykonano w projekcji poprzecznej przy
parametrach: TR 2000,0 ms, TE 100,0 ms, aby otrzymać
obrazy T2-zależne
Ustalono 18 warstw skanowania o grubości (ang. slice
thickness) 7,0 mm i rozstawie (ang. slice spacing) 0,0 mm
MRI świetnie nadaje się do badania
mózgu
MRI jest nieszkodliwy
Guz nowotworowy
5
2015-06-04
Można „filmować” pracę organów
Można „podglądać” myśli
Pomarańczowe regiony – aktywne partie mózgu
Serce szczura
Jeden z twórców NMR - Raymond Damadian
Kilka słów o historii powstania
i rozwoju NMR
Jego prace miały ogromne znaczenie dla rozwoju rozważanej techniki,
ale nie zostały uhonorowane Nagrodą Nobla
Byłem jednym z pionierów wdrażania NMR w Krakowie
Laureaci
Nagrody
Nobla,
przyznanej
za prace
związane
z NMR
…
…
Przypomnijmy: Nagroda Nobla za odkrycie MRI przyznana została 2003
6
2015-06-04
Ruchy w jądrze atomowym
Jądrami posiadającymi spin są
głównie protony (jądra wodoru)
oraz jądra fosforu, wchodzącego
w skład ATP
a – spin elektronu wokół własnej osi,
b – ruch elektronu wokół jądra atomowego,
c – spin jądra indukujący moment magnetyczny atomu
Wiadomo, że jądra atomowe posiadają spin oraz
moment magnetyczny, związane zależnością:
Ruch spinowy protonu jądra atomu wodoru,
indukujący pole magnetyczne (na rysunku
zaznaczone w postaci linii sił) opisywany
wektorem momentu magnetycznego m
Można pokazać, że energia swobodnego spinu jądrowego umieszczonego
w polu magnetycznym o indukcji B może przyjąć jeden z 2I+1 dyskretnych,
równoodległych poziomów. Odległość między sąsiednimi poziomami wynosi:
W uproszczeniu rezonans jądrowy można potraktować jako kwantową absorpcję
promieniowania.
Spin może przejść do wyższego stanu, pobierając kwant energii z pola
magnetycznego, np. wytworzonego przez cewkę okalającą próbkę.
Momenty magnetyczne m jąder atomów wodoru, wchodzących
w skład tkanek ludzkiego ciała zorientowane są w sposób
losowy.
Zasada powstawania sygnału NMR
Po przyłożeniu zewnętrznego pola magnetycznego B0 wektory
m porządkują się równolegle i antyrównolegle w stosunku do
przyłożonego pola (mają zwroty zgodne albo przeciwne niż B0).
W zależności od siły przyłożonego pola i temperatury badanej
tkanki różne są proporcje pomiędzy ilością pierwszych i drugich.
W stanie równowagi cieplnej istnieje jednak przewaga jąder
o momentach magnetycznych zorientowanych równolegle do
przyłożonego pola.
Dają one łącznie wypadkowy wektor magnetyzacji M.
Składowa poprzeczna wektora M jest wynosi zero, ponieważ
losowo skierowane poprzeczne składowe momentów
magnetycznych znoszą się.
7
2015-06-04
Precesja Larmora
Częstotliwość ruchu precesyjnego opisana jest równaniem Larmora:
0 B0
gdzie B0, to wartość zewnętrznego pola magnetycznego, w którym znajduje się
tkanka, natomiast stała to tzw. współczynnik żyromagnetyczny, zależny od rodzaju
jądra atomowego.
Częstotliwość 0 nosi nazwę częstości Larmora.
Pola magnetyczne stosowane we współczesnych tomografach magnetycznorezonansowych mają wartości rzędu 0,04 T – 2,5 T.
Współczynnik żyromagnetyczny dla atomu wodoru wynosi 42,58 MHz/T.
Obecność zewnętrznego pola magnetycznego B0 powoduje, że obok uporządkowania
momentów magnetycznych (a co za tym idzie pojawienia się niezerowej magnetyzacji
M), pojawia się zjawisko precesji polegające na ruchu wektora m po tworzącej stożka
zorientowanego wzdłuż pola B0
Częstości Larmora niektórych
pierwiastków w polu B0 = 1 T
Izotop
Wodór 1H
Deuter 2H
Węgiel 13C
Azot 14N
Azot 15N
Fluor 19F
Sód 23Na
Fosfor 31P
Częstość Larmora (MHz)
42,58
6,54
10,71
3,08
4,32
40,08
11,27
17,25
Dla pola 2 T precesja wektora M odbywa się zatem z częstością ok. 85 MHz, co
odpowiada częstości fal radiowych.
Magnetyczny rezonans jądrowy
Jeśli tkankę będącą w zewnętrznym polu B0, a zatem
charakteryzowaną pewną określoną magnetyzacją M,
podda się działaniu impulsu elektromagnetycznego
o częstotliwości równej częstości Larmora i o kierunku
prostopadłym do kierunku M i B0, wówczas dochodzi do
rezonansu.
Polega on na pochłonięciu energii przez jądra atomowe,
których momenty magnetyczne dają wkład do
magnetyzacji M.
W wyniku tego zjawiska wektor M ulega przejściu do
płaszczyzny prostopadłej do B0 (płaszczyzna
poprzeczna), wykonując na niej ruch obrotowy
z częstością Larmora
Wektor magnetyzacji przed (a), tuż po
wzbudzeniu (b) oraz podczas relaksacji (c).
Na rysunkach (b) i (c) zaznaczono ścieżki precesji wektorów M oraz M
(ściśle rzecz biorąc, wektor M zbiega po spirali do zera, natomiast ruch M jest
wypadkową ruchu M i odtwarzania się składowej Mz)
8
2015-06-04
Aby lepiej zrozumieć mechanizmy zachodzące
w tkance poddanej zjawisku rezonansu magnetycznego
wygodnie jest wprowadzić następującą notację
Wektor magnetyzacji można rozłożyć na sumę dwóch składowych:
Istotne zjawisko zachodzi na poziomie
pojedynczych jąder atomowych.
Cewka zbierająca
sygnał do analizy
M = M + Mz ,
gdzie M jest składową poprzeczną magnetyzacji, leżącą w płaszczyźnie
poprzecznej do kierunku pola B0, natomiast Mz składową podłużną, równoległą, do
kierunku B0.
W chwili początkowej (przed wzbudzeniem) brak jest składowej poprzecznej, czyli
M=0, co wynika z faktu, że składowe poprzeczne momentów magnetycznych
poszczególnych jąder są skierowane losowo i w związku z tym znoszą się.
Z kolei, w momencie zaraz po wzbudzeniu, Mz=0 i wektor magnetyzacji leży na
Otóż wszystkie momenty magnetyczne m pojedynczych jąder, które składają się na
magnetyzację M, wirują po wzbudzeniu, w płaszczyźnie poprzecznej,
z jednakowymi częstościami (Larmora) i w zgodnych fazach
płaszczyźnie poprzecznej.
Zasada zbierania sygnału NMR
Relaksacja
Jeśli w rejonie takiej „wzbudzonej” tkanki umieści się
odpowiednio nakierowaną cewkę, wówczas zgodnie
z zasadą indukcji magneto-elektrycznej Faradaya
pojawi się w niej prąd zmienny o częstości 0.
Nosi on nazwę sygnału swobodnej precesji
(ang.: FID – free induction decay).
Po wyłączeniu impulsu odpowiedzialnego za powstanie
rezonansu, następuje zjawisko nazywane
relaksacją.
Relaksacja składa się z dwóch niezależnych od siebie
procesów.
1. Odtworzenie składowej podłużnej Mz magnetyzacji.
Wynika ono ze stałej obecności zewnętrznego pola
magnetycznego B0.
Wielkość tego prądu zależy od wartości magnetyzacji
M, a dokładniej od wartości jej składowej poprzecznej
M, która w początkowej chwili spełnia równanie
M = M .
Podstawowe stałe czasowe
2. Wygaśnięcie do zera składowej poprzecznej M.
Zanik M ma dwie przyczyny. Pierwsza to
niejednorodność pola magnetycznego B0, druga
związana jest z wzajemnymi oddziaływaniami
momentów magnetycznych m sąsiednich jąder.
Zmiana składowych M w procesie relaksacji.
Zjawisko powrotu magnetyzacji Mz do wartości
początkowej oraz całkowity zanik wartości M,
odbywają się w różnych skalach czasowych
charakteryzowanych dwiema stałymi T1 i T2,
nazywanymi odpowiednio czasem relaksacji
podłużnej i czasem relaksacji poprzecznej.
Parametr T1 jest zdefiniowany jako czas potrzebny na to, aby
Mz osiągnęło 63% swojej początkowej wartości
(tj. sprzed wzbudzenia),
natomiast T2 jako czas, po którym 63% magnetyzacji poprzecznej
M po wzbudzeniu ulega zanikowi
Po lewej: Stała czasowa T1, charakteryzująca odtwarzanie się składowej podłużnej M z.
Po prawej: Zanik składowej poprzecznej M określony stałą czasową T2
9
2015-06-04
W wyniku relaksacji i zaniku M następuje
spadek napięcia w cewce, w której precesja
magnetyzacji M indukuje prąd
Czasy T1 i T2 przyjmują dla tkanek
ludzkich wartości
między 0,08 s a 2,5 s
i są zależne od rodzaju tkanki.
Skrajne przypadki stanowią tłuszcz,
o krótkich czasach relaksacji
i woda, dla której T1 i T2 są duże.
Na przykład T2 wody wynosi 0,2 s,
zaś T2 dla tłuszczu 0,08 s.
Zestawienie czasów relaksacji T1 i T2
dla różnych tkanek i narządów w polu 0.15 T
W diagnostyce magnetyczno rezonansowej nie stosuje się
pojedynczych impulsów wzbudzających, ale ich sekwencje
Woda
Płyn mózgowo-rdzeniowy
Materiał biologiczny
Krew
Mięśnie
T1
Nerki (rdzeń)
Nerki (kora)
T2
Śledziona
Mózg - istota szara
Mózg - istota biała
Istotną rolę odgrywają tu kolejne dwa parametry czasowe, a mianowicie czas repetycji TR oraz
czas odczekania TE, oba mierzone w milisekundach.
Wątroba
0
500
1000
1500
2000
2500
3000
Czas relaksacji [ms]
Wielkości TR i TE są parametrami
aparaturowymi i jako takie mogą
być zmieniane przez osobę
obsługującą tomograf
magnetyczno-rezonansowy.
Odpowiednie ich ustawienie
gwarantuje nadanie żądanego
kontrastu obrazom uzyskiwanym
w badaniu.
TR jest odstępem między dwoma kolejnymi impulsami, natomiast TE czasem pomiędzy zadaniem
impulsu, a momentem pojawienia się maksymalnego sygnału (prądu) w cewce
Zasady kontrastowania tkanek
Istnieją trzy sposoby kontrastowania tkanek
w obrazach magnetyczno-rezonansowych.
W dwu pierwszych wykorzystuje się różnice
w czasach relaksacji, T1 bądź T2, pomiędzy
różnymi substancjami, z których zbudowane jest
ciało ludzkie.
W trzeciej różnice w gęstościach protonów
w tychże substancjach.
10
2015-06-04
Czas T1 tłuszczu jest mniejszy od czasu T1 wody.
Dla tzw. obrazów z przewagą T1
(ang.: T1 weighted images,
nazywanych także obrazowaniem
lub kontrastowaniem T1)
istotna jest różnica szybkości,
z jaką w danej tkance odtwarza się
składowa podłużna magnetyzacji Mz.
Po upływie czasu TR wartość składowej podłużnej wektora magnetyzacji dla
tłuszczu będzie większa niż dla wody
Zatem, kiedy po następnym impulsie, oba wektory magnetyzacji zostaną ponownie
„położone” na płaszczyźnie poprzecznej, długość magnetyzacji M dla tłuszczu będzie
większa.
Datego impuls w cewce będzie silniejszy, co da w następstwie jaśniejszy obraz tej
tkanki.
Parametrem umożliwiającym manipulowanie kontrastem jest tu czas repetycji TR,
od którego zależy, na ile składowe Mz, odtworzą się.
Aby osiągnąć zadowalające zobrazowanie stosuje się krótkie TR i TE.
Przy generowaniu tzw. obrazów
z przewagą T2 (ang.: T2 weighted
images, obrazowanie T2,
kontrastowanie T2)
wykorzystywana jest różnica
szybkości z jaką zanika składowa
poprzeczna magnetyzacji
w różnych typach tkanek.
Parametrem wpływającym na jakość
kontrastu jest czas odczekania TE.
Łatwo zauważyć, iż wzięcie zbyt małej wartości TE
spowoduje, że nawet składowa poprzeczna
o krótkim czasie relaksacji T2 (tzn. zanikająca
szybko) nie zdąży wygasnąć na tyle, aby różnica
sygnału generowanego przez nią i sygnałów
generowanych przez składowe poprzeczne innych
tkanek były dostatecznie wyraźne.
Dla obrazów z przewagą T2 dobry kontrast
uzyskuje się przy długich czasach TR i TE.
Podobnie jak w poprzednim przypadku, czas
relaksacji poprzecznej T2 dla tłuszczu jest
mniejszy niż dla wody.
Jeśli zatem po zadaniu impulsu
wzbudzającego odczekamy odpowiednio
długi czas TE, wówczas otrzymamy
względnie silny sygnał z obszarów
występowania wody i słaby sygnał (lub jego
brak) z tkanek tłuszczowych.
Dlatego też, w obrazowaniu T2, odwrotnie
niż w T1, tkanki tłuszczowe są koloru
ciemnego, natomiast woda jasnego.
Trzeci typ kontrastowania to tzw.
obrazowanie z przewagą
gęstości PD
(ang.: proton density weighting).
Bazuje ono na różnicach gęstości protonów (jąder atomów wodoru)
w różnych tkankach i „pomija” różnice między czasami relaksacji dla
poszczególnych typów tkanek.
Aby osiągnąć ostatni warunek ustawia się długi czas repetycji TR i krótki
czas odczekania TE.
Długi TR pozwala odtworzyć się składowym podłużnym magnetyzacji Mz
zarówno w tłuszczu jak i w obszarze z przeważającym udziałem wody
(biorąc te dwa skrajne przykłady), przed zadaniem kolejnego impulsu
wzbudzającego.
To zaś niweluje opisywany wcześniej efekt, wykorzystywany przy
obrazowaniu T1.
11
2015-06-04
Ustalenie krótkiego TE, po którym następuje
odczyt sygnału, gwarantuje, że zanik
składowych poprzecznych magnetyzacji M
w różnych tkankach będzie praktycznie taki
sam. Jeśli tak, to jedynym czynnikiem
decydującym o sile sygnału (długości M)
jest proporcjonalna do gęstości ilość
protonów, których momenty magnetyczne m
dają wkład do M.
Typowe czasy repetycji TR i odczekania TE
opisane powyżej jako „krótkie” lub „długie”
przyjmują wartości podane w Tabeli
TR
TE
Długi
2s
0,06 s
Krótki
0,25 s – 0,7 s
0,01 s – 0,025 s
Im w danej tkance więcej protonów, tym jej
magnetyzacja M jest większa, sygnał
silniejszy, a jej obraz jaśniejszy.
Zmiany intensywności sygnału dla tłuszczu i wody w funkcji
czasu repetycji (TR), dla obrazowania T1 (po lewej) i w
funkcji czasu odczekania, dla obrazowania T2 (po prawej).
Wyniki obrazowania T1 i T2
Dla lewego wykresu zaznaczono literami A i B czasy repetycji dające odpowiednio
dobre kontrastowanie (różnica sygnałów) i jego brak.
Na prawym wykresie odwrotnie: A jest czasem odczekania, dla którego otrzymuje
się słaby kontrast, zaś dla B dobry
Powyższe rozważania można
uzupełnić o matematyczny opis
amplitudy sygnału S docierającego
z badanej tkanki do cewki odbiorczej.
Jej wartość jest funkcją stałych tkankowych T1, T2, i parametrów aparaturowych
TR, TE
S (1 e TR T1 )e TE T2
Gdy operator tomografu ustala wartość TR>>T1, wówczas S przestaje zależeć od T1, co
wynika z faktu iż
TR T
e
1
0
Podobnie, gdy TE<<T2, wtedy
W ten sposób, dobierając właściwe
czasy repetycji i odczekania można
zmieniać rodzaj stosowanego
kontrastowania.
e TE T2 1
a sygnał S praktycznie nie zależy od T2.
Ustawienie TR i TE tak, aby oba warunki zachodziły jednocześnie pozwala na
uzyskanie obrazu zależnego tylko od koncentracji protonów.
12
2015-06-04
Przykładowe obrazy kolana zarejestrowane dla sekwencji
protonowej (PD), ważone T1, ważone T2
Inny przykład zobrazowań T1, T2 oraz PD
Ten sam obraz mózgu
w kontrastach (od lewej) T1, T2 i PD
Jasność wybranych tkanek
organizmu ludzkiego na obrazach
NMR w kontrastowaniu T1 i T2
Tkanka
Substancja biała
Substancja szara
Płyn mózgowo-rdzeniowy
Stwardnienie rozsiane
Łagodny zawał
Guz
Oponiak
Ropień
Obrzęk
Zwapnienie
Jasność wybranych tkanek
organizmu ludzkiego na obrazach
NMR w kontrastowaniu T1 i T2 – cd.
Prawidłowy
Zdegenerowany
Żółty
Czerwony
Włóknista
Szklista
Dysk międzykręgowy
Pośredni
Pośredni do ciemnego
Szpik kostny
Bardzo jasny
Pośredni
Chrząstka
Bardzo ciemny
Pośredni
Jasny
Ciemny
Umiarkowany do ciemnego
Umiarkowanie ciemny
Bardzo ciemny
Pośredni
Kontrastowanie z przewagą Kontrastowanie z przewagą
T1
T2
Mózg
Jasny
Umiarkowanie ciemny
Umiarkowanie ciemny
Umiarkowanie jasny
Bardzo ciemny
Bardzo jasny
Pośredni do ciemnego
Jasny
Ciemny
Jasny
Ciemny
Jasny
Pośredni
Pośredni
Ciemny
Jasny
Ciemny
Jasny
Zmienny: słabo widoczny,
Zmienny: słabo widoczny
ciemny albo jasny
albo ciemny
Jasność wybranych tkanek
organizmu ludzkiego na obrazach
NMR w kontrastowaniu T1 i T2 – cd.
Miąższ prawidłowy
Ogniska choroby
Naczyniak
Mięsień
Płuco
Trzustka
Śledziona
Kość korowa
Wątroba
Umiarkowanie jasny
Ciemny
Ciemny
Ciemny
Bardzo ciemny
Umiarkowanie jasny
Ciemny
Bardzo ciemny
Ciemny
Umiarkowanie jasny
Bardzo jasny
Ciemny
Bardzo ciemny
Ciemny
Umiarkowanie jasny
Bardzo ciemny
13
2015-06-04
W technice NMR szczególnie
dobrze daje się odwzorowywać
elementy systemu nerwowego
MRI jest jedną z najlepszych
technik obrazowania kręgosłupa
Narządy jamy brzusznej
obrazowane za pomocą MRI
Wizualizacja MRI wnętrza klatki piersiowej
Wizualizacja MRI kości nadgarstka
Staw kolanowy przedstawiony w wizualizacji MRI
14
2015-06-04
Obrazowanie MRI pozwala obecnie przedstawiać narządy
całego ciała
Przykłady
diagnostycznych
obrazów NMR
Do usuwania skutków „kręcenie się”
pacjenta stosuje się program „Propeller”
Pewien problem wiąże się
z faktem, że badanie trwa dość
długo (pół godziny lub więcej)
i pacjent w tym czasie może się
poruszać, a to powoduje, że
uzyskiwane obrazy są nieostre.
Lepsze obrazy uzyskuje się przy
większych natężeniach pola (~3T)
Obrazowanie wielkości przepływu krwi
przez poszczególne rejony mózgu
na podstawie obrazu T 2 NMR
15
2015-06-04
Obrazy pokazujące perfuzję krwi w mózgu można konstruować
opierając się na różnych metodach kodowania pomierzonych
parametrów za pomocą sztucznie dobranych kolorów
Angiografia oparta na MRI
Tętnice mózgowe uwidocznione
w obrazie MRI
Rekonstrukcja danych MRI
w postaci obrazu 3D
Porównanie
MR i CT
pod względem
źródeł błędów
zobrazowania
Teraz trochę szczegółów
technicznych
16
2015-06-04
Identyfikacja płaszczyzny przekroju
W tomografie magnetyczno-rezonansowym, w którym znajduje się badany
pacjent, istnieje w przybliżeniu jednorodne pole magnetyczne B0.
Po podaniu wzbudzającego impulsu o częstości Larmora
Gdyby jednak przyłożone pole magnetyczne nie było stale
równe B0, ale zmieniało się liniowo wzdłuż osi Z, od
wartości np. B0–B do B0+B, wówczas częstość Larmora
także byłaby liniowo zależna od Z
0 B0
dobranej dla atomu wodoru (czyli dla stałej jądra wodoru 1H), wszystkie jądra tego
pierwiastka ulegną zjawisku rezonansu magnetycznego.
Wówczas warunek rezonansu byłby spełniony tylko dla pewnej współrzędnej Z = Z R,
w której 0 = B(ZR) równa jest częstości wzbudzającego impulsu.
Inaczej mówiąc wzbudzeniu uległaby tylko warstwa o określonej współrzędnej Z R
Sposób przyłożenia gradientu pola
W tomografach NMR istnieją tzw. cewki
gradientowe wywołujące opisany efekt
liniowego spadku pola magnetycznego
wzdłuż osi Z, a wartość gradientu pola jest
parametrem aparaturowym pozwalającym
na sterowanie grubością warstwy, z której
zbierany jest sygnał.
Stosowane w tomografach NMR gradienty
są najczęściej rzędu 1-5 mT/m, co oznacza,
że na 1 m długości komory, w której
spoczywa pacjent zmiana pola B jest rzędu
1-5 mT.
Zasada doboru warstwy do
obrazowania na osi z
Sposób identyfikacji przekroju
17
2015-06-04
Identyfikacja punktów na
płaszczyźnie przekroju
Mając daną płaszczyznę przekroju o ustalonym Z,
pozostaje jeszcze odpowiedzieć na pytanie: jaki sygnał
płynie z punktu o współrzędnych (X,Y) tego przekroju.
Aby to osiągnąć wykorzystuje się opisany już efekt
gradientu pola B0, tyle, że nie w kierunku osi Z
(teraz Z jest już ustalone i nie zmienia się),
ale najpierw w kierunku Y, a potem, w kierunku X.
Prosta sekwencja impulsów pozwalającą zarejestrować
obraz wybranej warstwy w płaszczyźnie xy
Zbieranie danych potrzebnych do odtworzenia
obrazu w płaszczyźnie XY, polega na
wielokrotnym powtórzeniu trójetapowego
eksperymentu „pojedynczego”:
1.
Zadanie impulsu wzbudzającego określoną
warstwę Z (omówione w poprzednim punkcie)
2.
Włączenie na ustalony czas t1 gradientu pola
w kierunku Y
3.
Po czasie t1, wyłączenie gradientu pola w kierunku
Y i włączenie gradientu pola w kierunku X. W tym
stanie przeprowadzany jest próbkowany odczyt
sygnału po zmieniającym się ze stałym krokiem,
czasie t2.
Po etapie 1 magnetyzacje poszczególnych tkanek precesują w
płaszczyźnie XY, w zgodnych fazach i z jednakowymi
częstościami.
W etapie 2 zostaje włączony gradient pola
w kierunku Y: będzie ono zmieniać się wzdłuż Y od B0–B do
B0+B. W kierunku X jest ono stałe.
Na mocy równania 0 = B0 w „paskach” znajdujących się
powyżej Y dla których pole zmniejszy się, częstości precesji
zmaleją, natomiast w tych, dla których pole wzrośnie, precesja
„przyspieszy”.
Ta różnica częstości precesji wektorów
magnetyzacji w poszczególnych paskach
spowoduje, że powstaną między nimi
przesunięcia w fazie:
Magnetyzacje w słabszym polu (zatem o
mniejszych prędkościach) pozostaną w tyle, te
zaś, które znajdują się w polu silniejszym
przyspieszą.
W pasku o współrzędnej Y, dla której pole nie
zmieniło się, częstość precesji też nie ulega
zmianie. Ten etap nazywany jest etapem
kodowania fazowego.
Po czasie t1 przechodzimy do etapu 3, w którym następuje
przełączenie gradientu z kierunku Y na kierunek X.
Jego zmiana spowoduje kolejne zróżnicowanie
częstości precesji, tym razem w poszczególnych
„wierszach” (w chwili zakończenia etapu 2,
w każdym wierszu częstość jest jednakowa.
Podobnie jak dla wierszy w etapie kodowania
fazowego, teraz każda kolumna o grubości X
będzie się znajdowała w innym polu B (zmiennym
liniowo wraz z X), a więc i częstości precesji
w każdej z nich będą różne.
Należy zauważyć, iż następujące po etapie 2 przełączenie gradientu z Y na X
w etapie 3, powoduje „nałożenie” się na siebie różnic w częstościach precesji.
W ten sposób „zakodowana” zostaje niejako historia eksperymentu
pojedynczego.
Po ustalonym czasie t2 zmieniającym się od np. 510-7 s do
1,2810-4 s, co 510-7 s (256 pomiarów), dokonujemy pomiaru
sygnału.
Etapy 1-3 powtarzamy ze zmieniającym się czasem t1, przy czym
zmiany następują w tych samych granicach i z takim samym
krokiem, jak dla czasu t2 w etapie 3, otrzymując łącznie 256256
pomiarów.
Jak można łatwo zauważyć z każdym elementem (X,Y)
płaszczyzny obrazowania skojarzona jest prędkość 1
„odziedziczona” przez wiersz Y w etapie 2 i prędkość 2 kolumny
X z etapu 3.
To skojarzenie jest jednoznaczne: mając sygnał dla elementu
(1,2) mamy go dla punktu (X,Y).
Ostatnią rzeczą jest więc obliczenie sygnału S( 1,2) (czyli de
facto S(X,Y)).
Wyliczenie to można zrobić biorąc dwuwymiarową dyskretną
transformatę Fouriera sygnału S(t1,t2) mierzonego w dziedzinie
czasu dla różnych t1 i t2 (są one zmieniane w porządku
omówionym powyżej).
18
2015-06-04
Zauważmy, że im więcej pomiarów dla t1 i
t2, tym więcej punktów (X,Y), w których
obliczany jest sygnał, a zatem teoretycznie
większa rozdzielczość.
Górnym ograniczeniem jest tu jednak
rozmiar elementu objętości.
Gdy jest on zbyt mały, wtedy za słaby jest
sygnał (generowany przez magnetyzację
tego elementu), który mamy rejestrować.
Proces uzyskiwania bitmapy B obrazującej
badaną tkankę, na podstawie zmierzonego
sygnału S, można schematycznie przedstawić
w postaci ciągu operacji:
FFT
Grad
Dla danego przekroju Z=const. potrafimy obliczyć sygnał S(X,Y),
pochodzący z punktu (X,Y) tkanki, a dokładniej
z określonego elementu objętości XYZ zlokalizowanego w
punkcie (X,Y) i zwanego wokselem.
Rozmiar woksela jest zdeterminowany ilością próbkowań
w etapie 3 i ilością zastosowanych czasów t1 przyłożenia
gradientu w kierunku Y.
Jeśli z wielkością S(X,Y) skojarzymy jasność piksela, wówczas
S(X,Y) po ewentualnej normalizacji możemy interpretować jako
funkcję definiującą bitmapę będącą wizualizacją badanego
przekroju.
Piksel o współrzędnych (X,Y) ma jasność S(X,Y). Rozdzielczość
obrazka uzyskanego dla podanych wyżej, przykładowych
zakresów czasów t1 i t2, wynosi
256256 pikseli.
Schemat blokowy układu do obrazowania
magnetyczno-rezonansowego
Norm
S (t1 , t2 ) S (1 , 2 ) S ( X ,Y ) B( X ,Y )
gdzie:
–FFT oznacza dyskretna transformatę Fouriera;
–Grad jest procesem mapowania częstości precesji
(1, 2) na współrzędne (X,Y), w oparciu o
znajomość gradientów zastosowanych w etapach
2 i 3 eksperymentu pojedynczego;
–Norm to normalizacja funkcji S do stosowanej
w bitmapie B skali jasności.
W porównaniu z konkurencyjnymi technikami (przede
wszystkim tomografią komputerową CT) obrazy MRI
charakteryzują się bardzo dobrą dyskryminacją tkanek
miękkich (możliwości obrazowania tkanek twardych są
bardzo ograniczone).
Swobodny jest wybór badanej płaszczyzny.
Przy zachowaniu odpowiednich środków ostrożności
przebywanie pacjenta w silnym polu magnetycznym nie
wywołuje skutków ubocznych.
Również fale radiowe wykorzystywane w badaniu nie
stanowią zagrożenia.
Jednym z nielicznych przeciwwskazań do badania jest
posiadanie przez pacjenta wszczepionego rozrusznika
serca.
Problemem mogą być również metalowe obiekty
wewnątrz ciała.
W porównaniu z tomografią komputerową gorsza
jest natomiast jakość uzyskiwanych obrazów
(rozdzielczość, stosunek sygnału do szumu,
obecność różnego typu artefaktów).
Jedną z głównych wad jest występowanie dystorsji
geometrycznych związanych z samym
urządzeniem, w szczególności z
niejednorodnością pola
magnetycznego wewnątrz magnesu głównego
19
2015-06-04
Oryginalny wynik badania MRI
ma postać zbioru „plasterków”
Odtwarzane komputerowo przekroje są
najczęściej stosowaną formą prezentacji
zobrazowania MRI
Rekonstrukcja obrazu MRI 3D z fragmentów
przekrojów biegnących w różnych kierunkach
Trójwymiarowe rekonstrukcje graficzne używane
dla prezentacji wyników badania MRI
Podniesienie przydatności diagnostycznej zobrazowań MRI
po podaniu kontrastu
Obrazy medyczne głowy tego samego
pacjenta, odpowiednio: CT i NMR
20
2015-06-04
Zbiór wybranych przekrojów MRI
głowy kobiety
Przykładowy obrazy NMR i ich
interpretacje
Pęknięty tętniak
Cysta
Krwiak
Guz mózgu
21
2015-06-04
Guz o innej lokalizacji
Jeszcze jeden guz
MRA - magnetic resonance angiography
Obrazowanie NMR
można polepszać
stosując magnetyczne środki
kontrastujące
Często zachodzi potrzeba uzupełniania informacji
zawartej w obrazie NMR (u góry) przez informacje
zawarte w obrazie CT (u dołu).
Jest to ułatwione, jeśli oba tomografy są
mechanicznie połączone
Problem polega jednak
wtedy na tym, że
niezależne
skanowanie ciała
pacjenta
w jednym drugim
tomografie daje
kolekcje przekrojów,
które trzeba do siebie
wzajemnie
dopasować.
22
2015-06-04
W takim tomografie trzeba dbać
o samopoczucie pacjenta, żeby
nie ulegał klaustrofobii
Przy dopasowywaniu wykorzystuje się technikę
histogramów dwuwymiarowych
Histogram przed dopasowaniem
Histogram po dopasowaniu
Parametry transformacji dla
optymalnego dopasowania zbiorów
Przykład fuzji obrazu CT i NMR
Cel, do jakiego zmierzamy, polega na znalezieniu
takich parametrów transformacji, które zapewniają
maksimum funkcji informacji wzajemnej
Wykres zależności informacji wzajemnej od 2 parametrów transformacji (Tx i Ry)
przy pozostałych 4 ustalonych w optimum
Przykłady dopasowanych par
23
2015-06-04
Pary dopasowane w przekrojach strzałkowych
Sprawdzenie jakości dopasowania poprzez
zastosowanie metody szachownicy
Sprawdzenie jakości dopasowania poprzez
nałożenie obrazów w pseudo-kolorach
Dopasowanie obrazów CT i NMR jest
niekiedy wręcz konieczne, ponieważ na
obrazie NMR widać lepiej zmianę
nowotworową, którą trzeba operować,
natomiast obraz CT (zwłaszcza czaszki
w ramie stereotaktycznej) daje
charakterystyczne punkty odniesienia,
w nawiązaniu do których możliwa jest
precyzyjna nawigacja narzędzia
neurochirurgicznego.
Złożenie kilku
zobrazowań typu
NMR w celu
zaplanowania
operacji
neurochirurgicznej
Dopasowywane obrazy
Wynik dopasowania i nałożenia
dopasowanych obrazów
24
2015-06-04
NMR stosuje się do wszystkich
narządów ciała
Przykładowy obraz naczyń
krwionośnych, uzyskany metodą MRI
(tu elementy szkieletu)
Obraz tomografii NMR
narządów jamy brzusznej
Rekonstrukcja danych MRI
w postaci obrazu 3D
Badanie mózgu metodą fMRI
Efekt badania fMRI
fMRI (Functional Magnetic Resonance Imaging) jest nową techniką obrazowania
bardziej lub mniej aktywnych obszarów tkanki nerwowej
25
2015-06-04
Obrazy fMRI pokazujące w sposób zależny od czasu
(kolejne obrazy dotyczą kolejnych chwil czasu)
zmienność aktywności wybranych struktur mózgu
Technika fMRI wykorzystuje magnetyczny
rezonans jądrowy do wydzielanie aktywnych
obszarów w mózgu
Żartobliwe porównanie MRI z fMRI
Obraz fMRI jest mniej dokładny od obrazu MRI
uzyskanego podczas skanowania strukturalnego,
ale pokazuje funkcje
Przykładowe parametry badania
fMRI
Typowa sekwencja aktywności
i spoczynku w badaniu fMRI
Badanie funkcjonalne przeprowadzono w projekcji poprzecznej
wykorzystując sekwencję EPI przy następujących parametrach:
TR 3000,0 ms, TE 60,0 ms, FA 90, FOV 24x24 cm, NEX 1.
stymulacja
Ustalono 50 skanów każdej z warstw i minimalne opóźnienie przy
akwizycji danych.
spoczynek
Uwaga: sekwencja EPI (ang. echo-planar imaging) umożliwia
rejestrację zmiany aktywności mózgu podczas wykonywania
określonego zadania przez pacjenta.
30
60
90
120
150
[s]
26
2015-06-04
Opis przeprowadzonego badania w standardzie
DICOM
Określenie progu istotności w badaniu fMRI
Wynik analizy obrazów mózgu badanej pacjentki wykonanych
podczas poruszania palcami lewej kończyny górnej
Wynik analizy obrazów mózgu badanej pacjentki wykonanych
podczas poruszania palcami lewej kończyny dolnej
Obraz przedstawiający aktywność neuronalną oraz
guz obrysowany zieloną linią
Przekrój nr 11 mózgu pacjentki z oznaczonym kolorem żółtym
obszarem aktywności ruchowej kończyny górnej lewej oraz
kolorem zielonym – obszarem aktywności kory przedczołowej
27
2015-06-04
Obrazy z zaznaczonym
artefaktem spowodowanym
obecnością metalowego klipsa
Przykładowe wyniki
Obraz mózgu uzyskiwany metodą fMRI
w zadaniu pamięciowym
28