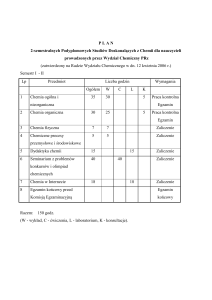
Wykład 3: Atomy wieloelektronowe
Funkcje falowe
Kolejność zapełniania orbitali
Energia elektronów
Konfiguracja elektronowa
Reguła Hunda i zakaz Pauliego
Efektywna liczba atomowa
Reguły Slatera
Wydział Chemii UJ
Chemia ogólna - wykład 3/1
dr hab. W. Makowski
Funkcje falowe dla atomów wieloelektronowych
– w równaniu Schrödingera należy uwzględnić wzajemne
odpychanie elektronów
– rozwiązaniem równania Schrödingera jest wieloelektronowa
funkcja falowa (określona dla współrzędnych wszystkich
elektronów)
np. dla He
Ĥ Êk 1 V1 Êk 2 V2 V12
Ψ(x1 , y1 , z1 , x2 , y2 , z2 )
Przybliżenie jednoelektronowe:
Funkcję wieloelektronową można przedstawić za pomocą funkcji
jednoelektronowych, podobnych do orbitali dla atomu wodoru
Konfiguracja elektronowa:
Przypisanie elektronów do poszczególnych orbitali
(jednoelektronowych funkcji falowych)
Wydział Chemii UJ
Chemia ogólna - wykład 3/2
dr hab. W. Makowski
1
Kolejność zapełniania orbitali atomowych
• zgodnie ze wzrostem energii
1
2
3
4
5
6
7
s
s
s
s
s
s
s
p
p
p
p
p
p
d
d
d
d
d
f
f
f
f
• z zachowaniem zakazu Pauliego i reguły Hunda
Wydział Chemii UJ
Chemia ogólna - wykład 3/3
dr hab. W. Makowski
Energia elektronów
Degeneracja
– istnienie różnych stanów kwantowych o takiej samej energii
np. w atomie H
dla n = 2
4 orbitale (2s, 2p-1, 2p0 2p1)
mają taką samą energię
Dla atomów
wieloelektronowych
obserwuje się zmniejszenie
degeneracji
poziomów elektronowych
- energia elektronów zależy
od liczb kwantowych n i l
Wydział Chemii UJ
Chemia ogólna - wykład 3/4
dr hab. W. Makowski
2
Zakaz Pauliego i reguła Hunda
Zakaz Pauliego
W atomie nie mogą występować elektrony, które nie różnią się
przynajmniej jedną liczbą kwantową.
albo
Dowolny orbital może być obsadzony przez najwyżej dwa elektrony.
Reguła Hunda
Orbitale zdegenerowane przyporządkowywane są kolejnym elektronom
w taki sposób, by liczba elektronów niesparowanych w stanie
podstawowym była możliwie największa.
albo
Jeżeli w podpowłoce dostępnych jest kilka orbitali, elektrony najpierw
obsadzają niezajęte orbitale, zanim w jednym z orbitali utworzą parę.
Wydział Chemii UJ
Chemia ogólna - wykład 3/5
dr hab. W. Makowski
Konfiguracja elektronowa
Okres 2
Okres 1
s
Wydział Chemii UJ
Okres 3
s
s
p
p
Chemia ogólna - wykład 3/6
dr hab. W. Makowski
3
Konfiguracja elektronowa
Okres 4
s
d
d
p
Wydział Chemii UJ
Chemia ogólna - wykład 3/7
dr hab. W. Makowski
Bloki s, p, d i f w układzie okresowym
p
d
s
f
Wydział Chemii UJ
Chemia ogólna - wykład 3/8
dr hab. W. Makowski
4
Odstępstwa od kolejności zapełniania orbitali atomowych
24Cr
29Cu
[18Ar]3d54s1
[18Ar]3d104s1
42Mo
47Ag
[36Kr]4d55s1
[36Kr]4d105s1
26Fe
27Co
28Ni
[18Ar]3d64s2
[18Ar]3d74s2
[18Ar]3d84s2
44Ru
45Rh
46Pd
[36Kr]4d75s1
[36Kr]4d85s1
[36Kr]4d10
76Os
77Ir
78Pt
[54Xe]4f145d66s2
[54Xe]4f145d76s2
[54Xe]4f145d96s1
Wydział Chemii UJ
Chemia ogólna - wykład 3/9
dr hab. W. Makowski
Konfiguracja kationów metali przejściowych
- atomy z bloku d najpierw tracą elektrony walencyjne z orbitali s
[Mn]: [Ar]3d54s2
[Mn2+]: [Ar]3d5
[Fe]: [Ar]3d64s2
[Fe2+]: [Ar]3d6
[Fe3+]: [Ar]3d5
[Co]: [Ar]3d74s2
[Co2+]: [Ar]3d7
[Co3+]: [Ar]3d6
[Cu]: [Ar]3d104s1
[Cu+]: [Ar]3d10
[Cu2+]: [Ar]3d9
[Zn]: [Ar]3d104s2
[Zn2+]: [Ar]3d10
[Ag]: [Kr]4d105s1
[Ag+]: [Kr]4d10
Wydział Chemii UJ
Chemia ogólna - wykład 3/10
dr hab. W. Makowski
5
Ekranowanie jądra
elektrony znajdujące się
na wyższych powłokach
nie wpływają na
oddziaływanie z jądrem
elektrony znajdujące się
na niższych powłokach
zmniejszają przyciąganie
przez jądro
Wydział Chemii UJ
Chemia ogólna - wykład 3/11
dr hab. W. Makowski
Postulaty Slatera
1. Zachowujemy orbitale wodoropodobne
2. Uwzględniamy ekranowanie elektronów zewnętrznych
przez wewnętrzne
3. Wprowadzamy efektywną liczbę atomową Z*,
czyli efektywny ładunek jądra
4. Zachowujemy wzór na energię elektronu
E
Z m e
* 2
4
e
8 h 2 o2 n 2
Z* Z S
Wydział Chemii UJ
Chemia ogólna - wykład 3/12
S - stała ekranowania
obliczona na podstawie
reguł Slatera
dr hab. W. Makowski
6
Obliczanie stałej ekranowania
Wprowadzamy ugrupowania orbitali
(1s) (2s 2p) (3s 3p) (3d) (4s 4p) (4d) (4f) (5s 5p) (5d) (5f) itd
Wprowadzamy udziały elektronów w stałej ekranowania
dla (ns np)
dla (nd ) lub (nf)
0
elektrony z prawej strony
0,35
z tego samego
ugrupowania
znika ostatnie rozróżnienie
- dla wszystkich wcześniejszych
elektronów udział = 1,0
wyjątek 1s udział = 0,3
0,85
z ugrupowania (n-1)
1,0
z ugrupowania (n-2), (n-3),
itd.
Wydział Chemii UJ
Chemia ogólna - wykład 3/13
dr hab. W. Makowski
Reguły Slatera – przykład 1
Porównanie energii elektronów 3d i 4s w atomie Cu
[29Cu]: (1s)2 (2s2p)8 (3s3p)8 (3d)10 (4s)1
dla elektronu 4s
S = 18 x 0,85 + 10 x 1,0 = 25,3
Z* = 29 – 25,3 = 3,7
dla elektronu 3d
S = 9 x 0,35 + 8 x 1,0 + 8 x 1,0 + 2 x 1,0 = 21,15
Z* = 29 – 21,15 = 7,85
Wydział Chemii UJ
niższa energia!
Chemia ogólna - wykład 3/14
dr hab. W. Makowski
7
Reguły Slatera – przykład 2
Uzasadnienie konfiguracji elektronowej atomu K
[19K]: (1s)2 (2s2p)8 (3s3p)8 3d1
(1s)2 (2s2p)8 (3s3p)8 4s1
hipotetyczna
rzeczywista
dla elektronu 3d
Z* = 19 – 18 = 1
s = 18 x 1,0 = 18
dla elektronu 4s
s = 8 x 0,85 + 10 x 1,0 = 16,8
Z* = 19 – 16,8 = 2,2
niższa energia!
Wydział Chemii UJ
Chemia ogólna - wykład 3/15
dr hab. W. Makowski
8