1
ZEROWA ZASADA TERMODYNAMIKI
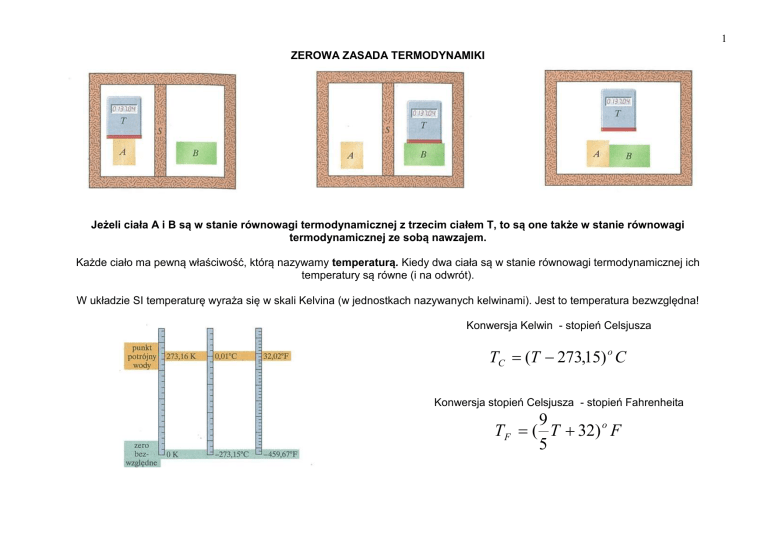
Jeżeli ciała A i B są w stanie równowagi termodynamicznej z trzecim ciałem T, to są one także w stanie równowagi
termodynamicznej ze sobą nawzajem.
Każde ciało ma pewną właściwość, którą nazywamy temperaturą. Kiedy dwa ciała są w stanie równowagi termodynamicznej ich
temperatury są równe (i na odwrót).
W układzie SI temperaturę wyraża się w skali Kelvina (w jednostkach nazywanych kelwinami). Jest to temperatura bezwzględna!
Konwersja Kelwin - stopień Celsjusza
TC (T 273,15) o C
Konwersja stopień Celsjusza - stopień Fahrenheita
9
TF ( T 32) o F
5
2
ROZSZERZALNOŚĆ CIEPLNA
Rozszerzalność liniowa
L LT
Substancja
Lód
Ołów
Stal
Szkło
Kwarc
[10-6/ºC]
51
29
11
9
0,5
Rozszerzalność objętościowa
V VT
3
3
Temperatura i ciepło
Ciepło jest energią przekazywaną między układem a jego otoczeniem na skutek istniejącej między nimi różnicy temperatury.
Zwyczajową jednostką ciepła jest kaloria - ilość ciepła potrzebna do podniesienia temperatury 1g wody od 14,5 do 15,5ºC
W układzie SI jednostką ciepła jest dżul
1 cal = 4,1860 J
Pochłanianie ciepła prze ciała stałe i ciecze
Pojemność cieplna:
C
Q
; Q
T
4
Ciepło właściwe:
c
Q
; Q
mT
c
J
kg K
Ciepło przemiany:
c przem
Q
; Q
m
c kgJ
przem
Przykład: Ile ciepła musi pobrać lód o masie m= 1000g i temperaturze -20ºC aby zamienił sie w wodę o temperaturze 20ºC
cw = 1cal/gK, cl = 0,5 cal/gK, cTop = 80 cal/g
PRACA W GAZACH
dW
W
VK
pdV
V0
5
PIERWSZA ZASADA TERMODYNAMIKI
Fakt doświadczalny: Q - W = const
We wszystkich powyższych procesach!!
U U K U 0 Q W
6
Zmiana energii wewnętrznej układu jest równa różnicy ciepła dostarczonego do układu i pracy wykonanej przez układ
dU dQ dW
Przypadki szczególne:
1. Przemiana adiabatyczna
U W
2. Przemiana izochoryczna (V = const)
U Q
3. Proces cykliczny
Q W
4. Rozprężanie swobodne
U 0
7
MECHANIZM PRZEKAZYWANIA CIEPŁA
1. Przewodnicwo cieplne
Strumień ciepła
Q
t
T
Pprzew kS
L
Pprzew
k - przewodność cieplna właściwa
Opór cieplny:
R
Pprzew
2. Konwekcja
3. Promieniowanie
Pprom ST 4
L
kS
8
KINETYCZNA TEORIA GAZÓW
Kiedy rozpatrujemy układy cząsteczek posługujemy się wielkością próbki wyrażoną w molach. Mol jest miarą ilości substancji.
Jeden mol to liczba atomów (lub cząsteczek) odpowiadających liczbie atomów w próbce węgla (C12) o masie 12 g.
Liczba tych atomów (cząsteczek) jest równa liczbie Avogadra NA = 6,0210-12 mol-1.
Liczba moli substancji w próbce jest równa ilorazowi liczby cząstek N w próbce i liczby Avogadra.
n
Masa jednego mola jest równa iloczynowi masy pojedynczej cząstki i liczby Avogadra.
Znając masę molową można wyznaczyć liczbę moli w próbce jeżeli znamy masę próbki.
n
9
Gazy doskonałe
Gaz doskonały – zwany gazem idealnym jest to abstrakcyjny, matematyczny model gazu, spełniający następujące warunki:
1.
2.
3.
4.
brak oddziaływań międzycząsteczkowych
objętość cząsteczek jest znikoma w stosunku do objętości gazu
zderzenia cząsteczek są doskonale sprężyste
cząsteczki znajdują się w ciągłym chaotycznym ruchu
W praktyce gazy rzeczywiste zachowują się w przybliżeniu jak gaz doskonały pod dostatecznie niskim ciśnieniem, czyli kiedy ich gęstość
jest dostatecznie mała
Parametry stanu gazu doskonałego powiązane są wzajemnie równaniem stanu gazu doskonałego.
pV nRT
równanie stanu gazu doskonałego (Clapeyrona)
Symbol R oznacza pewną stałą, nazywaną stałą gazową - R 8,31 J / mol K
Równanie stanu gazu można również zapisać wykorzystując zamiast liczby moli liczbę cząsteczek gazu.
pV NkT
inna postać równania stanu gazu doskonałego
Oczywiście tożsamość tych równań wymaga aby:
Symbol k oznacza stałą Boltzmanna - k 1,38 1023 J / K
10
MOLEKULARNE ŹRÓDŁO CIŚNIENIA GAZU
Zmiana pędu cząstki przy zderzeniu ze ścianką
naczynia:
pX
szybkość przekazu pędu:
p X
t
Ciśnienie wywierane na ściankę naczynia
p
Dla dowolnej cząstki v 2
11
ale z uwagi na olbrzymia liczbę cząstek gazu, które poruszają się w przypadkowych kierunkach można przyjąć że średnie wartości
1
kwadratów składowych prędkości są sobie równe a więc: v x2 v 2
3
czyli ostatecznie ciśnienie możemy zapisać w postaci :
często dla wyrażenia
v
2
śr
wprowadza się oznaczenie vśr.kw. - nazywa się je prędkością średnią kwadratową.
Wtedy zależność opisując ciśnienie przyjmie postać: p
n vśr2 .kw
3V
Korzystając z równania Clapeyrona możemy wyznaczyć prędkość średnią kwadratową:
vśr.kw.
3RT
prędkość średnia kwadratowa
Energia kinetyczna ruchu cząstek
W dowolnej chwili czasu energia kinetyczna cząstki ma postać:
Dla własności gazu złożonego z ogromnej liczby cząstek istotne znaczenie ma średnia energia cząstek.
12
EK
Średnia energia kinetyczna
Ek .śr .
3
kT
2
W danej temperaturze T wszystkie cząsteczki gazu doskonałego – niezależnie od swojej masy – mają taką sama energie kinetyczną ruchu
postępowego, równą 3/2 kT. Mierząc temperaturę gazu wyznaczamy jednocześnie średnią energię kinetyczną ruchu postępowego jego
cząsteczek.
Średnia droga swobodna
Poruszająca się cząsteczka gazu zderza się wzdłuż swojego toru z innymi cząstkami.
Próba pełnego opisu takiego ruchu jest w praktyce skazana na niepowodzenie.
Ruch cząstek gazu opisuje się na ogół jedynie statystycznie, jednym z użytecznych parametrów
takiego opisu jest średnia droga swobodna .
13
Parametr zgodnie ze swoją nazwą mówi nam jaką drogę pokonuje cząstka średnio między kolejnymi zderzeniami.
Spróbujmy wyznaczyć ten parametr przyjmując pewne
założenia:
1. pewna wybrana cząstka porusza się z prędkośćią v
a pozostałe cząstki pozostają w spoczynku
2. cząstki są kulami o średnicy d – zderzenie nastąpi
jeżeli odległość między środkami dwu cząstek
wyniesie d.
= (droga cząstki w czasie t)/(liczba zderzeń w czasie t)
W rzeczywistości ponieważ wszystkie cząstki się poruszają co powoduje że zależność ta wymaga ilościowej modyfikacji.
1
2 d 2 N / V
średnia droga swobodna
14
Rozkład prędkości cząstek
Jako miarę prędkości cząstek gazu w określonej temperaturze przyjęliśmy wcześniej prędkość średnią kwadratową. Jest to jednak pewna
konkretna wartość nie mówiąca nic o tym jaka część cząstek ma prędkość większą, a jaka mniejszą od tej konkretnie prędkości.
Aby w pełni scharakteryzować prędkości cząsteczek w gazie można wykorzystać funkcję rozkładu prawdopodobieństwa określającą jakie
jest prawdopodobieństwo znalezienia cząstki z pewnego określonego przedziału prędkości.
Ponieważ prawdopodobieństwo tego że cząstka ma jakąkolwiek prędkość z przedziału 0, jest dokładnie równe jedności można zapisać.
Pvdv 1
0
Aby policzyć ułamek cząstek zawartych w przedziale prędkości v1,v2 trzeba wyznaczyć wartość całki
V2
Pv dv
V1
15
Rozkład prędkości cząsteczek
gazu po raz pierwszy wyznaczył
James Clark Maxwell, wyraża
się on wzorem:
Pv 4
2 RT
3/ 2
v 2e v
2
/ 2 RT
Znając rozkład prędkości cząsteczek gazu możemy wyznaczyć:
1. Średnią prędkość cząsteczek gazu
Jeżeli znana jest funkcja rozkładu prawdopodobieństwa f(x) dla pewnej zmiennej x to aby policzyć wartość średnią tej zmiennej musimy
wyznaczyć wartość wyrażenia:
x x f x dx
D
W przypadku średniej prędkości otrzymamy:
v
vśr
8RT
średnia prędkość cząsteczek gazu
16
2. Prędkość średnią kwadratową
v2
vśr.kw.
3RT
średnia prędkość kwadratowa
3. Prędkość najbardziej prawdopodobną
Jest to prędkość dla której funkcja rozkładu prawdopodobieństwa osiąga wartość maksymalną.
Można ją wyznaczyć korzystając z warunku że w maksimum funkcji jej pochodna osiąga wartość maksymalną.
dP
0
dv
vp
2 RT
prędkość najbardziej prawdopodobna
17
Ciepło molowe gazów doskonałych
Energia wewnętrzna
Energia wewnętrzna gazu doskonałego jest po prostu sumą energii kinetycznych wszystkich jego cząstek związanych z ich ruchem
postępowym.
EW EKi
i
Zamiast liczyć tę sumę, możemy skorzystać ze średniej energii kinetycznej dla każdej z cząstek, wtedy:
EW NCZ EK
EW
3
nRT
2
energia wewnętrzna jednego mola gazu doskonałego
18
Molowe ciepło właściwe przy stałej objętości
Jeżeli nie zmienia się objętość gazu to nie wykonuje on żadnej pracy.
W 0
Zgodnie z pierwszą zasadą termodynamiki
Q
ale ogólnie ciepło przemiany możemy zapisać
Q
19
Ciepło molowe przy stałej objętości gazu
doskonałego
CV
3
R
2
Zmiana energii wewnętrznej gazu
doskonałego zamkniętego w zbiorniku
zależy tylko od zmiany temperatury gazu,
nie zależy natomiast od typu procesu w
którym nastąpiła zmiana temperatury
EW nCV T
Molowe ciepło właściwe przy stałym ciśnieniu
W dW
VK
p(v)dv
VP
20
W warunkach stałego ciśnienia:
W pV
ale
pV nRT
Praca wykonana przez gaz podczas rozprężania pod stałym ciśnieniem
(izobarycznie)
W nRT
Ogólnie ciepło tej przemiany możemy zapisać w postaci:
Q
ale zgodnie I zasadą termodynamiki
Wynika z tego następująca zależność:
CP CV R
21
Molowe ciepła właściwe gazów wieloatomowych – stopnie swobody
f = 3 (x,y,z)
f=5
f=6
Zasada ekwipartycji energii - Każdy rodzaj cząstek charakteryzuje pewna liczba stopni swobody f , które dają cząsteczce niezależne
1
1
sposoby magazynowania energii. Na każdy stopień swobody przypada średnio energia równa kT na cząsteczkę (lub RT w przeliczeniu
2
2
na mol)
Uogólniając można zapisać ciepło molowe przy stałej objętości dla gazów jedno-, dwu- i wieloatomowych w postaci
f
CV R
2
22
Ciepło molowe gazów rzeczywistych
Zależność ciepła molowego
od temperatury dla
dwuatomowego wodoru
PRZEMIANA ADIABTYCZNA
23
pV const;
p1V1 p2V2
CP CV
1
TV 1 const ; T1V1
Wyprowadzenie:
T2V2
1
24
ENTROPIA
Przemiana nieodwracalna w układzie zamkniętym powoduje zawsze w układzie zamkniętym wzrost entropii układu - NIGDY jej spadek
Entropię można charakteryzować na dwa sposoby:
1) poprzez ilość dostarczonego ciepła i temperaturę w jakiej było ono dostarczane - ściśle rzecz biorąc charakteryzujemy wtedy zmiany
entropii.
2) poprzez wyznaczenie możliwych kombinacji ułożenia atomów lub cząsteczek w układzie.
K
dQ
dt
P
S S K S P
25
Aby wyznaczyć zmianę entropii w przemianie nieodwracalnej zachodzącej w układzie zamkniętym należy zastąpić te przemianę dowolną
przemianą odwracalną o takim samym stanie początkowym i końcowym.
S S izoterm
26
ENTROPIA JAKO FUNKCJA STANU
dU dQ dW
S nR ln
VK
T
nCV ln K
VP
TP
DRUGA ZASADA TERMODYNAMIKI
W układzie zamkniętym ciepło może przepływać między elementami układu, nie może go jednak opuszczać ani być do niego dostarczane.
Dla układu gaz - rezerwuar ciepła
dQG dQR
Dla przemiany izotermicznej otrzymamy:
S 0
27
II ZT: Entropia układu zamkniętego wzrasta w przemianach nieodwracalnych i nie zmienia się w przemianach odwracalnych. ENTROPIA
NIGDY NIE MALEJE.
S 0
SILNIK CARNOTA
W silniku idealnym wszystkie procesy są odwracalne i nie ma strat spowodowanych turbulencją czy tarciem.
28
Praca w jednym cyklu
E Q W W
S SG SZ
SPRAWNOŚĆ SILNIKA CARNOTA:
W
energia uzyskana
energia dostarczona QG
C
C
TG TZ
- sprawność silnika Carnota
TG
Nie jest możliwy żaden ciąg przemian, którego jedynym skutkiem byłoby pobranie
ciepła i całkowita zamiana go w pracę.
Nie jest możliwe skonstruowanie perpetuum mobile drugiego rodzaju
29
SILNIK STIRLINGA
Silnik Stirlinga – silnik cieplny, który przetwarza energię cieplną w energię mechaniczną, jednak bez
procesu wewnętrznego spalania paliwa, a
na skutek dostarczania ciepła z zewnątrz,
dzięki czemu możliwe jest zasilanie go
ciepłem z dowolnego źródła. Źródłem ciepła
może być w szczególności proces spalania
jakiegoś paliwa, ale nie jest to konieczne.
SILNIKI SPALINOWE
DIESEL
OTTO
30
CHŁODZIARKI
W idealnej chłodziarce wszystkie procesy są odwracalne i nie ma rozpraszania energii.
K
energia odebrana
- współczynnik wydajność chłodziarki
energia dostarczon a
Dla chłodziarki Carnota
KC
KC
S
QZ
TZ
TZ
TG TZ
QG
TG
Gdyby tyle samo ciepła pobierać co oddawać to
S
Ale entropia nie może maleć !!!
Nie można przeprowadzić ciągu procesów, którego jedynym rezultatem jest oddanie energii w postaci ciepła przez ciało chłodniejsze ciału
cieplejszemu (IIZT)
31
SPRAWNOŚĆ SILNIKÓW RZECZYWISTYCH
Załóżmy, że można skonstruować silnik o sprawności większej niż sprawność silnika Carnota.
X C
Można by go wykorzystać do napędu chłodziarki Carnota.
Z definicji sprawności:
W
QGX
W
QGC
Żaden silnik rzeczywisty nie może mieć sprawności większej niż silnik Carnota współpracujący ze zbiornikami cieplnymi o tych samych
temperaturach.
32
STATYSTYCZNE PODEJŚCIE DO ENTROPII
Wszystkie mikrostany są równoważne.
Całkowita liczba mikrostanów w układzie opisana jest zależnośćcią:
L
L N!
Różne konfiguracje NIE są równoważne ponieważ możne je
utworzyć z RÓŻNEJ liczby mikrostanów
KROTNOŚĆ KONFIGURACJI
Rozważmy 6 cząstek:
Konfiguracja
Symbol
n1
Liczba mikrostanów w danej konfiguracji
n2
Entropia [10-23 J/K]
33
Konfiguracja z największą liczbą mikrostanów jest konfiguracją
najbardziej prawdopodobną.
Prawdopodobieństwo bardzo szybko malej wraz ze wzrostem
nierównomierności podziału cząstek pomiędzy dwie części naczynia.
Wzór Boltzmanna na entropię:
S k ln W
Wyznaczenie W jest dość trudne - jest to ogromna liczba
Wygodnie jest skorzystać z przybliżonego wzoru na logarytm z silni:
ln N! N ln N N
- wzór Stirlinga












