WARUNKI RÓWNOWAGI UKŁADU
TERMODYNAMICZNEGO
Proces termodynamiczny zachodzi dopóty, dopóki układ nie
osiągnie stanu równowagi. W stanie równowagi odpowiedni
potencjał termodynamiczny układu osiąga minimum, podczas
gdy entropia układu i otoczenia osiąga maksimum.
W szczególności:
Kiedy entropia (S) i "zewnętrzne parametry" (np. objętość) zamkniętego
układu termodynamicznego są stałymi parametrami przemiany, energia
wewnętrzna (U) maleje i osiąga minimalną wartość w punkcie
równowagi. Wynika to z pierwszej i drugiej zasady termodynamiki i jest
nazwane zasadą minimum energii.
Kiedy temperatura (T) i zewnętrzne parametry zamkniętego układu
termodynamicznego są stałe, energia swobodna Helmholtza (F) maleje i
osiąga minimalną wartość w punkcie równowagi.
WARUNKI RÓWNOWAGI UKŁADU
TERMODYNAMICZNEGO
Kiedy
ciśnienie (p) i zewnętrzne parametry
zamkniętego układu termodynamicznego są stałe,
entalpia (H) maleje i osiąga minimalną wartość w
punkcie równowagi.
Kiedy temperatura (T), ciśnienie (p) i zewnętrzne
parametry zamkniętego układu
termodynamicznego są stałe, entalpia swobodna
Gibbsa (G ) maleje i osiąga minimalną wartość w
punkcie równowagi.
KONIEC WYKŁADU I
TEMPERATURA A ENERGIA CIAŁA
Przez układy termodynamiczne będziemy
rozumieć makroskopowe ciała, które mogą
wymieniać się energią zarówno między sobą jak
i również z ośrodkiem zewnętrznym, czyli
otoczeniem.
TEMPERATURA
Temperatura układu termodynamicznego
jest miarą ruchu cieplnego jego cząstek
(cząsteczek, atomów, jonów).
Jeżeli układ termodynamiczny pozostaje w
stanie równowagi, to średnia energia
kinetyczna ruchu cieplnego jego cząstek jest
wprost proporcjonalna do termodynamicznej
temperatury układu:
~
E kT
k – stała Boltzmana k = 1,38 10-23 , JK-1,
T - temperatura (bezwzględna) ciała.
ROZKŁAD PRĘDKOŚCI CZĄSTEK
W OBJĘTOŚCI V
Ilość cząstek uderzających
w ściankę S można wyliczyć jako:
n
S
dV
;
V
dV lS vtS;
N
6
Zmiana pędu n cząstek:
p n 2mv F t F
2mvn
t
F 2mvn
vN
2mv 2 N
P
2mvn
S
tS
n6V
6V
l
Po podstawieniu Ek = mv2/2 otrzymujemy
RÓWNANIE STANU GAZU DLA N CZĄSTEK
Po podstawieniu:
Otrzymamy:
I dalej po podstawieniach:
nm – liczba moli gazu;
lub
A- liczba Avogadro,
pV
nm R const
T
R - stała gazowa
ROZKŁAD ENERGII CZĄSTEK
Er
Pr C exp
kT
Er
r Pr 1 C r exp kT 1
E
exp r
1
kT
C
Pr
Er
Er
r exp kT
r exp kT
s k ln
ROZKŁAD ENERGII CZĄSTEK
OZIĘBIANIE WEWNĘTRZNE
Poprzez zmianę, w warunkach izentropowych, jednego
z termodynamicznych parametrów intensywnych:
ciśnienia,
natężenia pola magnetycznego
oraz utrzymanie wysokiego stopnia uporządkowania ciała przy
zmianie jego energii (patrz rys. rozkład energii cząstek)
s = k ln Ω = const
– oznacza to, że w procesie izentropowym nie zmienia się liczba
stanów, zmienia się natomiast ich szerokość – obniżeniu ulega
średnia energia ruchów cieplnych (patrz rys.)
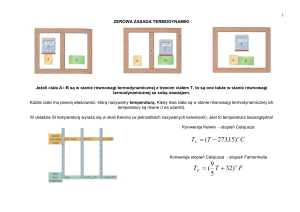
OZIĘBIANIE ZEWNĘTRZNE
Poprzez kontakt cieplny ciała o temperaturze
wyższej z ciałem o temperaturze niższej, a więc
o niższej energii ruchów cieplnych cząstek.
Na mocy zerowej zasady termodynamiki
nastąpi wtedy wyrównanie temperatur obu ciał i
przepływ ciepła od ciała o temperaturze wyższej
do ciała o temperaturze niższej.
Taki sposób obniżania temperatury ciała
nazwiemy oziębianiem zewnętrznym.
OZIĘBIANIE ZEWNĘTRZNE I WEWNĘTRZNE
KONIEC WYKŁADU II
UOGÓLNIONY PROCES OZIĘBIANIA
WEWNĘTRZNEGO CIAŁA
Obniżenie entropii ciała w procesie izotermicznym
jest możliwe tylko wtedy, gdy funkcja ta zależy od
dwóch parametrów: temperatury T oraz pewnego
parametru stanu X o charakterze uogólnionej siły.
S S (T , X )
W przypadku gazów parametr X jest ciśnieniem,
magnetyków - natężeniem pola magnetycznego,
dielektryków - natężeniem pola elektrycznego
UOGÓLNIONY PROCES OZIĘBIANIA
WEWNĘTRZNEGO CIAŁA
Uogólniona siła X musi być skojarzona z
przesunięciem Y, tak aby elementarna praca
wykonana nad ciałem wynosiła:
dW XdY
dW Fdr
UOGÓLNIONY PROCES OZIĘBIANIA
WEWNĘTRZNEGO CIAŁA
UOGÓLNIONY PROCES OZIĘBIANIA W UKŁADZIE
TS.
Y2
W XdY
Y1
Q TA ( S A S B )
dU TdS XdY
lub dH TdS YdX
gdzie H jest entalpią równą H U XY
S S (T , X )
S
S
dS dT dX 0
T X
X T
UOGÓLNIONY PROCES OZIĘBIANIA
Różniczkowy efekt
analizowanego procesu μs
jest równy:
gdzie cX jest ciepłem
właściwym ciała przy stałej
wartości parametru X
S
X T
S
s
S
X S
T X
cX
S
T X T
UOGÓLNIONY PROCES OZIĘBIANIA
Zatem otrzymujemy:
S
T
T
dX T
S
cX
dX S
Zauważmy, że aby μs było różne od zera
konieczne jest, aby przy temperaturze T entropia
S zależała od wielkości X.
UOGÓLNIONY PROCES OZIĘBIANIA
Pochodną
S
X T
wyznaczymy korzystając z różniczki entalpii
swobodnej F:
F = H − TS ,
stąd po zróżniczkowaniu otrzymujemy dF = −YdX − SdT
Korzystając z własności, że drugie pochodne są sobie
równe:
UOGÓLNIONY PROCES OZIĘBIANIA
Ostatecznie otrzymujemy ogólne wyrażenie
określające różniczkowy efekt obniżenia
temperatury w izentropowym procesie wykonania
pracy przez uogólnioną siłę X na uogólnionej
drodze Y:
Y
T
T X
dT
S
cX
dX S
WARUNKI POTRZEBNE DO OBNIŻENIA
TEMPERATURY
1.
Substancja dla której S = S(T, X)
2.
3.
4.
X ma charakter uogólnionej siły, np. ciśnienia lub natężenia pola
magnetycznego.
Obniżyć entropię w warunkach izotermicznych
Wykonać pracę z równoczesnym oddaniem ciepła do
otoczenia. (Przykładem takiego procesu jest izotermiczne
sprężenie gazu.)
WARUNKI POTRZEBNE DO OBNIŻENIA
TEMPERATURY
4.
Zrealizować przemianę, w której uogólniona siła wróci do swej
pierwotnej wartości, natomiast entropia ciała pozostanie
niska. W przemianie tej nastąpi obniżenie temperatury ciała z
tego powodu, że będzie miało miejsce jakościowe
przeobrażenie się entropii ciała. Obniżeniu ulegnie ta jej
część, która jest związana z temperaturą, wzrośnie natomiast
część określona przez uogólnioną siłę X.
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ.
Adiabatyczne i izentropowe rozprężenie gazu jest możliwe pod
warunkiem, że w gazie nie mają miejsca zjawiska
nieodwracalne, np. wewnętrznego tarcia.
Aby spełnić warunek s = const należy całą osiągalną energię
sprężonego gazu odebrać w postaci pracy zewnętrznej.
Praca musi zostać w całości wykonana nad obiektem
odizolowanym termodynamicznie od rozprężanego gazu.
W efekcie następują największe z możliwych spadki energii
wewnętrznej gazu oraz jego entalpii.
Spadek temperatury jest maksymalny i większy niż
obserwowany w innych procesach.
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ.
h1 2 '
h1 2
współczynnik sprawności
w (u1 p1v1 ) (u 2 p2 v2 ) h1 h2
w zewnętrzna praca użyteczna
u1 energia wewn. gazu na wlocie
p1 v1 praca napełniani a
u 2 energia wewn. gazu na wylocie
p2 v2 praca opróżniania
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ.
Spadek temperatury gazu w procesie
izentropowego rozprężania może zostać
wyznaczony przez wyrażenie entropii jako funkcji
ciśnienia i temperatury S = S(p,T ), a następnie
przyrównanie do zera jej różniczki zupełnej.
S
S
dS
dT dp 0
T p
p T
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ.
Po przekształceniach otrzymujemy:
dT
s
dp S
S
p T
S
T p
S
v
Po podstawien iu :
oraz
T p
p T
v
T
dT
T p Tv
Otrzymujemy : s
,
cp
cp
dp S
cp
S
T p T
1 v
v T p
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ.
Z równania wynika, że zarówno dla gazu doskonałego
jak i dla gazów rzeczywistych współczynnik μs ma
wartość dodatnią, co oznacza, że spadkowi ciśnienia
gazu w procesie izentropowego rozprężania zawsze
towarzyszy spadek temperatury.
dT
s
dp S
v
T
T p Tv
cp
cp
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ
Po podstawieniu do powyższego równania - równania
stanu gazu doskonałego otrzymuje się:
dT
1 T
s
p
dp S
po scałkowaniu :
T2 p2
T1 p1
1
ROZPRĘŻANIE IZENTROPOWE Z WYKONANIEM
PRACY ZEWNĘTRZNEJ
Schemat rozprężarki
tłokowej:
1- uszczelnienie, 2 tłok, 3 - cylinder, 4 –
zawory, 5 - popychacz
zaworów, 6 - układ
sterowania zaworami, 7
- mechanizm korbowy, 8
- hamulec (układ
pochłaniający energię
mechaniczną)
KONIEC WYKŁADU III
METODY UZYSKIWANIA NISKICH TEMPERATUR
DŁAWIENIE IZENTALPOWE
Dławienie – proces w którym gaz rozpręża się
adiabatycznie w układzie otwartym, bez
wykonania pracy zewnętrznej oraz bez zmiany
prędkości ani istotnej zmiany wysokości.
Dławienie gazu może odbywać się w trakcie
jego przepływu przez porowatą zatyczkę, dyszą,
kapilarę czy zawór dławiący.
DŁAWIENIE IZOENERGETYCZNE
DŁAWIENIE IZENTALPOWE
DŁAWIENIE IZENTALPOWE
Bilans energii układu otwartego możemy zapisać
gdzie: q - ciepło, h - entalpia, w - prędkość, z wysokość, l – praca
W procesie adiabatycznego dławienia zarówno
ciepło q jak i praca przemiany - l są równe zero, a
zmiany prędkości gazu w oraz jego położenia z są
pomijalne, więc:
PRZEBIEG PROCESU DŁAWIENIA NA WYKRESIE
T-S
dh = 0
DŁAWIENIE IZENTALPOWE
Po przekształceniu drugiej zasady termodynamiki
dh
ds
dh Tds vdp do postaci T v
dp T
dp T
i po podstawieniu równania M axwella
ds dv
dp T dT p
otrzymujemy :
dT
h
dp h
dv
T
v
dT p
cp
DŁAWIENIE IZENTALPOWE
Dla gazu idealnego z równania Clapeyrona:
pv RT
R v
p T
RT
v
p
R v
v
T p p T
Różniczkowy współczynnik dławienia
dT
h
dp h
dv
T
v T v v
dT p
T
0
cp
cp
DŁAWIENIE IZENTALPOWE
Taka wartość μh wynika z faktu, że między cząstkami
gazu idealnego nie występują siły wzajemnego
oddziaływania.
W procesie dławienia izentalpowego gaz nie wykonuje
pracy zewnętrznej.
Jeżeli między cząstkami gazu nie występują
oddziaływania, to zwiększenie średniej odległości
pomiędzy nimi nie wymaga wykonania pracy kosztem
energii cieplnej cząstek E ≈ kT , gdzie k jest stałą
Boltzmanna. W efekcie temperatura gazu T pozostaje
niezmieniona.
DŁAWIENIE IZENTALPOWE
Dla gazów rzeczywistych
istnieją oddziaływania
pomiędzy cząsteczkami
Energię potencjalną tych
oddziaływań opisuje
potencjał LennardaJonesa:
φ
φ
12 6
4 0
r
r
0,2 – 0,5 nm – średnica atomu gazu
0 - min energii potencjalnej
r – odległość pomiędzy molekułami
σ - odl. pomiędzy molekułami przy której równoważą się siły przyciągania i
odpychania