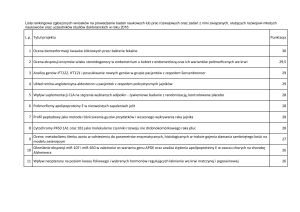
PRZEDMOWA ............................................................................................................................... 5
WSTĘP ......................................................................................................................................... 6
1. POJĘCIE GENU, MUTACJE GENOWE ......................................................................................... 12
1.1. BUDOWA GENU U PROCARYOTA I EUKARYOTA I WYNIKAJĄCE Z TEGO RÓŻNICE ..................................... 16
1.1.1. TRANSKRYPCJA ................................................................................................................................ 17
1.1.2. TRANSLACJA .................................................................................................................................... 18
1.2. MUTACJE ............................................................................................................................... 19
LITERATURA DO ROZDZIAŁU 1 ............................................................................................................ 20
ZADANIA DO ROZDZIAŁU 1 ................................................................................................................ 20
ODPOWIEDZI DO ZADAŃ .............................................................................................................................. 21
2. PODZIAŁY KOMÓRKOWE. CHROMOSOMY ............................................................................... 22
2.1. MITOZA ................................................................................................................................. 22
2.2. INFORMACJE O CHROMOSOMACH WYBRANYCH GATUNKÓW ............................................................... 26
2.2.1. BYDŁO DOMOWE BOS TAURUS 2N=60, XY........................................................................................... 26
2.2.2. OWCA DOMOWA OVIS ARIES 2N=54, XY ............................................................................................. 27
2.2.3. INNE PARZYSTOKOPYTNE ................................................................................................................... 29
2.2.4. KONIOWATE .................................................................................................................................... 29
2.2.5. ŚWINIA DOMOWA SUS SCROFA DOM. L. 2N=38, XY .............................................................................. 30
2.2.6. CHROMOSOMY PTAKÓW ................................................................................................................... 31
2.3. CHROMOSOMY PŁCI .................................................................................................................. 32
2.4 CHROMOSOMY AKTYWNE TRANSKRYPCYJNIE ................................................................................... 36
2.4.1. CHROMOSOMY POLITENICZNE ............................................................................................................ 36
2.4.2. CHROMOSOMY SZCZOTECZKOWE ........................................................................................................ 37
2.5. PODSTAWOWE METODY BARWIENIA CHROMOSOMÓW...................................................................... 38
2.5.1. BARWIENIE KONWENCJONALNE .......................................................................................................... 38
2.5.2. BARWIENIA RÓŻNICUJĄCE .................................................................................................................. 38
2.5.2.1. Prążki G ..................................................................................................................................... 39
2.5.2.2. Prążki R (metoda RBA) .............................................................................................................. 40
2.5.2.3. Prążki C (metoda CBG).............................................................................................................. 41
2.5.2.4. Oznaczanie rejonów jąderkotwórczych – NOR ........................................................................ 42
2.5.3. BARWIENIA FLUOROCHROMAMI ......................................................................................................... 43
2.5.3.1. Metoda FISH (Fluorescence In Situ Hybridyzation) .................................................................. 45
2.6. MEJOZA................................................................................................................................. 46
2.6.1. PROFAZA ........................................................................................................................................ 46
2.6.2. METAFAZA I .................................................................................................................................... 48
2.6.3. ANAFAZA I ...................................................................................................................................... 49
2.6.4. TELOFAZA I I POZOSTAŁE ETAPY MEJOZY ............................................................................................... 49
2.7. MUTACJE CHROMOSOMOWE ...................................................................................................... 50
2.7.1. DUPLIKACJE I DELECJE ....................................................................................................................... 51
2.7.2. INWERSJE........................................................................................................................................ 51
2.7.3. TRANSLOKACJE ................................................................................................................................ 51
2.8. MUTACJE GENOMOWE .............................................................................................................. 55
2.8.1. POLIPLOIDIE .................................................................................................................................... 55
2.8.2. ANEUPLOIDIE................................................................................................................................... 55
2.9. PRAWA MENDLA W ŚWIETLE ZASAD PODZIAŁU KOMÓRKI ................................................................... 58
1
2.9.1. ODSTĘPSTWA OD PRAW MENDLA ....................................................................................................... 59
LITERATURA DO ROZDZIAŁU 2 ............................................................................................................ 61
ZADANIA DO ROZDZIAŁU 2 ................................................................................................................ 64
3. DZIEDZICZENIE MENDLOWSKIE ............................................................................................... 65
3.1. WSPÓŁDZIAŁANIE ALLELICZNE...................................................................................................... 66
3.1.1. DOMINACJA CAŁKOWITA ................................................................................................................... 66
3.1.2. DOMINACJA NIEPEŁNA (DZIEDZICZENIE POŚREDNIE) ............................................................................... 70
3.1.3. KODOMINACJA ................................................................................................................................ 71
3.1.4. NADDOMINOWANIE ......................................................................................................................... 72
3.1.5. WSPÓŁDZIAŁANIE ADDYTYWNE ........................................................................................................... 72
3.1.6. PLEJOTROPIA ................................................................................................................................... 72
3.2. NIEZALEŻNE DZIEDZICZENIE CECH .................................................................................................. 73
3.2.1. TESTOWANIE HIPOTEZY O ZGODNOŚCI Z ROZKŁADEM TEORETYCZNYM ....................................................... 78
3.3. WSPÓŁDZIAŁANIE NIEALLELICZNE ........................................................................................................... 80
3.3.1. WSPÓŁDZIAŁANIE KOMPLEMENTARNE (DOPEŁNIAJĄCE) .......................................................................... 81
3.3.2. WSPÓŁDZIAŁANIE DOPEŁNIAJĄCE KUMULATYWNE.................................................................................. 83
3.3.3. EPISTAZA ........................................................................................................................................ 83
3.3.3.1. Epistaza dominująca ................................................................................................................. 84
3.3.3.2. Epistaza recesywna .................................................................................................................. 85
3.3.3.3. Epistaza podwójna recesywna ................................................................................................. 86
3.3.3.4. Epistaza podwójna dominująca................................................................................................ 87
3.3.3.5. Epistaza dominująca, niepełna, letalna .................................................................................... 88
3.3.3.6. Epistaza sprzężona z płcią ........................................................................................................ 88
3.3.4. ADDYTYWNE (SUMUJĄCE) DZIAŁANIE GENÓW ....................................................................................... 91
3.3.4.1. Geny modyfikujące (modyfikatory) .......................................................................................... 95
LITERATURA DO ROZDZIAŁU 3 ............................................................................................................ 97
ZADANIA DO ROZDZIAŁU 3 ................................................................................................................ 97
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 103
4. DZIEDZICZENIE I DETERMINACJA PŁCI .....................................................................................105
4.1. GENETYCZNE PODSTAWY DETERMINACJI PŁCI .................................................................................105
4.2. CECHY SPRZĘŻONE Z PŁCIĄ .........................................................................................................108
4.3. CECHY ZWIĄZANE Z PŁCIĄ I OGRANICZONE PŁCIĄ .............................................................................111
LITERATURA DO ROZDZIAŁU 4 ...........................................................................................................113
ZADANIA DO ROZDZIAŁU 4 ...............................................................................................................113
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 115
5. MARKERY GENETYCZNE W HODOWLI ZWIERZĄT I ALLELE WIELOKROTNE. ...............................117
5.1. WYBRANE PRZYKŁADY GRUP KRWI U ZWIERZĄT ..............................................................................118
5.2. PRZYKŁAD POLIMORFIZMU GRUP KRWI I BIAŁEK SUROWICY KRWI U KONI ..............................................120
5.3. SEKWENCJE MIKROSATELITARNE .................................................................................................122
5.4. UMASZCZENIE ZWIERZĄT...........................................................................................................124
5.5. PODSTAWOWE GENY WARUNKUJĄCE BARWĘ WŁOSA .......................................................................126
5.5.1. LOCUS TYRP1 (INACZEJ B) ............................................................................................................... 128
5.5.2. LOCUS NONAGOUTI (A) ................................................................................................................... 128
5.5.3. LOCUS E- EXTENSION ...................................................................................................................... 129
2
5.5.4. LOCUS D- DILUTION ........................................................................................................................ 130
5.5.5. LOCUS S (RECEPTOR ENDOTELINY TYPU B – EDNRBS) ............................................................................ 131
5.5.6. LOCUS W (DOMINANT WHITE SPOTTING) .......................................................................................... 131
5.6. SKUTKI MUTACJI W GENACH WARUNKUJĄCYCH UMASZCZENIE U ZWIERZĄT ............................................133
LITERATURA DO ROZDZIAŁU 5 ...........................................................................................................134
ZADANIA DO ROZDZIAŁU 5 ...............................................................................................................134
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 137
6. MAPOWANIE GENÓW ...........................................................................................................140
6.1. ZJAWISKO REKOMBINACJI..........................................................................................................140
6.2. SPRZĘŻENIE GENÓW .................................................................................................................141
6.3. METODY OBLICZANIA SPRZĘŻEŃ MIĘDZY GENAMI ............................................................................143
6.3.1. KRZYŻÓWKA DWUPUNKTOWA .......................................................................................................... 144
6.3.2. KRZYŻÓWKA TRZYPUNKTOWA........................................................................................................... 146
6.3.3. OKREŚLANIE SPRZĘŻEŃ METODĄ STATYSTYCZNĄ .................................................................................. 151
6.4. TWORZENIE MAP GENETYCZNYCH ................................................................................................154
LITERATURA DO ROZDZIAŁU 6 ...........................................................................................................155
ZADANIA DO ROZDZIAŁU 6 ...............................................................................................................155
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 158
7. WADY WRODZONE ................................................................................................................159
7.1. PODZIAŁ I PRZYCZYNY WAD WRODZONYCH ....................................................................................159
7.2. WADY WRODZONE UWARUNKOWANE MUTACJAMI GENÓW ..............................................................159
7.3. WADY SPOWODOWANE MUTACJAMI CHROMOSOMOWYMI ...............................................................162
7.4. ELIMINACJA WAD WRODZONYCH.................................................................................................164
7.4.1. TESTOWANIE NOSICIELSTWA GENÓW RECESYWNYCH ............................................................................ 165
7.4.2. DIAGNOSTYKA CYTOGENETYCZNA ...................................................................................................... 169
7.4.3. DIAGNOSTYKA MOLEKULARNA .......................................................................................................... 170
LITERATURA DO ROZDZIAŁU 7 ...........................................................................................................171
ZADANIA DO ROZDZIAŁU 7 ...............................................................................................................171
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 172
8. STRUKTURA GENETYCZNA POPULACJI ....................................................................................174
8.1. FREKWENCJA GENÓW I GENOTYPÓW ............................................................................................174
8.1. FREKWENCJA GENÓW I GENOTYPÓW– CECHY UWARUNKOWANE JEDNĄ PARĄ ALLELI ................................175
8.2. FREKWENCJA GENÓW I GENOTYPÓW- ALLELE WIELOKROTNE ..............................................................178
8.3. FREKWENCJA GENÓW I GENOTYPÓW- DWIE LUB WIĘCEJ CECH JEDNOCZEŚNIE .........................................181
8.4. FREKWENCJA GENÓW I GENOTYPÓW- CECHY SPRZĘŻONE Z PŁCIĄ .........................................................185
LITERATURA DO ROZDZIAŁU 8 ...........................................................................................................186
ZADANIA DO ROZDZIAŁU 8 ...............................................................................................................187
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 188
9. SPOKREWNIENIE I INBRED .....................................................................................................189
9.1. RODOWÓD ............................................................................................................................189
9.2. OBLICZANIE SPOKREWNIENIA I INBREDU ........................................................................................193
3
9.3. SPOKREWNIENIE W LINII PROSTEJ I W LINII BOCZNEJ .........................................................................195
9.3.1. SPOKREWNIENIE W LINII PROSTEJ ...................................................................................................... 195
9.3.2. SPOKREWNIENIE W LINII BOCZNEJ ..................................................................................................... 198
9.3.3. ŚREDNIE SPOKREWNIENIE W STADZIE ................................................................................................. 203
LITERATURA DO ROZDZIAŁU 9 ...........................................................................................................204
ZADANIA DO ROZDZIAŁU 9 ...............................................................................................................204
ODPOWIEDZI DO ZADAŃ ............................................................................................................................ 207
4
Przedmowa
Podręcznik jest przeznaczony zarówno dla studentów wszystkich kierunków studiów, na
których znajomość podstaw genetyki zwierząt jest konieczna jak i dla osób zainteresowanych
poznaniem zagadnień związanych z genetyką zwierząt.
Podręcznik jest podzielony na wstęp i dziewięć rozdziałów, z których każdy składa się z dwóch części:
obszernej części teoretycznej i części praktycznej (przykłady i zadania). Na zakończenie każdego
rozdziału prezentowanego Czytelnikom podręcznika, podano najważniejsze, zdaniem autorów,
pozycje piśmiennictwa z zakresu omawianych zagadnień. Autorzy skupili się w niniejszym
opracowaniu nie tylko na elementach podstaw genetyki klasycznej, ale przedstawili najbardziej
aktualne informacje dotyczące umaszczenia zwierząt, dziedziczenia grup krwi, a także chorób
genetycznych wad wrodzonych u zwierząt. Zamieścili także unikatowe informacje dotyczące
zagadnień cytogenetyki oraz mapowania genetycznego. Dwa ostatnie rozdziały zawierają
podstawowe informacje o rodowodach, spokrewnieniu i inbredzie, a także wstęp do genetyki
populacji.
Do napisania tego podręcznika i ostatecznego jego kształtu przyczyniło się nasze wieloletnie
doświadczenie w zakresie prowadzenia prac badawczych i dydaktyki. Doświadczenie to pozwoliło na
kompleksowe ujęcie i powiązanie teorii z praktyką
Autorzy
Pragniemy podziękować Panu Profesorowi Tadeuszowi Kalecie za recenzję podręcznika oraz
Panu Doktorowi habilitowanemu Mariuszowi Sacharczukowi, którego recenzja i cenne uwagi
wpłynęły na ostateczny kształt książki. Dziękujemy również wszystkim osobom wymienionym w
książce za udostępnienie zdjęć, które ubarwiły i wspomogły merytorycznie rozdział ”Podziały
komórkowe. Chromosomy”.
5
Wstęp
Autorki: Elżbieta Witrh-Dzięciołowska; Zuzanna Nowak
Genetyka jest nauką opisującą zjawisko dziedziczności i zmienności wszystkich organizmów
żywych. Zjawisko dziedziczności obserwowane przez wieki przez różnych badaczy zostało opisane w
sposób naukowy po przeprowadzeniu serii powtarzalnych doświadczeń oraz opublikowane w 1866
przez Grzegorza Mendla. Mimo, iż przez rok jeszcze od wydania tej publikacji wykładał on nauki
przyrodnicze w Szkole Technicznej w Brnie, jego prace do końca wieku nie zostały w żaden sposób
wyróżnione. Z początkiem XX wieku, sześć lat po śmierci Grzegorza Mendla trzech botaników:
Holender- Hugo de’Vries, Austriak- Erich Teschmark i Niemiec- Carl Correns powtórzyli jego
doświadczenia i potwierdzili opisane prawa dziedziczenia. Potwierdzenie praw opisanych przez
Mendla nadal nie przyniosło rezultatów na skalę światową, główną tego przyczyną było to, że
zarówno publikacja Grzegorza Mendla jak i kolejne doniesienia ukazały się w języku niemieckim.
Dopiero po przetłumaczeniu opisu eksperymentów na język angielski zainteresowali się nimi kolejni
naukowcy, którzy podchodząc niezwykle sceptycznie do prac Mendla w rezultacie odegrali ogromną
rolę w ich popularyzacji w świecie nauki. Byli nimi William Bateson i Thomas Morgan. Temu
pierwszemu zawdzięcza się przeprowadzenie eksperymentów potwierdzających prawa opisane przez
Mendla na zwierzętach oraz obecną nazwę dziedziny. Termin ten pochodzi od greckiego słowa
genetes– rodzic, zrodzony, a także ma związek z łacińskim słowem Genesis- narodzenie, pochodzenie.
Wiliam Bateson sformułował również takie pojęcia jak heterozygota, allelomorfy oraz sprecyzował
pojęcie czystości gamet. Do współczesnego brzmienia praw Mendla przyczynił się również duński
botanik Wilhelm Johannsen wprowadzając pojęcia, dziś tak oczywiste jak genotyp i fenotyp. Odkrycie
pracy Mendla stało się podstawą do rozpoczęcia wielu badań prowadzonych na roślinach i na
zwierzętach, w których zostały potwierdzone zaobserwowane wcześniej zasady dziedziczenia zgodne
z prawem czystości gamet (pierwsze prawo Mendla) oraz z prawem niezależnego dziedziczenia cech
(drugie prawo Mendla).
Jednak nie wszystkie wyniki badań wykazywały zgodność z prawami Mendla, bowiem już na
początku XX w. prace prowadzone nad dziedziczeniem zielonej barwy liści u dziwaczka
peruwiańskiego stanowiły wyjątek niepasujący do klasycznego rozkładu cechy w pokoleniu drugim.
Okazało się, że wyniki dziedziczenia zależne były od tego czy badaną cechę przekazywał potomstwu
organizm mateczny czy ojcowski. Odchylenie od zasad dziedziczenia dotyczyły zarówno pokolenia
pierwszego jak i drugiego. Wyniki tych badań dały się wyjaśnić dopiero po stwierdzeniu, że materiał
genetyczny w komórce eukariotycznej nie ogranicza się tylko do jądra, ale występuje także w
mitochondriach i chloroplastach. Badania te dały początek tzw. dziedziczeniu pozajądrowemu.
Przy wspominaniu o początkach nowej dziedziny nauki jaką była wówczas genetyka, należy
się też kilka słów Augustowi Weismannowi (1834-1914), który opracował koncepcję dziedziczenia
6
opartą na nośnikach chromosomowych, w których występują determinanty (geny), decydujące o
cechach potomstwa. Przewidział również nieznaną jeszcze wówczas mejozę i wielkie możliwości
zmienności wśród potomstwa.
Koncepcję tę potwierdzili Theodor Boveri i Walter Sutton w 1904 roku zwracając uwagę na
fakt, że chromosomy zachowują się podobnie jak mendlowskie geny i zasugerowali ich wzajemny
związek głosząc chromosomową teorię dziedziczności. Thomas Morgan eksperymentalnie potwierdził
związek między genami i chromosomem. Udowodnił w badaniach na muszce owocowej (Drosophila
melanogaster) liniowy układ genów, opracował system sporządzania map chromosomowych,
zinterpretował zjawisko crossing over między chromatydami chromosomów homologicznych i
udowodnił sprzężenie genów z płcią. Za swoje prace otrzymał nagrodę Nobla w 1933 r.
Problemem niewyjaśnionym w pierwszej połowie XX wieku była sprawa budowy składników
dziedzicznych. Według Loeb’a i Child’a białko było tą cząsteczką chemiczną, która zdolna była do
przeprowadzenia szeregu reakcji chemicznych. Wykryte w 1944 roku DNA przez Averego, MacLeoda i
McCarthego w badaniach na mikroorganizmach a w 1952 roku u bakteriofagów nie do końca
przemawiało do naukowców. Rewolucję w zrozumieniu istoty nośnika dziedziczności wprowadziły
badania chemika Linusa Paulinga i Rosalind Franklin, na podstawie, których James Watson i Francis
Crick w 1953 roku ogłosili model budowy przestrzennej DNA. Ich doniesienie stało się przełomem w
rozwoju genetyki. Zaraz też ruszyła lawina odkryć, które przyniosły informację o modelu regulacji
działania genu u bakterii zwanego, operonem, a składającego się z regionów odpowiadających za
start, ekspresję i zakończenie ekspresji genu u Procaryota (F. Jacob, J. Monod 1961r). Ci sami badacze
odkrywają istnienie informacyjnego RNA– mRNA. W tym samym czasie M. Nirenberg i S. Ochoa
opracowali zasady kodu genetycznego, który pozwolił zrozumieć naturę informacji genetycznej, a.
pełen kod genetyczny, w 1966 roku podali G.H. Kornberg, M. Nirenberg, i R.W. Holley W 1964 roku D.
Baltimore i H. M. Temin odkrywają enzym odwrotną transkryptazę i jego rolę w mechanizmie
przekazywania informacji genetycznej. W 1965 roku zostaje po raz pierwszy przeprowadzone
sekwencjonowanie kwasów nukleinowych (R.W Holley i Zachar), a w 1967 A. Kornberg i M. Goulian
zsyntetyzowali wirusowe DNA.
Jak wynika z tego krótkiego zestawienia, przez okres niespełna 70 lat od odkrycia prac
Mendla poznano strukturę i funkcję genów, poznano odmienność budowy genu u Procaryota i
Eukaryota. Dzisiaj znamy mapy genowe wielu organizmów eukariotycznych a także został
zsekwencjonowany cały genom człowieka, myszy, szczura i innych organizmów. Wiemy już wiele na
temat regulacji ekspresji genu, coraz więcej wiadomo na temat funkcji różnych cząsteczek RNA,
wiemy także, że na bazie zapisanej informacji w DNA mogą powstać różne formy tego samego białka.
7
Genetyka stała się „królową nauk biologicznych” i jej obecność można stwierdzić w wielu
dziedzinach. Możemy w związku z tym mówić nie tylko o genetyce mendlowskiej– klasycznejzajmującej się materialnymi podstawami dziedziczenia, ale także o:
cytogenetyce- zajmującej się dziedziczeniem i zmiennością na poziomie jądra i komórki a
więc rolą chromosomów w dziedziczeniu, związkiem struktury i mechanizmów replikacji
chromosomów z ich funkcją genetyczną, tworzeniem fizycznych map genów
genetyce biochemicznej (fizjologicznej)- w której rozpatruje się przede wszystkim
dziedziczenie procesów biochemicznych, zdolności do syntezy białek, enzymów, kierowanie
metabolizmem komórki
genetyce rozwoju (embriologicznej)– zajmującej się przebiegiem i kierowaniem ontogenezą,,
której, u wielu gatunków, ważną częścią jest embriogeneza. Dziedzina ta zajmuje się także
rolą genów w kształtowaniu i rozwoju tkanek, organów oraz determinacji płci osobniczej
genetyce molekularnej– badającej mechanizm dziedziczenia i zmienności na poziomie
chemicznym, rolą i budową DNA i RNA, mechanizmem replikacji DNA, sposobem kontroli
syntezy białka itp. Można powiedzieć, że zajmuje się elementarnymi podstawami życia
immunogenetyce- zajmującej się genetycznymi mechanizmami odporności i podłoża chorób
np. autoagresywnych. Odgrywa też ogromną rolę w rozwoju transplantologii i onkologii
genetyce populacji– badającej zasady dziedziczenia i rozpowszechniania genów w populacji,
określającej czynniki, od których zależy występowanie poszczególnych cech, a także wpływ
warunków ekologicznych na rozprzestrzenianie lub zanikanie ich w populacji. Ten dział
genetyki oparty jest na modelach statystycznych, wykorzystuje również osiągnięcia genetyki
molekularnej w celu określenia frekwencji genów
genetyce behawioru– (względnie nowym dziale genetyki)– zajmującym się wpływem
genotypu na zachowanie organizmów. Okazało się, wbrew poprzednim założeniom, że geny
odgrywają główną rolę w kształtowaniu prawie wszystkich typów zachowań
O genetyce możemy mówić także ze względu na grupę badanych organizmów.
Mamy zatem genetykę mikroorganizmów, genetykę roślin czy genetykę zwierząt, czy
genetykę człowieka. W ramach genetyki człowieka mamy genetykę medyczną, zajmującą się
zastosowaniem zasad genetyki w praktyce lekarskiej, czy genetykę z zakresu ekspertyz medycyny
sądowej.
Szybki rozwój technik laboratoryjnych spowodował, że coraz większą rolę przypisuje się genomice i
proteomice.
Genomika to dziedzina, której głównym celem jest wyjaśnienie struktury całego genomu
organizmów a nie pojedynczych genów, a więc uwzględnienie wszystkich interakcji pomiędzy
8
wszystkimi podjednostkami tworzącymi zespolony genom. Ze względu na ogromny zasób
informacji jaki kryje w sobie genom, wyróżnia się kilka działów genomiki:
genomika strukturalna (poznanie sekwencji i jej wstępny opis)
genomika funkcjonalna (poznanie funkcji wszystkich genów w genomie)
genomika teoretyczna (ogólne prawa rządzące genomami)
genomika porównawcza (ewolucja genomów)
genomika indywidualnych różnic (zmienność międzyosobnicza genomów tego samego gatunku)
Proteomika- zajmuje się badaniem struktury i funkcji białek, próbując podobnie jak genomika,
wyjaśnić sposoby oddziaływania jednych struktur białkowych na drugie.
Podobnie jak pojęcie genom określa wszystkie geny w komórce, tak pojęcie proteom będzie określać
wszystkie białka obecne w komórce organizmu.
Warto zwrócić uwagę, że proteomika jest dziedziną znacznie szerszą i bardziej złożoną niż
genomika, ponieważ genom jest obiektem zmieniającym się w bardzo małym stopniu, natomiast
zestaw białek obecnych w komórce zmienia się nieustannie wskutek interakcji z czynnikami
środowiskowymi oraz z innymi komórkami w organizmie.
Jak wynika z tego krótkiego przeglądu, rozwój genetyki i nauk jej pokrewnych miał bardzo szybkie
tempo w drugiej połowie XX w i wszystko wskazuje że wiek XXI przyniesie dalszy postęp w tej
dziedzinie. Świadczy o tym choćby ilość nagród Nobla przyznawanych za odkrycia związane z tą
dziedziną nauki.
1933r- Pierwsza nagroda Nobla z dziedziny genetyki przyznana T.H. Morganowi za odkrycie roli
chromosomów w przekazywaniu cech dziedzicznych w 1910r.
1946r- H.J. Muller - odkrycie mutagennego działania promieni rentgenowskich w latach 1919 -1926.
1958r– J. Ledeberg, G.W. Beadle, E.L. Tatum– poznanie rekombinacji u bakterii i stworzenie hipotezy
„jeden gen– jeden enzym”w 1941r.
1962r– F.H.C. Crick, J.D. Watson, M.H.F. Wilkins – odkrycie struktury DNA w 1953r.
1965r– F. Jacob, A.M. Lwoff, M.J. Monod – opracowanie modelu operonu w 1961r.
1966r– T.P. Rous, Ch. B. Huggins - prace nad wirusowym podłożem chorób nowotworowych i
hormonalnej terapii przeciwnowotworowej
1968r– M. Nirenberg, H.G,. Khorana, J.H. Matthaei – wyjaśnienie istoty kodu genetycznego w 1964r.
1975r– D. Baltimore, R. Dulbeco, H Termin – wykrycie odwrotnej transkryptazy w 1970r.
1978r– D. Nathans, W Arber, H. Smith – odkrycie enzymów restrykcyjnych i ich zastosowanie w
genetyce molekularnej – podstawa inżynierii genetycznej.
1980r- P. Berg (badania kwasów nukleinowych, zwłaszcza techniki rekombinacyjne) oraz W. Gilbert i
F. Sanger (opracowanie metody sekwencjonowania fragmentów DNA w 1977r.
1980r– G. Snell,– odkrycie głównego kompleksu zgodności tkankowej (MHC) w 1941r.
9
1980r- J.Dausset, B. Bonacerraf – badania nad genami odpowiedzialnymi za reakcje odpornościowe.
1983r– B. McClintock – odkrycie ruchomych cząstek DNA (transpozonów) w 1953r. – jeden z
najdłuższych okresów oczekiwania na uznanie ważności badań.
1989r– J.M. Bishop – odkrycie zależności między onkogenem a protoonkogenem, nowotwory o
pochodzeniu retrowirusowym 1976r.
1993r- K.B. Mullis, M. Smith – opracowanie łańcuchowej reakcji polimerazy (PCR) w 1989r.
1993r– P.A. Sharp, R.J. Roberts – wykazanie nieciągłej budowy genów Eukaryota - eksony i introny
1995r– E.B. Lewis, CH. Nüsslein-Volhard, E.F. Wieshaus- badania embriogenezy u D. melanogaster
lata 1942-1980 – wykazanie roli genów w kierowaniu rozwojem (geny homeotyczne)
1997r- S.B. Prusiner – wykazanie, że białko może być źródłem zakażeń - priony- 1982r,
2001r– T.R. Hunt – wykrycie molekularnych mechanizmów regulujących cykl komórkowy w latach
80tych.
2002r- S. Benner, H.R. Horovitz, J.E.Suston- opisanie genetycznej regulacji organogenezy i apoptozy u
nicienia Caenorhabditis elegant.
2004r– A. Ciechanover, A. Hershko, I Rose – za wykrycie ubikwitynacji białek
2005r- B.J. Marshall, J.R. Warren – za wykrycie Helicobacter pylori i jej rolę w rozwoju stanów
zapalnych i wrzodów żołądka w 1979 r.
2006r- R.D. Korneberg - opisanie molekularnych mechanizmów transkrypcji w komórkach
eukariotycznych, w tym odkrycie polimeraz RNA (badania rozpoczęte w 1974r)
2006r- A.Z. Fire, K. Mello –w pracy nad nicieniem Caenorhabditis elegant, odkryli mechanizm
interferencji RNA, które może mieć zastosowanie w terapii genowej. RNA
2007r– M. Capecchi, M. Evans, O. Smithies – za wykrycie i badania od roku 1981 zarodkowych
komórek macierzystych myszy
2008r– H. zur Hausen, F. Barre-Sinoussi, L. Montagnier - za odkrycie wirusa brodawczaka ludzkiego
(HPV) w latach 80 tych, wywołującego raka szyjki macicy i odkrycie ludzkiego wirusa upośledzenia
odporności, znanego pod nazwą HIV w dwa lata po odkryciu AIDS (1984r)
2009r– C. Greiner, E. Blackburg, J. Szostak – za badania roli telomerów i telomerazy w trakcie
podziałów komórki. Badania te prowadzone w latach 80 tych XX w. rzuciły światło na procesy
nowotworzenia oraz starzenia się komórki.
2010r- R.G. Edwards- opracowanie skutecznej metody zapłodnienia in vitro. Zwieńczeniem jego prac
było przyjście na świat w 1978r Luizy Brown- pierwszego dziecka „z probówki”.
2011r– B.A. Beutler, J. Hoffmann, R. Steinmann– za badania nad funkcjonowaniem układu
odpornościowego i odkrycie mechanizmów jego aktywacji
2012r– J. Gurdon, S. Yamanaka– za odkrycie sposobu „przeprogramowywania” dojrzałych komórek w
komórki pluriopotentne
10
Warto tu wymienić prace, które nie zostały jeszcze uhonorowane nagrodą Nobla, ale odegrały wielce
istotną rolę w postępie badań genetycznych. Są to między innymi:
- Pierwsza udana próba leczenia choroby genetycznej (wrodzonego upośledzenia odporności)
związanej z niedoborem deaminazy adenozynowa (SCID/ADA) (wrodzony niedobór odporności)
technikami inżynierii genetycznej- 1992r. Obecnie są próby leczenia tą metodą hemofilii,
mukowiscydozy oraz choroby Parkinsona.
- Sekwencjonowanie ludzkiego genomu pod kierunkiem Watsona w latach 1988 - 2000
- Zsekwencjonowanie genomu myszy 2002 rok, genomu szczura – 2004 rok, genomu psa i genomu
szympansa– 2005r,
- Pierwsze transgeniczne myszy– Palmitier 1982r,
- Pierwsza sklonowana owca– Dolly– J. Wilmut 1997r
11
1. Pojęcie genu, mutacje genowe
Autorki: Elżbieta Wirth-Dzięciołowska; Zuzanna Nowak
Odkrycie prac Mendla i poznanie podstawowych zasad dziedziczności dały podstawy do
dalszych badań, które wyjaśniły, czym jest gen, gdzie się znajduje i jaka jest jego budowa. Pierwotnie
uważano, że gen jest strukturą przypominającą koralik na sznurku korali, zajmujący stałe, określone
miejsce w chromosomie. Przez wiele lat uważany był za jednostkę funkcji, rekombinacji i mutacji. Gdy
poznano strukturę kwasu deoksyrybonukleinowego DNA (ang. Deoxyribonucleic Acid), gen okazał się
odcinkiem kwasu DNA kodującym odpowiednie białko. Badania wykazały, że mutacje mogą zachodzić
w genie w różnych jego fragmentach a rekombinacja, co prawda z dużo mniejszą częstością, ma
miejsce także w obrębie genu. W tej sytuacji jednostką dziedziczenia jest gen, jednostką mutacji
okazał się nukleotyd (ryc. 1.1b) a jednostką rekombinacji- nukleozyd (ryc. 1.1a).
a
(rys. Z. Nowak)
b
Rysunek 1.1. A. Nukleozyd- zasada azotowa połączona z pierwszym węglem szkieletu cukrowego rybozy lub
deoksyrybozy wiązaniem beta-glikozydowym. Na rysunku przedstawiona adenozyna. B. Brak wiązania
estrowego z resztą fosforanową nukleotyd- nukleozydo-(trój)fosforan, nukleotydy posiadają od jednej do
trzech grup fosforanowych przyłączonych do 5 węgla szkieletu cukrowego (rybozy lub deoksyrybozy), na
rysunku przedstawiony adenozyno-5’-trójfosforan.
Struktura kwasu dezoksyrybonukleinowego występująca w postaci podwójnej helisy, o
przeciwnie spolaryzowanych łańcuchach polinukleotydowych, została zaproponowana przez Jamesa
Watsona i Francisa Cricka na podstawie badań rentgenowskich prowadzonych przez Maurice’a
Wilkinsa i Rosalindę Franklin. Cechą podstawową zaproponowanego modelu jest komplementarność
zasad, tzn. zasada purynowa zawsze łączy się z zasadą pirymidynową i tak: adenina (A) leży
naprzeciwko tyminy (T) a cytozyna (C) łączy się z guaniną (G). Takie ułożenie zasad zapewnia
stabilność struktury fizycznej cząsteczki a jednocześnie funkcję biologiczną związaną z powielaniem
informacji genetycznej podczas replikacji DNA.
Adenina z tyminą łączy się dwoma wiązaniami a cytozyna z guaniną trzema wiązaniami
wodorowymi, co warunkuje silniejsze połączenie między nićmi polinukleotydowymi w odcinkach DNA
bogatych w pary GC niż w przypadku przewagi par AT. Hydrofobowe zasady azotowe skierowane są
ku środkowi helisy, natomiast hydrofilowe łańcuchy cukrowo-fosforowe na zewnątrz. Pomiędzy
dwoma sąsiednimi skrętami helisy znajduje się wolna przestrzeń, która tworzy dwie bruzdy; małą i
12
dużą. Bruzdy te, a szczególnie bruzda duża jest miejscem kontaktu białek swoiście rozpoznających
sekwencje nukleotydowe zasad azotowych. Jednak cząsteczki DNA, których długość nie rzadko osiąga
106– 109 par zasad/ cząsteczkę, nie zawsze są jednakowe na całej swej długości. Na
różnorodność/polimorfizm strukturalny DNA składają się różne formy helisy określane jako A, B i Z.
Forma B jest strukturą najczęściej opisywaną i najbardziej stabilną. Forma A i Z występują znacznie
rzadziej i różnią się od formy B liczbą par zasad przypadających na jeden skręt a także głębokością i
szerokością bruzd.
Tabela 1.1 Cechy charakterystyczne różnych form DNA
Cecha
Średnica heliksu (nm)
B
2.0
A
2.6
Z
1.8
Odległość między kolejnymi zasadami
3.4
3.4
3.4
Liczba par zasad na 1 skręt helisy
10
11
12
Szerokość/ głębokość bruzdy większej (nm)
1.17/0.88
0.27/1.35
0.88/0.37
Szerokość /głębokość bruzdy mniejszej (nm)
0.57/0.75
1.1/0.28
0.2/1.38
prawoskrętna
prawoskrętna
lewoskrętna
Kierunek skrętu helisy
Podstawowa różnica między formą B i A związana jest z różną zawartością cząsteczek wody,
forma A jest mniej uwodniona i występuje w warunkach niskiej wilgotności. Forma Z różni się nie
tylko cechami wymienionymi w tabeli, ale ponadto dinukleotydowymi podjednostkami o różnym
ułożeniu zasad azotowych w stosunku do deoksyrybozy. Daje to w efekcie zygzakowaty kształt tej
struktury DNA.
a
b
(rys. J. Dzięciołowska)
Rysunek 1.2. Dwie formy nukleotydu. a) występuje w helisie typu B i A. b) występuje w helisie typu Z na
przemian z formą typową dla A i B.
13
Układ sekwencji zasad wzdłuż nici polinukleotydu ma bardzo duży wpływ na tworzenie form
strukturalnych cząsteczki, a także na funkcje poszczególnych rejonów nici DNA. Miejsca bogate w
pary GC łatwiej tworzą strukturę typu Z natomiast w miejscach bogatych w pary AT, łańcuch ulega
łatwiej zagięciu, co ma znaczenie przy upakowywaniu DNA np. w fazie przygotowującej komórkę do
podziału. Ponadto zasady; adenina i cytozyna mogą występować w formie zmetylowanej np. N6metyloadenina (m6A) czy N5- metylocytozyna (M5C), których obecność może mieć wpływ na
powinowactwo pewnych białek do DNA.
Cząsteczki DNA mogą też występować w formach trzy- i czteroniciowych. Formy trójniciowe
powstają w wyniku dołączenia do dużej bruzdy trzeciej nici. Ma to miejsce wtedy, gdy jedna nić
dwuniciowej cząsteczki jest homopurynowa a druga homopirymidynowa, wtedy trzecia nić
homopurynowa łączy się wiązaniami wodorowymi z nicią homopirydynową w odwrotnej do niej
polaryzacji. Formy czteroniciowe powstają we fragmentach bogatych w pary GC, np. odcinkach
telomerowych wykazując własności ochronne dla końcowych odcinków chromosomu. Inne niezwykłe
formy strukturalne DNA to helisy w obrębie jednej nici tworzące np. strukturę typu spinki do włosów,
odgrywającą rolę przy regulacji transkrypcji.
Oczywiście wspomniane cechy nici polinukleotydu nie są typowe w całym świecie ożywionym.
Związane to jest z pewnymi różnicami, jakie występują między organizmami protokariotycznymi i
eukariotycznymi.
U organizmów protokariotycznych DNA jest „nagi” i poza archebakteriami, nie tworzy z
białkami struktury chromosomu charakterystycznego dla eukariontów. U większości bakterii DNA
występuję w postaci kolistej cząsteczki, podzielonej na szereg pętli zachowujących pewną autonomię
topologiczną i funkcjonalną. Znane są, co prawda formy liniowe cząsteczki DNA czy występowanie
dwóch, trzech form kolistych, ale stanowią one wyjątek w świecie mikroorganizmów. Długość
cząsteczki DNA np. u Escherichia coli wynosi około 1000-1500µm, w związku z tym musi być
wielokrotnie upakowana w komórce. Rejon występowania DNA nosi nazwa nukleoidu i nie jest
oddzielony od reszty komórki. Obok podstawowego chromosomu, u bakterii mogą występować małe
koliste cząsteczki, plazmidy pełniące różne funkcje w komórce.
U organizmów eukariotycznych DNA występuje w komórce na terenie jądra, oddzielonego
porowatą błoną jądrową od reszty komórki. Cząsteczka DNA ma charakter liniowy i np. w komórce
człowieka wynosi około 2m. Taka długość musi zmieścić się w jądrze o średnicy rzędu 10 µm. W
upakowaniu DNA w jądrze znaczną rolę odgrywa kompleks nukleoproteinowy zwany chromatyną.
Zbudowany jest z części rdzeniowej- nukleosomu, który tworzą cztery rodzaje białek histonowych
(H2A, H2B, H3 i H4), oraz nawiniętego odcinka DNA składającego się z około 145pz. Rdzeń
nukleosomu składa się z oktameru histonów- w centrum znajduje się tetrametr (H3-H4)2, na zewnątrz
są dwa dimery H2A-H2B. Nawinięte DNA na nukleosom spięte jest jeszcze jednym histonem- H1,
14
zwanym często histonem łącznikowym, który zabezpiecza dodatkowe 20 par nukleotydów. Kontakt
DNA z histonami ogranicza dostęp do DNA białkom biorącym udział w transkrypcji czy translacji, a
także nukleazom, enzymom trawiącym kwas nukleinowy.
Cechą wspólną DNA prokariontów i eukariontów jest kodowanie informacji zarówno o
białkach budujących komórkę, jak i enzymach regulujących funkcjonowanie komórki. Informacje te
zawarte są w kolejności ułożonych nukleotydów, tworzących kod genetyczny.
Tabela.1.2. Tabela kodu genetycznego wyrażona zapisem sekwencji nukleotydów w informacyjnym RNA.
DRUGI NUKLEOTYD
C
A
G
UUU
UCU
UAU
UGU
U
Phe
Tyr
Cys
UUC
UCC
UAC
UGC
C
U
Ser
UUA
UCA
UAA
UGA
STOP
A
Leu
STOP
UUG
UCG
UAG
UGG
Trp
G
CUU
CCU
CAU
CGU
U
His
CUC
CCC
CAC
CGC
C
C
Leu
Pro
Arg
CUA
CCA
CAA
CGA
A
Gln
CUG
CCG
CAG
CGG
G
AUU
ACU
AAU
AGU
U
Ile
Asn
Ser
AUC
ACC
AAC
AGC
C
A
Thr
AUA
AAA
AGA
A
Met ACA
Lys
Arg
START ACG
AUG
AAG
AGG
G
GUU
GCU
GAU
GGU
U
Asp
GUC
GCC
GAC
GGC
C
G
Val
Ala
Gly
GUA
GCA
GAA
GGA
A
Glu
GUG
GCG
GAG
GGG
G
Ala- alanina; Arg- arginina; Asn- asparagina; Asp- kwas asparaginowy; Cys-cysteina; Gln-glutamina;
Glu- kwas glutaminowy; Gly- glicyna; His- histydyna; Ile- izoleucyna; Leu- leucyna; Lys- lizyna; Metmetionina; Phe-fenyloalanina; Pro- prolina; Ser- seryna; Thr- treonina; Trp- tryptofan; Tyr-tyrozyna;
Val-walina
TRZECI NUKLEOTYD
PIERWSZY NUKLEOTYD
U
Kod genetyczny ma pewne własności, które zostały opisane i nazwane.
Kod genetyczny jest trójkowy- trzy kolejne trójki nukleotydów są przepisywane w procesie
transkrypcji na mRNA i jako kodony kodują jeden aminokwas. Wyjątek stanowią trzy kodony
(kodony stop), oznaczające zakończenie translacji (tabela 1.2).
Kod genetyczny jest bezprzecinkowy– trójki nukleotydów tworzących kodony w mRNA nie są
oddzielone od siebie żadnymi cząsteczkami. Informacja zaczyna się w określonym miejscu (od
trójki AUG- kodującej zarazem metioninę) i kończy kodonem stop.
Kod jest niezachodzący- następujące po sobie kodony kodują kolejne aminokwasy. Dowodem
jest fakt, że podmiana (substytucja) pojedynczego nukleotydu w kodonie, może spowodować
zmianę sensu tylko jednego aminokwasu, pozostałe będą syntetyzowane bez zmian.
15
Kod genetyczny jest zdegenerowany (wieloznaczny), kilka kodonów może kodować ten sam
aminokwas (tabela.1.2). Antykodon tRNA rozpoznaje przede wszystkim dwie pierwsze zasady,
trzecia jest mało wybiórcza.
Kod genetyczny jest uniwersalny- taki sam u wszystkich organizmów. Jest tu jednak pewien
wyjątek. Uniwersalność dotyczy jedynie genów jądrowych, bowiem w DNA mitochondrialnym
istnieją odstępstwa np. UAG oznacza tryptofan, AGG- stop a AUA- metioninę.
1.1. Budowa genu u Procaryota i Eukaryota i wynikające z tego różnice
Istnieją jednak pewne różnice w odczytywaniu kodu genetycznego u Procaryota i Eukaryota
związane z różnicą w budowie genów w tych grupach organizmów. U Procaryota geny mają budowę
ciągłą, czyli każda kolejna trójka oznacza kolejny aminokwas. Gen stanowiący jednostkę funkcjonalną,
kodującą jeden polipeptyd nosi nazwę cistronu. Istnieje pełna kolinearność między układem trójek w
DNA i układem kolejnych aminokwasów w białku a miejsce mutacji w genie, odpowiada miejscu
zmiany aminokwasu.
Tabela 1.3. Zależność między DNA i białkiem u Prokaryota możemy przedstawić jeszcze w inny sposób.
DNA
Białko
3 kolejne nukleotydy
-1 aminokwas
polinukleotyd
- polipeptyd struktura I-rzędowa
- zagięcia polipeptydu – struktura II-rzędowa,
- Zawinięcia polipeptydu – struktura III-rzędowa
stabilizowana np. mostkami siarczkowymi.
Struktura I-rzędowa polipeptydu decyduje o funkcji białka i o strukturze drugorzędowej. Jednak w
latach 70- tych wykazano, że geny u Eukaryota mają inną budowę i nie można takiej prostej
zależności ustalić między DNA i białkiem. Okazało się, że wiele genów zawiera sekwencje
nukleotydów, które nie są przenoszone na białko. Sekwencje te stanowią nawet 2/3 wszystkich par
nukleotydów i określane są mianem intronów. Jedynie niewielka liczba genów Eukaryota jest
bezintronowa. Do takich genów należą między innymi geny histonów, gen interferonu czy większości
białek szoku termicznego. Większość genów organizmów eukariotycznych ma budowę nieciągłą,
złożoną z elementów przenoszących informację genetyczną– eksonów, poprzedzielanych
fragmentami niekodującymi- intronami.
16
Liczba intronów w genie może być różna np. w genie globin jest ich 2, w albuminie jaja
kurzego- 7, w genie α kolagenu- 50, natomiast najdłuższy poznany dotychczas gen kodujący
dystrofinę u człowieka (mutacja w tym genie powoduje dystrofię mięśniową Duchenne’a) zawiera 75
intronów. Gen ten składa się z 2,5ml par zasad, zaś eksony obejmują łącznie 11000 par zasad, co
stanowi jedynie 0,5% długości genu. Długość pojedynczego intronu może wynosić od kilkunastu par
zasad do 210 000pz. w najdłuższym intronie dystrofiny mięśniowej.
W związku z różną budową genów Procaryota i Eukaryota istnieją wyraźne różnice w
przebiegu transkrypcji i translacji w komórkach obu grup organizmów.
1.1.1. Transkrypcja
Transkrypcja to proces syntezy informacyjnego RNA (mRNA- messenger RNA) na nici 3’ DNA
(antysensownej). Jest pierwszym i podstawowym procesem w ekspresji genów. Skład komórkowego
RNA decyduje o charakterze proteomu i określa funkcje samej komórki. Różnice w budowie genów i
samym procesie transkrypcji u Procaryota i Eucaryota przedstawia tabela 1.4.
Tabela 1.4. Porównanie transkrypcji u Procaryota i Eukaryota
Cechy
Procaryota
Eukaryota
Budowa
genów
Ciągła, składają się wyłącznie z
sekwencji kodujących
Nieciągła, - eksony i introny
Budowa
promotorów
Dwie krótkie sekwencje kasety
Zawiera kasetę TATA – 30 par zasad,
sekwencje CAAT w odległości od -40 do 300pz od miejsca startu transkrypcji oraz
enhancer sekwencje wzmacniające
położone w odległości kilku- kilkunastu
tysięcy par zasad od genu.
(-35 GACA) oraz kasety
(-10TATAAT), które zlokalizowane są
przed miejscem rozpoczęcia
transkrypcji
Liczba
promotorów
Kilka genów może mieć wspólny jeden
promotor, mogą być transkrybowane
razem
W zasadzie każdy gen ma swój własny
promotor i transkrybowany jest oddzielnie
Liczba
rodzajów
polimeraz
RNA
Jeden rodzaj polimerazy odczytuje
wszystkie geny
Trzy rodzaje polimeraz jądrowych;
polimeraza RNA I (jąderkowa)
transkrybuje geny rRNA,
polimeraza RNA II –syntetyzuje mRNA
genów kodujących białka
polimeraza RNA III transkrybuje geny
tRNA i 5SrRNA
Ponadto polimeraza RNA
mitochondrialna i u roślin
chloroplastowa
17
U bakterii bezpośredni dostęp do
genoforu
Po rozluźnieniu struktury nukleosomowej
chromosomu i despiralizację chromatyny
Struktura
mRNA
Policistronowa (informacja o kilku
białkach na jednej nici mRNA)
Monocistronowa (1 nić mRNA = 1 białko)
Dojrzewanie
RNA
mRNA stanowi pierwotny trankrypt,
ulegający translacji
Pre-mRNA jest kopią budowy DNA, ulega
obróbce potrankrypcyjnej- wycinanie
intronów i łączenie eksonów– splicing
Rozdział
między
transkrypcją
a translacją
Brak rozdziału przestrzennego i
czasowego między transkrypcją i
translacją, DNA genoforu nie jest
oddzielone od cytoplazmy
Oba procesy rozdzielone w czasie i miejscu.
Transkrypcja zachodzi w jądrze komórki,
translacja w cytoplazmie. DNA
chromosomów oddzielone błoną jądrową od
cytoplazmy
Czas
półtrwania
mRNA
Kilka minut
Kilkanaście godzin (w erytroblastach ssaków
nawet kilka dni)
Dostęp
polimeraz
RNA do nici
DNA
1.1.2. Translacja
W procesie translacji dochodzi do przetłumaczenia informacji z języka nukleotydów na język
aminokwasów. Niezmiernie ważną rolę w tym procesie odgrywają rybosomy, zbudowane z wielu
białek oraz RNA rybosomowego (nukleoproteiny). Zapewniają one: połączenie między mRNA i
aminoacylo-tRNA; precyzyjność odczytu (żadna zasada nie jest pominięta w trakcie odczytu ani
odczytana dwukrotnie); uporządkowanie przestrzenne i względem siebie cząsteczek biorących udział
w biosyntezie białka.
Rybosomy składają się z dwóch, różnej wielkości cząsteczek pełniących odmienne funkcje w
trakcie biosyntezy białka. Na powierzchni cząsteczki mniejszej są odpowiednie miejsca kształtem
dopasowane do nici mRNA i aminoacylo-tRNA. Tu następuje połączenie między dwoma, kolejnymi
cząsteczkami tRNA i mRNA. W procesie tworzenia wiązania peptydowego między dwoma
aminokwasami rolę odgrywa duża cząsteczka rybosomy, która ma właściwości enzymu katalizującego
proces syntezy peptydu.
18
Tabela 1.5. Porównanie procesu translacji u Prokaryota i Eukaryota
Komórki Procaryota
Komórki Eukaryota
Kodon inicjacyjny AUG w mRNA (czasem (GUG)- Kodon AUG w mRNA koduje metioninę
koduje formylometioninę
Kodon inicjacyjny poprzedzony
kodonów nonsensownych w mRNA
jednym
z Kodon inicjacyjny poprzedzony
7-metyloguanozyną (struktura czapeczki)
Brak reticulum endoplazmatycznego- rybosomy Rybosomy w zasadzie związane z reticulum
występują luźno w cytoplazmie, złożone z dwóch endoplazmatycznym,
złożone
z
dwóch
podjednostek mniejszej 30S i większej 50S
podjednostek 40S i 60S.
Koniec 5’ mRNA łączy się z mniejszą cząsteczką rybosomu, do niej przybliża się tRNA, następnie
dołącza się duża cząsteczka rybosomu,- powstaje aktywny rybosom i rozpoczyna się faza elongacji
rozbita na dwa etapy: rozpoznanie kodonów w mRNA i tworzenie wiązań peptydowych. Związany z
tym jest proces translokacji zarówno mRNA jak i peptydylo-tRNA. Proces powtarza się aż do chwili,
gdy miejsce aktywne w rybosomie osiągnie kodon stop, który rozpoczyna proces terminacjinastępuje uwolnienie peptydu, dysocjacja kompleksu rybosomalnego, rozpad mRNA.
1.2. Mutacje
Pod pojęciem mutacji rozumiemy wszelkie zmiany zachodzące w materiale genetycznym. W
zależności od rozmiaru tych zmian dzielimy je na genowe lub punktowe, jeśli dotyczą pojedynczego
genu, albo chromosomowe, jeśli powodują zmianę struktury chromosomu lub ich liczby. Więcej na
temat mutacji chromosomowych w rozdziale drugim.
Mutacje punktowe polegające na zamianie jednej zasady na inną w triplecie noszą nazwę
substytucji. Jeśli zamiana jednej zasady na inną zachodzi w obrębie zasad purynowych lub
pirymidynowych określamy je mianem tranzycji. Zamianę zaś puryny na pirymidynę lub odwrotnie
pirymidyny na purynę nazywamy transwersją.
Tego typu mutacje mogą mieć różne skutki. Jeśli taka podmiana spowoduje zamianę jednego
aminokwasu na inny – mówimy o mutacji zmiany sensu np. ACA na AAA powoduje zamianę treoniny
na lizynę. Zdarza się jednak, że zamiana zasady nie powoduje zmiany aminokwasu np. AUA na AUC –
izoleucyna, - mamy wtedy do czynienia z tzw. mutacją cichą. W sytuacji, gdy mutacja powoduje
skrócenie zawartej w genie informacji zmieniając trójkę kodującą aminokwas na trójkę STOP, mamy
wtedy do czynienia z mutacją typu nonsens. Ten typ mutacji może dotyczyć zarówno eksonów, jak i
transkryptów z nieprawidłowym położeniem kodonu STOP względem miejsc styku intron-ekson.
Oprócz wspomnianych mutacji punktowych mogą wystąpić zakłócenia struktury DNA poprzez
wstawienie (insercję), wypadnięcie (delecję) jednego lub większej liczby nukleotydów. Mutacje takie
prowadzą do zmiany ramki odczytu. Jednak w tej sytuacji jest jeden warunek, liczba zmienionych w
19
ten sposób nukleotydów nie może obejmować trójki bądź jej wielokrotności. (Uwaga. Jaki będzie
efekt, gdy ten warunek nie jest spełniony?)
Mutacje zachodzące w DNA możemy podzielić na spontaniczne i indukowane, powodowane
działaniem czynników zewnętrznych– mutagenów. Główną przyczyną mutacji spontanicznych są
błędy replikacji wywołane niedokładnością przyłączania nukleotydów przez polimerazy DNA,
wstawienie nieprawidłowego nukleotydu będące np. wynikiem występowania analogów zasad, lub
tautomerii zasad, a także poślizg polimerazy w miejscach występowania wielokrotnych powtórzeń
pojedynczego nukleotydu.
Mutacje indukowane mogą być wywołane przez czynniki środowiska komórki jak i czynniki
środowiska zewnętrznego, w którym żyje organizm. Jednym z głównych czynników uszkadzających
DNA są aktywne formy tlenu– wolne rodniki jak rodnik ponadtlenkowy O2-, nadtlenek wodoru (H2O2)
czy wodorotlenkowy ( OH+).
Literatura do rozdziału 1
1. Berg P., Singer M., 1997, Język genów, Prószyński i S-ka.
2. Węgleński P., 2006, Genetyka molekularna, Praca zbiorowa, PWN, Warszawa
Zadania do rozdziału 1
Zadanie 1.1
Pewne białko produkowane przez bakterie ma 200 aminokwasów. Z ilu rybonukleotydów składa się
mRNA a ile nukleotydów ma odpowiedni gen?
Zadanie 1.2
Łańcuch białka hemoglobiny alfa u człowieka składa się z141 aminokwasów. Jakiej długości będzie
mRNA niosący informację o tym białku? Czy odpowiedni fragment DNA kodujący informację będzie
dłuższy, krótszy czy tej samej długości, co mRNA? Jak zmieniłaby się odpowiedź na to pytanie, gdyby
białko o tej długości było produkowane przez Escherichia coli?
Zadanie 1.3
Krótki fragment cząsteczki DNA ma następująca sekwencje nukleotydów:
3’ ATCTTTACGCTA 5’
5’TAGAAATGCGAT 3’
Która z nici DNA służy za matrycę dla syntezy mRNA? Jaka będzie sekwencja rybonukleotydów? Jaki
byłby wynik, gdyby informacja była przepisywana z niewłaściwej nici zarówno na poziomie mRNA jak
i peptydu?
20
Zadanie 1.4
Mamy fragment nici DNA
5’ ACT ATT CTC CCC ACT 3’.
Od której strony będzie przepisywana ta nić na mRNA? Jakie powstaną rybonukleotydy?
Zadanie 1.5
Syntetaza tryptofanowa Escherichia coli składa się z 267 aminokwasów. W dzikim typie w pewnym
odcinku białka jest następująca sekwencja aminokwasów;
tyrozyna-leucyna-treonina-glicyna-glicyna-glicyna-glicyna-glicynaseryna.
U mutanta A446 cysteina zajmuje miejsce tyrozyny. Mutant A187 ma trzecią glicynę zastąpioną przez
walinę. Jaki mechanizm zmian miał miejsce w kodzie genetycznym w każdym z tych przypadków?
Jakie znasz jeszcze inne rodzaje mutacji genowych, które nie wystąpiły w wymienionych przykładach?
Przedstaw swoje rozumowanie posługując się symboliką kodu genetycznego.
Zadanie 1.6
Który z przedstawionych poniżej układów nukleotydów w DNA pozwoli na zainicjowanie i
zakończenie transkrypcji podanych sekwencji.
a)
5’ A A A C G C A C G T A A T T T G T C G G G C C C A T C 3’
b)
3’ T A C T A C A G C A T A T T T G G C C T T A T T 5 ‘
Wypisz wynik transkrypcji i translacji w obu przypadkach.
Odpowiedzi do zadań
Ad1. 606/ może być więcej
Ad2. 429/może być tej samej długości lub dłuższy/ o trzy nukleotydy dłuższy
Ad3. 3’-5’/5’UAGAAAUGCGAU 3’/….
Ad4. 3’-5’/ 5’ AGU GGG GAG AAU AGU 3’
Ad5. ….
Ad6.
a) 5’ GAU GGG CCC GAC AAA UUA CGU GCG UUU 3’ brak kodonu rozpoczynającego translację
b) 5’ AUG AUG UCG UAU AAA CCG GAA UAA 3’ kodon START- met- ser- tyr- lys- pro- glu-
kodon STOP
21
2. Podziały komórkowe. Chromosomy
Autor: Andrzej Życzyński
Chcąc zrozumieć genetykę– naukę o zasadach i skutkach dziedziczenia, musimy w pierwszej
kolejności uzmysłowić sobie podstawowy mechanizm przekazywania informacji genetycznej,
pomiędzy kolejnymi generacjami komórek. Mechanizm ten gwarantuje generacjom somatycznym
odziedziczenie dokładnej kopii genów komórek rodzicielskich, a generacjom płciowym przekazanie
połowy kopii materiału rodzicielskiego i to w taki sposób, by zapewnić maksymalną różnorodność
docelowych kombinacji. Obydwa warianty przekazywania informacji genetycznej, zawartej w DNA–
kwasie dezoksyrybonukleinowym, wchodzącym w skład jądra komórkowego, realizowane są w
trakcie podziałów komórkowych, zwanych odpowiednio mitozą i mejozą.
Znajomość przebiegu obu podziałów jest niezbędna dla rozumienia genetyki, dlatego
prezentujemy krótkie przypomnienie, odwołujące się w dużej części do materiału wyniesionego przez
Studentów ze szkoły średniej.
Okres poprzedzający podział mitotyczny zwany jest interfazą. Wówczas DNA, zgodnie z
niesioną informacją genetyczną realizuje zadania potrzebne komórce poprzez syntezę odpowiednich
białek. Gdy zabarwimy komórkę np. standardowym barwnikiem Giemsy, łączącym się
powierzchniowo z DNA, w polu widzenia zobaczymy fioletowe jądro, zwykle- choć nie zawszekrągłego kształtu (fot. 2.1), pokryte równomiernie barwnikiem. W skład tego jądra wchodzą gęsto
upakowane nici chromatynowe. Nić chromatynową tworzy podwójna helisa DNA, nawinięta na wzór
struktury paciorkowej na białka histonowe, tworzące wraz z DNA nukleosomy. Każdy gatunek posiada
swoją własną liczbę tych nici chromatynowych, które odziedziczył po połowie od każdego z rodziców.
Wielkość tę określamy jako 2n, co odpowiada statusowi diploidalnemu organizmu. Oznacza to, że od
każdego rodzica w drodze rozrodu płciowego otrzymujemy po 1n nici chromatynowych. Ilość DNA
(np. wyrażona w piktogramach) zawartego w 2n niciach jest również charakterystyczna dla każdego
gatunku. Umownie określamy ją symbolem 2C. Wielkości 2C mogą znacznie różnić się u
poszczególnych taksonów. Wartość 2C jest szczególnie wysoka u płazów– zwłaszcza ogoniastych
Urodela. Neoteniczny odmieniec amerykański Necturus maculosus ma prawie 28 razy więcej DNA niż
mysz Mus musculus a traszka Triturus viridescens 13 razy [Mirsky, Ris 1951].
2.1. Mitoza
Bezpośrednio przed podziałem komórka przechodzi przez tzw. fazę G1. Jest to ważna część
interfazy, przygotowująca jądro do podziału. Następuje w niej wytworzenie odpowiedniej puli
nukleotydów do syntezy DNA i potrzebnych aminokwasów. Towarzyszy temu aktywacja
odpowiednich enzymów oraz nagromadzenie źródeł energii. Po zakończeniu G1 następuje faza S,
czyli faza syntezy DNA. Przebieg syntezy omawiany jest zazwyczaj dokładnie w ramach przedmiotu
22
Biochemia. W wyniku fazy S każda nić chromatynowa zostaje powielona i występuje w dwóch,
pozostających ze sobą w fizycznym kontakcie, identycznych kopiach. Oznacza to, że wartość 2n
pozostaje taka sama (mamy dalej 2n fragmentów, lecz już dwukrotnie grubszych– efekt przylegania
do siebie obu identycznych nici po fazie S), lecz wskutek podwojenia ilości DNA, w jednostkach [C]
dochodzimy do wartości 4C. Jest to ważna informacja, której znaczenie bywa zazwyczaj
niedostrzegane przez Studentów. Jeśli po podziale somatycznym (mitoza) z komórki rodzicielskiej (2n
i 2C) mamy otrzymać dwie identyczne komórki potomne, to zgodnie z zasadami arytmetyki wielkość
dzieloną na dwie połowy należy najpierw pomnożyć przez 2. Tak więc posiadająca wciąż 2n
fragmentów chromatyny (podwójnych po fazie S) komórka ma już 4C DNA. Gdy przeglądamy
zabarwiony barwnikiem Giemsy preparat łatwo odróżniamy takie komórki od opisanych wcześniej.
Jądro komórkowe jest znacznie większe, przybiera regularny okrągły kształt a intensywność pokrycia
barwnikiem jest mniejsza, przez co wydaje się jaśniejsze.
Komórki takie nazywamy pobudzonymi a ich duża ilość w polu widzenia mikroskopu dobrze rokuje
osobie poszukującej materiału w dalszych fazach podziałowych (fot. 2.25).
Po zakończeniu fazy S następuje krótka faza G2 (obejmująca syntezę wrzeciona
podziałowego) a po niej rozpoczyna się profaza. Jej istotą jest kondensacja chromatyny. Następuje to
w wyniku tworzenia kolejnych splotów chromatyny o zwiększonych średnicach. Wskutek ciągłego
pogrubiania (procesu kontrolowanego przez histonowe i niehistonowe białka) długość fragmentów
chromatyny maleje. W pewnym momencie stopień kondensacji chromatyny jest tak duży, że zaczyna
wyraźnie załamywać przechodzące przez nią światło lampy mikroskopowej. Od tego momentu
fragmenty chromatyny, widoczne pod mikroskopem świetlnym zaczynamy nazywać chromosomami,
chociaż pojęcie to bywa stosowane już wobec interfazowych nici chromatynowych (chromosomy
interfazowe). Początkowo widzimy je w postaci ziarninowania na obszarze jądra (fot. 2.26), potem
jako struktury wyraźne podłużne. Jest ich 2n i każda składa się z dwóch chromatyd siostrzanych (efekt
fazy S). W miarę upływu czasu chromosomy kurczą się coraz bardziej a pod koniec profazy
chromatydy siostrzane (dwie przylegające do siebie, kondensujące nici) zaczynają oddzielać się od
siebie. Pozostają połączone w tzw. przewężeniu pierwotnym- centromerze. Daje nam to możliwość
morfologicznego opisu chromosomu. Centromer dzieli chromosom na dwa ramiona– dłuższe- q i
krótsze– p. W zależności od wzajemnego stosunku długości obu ramion q : p, chromosomy dzielone
są na metacentryczne 1.0- 1.7, submetacentryczne 1.7– 3, subtelocentryczne 3.01– 7.0, oraz
telocentryczne >7.0 [Levan i wsp. 1964]. Innym parametrem stosowanym w opisie chromosomu jest
jego długość względna. Oznacza ona stosunek zmierzonej na preparacie długości chromosomu do
długości całego haploidalnego zestawu chromosomów. Suma haploidalnego zestawu obliczana jest
po dodaniu zmierzonych długości chromosomów osobnika płci homogametycznej (żeńskiej u ssaków)
i podzieleniu tej sumy przez 2. Tam gdzie chromosomy płci (np. u większości płazów czy ryb) nie
23
różnią się morfologicznie między sobą, niezależnie od systemu XX/XY czy ZZ/ZW (vide rozdział 4),
wybór płci do oznaczenia długości haploidalnej genomu nie ma znaczenia. Niektórzy badacze
wyrażają względną długość chromosomu jako stosunek jego długości do długości ramienia q
chromosomu z pierwszej, największej pary.
Obok centromeru, w niektórych chromosomach wyróżniamy przewężenie wtórne. W
miejscach tych zlokalizowane są geny kodujące RNA rybosomalny– rRNA o stałych sedymentacji 5.8S,
18S i 28S. Jeśli geny te były aktywne w interfazie poprzedzającej podział komórki, to w trakcie
spiralizacji prowadzącej do opisanej wcześniej wizualizacji chromosomów, kondensacja chromatyny
zawierającej te loci jest opóźniona. Wówczas, gdy oglądamy konwencjonalnie zabarwiony
chromosom, widzimy pozorne przerwanie jego ciągłości. Obszar chromosomu pomiędzy owym
przerwaniem a właściwie przewężeniem i telomerem nazywamy satelitą. Należy powtórzyć, że
przewężenie wtórne będzie widoczne jedynie w tych komórkach, w których geny rDNA
(jąderkotwórcze– odpowiedzialne za tworzenie się tych organelli komórkowych) były aktywne przed
cyklem podziałowym. Tak więc konwencjonalne barwienia, pokazujące sam kształt chromosomu, nie
we wszystkich przypadkach mogą pokazać lokalizację rejonów jąderkotwórczych– NOR (Nucleolus
Organizer Region). Na szczęście są metody barwienia (vide podrozdział „Podstawowe metody
barwienia chromosomów”) pozwalające na zmapowanie genów rDNA niezależnie od ich aktualnej czy
przeszłej aktywności a więc od obecności przewężenia wtórnego i leżącego za nim satelity. Oprócz
obu ramion chromosomu, centromeru oraz obszaru NOR (w tych gdzie są zlokalizowane geny rDNA),
w chromosomach wyróżniamy struktury telomerowe. Stanowią one oba końce chromosomów i
zabezpieczają je przed uszkodzeniami. Dokładne badania wykazały, że w DNA telomerowym
większości organizmów wielokomórkowych można wyróżnić motyw TTAGGG, powtórzony kilkaset
razy i zorientowany w kierunku końca 3’, tworzący jednoniciowe zakończenie chromatydy. Związane
z powtarzającymi się sekwencjami białka telomerowe, wraz z nukleosomami, tworzą tzw. białkową
czapeczkę, chroniącą chromosom przed uszkodzeniami na wzór sztywnej okładki w książce. Sposób
replikacji DNA okolic telomerowych Czytelnik znajdzie szczegółowo opisany w podręczniku „Genomy”
Browna.
Po zakończeniu profazy rozpoczyna się metafaza. W jej trakcie stopniowo zanika błona jądra
komórkowego a same chromosomy ustawiają się w płaszczyźnie środkowego przekroju komórki,
zwanej też płaszczyzną równikową. Tak dokładnie to w płaszczyźnie tej ustawiają się centromery
chromosomów, pozostając w równej odległości od obu biegunów komórki. W trakcie metafazy
kondensacja chromosomów trwa dalej (stają się więc coraz krótsze) a chromatydy siostrzane coraz
bardziej rozchylają się od siebie- w rejonach telomerowych– fot.2.1. Efektem tego rozchylania jest
przybieranie przez chromosomy meta i submetacentryczne postaci litery X a przez chromosomy
subtelo- i telocentryczne kształtu litery V.
24
Fotografia 2.1. Metafazy mitotyczne pstrąga tęczowego (Oncorhyncus mykkis). Barwienie konwencjonalne
barwnikiem Giemsy. W polu widzenia znajdują się trzy płytki metafazowe– patrząc z dołu od prawej strony
widzimy wczesną metafazę– chromosomy długie, chromatydy siostrzane przylegają do siebie, potem starszą–
chromosomy krótsze a stopień rozchylenia chromatyd większy. W lewym górnym rogu metafaza najstarsza, tuż
przed anafazą– chromosomy bardzo skondensowane, najkrótsze a chromatydy siostrzane szeroko rozwarte.
Widoczne również niepobudzone jądra interfazowe. (A. Życzyński)
Metafaza mitotyczna jest dogodnym momentem do analizy chromosomowej. Dysponując
czytelnym (chromosomy są w polu widzenia rozproszone i nie zachodzą na siebie) preparatem,
możemy je policzyć i poukładać w pary homologiczne, budując tzw. kariotyp. Gdy chromosomy
poszczególnych par są dobrze rozróżnialne na podstawie kształtu i wielkości, do konstrukcji kariotypu
wystarczy konwencjonalne barwienie barwnikiem Giemsy. Niestety u wielu gatunków (między innymi
myszy, człowieka, bydła i psów) wiele chromosomów niehomologicznych ma wygląd identyczny,
uniemożliwiający ich bezpośrednią identyfikację. Wówczas należy posłużyć się różnymi metodami
barwień różnicujących. Wykonanie tych barwień utrudnia wysoki stopień kondensacji chromatyny,
stąd najlepsze wyniki uzyskuje się przy chromosomach późnej profazy lub bardzo wczesnej metafazy,
gdy wydłużone chromatydy siostrzane nie są jeszcze rozdzielone.
Kulminacyjnym momentem podziału jest anafaza. Wytworzone wrzeciono podziałowe łączy
centromery chromosomów z biegunami komórki i kurcząc się rozciąga do obu biegunów chromatydy
siostrzane. Każdy chromosom, reprezentowany do tej pory przez dwie identyczne chromatydy
siostrzane, zostaje rozerwany po pęknięciu centromeru na dwie połowy, stające się od tej chwili
samodzielnymi, jedno-chromatydowymi chromosomami (siostrzanymi). Jedno-chromatydowe
chromosomy, odciągnięte przez wrzeciono do biegunów komórki wyjściowej, tworzą dwa jądra
25
przyszłych komórek potomnych. Ich liczba dalej wynosi 2n a więc pozostaje bez zmian. Ponieważ są
one już jedno-chromatydowe, ilość DNA w jądrze pochodnym znów wynosi 2C a więc wraca do
wielkości początkowej, charakterystycznej dla danego gatunku. Cały cykl podziałowy kończy telofaza,
w której zachodzą procesy odwrotne do profazy, czyli dekondensacja chromatyny, odbudowanie
błony jądrowej i następuje podział cytoplazmy komórki wyjściowej oraz zamknięcie błoną
komórkową obu komórek pochodnych.
2.2. Informacje o chromosomach wybranych gatunków
Jak wspomniano poprzednio, chromosomy późnej profazy oraz metafazy są wykorzystywane
do podstawowej charakterystyki genomu danego gatunku. Uzyskane czytelne preparaty służą po
wybarwieniu do sporządzania tzw. kariotypów, gdzie po ułożeniu chromosomów w pary– sporządza
się stosowną dokumentację. Obejmuje ona ustalenie liczby 2n, opis morfologiczny chromosomów,
oraz, po wykorzystaniu bardziej zaawansowanych technik mapowania, lokalizację poszczególnych
genów– ustalanie ich loci w chromosomach. Dodatkowym parametrem opisującym konkretny
kariotyp może być wartość NF (Nombre Fundamentale, Fundamental Number), czyli liczba
podstawowa. Oznacza ona liczbę ramion (widocznych rozgałęzień). Zgodnie z definicją NF każdy
chromosom meta i submetacentryczny ma dwa ramiona (rozgałęzienia) a chromosomy subtelo i
telocentryczne po jednym. NF bywa użyteczna przy porównawczej analizie chromosomów
spokrewnionych gatunków, pokazując wzajemne relacje kariotypowe przy uwzględnieniu
przekształceń drogą fuzji i fizji centrycznych, a także pomaga przy interpretacji mniej czytelnych
preparatów. Poniżej przedstawiamy informacje o kariotypach wybranych gatunków zwierząt.
2.2.1. Bydło domowe Bos taurus 2n=60, XY
Wartość 2n=60, wartość NF=62. 29 par chromosomów autosomalnych ma postać
jednoramienną a różnice w rozmiarach mają charakter dyskretny (fot. 2.2). Utrudnia to identyfikację
poszczególnych par na podstawie wyglądu morfologicznego, nawet przy użyciu metody cytometrii
przepływowej. W parze chromosomów płciowych wyróżniamy duży submetacentryczny chromosom
X oraz mały metacentryczny Y. Chromosom ten ma charakter polimorficzny zarówno w odniesieniu
do wielkości jak i samego kształtu. U pewnych ras bydła jego względna długość jest bardzo mała (rasa
Romagnol) a u innych (Charolais) prawie dwukrotnie dłuższa niż przeciętny bydlęcy Y (ponad połowa
długości chromosomu X). Względne rozmiary Y nie mają u bydła wpływu na zdolności reprodukcyjne
[9; 24]. Wspomniany polimorfizm kształtu chromosomu Y obserwujemy porównując kariotyp bydła
domowego europejskiego (Bos taurus) z indyjskim bydłem zebu (Bos indicus). U zebu chromosom Y
jest subtelocentryczny, podobnie jak u amerykańskiego bizona (Bison bison). Tymczasem ten sam
chromosom u europejskiego żubra (Bison bonasus) jest submetacentrykiem [Fedyk, Sysa 1971]. Dane
26
te wskazują, że o ile u wszystkich tych gatunków wartość 2n=60 to NF może być zmienne (u samic
zawsze NF=62 a u samców w zależności od taksonu wynosi odpowiednio 61 lub również 62). Różnice
kształtu chromosomów Y u obu podgatunków bydła domowego interpretowane są jako efekt inwersji
pericentrycznej (vide inwersje).
Fotografia2.2. Kariotyp krowy. 60,XX. Widoczna para chromosomów płciowych XX. Pozostałe chromosomy są
jednoramienne, trudne do rozróżnienia. Stąd przy konwencjonalnym barwieniu barwnikiem Giemsy
zestawianie par homologów jest arbitralne. (P. Sysa niepublikowane)
2.2.2. Owca domowa Ovis aries 2n=54, XY
U gatunków należących do rodzaju Ovis obserwujemy polimorfizm ilościowy, wyrażający się
zmienną wartością 2n. U gatunków Ovis vignei 2n = 58, O. ammon 2n=56, O. aries (owca domowa),
(fot.2.3), O. canadensis, O. dalli, O. musimon, O. orientalis 2n=54 a u O. nivicola 2n=52 [KozubskaSobocińskan i wsp. 2006]. Porównując kariotyp owiec z bydlęcym czy kozim można wykazać między
nimi podobieństwo. Zmniejszającej się wartości 2n o jeden towarzyszy pojawienie się jednego
chromosomu dwuramiennego w miejsce dwóch jednoramiennych. Tak więc owca domowa przy 2n =
54 posiada o 6 chromosomów mniej niż koza lecz za to 3 pary chromosomów submetacentrycznych.
Jest to efekt fuzji centrycznych pomiędzy chromosomami niehomologicznymi. Dalsze fuzje
centryczne wykryto również u różnych ras owcy domowej O. aries, co jest przyczyną polimorfizmu
wewnątrz i międzyrasowego[Sysa 1982]. U 4.6% populacji nowozelandzkiej rasy Romney wykryto
translokację między chromosomami pary 5 i 26 a u dalszych 4% translokację między parą 8 i 11. Z
27
kolei 27% osobników rasy Drysdale było nosicielami translokacji między chromosomem pary 7 a 25.
Wszyscy nosiciele pojedynczej (heterozygotycznej) translokacji mieli więc zamiast 6, 7 chromosomów
dwuramiennych a wartość 2n=53. Na drodze krzyżowań owiec nosicieli tych translokacji,
wyprowadzono formy mające wszystkie trzy translokacje na raz w formie homozygotycznej.
Sprowadziło to wartość 2n do poziomu 48 (6 par submetacentryków zamiast 3). Oczywiście nie
wpłynęło to na wartość NF. Wartość ta jest u owiec mniejsza w porównaniu do bydła i wynosi NF = 60
u maciorek a 61 u tryków, gdyż chromosom X jest jednoramienny. Jego kształt interpretuje się jako
wynik inwersji pericentrycznej chromosomu X typu bydlęcego. Szczegółowe badania wzorów
prążkowych ujawniły jeszcze obecność inwersji paracentrycznej w rejonie ramienia q 9 pary, co
różnicuje dodatkowo kariotypy bydła/kóz od owczych [Hayes i wsp. 1991]. Obecne poglądy uznają
formę 2n=60 jako podstawową dla Bovidae a zmienne wartości 2n u poszczególnych gatunków są
wynikiem rearanżacji chromosomowych, (głównie fuzji centrycznych) mających miejsce w toku
ewolucji.
Fotografia 2.3. Kariotyp owcy domowej. 2n = 54,XY. 3 pary chromosomów dwuramiennych (co zredukowało
filogenetycznie pierwotną wartość 2n=60 o 6). U góry kariotyp tryka (XY) u dołu maciorki (XX). Chromosom Y
jest małym metacentrykiem podobnie jak u buhaja (morfologia Y nieczytelna na zdjęciu). Chromosomy X są
jednoramienne (efekt inwersji pericentrycznej submetacentrycznego chromosomu X typu bydlęcego. Barwienie
konwencjonalne barwnikiem Giemsy. (E. Słota– dzięki uprzejmości Autorki)
28
2.2.3. Inne parzystokopytne
Koza (Capra hircus) posiada chromosomy identyczne morfologicznie z bydłem domowym
(2n=60,XY) lecz chromosom X jest akrocentryczny podobnie jak u owcy. Stąd wartość NF=60 u kóz i
61 u kozłów.
Podobny do owiec polimorfizm wewnątrzgatunkowy opisano u jelenia Dybowskiego (Cervus nippon
hortulorum) [Caspersson i wsp 1968; Jaszczak i wsp. 2004]. U form o 2n=68 (fot. 2.4) stwierdzono
jedną parę chromosomów dwuramiennych, u 2n=67 były trzy chromosomy dwuramienne a u 2n=66,
cztery. U wszystkich podgatunków tego jelenia wartość NF=70.
Fotografia 2.4. Metafaza mitotyczna jelenia Dybowskiego (Cervus nippon hortulorum). 2n=68,XY. Strzałkami
oznaczono chromosomy metacentryczne (jedna para) oraz wybarwione azotanem srebra rejony
jąderkotwórcze (5 chromosomów). (R. Parada– dzięki uprzejmości Autora)
2.2.4. Koniowate
Rodzina koniowatych (Equidae) charakteryzuje się zarówno zmiennymi wartościami 2n jak i
NF. Wahają się one w przedziale od 2n=32,XY u zebry Hartmanna (Equus zebra hartmannae) do
2n=66,XY u konia Przewalskiego (Equus Przewalski). Koń domowy (Equus caballus) ma 64
chromosomy (fot. 2.5), zebra nizinna (E. burchelli boehmi) 44 a osioł (E. assinus) 62. U osła wartość
NF jest najwyższa i wynosi 102 [Power 1984]. Kułan (E. kulan) posiada 2n=54,XY, kiang (E. kiang)
2n=52,XY a onager (E. h. onager) 2n=56,XY [Musilova i wsp 2008]. Różnice między kariotypami kianga
i kułana spowodowane są rearanżacjami pięciu chromosomów typu obrazu kariotypowego kułana.
Jeden (homolog 2 chromosomu konia domowego) uległ centralnej fizji a cztery pozostałe uległy
dwóm centralnym fuzjom– homologi 8q i 15 chromosomów konia domowego oraz homologi 7 i 15
konia domowego utworzyły nowe chromosomy, sprowadzając tym samym 2n=54 kułana do 2n=52
kianga. Pozostałe pary autosomów obu gatunków są identyczne. Ilość DNA (wartość 2C) u wszystkich
gatunków koniowatych jest podobna, lecz zmienna NF świadczy, że rearanżacje chromosomowe nie
29
ograniczały się jedynie do fuzji/fizji centrycznych. Utrudnia to prawidłową koniugację odcinków
homologicznych podczas mejozy u mieszańców międzygatunkowych, co sprawia, że są one w
większości bezpłodne.
Fotografia 2.5. Metafaza mitotyczna konia. 2n=64,XX. Barwienie konwencjonalne barwnikiem Giemsy. (M.
Bugno niepublikowane. Dzięki uprzejmości Autorki)
2.2.5. Świnia domowa Sus scrofa dom. L. 2n=38, XY
Garnitur chromosomowy u świń (fot. 2.6 i 2.7) jest zróżnicowany morfologicznie. Na wartość
2n=38 składają się zarówno chromosomy dwuramienne jak i jednoramienne– 6 par, w różnych
kategoriach wielkościowych. Europejski dzik (Sus strofa ferus) odznacza się polimorfizmem– 2n=36
lub 38. Porównanie obu form wykazało, że przyczyną różnic jest fuzja centryczna pomiędzy
chromosomami pary 15 i 17 (według numeracji kariotypu świni) u dzika, chociaż interpretacja, że
udomowieniu świni towarzyszyła fizja (rozszczepienie pary metacentryków na dwie pary
subtelocentryków) jest równie przekonywująca. U dzików środkowoazjatyckich (Sus strofa nigripes)
(2n=36) stwierdzono, że jedna para metacentryków odpowiada chromosomom par 16 i 17 świni
domowej.
Fotografia 2.6. Kariotyp świni domowej (Sus strofa)– maciory. 2n=38,XX. Oznaczono dwa chromosomy X.
Barwienie konwencjonalne barwnikiem Giemsy. (P. Sysa– niepublikowane)
30
Fot. 2.7. Kariotyp świni domowej (Sus strofa)– knura: 38,XY. Widoczna para heterochromosomów płciowych.
Chromosom Y jest małym metacentrykiem. Barwienie konwencjonalne barwnikiem Giemsy. (P. Sysa–
niepublikowane)
U wielu gatunków zwierząt w garniturach chromosomowych występują tzw. mikrochromosomy.
Spotykamy je u psowatych, ptaków, żółwi a także u niektórych płazów.
Niektórzy interpretują je jako pozostałości po zajściach fuzji centrycznych. Małe rozmiary utrudniają
identyfikację morfologiczną a zmienna liczba staje się źródłem polimorfizmu a nawet mozaicyzmu
chromosomowego międzykomórkowego (mozaicyzmem określa się obecność w jednym organizmie 2
lub większej liczby autogenicznych linii komórkowych o różnym genotypie).
2.2.6. Chromosomy ptaków
U kur (2n = 78ZW) stwierdzono 30 par mikrochromosomów, zawierających aż 50% genów z
całego genomu [Burt 2002]. Z uwagi na trudności w ich analizowaniu, zwykło się opisywać jedynie
pary największych – makrochromosomów (w tym para chromosomów płciowych ZW) – fot. 2.8, 2.9 a,
b.
Fotografia 2.8. Metafaza mitotyczna głuszca (Tetrao urogallus). 18 makrochromosomów w tym nieoznaczona
para chromosomów płci ZW. Barwienie konwencjonalne barwnikiem Giemsy. Widoczne liczne
mikrochromosomy. (R. Parada– niepublikowane)
31
a
b
Fotografia 2.9. a) Płytka metafazalna gęsi kubanieckiej (Anser cygnoides). 2n = 80,ZW; b) Częściowy kariotyp
gęsi wraz z parą chromosomów płciowych. Barwienie RBG. (E. Wójcik– rozprawa doktorska)
2.3. Chromosomy płci
Chromosomy dzielimy na autosomy oraz chromosomy płci. Tym ostatnim warto poświęcić
osobną uwagę.
Chromosomy płci powstały ewolucyjnie z autosomów, gdy na nich zebrały się kluczowe geny,
odpowiedzialne za determinację płciowego fenotypu. Należy jednak dodać, że w wielu przypadkach
można wyróżnić geny odpowiedzialne za współtworzenie fenotypu płciowego, których loci znajdują
się na autosomach.
Rozróżniamy wiele systemów chromosomowej determinacji płci. Jedna płeć jest zazwyczaj
homogametyczna (z identycznym zestawem chromosomów płciowych) a druga heterogametyczna z
chromosomami płciowymi różnymi. Różnice pomiędzy obydwoma rodzajami płci mogą polegać na
różnej liczbie chromosomów płciowych (chromosomy płciowe wielokrotne), różnym składzie loci
genowych, bądź na braku któregoś chromosomu. U pszczół obydwie płcie różnią się stopniem
ploidalniości– samice (2n) powstają z zapłodnionych jaj a haploidalne samce (trutnie) z jaj
niezapłodnionych. Okazało się, że zjawisko to u pszczół jest znacznie bardziej złożone a jego tajniki
odsłonił polski uczony, wieloletni wykładowca SGGW, profesor Jerzy Woyke. Wykazał, że płeć zależy
od składu jednego autosomalnego locus, bardzo polimorficznego (około 10 alleli) oznaczonego jako X
[29]. Heterozygotyczność w tym locus prowadzi do powstania samicy a homozygotyczność daje
samca. Samce te (2n) są zjadane przez robotnice 4 godziny po wykluciu się z jaj. Tylko haploidalne
trutnie są tolerowane. Po liczbie pustych stanowisk w czerwiu można ustalić frekwencję alleli
płciowych (na podstawie frekwencji zniszczonych homozygot), przy założeniu spełnienia warunku
równowagi genetycznej.
32
Wyjątkowa złożoność systemów chromosomowej determinacji płciowej występuje w
gromadzie ryb, gdzie naliczono przynajmniej 9 różnych genetycznych (są również inne–
środowiskowe) mechanizmów determinacji płciowej, w tym aż 8 chromosomowych [Tave 1986].
Zazwyczaj jednak mamy do czynienia z jedną parą chromosomów płciowych. Gdy płcią
homogametyczną jest żeńska a heterogametyczną męska to system ten oznaczamy symbolami
XX/XY. Gdy jest odwrotnie używamy symboli ZZ/ZW. Oczywiście symbole te nie mają nic wspólnego z
kształtem chromosomów, uzyskiwanym podczas kondensacji chromatyny i rozchylania się chromatyd
siostrzanych! Należy dodać, że różne chromosomy płciowe mogą, choć nie muszą różnić się
morfologicznie. Jeśli różnice w budowie tych chromosomów występują– to płeć homogametyczna ma
dwa identyczne chromosomy płciowe a heterogametyczna dwa różne. Jednak u wielu gatunków
zwierząt o chromosomowej determinacji płci owe chromosomy są nierozróżnialne morfologicznie.
Tam, gdzie mamy do czynienia z jedną parą chromosomów płciowych, rozróżnienie systemu XX/XY
od ZZ/ZW możliwe jest po zastosowaniu kojarzeń testowych przy użyciu osobników o odwróconej
płci, po zastosowaniu hormonów androgenowych lub estrogenowych. Na szczęście hormonalne
odwracanie płci jest łatwe i skuteczne u zwierząt o zewnętrznym zapłodnieniu (większość płazów i
ryb), gdzie rozwój embrionalny nie odbywa się pod „ochronnym parasolem” łożyska. A właśnie tam
najczęściej nie możemy chromosomów płciowych odróżnić morfologicznie od siebie. I tak dla
przykładu, kiedy ikrę/skrzek będziemy inkubować w środowisku androgenowym (można też dodawać
hormony do paszy) otrzymamy całe pokolenie męskie. Połowa samców będzie miała płeć naturalną
(genotypy XY bądź ZZ– tego jeszcze nie wiemy) a statystyczna druga połowa to genetyczne samice XX
bądź ZW o męskim, funkcjonalnym fenotypie. Gdy takie odwrócone samce, po osiągnięciu dojrzałości
płciowej, użyjemy do rozrodu, uzyskamy różny (niż 1 : 1) rozkład płci potomstwa. W przypadku
systemu XX/XY kojarzenie odwróconego (androgenami) samca XX z normalną samicą XX da nam w
efekcie wyłącznie żeńskie potomstwo (brak w takiej populacji chromosomu Y). Jakość konsumpcyjna
samic pstrąga tęczowego jest lepsza niż samców, dlatego producenci wykorzystują ten manewr na
farmach produkcyjnych, produkując wyłącznie żeńskie populacje na potrzeby tuczu. Jeżeli badany
gatunek odznacza się systemem ZZ/ZW to androgenizowane (odwrócone) samce ZW skojarzone z
normalnymi samicami ZW dadzą potomstwo (ZZ, ZW, WZ, WW) w statystycznym stosunku 1 : 3 na
korzyść samic.
Dla odmiany zastosowanie bodźca estrogenowego prowadzi do uzyskania populacji żeńskiej
(połowa samic normalnych XX bądź ZW i połowa odwróconych samic XY lub ZZ). Jeśli odwrócona
samica ma genotyp ZZ, to skojarzona z normalnym samcem (ZZ) wytworzy potomstwo wyłącznie
męskie (brak chromosomu W). Jeśli odwrócona samica ma genotyp XY to po skojarzeniu z
normalnym samcem (też XY) da potomstwo (XX, XY, YX, YY) w stosunku 3: 1 na korzyść samców (u ryb
i płazów formy YY mogą być żywotne). Tak więc pośrednio dostarczy informacji o rodzaju
33
chromosomów płciowych w swoim gatunku. Okazało się, że nawet blisko spokrewnione gatunki, a
nawet różne populacje tego samego gatunku (rodzina piękniczkowate- Pecilidae) mogą różnić się
systemem chromosomowej determinacji płciowej [Tave 1986]. Jeśli chodzi o główne gatunki ryb
użytkowane gospodarczo w systemie fermowym, to łososiowate- Salmonidae oraz karpiowateCyprinidae mają system XX/XY, podobnie jak ssaki. Dla odmiany rodzina węgorzowatych- Anguillidae
charakteryzuje się systemem ZZ/ZW.
W świecie płazów widoczny heteromorfizm chromosomów płciowych stwierdzono zaledwie u
około 25 gatunków, w większości (20 gatunków) u płazów ogoniastych- Urodela. U pozostałych
system ten należy rozszyfrowywać, jak opisano to powyżej Podobnie jest u ryb. Występowanie
wstępnego stadium zróżnicowania morfologicznego chromosomów płciowych stwierdzono u pstrąga
tęczowego (Oncorhyncus mykkis)– gatunku o dużym znaczeniu gospodarczym [Thorgaard 1977].
Niemniej różnica ta w postaci nieznacznie krótszego ramienia p chromosomu Y nie zawsze jest
widoczna na preparatach. Nie występuje też u wszystkich osobników. Przypadek pstrąga tęczowego
możemy uznać za wyjątkowy. Najczęściej nie potrafimy nawet rzeczonych chromosomów odróżnić
od autosomów. Biwalent płciowy ma normalną budowę i podlega swobodnie zjawisku rekombinacji.
O kolejnym wyjątku ze świata ryb (gdzie jak wspomniano, z reguły chromosomy płci są
nierozróżnialne morfologicznie) doniósł polski zespół, prowadzący badania nad ciernikiem (Pungitius
pungitius). Stwierdzono występowanie u samic pary dużych metacentryków. Natomiast u samców
występował jeden metacentryk tej pary oraz jeden bardzo duży (największy w całym garniturze)
submetacentryk, nie mający swego morfologicznego homologa. Zdefiniowany został jako chromosom
Y [Ocalewicz I wsp. 2008].
Jako niewątpliwą ciekawostkę należy traktować dwa znane dotychczas nauce przypadki
równoczesnego występowania obu systemów XX/XY oraz ZZ/ZW jednocześnie u tego samego
gatunku. Stwierdzono to u popularnej rybki akwariowej zmienniaka plamistego, inaczej platki
(Platypecilus maculatus) [Gordon 1947] oraz japońskiej żaby Rana rugosa [Miura i wsp. 1996]. W
pierwszym przypadku w chromosomie X powstała mutacja blokująca aktywność genów
determinujących płeć męską, położonych w Y. Zmutowany X przeobraził się w nowy, pod względem
swej roli, chromosom W. W konsekwencji samce mogą powstać przy konfiguracjach XY oraz YY
natomiast wszystkie pozostałe czyli XX, WX i WY dadzą samice. Powstanie różnych chromosomów u
japońskich żab jest wynikiem inwersji pericentrycznych, które wystąpiły w przeszłości.
U innych zwierząt wskazanie chromosomów płciowych jest proste. U muszki owocowej
(Drosophila melanogaster) mamy system XX/XY z dobrze widoczną parą płciową, lecz ostateczne
ukształtowanie płci zależy też od stosunku ilościowego autosomów do chromosomów płciowych.
U ssaków, w tym gatunków gospodarskich, mamy system XX/XY. Odróżnienie chromosomów
płciowych nie jest trudne, o czym świadczą załączone fotografie. Zazwyczaj wystarcza barwienie
34
konwencjonalne, (vide podrozdział poświęcony różnicowemu barwieniu chromosomów) pokazujące
kształt i wielkość chromosomów. U człowieka chromosom Y ma podobną wielkość do autosomów par
21 i 22. Niemniej jego chromatydy siostrzane nie rozchylają się nadmiernie i w obrazie metafazalnym
pozostają mniej więcej równoległe od odcinka centromerowego do telomerów. Ta więc stopień
rozwarcia chromatyd pozwala na precyzyjne określenie Y, w przeciwieństwie do wspomnianych
autosomów par 21 i 22, gdzie dla ich określenia potrzebne jest zastosowanie metod barwienia
różnicowego. Jak wspomniano wcześniej bydło domowe europejskie ma chromosomy płci
dwuramienne. U bydła i owiec jedynie na chromosomach płciowych brak pozytywnego prążka C (fot.
2.14) co bywa też przydatne przy kariotypowaniu owiec i kóz, gdzie X ma podobnie do autosomów
kształt akrocentryczny. U koni chromosom X wyróżnia się na tle autosomów brakiem
centromerowego prążka C a bardzo mały Y ma duży blok pozytywnie wybarwiony C. U trzody
chlewnej sama procedura barwienia prążkami C nie wystarcza do jednoznacznego wskazania X.
W odróżnieniu od ssaków ptaki charakteryzuje system ZZ/ZW (fot. 2.9b). U drobiu – zarówno
grzebiącego jak i pływającego chromosomy płci są łatwo rozróżnialne. Nie jest to jednak właściwość
uniwersalna dla wszystkich ptaków. Nieloty (zwane dawniej bezgrzebieniowcami) mają chromosomy
Z i W identyczne morfologicznie, z podobnym rozmieszczeniem euchromatyny i heterochromatyny,
co uniemożliwia ich identyfikację na podstawie wzorów prążkowych bądź analiz cytofotometrycznych
[Tagaki i wsp. 1972; Ansari i wsp. 1988]. Zróżnicowaniu morfologicznemu pary chromosomów
płciowych towarzyszy zróżnicowanie loci genowych. Na pewnych odcinkach tych chromosomów
(rejony pseudoautosomalne PAR) skład genetyczny obu chromosomów jest identyczny. Umożliwia to
koniugację tych rejonów podczas mejozy I (fot. 2.22), oraz zachodzenie rekombinacji- crossing over.
Geny z loci tych rejonów dziedziczą się według normalnych reguł autosomalnych, w przeciwieństwie
do genów z loci z rejonów heteromorficznych– vide rozdział 6. U człowieka rejon PAR obejmuje końce
ramion p chromosomów X i Y. Blisko rejonu PAR u człowieka znajduje się gen SRY (Sex Determining
Region of Y) odpowiedzialny za powstawanie jąder. Chromosom Y (poza płazami i rybami, gdzie w
większości przypadków oba płciowe homologi nie różnią się morfologicznie) jest mniejszy od X i w
dużej części składający się z heterochromatyny, prawdopodobnie traconej w toku ewolucji.
Ciekawym przypadkiem jest rzekotka (Gastrotheca riobamba), u której chromosom Y (prawie
całkowicie heterochromatynowy) jest większy od X, zbudowanego dla odróżnienia praktycznie z
samej euchromatyny [Shmid i wsp. 1983]. Można domniemywać, że w dalszym toku ewolucji
rozmiary tego Y zostaną zmniejszone, wskutek utraty heterochromatyny.
Geny położone na chromosomie Y (poza rejonem PAR) dziedziczą się z ojca na syna „po mieczu”, czyli
holandrycznie.
Rola ptasich chromosomów Z i W nie jest do końca rozstrzygnięta. Nie stwierdzono u nich
odpowiedzialnego za kształtowanie się fenotypu męskiego genu SRY, mapowanego u innych
35
taksonów na Y. Powszechnie uważa się, że czynnikiem determinującym ptasią płeć jest poziom
produktu genu DMRT1 mapowanego na chromosomie Z. Tak więc podwójna doza produktu DMRT1
(u homogametycznych samców ZZ) prowadzi do fenotypu samczego. Wnioski te wyciągnięto na
podstawie badań nad drobiem. Stwierdzono, że triploidalne ptaki 3AZZW wprawdzie w początkowej
fazie życia są samicami, ale po osiągnięciu dojrzałości płciowej zmieniają się w samce. Ptaki o
konfiguracji chromosomów płci ZWW są niezdolne do życia. [Abdel-Hameed, Shoffner 1971; Thorne,
Sheldon 1993]
Okazało się jednak, że wbrew zdaniu cytowanych autorów drób nie jest uniwersalnym
modelem badawczym nad determinacją płci u ptaków. Opisano trzy przypadki triploidalnych ptaków
3AZZW, które okazały się być płodnymi samicami. Dwa pierwsze dotyczyły papugi ararauny
zwyczajnej (Ara ararauna) oraz przedstawicielki pokrzewkowatych Acrocephalus arundinaceus. W
obu przypadkach nie zdołano jednak potwierdzić triploidalnego
statusu linii komórkowych w
gonadach. Natomiast w przypadku trzecim triploidalna sieweczka morska Charadius alexandrinus
mimo podwójnej
dozy produktu z chromosomu Z również w komórkach gonad, była
pełnowartościową samicą [Kupper i wsp 2012]. Wskazuje to na ważną, być może decydującą, rolę
chromosomu W.
2.4 Chromosomy aktywne transkrypcyjnie
Przybieranie, podczas podziałów komórkowych, przez nici DNA formy chromosomów
ułatwia ich kinetykę, lecz również praktycznie wyłącza aktywność transkrypcyjną. Niemniej są tu
wyjątki. Istnieją formy chromosomowe charakteryzujące się wysoką aktywnością. Należą do nich
chromosomy politeniczne oraz chromosomy szczoteczkowe.
2.4.1. Chromosomy politeniczne
Chromosomy te zostały odkryte w roku 1881 w gruczołach ślinowych u larw ochotkowatych
(Chironomus) przez Balbianiego. W porównaniu z chromosomami mitotycznymi i mejotycznymi,
chromosomy politeniczne mają ogromne rozmiary – są od tych poprzednich ponad 100 razy dłuższe.
Składają się ze ściśle skoniugowanych ze sobą homologicznych nici, powstałych w wyniku 10
powtarzających się cykli replikacyjnych, po których nie następują podziały. W efekcie na każdy
chromosom przypada 1024 nici, tworzących rodzaj synapsis na wzór dwóch
homologów
skoniugowanych w pachytenie. Wszystkie chromosomy łączą się ze sobą w obszarze zwanym
chromocentrum. Na całej długości pokryte są poprzecznymi prążkami, na które składają się odcinki
na przemian chromatynowe i achromatynowe. Układ tych prążków jest charakterystyczny dla
każdego chromosomu, pozwalając na dokładne jego zmapowanie. Chociaż znane są głównie z
gruczołów śliniankowych, występują również w innych tkankach – w tym w cewkach Malpighiego,
36
ciałach odżywczych jajników oraz w nabłonku jelit. Prążki z różnych tkanek mogą różnić się
wielkością, co jest związane z różną aktywnością metaboliczną. Przejawem aktywności jest tworzenie
rozszerzeń, zwanych pufami bądź pierścieniami Balbianiego, w których odbywa się intensywna
synteza RNA.
2.4.2. Chromosomy szczoteczkowe
Postać chromosomów szczoteczkowych obserwowana jest w czasie profazy mejotycznej
oocytów u zwierząt, których komórki jajowe są bogate w żółtko. Należą tu przede wszystkim ryby,
płazy, gady oraz ptaki. Po raz pierwszy opisał je w roku 1882 Flemming, badając oocyty
przedstawicielki salamander poprzecznozębnych - ambystomy meksykańskiej (Ambystoma
mexicanum). Termin – chromosomy szczoteczkowe (ang. Lampbrush chromosomes) wprowadził
później Ruckert pracujący nad oocytami rekina. Porównał on strukturę tych form do szczotek
używanych do czyszczenia ulicznych lamp, jak również butelek czy probówek. Każda taka
„szczoteczka” jest rozwiniętym biwalentem około 30 razy dłuższym, niż biwalent obserwowany w
czasie mejotycznej metafazy. Dzięki tym rozmiarom, pod mikroskopem świetlnym możemy
zidentyfikować nie tylko oba homologi lecz również chromatydy siostrzane, składające się z rejonów
skondensowanej chromatyny oraz zdekondensowanej – rozwiniętej, tworzącej długie pętle. Pętle te–
każda w poczwórnym powtórzeniu (stadium tetrady) stanowią rejony aktywne transkrypcyjnie,
analogiczne do puf w chromosomach politenicznych. Tam więc powstają odcinki RNA gromadzone,
wraz z syntetyzowanymi na ich bazie białkami, w cytoplazmie jaja.
Chromosomy szczoteczkowe (fot. 2.10.) stanowią niezwykle informatywne źródło wiedzy o
regulacji transkrypcji czy rekombinacji, śledzonej nawet na ptasich mikrochromosomach, tradycyjnie
z powodu rozmiarów nieczytelnych w czasie analiz metafazy mitotycznej. Lokalizacje rejonów
aktywnych – pętli korespondują z położeniem prążków G a więc obszarów euchromatynowych
[Andraszek, Smalec 2011] na chromosomach mitotycznych.
Fot. 2.10. para chromosomów szczoteczkowych gęsi. K. Andraszek – praca doktorska.
37
2.5. Podstawowe metody barwienia chromosomów
Informacje podane poniżej mają charakter poglądowy. Czytelnik chcący zastosować
samodzielnie podane niżej metody powinien zapoznać się z bardziej szczegółowymi wskazówkami,
które znajdzie w podręcznikach: „Metody badania chromosomów”- praca zbiorowa pod redakcją
Olszewskiej (1981) oraz „Diagnostyka cytogenetyczna zwierząt domowych (Świtoński, Słota, Jaszczak
2006).
2.5.1. Barwienie konwencjonalne
Najpopularniejszym sposobem barwienia struktur chromosomowych jest użycie barwnika
Giemsy, co zostało kilkakrotnie już wspomniane wcześniej. Główny składnik barwnika– błękit
metylenowy– łączy się z ujemnymi resztami fosforanowymi DNA, do których ma swobodny dostęp
praktycznie na prawie całej powierzchni chromosomu. Utrwalony preparat zanurzamy na okres od
kilku do kilkunastu minut w kilkuprocentowym roztworze barwnika, następnie szkiełko spłukujemy
wodą i suszymy. Barwienie to pozwala na ocenę morfologii chromosomów, przyjmujących kolor
fioletowo-granatowy, w zależności od stężenia barwnika i czasu kąpieli. Przy niektórych metodach
przygotowania preparatów (metoda gniecenia) efekt wizualizacji chromosomów i ich morfologii
zapewnia barwnik fuksyna zasadowa, rozpuszczona w 45% kwasie octowym. Przykłady barwienia
konwencjonalnego pokazują wcześniejsze fotografie 2.1- 2.3; 2.5- 2.8, oraz późniejsze 2.23-2.29,
2.31, 2.32.
2.5.2. Barwienia różnicujące
Tam gdzie podobieństwo morfologiczne chromosomów z różnych par uniemożliwia ich
wzajemne odróżnianie, metody konwencjonalne muszą być zastąpione barwieniami bardziej
szczegółowymi, zapewniającymi wyższą rozdzielczość odczytu. Służą do tego metody prążkowe.
Wykorzystują one różny stopień kondensacji chromatyny w chromosomie. Ze względu na ową
kondensację chromatynę dzielimy na euchromatynę (zawiera ona dużą liczbę aktywnych genów),
będącą w chromosomie formą mniej skondensowaną oraz silnie skondensowaną heterochromatynę
(zawiera powtarzalne sekwencje, w większości niekodujące). Heterochromatyna nie jest jednorodna.
Wyróżniamy jej dwie formy; heterochromatynę konstytutywną i fakultatywną. Heterochromatyna
konstytutywna pozostaje skondensowana (a więc zamknięta do odczytu) nawet w jądrze
interfazowym. Heterochromatyna fakultatywna ulega kondensacji w różnym stopniu w zależności od
aktywności chromosomu (np. ciałko Barra). Jak pamiętamy powstawanie chromosomów (tu form
dostrzegalnych pod mikroskopem świetlnym) polega na coraz dalej posuniętej spiralizacji i
38
kondensacji chromatyny. Kondensacja chromatyny jest zależna nie tylko od jej składu, ale również
wiąże się z momentem replikacji w fazie S. I tak odcinki euchromatyny, bogate w pary zasad C-G,
replikują we wczesnej fazie S a odcinki heterochromatyny (względnie bogatsze w pary A-T), replikują
w drugiej połowie fazy S.
2.5.2.1. Prążki G
Jest to popularna metoda barwienia, ujawniająca do kilkuset prążków w garniturze
chromosomowym. Ponieważ chromosomy homologiczne mają ten sam wzór prążkowy, udane
zabarwienie pozwala na identyfikację i przypisanie do konkretnych par chromosomów o identycznym
kształcie i wielkości (vide kariotyp bydła). Ilość uzyskanych prążków zależy od stopnia kondensacji
chromatyny, stąd najlepsze wyniki uzyskuje się barwiąc preparat z późnej profazy lub bardzo
wczesnej metafazy. Dodanie do medium z dzielącymi się komórkami substancji zapobiegających
kondensacji chromatyny pozwala uzyskać tzw. chromosomy wydłużone, co daje wzór prążkowy
wysokiej rozdzielczości HRBT (High Resolution Banding Technik). Uzyskanie prążków G metodą GTGfot 2.11 oraz 2.13, odbywa się dzięki poddaniu chromosomów trawieniu enzymem proteolitycznym
(trypsyną) podczas kilkunastosekundowej (czas dobieramy eksperymentalnie) kąpieli. Następnie
usuwamy enzym i preparat poddajemy barwieniu odczynnikiem Giemsy. W wyniku denaturacji białka
histonowe przesuwają się powodując miejscową utratę powinowactwa grup fosforanowych do
błękitu metylenowego. W tych miejscach po zastosowaniu barwnika Giemsy otrzymujemy prążki
negatywne, podczas gdy w pozostałych pozytywne– barwnik przyłącza się. Prążki GTG pozytywne
obejmują późno replikujące miejsca chromosomu (bogate w pary A-T).
Fotografia 2.11. Porównanie chromosomu X u owcy (o), kozy (k) i owcy grzywiastej (og). Prążki G. (A. KozubskaSobocińska, Praca doktorska. Dzięki uprzejmości Autorki)
39
Fotografia 2.12. Chromosom X bydła domowego. Prążki G– technika HRBT i GTG. Widoczna jest różnica w ilości
uzyskanych prążków. (A. Kozubska-Sobocińska, Praca doktorska. Dzięki uprzejmości Autorki)
a
b
Fotografia 2.13. Kariotyp człowieka– a)mężczyzny 46,XY, b) kobiety 46,XX. Barwienie GTG. (A. Życzyński
niepublikowane)
2.5.2.2. Prążki R (metoda RBA)
Prążki te stanowią negatywowy obraz prążków G (fot. 2.14), pokazujący fragmenty wcześnie
replikujące. Po wprowadzeniu do medium z dzielącymi się komórkami analogu tymidyny– BrdU– 5bromo-2’-deoksyurydyny, powodujemy, że związek ten przyłącza się do syntetyzowanej nici
chromatynowej w miejsce zasady T. Miejsca te tracą powinowactwo do stosowanego później w
czasie barwienia fluorochromu– oranżu akrydyny. Fragmenty chromosomu replikujące wcześniej (a
więc przed zadziałaniem BrdU) tworzą obok będących w przewadze C-G normalne pary A-T, które
przyłączają fluorochrom, wskutek czego świecą podczas przeglądania preparatu pod mikroskopem
fluorescencyjnym. Sygnał świetlny daje tym samym prążki pozytywne (odpowiadające negatywnym
przy stosowaniu GTG).
Odmianą prążkowania RBA jest metoda RBG. Jest ona przydatna, gdy nie dysponujemy
mikroskopem fluorescencyjnym. Preparaty z komórek (inkubowanych jak poprzednio w obecności
BrdU) umieszczamy w barwniku Hoechsta 33258 a następnie naświetlamy przez 30 min lampą UV z
odległości 2-3 cm. Potem preparat barwimy barwnikiem Giemsy (rozpuszczonym nie w wodzie
40
destylowanej, lecz w buforze Sørensena o pH 6.8). Mostki A-BrdU są znacznie słabsze od normalnych
mostków A-T i pod wpływem promieni UV pękają. Miejsca późno replikujące, a więc głównie
zawierające właśnie takie mostki nie wybarwiają się barwnikiem Giemsy, gdyż chromatyna jest tam
uszkodzona. Miejsca wcześnie replikujące (głównie z mostkami C-G) mają chromatynę całą,
przyłączają barwnik Giemsy dając tym samym prążki pozytywne.
Należy nadmienić, że znając czas przebiegu fazy S w kulturze in vitro możemy dodać BrdU na
jej początku lub pod koniec. Wtedy przy pomocy negatywnych prążków możemy osobno oznaczyć
regiony chromosomu wcześnie i późno replikujące. Oba warianty dadzą obraz odwrotny względem
siebie. I tak pozytywny (a więc późno replikujący) prążek otrzymamy po podaniu BrdU we wczesnej
fazie S (w tym rejonie replikacja jeszcze nie ma miejsca i nie powstają mostki A-BrdU). Dla odmiany–
ten sam rejon po podaniu BrdU pod koniec fazy S da nam prążek negatywny (wtedy powstają mostki
A- BrdU ulegające zniszczeniu pod wpływem UV i nie przyłączające w efekcie barwnika).
Fotografia 2.14. Kariotyp tryka. 2n = 54,XY. Barwienie różnicowe RBA. Prążki fluorescencyjne dające odwrotny
wzór niż prążki GTG. (A. Kozubska-Sobocińska- praca doktorska– dzięki uprzejmości Autorki)
2.5.2.3. Prążki C (metoda CBG)
Metoda ta barwi rejony najmocniej skondensowanej chromatyny (konstytutywnej)- fot. 2.15 i
2.16. Poprzez inkubację szkiełek z preparatami w roztworach HCl, Ba(OH)2 i SSC usuwa się luźne bloki
euchromatyny a pozostałe barwi barwnikiem Giemsy. Barwnik przyłącza się do chromatyny, która
„przetrwała” agresywną chemiczną obróbkę, tworząc prążki pozytywne. Znajdziemy je przede
wszystkim w rejonach centromerowych (stąd przydatność tej metody do oznaczania centromerów w
chromosomach długich, gdzie chromatydy siostrzane jeszcze nie oddzielają się od siebie), jak również
w telomerach a czasem też interstycjalnie (między centromerem a telomerem).
41
Fotografia 2.15. Chromosomy metafazowe tryka (Ovis aries). Barwienie CBG. Widziany na dole duży
jednoramienny chromosom X nieposiadający prążka C. Nad nim widoczny mały chromosom Y. Wszystkie
autosomy posiadają pozytywne prążki w rejonach centromerowych. (A. Kozubska-Sobocińska. Praca doktorska.
Dzięki uprzejmości Autorki)
Fotografia 2.16. Kariotyp samicy zająca (Lepus europaeus). 2n = 48,XX. Prążki CBG. (R. Parada– niepublikowane)
2.5.2.4. Oznaczanie rejonów jąderkotwórczych – NOR
O genach rDNA wspomniano już poprzednio. Ich interfazowa aktywność przed wejściem
komórki w cykl podziałowy sprawia, że chromatyna w tych loci nawet w czasie metafazy jest
rozciągnięta, powodując występowanie przewężenia wtórnego oraz satelity. Widoczne to jest nawet
przy konwencjonalnym barwieniu odczynnikiem Giemsy. Również użycie azotanu srebra pozwala na
wizualizację tych miejsc dzięki powstaniu prążków Ag-I (AgNOR)- fot. 2.17, widocznych w postaci
czarnych depozytów. Barwienie przeprowadza się nakrapiając na szkiełko z preparatem roztwór
azotanu srebra i roztwór żelatyny (zapewniającej równomierne i mniej raptowne działanie barwnika).
Szkiełka umieszczamy w cieplarce w temperaturze 37oC, kontrolując stopień zabarwienia. Gdy
chromosomy nabierają koloru jasnego miodu, przerywamy inkubację i spłukujemy barwnik wraz z
żelatyną. Czarne złogi pokazują lokalizację genów rDNA. Liczba otrzymanych prążków zależy od
wspomnianej aktywności tych sekwencji (najczęściej oznaczamy dwa takie rejony, lecz u wielu
42
gatunków geny te występują na więcej niż jednej parze chromosomów (na fotografii 2.4
przedstawiającej kariotyp jelenia, widoczne jest 5 chromosomów, na których geny rDNA były
aktywne w interfazie przed aktualnym podziałem mitotycznym).
Fotografia 2.17. Metafaza u rzekotki żabiej (Phrynochyias resinifitrix). Wyraźnie widać prążek AgNOR na
chromosomie z 10 pary. Obok znajduje się jądro interfazowe, gdzie widzimy 2 sygnały w postaci dużych
czarnych plam. W tych miejscach na rozciągniętej, otwartej do odczytu, chromatynie odbywa się synteza RNA o
stałych sedymentacji 28S, 18S i 5.8S. (A. Życzyński, P. Krawczyk- niepublikowane)
2.5.3. Barwienia fluorochromami
Jest wiele fluorochromów, które znalazły zastosowanie w cytogenetyce. Mają różne
mechanizmy działania i wywołują świecenie wzbudzone falami lampy fluorescencyjnej o różnych
długościach. W mikroskopie fluorescencyjnym znajduje się zestaw odpowiednich filtrów, które
przepuszczają światło o określonej długości fal. Tak, więc jest możliwe zabarwienie preparatu kilkoma
fluorochromami na raz, by potem zmieniając odpowiednio filtr odczytywać różne sygnały.
Historycznie pierwszym fluorochromem wykorzystanym w cytogenetyce była kwinakryna,
użyta do barwienia chromosomów bobu (Vicia faba) [Caspersson i wsp. 1968]. Pozwala ona na
uzyskanie wzoru prążkowego zwanego prążkami Q (QFQ). Wyniki te były wykorzystane w
cytogenetyce człowieka, by później znaleźć zastosowanie przy badaniu chromosomów zwierząt.
Prążki Q pomagają w odróżnianiu homologów, co nie zawsze jest możliwe przy barwieniach
konwencjonalnych. Obraz Prążków Q jest podobny do uzyskanego metodą GTG.
Innym stosowanym fluorochromem jest jodek propidyny. Posiada zdolność łączenia się
interkalarnego z mostkami zasadowymi DNA i wzbudzony światłem o długości około 488nm emituje
czerwone światło. Zabarwia równomiernie chromosomy na całej długości. Zazwyczaj zabarwiony
preparat przeszukujemy przy filtrze pozwalającym na emisję światła jodku propidyny, by następnie
po ustawieniu badanego obiektu (czytelnej metafazy) zmienić filtr na pozwalający emitować światło
innych, często nietrwałych, barwników. Należy do nich DAPI (fot. 2.18) łączący się wybiórczo z
43
mostkami A-T. Fragmenty chromosomów bogate w pary zasad A-T dają intensywny niebieski sygnał.
Sygnały te pokrywają się częściowo z prążkami GTG oraz Q a także dość dokładnie z prążkami C.
Fotografia 2.18. Metafaza pstrąga tęczowego (Onchorhynchus mykkis), osobnik triploidalny 3n 90,XXX.
Barwienie DAPI. Mocne sygnały widoczne są w rejonach centromerowych. (A. Życzyński niepublikowane)
Odpowiednia zmiana filtra pozwala na emisję światła przez chromomycynę A3. Ta w
odróżnieniu od DAPI łączy się z mostkami C-G, co pozwala na uzyskanie obrazu odwrotnego do DAPI.
Chromomycyna A3 wykorzystywana jest do typowania położenia loci rDNA. Loci te oflankowane są
dwustronnie chromatyną szczególnie bogatą w pary C-G. Tak więc silny, przerwany sygnał przy
stosowaniu chromomycyny A3 daje podstawy do mapowania tych rejonów nawet w preparatach, na
których nie znajdziemy komórek z aktywnymi genami rDNA przed cyklem podziałowym (wtedy
barwienie konwencjonalne pokazuje przewężenia wtórne a barwienie AG-I- czarne prążki (AgNOR).
Porównanie trzech metod pokazuje fotografia 19.
a)
b)
c)
Fotografia 2.19. Wizualizacja loci rDNA u rzekotki żabiej (Phrynohyias resinifitrix) na 10 parze chromosomów.
Od lewej barwienie: a- konwencjonalne barwnikiem Giemsy pokazuje przewężenie wtórne i satelity (u dołu
chromosomów); b– prążki AgNOR, c– DAPI. Oflankowanie loci rDNA bogate w pary C-G daje negatywny sygnał
DAPI– dół chromosomów. (A. Życzyński, P. Krawczyk– niepublikowane)
44
2.5.3.1. Metoda FISH (Fluorescence In Situ Hybridyzation)
W celu wykonania tego barwienia należy dysponować wyznakowaną fluorescencyjnie sondą
molekularną, zawierającą określone sekwencje DNA. Sondę taką można wykonać, korzystając z
opublikowanych wyników sekwencjonowania DNA, bądź wykorzystać wycięte fragmenty
chromosomów w miejscach zawierających interesujące nas loci genowe. W przypadku mapowania
metodą FISH sekwencji mało zmiennych w przyrodzie (tzw. wysoce konserwowanych ewolucyjnie)–
np. sekwencji telomerowych lub rDNA, sonda może być wykonana na bazie organizmu bardzo
odległego taksonomicznie od aktualnie badanego– fotografie 20 i 21. Możliwe też jest wykonanie
sondy przy użyciu całego chromosomu by zmapować jego homologa na innym materiale– fotografia
22.
Posiadaną sondę oraz chromosomy poddaje się denaturacji powodując rozpad podwójnej
helisy na nici pojedyncze. Sondę nanosi się na szkiełko z preparatem chromosomowym a następnie
tworzy warunki dla denaturacji. Komplementarne nici łączą się ze sobą, co obejmuje również sondę,
która hybrydyzuje z komplementarnym miejscem na chromosomie. Końcową analizę prowadzimy
pod mikroskopem fluorescencyjnym, przy użyciu filtra właściwego dla barwnika znakującego sondę.
W ten sposób możemy zmapować (ustalić położenie w garniturze chromosomowym) określonych
chromosomów- ich fragmentów charakterystycznych dla jednego gatunku w garniturze gatunku
drugiego, zmapować poszczególne geny, ocenić skutki rearanżacji chromosomowych czy mutacji
zarówno genomowych jak i chromosomowych. Niektóre wnioskowania można przeprowadzać
również przy wykorzystaniu jąder interfazowych, co oznacza, że nie zawsze konieczne jest uzyskanie
czytelnego preparatu chromosomowego.
Fotografia 2.20. Metafaza żaby zielonej (Rana esculenta complex) 26,XY. Barwienie FISH przy użyciu sondy
otrzymanej z rDNA człowieka. Sonda z genów człowieka wykazała wystarczające podobieństwo do tych samych
genów żabich, by precyzyjnie określić miejsce ich położenia w genomie– tu na 10 parze metacentryków,
niezależnie od ich aktywności poprzedzającej, udokumentowany metafazą, cykl podziałowy. (A. Życzyńskiniepublikowane)
45
Fotografia 2.21. Chromosomy metafazowe pstrąga tęczowego (Oncorhyncus mykkis). Barwienie FISH przy
użyciu sondy otrzymanej z rDNA człowieka. Widoczne dwa sygnały. Podobnie jak na fotografii 17 odległość
taksonomiczna pomiędzy człowiekiem a rybą nie jest przeszkodą w mapowaniu tych sekwencji, przy użyciu
sondy wykonanej z DNA człowieka. (A. Życzyński– niepublikowane)
Fotografia 2.22. Chromosomy metafazowe klaczy. Barwienie FISH przy wykorzystaniu sondy z końskiego
chromosomu X, która „pomalowała” właściwe chromosomy na preparacie. Widoczne dwa sygnały pokazujące
oba chromosomy X. (M. Bugno– dzięki uprzejmości Autorki)
2.6. Mejoza
Podział mejotyczny– redukcyjny (od greckiego meiosis– redukcja) ma miejsce w komórkach
płciowych. Hipotezę o redukcyjnym charakterze podziałów prowadzących do powstania gamet
wysunął w roku 1887 Weismann. Późniejsze badania potwierdziły teoretyczne przewidywania.
Podobnie jak w mitozie, podział mejotyczny poprzedzony jest replikacją DNA (faza S). Następuje
profaza, która w przeciwieństwie do profazy mitotycznej „obfituje” w wydarzenia o dość złożonym
przebiegu, przedstawionym poniżej w formie punktów.
2.6.1. Profaza
Leptoten– cienka nić. Rozpoczyna się kondensacja jak w profazie mitotycznej, lecz fragmenty
chromatyny są jeszcze długie i cienkie.
Zygoten– nić zespolona. W tym stadium następuje koniugacja między coraz bardziej kondensującymi
homologami (fot. 2.23). Przylegają do siebie tworząc biwalenty. Każdy chromosom (po fazie S) jest
46
podwojony– (składa się z chromatyd siostrzanych– stąd 4C), biwalenty nazywane są niekiedy
tetradami. Oznacza to, że każdy gen występuje na dwóch przylegających do siebie chromosomach w
4 kopiach– dwóch ojcowskich i dwóch matczynych, ułożonych koło siebie (tam gdzie koniugacja
homologów jest ścisła).
Fotografia 2.23. Spermatocyt I myszy(2n = 40,XY). Zygoten. Widoczne na zdjęciu podłużne pasy to białkowe
struktury– kompleksy synaptemalne, łączące ze sobą skoniugowane chromosomy homologiczne (tu
niewybarwione). Jest ich– tyle co biwalentów- tu 20. Na dole, na ciemniejszym tle widać kompleks scalający
biwalent płciowy z dobrze zaznaczonym fragmentem łączącym w biwalencie rejon pseudoautosomalny PAR. (J.
Sosnowski– dzięki uprzejmości Autora)
Pachyten– gruba nić. Obok postępującej kondensacji w stadium zachodzi proces rekombinacji–
crossing over (c/o). W biwalentach wewnętrzne, przylegające do siebie bezpośrednio chromatydy
siostrzane obu homologów wymieniają się między sobą fragmentami. W rezultacie w
biwalencie/tetradzie mamy dwie chromatydy zewnętrzne (matczyną i ojcowską)- oryginalne, oraz
dwie chromatydy wewnętrzne zrekombinowane (składające się częściowo z materiału matecznego i
częściowo z ojcowskiego). W tym stadium widoczne są jąderka, często połączone z kodującymi ich
powstanie loci (NOR) na odpowiednich chromosomach.
Diploten– podwójna nić. Rozpoczyna się rozdzielanie homologów w obrębie biwalentów. Zachowane
jest połączenie homologów w telomerach, oraz chiazmach– punktach świadczących o zajściu c/o
pomiędzy wewnętrznymi chromatydami biwalentu/tetrady. W zależności od liczby chiazm biwalenty
przyjmują różne kształty. Im chromosomy są dłuższe, tym prawdopodobieństwo zajścia
wielokrotnego c/o w obrębie biwalentu jest większe, stąd większa również ilość obserwowanych
chiazm. W organizmach żeńskich podział mejotyczny rozpoczyna się w oocytach, które uformowane
są już w okresie życia płodowego. Żeńska mejoza zatrzymuje się w stadium diplotenu, przechodząc
47
do fazy diktyotenu, którą kończy moment dojrzewania komórek jajowych, kiedy następuje owulacja.
W zależności od gatunku i jego strategii rozrodczej, komórki w stadium diktyotenu mogą trwać nawet
wiele lat.
Diakineza. W diakinezie następuje silna kondensacja chromatyny oraz terminalizacja chiazm, które
przesuwają się do końców biwalentu. W przypadku długich biwalentów, po wielokrotnej
rekombinacji, niektóre chiazmy dalej zachowują pozycje interstycjalne.
Po zakończeniu profazy dzieląca się komórka rozrodcza przechodzi do I metafazy mejotycznej.
2.6.2. Metafaza I
Podobnie jak w metafazie mitotycznej zanika błona jądrowa i wytwarza się wrzeciono
podziałowe. Rejony centromerów biwalentów ustawiają się w płaszczyźnie równikowej a same
homologi coraz bardziej odchylają się od siebie, zachowując łączność w telomerach i czasami (w
przypadku długich chromosomów) w nie do końca zterminalizowanych chiazmach. Dla wprawnego
oka odróżnienie metafazy mejotycznej I od metafazy mitotycznej nie sprawia trudności.
Obserwowanych w polu widzenia struktur jest dwa razy mniej (1n) ale nie są to pojedyncze
chromosomy lecz biwalenty. Biwalent w odróżnieniu od chromosomu metafazy mitotycznej (fot.
2.24), u którego chromatydy siostrzane obu ramion rozchylają się poczynając od telomerów, ma
zamknięte końce (oba chromosomy homologiczne dalej są połączone telomerami)– porównaj
fotografie 2.24 z fotografią 2.25 i 2.26, przedstawiające odpowiednio metafazę mitotyczną oraz
obrazy metafazy mejotycznej I żaby zielonej.
Fotografia 2.24. Metafaza mitotyczna żaby zielonej (Pelophylax complex) 2n = 26,XY. Chromosomy z
rozchylonymi, otwartymi na końcach chromatydami siostrzanymi. Barwienie konwencjonalne barwnikiem
Giemsy. (A. Zaleśna– niepublikowane. Dzięki uprzejmości Autorki)
48
Fot.2. 25 i 2.26. Obrazy metafazy mejotycznej I żaby zielonej (Pelophylax complex). Widać 1n = 13 biwalentów
tworzących zamknięte pierścienie, wskutek rozejścia się homologów z zachowaniem połączeń w telomerach.
Metafazy na obu fotografiach różnią się stopniem kondensacji. Barwienie konwencjonalne barwnikiem Giemsy.
Na fotografii 25 z lewej strony widoczne jest jądro interfazowe a z prawej dwa jądra pobudzone do podziału. (A.
Zaleśna– niepublikowane. Dzięki uprzejmości Autorki
2.6.3. Anafaza I
Włókna wrzeciona podziałowego, połączone z centromerami obu homologów każdego
biwalentu zaczynają rozciągać homologi do przeciwnych biegunów komórki. Do każdego bieguna
wędruje po jednym homologu, tworząc komplet chromosomów o zredukowanej (do 1n) a więc
haploidalnej liczbie chromosomów. Po anafazie mejotycznej I powstające jądra potomne mają 1n
dwuramiennych chromosomów i 2C DNA (dla porównania– po anafazie mitotycznej przy tej samej
wartości 2C, liczba chromosomów– jednoramiennych- wynosi 2n). Fotografia 2.27 pokazuje
zredukowane, haploidalne komplety chromosomów po anafazie mejotycznej I.
Fotografia 2.27. Dwa haploidalne (1n = 13, 2C) komplety chromosomów żaby zielonej po anafazie I
spermatogenezy. Równocześnie obserwujemy dwie metafazy mejozy II. Z lewej strony widać
wczesnoprofazowe jądro z ziarnistą strukturą chromatyny. Barwienie barwnikiem Giemsy. (A. Zaleśna–
niepublikowane. Dzięki uprzejmości Autorki)
2.6.4. Telofaza I i pozostałe etapy mejozy
Po anafazie I następuje telofaza- reorganizacja potomnych jąder, wytworzenie błon
jądrowych, podział cytoplazmy. Okres pomiędzy telofazą a mejozą II nazywamy interkinezą.
Chromosomy rozluźniają swoją strukturę. Ważne jest, że w interkinezie nie ma II fazy S. Czasem też
nie ma właściwej profazy II i prawie bezpośrednio po anafazie I rozpoczyna się metafaza II. Zatem,
fotografia 2.27 pokazuje nie tylko efekt anafazy I ale również dwie metafazy II podziału
49
mejotycznego. Chromosomy ustawiają się w nowych płaszczyznach równikowych i wraz z
kondensacją rozchylają w telomerach chromatydy siostrzane. Rozchylenie to ostatecznie jest większe
niż w metafazie mitotycznej. Następuje anafaza II i wrzeciono podziałowe rozciąga (tak jak w anafazie
mitotycznej) chromatydy siostrzane. Wędrujące do biegunów chromatydy tworzą haploidalne
garnitury po 1n i 1C.
Komórki żeńskie owulują w profazie II mejozy. Cykl podziałowy zostaje zatrzymany i podjęty
dopiero po wniknięciu do komórki jajowej plemnika. Wówczas następuje metafaza II a następnie
anafaza II zakończona wyrzuceniem II ciałka kierunkowego (jednego kompletu chromatyd
siostrzanych– 1n, 1C). Bezpośrednio po zapłodnieniu zygota ma status 2n ale 3C– jeden komplet
haploidalnych chromosomów jednochromatydowych plemnika i jeden komplet chromosomów
dwuchromatydowych jądra jaja. Dopiero po wyrzuceniu II ciałka kierunkowego jednochromatydowe
chromosomy matki i ojca tworzą wspólne jądro nowego organizmu 2n i 2C. Gdy komórka jajowa nie
zostaje zapłodniona, zostaje resorbowana nigdy nie kończąc mejozy II.
2.7. Mutacje chromosomowe
Przedstawiony opis podziałów komórkowych dotyczy procesów o przebiegu prawidłowym.
Zdarzające się błędy podczas c/o, czy błędny proces naprawczy mechanicznych uszkodzeń prowadzi
do zmian struktury chromosomów. Jego efektem może być zmiana ilości materiału genetycznego lub
jego przegrupowanie (rearanżacja). Takie zaburzenia w strukturze chromosomów prowadzi do
mutacji chromosomowych zwanych również aberracjami. Mutacje chromosomowe dzielimy na
zrównoważone lub niezrównoważone.
Do niezrównoważonych mutacji chromosomowych zaliczamy delecję (utratę fragmentu
chromosomu) lub duplikację, gdy jakiś odcinek zostaje podwojony. Obydwie mogą dotyczyć zarówno
terminalnej, jak i interstycjalnej (w obrębie ramienia p lub q) części chromosomu. Przyczyną tych
mutacji są nie naprawione uszkodzenia mechaniczne oraz nieprawidłowy przebieg wymian odcinków
chromatyd w czasie rekombinacji. Jeśli gamety niosące takie mutacje uczestniczą w zapłodnieniu, to
powstałe zygoty mają brak lub nadmiar określonych fragmentów informacji genetycznej. Ich skutki są
różne, gdyż każda mutacja może mieć swoje unikalne znaczenia w zależności od roli objętych nią
genów. Szczególnie dokładna diagnostyka prowadzona w medycynie człowieka, pokazuje, że
najmniejsze nawet niezbilansowanie naszego genomu wskutek zaszłej delecji czy duplikacji, prowadzi
do łatwych do zaobserwowania zaburzeń rozwoju somatycznego oraz umysłowego.
Zrównoważone mutacje chromosomowe mogą dotyczyć jednego chromosomu– inwersje, bądź
większej ich liczby– translokacje wzajemne. O ile dla samego nosiciela mutacje te mogą nie mieć
szczególnego znaczenia, to wywierają wpływ na jakość produkowanych gamet, co może prowadzić do
obniżonej płodności. O mutacjach zrównoważonych wspominano wcześniej przy omawianiu
50
podobieństwa kariotypów spokrewnionych gatunków, teraz mamy okazję do zdefiniowania
używanych uprzednio pojęć.
2.7.1. Duplikacje i delecje
Jak wspomniano wcześniej, do delecji dochodzi w wyniku utraty fragmentu bądź całego
chromosomu. W tym drugim przypadku jest to skutkiem nieprawidłowego (poprzecznego) pęknięcia
centromeru. Jedno ramię ulega zgubieniu . Jeśli chromatydy siostrzane drugiego ramienia nie zostają
rozdzielone to delecji jednego ramienia towarzyszy duplikacja drugiego – każda z chromatyd
siostrzanych staje się ramieniem nowego chromosomu. Kiedy ma to miejsce w czasie mejozy II
powstałe gameta po procesie zapłodnienia tworzy zygotę z monosomią jednego ramienia i trisomią
drugiego. Trudno sobie wyobrazić, by taki organizm był zdolny do życia a ewentualna dokumentacja
takiego scenariusza może pochodzić z diagnostyki medycyny człowieka. Jako przykład dokumentacji
samej duplikacji może służyć praca
2.7.2. Inwersje
Mutacja ta zachodzi wskutek pęknięcia chromosomu i odwrócenia oderwanego fragmentu o
180o, wskutek nieprawidłowej naprawy, lub nieprawidłowego przebiegu crossing over. Przy jednym
pęknięciu odwrócony zostaje fragment terminalny, przy dwóch interstycjalny. Gdy inwersja obejmuje
swoim zasięgiem centromer (inwersja pericentryczna), często w jej wyniku dochodzi do zmiany
kształtu chromosomu – wymieniony wcześniej przykład chromosomu Y u Bovini, bądź jednoramienny
chromosom X u owiec i kóz. Inwersja nie obejmująca centromeru nazywana jest paracentryczną
(wymieniony wcześniej przykład ramienia q chromosomu 9 bydła i kóz). Kształt chromosomu
pozostaje bez zmian i wykrywamy ją dzięki odwróconemu wzorowi prążków.
Powstanie inwersji może utrudniać koniugację chromosomów homologicznych w zygotenie.
Chromosomy tworzą wówczas charakterystyczne pętle inwersyjne, pozwalające na koniugację miejsc
homologicznych, które wskutek inwersji zmieniły pierwotne miejsce w chromosomie.
2.7.3. Translokacje
Translokacją nazywamy połączenie całego chromosomu, bądź jego fragmentu z innym
chromosomem niehomologicznym.
Pierwszym rodzajem translokacji jest translokacja Robertsonowska, zwana też fuzją
centromerową lub fuzją centryczną. Dotyczy niehomologicznych chromosomów jednoramiennych,
które łączą się ze sobą centromerami. W przypadku chromosomów telocentrycznych towarzyszy
temu utrata fragmentów centromerów, natomiast w przypadku chromosomów akrocentrycznych
51
również utrata szczątkowych ramion krótkich (lecz nie ma to wpływu na organizm nosiciela).
Najsłynniejszą translokacją Robertonowską, znaną z hodowli zwierząt gospodarskich, jest fuzja
centryczna 1/29 u bydła, rozprzestrzeniona wśród czerwonych ras bydła na całym świecie.
Heterozygotyczny nosiciel takiej translokacji, oprócz gamet prawidłowych– z oddzielnymi
chromosomami pary 1 i 29, przekazuje tę translokację (oba chromosomy połączone). Z obu takich
gamet mogą powstać żywotne zarodki (normalny i kolejny nosiciel– rys. 2.4b). Oprócz tych rodzajów
gamet produkowane są jednak gamety nieprawidłowe– niezależna segregacja w anafazie I podziału
mejotycznego sprawia, że do jednego bieguna może powędrować fuzyjny chromosom1/29 wraz z
którymś z jego składowych homologów, podczas gdy w drugim biegunie któregoś z omawianych
chromosomów zabraknie. Gamety takie po zapłodnieniu dadzą początek zygotom z trisomią 1 lub 29
bądź odpowiednimi monosomiami– rys 2.4c i 2.4d. Zygoty takie są niezdolne do życia, co obniża
ogólną płodność nosiciela translokacji.
Rysunek 2.1. a)- Fragment metafazy mitotycznej bydła (2n, 4C) bydła zawierający dwuchromatydowe,
akrocentryczne chromosomy par –1 i 29; b) Efekt anafazy mitotycznej– dwa jądra (2n, 2C) z
jednochromatydowymi chromosomami obu par
Rysunek 2.2. a) Fragment metafazy mitotycznej bydła (2n, 4C) zawierający chromosomy par 1 i 29 u
heterozygotycznego nosiciela translokacji 1/29. Widzimy dwa chromosomy połączone i ich wolne homologi.
Porównaj z fotografią 2.27; b) Efekt anafazy mitotycznej– jądra pochodne (2n, 2C) z jednoramiennymi
chromosomami 1/29 zaangażowanymi w translokację i ich wolnymi akrcentrycznymi homologami.
52
Rysunek 2.3. a) Fragment metafazy mejozy I (2n, 4C) zawierający dwa biwalenty (tetrady) chromosomów par 1
i 29; b) Efekt redukcyjnej anafazy I– dwa jądra pochodne (1n, 2C) z pojedynczymi, dwuchromatydowymi
chromosomami obu par; c) Efekt anafazy II– 4 jądra pochodne (1n, 1 C) z pojedynczymi, jednochromatydowymi
chromosomami obu par
Rysunek 2.4. Fragment metafazy mejotycznej bydła zawierający chromosomy par 1 i 29 u heterozygotycznego
nosiciela translokacji 1/29; a) Tetrawalent (dwa połączone wskutek translokacji biwalenty). 2n, 4 C; b) Efekt
redukcyjnej anafazy I. Dwa jądra pochodne (1n, 2C) – jedno z połączonymi chromosomami, drugie z
chromosomami wolnymi. Z jąder tych po anafazie II powstaną gamety (1n, 1C), które po zapłodnieniu stworzą
normalne fenotypowo osobniki – jednego nosiciela translokacji 1/29, drugiego z chromosomami prawidłowymi;
c) Efekt anafazy I. Dwa jądra pochodne aneuploidalne. Z górnego po anafazie II powstaną gamety z dwoma
chromosomami pary 29, które po zapłodnieniu dadzą trisomiczną zygotę 60,XY,t.rob.(1;29),+29. Z dolnego
jądra po anafazie II powstaną gamety bez chromosomu 29, które po zapłodnieniu dadzą aneuploidalną zygotę
2n = 59, monosomiczną w parze 29 (59,XY,-29); d) Efekt anafazy I. Dwa jądra pochodne aneuploidalne. Z
górnego po anafazie II powstaną gamety z dwoma chromosomami pary 1, które po zapłodnieniu dadzą
trisomiczną zygotę [60,XY,t.rob.(1;29),+1]. Z dolnego jądra po anafazie II powstaną gamety bez chromosomu 1
(59,XY,-1)
Warianty pokazane na rysunkach 2.4b, 2.4c i 2.4d są jednakowo prawdopodobne (efekt
działania II Prawa Mendla) lecz tylko w przypadku 4b powstaną osobniki zdolne do życia. W
scenariuszach z 4c i 4d powstałe po zapłodnieniu zygoty obumierają a pokryta krowa powtarza ruję.
Translokacje Robertsonowskie są łatwe do wykrycia u bydła z uwagi na jednoramienne autosomy.
Identyfikacja w polu widzenia trzeciego (poza parą chromosomów płciowych) chromosomu
dwuramiennego nie wymaga stosowania pracochłonnych metod barwienia różnicowego, gdyż
wstępną diagnozę, wystarczającą do wyeliminowania z hodowli danego buhaja, można postawić na
podstawie barwienia konwencjonalnego– fotografia 2.27.
53
Fotografia 2.28. Buhaj 59,XY,Rb(1;29). Metafaza i kariotyp buhaja nosiciela translokacji robertsonowskiej 1/29.
Homologi chromosomów tych par połączone są w jeden, dodatkowy w garniturze chromosom
submetacentryczny (oznaczony literą t). Barwienie odczynnikiem Giemsy. (P. Sysa– dzięki uprzejmości Autora)
Odwrotnością fuzji centrycznej jest fizja centryczna. W wyniku rozpadu chromosomu w
obszarze centromeru, z jednego dwuramiennego powstają dwa oddzielne chromosomy
jednoramienne (vide rearanżacje chromosomowe w rodzinie koniowatych).
Innym rodzajem translokacji jest translokacja tandemowa. Dochodzi wówczas do połączenia
rejonu telomerowego jednego chromosomu z rejonem centromerowym innego chromosomu
(jednoramiennego). Również tu (identycznie jak w fuzji centrycznej) wstępna diagnoza jest możliwa
przy zastosowaniu barwienia konwencjonalnego. Skutkiem translokacji (fuzji) tandemowej jest
najczęściej powstanie chromosomu dicentrycznego lub akrocentrycznego (z utratą centromeru
jednego z chromosomów) oraz zmniejszenie 2n o jeden chromosom
Najtrudniejszą do wykrycia jest translokacja wzajemna. Dwa różne chromosomy wskutek
pęknięć i błędów naprawy wymieniają się między sobą fragmentami chromosomów. Szczegółowa
diagnoza takiej translokacji może być wykonana po zastosowaniu metod barwienia różnicowego,
również przy użyciu sond (FISH). Utrudniona koniugacja homologów zaburza przebieg mejozy,
wskutek czego nosiciele tych translokacji mają obniżoną płodność. Z problemem tym miewamy
często do czynienia w przypadku trzody chlewnej.
54
2.8. Mutacje genomowe
2.8.1. Poliploidie
Do mutacji tych zaliczamy zmiany w poziomie ploidalności, zwykle wskutek zaburzeń
podziałów mejotycznych. Zaburzenia anafazy mitotycznej bądź mejotycznej (zarówno I jak i II)
uniemożliwiają rozejście się chromosomów– zarówno jedno jak i dwuchromatydowych do jąder
potomnych. Gdy dzieląca się komórka takie zaburzenie przeżyje i wejdzie w kolejny cykl podziałowy,
rozpocznie go z dwukrotnie wyższego poziomu [n] i [C]. Następująca faza S podwoi zastaną ilość DNA
i przy prawidłowej segregacji w anafazie otrzymamy kolejną generację komórek o zmienionej
wartości [n]. W przypadku zaburzeń anafazy mitotycznej (gdy nie dotyczą one pierwszego podziału
jednokomórkowej jeszcze zygoty) ich efektem może być mozaicyzm– organizm składa się z różnych
linii komórkowych, o różnym stopniu ploidalności. Poliploidyzacja bywała dokumentowana w
filogenezie wielu gatunków zarówno roślin (zboża) jak i zwierząt (kilka rodzin ryb). Najczęstszymi
formami są tetraploidy (4n licząc układ wyjściowy, heksaploidy– 6n oraz oktoploidy– 8n. Formy
triploidalne powstałe po zaburzeniu anafazy mejotycznej II (nie dochodzi do wyrzucenia II ciałka
kierunkowego i 1n, 2C od matki łączy się po zapłodnieniu z 1n, 1C od ojca przekształcając się w 3n,
3C) są niepłodne. W akwakulturze zaburzenia takie wywołuje się celowo, nadając ich skutkom
znaczenie produkcyjne vide Życzyński (1997).
2.8.2. Aneuploidie
Aneuploidie są wynikiem zaburzeń typu nondisjunction (brak rozejścia się) w anafazie
mejotycznej. Nondisjunction może dotyczyć biwalentów (anafaza I) bądź chromatyd siostrzanych
(anafaza II). Dotyczy całych chromosomów/chromatyd, których wrzeciono podziałowe nie odciągnie
od rejonów homologicznych. Efektem braku rozejścia się w anafazie jest powstanie gamet z brakiem
lub nadmiarem jednego chromosomu. Z gamet takich powstają zygoty, których wartość 2n różni się
od normalnej. Uważa się, że zdecydowanie najczęściej aneuploidie powstają w wyniku zaburzeń
rozdziału biwalentów w I anafazie mejoz żeńskich. U ludzi istnieje statystyczna zależność między
wiekiem kobiet (który jest równy okresowi od zatrzymania koniugujących biwalentów w fazie
diplotenu – co ma miejsce już w momencie narodzin dziewczynki) a częstotliwością urodzeń
aneuploidalnego potomstwa. Najbardziej znaną aneuploidią autosomalną jest trisomia 21 (trzy
chromosomy 21 pary) zwana Zespołem Downa (47,XY, +21). Trisomia 13 pary chromosomów
powoduje objawy zwane Zespołem Pataua (47,XY + 13), a trisomia 18 pary jest przyczyną wystąpienia
Zespołu Edwardsa (47,XY + 18).
55
Szczególnie dobrze zbadane (zarówno w medycynie ludzkiej jak i weterynaryjnej) są
aneuploidie chromosomów płci. Nondisjunction biwalentu płciowego XX, bądź XY (anafaza I mejozy)
czy chromatyd siostrzanych chromosomu X lub Y (anafaza II) prowadzi ostatecznie do powstania
aneuploidalnych gamet 1n + 1, lub 1n – 1. Gdy gamety takie utworzą zygoty, otrzymujemy
aneuploidalne osobniki, trisomiczne 2n + 1,XXX, 2n+ 1,XXY, 2n + 1,XYY lub odpowiednio
monosomiczne 2n– 1,XO lub 2n – 1,YO. Te ostatnie u ssaków nie są żywotne.
Monosomia XO– u ludzi opisana jest jako Zespół Turnera 45,XO. Kobiety z tym zespołem mają
zaburzenia rozwojowe układu kostnego, niski wzrost oraz niedorozwój układu rozrodczego.
Monosomia XO (fot.2.30) została wielokrotnie opisana u zwierząt. U koni w przeciwieństwie do
Zespołu Turnera opisanego w medycynie ludzkiej, samice nie przejawiają widocznych cech
fenotypowych– pokrojowo nie odbiegają od normy (fot. 2.29). Przesłanką do podejmowanych analiz
cytogenetycznych bywa niepłodność a badania wykazują przy tym dysgenezję układu rozrodczego.
Fotografia 2.29. Arabska klacz Mimoza, u której zdiagnozowano monosomię 63,XO. Pokrój zwierzęcia nie
odbiega od normy. (P. Sysa– dzięki uprzejmości Autora)
Fotografia 2.30. Kariotyp arabskiej klaczy Mimozy. Monosomia 63,XO. Barwienie odczynnikiem Giemsy. (P.
Sysa– dzięki uprzejmości Autora)
56
Opisany został przypadek dwóch monosomicznych XO srebrnych lisów (Vulpes fulvus)– sióstr
z jednego miotu urodzonego na jednej z ferm w Finlandii. Obydwie lisice miały nieco mniejsze
rozmiary, oraz dysgenezję układy rozrodczego, w porównaniu z lisicami w tym samym wieku, ubitymi
w tej samej fazie sezonu produkcyjnego[Makinen, Valtonen 1984].
Trisomia XXY znana jest z medycyny ludzkiej jako Zespół Klinefeltera. Nosiciele tej mutacji są
metrykalnej płci męskiej. Odznaczają się wydłużonymi wobec tułowia kończynami, dość wysokim
wzrostem oraz zmniejszonymi narządami płciowymi (poza prąciem, które wykształca się
prawidłowo), są niepłodni. Aberrację tę opisywano między innymi u bydła. Przykładem jej
nosicielstwa jest buhaj rasy HF Wulkan– fotografia 2.31.
Fotografia 2.31. Buhaj 61,XXY Wulkan. (P. Sysa– dzięki uprzejmości Autora)
Podobnie jak w przypadku translokacji 1/29, diagnostyka tej nieprawidłowości jest u bydła łatwa i
może być oparta o konwencjonalne barwienie odczynnikiem Giemsy– fotografia 32 i 33.
Fotografia 2.32. Metafaza buhaja z trisomią XXY. Łatwo rozróżnialne, dwuramienne chromosomy płci
zaznaczone strzałkami oraz gwiazdką. Barwienie odczynnikiem Giemsy. (P. Sysa– dzięki uprzejmości Autora)
Fotografia 2.33. Kariotyp trisomicznego 61,XXY buhaja Wulkana. Barwienie odczynnikiem Giemsy. (P. Sysa–
dzięki uprzejmości Autora)
57
2.9. Prawa Mendla w świetle zasad podziału komórki
Znajomość praw Mendla Czytelnik, według założeń programów edukacyjnych, powinien
posiąść jeszcze w szkole średniej. Niemniej długoletnie doświadczenie z pracy dydaktycznej
podpowiedziało, że warto do materiału tego wrócić przy okazji omawiania podstaw cytogenetyki.
Pierwsze prawo Mendla to prawo czystości gamet. Oznacza w skrócie ni mniej ni więcej to, że w
gamecie może znaleźć się tylko jeden allel z każdego locus genowego. Oczywiście ma ono
zastosowanie jedynie w przypadku heterozygotyczności, gdyż tylko wtedy mamy do czynienia z
dwoma różnymi allelami. Innymi słowy można powiedzieć, że I prawo Mendla nie dotyczy
homozygoty (oczywiście przebieg podziału mejotycznego, prowadzący do wytworzenia gamet jest
identyczny dla homo i heterozygoty). Spójrzmy na to z pozycji dowolnego locus- np. A, w którym
wystąpiła heterozygotyczność Aa.
1. Komórka rozpoczynająca gametogenezę a więc podział mejotyczny przechodzi przez fazę S.
Wskutek replikacji na obu homologicznych niciach chromatynowych zawierających gen A powstają
jego kopie- powstaje układ AAaa (2n, 4C DNA).
2. Skondensowane chromosomy tworzą biwalent/tetradę, która w I metafazie mejotycznej ustawia
się centralnie w cytoplazmie komórki (fot.2. 25 i 2.26).
3. W anafazie I wrzeciono podziałowe rozciąga homologi do biegunów. Do jednego bieguna na
jednym homologu (dwuramiennym!) podążają allele AA a do drugiego, na homologu drugim aa.
Właściwie już od tego momentu I prawo Mendla jest zrealizowane. Wprawdzie jeszcze nie ma
klasycznej haploidalnej gamety 1n 1C (należy przypomnieć, że w przypadku oogenezy taka
haploidalna gameta jest pojęciem umownym, z uwagi na wstrzymanie II podziału mejotycznego aż do
momentu zapłodnienia) ale już występuje tylko jeden z dwóch wyjściowych alleli. Mamy więc układ
„czysty”, o którym mówi prawo Mendla. O dokonanej realizacji I prawa Mendla już po anafazie I nie
możemy mówić, gdy odcinek chromosomu zawierający locus A był zaangażowany w rekombinację.
Wskutek c/o na każdym segregującym w anafazie I homologu znajdują się wtedy dwa różne allele Aa,
równocześnie (kopia allelu na wewnętrznej chromatydzie homologa zamieniła się miejscem z kopią
allelu na chromatydzie wewnętrznej drugiego homologa). Do biegunów podążają dwa zestawy
heterozygotyczne Aa i Aa.
4. Anafaza II podziału mejotycznego rozciąga do biegunów komórki chromatydy siostrzane. W
biegunach, niezależnie czy locus A było objęte rekombinacją czy nie, znajduje się ostatecznie tylko
jeden allel z pary– A lub a. Gameta jest więc „czysta”!
58
II prawo Mendla to prawo niezależnego dziedziczenia się cech. Dotyczy tych cech, które są
warunkowane przez geny, których loci znajdują się w różnych– niehomologicznych chromosomach.
Ponieważ
segregacja
chromosomów
matczynych
i
ojcowskich
odbywa
się
niezależnie,
prawdopodobieństwo każdej kombinacji chromosomów po I anafazie mejotycznej jest takie samo.
Ilość kombinacji możliwego rozsortowania homologów do biegunów w anafazie I, obliczamy
podnosząc 2 (organizm diploidalny) do potęgi równej liczbie biwalentów, czyli 1n. Wynika z tego, że
im większa jest wartość 2n, tym więcej jest rodzajów powstałych gamet, różnych pod względem
udziału chromosomów każdego rodzica. Dla przykładu, gdy organizm ma 2n=6 (3 pary
chromosomów) to tworzy 8 różnych, pod względem rodzicielskiego pochodzenia, gamet. Proces
rekombinacji (crossing over) różnorodność gamet jeszcze zwiększa.
Gdy II prawo Mendla rozpatrujemy pod kątem niezależnego dziedziczenia cech
warunkowanych przez geny, liczbę możliwych do powstania w czasie anafazy I gamet obliczamy
podnosząc 2 do potęgi równej liczbie układów heterozygotycznych w rozważanych loci. I tak osobnik
potrójnie homozygotyczny pod względem trzech genów położonych na trzech różnych
chromosomach (np. aaBBCC) może wytworzyć tylko jeden rodzaj gamety aBC (zero układów
heterozygotycznych). Potrójna heterozygota w omawianych loci - (AaBbCc) przy trzech układach
heterozygotycznych może produkować 8 rodzajów różnych gamet – ABC, abc, .ABc, aBc, abC, aBC,
Abc, AbC.
2.9.1. Odstępstwa od praw Mendla
Istnieją sytuacje, gdy obserwujemy odstępstwa od praw Mendla. Najczęściej (choć nie tylko)
wynikają one z zaburzeń naturalnych procesów.
Pierwsze
prawo
Mendla
może
nie
obowiązywać
w
przypadku
non
dysjunctio
chromosomów/fragmentów zawierających geny w układzie heterozygotycznym. Gdy nastąpi błąd w
anafazie I, w jednym biegunie komórki będą jednocześnie dwa różne allele AAaa . Po anafazie II
powstają jądra gamet 1n + 1 z układem Aa. To, że gameta taka jako aneuploidalna, z definicji nie jest
prawidłowa, nie ma znaczenia z rozważanego punktu widzenia. Gameta w locus A nie jest czysta
(obecne są równocześnie oba allele). Podobny skutek nastąpi, gdy rejon z locus A uległ c/o w profazie
I mejozy a non dysjunctio miało miejsce w anafazie II, między chromatydami siostrzanymi z Aa. Znów
powstanie gameta „nieczysta” 1n + 1 z obydwoma allelami Aa równocześnie.
Inny przypadek odstępstwa od I prawa Mendla jest wynikiem poliploidyzacji, jaka miała
miejsce np. w niektórych rodzinach ryb (Cyprinidae, Salmonidae), będącymi filogenetycznymi
tetraploidami. W ich genomach wciąż są aktywne loci, występujące w zdublowanej ilości (izoloci).
Gdy znajdują się one na różnych, a więc niezależnie segregujących w anafazie I chromosomach, do
jednej gamety mogą trafić różne allele tego samego genu (izogenu) z różnych izoloci. Przykładem
59
takiego odstępstwa jest dziedziczenie pigmentacji łusek u karasia – interpretowane jako niealleliczne
(izoloci) według zasad epistazy dominującej podwójnej. Dominujący allel (dziedziczenie Pisum),
dominuje nie tylko nad recesywnym partnerem ze swojego własnego locus, lecz także nad
recesywnym allelem z drugiego izolocus. Ponieważ obydwa izoloci segregują niezależnie, przy
krzyżowaniu heterozygot (podwójnych) tetraploidalnych otrzymujemy rozkład fenotypowy 15:1 a nie
3:1.
Zatem, diploidalna gameta tetraploidalnego filogenetycznie organizmu może zawierać
równocześnie różne allele tego samego genu! Gametami „czystymi” będą gamety AA i aa a
„nieczystymi” Aa.
Skutki filogenetycznej poliploidyzacji możemy niekiedy obserwować śledząc przebieg gametogenezy.
W profazie mejotycznej dochodzi do powstawania multiwalentów, gdyż więcej jest odszukujących się
fragmentów homologicznych, często na różnych– niehomologicznych chromosomach (efekty różnych
translokacji). Takie multiwalenty bywają obserwowane w metafazach mejotycznych pstrąga
źródlanego (Salvelinus fontinalis) [Wright i wsp. 1983], czy poliploidalnych płazów[Rahn, Marinez
1983; Shmid i wsp. 1985].
Drugie prawo Mendla o niezależnym dziedziczeniu cech również nie ma charakteru
uniwersalnego. Jest oczywiste, że naturalnym ograniczeniem jest sprzężenie genów, a więc położenie
w tym samym chromosomie. Segregujący chromosom (jedno, czy dwuchromatydowy) przenosi do
komórki potomnej łącznie, wszystkie kombinacje alleli ze sprzężonych loci. Zatem, sprzężenie
ogranicza różnorodność gamet. Skutki sprzężeń w dużej mierze znosi rekombinacja, zwiększająca
możliwości powstających kombinacji.
Oprócz sprzężeń naturalnych miewamy do czynienia ze sprzężeniami sztucznymi, wynikłymi z
powstałych translokacji. Geny z różnych chromosomów, naturalnie segregujące niezależnie, wskutek
rearanżacji zaczynają segregować łącznie. Przykładem może być wymieniona wcześniej translokacja
1/29 u bydła. Wówczas geny mapowane na chromosomie 1 pary dziedziczą się razem z genami
chromosomu pary 29 a więc sprzecznie z zasadą niezależnej segregacji. U osobnika
heterozygotycznego pod względem translokacji, geny z wolnych homologów sprzężonej pary 1/29,
równocześnie w tej samej anafazie podlegają II prawu Mendla, co powoduje, że połowa genów z par
1 i 29 segreguje niezgodnie z II prawem Mendla (chromosom translokacyjny 1/29), podczas gdy druga
połowa (chromosomy 1 i 29) segreguje normalnie, prawu temu podlegając.
Ominięcie II prawa Mendla ma miejsce podczas rozrodu mieszańców hybrydogenetycznych.
Czasem mieszaniec dwóch pokrewnych form wykazuje nietypowy przebieg mejozy. Chromosomy
każdego z rodziców mieszańca segregują w anafazie I łącznie, mimo braku jakiegokolwiek fizycznego
sprzężenia, zgodnie ze swym pochodzeniem. Mieszaniec wytwarza wtedy jedynie dwa rodzaje gamet
(a nie 2 do potęgi n) a właściwie tylko jeden, gdyż gamety z chromosomami drugiego rodzica zostają
60
gubione w szlaku płciowym. Przykładem mieszańca hybrydogenetycznego jest żaba wodna
(Pelophylax esculentus) powstająca z krzyżówek żaby śmieszki (Pelophylax ridibundus) z żabą
jeziorową (Pelophylax lessonae). Znane są liczne przykłady hybrydogenezy u ryb. Hybrydogenezie
towarzyszy często podniesienie ploidalności do poziomu 3n [Berger, Rogulski 1978; Ogielska i wsp.
2004].
Literatura do rozdziału 2
1. Abdel-Hameed F., Shoffner R.N., 1971 - Intersexes and sex determination in chickens. Science
172, 962-964
2. Andraszek K., Smalec E. 2011. Comparison of active transcription regions of lampbrush
chromosomes with the mitotic chromosome G pattern in the European domestic goose
Anser anser. Archiv Tierzucht 54; 1: 69-82
3. Ansari H., Tagaki N., Sasaki M., 1988 - Morphological differentiation of sex chromosomes in
three species of ratite birds. Cytogenetics and Cell Genetics 47, 185-188
4. Berger L., Rogulski H. 1978. Ploidy of progeny from different size egg classes of Rana
esculenta L. Folia Biologica (Cracow) 26: 231-248.
5. Brown T.A. Genomy. Wydawnictwo Naukowe PWN. Warszawa 2001.
6. Burt D.W. 2002. Origin and evolution of avian microchromosomes. Cytogenetics and Genome
Research 96: 97-112.
7. Caspersson T., Farber S., Foley G.E., Kudynowski J., Modest E.J., Simonsson E., Wagh U., Zech
L. 1968. Chemical differentiation along metaphase chromosomes. Experimetal Cell Reaserch
49: 219-222.
8. Fedyk S., Sysa P.S. 1971. Chromosomes of European Bison, Domestic Cattle and their hybrids.
Acta Theriologica. Vol. XVI, 30: 465-470.
9. Gordon M.1947. Genetics of Platypecilus maculatus. IV. The sex determining mechanisms in
two wild population in the Mexican platyfish. Genetics 32: 8-17.
10. Gustavsson I., Stundt K.O. 1969. Three polymorphic chromosome systems in centric fusion
type in a population of Manchurian sikadeer (Cervus nippon hortulonum Swinhoe).
Chromosoma 28: 245-254.
11. Hayes H., Petit D., Dutrillaux B. 1991. Comparison of RBG-banded karyotypes of cattle, sheep
and goats. Cytogenet. Cell Genet. 57: 51-55.
12. Jaszczak K., Parada R., Słoniewski K. 1998. Two morphologic forms of chromosome Y In
Piedimontese cattle. Anim. Sci. Papers. Rep. 16: 5-11.
61
13. Jaszczak K., Parada R., Krzywiński A. 2004. Cytogenetic variation in farmer stock of
Dybowski’s Sika Deer. Folia Biologica (Kraków), vol. 52 nr 1-2.
14. Kozubska-Sobocińska A., Słota E., Pakusiewicz M. 2006. Analiza porównawcza wzorów
prążków G w kariotypie daniela Dama dama i kozy Capra hircus. Rocz. Nauk Zoot., T. 33 z.2
(2006): 235-240.
15. Kupper C., Augustin J., Edwards S., Szekedy T., Kosztolanyi A., Burke T., Janes D.E. 2012.
Triploid plower female provides support for the role of the W chromosome in avian sex
determination. Biol. Lett. October 23 8(5): 787-789
16. Levan A., Fredga K., Sandberg A. 1964. Nomenclature for centromeric position on
chromosomes. Hereditas 52: 201-220.
17. Makinen A., Valtonen M. 1984. The XO syndrome in the silver fox (Vulpes fulvus Desm.). 6th
European Colloquium on Cytogenetics of domestic animals. July 16-20. Zurich. Switzerland.
18. Mirsky A. E.; Ris H. 1951. The DNA content of animal cells and its evolutionary siginificance. J.
Gen. Physiol. 34: 451-462.
19. Miura I, Ohtani H, Kashiwagi A, Hanada H, Nakamura M. 1996. Structural differences
between XX and ZW sex lampbrush chromosomes in Rana rugosa females (Anura: Ranidae).
Chromosoma Oct. (4): 237-241.
20. Musilova P., Kubickova S., Horin P., Vodicka R., Rubes J. 2008. Karyotipic relationship among
Asiatic asses (kulan and kiang) and domestic horse using horse chromosome specific arm
probes. 18 international colloquium of animal cytogenetics and gene mapping. June 08-10.
Bucharest. Romania.
21. Ocalewicz K, Fopp-Bayad D., Woźnicki P. Jankun M. 2008. Heteromorphic sex chromosomes
in the ninespine stickleback Pungitius pungitius. Journal of Fish Biology. 73: 456-462.
22. Ogielska M., Kierzkowski P., Rybacki M. 2004. DNA content and genome composition of
diploid and triploid water frogs belonging to Rana esculenta complex (Amphibia, Anura). Can.
J. Zool. 82: 1894-1901.
23. Olszewska M. i współ. 1981. Metody badania chromosomów. PWRil. Warszawa 1981.
24. Power M.M. 1984. Comparative R banding in the horse, donkey and zebra. 6th European
Colloquium on Cytogenetics of Domestic Animals. Zurich. July 16-20. pp. 145-155.
25. Rahn I.M., Marinez A. 1983. Chromosome pairing in female and male diploid and polyploidy
anuras (Amphibia) from South America. Can. J. Genet. Cytol. Vol 25: 487-494.
26. Schmid M., Haaf T., Geile B., Sims S. 1983. Chromosome banding in Amphibia VIII. An unusual
XY/XX sex chromosome system in Gastroteca riobambae (Anura, Hylidae). Chromosoma
88(1): 69-82.
62
27. Schmid M., Haaf T., Schempp W. 1985. Chromosome banding in Amphibia IX. The polyploidy
karyotypes of Odontophrynus americanus and Ceratophrys ornate (Anura, Leptodactylidae).
Chromosoma (Berl) 91: 172-184.
28. Sysa P.S., Jaszczak K. 1976. . Dlouhy chromosom Y u plemena charolais. 8 Dni Genetyky
Gospodarskich Zvierat, Wysoke Tatry.
29. Sysa P.S. 1982. Polimorfizm chromosomów zwierząt domowych. Postępy Biologii Komórki.
Tom 9. nr 2: 271-296.
30. Świtoński M., Słota E., Jaszczak K. 2006. Diagnostyka cytogenetyczna zwierząt domowych.
Wyd. Akademii Rolniczej im. A. Cieszkowskiego w Poznaniu.
31. Tagaki N., Itoh M., Sasaki M., 1972 - Chromosome studies in four species of ratitae (Aves).
Chromosoma 36, 281-291
32. Tave D. 1986. Genetics for Fish Hatchery Managers. AVI Publishing Company, Inc. Westport,
Connecticut. 1986.
33. Thorgaard G. 1977. Heteromorphic sex chromosomes in male rainbow trout. Science 196:
900-902.
34. Thorne M.H., Sheldon B.L., 1993 - Triploid intersex and chimeric chickens - useful models for
studies of avian sex determination. Wyd. REED K.C., GRAVES J.A.M. Sex chromosomes and
sex-determining genes, 199-205.
35. Woyke J. 1976. Population Genetics studies and sex alleles in the honeybee using the
example of the Kangaroo Island bee sanctuary. J. Apicul. Res. 15(3/40: 105-123.
36. Wright J.Jr., Johnson K., Hollister A., May B. 1983. Meiotic models to explain classical linkage,
pseudolinkage and chromosome pairingin tetraploid derivative salmonid genomes. In
isozymes: Current Topics in Biological and Medical Reaserch, Vol 10: Genetics and Evolution.
M.C. Rattazi, J. G. Scandalio, and G.S. Whitt, Eds. Alan R, Liss, NY.: 239-260.
37. Życzyński A. (1997) Biotechnologia Zwierząt – praca zbiorowa. Rozdział XIX – Biotechnologia
w Rybactwie. PWN Warszawa.
Podziękowania:
Pragnę złożyć serdeczne podziękowania Koleżankom i Kolegom z krajowych laboratoriów
cytogenetycznych za udostępnienie cennych zdjęć, które bardzo podniosły wartość tego pracowania:
profesorom Ewie Słocie, Pawłowi Sysie, Monice Bugno oraz doktorom Annie Zaleśnej, Annie
Kozubskiej- Sobocińskiej, Ewie Wójcik, Rafałowi Paradzie i Jarosławowi Sosnowskiemu.
63
Zadania do rozdziału 2
Zadanie 2.1
Czym różni się obraz metafazy mitotycznej od metafazy mejotycznej I?
Zadanie 2.2
Czym różni się obraz metafazy mitotycznej od metafazy mejotycznej II?
Zadanie 2.3
Opisz wszystkie możliwe scenariusze prowadzące do powstania trisomii 2n + 1 XXX, 2nXYY oraz
trisomii 2n + 1XXY wskutek non dysjunctio.
Zadanie 2.4
U pewnego organizmu wartość 2n = 4. Kariotyp składa się z jednej pary dużych submetacentryków
oraz jednej pary małych telocentryków. Na chromosomie submetacentrycznym, blisko telomeru
ramienia q znajduje się locus A. Blisko centromeru telocentryka położone jest locus B.
Narysuj:
- obraz metafazy mitotycznej ,
- obraz po anafazie mitotycznej – jądra pochodne,
- obraz metafazy mejotycznej I,
- oraz metafazy mejotycznej II,
- wszystkie jądra po anafazie mejotycznej II.
Rozpatrywany osobnik jest podwójną heterozygotą AaBb. Na schematach powinny być
przedstawione czytelnie losy każdego allelu (każdej literki –dużej i małej).
Zadanie 2.5
U pewnego organizmu wartość 2n = 4. Kariotyp składa się z jednej pary dużych submetacentryków
oraz jednej pary małych telocentryków. Na chromosomie submetacentrycznym, blisko telomeru
ramienia q znajduje się locus A. W odległości 40cM od A znajduje się locus locus B a o 25cM dalej w
kierunku centromeru locus C. Blisko centromeru telocentryka położone jest locus D. Rozpatrywany
osobnik jest potrójną heterozygotą AaBbCc w układzie przyciągania i homozygotą dd w locus D.
Narysuj:
- metafazę mitotyczną,
- wszystkie metafazy mejozy I wraz z podaniem ich liczbowego rozkładu,
- wszystkie jądra po anafazie mejotycznej II z podaniem ich liczbowego rozkładu.
Odpowiedzi do zadań zostały pominięte, ponieważ czytelnik powinien najpierw samodzielnie
wykonać wszystkie rysunki a później je konsultować.
64
3. Dziedziczenie Mendlowskie
Autorzy: Andrzej Życzyński; Elżbieta Wirth- Dzięciołowska
Obserwacje dotyczące większego podobieństwa osobników należących do jednej rodziny w
porównaniu całą populacją przeprowadzano już przed wiekami. Dotyczyło to nie tylko cech łatwych
do scharakteryzowania jak np. kształt twarzy, nosa, stopy czy koloru oczu lub włosów, ale także
szeregu cech typowych dla gatunku. Jak dotąd potomkiem człowieka był człowiek, psa-pies, czy kotakot. Te zagadnienia wyjaśnia dziedziczność, czyli zespół procesów prowadzących do powstawania
organizmów potomnych, u który w różnym stopniu przejawiają się cechy organizmów rodzicielskich.
Podstawy dziedziczenia obejmują dwa główne zagadnienia Pierwsze; w jaki sposób przekazywane są
cechy z pokolenia na pokolenie, czyli co leży u podstaw dziedziczenia? Druga sprawa związana jest z
poznaniem natury czynników dziedzicznych, ich działania, rodzajem i zakresem zmienności.
Odpowiedź na pierwsze pytanie dał Grzegorz Mendel i jego następcy wprowadzając pojęcie genu i
allelu oraz ich lokalizacji w chromosomach. Na drugie pytanie daje nam odpowiedź między innymi
genetyka molekularna, ale im bardziej ją zgłębiamy, tym więcej pytań wymaga odpowiedzi.
Zanim przejdziemy do bardziej złożonych zagadnień spróbujmy wyjaśnić podstawowe
zagadnienia dziedziczności. Podstawową jednostką dziedziczności jest gen. Gen zajmuje określone
miejsce w chromosomie i w zasadzie w każdym organizmie* występuje w podwójnej postaci, czyli w
postaci dwóch alleli, które zlokalizowane są na chromosomach homologicznych. Jeśli oba allele są
identyczne, mówimy, że osobnik pod względem danego genu jest homozygotą, jeśli zaś na każdym z
chromosomów homologicznych w określonym locus znajdują się różne formy genu, różne allele,
mówimy, że mamy do czynienia z heterozygotą. Między poszczególnymi allelami danego genu mogą
być różne rodzaje oddziaływania dające w wyniku różne formy warunkowanej przez dany gen cechy.
Każdy organizm charakteryzuje się cechami, które można opisać słownie np. biały, czerwony,
niebieski, rogaty, bezrogi, itp. Cechy takie określamy mianem cech jakościowych– w przypadku
zmienności tworzą odrębne, łatwe do rozróżnienia klasy. Mogą one być uwarunkowane jedną lub
kilkoma parami alleli. Zatem w kolejnych podrozdziałach będziemy analizować skutki rożnych
rodzajów współdziałania allelicznego– skutki oddziaływań w obrębie tej samej pary (w obrębie tego
samego locus) i nieallelicznego– gdy na dany efekt składa się współdziałanie alleli z różnych loci.
65
3.1. Współdziałanie alleliczne
Współdziałanie alleli w kształtowaniu cechy w obrębie tego samego locus nazywamy
współdziałaniem allelicznym.
Można wyróżnić cztery zasadnicze rodzaje takiego współdziałania: dominacja zupełna, dominacja
niezupełna, kodominacja i naddominacja. Kolejno omówimy poszczególne rodzaje współdziałania
allelicznego. Zanim do tego przejdziemy, warto zaznajomić Czytelnika z pewnymi umownymi
symbolami, które obowiązują w większości współczesnych tekstów z dziedziny genetyki. Symbol
(nazwę) genu zapisujemy kursywą– pismem pochylonym. Gdy mamy na myśli produkt genu– cechę,
kodowane białko– wówczas używamy pisma normalnego. I tak gen A warunkuje cechę A– np. gen Est
I powoduje powstanie białka Est I– czyli esterazy I. Gdy allele tego samego genu zapisujemy różnymi
literami dużą i małą, oznacza to że ich wzajemna relacja opiera się na pełnej dominacji (vide
podrozdział 3.1.1). Gdy symbole alleli piszemy tą samą literą, lecz różnicujemy je za pomocą różnych
indeksów (górnych, dolnych itp.) to mamy do czynienia z dominowaniem niepełnym (vide rozdział
3.1.2).
Symbolem „+” oznaczamy allel typu „dzikiego” tzn. występujący powszechnie w populacjach
naturalnych, dzikich. Uznajemy go umownie za formę wyjściową genu, w odróżnieniu od mutacji,
rozpowszechnionych i utrwalonych w populacjach hodowlanych. Allel dziki + ma najczęściej postać
dominującą wobec alleli zmutowanych, ale nie jest to regułą. Symbolem kropki oznaczamy
dowolność podstawienia w genotypie dającym określony fenotyp. Dotyczy to oczywiście
dominowania pełnego, gdzie ten sam fenotyp może być warunkowany zarówno homozygotą
dominującą jak i heterozygotą (tekst poniżej). I tak „A.” oznacza fenotyp A niezależnie czy wynika on
z układu alleli „AA” czy „Aa”.
3.1.1. Dominacja całkowita
Dominacja całkowita (pełna) ma miejsce wtedy, gdy obecność jednego allelu
(dominującego), nie pozwala na ujawnienie się działania drugiego allelu nazywanego allelem
recesywnym. Oznacza to, że fenotyp osobnika o genotypie homozygotycznym, który ma oba allele
dominujące jest taki sam, jak fenotyp osobnika heterozygotycznego, który ma jeden allel dominujący,
a drugi recesywny. Taki rodzaj współdziałania nazywamy też dziedziczeniem typu Pisum– od
łacińskiej nazwy groszku. Analiza sposobu dziedziczenia barw kwiatów posłużyła Grzegorzowi
Mendlowi do sformułowania praw dziedziczenia. W ten sposób dziedziczy się wiele cech, między
innymi bezrożność i rogatość, czarne i czerwone umaszczenie, łaciatość i jednolite umaszczenie
bydła, czarne i czekoladowo-brązowe umaszczenie czy czarne i stalowo-błękitne umaszczenie psów,
66
krótki i długi włos psów lub kotów, białe i czarne umaszczenie owiec oraz szereg innych cech. Sposób
dziedziczenia z pełną dominacją rozważmy na podstawie poniższego przykładu.
Przykład 3.1
Barwa biała warunkowana allelem A u owiec jest dominująca w stosunku do barwy czarnej (allel
recesywny a). Owce białe mogą więc mieć genotyp AA albo Aa, owce czarne mają zawsze genotyp
aa. Jaki będzie efekt kojarzenia białego homozygotycznego tryka AA z czarno umaszczoną maciorką
aa?
P (oznaczenie pokolenia rodzicielskiego)
biały ♂ x
czarna ♀
AA
aa
gamety
A
A
a
a
częstość
½
½
½
½
F1(oznaczenie pierwszego pokolenia potomnego)
Aa
Aa
Aa
Aa
białe heterozygoty
Aby przeanalizować efekty kojarzenia między sobą osobników heterozygotycznych, możemy
posłużyć się szachownicą Punnett`a. W kolumnie zewnętrznej zaznaczamy gamety, jakie produkuje
np. osobnik żeński, pod względem analizowanych przez nas alleli, a w górnym rzędzie, rodzaje gamet
produkowanych przez drugiego rodzica. Można również w tabeli zaznaczyć częstość wytwarzania
poszczególnych typów gamet, co pozwala na wyliczenie prawdopodobieństwa pojawienia się w
potomstwie osobników o poszczególnych genotypach i fenotypach.
Jeżeli kojarzone owce białe są heterozygotyczne, to:
♀/♂
F2 (oznaczenie drugiego pokolenia potomnego)
A
½
a
½
AA
A
½
AA
½x½=¼
Aa
½x½=¼
Aa
Aa
Stosunek fenotypowy u potomstwa:
3
Białe
a
½
Aa
½x½=¼
aa
½x½=¼
aa
:
1
Czarne
Stosunek genotypowy u potomstwa 1:2:1
67
Taki wynik kojarzenia oznacza, że w przypadku urodzenia się tylko jednego jagnięcia mamy 75%
prawdopodobieństwa, że będzie ono białe, a 25% prawdopodobieństwa, że będzie czarno
umaszczone. W praktyce oznacza to, że urodzenie po dwóch biało umaszczonych rodzicach białego
jagnięcia wcale nie wyklucza tego, że oboje rodzice są heterozygotami– nosicielami recesywnego
allelu barwy czarnej. Właśnie, dlatego w stadzie białych owiec od pokoleń hodowanych tylko o tym
umaszczeniu, czasami rodzi się czarne jagnię.
Powstaje tu więc pytanie. Jaką cechę można szybciej utrwalić w populacji, uwarunkowaną allelem
dominującym czy allelem recesywnym? Rozważmy to na przykładzie.
Przykład 3.2
Hodowca owiec chce uzyskać wszystkie jagnięta w tym samym kolorze. Czy powinien zdecydować się
na hodowlę wyłącznie owiec białych, czy czarnych?
Jak wynika z poprzedniego przykładu, jeśli będzie hodował wyłącznie owce białe, to może wśród nich
mieć homozygoty i heterozygoty. Ich zapis fenotypowy można przedstawić jako A. co oznacza, że
osobniki są białe, ale nie wiemy czy są homozygotami czy heterozygotami. (W miejsce kropki można
wpisać a lub A– fenotyp się nie zmieni). Kojarząc dwie homozygotyczne owce białe AA x AA uzyska
całe potomstwo białe AA. Kojarząc owce białe, z których jedna jest homozygotą, a druga
heterozygotą uzyskamy całe potomstwo fenotypowo jednorodne - białe, ale pod względem genotypu
będzie 50% homozygot AA i 50% heterozygot Aa.
Rodzice AAxAa
♂/♀ A
A
AA
A
AA
a
Aa
Aa
Przy kolejnych kojarzeniach białych osobników między sobą, może zdarzyć się kojarzenie między
dwoma heterozygotami i wtedy istnieje szansa 1 na 4 potomków, urodzenia się osobnika o
umaszczeniu czarnym.
Rodzice Aa x Aa
♂/♀ A
a
A
AA Aa
a
Aa aa
Inaczej przedstawia się sytuacja, gdy hodowca zdecyduje się na hodowlę osobników o czarnym
umaszczeniu. W związku z tym, że jest to cecha uwarunkowana allelem recesywnym, osobniki czarne
muszą być homozygotami recesywnymi.
68
Rodzice (tylko homozygoty)
aa x aa
♂/♀ a
a
a
aa aa
a
aa aa
W tym przypadku możemy oczekiwać, że całe potomstwo będzie miało takie samo umaszczenie jak
rodzice (aa).
Z przedstawionego przykładu wynika jeszcze jedna przesłanka: Cechę uwarunkowaną allelem
dominującym jest trudno utrwalić w potomstwie, natomiast cechę o charakterze recesywnym
można utrwalić już w pierwszym pokoleniu potomnym.
Z przytoczonego przykładu wynika, że w przypadku cechy dominującej, nie jesteśmy w stanie
rozróżnić homozygotycznych osobników od heterozygotycznych wyłącznie na podstawie fenotypu.
Czy zatem istnieje jakiś sposób, aby usunąć z hodowli osobniki heterozygotyczne?
W tym celu można wykorzystać dwie metody oparte na przeprowadzeniu odpowiednich kojarzeń.
Pierwsza z nich to tzw. krzyżowanie testowe, które polega na skojarzeniu osobnika o cesze
dominującej z osobnikiem homozygotycznym o cesze recesywnej. Jeśli testowany osobnik jest
heterozygotą, powinna urodzić się połowa potomstwa o fenotypie recesywnym (homozygot).
Rodzice Aa x aa
♂/♀
A
a
a
Aa
aa
a
Aa
aa
Z takiej krzyżówki uzyskujmy potomstwo białe (Aa) i czarne (aa) w stosunku 1:1
Inną metodą jest kojarzenie testowanego osobnika ze znaną heterozygotą– wtedy wśród
uzyskanego potomstwa, możemy oczekiwać ¼ osobników o fenotypie recesywnym. (patrz przykład 2)
Wynik kojarzenia testowego wykluczający nosicielstwo „podejrzanego” osobnika– czyli urodzenie się
wyłącznie potomstwa o fenotypie dominującym- będzie wiarygodny jedynie wtedy, gdy uzyskamy
dostatecznie liczne potomstwo Z drugiej strony, jeśli urodzi się chociaż jeden potomek o fenotypie
homozygoty recesywnej wiemy już, że oboje jego rodzice byli heterozygotami– nosicielami genu
recesywnego.
69
3.1.2. Dominacja niepełna (dziedziczenie pośrednie)
W przypadku dominacji niepełnej fenotyp heterozygot ma charakter pośredni między
fenotypem homozygotycznych osobników rodzicielskich np. po skrzyżowaniu wyżlinu (Antirrhinum
majus) o kwiatach czerwonych z rośliną o kwiatach białych, otrzymujemy całe potomstwo o kwiatach
różowych. Ten typ współdziałania nazywamy też współdziałaniem typu Zea, od łacińskiej nazwy
kukurydzy. Tak dziedziczy się u zwierząt np. długość uszu u owiec– uszy normalnej długości,
częściowo skrócone (heterozygota) i szczątkowe, u koni– umaszczenie, intensywny pigment (np.
kasztan), rozjaśniony pigment (heterozygota, np. izabelowaty) i skrajnie rozjaśniony pigment (np.
Cremello), u kur andaluzyjskich umaszczenie czarne, stalowo– błękitne (heterozygota) i białe, u kur
szurpatość (pióra pokrywowe bez haczyków) a także szereg innych cech. Cechą charakterystyczna
tego typu dziedziczenia jest brak dominacji jednego allelu nad drugim w heterozygocie. Dlatego dla
odróżnienia zapisu dziedziczących się w ten sposób cech od dziedziczenia z dominacją pełną,
stosujemy w zapisie symboli litery tej samej wielkości (litery duże lub litery małe), ale z dodatkowym
znacznikiem np. wspomniana szurpatość u kur: FF– szurpaty, F’F- słabo szurpaty i F’F’- normalny.
Przykład 3.3
Hodowca drobiu andaluzyjskiego chce uzyskać wyłącznie niebieskie kurczęta. Który wariant
kojarzenia powinien wybrać?
a) Kojarzyć niebieskie kury z niebieskimi kogutami?
b) Kojarzyć białe kury z niebieskimi kogutami?
c) Kojarzyć białe kury z czarnymi kogutami?
Ad a) niebieska kura CC’ x niebieski kogut CC’
♂/♀ C
C’
C
CC CC’
C’
CC’ C’C’
Stosunek fenotypowy wynosi 1:2:1, czyli jest zgodny ze stosunkiem genotypów.
(¼ kurcząt białych, ½ niebieskich i ¼ czarnych).
Ad b) Biała Kura CC x niebieski kogut CC’
♂/♀ C
C
C
CC CC
C’
CC’ CC’
Stosunek fenotypowy 1:1, czyli ½ kurcząt białych i ½ kurcząt niebieskich.
70
Ad c) Białe kury CC x czarny kogut C’C’
♂/♀ C
C
C’
CC’ CC’
C’
CC’ CC’
Wszystkie kurczęta niebieskie
Odpowiedź: Wyłącznie niebieskie kurczęta uzyskamy kojarząc miedzy sobą ptaki czarne i biało
upierzone wariant c).
Z tego przykładu wynikają jeszcze inne wioski. Przy dziedziczeniu z niepełną dominacją każdy
genotyp ma swój fenotyp, co oznacza, że na podstawie fenotypu jesteśmy w stanie określić
genotyp. Drugi wniosek, to niemożność utrwalenia fenotypu heterozygot. Zawsze z kojarzenia ich
między sobą, otrzymamy rozszczepienie cechy na trzy fenotypy.
3.1.3. Kodominacja
Ten rodzaj współdziałania występuje wtedy, gdy badamy dziedziczenie się zdolności do
wytwarzania określonych typów białek, np. różnych rodzajów hemoglobiny czy antygenów
krwinkowych. Wtedy w fenotypie heterozygot ujawniają się obie formy cechy. Oba allele są
równorzędne w stosunku do siebie. Przykładem tego typu współdziałania jest dziedziczenie grup
krwi, chociaż tu też można zaliczyć umaszczenie bydła rasy Shorthorn– czerwone, białe i dereszowate
(nazywane też mroziatym, heterozygota ma przemieszane włosy białe i czerwone). Przy tym typie
dziedziczenia, podobnie jak przy niepełnej dominacji oznaczenie alleli powinno być literami tej samej
wielkości.
Przykład 3.4
Jednolita czerwona barwa bydła rasy shorthorn uwarunkowana jest dominującym allelem M z locus
M (zidentyfikowanym na poziomie molekularnym jako gen MGF). Allel przeciwstawny M’ warunkuje
barwę
białą. Zwierzęta heterozygotyczne
MM’ mają umaszczenie mroziate. Czerwona,
homozygotyczna krowa MM skojarzona z czerwonym homozygotycznym buhajem może urodzić
wyłącznie czerwone, także homozygotyczne cielęta. Podobnie biała homozygotyczna krowa M’M’
skojarzona z białym homozygotycznym buhajem M’M’ urodzi białe homozygotyczne cielęta. A co się
stanie, jeśli skojarzymy ze sobą dwa heterozygotyczne, mroziate zwierzęta?
♀/♂
M
½
M’
½
M
½
MM
½x½=¼
czerwone
M’
½
MM’
½x½=¼
mroziate
MM’
½x½=¼
mroziate
M’M’
½x½=¼
białe
71
Stosunek fenotypowy potomstwa wynosi 1:2:1– jeśli urodzi się tylko jedno cielę, to
prawdopodobieństwo, że będzie ono czerwone wynosi ¼, mroziate ½, lub białe ¼.
W tym wypadku stosunek fenotypowy = stosunkowi genotypowemu 1:2:1 .
3.1.4. Naddominowanie
Ten typ dziedziczenia występuje wyjątkowo rzadko, i polega na tym, że genotyp
heterozygotyczny warunkuje większą ekspresję cechy niż którykolwiek z dwóch genotypów
homozygotycznych. Tak np. jest skojarzeniu dwóch roślin o kwiatach czerwonych gdy w potomstwie
czerwień kwiatów będzie jeszcze mocniejsza lub gdy kojarzone ze sobą myszy o normalnej liczbie
płytek krwi (800 K/μl) z myszami z niedoborem krwinek (200 K/μl). W F1 uzyskano wszystkie
zwierzęta o liczbie płytek krwi powyżej 1200 K/μl.
3.1.5. Współdziałanie addytywne
Do czterech podstawowych form współdziałania allelicznego możemy dorzucić jeszcze
współdziałanie addytywne– sumujące. Niemniej jak długo poruszamy się w obrębie jednego locus,
wyróżnienie to wydaje się cokolwiek sztuczne, gdyż nie daje innych stosunków genotypowych i
fenotypowych niż współdziałanie typu Zea, czy kodominacja. Różnica leży jedynie w zdefiniowaniu
cechy, która ma w tym wypadku charakter ilościowy, wyrażany jednostkami metrycznymi a nie
kategoriami jakościowymi, opisowymi. (kolor, kształt itp.). Wyobraźmy sobie hipotetyczne,
polimorficzne locus A, z allelem A, którego ekspresja daje 7 jednostek omawianej cechy, oraz allelem
A1 warunkującym 3 jednostki. Homozygoty AA i A1A1 będą wykazywały odpowiednio 14 i 6
jednostek a heterozygota 10 (7+3). Kojarząc dwie heterozygoty (dziesiątki) otrzymamy w potomstwie
stosunek 1:2:1 (czternastkę, dwie dziesiątki i szóstkę) a przy kojarzeniu heterozygoty z homozygotą
stosunek 1:1. By przyzwyczaić Czytelnika do analizowania cech ilościowych, wyniki takich kojarzeń
przedstawiamy nie na tradycyjnej szachownicy Punnett’a lecz na wykresach, ujmujących zależność
częstotliwości genotypu od jego wartości, w poszczególnych kojarzeniach. Sprawdzianem czy mamy
do czynienia z addytywnym współdziałaniem w obrębie jednego locus jest równość wartości
heterozygoty ze średnią arytmetyczną obu przeciwstawnych homozygot. Rozbieżność tych wartości
(wartość heterozygoty jest różna od średniej arytmetycznej dwóch homozygot) świadczy o innym niż
addytywne współdziałaniu obu alleli, co będzie omawiane szczegółowo na przedmiocie „Metody
Pracy Hodowlanej” w ramach tematu „Analiza wariancji na modelu jednego locus”.
3.1.6. Plejotropia
W przypadku działania genu, ciekawym zjawiskiem jest plejotropia. Polega na tym, że
pojedynczy allel może wpływać na dwie różne cechy, np. recesywny allel warunkujący albinizm
72
powoduje nie tylko białą barwę włosów, jasną skórę, ale również jasnoniebieską barwę oczu oraz
krótkowzroczność. Dominujący allel z innego locus warunkujący białą barwę sierści u kotów czy psów,
powodujący również jasno niebieską barwę oka, warunkuje jednocześnie głuchotę zwierząt.
Niebieskie bb lub złote gg karpie wykazują gorszy wzrost. Około 17 uwarunkowań o plejotropowym
charakterze przypisano różnym genotypom decydującym o typie ułuszczenia u karpi [4, 9]._Zależnymi
od wzoru ułuszczenia okazały się między innymi takie cechy jak masa ciała roczniaków i dwulatków,
wychowywanych w różnych środowiskach, liczba promieni w poszczególnych płetwach, liczba zębów
gardłowych, tempo metabolizmu, zdolność do regeneracji i inne. Tego typu plejotropia jest wynikiem
mutacji, która miała miejsce we wczesnym stadium rozwoju prenatalnego. Dotyczy ona pierwotnych
komórek zarodkowych, z których następnie rozwijają się poszczególne tkanki czy narządy, pełniące
różne funkcje docelowe. Efekt plejotropowy może wynikać również z wzajemnego oddziaływania
ścieżek metabolicznych białek , warunkowanych poprzez allele z różnych loci.
Innym przykładem plejotropii może być mutacja genu Jak2 (kinazy tyrozynowej Janus 2)
zachodząca w komórkach macierzystych szpiku u osób dorosłych, która może prowadzić do
czerwienicy prawdziwej, nadpłytkowości samoistnej, zwłóknienia szpiku, ale także do pewnych form
białaczki. Kolejnym przykładem może być mutacja powodująca sierpowatość krwinek czerwonych,
która nie tylko zmienia ich kształt, ale prowadzi do anemii, a występując w pojedynczej dawce,
powoduje odporność na malarię. Omówione zagadnienia, to przykłady. plejotropii prawdziwej. W
przypadku, gdy pewne cechy wykazują tendencję do wspólnego występowania, ale wynikają z
bliskiego położenia genów w jednym chromosomie, mówimy o plejotropii rzekomej, (więcej
przykładów plejotropii przedstawiono w rozdziale 6).
3.2. Niezależne dziedziczenie cech
Nie zawsze interesuje nas dziedziczenie pojedynczej cechy. Często, szczególnie w sytuacji, gdy
chcemy uzyskać nowe kombinacje cech, analizujemy dziedziczenie się dwu lub trzech cech. Możemy
mieć wtedy do czynienia z niezależnym dziedziczeniem się cech, przy spełnionym podstawowym
warunku, że geny determinujące te cechy mają swoje loci w różnych chromosomach. Grzegorz
Mendel badając sposób dziedziczenia barwy i kształtu nasion u groszku stwierdził, że cechy te
dziedziczą się niezależnie (II prawo Mendla). W przypadku niezależnego dziedziczenia cech,
segregacja alleli jednej pary podczas mejozy jest niezależna od segregacji alleli drugiej pary. Inaczej
mówiąc, z takim samym prawdopodobieństwem allel dominujący jednej pary może spotkać się w
gamecie z allelem dominującym lub recesywnym drugiej pary (szczegółowe wyjaśnienia w rozdziale
IV).
73
Przykład 3.5
Niezależne dziedziczenie cech spróbujmy wyjaśnić na przykładzie dziedziczenia rogatości i barwy
głowy u bydła. Bezrożność warunkowana allelem P dominuje nad rogatością warunkowaną allelem p.
Biała głowa (allel H) jest cechą dominującą względem barwnej głowy (allel h). Jakiego rozkładu
fenotypów możemy spodziewać się wśród potomstwa uzyskanego z kojarzenia homozygotycznego
białogłowego, bezrogiego buhaja z rogatą krową o barwnej głowie:
bezrogi białogłowy ♂
P
rogata barwna głowa ♀
PPHH
gamety
PH
PH
F1
PpHh
pphh
PpHh
ph
bezrogie białogłowe
PpHh
ph
PpHh
F2
♂/♀ PH
¼
PH
PPHH
¼
¼ x ¼ = 1/16
bezr. biał.
Ph
PPHh
¼
¼ x ¼ = 1/16
bezr. biał.
pH
PpHH
¼
¼ x ¼ = 1/16
bezr. biał.
ph
PpHh
¼
¼ x ¼ = 1/16
bezr. biał.
Ph
¼
PPHh
¼ x ¼ = 1/16
bezr. biał.
PPhh
¼ x ¼ = 1/16
bezr. kol.
PpHh
¼ x ¼ = 1/16
bezr. biał.
Pphh
¼ x ¼ = 1/16
bezr. kol.
pH
¼
PpHH
¼ x ¼ = 1/16
bezr. biał.
PpHh
¼ x ¼ = 1/16
bezr. biał.
ppHH
¼ x ¼ = 1/16
rog. biał.
ppHh
¼ x ¼ = 1/16
rog. biał.
ph
¼
PpHh
¼ x ¼ = 1/16
bezr. biał.
Pphh
¼ x ¼ = 1/16
bezr. kol.
ppHh
¼ x ¼ = 1/16
rog. biał.
pphh
¼ x ¼ = 1/16
rog. kol.
W pokoleniu drugim ( F2) uzyskujemy 16 możliwych kombinacji alleli z obu loci genowych i 4
fenotypy:
bezrogi biały
bezrogi kolorowy
rogaty biały
rogaty kolorowy
9/16
3/16
3/16
1/16
Stosunek fenotypowy 9:3:3:1
74
Taki liczbowy stosunek rozszczepienia cech uzyskujemy wtedy, gdy będziemy obserwować
dostatecznie dużą liczbę potomstwa, osobników będących heterozygotami pod względem dwóch par
alleli, które dziedziczą się z dominacją całkowitą.
Nieco inny wynik liczbowy fenotypów uzyskamy, jeśli jedna z analizowanych cech będzie dziedziczyła
się z pełną dominacją a druga z dominacja niepełną.
Przykład 3.6
Na głowie kur czubatek polskich widzimy nastroszone pióra dające tzw. czub. Jest to cecha
uwarunkowana genem dominującym Cr. Brak czuba jest cechą recesywną. W tej samej rasie
spotykamy się z występowaniem wydłużonych piór po bokach policzków i pod dolną częścią dzioba,
jest to tzw. brodatość uwarunkowana niekompletnie dominującym genem Mn. Heterozygoty o
genotypie MnMn’ mają baki i brodę mniej wyraźnie zaznaczone. Osobniki Mn’Mn’ nie posiadają
cechy brodatości.
Jakiego rozkładu fenotypów i w jakim stosunku liczbowym możemy spodziewać się wśród potomstwa
czubatego i brodatego koguta skojarzonego z gładkogłową, niebrodatą kurą?
P
czubaty, brodaty ♂ x gładkogłowa, niebrodata ♀
CrCrMnMn x crcrMn’Mn’
F1
czubaty średnio brodaty ♂ x czubata średnio brodata ♀
CrcrMnMn’ x CrcrMnMn’
♂/♀
CrMn
¼
CrMn CrCrMnMn
¼
czub. brod.
CrMn’ CrCrMnMn’
¼
czub, sł. brod
crMn CrcrMnMn
¼
czub.brod.
crMn’ CrcrMnMn’
¼
czub, sł. brod
CrMn’
¼
CrCrMnMn’
czub, sł. brod.
CrCrMn’Mn’
czub. niebrod.
CrcrMnMn’
czub, sł. brod
CrcrMn’Mn’
czub. niebrod.
crMn
¼
CrcrMnMn
czub.brod.
CrcrMnMn’
czub, sł. brod
crcrMnMn
gładkogł. brod.
crcrMnMn’
gładkogł. sł. brod
crMn’
¼
CrcrMnMn’
czub, sł. brod
CrcrMn’Mn’
czub. niebrod.
crcrMnMn’
gładkogł. sł. brod.
crcrMn’Mn’
gładkogł. niebrod.
W pokoleniu F2 otrzymamy następujące fenotypy;
Czubate, brodate
Cr.MnMn
3
Czubate, słabo brodate
Cr. MnMn’
6
Czubate, nie brodate
Cr. Mn’Mn’
3
Gładkogłowe, brodate
crcrMnMn
1
Gładkogłowe, słabo brodate crcrMnMn’
2
Gładkogłowe, niebrodata
crcrMn’Mn’
1
75
Jeszcze inaczej będzie wyglądał wynik krzyżowania, jeśli obie cechy będą dziedziczyły się z niepełną
dominacją.
Przykład 3.7
U kur andaluzyjskich spotykamy barwę piór czarną uwarunkowaną genem B, białą- B1 oraz niebieską,
która występuje u heterozygot.
Szurpatość (brak haczyków w piórach pokrywowych, powoduje, że promienie i promyki są luźne a
chorągiewka pióra, nie jest sztywna) warunkuje allel F, proste pióra allel F’, a kury heterozygotyczne
zwane też słabo szurpatymi FF’ mają pióra lokowate (lekko skręcone). Jaki będzie stosunek
fenotypowy potomstwa w F2 z kojarzenia białego, szurpatego koguta z czarną, kurą o prostych
piórach?
P
F1
biały szurpaty ♂
BBFF
x
x
niebieski, lokowaty ♂ x
BB1FF’
x
♂/♀
BF
¼
BF’
¼
B1F
¼
B1F’
¼
BF
¼
BBFF
biał. szur.
BBFF’
biał. lok.
B1BFF
błęk. szur.
B1BFF’
błęk. lok.
czarna proste pióra ♀
B1B1F’F’
niebieska, lokowata ♀
BB1FF’
BF’
¼
BBFF’
biał. lok.
BBF’F’
biał. prost.
B1BFF’
błęk. lok.
B1BF’F’
błęk. prost.
B1F
¼
B1BFF
błęk. szur.
B1BFF’
błęk. lok.
B1B1FF
czar. szur.
B1B1FF’
czar. lok.
B1F’
¼
B1BFF’
błęk. lok.
B1B F’F’
błęk. prost.
B1B1FF’
czar. lok.
B1B1F’F’
czar. prost.
F2
Uzyskujemy 9 różnych fenotypów w proporcjach:
biały szurpaty
1
biały lokowaty
2
biały prosty
1
błękitny szurpaty
2
błękitny lokowaty
4
błękitny prosty
2
czarny szurpaty
1
czarny lokowaty
2
czarny prosty
1
Przy tym typie dziedziczenia stosunek fenotypów jest taki sam jak stosunek genotypów, czyli przy
dziedziczeniu cech z niepełną dominacją stosunek fenotypów = stosunkowi genotypów.
76
W przypadku kojarzenia osobników, u których rozpatrujemy 3, albo więcej par alleli z różnych
loci sporządzenie szachownicy Punnett’a choć możliwe, jest jednak bardzo pracochłonne. Możemy
wtedy posłużyć się inną metodą, opartą na prawdopodobieństwie. Jako, że każda z analizowanych
cech uwarunkowana jest genami leżącymi w różnych chromosomach, można traktować jej
wystąpienie jako zdarzenie niezależne. Opierając się na twierdzeniu, że prawdopodobieństwo
wystąpienia dwóch zdarzeń niezależnych jednocześnie, równa się iloczynowi prawdopodobieństw
każdego z nich, oczekiwane prawdopodobieństwo wystąpienia osobników o poszczególnych
fenotypach można określić mnożąc przez siebie prawdopodobieństwo wystąpienia fenotypów
uwarunkowanych poszczególnymi parami alleli.
Przykład 3.8
Kojarzymy białogłowego bezrogiego buhaja (oznaczenia alleli jak w przykładzie 5). o czarnym
umaszczeniu (allel E, dominacja całkowita) z krowami z głową barwną (np. czerwoną), rogatymi, o
czerwonym umaszczeniu (allel e).
P
HHPPEE
x
hhppee
F1
HhPpEe
x
HhPpEe
Analizując każdą parę alleli oddzielnie mamy:
(Hh x Hh)
(Pp x Pp)
F2 fenotypy
(¾biał. + ¼ kol.)
(¾ bezr. + ¼ rog.)
(Ee x Ee)
( ¾ czar. + ¼ czer.) =
białogłowe bezrogie czarne
H. P. E.
¾ x ¾ x ¾ = 27/64
białogłowe bezrogie czerwone
H.P. ee
¾ x ¾ x ¼ = 9/64
białogłowe rogate czarne
H. pp E.
¾ x ¼ x ¾ = 9/64
białogłowe rogate czerwone
H. pp ee
¾ x ¼ x ¼ = 3/64
kolorowa głowa bezrogie czarne
hh P. E.
¼ x ¾ x ¾ = 9/64
kolorowa głowa bezrogie czerwone
hh P.ee
¼ x ¾ x ¼ = 3/64
kolorowa głowa rogate czarne
hh pp E.
¼ x ¼ x ¾ = 3/64
kolorowa głowa rogate czerwone
hh pp ee
¼ x ¼ x ¼ = 1/64
Stosunek fenotypowy wynosi zatem: 27:9:9:9:3:3:3:1
Z tego przykładu wynika jeszcze jedna informacja, że im więcej cech rozpatrujemy
jednocześnie, tym większa liczba osobników potomnych jest potrzebna, aby mogły wystąpić
wszystkie oczekiwane kombinacje gamet, fenotypów i genotypów. Zależności te ujmuje poniższe
zestawienie:
Osobniki heterozygotyczne pod względem n par alleli wytwarzają liczbę różnych gamet równą 2n
Liczba różnych genotypów uzyskanych ze skojarzenia takich osobników wynosi
3n
Liczba różnych fenotypów przy pełnej dominacji w każdej parze alleli
2n
Maksymalna możliwa liczba fenotypów = liczba genotypów
3n
Liczba potomstwa niezbędna do wystąpienia osobnika recesywnego wynosi
4n
77
Przykład 3.9
Hodowca drobiu miał stado kur o grzebieniu różyczkowym i białej skórze. Zakupił do tego stada
koguta o grzebieniu prostym i żółtej skórze. Kiedy ze zniesionych przez kury jaj wylęgły się pisklęta
wszystkie miały grzebień różyczkowy i białą skórę. Hodowca pozostawił do dalszej hodowli wszystkie
kurki i jednego koguta. Wśród ich potomstwa było: 81 piskląt o grzebieniu różyczkowym i białej
skórze, 27 piskląt o grzebieniu różyczkowym i żółtej skórze, 27 piskląt o grzebieniu pojedynczym i
białej skórze i 9 piskląt o grzebieniu prostym i żółtej skórze. Należy określić jak dziedziczą się te cechy.
Odpowiedź: Po skojarzeniu osobników o dwóch przeciwstawnych cechach. Całe potomstwo miało
obie cechy takie, jak jedno z rodziców. Można przyjąć, że obie cechy dziedziczą się z pełną dominacją.
Potwierdza to założenie, rozkład fenotypów w kolejnym pokoleniu; 81 na 144 potomków, czyli 9/16
miało różyczkowy grzebień i białą skórę, 27 na 144 czyli 3/16 o grzebieniu różyczkowym i żółtej
skórze, tyle samo o prostym grzebieniu i białej skórze i 9 na 144 czyli 1/16 o prostym grzebieniu i
białej skórze.
Stosunek fenotypowy 9:3:3:1 potomstwa w drugim pokoleniu wskazuje, że mamy do czynienia z
niezależnym dziedziczeniem dwóch cech o dominacji całkowitej: grzebień różyczkowy (R ) dominuje
nad prostym, a biała skóra (Y) nad żółtą. (Rozpisz to zadanie przy pomocy przyjętych symboli dla
oznaczenia poszczególnych cech)
W powyższym przykładzie rozkład fenotypowy potomstwa był całkowicie zgodny z rozkładem
hipotetycznym. Najczęściej jednak w praktyce występują pewne odstępstwa od takiego rozkładu. O
tym, czy te odstępstwa zaprzeczają prawdziwości przyjętej hipotezy, czy są nieistotne i dopuszczalne,
można zdecydować analizując zgodność uzyskanego w rzeczywistości rozkładu fenotypowego z
oczekiwanym (hipotetycznym), za pomocą testu χ2.
3.2.1. Testowanie hipotezy o zgodności z rozkładem teoretycznym
Test Chi2 (χ2) jest testem stosowanym najczęściej w celu określania zgodności rozkładu cech
jakościowych w potomstwie z przyjętą hipotezą. Np. stosując krzyżowanie osobników o dwóch
cechach niezależnych powinniśmy otrzymać rozkład fenotypów w potomstwie zgodny z
teoretycznym stosunkiem: 9:3:3:1. Rozważmy to na poniższym przykładzie.
Przykład 3.10
Z kojarzenia osobników heterozygotycznych pod względem kształtu grzebienia i barwy piór (ptaki
białe o grzebieniu różyczkowym), otrzymano w pokoleniu potomnym 82 sztuki o fenotypie
rodzicielskim, 30 kurcząt białych o grzebieniu prostym, 28 barwnych o grzebieniu różyczkowym i 10
78
barwnych o grzebieniu prostym. Jak uwarunkowane są badane cechy? Czy otrzymany stosunek
fenotypowy jest zgodny z teoretycznym? Sprawdź testem Chi2.
Wyniki kojarzenia wskazują, że mamy do czynienia z dziedziczeniem dwóch cech– kształt grzebienia i
barwa piór. Jeśli rodzice o podobnych fenotypach dali potomstwo, w którym nastąpiło rozczepienie
cech możemy przyjąć, że oboje byli heterozygotami, zatem rozkład analizowanych cech w
potomstwie powinien być zgodny z założonym stosunkiem fenotypów 9:3:3:1.
Można postawić zatem hipotezę testowaną (Ho) oraz alternatywną (H1):
Ho: Empiryczny rozkład fenotypów JEST zgodny z zakładanym (hipotetycznym)
H1: Empiryczny rozkład fenotypów NIE jest zgodny z zakładanym (hipotetycznym)
Weryfikacja tej hipotezy będzie polegała na porównaniu realnych (empirycznych) liczebności z
poszczególnych klas fenotypowych z liczebnościami hipotetycznymi otrzymanymi przy założeniu
odpowiednich stosunków fenotypowych.
klasa fenotypowa [k]
liczebność
empiryczna [ni]
pióra białe, grzebień różyczkowy
pióra białe, grzebień prosty
pióra barwne, grzebień różyczkowy
pióra barwne, grzebień prosty
SUMY
82
30
28
10
150
2
emp
k
ni pi N 2
i 1
pi N
prawdopodobieństwo
wystąpienia danego
liczebność
fenotypu obliczane z
hipotetyczna [piN]
założonego stosunku
fenotypów [pi]
9/16
3/16
3/16
1/16
1
84 3/8
28 1/8
28 1/8
9 3/8
150
Gdzie:
ni– liczebność obserwowana w poszczególnych klasach fenotypowych
pi – prawdopodobieństwo wystąpienia danego fenotypu (w tym przypadku obliczone przy założeniu
realizacji II prawa Mendla)
pi ●N- oszacowana liczebność w poszczególnych klasach fenotypowych
N- całkowita liczebność badanych zwierząt
χ2emp = (82-84,375)2/ 84,375 + ( 30- 28,125)2/ 28,125 + (28 – 28,125)2/28,125 +(10 – 9,375)2/9,375 =
(-2,375)2 /84,375 + (1,725)2/ 28,125 + (-0,125)2 /28,125 + ( 0.725)2/9,375 = 0,0668 +0,1058 +0,0005 +
0,0557 =0,229
Widać więc, że aby obliczyć χ2emp należy od liczebności uzyskanej doświadczalnie odjąć wartość
teoretyczną, różnicę podnieść do kwadratu i następnie podzielić przez wartość teoretyczną i
79
zsumować wartości uzyskane dla poszczególnych klas fenotypowych. Otrzymaną wartość χ2emp
porównujemy z wartością graniczną (teoretyczną) χ2α,v, odczytaną z tablic (przy odpowiedniej liczbie
stopni swobody- v= k-1 i prawdopodobieństwie błędu α= 0,05 lub α=0,01).
χ2α,v =7,815; (α= 0,05; liczba stopni swobody wynosi; n = 4 – 1 = 3)
Skrócona wersja tabeli χ2
Stopnie
swobody
1
2
3
4
5
6
7
8
9
10
0,99
0,0016
0,0201
0,115
0,297
0,554
0,872
1,239
1,646
2,088
2,558
0,95
0,0039
0,103
0,352
0,711
1,145
1,635
2,167
2,733
3,325
3,940
0,70
0,148
0,713
1,424
2,195
3,000
3,828
4,671
5,527
6,393
7,267
Prawdopodobieństwo α
0,50
0,30
0,455
1,074
1,386
2,408
2,366
3,665
3,357
4,878
4,351
6,064
5,348
7,231
6,346
8,383
7,344
9,524
8,343
10,656
9,342
11,781
0,05
3,841
5,991
7,815
9,488
11,070
12,592
14,067
15,507
16,919
18,307
0,01
6,635
9,210
11,345
13,277
15,086
16,812
18,475
20,090
21,667
23,209
Gdyby wartość χ2emp była równa lub wyższa od wartości granicznej (teoretycznej), wtedy
znaczyłoby, że mamy prawo (z błędem α) odrzucić hipotezę testowaną (Ho) na korzyść hipotezy
alternatywnej (H1), a zatem na stosunek fenotypów w analizowanym przypadku działał by jakiś
czynnik losowy. Wartość graniczna przy 3 stopniach swobody dla prawdopodobieństwa 0,05 wynosi
7,815 czyli jest zdecydowanie wyższa od otrzymanej doświadczalnie. Inaczej mówiąc, obliczona w
przykładzie wartość empiryczna mieści się w granicach prawdopodobieństwa od 0,99 do 0,95, co
oznacza, że uzyskanie podobnego wyniku doświadczenia jest możliwe w 95 a nawet 99 % podobnych
kojarzeń.
3.3. Współdziałanie niealleliczne
Analizując różne cechy roślin czy zwierząt można zauważyć, że szereg z nich może mieć wiele
form, nie tylko dwie czy trzy, jak to wynika z uwarunkowania allelicznego w jednym locus. Można
wtedy zauważyć, że np. takie cechy jak barwa sierści u zwierząt, kolor oczu człowieka czy muszki
owocowej albo barwa skóry mogą zależeć od wielu, różnych genów. Jak można przekonać się o tym,
że dwie różne formy cechy nie wynikają z oddziaływania jednego locus genetycznego, lecz np. dwóch
różnych loci?
Wyniki współdziałania allelicznego zostały omówione w poprzednich podrozdziałach. W
zależności od charakteru współdziałania alleli, po skojarzeniu osobników o cechach przeciwnych
80
otrzymywaliśmy w potomstwie albo jedną z form rodzicielskich, albo cechę pośrednią, a w pokoleniu
F2 stosunek fenotypów równy 3:1 albo 1:2:1.
W przypadku współdziałania nieallelicznego, po skrzyżowaniu ze sobą dwóch mutantów
możemy mieć do czynienia ze zjawiskiem komplementacji, prowadzącym do powrotu do formy
dominującej analizowanej cechy, często jest to wystąpienie formy dzikiej danej cechy. Np. kojarząc
muszki Drosophila melanogaster o oczach białych z muszkami o oczach brązowych, w pokoleniu
potomnym uzyskamy owady o oczach czerwonych typu dzikiego. Znaczy to, że obie (ustalone już
homozygotycznie) mutacje wystąpiły w różnych miejscach genomu (są niealleliczne), co więcej– mają
charakter recesywny. Krzyżówka dwóch różnych fenotypów znosi homozygotyczność w obu
zmutowanych loci, a podwójne heterozygoty, dzięki dominującym allelom odzyskują fenotyp
wyjściowy ++. Niemniej osobnik F1 jest podwójnym nosicielem dwóch recesywnych alleli–
warunkujących kolor biały i brązowy, każdego z innego locus. Podobnie kojarząc dwie rasy kur, które
utraciły zdolność kwoczenia każda wskutek innej mutacji recesywnej, w pokoleniu potomnym
otrzymamy kury kwoczące (cecha typu dzikiego) lecz nosicielki dwóch typów niekwoczenia
równocześnie.
Zatem o współdziałaniu nieallelicznym mówimy wtedy, gdy na jakąś cechę ma wpływ więcej
niż jedna para alleli. Ten rodzaj współdziałania można poznać również po wystąpieniu w pokoleniu
drugim stosunku fenotypowego 9:3:3:1, typowego dla dziedziczenia dwóch cech, lub po modyfikacji
tego stosunku, np. 9:3:4. W ramach współdziałania nieallelicznego wyróżniamy; komplementarność,
epistazę i addytywność.
3.3.1. Współdziałanie komplementarne (dopełniające)
O tego typu współdziałaniu można się łatwo przekonać kojarząc osobniki różniące się między
sobą różnymi formami mutacji.
Najczęściej opisywanym przykładem tego typu współdziałania jest dziedziczenie formy grzebienia u
drobiu. Kury rasy Wyandotte mają charakterystyczny różyczkowy grzebień a po skojarzeniu ich z
kogutem o grzebieniu prostym całe potomstwo ma grzebień różyczkowy. Kury Cornish mają grzebień
groszkowy, który również wykazuje dominację nad grzebieniem prostym.
Zatem powstaje pytanie, jaka jest zależność między grzebieniem różyczkowy i groszkowym i czy są to
mutacje występujące w jednym locus?
W celu uzyskania odpowiedzi, skojarzono między sobą ptaki obu ras i w pokoleniu potomnym
wszystkie ptaki miały inny kształt grzebienia zwany orzeszkowym. Ten wynik jeszcze nic nie wyjaśnia,
bowiem może również wskazywać na niepełną dominację. Dopiero skojarzenie między sobą ptaków z
pokolenia F1 daje w kolejnym pokoleniu aż 4 fenotypy: orzeszkowy, różyczkowy, groszkowy i prosty
w stosunku liczbowym 9:3:3:1. Uzyskany wynik świadczy o tym, że mamy do czynienia z dwoma loci
81
genetycznymi (stosunek jak przy dziedziczeniu niezależnym dwóch par alleli), a pojawienie się
fenotypu orzeszkowego jest wynikiem komplementacji. Grzebień różyczkowy (fenotyp R.pp)
warunkowany jest przez genotyp RRpp lub Rrpp, a grzebień groszkowy (fenotyp rrP.) przez genotyp
rrPP lub rrPp. Dla wystąpienia fenotypu– grzebień orzeszkowy potrzebna jest obecność w loci R i P
przynajmniej po jednym allelu dominującym R i P równocześnie. Tak więc fenotyp ten mogą tworzyć
konfiguracje RrPp, RRPp lub RrPP. Grzebień prosty to podwójna homozygota recesywna rrpp.
Komplementarne współdziałanie genów warunkuje też występowanie niektórych rodzajów
umaszczenia psów. Na przykład w rasie sharpei można spotkać psy o umaszczeniu czekoladowym
warunkowanym recesywnym allelem b z locus B (określanym również symbolem TYRP1),. Towarzyszy
mu dominujący allel D warunkujący pełną barwę pigmentu (określany obecnie jako gen Myo5a),
zatem osobnika o umaszczeniu czekoladowym można zapisać bbD. Umaszczenie błękitne jest
natomiast rozjaśnioną formą czarnego umaszczenia B przez obecność recesywnych alleli d z locus D
(zapis B.dd). Natomiast genotyp podwójnie recesywny bbdd warunkuje u zwierząt umaszczenie
określane jako liliowe.
Przykład 3.11
Jakiego potomstwa możemy oczekiwać po skojarzeniu błękitnej suki z czekoladowym samcem? Jakie
fenotypy mogą wystąpić wśród ich potomstwa?
P
♂bbDD
czekoladowy
F1
♀BBdd
błękitny
x
BbDd
♂czarny
x
BbDd
♀czarna
F2
♂/♀
BD
Bd
bD
bd
BD
BBDD
czarny
BBDd
czarny
BbDD
czarny
BbDd
czarny
Bd
BBDd
czarny
BBdd
błękitny
BbDd
czarny
Bbdd
błękitny
bD
BbDD
czarny
BbDd
czarny
bbDD
czekoladowy
bbDd
czekoladowy
bd
BbDd
czarny
Bbdd
błękitny
bbDd
czekoladowy
bbdd
lila
Stosunek fenotypowy 9:3:3:1 (czarny: błękitny: czekoladowy: liliowy) charakterystyczny dla
dziedziczenia dwóch par alleli, Rozpatrywana jest jedna cecha, barwa sierści więc otrzymany wynik
wskazuje na dziedziczenie dopełniające ( komplementarność).
82
3.3.2. Współdziałanie dopełniające kumulatywne
Współdziałanie to podobne jest do omówionego powyżej dopełniającego. Dla naszych
potrzeb posłużymy się przykładem popularnej wśród akwarystów rybki brzanki sumatrzańskiej.
Korpus tej rybki przecinają trzy poprzeczne, czarne paski, ciągnące się od grzbietu do brzucha. Wzór
ten zależy od dwóch loci- A i B z allelami dominującymi i recesywnymi. Obecność dwóch alleli
dominujących w obu loci daje wzór pełnego paskowania– fenotyp dziki ++++ warunkowany
genotypami AABB lub A.B. [1].Homozygotyczność recesywna w którymś z nich– aaB. lub A.bb
powoduje skrócenie środkowego paska, który przecina zaledwie linię naboczną. Podwójna
homozygotyczność recesywna aabb sprawia, że środkowy pasek jest jeszcze bardziej skrócony–
kończy się na linii nabocznej. Ponieważ obie pojedyncze homozygoty dają ten sam efekt to
rozszczepienie po skrzyżowaniu dwóch podwójnych heterozygot AaBb wynosi 9 : 6 : 1.
(wcięcie) Podobnie jak w przypadku grzebieni u kur rozszczepienie to dotyczy formy jednej cechy
(tam kształt grzebienia tu długość środkowego paska), która obecnie ma charakter metryczny
(kumulujący) a nie jakościowy. Obie pojedyncze homozygoty recesywne dają wspólnie frakcję 6/16
(3/16 + 3/16). Przykład ten, prosty w rozpisywaniu jest jednak dość złożony pod względem
interpretacji. Ponieważ w każdym z loci mamy efekt Pisum– identyczność efektów AA i Aa oraz BB i
Bb nie jest to współdziałanie czysto addytywne (przynajmniej nie addytywne alleliczne). Niemniej
możemy tu dopatrzyć się formy współdziałania addytywnego nieallelicznego przy jednakowych
efektach aa i bb. Długość paska pośredniego mieści się w granicach średniej z dwóch wariantów
skrajnych.
3.3.3. Epistaza
Ten rodzaj współdziałania polega na maskowaniu przez allel z jednego locus, efektu
fenotypowego innej pary alleli. Gen maskujący nosi nazwę genu epistatycznego, gen ulegający
maskowaniu jest genem hipostatycznym. Epistatyczny może być zarówno allel dominujący, jak i
recesywny, co łatwo można rozpoznać po uzyskanych stosunkach fenotypowych w potomstwie.
Zjawisko epistazy możemy również nazwać supresją genową a geny powodujące supresję–
supresorami.
Oprócz epistazy dominującej i recesywnej, wyróżniamy epistazę podwójną dominującą i
podwójną recesywną. Dodatkowo wymienić można epistazę dominującą niepełną letalną oraz
epistazę sprzężoną z płcią. Jeśli dla genu epistatycznego przyjmiemy określenie E a dla
hipostatycznego H, poszczególne warianty epistatyczne dadzą się łatwo zdefiniować.
83
3.3.3.1. Epistaza dominująca
Epistaza ta działa tak długo jak długo zachowana jest konfiguracja E…. Wystarczy obecność
jednego allelu dominującego w locus E, by allele z H były maskowane fenotypowo. Przełamanie
epistazy następuje w układzie ee. Wtedy allele z locus H dochodzą do głosu realizując odpowiednio
warianty eeH. bądź eehh.
Allele epistatyczne dominujące, to na przykład allel ED z locus E, warunkujący umaszczenie
kruczoczarne (tzw. kare dominujące) u koni. Allel ten jest epistatyczny w stosunku do dominującego
allelu A warunkującego umaszczenie typu dzikiego np. w maści gniadej. Oznacza to, że koń o
genotypie EDEDAA lub EDeAA jest kary. Allel A ujawni się w fenotypie konia jedynie wtedy, gdy w
locus E wystąpią allele e – a więc koń gniady ma genotyp eeAA lub eeAa. Umaszczenie kasztanowe
będzie wynikiem współdziałania recesywnych alleli z obu wymienionych loci.
Podobnie, allel dominujący KB z locus K warunkujący umaszczenie czarne u psów (inaczej gen
beta-defensyny103) jest epistatyczny w stosunku do dominującego allelu Ay z locus A (gen ASIP)
warunkującego maść płową oraz jego recesywnego allelu aw warunkującego maść wilczastą.
Recesywny allel ky warunkuje umaszczenie wilczaste, płowe lub czarne podpalane, w zależności od
obecności genów z innych loci).
Przykład 3.12
Skojarzono homozygotycznego czarnego psa o genotypie KBKBAYAY z wilczastą suką. Jaki był genotyp i
fenotyp potomstwa w pokoleniu F1 i F2?
Odpowiedź
P
♂ KBKBAYAY
F1
czarne
x
KBkyAYaw
♂/♀
KBAY
KBAY KB KBAY AY
czarne
B w
K a KBKB AY aw
czarne
y Y
k A KB kyAY AY
czarne
y w
ka
KB ky AY aw
czarne
♀ ky ky aw aw
x KBkyAYaw
KBaw
KB KBAY aw
czarne
KB KB awaw
czarne
KB ky AY aw
czarne
KB ky aw aw
czarne
kyAY
KB kyAY AY
czarne
KB kyAYaw
czarne
ky ky AYAY
płowe
kyky AY aw
płowe
kyaw
KB kyAY aw
czarne
KB kyaw aw
czarne
ky kyAY aw
płowe
ky kyaw aw
wilczaste
F2 Stosunek fenotypowy 12:3:1 (czarne : płowe : wilczaste).
84
Uzyskany stosunek fenotypowy wskazuje na odchylenie od stosunku 9:3:3:1 w kierunku
oddziaływania allelu dominującego (9 KB.AY. i 3 KB.awaw) dając zwiększone prawdopodobieństwo
występowania umaszczenia czarnego -12/16. Mamy tu przykład epistazy dominującej.
3.3.3.2. Epistaza recesywna
W odróżnieniu od przykładu poprzedniego epistaza ta działa w konfiguracji ee.. Teraz
homozygota recesywna w locus E blokuje ekspresję fenotypową alleli z H. Przełamanie epistazy
następuje gdy w E pojawi się choć jeden allel dominujący. Wówczas rozróżnimy fenotypy
odpowiednio E.H. bądź. E.hh.
(wciecie) Przykładem może być dziedziczenie albinizmu wywołane recesywnym allelem c z locus C
występującym u wielu gatunków zwierząt np. u myszy, królików, świnek morskich a także człowieka
(gen C znany też jako gen TYR). Genotyp cc uniemożliwia wytwarzanie pigmentu, dominujący allel z
tego locus- C umożliwia normalną produkcję pigmentu, którego barwa będzie zależała od
uwarunkowania przez inne loci ( patrz rozdział VII).
Przykład 3.13
U myszy recesywny allel c w układzie homozygotycznym powoduje albinizm. Znajdujący się w locus B
dominujący allel B warunkuje umaszczenie czarne myszy, jego recesywny allel b– umaszczenie
brązowe zwane czekoladowym, ale tylko w obecności allelu C. Skojarzono homozygotyczną
albinotyczną mysz z homozygotyczną myszą o umaszczeniu czekoladowym. Jaki był genotyp rodzica
albinotycznego, jeśli w pokoleniu F1 urodziły się myszy o umaszczeniu czarnym? Jakie były genotypy i
fenotypy potomstwa w pokoleniu F2 i w jakim pojawiły się stosunku fenotypowym?
Osobnik o umaszczeniu brązowym/czekoladowym musiał mieć allele dominujące z locus C i
recesywne z locus b. Czarne umaszczenie mogło być przenoszone tylko przez osobnika
albinotycznego. Zatem genotypy rodziców muszą być:
P
umaszczenie
F1
♂ccBB
albinotyczne
♀CCbb
x
jednolite brązowe
CcBb
x
CcBb
czarne
85
F2
♂/♀
CB
CB
CCBB
czarne
Cb
CCBb
czarne
cB
CcBB
czarne
cb
CcBb
czarne
Cb
CCBb
czarne
CCbb
czekoladowe
CcBb
czarne
Ccbb
czekoladowe
cB
CcBB
czarne
CcBb
czarne
ccBB
albinos
ccBb
albinos
cb
CcBb
czarne
Ccbb
czekoladowe
ccBb
albinos
ccbb
albinos
Stosunek fenotypowy 9:3:4 (czarne : czekoladowe: albinosy).
W tym przypadku stosunek 9:3:3:1 uległ zakłóceniu od strony genów recesywnych, bowiem w każdej
sytuacji, gdy wystąpią łącznie allele cc, osobniki będą pozbawione pigmentu bez względu na rodzaj
przenoszonych innych genów warunkujących barwę. Jest to przykład epistazy recesywnej.
Innym przykładem podobnego epistatycznego oddziaływania jest recesywny allel e z locus E (znany
również jako gen MC1R) warunkujący wytwarzanie żółtej lub rudej feomelaniny zamiast czarnej
eumelaniny. Dominujący allel E umożliwia normalną produkcję ciemnego pigmentu zależną od
genów z innych loci.
3.3.3.3. Epistaza podwójna recesywna
W tym przypadku mamy do czynienia z dwoma równorzędnymi loci epistatycznymi E1 i E2.
Każde z nich niezależnie od drugiego w układzie homozygotycznie recesywnym e1e1 lub e2e2
wywołuje maskujący efekt. Przełamanie epistazy ma miejsce przy braku któregokolwiek układu
homozygotycznego recesywnego a więc E1.E2. Wówczas dochodzi do głosu locus hipostatyczny.
Ciekawym przykładem jednocześnie na epistazę jak i komplementację jest dziedziczenie takiej cechy
jak kształt włosa zwany rex, u królików czy kotów.
Otóż, u niektórych ras tych zwierząt włos jest krótki i poskręcany. U kotów taka mutacja
wystąpiła niezależnie w trzech miejscach w Ameryce Północnej: w Oregon, Devon i w Kornwalii. Po
skojarzeniu ze sobą kotów o różnym pochodzeniu, otrzymano wszystkie koty o prostych włosach. Ten
fakt dowodzi, że te fenotypowo podobne mutacje zaszły w różnych miejscach genomu, a
jednocześnie potwierdza wystąpienie komplementacji, objawiającej się tu jako powrót do formy
dzikiej włosa. Jaki powinien być wynik kojarzenia, gdyby była to mutacja jednego locus?
Przykład 3.14
Jakiego zatem wyniku należy spodziewać się wśród potomstwa kotów prostowłosych ze
wspomnianej krzyżówki?
86
Jeśli była to mutacja w różnych loci to np. rexa Devon oznaczymy rdrd , zatem brak mutacji czyli
wystąpienie włosa długiego będzie warunkowane przez allel Rd. W przypadku mutacji rex Oregon
oznaczmy ją symbolem ror,o a normalna długość włosa będzie warunkowana allelem Ro.
Zatem genotyp rexa Dewon’a zapiszemy: rdrd RoRo a rexa Oregon RdRd roro
Z kojarzenia tych osobników
rdrd RoRo x RdRd roro
uzyskamy: F1
Rdrd Roro osobniki o włosach prostych
a w pokoleniu F2 otrzymamy:
Rd . Ro . ¾ x ¾ = 9/ 16 osobników o włosach prostych
Rd . roro ¾ x ¼ = 3/16 kotów rex
rdrd Ro . ¼ x ¾ = 3/16 kotów rex
rdrd roro ¼ x ¼ = 1/16 kotów rex
Ogółem otrzymamy stosunek fenotypowy 9 : 7 kotów o włosach prostych do kotów o włosach typu
rex. Ten typ współdziałania może określić jako klasyczną epistazę podwójną recesywną
3.3.3.4. Epistaza podwójna dominująca
Znów jak poprzednio mamy dwa równorzędne epistatyczne loci E1 i E2. Epistaza działa w
układzie E1.E2. a zostaje przełamana przy braku jakiegokolwiek allelu dominującego, w
którymkolwiek z obu loci– e1e1e2e2. Wtedy dochodzi do głosu locus hipostatyczne umożliwiając
powstanie innego fenotypu.
Przykładem epistazy podwójnie dominującej może być dziedziczenie rodzaju łuski u karasia,
która może być przeźroczysta bądź nieprzeźroczysta vide ustęp o odstępstwach od I prawa Mendla
(rozdział 2).
Przykład 3.15
Łuska nieprzeźroczysta u karasia stanowi tzw. fenotyp dziki (++++) i uwarunkowana jest przez allele
recesywne dwóch loci d1d1d2d2 [3]. Aby pojawiły się osobniki o łusce przezroczystej wystarczy aby
wystąpił chociaż jeden allel dominujący w locus D1.. lub..D2.
Przykład ten ilustruje najlepiej krzyżowanie podwójnych heterozygot.
D1d1D2d2 x D1d1 D2d2
Podwójne heterozygoty produkują gamety (czyste) D1 D2, d1d2, oraz nieczyste (odstępstwo od I
prawa Mendla vide rozdział 2) D1 d2 i d1D2.
87
W pokoleniu F2 powstaną:
D1. D2.
D1. d2d2
D1d1 D2.
d1d1 d2d2
9 osobników o łusce przeźroczystej
3 osobniki o łusce przeźroczystej
3 osobniki o łusce przeźroczystej
1 osobnik o łusce nieprzeźroczystej
Uzyskujemy ostatecznie stosunek fenotypowy 15:1 karasi o łuskach przeźroczystych do karasi o
łuskach nieprzeźroczystych.
3.3.3.5. Epistaza dominująca, niepełna, letalna
Według tej złożonej definicji dziedziczy się ułuszczenie u karpia. Typ ułuszczenia zależy od
dwóch loci– epistatycznego S kontrolującego ułuszczenie i hipostatycznego N modyfikującego wzór i
wielkość łusek [4, 12]. Epistaza jest dominująca lecz niepełna, gdyż genotyp S. nie przesądza
całkowicie o fenotypie (locus N nie jest całkowicie tłumiony). Dodatkowo homozygotyczność NN
powoduje letalność. Wzajemna zależność obu loci daje więc różne efekty.
S.nn– karp pełnołuski (sadzan)– pokryty równomiernie drobną łuską;
S.Nn– karp lampasowy– goła skóra z wyjątkiem dwóch rzędów dużych łusek wzdłuż linii nabocznej,
oraz grzbietowej. Mimo obecności allelu S locus N dochodzi do głosu i allel dominujący N ujawnia swą
obecność.
Całkowite przełamanie epistazy następuje dopiero w układzie homozygoty ss.
ss Nn- karp golec, pozbawiony całkowicie łusek
ssnn– karp lustrzeń– na gołej skórze znajdują się rozsiane pojedyncze, bardzo duże łuski.
Konfiguracja ..NN daje efekt letalny.
Brak łusek ułatwia obróbkę ryb (kłopotliwe skrobanie) lecz kojarzenie samych golców
powoduje straty w postaci wczesnego obumierania jednej czwartej potomstwa. Z drugiej strony
wprowadzenie do hodowli allelu S poprawia wyniki produkcyjne (przyrosty, odporność na choroby).
Wynika to ze wspomnianej wcześniej plejotropii. Stąd kojarzenie golców z lustrzeniami i całkowita
rezygnacja z sadzanów, mimo pożądanego fenotypu potomstwa nie jest preferowana w praktyce
stawowej.
Jakie kojarzenie da najbardziej pożądane wyniki: zdrowo rosnącą obsadę przy stosunkowo
wygodnym do ręcznej obróbki fenotypie?
3.3.3.6. Epistaza sprzężona z płcią
Klasycznym przykładem podlegającym temu dziedziczeniu jest umaszczenie u kotów. W tym
przypadku zajmujemy się jedynie dziedziczeniem maści zasadniczej, występującej w wariantach-
88
czarna i ruda. Pomijamy tu zmodyfikowania typu błękit, szarość, umaszczenie kremowe (wynik
działania locus D), oraz dziedziczenie wzoru– maść gładka, pręgowana, nakrapiana. Pomijamy
również ewentualną łaciatość, warunkowaną jeszcze innym locus (S). Skupiamy się wyłącznie na
umaszczeniu zasadniczym. Maść czarna zależy od locus B mapowanego na chromosomie
autosomalnym Prawdopodobnie locus to nie jest polimorficzne. Jest ono natomiast hipostatyczne
względem locus O (Orange), znajdującego się na chromosomie X. Allel O epistatyczny względem B,
sprawia że zamiast czerni pojawia się rudość. Heterogametyczny samiec (kocur) XY może mieć
genotyp O(-)– rudy, lub O’(-)– czarny (epistaza nie działa). Kotka XX może mieć genotyp
homozygotyczny- OO, O’O’ lub heterozygotyczny OO’. W przypadku OO epistaza działa i locus B jest
wyłączony. Mamy do czynienia z barwą rudą. U kotek O’O”epistaza nie działa i odblokowane locus B
sprawia że są czarne. U heterozygot występują obie maści na raz, więc są one dwukolorowe: czarnorude. W przypadku łaciatości (ss) są trójkolorowe– dochodzi maść biała. Równoczesna obecność
czerni i rudości nie jest jednak wynikiem kodominacji. U samic ssaków jeden z chromosomów X ulega
inaktywacji (jego DNA nie podlega transkrypcji i nawet w jądrze interfazowym występuje w formie
heterochromatyny (zwanej heterochromatyną konstytutywną). Wzór inaktywacji w poszczególnych
tkankach ustala się bardzo wcześnie i jest dziedziczony przez całe życie. Oznacza to, że w pewnych
tkankach (a nawet komórkach) „działają” geny z chromosomu X odziedziczonego po ojcu, a w innych
po matce. Tak więc u heterozygotycznej kotki OO’ w niektórych partiach skóry allel O będzie
epistatycznie wyłączał autosomalny allel B powodując barwę rudą a w innych (allel O’) epistaza nie
będzie działała dając tym samym barwę czarną. Kotki OO’ pręgowane zwane są szylkretowymi (fot.
3.1). Przy definiowaniu tej epistazy świadomie pominięto określenia recesywna bądź dominująca.
Wynika to stąd że obydwa allele z locus O nigdy de facto nie spotykają się razem w formie aktywnej.
Opisywanie ich małą bądź dużą literą jest więc całkowicie arbitralne– nie wiemy który dominuje nad
którym w ramach współdziałania allelicznego. Znamy jedynie skutek oddziaływania allelu O na B.
W świetle tych wyjaśnień zrozumiałe stają się przypadki dwukolorowych kocurów. Są one
trisomikami XXY (vide mutacje genomowe, aneuploidie; rozdział 2), u których nadliczbowy
chromosom X również (podobnie jak u samic drugi X) podlega losowej inaktywacji. Kocury te są
niepłodne. Niemniej stwierdzono wyjątki od tej reguły, gdy tak umaszczone kocury dawały jednak
potomstwo [6]. Analizy cytogenetyczne wykazywały u nich stan mozaikowy– XXY/XY, XX/XY z
prawidłowym obrazem chromosomowym w linii płciowej, co umożliwiało zachodzenie prawidłowych
podziałów mejotycznych czyli spermatogenezy.
89
Fotografia 3.1. Kotka heterozygotyczna w locus O– OO’. Widzimy równocześnie obie maści– czarną
(zmodyfikowaną przez dd do szarości) i rudą.
Ciekawa jest sytuacja, gdy ta sama cecha może być warunkowana przez dwie przeciwstawne epistazy
–dominującą i recesywną. Rozważmy to na przykładzie białego umaszczenia u kur.
Przykład 3.16
W rasie kur białych Leghornów umaszczenie białe zależne jest od dominującego allelu I. U białych
Wyandotów barwa piór wynika z działania recesywnego allelu z locus C.
(Uwaga! Zastanów się, w jaki sposób można było przekonać się o takim uwarunkowaniu barwy białej
w wymienionych rasach kur).
Po skrzyżowaniu obu ras, między sobą w pokoleniu F1 otrzymano wszystkie kury biało upierzone, ale
w pokoleniu F2 pojawiły się również kury o kolorowym upierzeniu.
Zatem powstają dwa pytania. Skąd wzięły się barwne ptaki? Jeśli to są dwie różne mutacje, dlaczego
w F1 nie pojawiło się inne umaszczenie niż białe?
Kury rasy Wyandot mając genotyp cc .. nie mają możliwości produkowania barwnika– wynik działania
epistazy recesywnej.
Kury Leghorn mają w genotypie gen inhibitorowy I I .. blokujący możliwość przejawienia się barwy
(epistaza dominująca). Zatem uwzględniając oba loci, genotypy kur obu ras można zapisać:
P
cc ii x CC I I
F1
CcIi kury białe, bowiem, allel I blokuje możliwość przejawienia się barwy,
czyli działanie allelu C. Epistaza recesywna przestała działać (Cc) ale dalej działa epistaza dominująca
(I…).
90
F2
C. I.
cc I.
C. ii
cc ii
¾ x ¾ = 9 /16 kury białe
¼ x ¾ = 3/16 kury białe
¾ x ¼ = 3/16 kury barwne, bowiem ii nie blokuje działania locus C.
¼ x ¼ = 1/16 kury białe
Ostatecznie otrzymujemy wynik 13 : 3 białych ptaków do barwnych.
3.3.4. Addytywne (sumujące) działanie genów
Ten rodzaj współdziałania polega na sumującym działaniu wielu (nawet kilkudziesięciu)
genów z różnych loci w kształtowaniu jednej cechy. Dlatego też nazywane jest dziedziczeniem
poligenicznym lub sumującym. Różne nasilenie warunkowanej w ten sposób cechy zależy od liczby i
siły ekspresji poszczególnych genów. W większości przypadków są to jednak geny o małym efekcie
fenotypowym. Sumujące działanie genów jest podstawą dziedziczenia tzw. cech ilościowych, do
których zaliczamy między innymi: masę ciała, wzrost, wydajność mleczną, wydajność nieśną czy liczbę
potomstwa, ale także należą tu takie cechy jak np. barwa skóry człowieka.
Czym się różnią cechy jakościowe od ilościowych przedstawia tabela 3.1.
Charakterystyka cech
Liczba loci wpływających na
cechę
Rodzaj współdziałania
allelicznego
Rodzaj współdziałania
nieallelicznego
Uwarunkowanie
Cechy jakościowe
1 lub kilka określonych loci
genowych
Dominacja, niepełna
dominacja, kodominacja
Komplementarność, epistaza
Liczba fenotypów przy dwóch
parach alleli w F2
Określenie cechy
4 (komplementarność)
3- 2 ( epistaza)
Opisowe, cechy niemierzalne
Wyłącznie genetyczne
Cechy ilościowe
Duża, często nieokreślona
liczba loci
Niepełna dominacja
Sumujące działanie genów,
addytywność.
Zależne od genotypu i
środowiska
5 addytywność
Mierzalne przy pomocy
jednostek miar (cm, g, ml, szt.)
Tabela 3.1 Różnice między cechami jakościowymi i ilościowymi
Czasem, niektóre cechy można zaliczyć zarówno do cech jakościowych jak i ilościowych, w
zależności od rozdzielczości kryterium klasyfikacyjnego. Do takich cech należy np. wzrost, mleczność,
tusza czy w niektórych przypadkach barwa sierści. Jeśli będziemy wzrost oceniać jako wysoki, niski
czy średni będzie to cecha jakościowa, jeśli zaś będziemy określać go w cm, to będziemy traktować tę
cechę jako ilościową. Podobnie można określić mleczność czy tuszę (zwierzę mleczne lub mało
mleczne, ktoś chudy lub gruby, tłusty– cecha jakościowa), ale wydajność mleczna wyrażona w
litrach/kg, czy pomiar grubości tłuszczu w tuszy to są już cechy ilościowe.
91
Wspomniana barwa sierści/ skóry może być traktowana jako cecha ilościowa, jeśli zmiana natężenia
barwy będzie zależna od liczby produkowanych ziaren pigmentu.
Przykład 3.17
W związku czarnoskórego mężczyzny z białą kobietą, urodziło się dwoje dzieci. Jaki będzie kolor ich
skóry? Jakiego koloru skóry można oczekiwać wśród potomstwa mulatów pochodzących z małżeństw
mieszanych?
Załóżmy, że barwa skóry biała i czarna zależą od dwóch par genów, które umownie oznaczymy
symbolami a oraz b (w rzeczywistości jest ich więcej), Zatem za barwę białą odpowiada genotyp aabb
a za barwę skrajnie czarną genotyp AABB.
Pokolenie F1 z takiego kojarzenia będzie miało barwę skóry ciemniejszą niż matka, ale jaśniejszą niż
ojciec.
AaBb x AaBb mulaci
Z małżeństwa dwojga mulatów z takich rodzin, mogą urodzić się dzieci o różnym odcieniu barwy
skóry, od czarnego do białego i z różnym prawdopodobieństwem
AABB–czarnoskóry
4 allele dominujące
1/16
AaBB, aABB, AABb, AAbB, ciemny mulat
3 allele dominujące
4/16
AaBb, aaBB, aAbB, AAbb, AabB, aABb, mulat
2 allele dominujące
6/16
aaBb, aabB, Aabb, aAbb –jasny mulat
1 allel dominujący
4/16
aabb biały
0 alleli dominujących
1/16
Oczywiście rozkład cechy i liczba możliwych fenotypów będzie tym większa im więcej loci genowych
bierze udział w kształtowaniu tej cechy.
Przy jednym locus genowym mamy 2 allele i trzy możliwe genotypy/fenotypy, przy dwóch loci
genowych, mamy 4 allele, ale fenotypów już 5 klas a genotypów 9, przy 16 kombinacjach gamet. Jak
będzie zmieniała się liczba klas fenotypów przy większej liczbie genów biorących udział w
kształtowaniu cech ilościowych?
Możemy w tym celu posłużyć się trójkątem Pascala lub rozwiniętą postacią dwumianu.
Trójkąt Pascala
1 para alleli
2 pary alleli
3 pary alleli
4 pary alleli
5 par alleli
1
1:1
1:2:1
1:3:3:1
1:4:6:4:1
1 : 5 : 10 : 10 : 5 : 1
1 : 6 : 15 : 20 : 15 : 6 : 1
1 : 7 : 21 : 35 : 35 : 21 : 7 : 1
1 : 8 : 28 : 56 : 70 : 56 : 28 : 8 : 1
1 : 9 : 36 : 84 : 126 : 126 : 84 : 36 : 9 : 1
1 : 10 : 45 : 120 : 210 : 252 : 210 : 120 : 45 : 10 : 1
92
Jak z trójkąta wynika, przy 3 parach alleli będziemy mieć 7 fenotypów a skrajne fenotypy
mają szansę pojawić się dopiero przy co najmniej 64 osobnikach potomnych.
Jeśli zaś rozpatrywalibyśmy 5 par alleli to liczba różnych fenotypów wzrosłaby do 11, zaś szansa
wystąpienia skrajnego fenotypu byłaby jak 1/1024. Rozpatrywanie tak liczebnego potomstwa jest w
większości hodowli zwierząt niemożliwe, stąd określenie większej liczby genów wpływających na
jakąś cechę sprawia duże trudności. Jednocześnie wzrost liczby fenotypów powoduje, że zmienność
między klasami jest coraz trudniejsza do określenia.
Można też skorzystać z podanych wcześniej informacji przy dziedziczeniu monogenowym
cech, które tu zaadoptujemy do dziedziczenia poligenowego (tab.3.2).
Liczba par alleli,
którymi różnią
się rodzice
1
2
3
4
n
Frakcja F2
podobna do
jednego z
rodziców
1/4
1/16
1/84
1/256
(¼)n
Liczba klas
genotypów w
F2
Liczba klas
fenotypów w
F2
3
9
27
64
3n
3
5
7
9
2n+1
Stosunek fenotypów w
F2 wynikający z
rozwiniętej postaci
dwumianu
(a + b)2
(a + b)4
(a + b)6
(a + b)8
(a + b)2n
Tabela 3.2. Obliczanie stosunków fenotypowych przy addytywnym działaniu genów
Z podanego zestawienia można skorzystać wyliczając np. liczbę par alleli wpływających na
dana cechę, jeśli mamy określoną liczbę klas fenotypów. Można również przewidzieć liczbę klas przy
danej liczbie alleli a także wielkość populacji potrzebną do wystąpienia skrajnej wartości cechy np.
prezentowanej przez jednego z rodziców.
Rozważmy jeszcze jeden przykład dotyczący tym razem cechy mierzalnej, jaką jest masa ciała. Przy
rozpatrywaniu tego przykładu musimy założyć, że wpływ warunków środowiska w tym wypadku
wynosi 0, a cała zmienność wynika z różnic genotypowych.
Przykład 3.18
Masa ciała kur ozdobnych rasy Bantam wynosi średnio 870g. Średnia masa ciała kur rasy hamburskiej
wynosi 1370g. Załóżmy, że masa ciała u kur zależy od 4 różnych loci genowych. Kiedy skrzyżowano
koguta hamburskiego z kurami bantamkami potomstwo miało masę ciała 1120g. Potomstwo z
pierwszego pokolenia skojarzono między sobą. Kury z pokolenia F2 miały masę ciała od 620 g do
1620 g. Dlaczego w drugim pokoleniu pojawiły się osobniki o wartości cechy niższej i wyższej niż w
pokoleniu rodzicielskim? Jaki jest wpływ pojedynczego allelu na analizowaną cechę? Ile różnych
fenotypów możemy spodziewać się w pokoleniu F2?
93
Rozumowanie:
Uwaga: małe i duże litery nie oznaczają tu alleli recesywnych i dominujących współdziałających
według zasady Pisum lecz allele o małym i dużym efekcie.
Jeśli w F2 pojawiły się kury cięższe i lżejsze od ras rodzicielskich to można wnioskować, że kury te
będą różniły się między sobą 4 parami alleli na zasadzie, że najlżejsze osobniki (poczwórne
homozygoty) mają allele o małym (równym?) efekcie aabbccdd natomiast najcięższe osobniki są
poczwórnymi homozygotami z allelami o dużym efekcie AABBCCDD. Różnica w masie ciała między
nimi wynosi 1000 g. W takim razie jeden allel o dużym efekcie powinien zwiększać masę ciała o 125g
(bo 1000 : 8).
Jeśli Bantamki mają masę ciała średnio 870g to są cięższe o 250g od kur najlżejszych a więc muszą
mieć przynajmniej dwa allele o dużym efekcie (aabbccDD). Jeśli masa ciała kur hamburskich wynosi
1370g, czyli jest większa od bantamek o 500g, to znaczy, że różni się od nich trzema parami alleli o
dużym efekcie (bo 125g x 6 = 500g), zatem ich genotyp musi być (AABBCCdd) Kury pokolenia F1
muszą mieć zgodnie z założeniami 4 allele o dużym efekcie, zatem ich masa ciała powinna wynosić
620 + (4 x 125) =1120g.
P
♀aabbccDD
1370g
F1
AaBbCcDd
x
870g
x
1120g
F2
♂AABBCCdd
aabbccdd
620g
AaBbCcDd
1120g
AABBCCDD
1620g
Jeżeli w pokoleniu F2 pojawią się osobniki o wartości cechy przewyższającej wartość u każdego z
rodziców mamy wtedy do czynienia z transgresją, jeśli zaś wystąpią wartości cechy niższe niż u
rodziców, mówimy wtedy o zjawisku regresji. Liczbę klas fenotypów i ewentualne masy ciała w
każdej z nich proponuję ustalić samemu.
Uwaga: Rozumowanie to zakłada że allele ze wszystkich czterech loci składających się na tę cechę
mają ten sam efekt.
94
3.3.4.1. Geny modyfikujące (modyfikatory)
Geny o współdziałaniu addytywnym nie zawsze muszą warunkować wystąpienie cechy, mogą
również powodować zróżnicowanie fenotypowe jakiejś cechy warunkowanej przez allele z
konkretnego locus. Mówimy wtedy o genach modyfikatorach.
Przykładem tego typu współdziałania jest modyfikacja łaciatości u wielu gatunków zwierząt.
Jednolite umaszczenie bądź łaciatość są uwarunkowane działaniem alleli z jednego locus. Allel S- gen
MITF warunkuje umaszczenie jednolite, podczas gdy jego recesywny allel s warunkuje łaciatość).
Taka zależność występuje między innymi u psów, bydła czy kotów.
Od obecności homozygotycznego genotypu ss zależy występowanie łaciatości, ale wielkość
tych łat czy ich rozmieszczenie na ciele zależy od działania genów modyfikatorów. Tę różnorodność
ekspresji genu łaciatości regulowaną przez geny modyfikatory można zaobserwować w stadzie
łaciatych krów, czy w hodowli kotów. Modyfikatory łaciatości zajmują wiele loci, przypuszczalnie
polimorficznych i o różnych efektach. Stąd w odpowiednio dużym stadzie składającym się z
osobników ss możemy obserwować zmienność natężenia łaciatości. Jak każda cecha poligeniczna,
dziedzicząca się addytywnie, łaciatość może podlegać selekcji. Dowiedziono tego [2], w
doświadczeniu ze szczurami kapturowymi hh (hooded– kapturowy). Sam fenotyp kapturowy
odznacza się zmiennością– wyróżniono 14 stopni o różnym rozprzestrzenieniu wzoru. Poprowadzono
przez 20 pokoleń selekcję szczurów hh w dwóch przeciwstawnych kierunkach, otrzymując ostatecznie
szczury umaszczone prawie całkowicie jednolicie oraz prawie całkowicie białe. Następnie
skrzyżowano obie wyprowadzone linie ze szczurami dzikimi ++ (HH). W pokoleniu F2 odzyskano w
obu przypadkach klasyczny wzór kaptura. Linia umaszczona prawie jednolicie pokazała, że wskutek
selekcji genów modyfikatorów (in plus) zwierzęta pomimo recesywnego genotypu zasadniczej cechy
(hh) wykazywały fenotyp de facto dominujący. Dalej jednak pozostały homozygotami recesywnymi.
95
AaBb x AaBb
Liczba
fenotypów
4<
Zależność między genami
AABB
AABb
AaBB
AaBb
AAbb
Aabb
aaBB
aaBb
aabb
A i B niepełna dominacja
1
2
2
4
1
2
1
2
1
3
6
1
2
3
1
4
A niepełna dominacja,
B pełna dominacja
A i B pełna dominacja
9
3
3
1
>4
aa epistatyczne do B i b
9
3
A epistatyczne do B i b
12
4
3
A epistatyczne do B i b
13*
3
bb epistatyczne do A i a
aa epistatyczne do B i b
9
7
Bb epistatyczne do A i a
A epistatyczne do B i b
15
B epistatyczne do A i a
Interakcja A.bb i aa z B.
9
6
Tabela 3.3. Wyniki kojarzenia dihybrydów z uwzględnieniem zależności między genami. (E. Wirth- Dzięciołowska- niepublikowane)
1
*
1
1
96
Literatura do rozdziału 3
1. Frankel J.S. (1985). Inheritence of trunk striping in the Sumatra tiger barb Barbus tetrazona J.
Hered. 76:478-479.
2. Hutt F.B. Genetyka zwierząt PWRiL 1972
3. Kajishima T. (1977). Genetic and developmental analysis of some new color mutants in the
gold fish Carassius auratus . Genetics 86: 161-174
4. Kirpichnikov V.S. 1981. Genetic Bases of Fish Selection. Springer-Verla, New York.
5. Little CC The inheritance of coat color in dogs (Ithaca, N.Y: Comstock) 1957
6. Long S.E., Leaman T., Rowland R. 1997. Male tortoiseshell cats in Great Britain. V Kolokwium
cytogenetyczne “Badania genomu zwierząt w oparciu o metody cytogenetyczne I
molekularne”. Balice, 4-5 listopada. 1997.
7. Lorkiewicz M., Tarkowski J. Zbiór zadań z genetyki i metod doskonalenia zwierząt PWN 1981
8. Schmutz S.M., Berryere T.G.(2007):Genes affecting coat colour and pattern in domestic dogs:
a review. Animal Genetics, 38, 539–549
9. Tave D. Genetics for Fish Hatchery Managers. AVI Publishing Company, Inc. Westport,
Connecticut.1986.
10. Thiruvenkadan A.K., KandasamyA. . Panneerselvam S.(2008) Coat colour inheritance in
horses. Livestock Science 117, 109-129
11. Willis MB. Genetics of the dog (New York:Howell) 1989.
12. Wohlfarth G., Lahman M., Moav R.1963. Genetic improvement of carp. IV.Leather and line
carp in fish ponds of Israel. Bamidgeh 15: 3-8.
Zadania do rozdziału 3
Zadanie3.1
Podaj rozkład fenotypowy potomstwa po kojarzeniach rodziców o następujących genotypach (przy
założeniu zupełnej dominacji genów A i B)
AA x aa
Aa x aa
AaBb x AaBb
AaBb x Aabb
Zadanie3.2
Jednomaścistość (S) u bydła dominuje nad plamistością wyznaczoną przez recesywny gen s.
Jaki będzie udział potomstwa o jednolitym umaszczeniu, pochodzącego z następujących kojarzeń:
97
Ss x Ss
Ss x ss
Zadanie3.3
Kolor skorupki jaja zależy od jednej pary genów i dominujący gen O determinuje białą skorupkę jajka
a jego allel recesywny o- siną. Błękitna barwa piór również zależy od jednej pary genów
pozostających w dominacji niepełnej (homozygota Bl’Bl’ warunkuje czarną barwę piór
a homozygota BlBl- barwę białą a układ heterozygotyczny- błękitną). Podaj, w jakich stosunkach
liczbowych wystąpią poszczególne fenotypy w potomstwie następujących par rodzicielskich:
OoBlBl x ooBl’Bl’
OOBlBl x OoBlBl’
ooBlBl x ooBl’Bl’
Zadanie3.4
Podaj sposób dziedziczenia się czarnego koloru piór u ptaków, jeśli wiadomo, że po skojarzeniu
czarnej
pary
całe
potomstwo
ma
pióra
czarne
a
po
skrzyżowaniu
białego
koguta
i czarnej kury (bądź odwrotnie) całe potomstwo ma jednolitą okrywę koloru stalowego (błękitnego).
Zadanie 3.5
Bezrożność u kóz jest cechą dominującą. Skojarzono bezrogie heterozygotyczne kozy,
jakie jest prawdopodobieństwo, że:
a) pierwsze koźlę będzie bezrogie?
b) rogate?
c) drugie koźlę będzie bezrogie, jeśli pierwsze urodziło się z rogami?
Zadanie 3.6
Dominujący gen B odpowiada za czarne umaszczenie (dominacja zupełna) a jego forma recesywna za
brązowe. Skojarzono ze sobą króliki o czarnym umaszczeniu. Ich potomstwo miało sierść czarną lub
brązową. Podaj w przybliżeniu, ile czarnych królików przypadło na 156 urodzonych zwierząt?
Zadanie 3.7
Opierzone skoki u kur są cechą dominującą (Sp) nad brakiem opierzenia (sp). Koguta
o opierzonych skokach skojarzono z dwiema kurami również o skokach opierzonych. Po kurze I
otrzymano liczne kurczęta mające skoki tylko opierzone. Kura II dała kurczęta zarówno
o skokach opierzonych jak i gładkich. Określ genotypy kur i koguta.
Zadanie3.8
Wśród kur andaluzyjskich występują ptaki czarne (BB), białe (B’B’) i niebieskie (BB’). Niebieskiego
koguta
o
skokach
opierzonych
(patrz
zadanie
powyżej)
skojarzono
z
kurą
czarną
o skokach nieopierzonych. Jakiego potomstwa (i jakich proporcjach) możemy oczekiwać po tych
98
rodzicach wiedząc, że ojciec koguta miał pióra czarne i dominujący układ homozygotyczny w locus
(Sp) a matka koguta była maiła pióra białe i nieopierzone skoki.
Kolor oczu
Możliwy genotyp
Niebieski
bbgg
Brązowy
B.gg; B.G.
Zielony
bbG.
Zadanie 3.9
Praworęczność P dominuje nad leworęcznością p i jest niezależna od koloru oczu. Praworęczny
niebieskooki mężczyzna, którego ojciec był leworęczny poślubia leworęczną, brązowooką kobietę z
rodziny, w której wszyscy członkowie od szeregu pokoleń mieli brązowe oczy. Jakiego potomstwa
mogą oczekiwać małżonkowie ze względu na obie cechy?
allel
cecha
gatunek (rasa)
typ dziedziczenia
H
biała głowa
h
barwna głowa
bydło (Hereford)
pisum
R
białe umaszczenie
R’
czerwone umaszczenie
bydło (Shorthorn)
kodominacja
Ed
umaszczenie czarne
bydło (Aberdeen Angus,
e
umaszczenie czerwone
Red Angus, Holsztyńsko-fryzyjskie)
P
bezrożność
p
Wyrastanie rogów
bydło domowe wszystkich ras
pisum
pisum
Zadanie 3.10
eeRR’ppHh
określ fenotyp buhaja o podanym genotypie
podaj częstość wystąpienia tego fenotypu (oboje rodzice mieli układy heterozygotyczne we
wszystkich loci) podaj częstość wystąpienia tego fenotypu, jeśli będzie on pochodził z krzyżówki
testowej
Zadanie 3.11
Umaszczenie rasy shorthorn zależy od jednej pary genów pozostających w kodominacji
(RR- białe, RR’- dereszowate/mroziate, R’R’- czerwone). Buhaja rasy shorthorn skojarzono z dwiema
krowami:
dereszowatą rogatą – urodziła cielę czerwone bezrogie
dereszowatą bezrożną - urodziła cielę białe rogate
Podaj jakie były genotypy buhaja i skojarzonych z nim krów?
99
Zadanie 3.12
W wyniku skojarzenia bydła rasy shorthorn uzyskano potomstwo, wśród którego połowa była
mroziato umaszczona (RR’). Określ udział potomstwa stanowiącego homozygoty czerwone i białe.
Podaj w przybliżeniu liczbę potomstwa o białym umaszczeniu, jeżeli wiadomo, iż było 168 cieląt
mroziatych.
Zadanie3.13
Ile
różnych
genotypów
i
fenotypów
otrzymamy
po
skojarzeniu
bydła
dereszowatego
i bezrogiego (heterozygotycznego w locus P)?
Zadanie3.14
U myszy dominujący gen z locus A odpowiada za nierównomierne rozłożenie pigmentu we włosie
(umaszczenie aguti), homozygotyczny układ alleli recesywnych daje włos jednobarwny. W locus P
(dominacja zupełna) znajdują się allele warunkujące kolor oczu allel P- warunkuje oczy czarne a próżowe. Samca aguti z różowymi oczami skrzyżowano z dwiema samicami. Po pierwszej samicy
otrzymano myszki aguti i nie-aguti w równych proporcjach, wszystkie z różowymi oczami. U drugiej
samicy pojawiły się myszki aguti z oczami czarnymi i różowymi oraz myszki z jednokolorowym
włosem o dwóch kolorach oczu w proporcjach 3:3:1:1. Określ genotypy wszystkich zwierzątek.
Zadanie3.15
U myszy dominujący allel B warunkuje czarną sierść, a jego allel recesywny b – sierść brązową. Allel V
(dominujący) warunkuje normalny sposób poruszania się, a jego allel recesywny v – „krok tańczący”.
Podaj genotypy rodziców wiedząc, że wśród potomstwa pojawiły się zarówno myszki czarne
poruszające się prawidłowo i „tańczące” jak i myszki brązowe o obu typach chodów w zbliżonych
proporcjach.
Zadanie 3.16
Jednolity kolor u kotów perskich C. dominuje nad umaszczeniem syjamskim uwarunkowanym
recesywnym allelem cs. Długa sierść kotów perskich jest wynikiem działania genów z locus „L”
wykazujących dominację niezupełną (w zależności od ilości kopii allelu dominującego sierść może być
długa, półdługa lub krótka ), koty syjamskie mają zawsze sierść krótką a persy- długą. Jakie
potomstwo otrzyma się w wyniku skrzyżowania jednolicie umaszczonego persa (homozygotycznego
w locus C) z kotem syjamskim? Jakie jest prawdopodobieństwo uzyskania w F2 kota długowłosego o
umaszczeniu syjamskim?
Zadanie 3.17
Siwienie z wiekiem u koni uwarunkowane jest epistazą dominującą S.. Przy braku alleli dominujących
z locus S uzyskujemy następujące typy umaszczenia: ssEE – kare, ssEe – nie kare i nie kasztanowate
(nie siwe), ssee – kasztanowate. Jaką maść odziedziczy potomstwo po skojarzeniu ogiera siwego o
genotypie SsEE z siwą klaczą SsEe?
100
Zadanie 3.18
Siwienie z wiekiem u koni uwarunkowane jest epistazą dominującą S.. Umaszczenie typu palomino
uwarunkowane jest dominacją niepełną alleli z locus C, (CcrCcr- determinuje umaszczenie białe (nie
siwe), CCcr – palomino, CC- kasztan). Klacz palomino w okresie jednej rui była pokryta ogierem siwym
a następnie kasztanem. Urodziła źrebię o maści kasztanowatej, czy można jednoznacznie wskazać, od
którego z ogierów pochodzi źrebak?
Zadanie3.19
U królików dominujący gen z locus A odpowiada za strefowe rozłożenie pigmentu we włosie
(umaszczenie aguti), homozygotyczny układ alleli recesywnych daje włos jednobarwny. Geny z locus
C wykazują epistazę recesywną względem wszystkich genów odpowiadających za kolor pigmentuwywołują albinizm. Królika samca aguti skojarzono z dwiema albinotycznymi samicami (podaj
dokładne genotypy samca i dwóch samic):
pierwsza samica dała potomstwo aguti i albinotyczne
druga- aguti, z jednobarwnym włosem i albinotyczne w proporcjach 3:1:4
Zadanie 3.20
Strefowe zabarwienie włosa aguti (locus A) u królików dominuje nad jednolitą barwą włosa. Przy
epistazie recesywnej genów z locus C barwa włosa nie ujawnia się i zwierzęta są albinotyczne. Samca
aguti kilkakrotnie skojarzono z samicą albinotyczną. Uzyskane z kilku miotów potomstwo miało różne
umaszczenie: aguti, jednolite i albinotyczne w stosunku 1:1:2. Jakie były genotypy rodziców?
Zadanie 3.21
U karasia łuska przeźroczysta spowodowana jest epistazą dominującą podwójną. Genotyp typu
dzikiego (łuska nieprzeźroczysta) to d1d1d2d2. Podaj wyniki krzyżowania: a. podwójnych heterozygot
D1d1D2d2 oraz b. D1d1D2d2 x d1d1d2d2.
Zadanie 3.22
U królików występuje rodzaj sierści rex warunkowany epistazą recesywną podwójną (geny z loci R1 i
R2 wykazują niezależnie identyczne działanie epistatyczne powodując wytworzenie włosa
bezrdzeniowego). Podaj wyniki krzyżowania R1r1R2r2 x r1r1r2r2.
Zadanie 3.23
Przy epistazie recesywnej genów z locus C barwa piór nie ujawnia się i zwierzęta są albinotyczne. Gen
I – wykazujący epistazę dominującą względem wszystkich innych genów odpowiedzialnych za barwę
piór, determinuje ich białą barwę a jego allel recesywny i- nie. W jaki sposób można sprawdzić, czy
niealbinotyczny biały kogut rasy Whitehorn jest nosicielem allelu recesywnego w locus I?
Zadanie 3.24
Barwa sierści u psów zależy od dwóch par dopełniających się genów E (extension) i B (black): psy
czarne – genotyp E.B., czekoladowe E.bb, szare eeB., żółte eebb. Kojarzono czarnego psa z
101
czekoladową samicą i uzyskano w kilku miotach tylko potomstwo czarne i szare. Określ genotypy
rodziców.
Zadanie 3.25
Skojarzono szarą sukę z czarnym psem. Wśród 8 szczeniąt pojawiły się 3 czarne i 3 szare oraz po
jednym żółtym i czekoladowym. Podaj genotypy rodziców. Jakim psem powinien pokryć hodowca
swoją sukę aby otrzymać więcej szczeniąt czekoladowych?
Zadanie 3.26
Stwierdzono, że masa ciała królików uwarunkowana jest 4 parami addytywnych genów
(A;a/B;b/C;c/D;d). W pewnej licznej populacji królików prowadzono badania dotyczące dziedziczenia
masy ciała. Zaobserwowano, że najlżejsze króliki osiągają masę 1kg (układ recesywny), natomiast
najcięższe 2,6kg (układ dominujący), przypuszcza się również, że poszczególne geny wpływają na
badaną cechę w tym samym stopniu. Podaj „wartość” każdego allelu w przełożeniu na masę ciała.
Określ liczbę alleli pozytywnie wpływających na masę ciała w genotypach rodziców wiedząc, że w
pokoleniu F1 uzyskano potomstwo o masie od 1,2 do 1,6kg. Określ masę ciała osobników o
następujących genotypach: AAbbCCdd i AaBbCcDd. Jaką maksymalną masę ciała może osiągnąć
królik pochodzący po rodzicach ważących po 1,4kg?
Zadanie 3.27
Allele z dwóch niezależnych loci Wa1 i Wa2 wykazują identyczne działanie epistatyczne, powodując
pofalowanie włosa u myszy gdy geny z przynajmniej jednego z loci znajdą się w układzie
homozygotycznym recesywnym (podobnie jak geny włosa typu rex u królików). Skojarzono myszy
heterozygotyczne, o gładkim futerku, z tego samego pokolenia i w pokoleniu potomnym otrzymano
129 myszy podobnych do rodziców i 115 myszy z falistym futerkiem. Przy użyciu testu Chi 2 sprawdź
(zakładając błąd α=0,05), czy podany rozkład odpowiada teoretycznemu, czyli podwójnej epistazie
recesywnej, w loci Wa1 i Wa2.
Zadanie 3.28
Skrzyżowano samca z gładką sierścią z myszami (z jednego miotu) z pofalowanym futerkiem, wśród
licznego potomstwa stwierdzono 29 myszek z pofalowaną sierścią i 11 z gładką, czy na tej podstawie
można stwierdzić, że samiec miał genotyp heterozygotyczny a samice homozygotyczny?
Wnioskowanie należy udowodnić statystycznie zakładając błąd α=0,05.
Zadanie 3.29
Skojarzono koguty o grzebieniu orzeszkowym (podwójna heterozygota) z kurami o grzebieniu
różyczkowym o genotypie ppRr (opis dziedziczenia w zadaniu nr 9). Wśród 752 wyklutych kurcząt 299
miało grzebień orzeszkowy, 95 groszkowy, 265 różyczkowy, a reszta pojedynczy. Sprawdź czy podany
rozkład odpowiada teoretycznemu?
102
Zadanie 3.30
Zgodnie z II prawem Mendla zakładającym losową segregację gamet i genów niesprzężonych, w
populacji powinny się znaleźć ptaki z grzebieniem orzeszkowym, groszkowym i różyczkowym oraz
pojedynczym w proporcjach 9:3:3:1. W zarodowym kurniku, wśród 1280 ptaków doliczono się 410
ptaków z grzebieniem orzeszkowym, 220 ptaków z grzebieniem groszkowym, 240 z grzebieniem
różyczkowym i, pozostałe ptaki miały grzebień pojedynczy. Przy użyciu testu Chi2, sprawdź, czy
hodowca preferuje jakiś kształt grzebienia, czy cecha ta jest niezależna od preferencji hodowcy i
podlega losowej segregacji w populacji?
Zadanie 3.31
Zbadano potomstwo 64 rodzin, w których rodzice mieli geny w układach heterozygotycznych i
następujące cechy: wolne płatki uszu (cecha dominująca vs płatek przyrośnięty) i zwijali język w
trąbkę (cecha dominująca vs brak umiejętności zwijania). Stwierdzono 39 dzieci z płatkami
nieprzyrośniętymi i umiejętności zwijania języka; 11 dzieci zwijających język ale z przyrośniętymi
płatkami uszu; 9 wykazujących cechy dokładnie odwrotne i 5 dzieci z przyrośniętymi płatkami uszu
pokazujące „prosty” język. Czy opisane cechy dziedziczą się zgodnie z teorią II prawa Mendla?
Udowodnij statystycznie!
Odpowiedzi do zadań
Ad1 a) 100% A.; b) 1/2A., 1/2aa; c) 9/16A.B., 3/16A.bb, 3/16aaB., 1/16aabb; d) 6/16A.B., 6/16A.bb, 2/16aaB.,
2/16aabb
Ad2. a) 75%; b) 50%
Ad3. a) pióra błękitne, biała skorupka 50%, pióra błękitne, sina skorupka 50%; b) pióra czarne, biała skorupka
50%, pióra błękitne biała skorupka 50%; c) pióra błękitne, sina skorupka 100%
Ad4. dominacja niezupełna
Ad5. a) 75%; b)25%; c) ??:)
Ad6. 117
p p
p p
p p
Ad7. kogut: S s ; kura I: S S ; kura II: S s
Ad8. potomstwo będzie miało pióra czarne i błękitne oraz skoki opierzone i nie opierzone w równych
proporcjach
Ad9. Połowa dzieci będzie prawo- a połowa leworęczna, najprawdopodobniej wszystkie dzieci będą miały
brązowe oczy
Ad10. a) wynika z tabelki; b) 6/256; c) 16/256
Ad11. krowa I: RR’pp; krowa II: RR’Pp; buhaj: RR’Pp
Ad12. po25%; 84 zwierzęta o białym umaszczeniu
Ad13. 9 genotypów; 6 fenotypów
Ad14. samica I: aapp; samica II: AaPp; samiec: Aapp; potomstwo I: Aapp, aapp; potomstwo II: A.Pp, A.pp, aaPp,
aapp
103
Ad15. samiec: BbVv, samica bbvv lub odwrotnie
Ad16. maść jednolita, sierść półdługa; 1/16
Ad17. siwą, karą lub inną nie kasztanową
Ad18. nie
Ad19. samiec: AaCc; samica I: AAcc; samica II: Aacc
Ad20. samiec: AaCc; samica: aacc
Ad21. a) 1/16 łuska normalna, 15/16 łuska przeźroczysta; b) ¼ łuska normalna, ¾ łuska przeźroczysta
Ad22. ¾-włos typu rex; 1/4włos normalny
Ad23. ?
Ad10. wszystkie możliwe
Ad24. samiec EeBB, samica Eebb
Ad25. samiec EeBb, samica eeBb
Ad26. a. 200g; b. 3; c. 1,8kg; d. 1,8kg
2
2
Ad27. Χ emp=1,133, Χ tab=3,841; TAK
2
2
2
2
Ad28. Χ emp=0,133, Χ tab=3,841; TAK
Ad29. Χ emp=2,071, Χ tab=7,815; TAK
2
2
Ad30. Χ emp=1496,8389, Χ tab=7,815; PREFERUJE!
2
2
Ad31. Χ emp=1,333, Χ tab=7,815; TAK
104
4. Dziedziczenie i determinacja płci
Autor: Wiesław Świderek
4.1. Genetyczne podstawy determinacji płci
Płeć jest zespołem przeciwstawnych a jednocześnie uzupełniających się cech i właściwości
organizmu związanych z rozmnażaniem. Różnice występujące między osobnikami męskimi i żeńskimi
określane są mianem dymorfizmu płciowego, który obejmuje gonady wytwarzające gamety, układ
rozrodczy oraz cechy fenotypowe i behawioralne. Proces determinacji płci u zwierząt kontrolowany
jest głównie przez geny zlokalizowane w jednej parze zróżnicowanych morfologicznie chromosomów,
zwanych chromosomami płci lub heterochromosomami. Pozostałe chromosomy organizmu,
identyczne u obu płci, noszą nazwę autosomów. Heterochromosomy w zależności od typu
determinacji płci oznaczane są symbolami X i Y lub Z i W.
U ssaków płeć żeńska jest homogametyczna co oznacza, że posiada w swoim kariotypie dwa
jednakowe chromosomy X, dziedziczone po jednym od każdego z rodziców. Natomiast płeć męska
określana jako heterogametyczna, determinowana jest przez strukturalnie odmienne chromosomy X
i Y, przy czym chromosom X pochodzi zawsze od matki a chromosom Y od ojca. Płeć
homogametyczna wytwarza tylko jeden rodzaj gamet z określonym chromosomem płci, natomiast
płeć heterogametyczna dwa rodzaje gamet zawierających jeden lub drugi chromosom płci.
Zdecydowanie odmiennie niż u ssaków przebiega proces różnicowania się płci u ptaków. U tych
zwierząt samce są homogametyczne (oznaczane ZZ) a samice hetrogametyczne (ZW). Oprócz
wymienionych
czynników
genetycznych
(determinacja
chromosomowa),
duży
wpływ
na
różnicowanie się płci, szczególnie u wielu gatunków ryb, płazów i gadów, mają warunki
środowiskowe (determinacja termiczna i behawioralna). Ponadto w świecie zwierzęcym, od
bezkręgowców po organizmy wyższe, poza osobnikami z jednoznacznie zdeterminowaną płcią męską
lub żeńską, występują również osobniki o cechach obupłciowych, nazywane obojnakami lub
hermafrodytami. W zależności od formy obojnactwa, osobnik taki może jednocześnie pełnić funkcję
obu płci lub zmieniać płeć np. pod wpływem różnych czynników środowiskowych.
Mechanizm determinacji płci najlepiej został poznany u muszek owocowych (Drosophila
melanogaster). U typowych diploidalnych przedstawicieli tego gatunku, osobniki XX są samicami,
natomiast XY – samcami. Jednak o płci u Drosophila melanogaster decyduje nie tylko obecność
chromosomów X i Y w genotypie ale przede wszystkim stosunek liczby chromosomów X do liczby
zespołu autosomów (A). Dotyczy to zarówno osobników diploidalnych jak i poliploidalnych (tabela
4.1). Gdy wartość X/A jest równa lub niższa niż 0,5 kształtuje się płeć męska, przy wartościach X/A
1,0 determinowana jest płeć żeńska. Natomiast gdy stosunek X do A przyjmuje wartości pośrednie
105
między 0,5 a 1,0 obserwowane są zaburzenia determinacji płci powodujące powstanie osobników
interseksualnych.
Tabela 4.1. Wpływ stosunku liczy chromosomów X do liczby zespołu autosomów (A) na determinację płci u
Drosophila melanogaster
Kariotyp
Stosunek X : A
Płeć
XY 2A
diploid
0,5
samiec
X 0 2A
monosomik
0,5
samiec*
XX 2A
diploid
1,0
samica
XXX 3A
triploid
1,0
samica
XYY 3A
triploid
0,33
samiec
XXY 3A
triploid
0,67
interseks
XXX 2A
trisomik
1,5
samica
XXXX 4A tetraploid
1,0
samica
XXXY 4A tetraploid
0,75
interseks
A – haploidalny zespół 3 autosomów, X – pojedynczy chromosom X, *bezpłodny
Mechanizm determinacji płci u Drosophila melanogaster jest bardzo złożony i zależy głównie
od genów zlokalizowanych w chromosomach X. Produktami tych genów są specyficzne białka mające
właściwości czynników transkrypcyjnych. Aktywują one nadrzędny gen sxl (Sex-lethal), który steruje
procesami różnicowania komórek rozrodczych, wpływa na kształtowanie się dymorfizmu płciowego
oraz reguluje aktywność wielu innych genów sprzężonych z chromosomem X. Proces determinacji
płci zaczyna się już we wczesnej fazie rozwoju embrionalnego. Rozwijający się zarodek wykazujący w
swoim genotypie stosunek chromosomów X/A 1,0 wytwarza, dzięki ekspresji genów obecnych w
chromosomach X, dużą ilość czynników transkrypcyjnych. Wysoki poziom tych specyficznych białek
jest niezbędny do aktywacji genu Sxl, który z kolei inicjuje szereg procesów umożliwiających
kształtowanie się płci żeńskiej. Niski poziom transkryptów genów związanych z chromosomem X (X/A
≤ 0,5) w okresie embriogenezy, zmniejsza poziom ekspresji genu Sxl oraz innych genów
odpowiedzialnych za procesy feminizacyjne do poziomu, umożliwiającego rozwój płci męskiej. Rola
chromosomu Y w mechanizmach determinacji płci u Drosophila melanogaster ogranicza się głównie
do zapewnienia prawidłowego procesu spermatogenezy. Bezpośrednim następstwem braku w
genotypie osobników męskich chromosomu Y jest bezpłodność.
U większości ssaków mechanizm różnicowania się płci zależy również od obecności w
genotypie chromosomów X i Y jednak podłoże genetyczne tej determinacji jest zdecydowanie inne
106
niż u muszek Drosophila melanogaster. Jak wynika z wieloletnich badań nadrzędną rolę w procesie
determinacji płci u ssaków odgrywa chromosom Y, który różni się znacznie morfologicznie i
strukturalnie od chromosomu X. Jedyne podobieństwo między tymi chromosomami dotyczy
niewielkich regionów położonych na końcach ramion chromosomu Y zwanych regionami
pseudoautosomalnymi PAR (pseudoatosomal region), zawierających identyczne geny jak na
chromosomie X. Regiony homologiczne PAR umożliwiają w trakcie mejozy koniugację i wymianę
materiału genetycznego między heterochromosomami. Dlatego geny położone w tych regionach
dziedziczą się jak geny autosomalne. Poza tym chromosom Y zawiera tylko niewielką liczbę genów,
zlokalizowanych w krótszym ramieniu, które odpowiedzialne są głównie za rozwój płci męskiej i
prawidłowy przebieg spermatogenezy. Ramię długie chromosomu Y w przeważającej części, zawiera
regiony zbudowane ze skondensowanej formy DNA (heterochromatyny), wykazujące znacznie
mniejszą aktywność biologiczną.
W początkowej fazie rozwoju zarodka u ssaków, jego układ rozrodczy nie jest zróżnicowany.
Aby nastąpił proces różnicowania się organizmu w kierunku męskim lub żeńskim niezbędne są
sygnały pochodzące z chromosomów płci. Rola chromosomu X w determinacji płci u ssaków jest
zdecydowanie mniejsza niż u Drosophila. Główną rolę w tym procesie odgrywają geny sprzężone z
chromosomem Y, a szczególnie gen SRY, który indukuje morfogenezę typu męskiego, realizowaną
przez wiele innych, kaskadowo włączanych genów. W przypadku braku, w trakcie rozwoju zarodka
produktów genu SRY, następuje aktywacja swoistych genów (chromosom X, autosomy)
determinujących pełny rozwój płci żeńskiej.
Z tego względu, że chromosomy płci nie są w pełni chromosomami homologicznymi,
występuje wyraźna różnica w zawartości materiału genetycznego (liczbie genów) między osobnikami
homogametycznymi (XX) a heterogametycznymi (XY). Występowaniu tych dysproporcji zapobiega
mechanizm kompensacyjny polegający na inaktywacji u samic jednego z chromosomów X. Proces
ten zachodzi tylko w komórkach somatycznych, w których losowo unieczynnieniu może ulec zarówno
chromosom matczyny jak i ojcowski. Inaktywowany chromosom podlega silnej kondensacji, tworząc
strukturę określaną jako ciałko Barra, widoczną w jądrze interfazowym. Zjawisko kompensacji jest
dość powszechne i zachodzi u tych gatunków zwierząt, u których występuje chromosomowa
determinacja płci. W efekcie inaktywacji, poziom produktów ekspresji genów związanych z
chromosomem X jest podobny u osobników obu płci.
Czasami proces determinacji i różnicowania się płci może ulec zakłóceniu, w wyniku czego
dochodzi do powstania różnych form interseksualizmu objawiającego się brakiem wyraźnego
ukształtowania się cech męskich czy żeńskich lub wystąpienia u osobnika anatomicznych cech obu
płci. Niekiedy do bardziej dokładnego opisu formy interseksualizmu używa się określeń hermafrodyta
właściwy i rzekomy (pseudohermafrodyta) a także frymartynizm (jałowiactwo). Hermafrodyta
107
właściwy posiada zarówno gonady (jądra, jajniki) jak i zewnętrzne narządy rozrodcze obu płci.
Natomiast u pseudohermafrodyty występują gonady jednej płci a pozostałe cechy drugiej płci.
Frymartynizm objawia się zaburzeniami rozwoju układu rozrodczego samic pochodzących z
różnopłciowych ciąż bliźniaczych. Najczęstszą przyczyną interseksualizmu u zwierząt są mutacje
liczbowe chromosomów płci. Anomalie te, stwierdzane w kariotypach zwierząt wynikają z zaburzeń
procesu mejotycznego, prowadzącego do powstania w gametach nadmiaru lub braku jednego z
chromosomów X lub Y. Do najczęściej odnotowywanych mutacji należy zaliczyć: XYY (zespół Jacobsa),
XXY (zespół Klinefeltera), XXX (zespół supersamica), X0 (zespół Turnera). Przyczyną frymartynizmu
jest chimeryzm krwi, objawiający się występowaniem u jednego osobnika komórek o różnych
kariotypach XX/XY. Do powstania chimeryzmu dochodzi w czasie ciąży bliźniaczej w wyniku wymiany
komórek krwi między bliźniętami różnopłuciowymi. Wymiana tych komórek odbywa się przez
wytworzone połączenia (anastomozy) między łożyskowymi naczyniami krwionośnymi obu płodów.
Więcej informacji dotyczących następstw zaburzeń determinacji płci zamieszczono w rozdziale 8
Wady wrodzone.
4.2. Cechy sprzężone z płcią
W typowych doświadczeniach dotyczących dziedziczenia cech uwarunkowanych genami
zlokalizowanymi w autosomach, nie jest istotne czy dana cecha występuje u samca czy samicy,
zawsze wynik kojarzeń w pokoleniu F1 i F2 będzie taki sam. Zdecydowanie inaczej przebiega
dziedziczenie cech sprzężonych z płcią to znaczy takich, które wyznaczane są przez geny
zlokalizowane w chromosomach płci oraz cech związanych z płcią.
Jak wykazały badania chromosom X zawiera wiele genów, nie mających swoich
odpowiedników w chromosomie Y. W związku z tym osobnik męski (XY), posiadający jeden
chromosom X dziedziczy wraz z nim tylko po jednym allelu z każdej pary alleli danego genu. Takiego
osobnika nazywamy hemizygotą. Osobniki hemizygotyczne wytwarzają dwa rodzaje gamet, z
chromosomem X lub Y, ale ze względu na sposób determinacji płci, mogą przekazać chromosom X
córkom, natomiast chromosom Y tylko swoim synom. Bezpośrednie przekazywanie z ojca na syna
chromosomu Y, a wraz z nim genów odpowiedzialnych za determinację cech męskich nazywane jest
dziedziczeniem holandrycznym. Płeć żeńska (XX) wytwarza gamety tylko z chromosomem X. W
związku z tym samice mogą przekazać geny zlokalizowane w tych chromosomach, całemu swojemu
potomstwu, zarówno córkom jak i synom. Znanym przykładem cechy sprzężonej z płcią jest barwa
oczu u Drosophila melanogaster. Spośród wielu odmian barwnych występujących u muszek
owocowych najłatwiej jest prześledzić dziedziczenie barwy czerwonej i białej. Gen warunkujący oczy
czerwone (W) dominuje nad genem decydującym o oczach białych (w). Na rysunku 4.2
108
przedstawiono dwa warianty krzyżowania osobników o odmiennej barwie oczu. Dla podkreślenia, że
jest to cecha sprzężona z chromosomem X, geny zapisano w indeksie górnym.
Wariant I
oczy:
P
czerwone
białe
XwY
XWXW
Xw
XW
XW
gamety
F1
XWXw
czerwone
gamety
XW
Xw
F2
XWXW XWXw
oczy:
Wariant II
75%
czerwone
Y
XWY
XW
XWY
25%
białe
Y
XwY
białe
czerwone
XwXw
XW Y
XW
Xw
Xw
XWXw
XW
XWXw
czerwone
Xw
XWY
50%
czerwone
Y
XwY
białe
Xw
Y
XwXw
XwY
50%
białe
Rysunek 4.2. Dziedziczenie barwy oczu (cecha sprzężona z płcią) u Drosophila melanogaster w zależności od
wariantu krzyżowania
Po skojarzeniu samicy o czerwonych oczach (WW) z samcem o oczach białych (w-), całe
uzyskane potomstwo pokolenia F1 będzie miało oczy wyłącznie czerwone. Zdecydowanie inny efekt
fenotypowy uzyskamy krzyżując białookie (ww) samice z czerwonookimi (W-) samcami. W tym
przypadku wszystkie córki odziedziczą kolor oczu po ojcu, natomiast synowie po matce. Taki typ
dziedziczenia określany jest jako dziedziczenie na krzyż. Konsekwencją odmiennego rozszczepienia
cech w pokoleniu F1, w obu prezentowanych wariantach kojarzenia, jest różny efekt fenotypowy w
109
pokoleniu F2. W pierwszym wariancie ¾ potomstwa będzie miało oczy czerwone, ¼ białe - (3:1).
Biorąc pod uwagę płeć, białe oczy odziedziczy tylko połowa męskiego potomstwa, natomiast druga
połowa samców i wszystkie samice będą miały oczy czerwone. W drugim wariancie oczy czerwone i
białe odziedziczy w jednakowej proporcji (po 50%) potomstwo zarówno męskie jak i żeńskie a
odsetek osobników z oczami czerwonym będzie taki sam jak z białymi (1:1).
Przedstawiony mechanizm dziedziczenia barwy oczu u muszek Drosophila dotyczy większości
dotychczas poznanych cech sprzężonych z płcią u różnych gatunków zwierząt. Jako przykład może
posłużyć dziedziczenie jastrzębiatego i jednolitego upierzenia u kur. Cecha jastrzębiatości
uwarunkowana jest genem B, który okresowo hamuje wytwarzanie w organizmie czarnego barwnika
(melaniny) powodując wystąpienie na piórach jasnych prążków, allel b decyduje o upierzeniu
jednolitym. Z tego względu, że u ptaków płcią homogametyczną (ZZ) są osobniki męskie a
heterogametyczną (ZW) osobniki żeńskie, wyniki kojarzeń osobników o przeciwstawnych fenotypach
(przedstawione poniżej), są odwrotne niż u muszek Drosophila.
B B
P
b b
B
♂Z Z x♀Z W
jastrzębiate jednolite
jednolite jastrzębiate
B b
♂Z Z
F1
b
♂Z Z x♀ Z W
,
B
B b
♀Z W
b
♂Z Z ,♀Z W
jastrzębiate
jastrzębiate jednolite
F2
♂
ZB
Zb
ZB
ZBZB
ZBZb
W
ZBW
ZbW
♀
75% jastrzębiate, 25% jednolite
♂
ZB
Zb
Zb
ZBZb
ZbZb
W
ZBW
ZbW
♀
50% jastrzębiate, 50% jednolite
Specyfikę dziedziczenia cech sprzężonych z płcią u kur, wykorzystano do tworzenia ras
autoseksingowych, które umożliwiają rozpoznanie płci kurcząt tuż po wykluciu. W wyniku
długotrwałej selekcji u pewnych ras kur (Camber, Polbar) wyeliminowano allel b warunkujący
jednolite upierzenie. Wobec tego w genotypach osobników występuje tylko allel B, powodujący
110
powstawanie białych prążków na piórach (jastrzębiatość). Koguty jako płeć homogametyczna (BB),
posiadające dwa allele B, wytwarzają szersze białe prążki, dlatego są jaśniejsze niż kury posiadające
tylko jeden allel (B -).
Niekiedy przy cechach sprzężonych z płcią obserwuje się nieco inne od wyżej
prezentowanych wyniki kojarzeń. Jednym z przykładów jest dziedziczenie u niektórych ras kotów,
barwy sierści rudej i czarnej, uwarunkowanej jedną parą genów. Allel O warunkuje barwę rudą, allel
O’ czarną. Po skojarzeniu kotki rudej (OO) z czarnym kocurem (O’ -), uzyskane potomstwo męskie
będzie rude (O -), natomiast żeńskie szylkretowe (OO’). Umaszczenie szylkretowe jest następstwem
losowej inaktywacji chromosomu X, do której dochodzi w każdej komórce rozwijającego się
organizmu. Ponieważ potomstwo żeńskie dziedziczy po matce chromosom X z allelem O a po ojcu
chromosom X z allelem O’, losowa inaktywacja jednego z chromosomów X umożliwia jedynie
ekspresję genów zlokalizowanych w chromosomie aktywnym (matczynym lub ojcowskim). W ten
sposób w różnych komórkach ciała kotki, wytwarzany jest barwnik rudy lub czarny co objawia się jako
umaszczenie szylkretowe. W odwrotnym kojarzeniu, czarnej kotki (O’O’) z rudym kocurem (O -),
wśród potomstwa mogą pojawić się tylko czarne kocurki (O’ -) i szylkretowe kotki (OO’). Jak wynika z
przytoczonych przykładów, przy prawidłowym przebiegu procesu determinacji płci osobniki męskie
jako hemizygoty nie mogą być szylkretowe.
4.3. Cechy związane z płcią i ograniczone płcią
Cechy związane z płcią w przeciwieństwie do cech sprzężonych z płcią, uwarunkowane są
przez geny zlokalizowane w autosomach. W związku z tym dziedziczą się zgodnie z prawami Mendla,
ale ich ekspresja fenotypowa zależy od płci osobnika. Przykładem takiej cechy jest, występująca u
pewnych ras owiec, bezrożność oraz rogatość uwarunkowana jedna parą genów (B,b). Wszystkie
osobniki o genotypie BB są bezrożne, natomiast o genotypie bb rogate bez względu na płeć. Po
skojarzeniu bezrożnej owcy z rogatymi trykami (schemat poniżej) uzyskane potomstwo w pierwszym
pokoleniu (F1) będzie posiadało identyczne genotypy (ze względu na geny Bb) ale różne fenotypy
zależne od płci (samce rogate, samice bezrożne). Zasadniczą rolę w odnotowanym zróżnicowaniu
fenotypowym heterozygot Bb odgrywają hormony płciowe wydzielane przez jądra i jajniki, które
wpływają modyfikująco na kształtowanie się cech uwarunkowanych genami zlokalizowanymi w
autosomach. Potwierdzają to również rezultaty uzyskane w drugim pokoleniu (F2). Do wystąpienia
rogów u tryka wystarczy obecność w jego genotypie tylko jednego recesywnego allelu (b), natomiast
aby owca była rogata musi być homozygotą pod względem pary tych alleli.
111
P
XXBB
x
XYbb
bezrożna owca
F1
XXBb
bezrożne owce
♂
♀
F2
rogaty tryk
XYBb
rogate tryki
XB
Xb
YB
Yb
XB
XXBB
XXBb
XYBB
XYBb
Xb
XXBb
XXbb
XYBb
XYbb
owce:
XXBB, XXBb, XXbb
bezrożne
tryki:
rogate
XYBB, XYBb, XYbb
bezrożne
rogate
W podobny sposób jak rogatość, dziedziczy się barwa umaszczenia u niektórych ras bydła.
Jest to cecha uwarunkowana jedną parą alleli (M, m). Allel dominujący warunkuje umaszczenie
mahoniowe a recesywny umaszczenie czerwone. Tak jak w przypadku cech autosomalnych
dziedziczących się z pełną dominacją, homozygoty MM, bez względu na płeć są zawsze mahoniowe, a
homozygoty mm - czerwone. Natomiast maść heterozygot Mm zależy od płci osobnika. Buhaje, u
których ekspresji ulega allel dominujący posiadają umaszczenie mahoniowe, u krów ze względu na
brak aktywności tego allelu powstaje barwa czerwona.
Innym przykładem cechy związanej z płcią jest kształt piór u drobiu. U większości ras kur,
koguty mają w charakterystyczny sposób ukształtowane pióra szyi i ogona określane jako upierzenie
„kogucie”, natomiast kury w tych partiach ciała posiadają zazwyczaj pióra proste (upierzenie kurze).
W przeprowadzonych przed wielu laty badaniach wykazano, że o kształcie piór przesądza dominujący
allel Hf, którego obecność w genotypie bez względu na płeć prowadzi zawsze do ukształtowania się
upierzenia charakterystycznego dla kur. Jedynie u homozygot recesywnych hfhf obserwuje się istotną
różnicę w kształcie piór między kurami a kogutami. Kury będą miały typowe upierzenie „kurze”,
natomiast koguty upierzenie „kogucie”.
Oprócz czech sprzężonych i związanych z płcią wyróżnia się również cechy ograniczone płcią
(występujące tylko u jednej płci). Do takich cech zaliczamy między innymi mleczność u samic ssaków,
nieśność u ptaków oraz niektóre wady, takie jak wnętrostwo u samców (niezstąpienie jąder z jamy
brzusznej do moszny) czy zaburzenia płodności u białych jałówek rasy shorthorn. Cechy te najczęściej
112
uwarunkowane są wieloma genami zlokalizowanymi w autosomach zarówno u samców jak i u samic,
natomiast ujawniają się tylko u jednej płci.
Literatura do rozdziału 4
1. Jura C., Klag J., (redaktorzy naukowi), 2005: Podstawy embriologii, tom II. Wydawnictwo
naukowe PWN, Warszawa.
2. Bishop J., 2001: Ssaki transgeniczne. Wydawnictwo Naukowe PWN, Warszawa.
3. Charon K., M., Świtoński, M., 2004: Genetyka zwierząt. PWN Warszawa.
4. Wirth-Dzięciołowska E., 1999: Poradnik hodowcy kotów. Multico Oficyna Wydawnicza.
5. Kosowska B., Nowicki B., 1999: Genetyka weterynaryjna. PZWL Warszawa.
6. Sadakierska-Chudy A., Dąbrowska G., Goc A., 2004: Genetyka ogólna. Wydawnictwo UMK
Toruń.
Zadania do rozdziału 4
Zadanie 4.1
Hemofilia (przedłużony czas krzepnięcia krwi) jest chorobą uwarunkowaną genem recesywnym (h)
sprzężonym z płcią.
a) Wśród licznego potomstwa pochodzącego od zdrowych psów, pojawiło się 25% osobników z
objawami hemofilii. Określ genotypy rodziców i chorego potomstwa.
b) Jakiego potomstwa należy oczekiwać po skojarzeniu suki będącej nosicielką genu hemofilii z
psem chorym na hemofilię?
c) Jakiego potomstwa należy oczekiwać po skojarzeniu chorej na hemofilię suki ze zdrowym
psem?
Zadanie 4.2
Barwa nóg i upierzenia u kur zależą od genów zlokalizowanych w chromosomie Z współdziałających z
pełną dominacją: A- nogi żółte, a– nogi zielone, B– jastrzębiatość, b - upierzenie barwne.
a) Jakie genotypy powinny posiadać jastrzębiato upierzone rodzice, aby tuż po wylęgu, u młodych
piskląt można było odróżnić płeć na podstawie barwy nóg?
b) Od pary jastrzębiatych kur uzyskano potomstwo o nogach zielonych jastrzębiate i barwne.
Określ genotypy rodziców.
c) Jastrzębiatego zielononogiego koguta skojarzono z jastrzębiatymi żółtonogimi kurami. Wśród
licznego potomstwa pojawiły się 2 osobniki barwne o zielonych nogach. Określ genotypy
rodziców.
113
Zadanie 4.3
W małym stadku kur wśród potomstwa pojawiały się kurki jastrzębiate i brązowe, natomiast koguciki
tylko jastrzębiate. Ponadto u wszystkich odmian barwnych bez względu na płeć odnotowano skoki
opierzone oraz gładkie. Określ genotypy rodziców o skokach opierzonych wiedząc, że geny
warunkujące brązową barwę piór (cecha sprzężona z płcią) oraz nogi gładkie (cecha autosomalna) są
recesywne.
Zadanie 4.4
Barwa puchu u kurcząt jest uwarunkowana jedną parą genów sprzężoną z płcią. Jakie genotypy
powinni posiadać rodzice, aby można było rozpoznać płeć tuż po wykluciu piskląt wiedząc, że allel
warunkujący srebrną barwę puchu (S) dominuje nad allelem decydującym o puchu złotym (s)?
Zadanie 4.5
Rude lub czarne zabarwienie sierści u kotów zależy od jednej pary genów (O,o). Jest to cecha
sprzężona z płcią, allel O warunkuje barwę rudą, allel o barwę czarną. Natomiast heterozygoty są
szylkretowe. Pewna szylkretowa kotka urodziła czarnego i rudego kocura oraz rudą i szylkretową
kotkę. Określ genotyp i fenotyp ojca tych kociąt.
Zadanie 4.6
Daltonizm (zaburzenia w rozróżnianiu barw) uwarunkowany jest genem recesywnym sprzężonym z
płcią (d).
a) Czy syn pochodzący po rodzicach normalnie rozróżniających barwy może być daltonistą?
b) Jakiego potomstwa można oczekiwać od mężczyzny daltonisty i kobiety pochodzącej z rodziny,
w której daltonizm nigdy nie występował?
c) Jakiego potomstwa można oczekiwać od małżeństwa kobiety daltonistki posiadającej grupę
krwi 0 z mężczyzną, o grupie krwi AB, normalnie rozróżniającego barwy?
Zadanie 4.7
U pewnych ras bydła sierść barwy mahoniowej lub czerwonej zależy od jednej pary genów (M, m).
Homozygoty MM są zawsze mahoniowe a mm czerwone bez względu na płeć. Maść heterozygot Mm
zależy od płci: buhaje są mahoniowe, krowy czerwone.
a) Czerwona krowa kojarzona wielokrotnie z czerwonym buhajem urodziła klika cieląt w tym
jedno mahoniowe. Określ genotypy rodziców oraz prawdopodobne genotypy, fenotypy i płeć
cieląt.
b) Dwie czerwone krowy o różnych genotypach skojarzono z czerwonym buhajem. Po pierwszej
krowie otrzymano czerwoną jałówkę, po drugiej mahoniowego buhajka. Jakie były genotypy
wymienionych zwierząt?
114
Zadanie 4.8
U pewnych ras owiec bezrożność i rogatość zależną od pary genów Bb. Zwierzęta BB są bezrożne, bb
rogate bez względu na płeć. Natomiast heterozygoty Bb mają różne fenotypy zależne od płci - samce
są rogate, samice bezrożne.
a) Ustal genotypy wszystkich osobników w rodowodzie.
1
2
bezrożne
rogate
3
4
5
6
bezrożne
bezrożne
rogate
rogate
9
7
8
bezrożne
rogate
bezrożne
10
tryk
owca
rogate
b) Jakiego potomstwa należy oczekiwać po skojarzeniu owcy 9 z trykiem 4?
c) Czy po skojarzeniu rogatej owcy (5) z bezrożnym trykiem (4) możliwe jest uzyskanie rogatego
tryczka?
Odpowiedzi do zadań
Ad1.
H h
H
h
a/ Rodzice X X x X Y, chory potomek męski X Y
H h
h
H h
h h
H
H h
h h
H
h
b/ Rodzice X X x X Y, potomstwo: X X , X X (chora), X Y, X Y (chory)
h
c/ Rodzice X X x X Y, potomstwo: X X (suczki zdrowe), X Y (psy chore)
Ad2.
aB aB
aB ab
AB
a/ Rodzice Z Z lub Z Z x Z W, potomstwo: ♀ nogi zielone, ♂ nogi żółte
aB ab
aB
aB ab
AB
b/ Rodzice Z Z x Z W, c/ Rodzice Z Z x Z W
B b
B
Ad3.
Rodzice Oo Z Z x Oo Z W
Ad4.
Rodzice Z Z x Z W
Ad5.
Czarny kocur X Y
s s
S
o
Ad6.
D d
D
d
D D
d
D d
D
d d
a/ Tak, rodzice X X x X Y, potomek daltonista X Y, b/ Rodzice X X x X Y, potomstwo X X , X Y, c/ Rodzice X X
D
A
B
D d A
D d B
d
A
d
B
ll x X Y L L , potomstwo: córki wzrok normalny X X L l, X X L l, synowie daltoniści X Y L l, X Y L l
Ad7.
115
a/ Rodzice XXMm x XYmm, potomstwo: czerwone jałówki XXmm, XXMm, czerwony buhajek XYmm, mahoniowy
buhajek XYMm, b/ Krowa I XXmm, krowa II XXMm, buhaj XYmm, potomstwo: czerwona jałówka XXmm,
mahoniowy buhajek XYMm
Ad8.
a/ 1-Bb, 2-Bb, 3-Bb, 4-BB, 5-bb, 6-Bb, 7-Bb, 8-Bb, 9-Bb, 10-bb
b/ Rodzice XXBb x XYBB, potomstwo: bezrożne owce XXBB, XXBb, bezrożny tryk XYBB, rogaty tryk XYBb
c/ Tak, Rodzice XXbb x XYBB, potomstwo: bezrożne owce XXBb, rogate tryki XYBb
116
5. Markery genetyczne w hodowli zwierząt i allele wielokrotne.
Autorki: Elżbieta Wirth- Dzięciołowska; Zuzanna Nowak
W hodowli zwierząt już dawno zwrócono uwagę na fakt, że pewne cechy łatwe do
odróżnienia fenotypowo występują łącznie z innymi cechami. Taki układ może wynikać z
plejotropowego działania genu, lub ze ścisłego sprzężenia między blisko leżącymi genami w
chromosomie. Cechy takie nazwano markerami, a geny je warunkujące genami markerowymi.
Pierwszymi, najłatwiejszymi do określenia markerami było umaszczenie zwierząt. Już Castle w 1941
roku zwrócił uwagę na to, że czarno i brązowo umaszczone króliki wykazują większą żywotność niż
króliki popielate czy platynowe. Jednocześnie umaszczenie brązowe wiązało się z niższa masą ciała.
Związki umaszczenia z letalnym efektem genu lub występowaniem wad znane są u zwierząt
gospodarskich i hodowlanych. Przykładem mogą być lisy platynowe, żółta mysz, umaszczenie merle u
psów rasy dog czy jamnik, oraz śmiertelność karakułów szarzejących z wiekiem, a także podatność na
urazy koni o jasnej skórze, niedorozwój dróg rodnych u białych jałówek rasy shorthorn, głuchota u
części białych kotów czy białych psów np. rasy bokser.
Niektóre rodzaje umaszczenia zostały uznane za markery rasowe, np. białe siodło u świń rasy
hampshire, biała głowa u bydła rasy hereford, himalajskie umaszczenie u kotów syjamskich, bądź
wręcz weszły do określenia nazwy rasy np. bydło polskie czerwone, kury zielononóżki, białe leghorny.
Od czasu poznania grup krwi i ich polimorficznego układu, rozwinięto badania nad
biochemicznymi markerami u zwierząt. Badania nad grupami krwi próbowano początkowo wiązać z
cechami produkcyjnymi zwierząt, jednak tylko w nielicznych przypadkach udało się ustalić takie
związki. Wykazano np., że u trzody chlewnej istnieje zależność między płodnością i grupą krwi H, u
kur wykazano związek między grupą krwi B19 a zwiększoną wylęgowością, zmniejszoną
śmiertelnością szybszymi przyrostami kurcząt i zwiększoną wrażliwością na wirus białaczki, w
przypadku zaś występowania grupy krwi B21, kury wykazywały oporność na chorobę Mareka. Jednak
najważniejszą rolę odgrywały bądź odgrywają badania grup krwi przy ustalaniu pochodzenia,
identyfikacji osobniczej (cecha niezmienna w ciągu całego życia), monitorowaniu stad w pracy
hodowlanej, charakterystyce ras (różna częstość poszczególnych układów grupowych) ustalaniu
stopnia homozygotyczności a także jako markery w badaniach grup sprzężeń.
Sekwencje kodujące wykorzystywane jako markery zostały zaliczone do klasy I markerów
genetycznych. W tej grupie markerów znajdują się geny i ich produkty (białka lub allozymy),
charakteryzujące się dość niską zmiennością w porównaniu z markerami genetycznymi klasy II. W
klasie II znajdują się niekodujące sekwencje DNA spełniające jednocześnie wszystkie podstawowe
kryteria dobrego markera genetycznego: dziedziczą się w sposób prosty (Mendlowski), są łatwo
117
identyfikowane (metodami laboratoryjnymi) i oczywiście wykazują wysoki polimorfizm w populacji.
Do markerów klasy I zalicza się np. antygeny erytrocytarne, białka mleka lub surowicy oraz same geny
występujące w wielu formach allelicznych, takie jak geny kompleksu zgodności tkankowej MHC (ang.
Major Histocompatybility Complex). W grupie markerów zaliczanych do klasy II najbardziej
rozpowszechnione są sekwencje mikrosatelitarne.
5.1. Wybrane przykłady grup krwi u zwierząt
Czym jest grupa krwi a czym układ grupowy? Układem grupowym krwi nazywa się zespół
antygenów występujących na powierzchni erytrocytów. Rodzaj antygenu z danej grupy będzie
determinował samą grupę krwi. Najprostszym przykładem jest najbardziej znany układ grupowy u
człowieka- AB0. W układzie tym wyróżnia się dwa typy antygenów (A i B). Ze względu na możliwość
wystąpienia na powierzchni erytrocytu jednocześnie obu tych antygenów, bądź niewystąpienie
żadnego, rozróżnia się w obrębie tego układu aż cztery grupy krwi: A- na powierzchni erytrocytów
występuje tylko jeden rodzaj antygenów (A); B- na powierzchni erytrocytów występuje tylko jeden
rodzaj antygenów (B); AB- na powierzchni erytrocytów występują oba typy antygenów (A i B); 0- na
powierzchni erytrocytów nie występuje żaden typ antygenów z tego układu grupowego. Układ
grupowy, w obrębie którego można wyróżnić więcej niż dwie grupy krwi nazywa się układem
złożonym w przeciwieństwie do układu grupowego prostego, w którym wyróżnia się tylko dwie grupy
(grupa z antygenem na powierzchni erytrocytu i grupa bez antygenu). Przykładem prostego układu
grupowego u człowieka jest układ Duffy (nazwany tak od imienia (?) pacjenta, u którego został
wykryty po raz pierwszy). W układzie tym występuje tylko jeden antygen- glikoproteina FY. (będąca
jednocześnie receptorem dla ludzkich zarodźców malarii Plasmodium vivax). Osoby u których
stwierdza się wystąpienie tego antygenu mają grupę D+ (jednocześnie wykazują pewną odporność na
zarodźce malarii), osoby pozbawione antygenu- D-. Tak więc układy proste charakteryzują się zawsze
tylko jednym antygenem a złożone dowolną ich liczbą (tabela 5.1). U wielu gatunków występuje od
kilku do kilkunastu układów grupowych. U człowieka rozróżnia się 32 układy grupowe, w tym
większość złożonych, a u psa tylko jeden- również złożony.
Co decyduje o wytworzeniu lub nie danego antygenu z układu grupowego? W każdym locus
genowym może wystąpić po kilka alleli, powstałych w wyniku różnych mutacji w obrębie jednego
genu. Mamy wtedy do czynienia z allelami wielokrotnymi a cechę uwarunkowaną nimi nazywamy
polimorficzną. Oczywiście o allelach wielokrotnych i polimorfizmie cech mówimy w odniesieniu do
populacji, bowiem każdy diploidalny osobnik może posiadać w swoim genotypie maksymalnie tylko
dwie formy alleliczne. Utrwalona mutacja daje początek nowej formie genu- aktywnej lub
nieaktywnej. Nieaktywna forma genu nie będzie zdolna do wytworzenia antygenu (lub jego
118
składnika), aktywna forma zmutowana może przyczynić się do powstania łańcucha aminokwasowego
z odbiegającym od standardowego zestawem aminokwasów lub do strukturalnie innej formy białka.
Tak więc wszystkie złożone układy grupowe krwi i wynikające z nich grupy krwi są przykładem cechy
polimorficznej. Znając liczbę alleli reprezentujących dane locus można przy pomocy łatwego wzoru
przewidzieć liczbę genotypów w populacji: N=n(n+1):2; gdzie n- liczba alleli. W przypadku układu
AB0, mamy 3 allele reprezentujące gen I (Immunoglobulina) z chromosomu 9 (allel odpowiadający za
wytworzenie antygenu „IA”; allel kodujący antygen „IB” oraz „i” allel, który utracił zdolność do
translacji- nieaktywny, zwany „zerowym”. Stąd liczba możliwych do zaobserwowania w populacji
genotypów to: N= 3(3+1):2= 3x4:2=6. Sprawdźmy poprawność wzoru: IAIA; IAIB; IAi; IBIB; IBi; ii. Należy
pamiętać, że między allelami tego samego locus mogą panować zależności opisane w I prawie
Mendla, dlatego liczba obecnych w populacji genotypów nie będzie równoważna z liczbą fenotypów.
Ile genotypów i fenotypów będzie w populacji, jeśli zamiast grupy A uwzględnimy jej dwa warianty A1
i A2, z czego pierwszy będzie dominował nad drugim?
Tabela 5.1. Układy grupowe krwi u wybranych gatunków zwierząt gospodarskich
Liczba układów
grupowych
Liczba antygenów
erytrocytarnych
Liczba alleli / grupę
bydło
11
80
2-~1000
świnie
15
74
2-18
konie
7
34
2-26
owce
7
22
2-52
kury
13
23
2-6
Gatunek
Zapis wszystkich układów grupowych danego osobnika z uwzględnieniem występujących antygenów
erytrocytarnych nosi nazwę formuły antygenowej.
Przykłady formuły antygenowej bydła
Układy grupowe krwi
AH
B
C
FV
J
L
M
SU
Z
T’
R’
Cielę
A1/-
BGKY/Y2D’
RW/C1
F/V
J/-
L/L
M/-
S/U1
Z/Z
-/-
R’/-
Krowa
A1/A2
B1GKOx/Y2D’
C1/C’X1 V/-
J/-
L/-
M/M
Z/-
T’/-
-/-
Buhaj
H/-
BGKY/A’O1
L’/-
J/J
L/-
-/-
Z/-
T’/T’
S’/-
F/F
S/U2
U1/U2
119
Jak z tego zestawienia wynika, niektóre układy grupowe są bardzo skomplikowane. Do takich
należy np. układ grupowy B i częściowo C, bowiem jeden allel nie warunkuje tu pojedynczego
antygenu, ale całą ich grupę –fenogrupę. U bydła, w grupie B określono ponad 1000 fenogrup.
Zjawisko fenogrupy nie jest „normalne” z punktu widzenia praw Mendla. Wraz z poznawaniem
genomu bydła domowego, dowiedziono, że w chromosomie, w miejscu kodującym powstanie
antygenów z układu B znajduje się nie jeden lecz kilka genów sprzężonych ze sobą. Układy grupowe L,
Z i T są układami prostymi. Określając pochodzenie potomka po konkretnych rodzicach należy
kierować się zasadą, że potomek nie może posiadać żadnej fenogrupy, której nie było u rodziców.
Prowadząc analizę zamieszczonego przykładu można stwierdzić, że cielę może pochodzi po
podanej krowie (ma w każdej grupie krwi jeden antygen lub grupę antygenów, które wystąpiły u
samicy), natomiast pochodzenie po podanym ojcu jest niemożliwe, bowiem istnieje niezgodność
między cielęciem i buhajem w grupie krwi C, T’ i R’. Do podważenia ojcostwa/ macierzyństwa
wystarczy, żeby wystąpiła niezgodność tylko w jednej z analizowanych grup krwi. Należy również
pamiętać, że analiza grup krwi może wykluczyć pochodzenie po danych osobnikach, ale nie może
stanowić dowodu na bezpośrednie pokrewieństwo.
Allele wielokrotne mogą również występować w przypadku wielu innych cech np białek
surowicy krwi, białek mięśni, enzymów erytrocytów, leukocytów, białek mleka czy białek żółtka oraz
białek jaja. Znajomość uwarunkowania genetycznego i dziedziczenia polimorficznych frakcji białek
może stanowić dodatkowy czynnik zwiększający prawdopodobieństwo określenia pochodzenia
danego osobnika.
5.2. Przykład polimorfizmu grup krwi i białek surowicy krwi u koni
U koni znanych jest 7 układów grupowych krwi, z których najbogatszy jest układ D. a najmniej
zróżnicowane są układy grupowe C, K, U ( po 2 allele)
Przykładowy układ grup krwi u źrebaka.
Grupy krwi
źrebię
A
C
D
K
P
Q
U
adf/b
a
bcmq/dkl
a
ad
abc
-
Kreską oddzielone są allele u osobnika heterozygotycznego (grupa krwi A i D) , pojedynczy
zapis litery/ liter prezentuje fenotyp homozygoty (grupa krwi C, K, P, Q ), kreska pozioma oznacza
brak antygenu ( allel recesywny).
120
Jako markery
genetyczne
zwiększające
wyraźnie prawdopodobieństwo określenia
pochodzenia danego źrebięcia po danych rodzicach, stosowane są elektroforetyczne rozdziały
szeregu białek i enzymów. Do najczęściej oznaczanych należą: albuminy (ALB)– 3 allele, Białko
wiążące witaminę D (GC)- 2 allele, esteraza (ES) -10 alleli, inhibitory α-proteaz (PI) -17 alleli,
transferyny (TF)– 13 alleli.
Jednocześnie wiele z analizowanych białek może być markerem rasowym a także markerem
różnych cech fenotypowych czy produkcyjnych badanych grup zwierząt. I tak np. hemoglobina
wariant A (HBA) jest charakterystyczna dla bydła rasy hereford a hemoglobin B (HBB)– dla bydła rasy
jersey, chociaż te typy hemoglobiny mogą również występować i u innych ras bydła. Natomiast HBD
występuje tylko u zebu afrykańskiego a HBE– u bydła afrykańskiego. U owiec, oporność na pasożyty
wewnętrzne skorelowana jest z typem hemoglobiny. Owce będące homozygotami ze względu na
genotyp HBA są bardziej oporne niż heterozygoty (HBAB) czy homozygoty HBB. U świń
zidentyfikowano największy polimorfizm białek surowicy krwi zwanych inhibitorami α-proteaz (PI1 –
PI4), uwarunkowany ściśle sprzężonymi ze sobą loci (odległość 1,6cM). W obszarze tym stwierdzono
29 alleli (u bydła tylko 3 allele), z których część jest charakterystyczna dla poszczególnych ras świń.
Niektóre frakcje prealbumin, postalbumin i globulin w surowicy krwi kur, identyfikowane są
tylko u kur niosek inne zaś obecne są u kogutów i kur brojlerów. Podobnie, polimorfizm białek mlekakazein i laktoglobulin- może być markerem wskazującym na przydatność mleka do przetwórstwa
serowarskiego. Stwierdzono występowanie w mleku krów dwóch typów κ kazeiny- A i B różniącymi
się sekwencją aminokwasów w pozycji 136 i 148. Mleko, w którym występują κ kazeiny typu B jest
bogatsze w białko i ma lepszą przydatność do przerobów serowarskich niż κ kazeiną typu A.
Natomiast genotyp κ kazeiny typu A charakteryzuje się większa wydajnością dobową mleka.
Po wytrąceniu kazein z mleka, w serwatce pozostają głównie w postaci rozpuszczonej,
laktoglobuliny, albuminy i immunoglobuliny. Z pośród tych białek, β laktoglobulina typu B ma wpływ
na większą zawartość tłuszczu i kazein w mleku, a co się z tym wiąże, lepszą jego przydatność do
obróbki technologicznej. Zatem, wskazane typy κ kazein i β laktoglobulin można określić mianem
markerów genetycznych
Umaszczenie zwierząt można również wykorzystać do ustalenia pochodzenie zwierząt lub
przewidywania fenotypów oczekiwanego potomstwa. Duża zmienność umaszczenia zwierząt
związana jest z faktem, że w większości jest to cecha wynikająca ze współdziałania wielu genów,
(komplementarność, epistaza, addytywność) a także z występowania alleli wielokrotnych we
współdziałających ze sobą loci.
121
5.3. Sekwencje mikrosatelitarne
Sekwencje mikrosatelitarne STR lub SSR (ang. Short Tandem Repeats lub Simple Sequence
Repeats) należą do grupy sekwencji nie ulegających transkrypcji o zmiennej liczbie tandemowych
powtórzeń VNTR (ang. Variable Number of Tandem Repeats). Sekwencje mikrosatelitarne to liczne
powtórzenia 2-6 nukleotydów rozmieszczone w miarę równomiernie w genomie (u ssaków występują
co 6-10 tysięcy par zasad)- najczęściej w intronach. Miejsce zajmowane przez daną mikrosatelitę w
łańcuchu DNA jest stałe i nazywane jest tak, jak w przypadku genów: locus. Zatem dwa fragmenty
DNA w chromosomach homologicznych różniące się od siebie długością danego powtórzenia będą
kolejnymi allelami danej sekwencji mikrosatelitarnej. Motywy podstawowe mogą być powtarzane 1050 razy w formie podstawowej, czyli niezmiennej lub przerywanej fragmentem innej sekwencji:
sekwencje proste/zupełne
5’…ACACACACACACACAC…3’ (AC)8
sekwencje proste przerwane
5’…ACACACCTTACACAC…3’
sekwencje złożone
5’…ACACACACGTGTGTGT…3’ (AC)4(GT)4
(AC)3CTT(AC)3
sekwencje złożone przerywane 5’…ACACACCTAGTGTGT…3’ (AC)3CTT(GT)3
Długość powtarzanego motywu zajmującego to samo miejsce w chromosomach homologicznych
może być różna. Polimorfizm ten jest wynikiem wysokiego
tempa mutacji w tych regionach,
spowodowanego zmniejszoną wydajnością systemu kontrolno- naprawczego. Zmniejszenie
skuteczności naprawy powstałych mutacji jest z kolei spowodowane tym, że sekwencje te nie ulegają
transkrypcji. W regionach DNA, w których znajdują się sekwencje mikrosatelitarne często dochodzi
do tzw. poślizgu polimerazy (w czasie replikacji DNA) lub niezrównoważonego crossin over (w czasie
podziału mejotycznego). Częstość mutacji sekwencji mikrosatelitarnych (średnio 10-2 -10-5 na
pokolenie) zależy od długości sekwencji, rodzaju powtórzeń oraz od lokalizacji w chromosomie.
Szacuje się, że 1,2% nowych alleli sekwencji mikrosatelitarnych spowodowana jest mutacjami takimi
jak: addycja bądź delecja pojedynczej kopii motywu podstawowego. Atutem sekwencji
mikrosatelitarnych jako markerów genetycznych jest to, że nigdy nie podlegały one selekcji, a zatem
ograniczaniu polimorfizmu, ponieważ mieszcząc się w niekodujących rejonach DNA, nie mają wpływu
na fenotyp osobnika. Dlatego nazywane są również markerami neutralnymi. Ich polimorfizm nie
polega jednak na strukturze powtórzeń, a na ich długości (liczbie powtórzeń danego motywu
nukleotydów), dzięki czemu można go opisać numerycznie. Powtórzone n- razy poszczególne motywy
rozmieszczone w różnych loci identyfikowane jako różne markery. U każdego osobnika w danym
locus na dwóch chromosomach homologicznych ta sama sekwencja mikrosatelitarna może mieć
różną długość (w zależności od ilości powtórzeń motywu nukleotydów) stanowiąc tym samym
genotyp.
122
Osobnik nr 1, chromosom nr 1 (ojcowski):
5’…ACACACACACACACAC…3’
(AC)8
Osobnik nr 1, chromosom nr 1 (matczyny):
5’…ACACACACACACACACACAC…3’
(AC)10
Osobnik nr 1, genotyp: 8/10 (układ heterozygotyczny)
Osobnik nr 1, chromosom nr 8 (ojcowski):
5’…ACACACACACACAC…3’
(AC)7
Osobnik nr 1, chromosom nr 8 (matczyny):
5’…ACACACACACACAC…3’
(AC)7
Osobnik nr 1, genotyp: 7/7 (układ homozygotyczny)
Każdy marker STR dziedziczony jest w sposób prosty tj. zgodnie z prawami Mendla. Osobnik w
zależności od tego czy jest homo czy heterozygotą pod względem konkretnej mikrosatelity, posiada
dwa takie same lub odpowiednio dwa różne allele danej sekwencji, które przekazuje potomstwu w
pojedynczej kopii, tak więc zmienna liczba powtórzeń dziedziczona po ojcu i matce jest z kolei
niezmienna przez całe życie każdego osobnika. U poszczególnych gatunków badanych zwierząt
wykryto od 500 do ponad 10 tysięcy sekwencji mikrosatelitarnych. Liczba odkrytych STR i ich alleli nie
jest bez znaczenia, ponieważ stanowi ich podstawowy atut wykorzystywany w kontroli
pokrewieństwa lub identyfikacji osobniczej (genotypowania).
Najczęściej używanymi w genotypowaniu mikrosatelitami są te z motywami 2, 3 lub 4
nukleotydów, ich allele różnią się między sobą skokowo o odpowiednio 2, 3 lub 4 pary zasad. Oznacza
to, że sekwencja CA może mieć allele o sumarycznej liczbie par zasad np.: 10, 12, 14, 16 itd.(czyli co
dwie pary zasad), a sekwencja GAAT może mieć allele o liczbie par zasad np. 12, 16, 20, 24 itd. (czyli
wielokrotność 4 par zasad). Zdarzają się jednak wyjątki od tej reguły, a mianowicie allele, które są
mniejsze lub większe od pozostałych o np. 1 parę zasad. Jest to spowodowane tym, że u niektórych
osobników nastąpiły mutacje polegające na insercji lub delecji nukleotydu w obrębie mikrosatelity
lub regionu bezpośrednio przylegającego do tandemowych powtórzeń.
Dzięki nowoczesnym technikom laboratoryjnym można w dość łatwy sposób namnożyć wybrane
sekwencje mikrosatelitarne danego osobnika i precyzyjnie określić ich długość. Ta metoda nosi nazwę
genetycznego odcisku palca (ang. genetic finger printing). Posługując się prostą zasadą ich
dziedziczenia można zidentyfikować osobniki spokrewnione ze sobą lub wykluczyć takie
pokrewieństwo. Przykładowe rezultaty analizy pokrewieństwa przedstawiono poniżej:
Locus (marker)
A
B
C
D
krowa
8/11
15/16
20/16
22/26
cielę
8/11
15/15
20/14
24/26
buhaj 1
8/11
15/16
14/20
22/24
buhaj 2
6/12
15/15
19/20
20/24
buhaj 3
10/11
16/16
20/20
22/22
123
Powyższa sytuacja sugeruje, że ojcem jest buhaj nr 1, ponieważ posiada on allele, których potomek
na pewno nie mógł odziedziczyć po matce ( loci C-14 i D-24), jednocześnie analizując genotyp cielęcia
i buhajów nr 2 i 3 widać, że żaden z nich nie mógł by być jego ojcem, ponieważ u cielęcia nie
stwierdzono żadnego z charakterystycznych dla nich alleli (buhaj nr 2: locus A-6/12; buhaj nr 3: loci B16/16 i D-22/22).
Sekwencje mikrosatelitarne znalazły zastosowanie w identyfikacji osobniczej, kontroli pochodzenia,
diagnostyce wad genetycznych i mapowaniu genów. Dzięki ich wykorzystaniu możliwa jest
charakterystyka zmienności i struktury genetycznej populacji, ocena dystansu genetycznego między
liniami, rasami, poszczególnymi populacjami i gatunkami. Mikrosatelity są wykorzystywane w wielu
badaniach dotyczących między innymi: oceny wartości hodowlanej, w analizie genetycznego tła cech
ilościowych u zwierząt gospodarskich.
5.4. Umaszczenie zwierząt
Wpływ genów umaszczenia nie ogranicza się często do barwy sierści, ale jak już wspomniano
we wstępie, obejmuje tak istotne narządy jak wzrok, słuch, przewód pokarmowy, a także może mieć
wpływ na płodność czy przeżywalność. Takie powiązania, na pozór cech bardzo odległych, wynikają z
faktu, że melanoblasty- komórki prekursorowe melanocytów, pochodzą z cewy nerwowej
rozwijającego się embrionu. Jest to ten sam rejon cewy nerwowej, który również daje początek
głównym nerwom dorosłego organizmu. Melanocyty, komórki barwnikowe umieszczone są w
warstwie podstawnej naskórka, w tęczówce i naczyniach oka oraz w naczyniach opon miękkich,
rdzeniu i warstwie siatkowatej gruczołu nadnerczowego. Wytwarzają one melaninę, pigment
nadający barwę skórze i włosom, który magazynowany jest w organellach zwanych melanosomami.
Melanocyty posiadają charakterystyczne długie liczne wypustki cytoplazmatyczne, wyposażone w
mikrofilamenty aktynowe i w mikrotubule, które umożliwiają ruch melanosomów, do keranocytów
czy torebek włosowych. Różnice w barwie skóry czy włosów wynikają głównie z różnic w liczbie,
wielkości, kompozycji i rozkładzie melanosomów w komórce, podczas gdy liczba melanocytów w
zasadzie pozostaje stała. Melanocyty znajdują się pod ścisłą kontrolą keratynocytów. Pod wpływem
promieniowania UV keratynocyty wydzielają substancje, które regulują proliferację, różnicowanie,
oraz ruchliwość melanocytów, a także stymulują melanocyty do wytwarzania melaniny, co w
konsekwencji powoduje powstanie silniejszego, ochronnego zabarwienia skóry. W ten sposób
melanocyty chronią komórki skóry, a przede wszystkim ich DNA przed uszkodzeniami
spowodowanymi promieniowaniem UV.
Aktywność melanocytów jest również regulowana przez melanotropinę (hormon
stymulujący), oraz melanotoninę wydzielaną przez szyszynkę.
124
Rozwój melanocytów u myszy stanowi bardzo dobry model do badań nad oddziaływaniami
międzykomórkowymi, podczas życia zarodkowego i płodowego. Z cewy nerwowej melanoblasty
rozwijają się około 8,5 dnia życia zarodkowego migrując początkowo w orientacji grzbietowo bocznej
pomiędzy ektodermą a mezodermą a także w kierunku głowy. Od 10,5 dnia rozwoju zarodkowego
myszy, melanoblasty zaczynają migrować w kierunku brzusznym w rozwijającej się skórze właściwej.
W 14,5 dniu życia płodowego przenikają do leżącego obok naskórka i stamtąd migrują do
rozwijających się mieszków włosowych. Tam kontynuują proliferację i różnicowanie już jako
melanocyty, a około 4 dnia rozwoju postnatalnego rozpoczyna się synteza melaniny w skórze.
Produkcja barwnika w oku rozpoczyna się znacznie wcześniej, bowiem noworodki barwne myszy,
mają ciemne źrenice prześwitujące przez zamknięte powieki.
Melanina jest syntetyzowana w melanosomach z prekursora jakim jest tyrozyna (ryc. 5.1). Może
występować w postaci eumelaniny (barwnik czarny do ciemno brązowego) i feomelaniny (barwnik
rudo czerwony do żółtego). Oba barwniki występują w różnych proporcjach w melanosomach stąd
możemy wyróżnić trzy typy melanosomów:
feomelanosomy– okrągłe, bardzo wrażliwe na promieniowanie UV, są odpowiedzial-ne za
czerwony i żółty kolor skóry czy włosów
eumelanosomy I– blaszkowato-eliptyczne, mniej wrażliwe na promieniowanie ultrafioletowe,
są odpowiedzialne za brązowy kolor skóry
eumelanosomy II– najmniej wrażliwe na działanie promieniowania ultrafioletowego, są
odpowiedzialne za czarny kolor włosów i skóry (w tym także za wszelkiego rodzaju
znamiona).
Feomelaniny i eumelaniny tworzą kompleksy z białkami macierzy melanosomalnej. Dwa
początkowe etapy przemiany tyrozyny, katalizuje zależny od miedzi kompleks enzymów zwany
potocznie tyrozynazą. Etap pierwszy polega na hydroksylacji tyrozyny i powstaniu 3,4dihydroksyfenyloalaniny, nazywanej także Dopą. Reakcja ta jest katalizowana przez monooksygenazę
monofenolową. W drugim etapie reakcji, katalizowanej przez oksydazę katecholową, w wyniku
oksydacji Dopy powstaje Dopachinon. Proces ten jest kontrolowany przez geny z locus C ( Tyr), i E.
125
Rysunek 5.1. Ścieżki powstawania eumelaniny i feomelaniny
Ziarna eumelaniny i feomelaniny wykazują wiele różnic.
Eumelanina
Feomelanina
Ziarna mają różny kształt (okrągłe, spłaszczone, Ziarna jednorodne, małe, okrągłe
owalne, gwiaździste)
Różne rozmiary, różne natężenie barwy
Nie rozpuszcza się w żadnych rozpuszczalnikach
Rozpuszczalna w rozpuszczalnikach zasadowych
Rozlokowane wokół włókienek miofibrynogenu
Nie posiadają zorganizowanej macierzy.
5.5. Podstawowe geny warunkujące barwę włosa
U myszy opisano ponad 50 loci odpowiadających za umaszczenie i więcej niż 250 alleli
wpływających na tę cechę. Kilka z nich wydaje się mieć szczególnie duże znaczenie dla koloru okrywy
włosowej.
126
Jednym z najważniejszych loci, od których zależy barwa włosów i skóry jest locus Tyr,
oznaczany według starej nomenklatury symbolem C, który koduje tyrozynazę, odpowiedzialną za
powstawanie melaniny. Tyrozynaza katalizuje początkowy etap syntezy melaniny, gen ją kodujący ma
długość 1,6 kb i składa się z 5 eksonów. W locus tym znajduje się szereg alleli wielokrotnych
powstałych w drodze mutacji. Każdy z nich upośledza w różnym stopniu produkcje melaniny a
najbardziej recesywny Tyr c warunkuje powstawanie albinizmu. Białko kodowane przez gen z locusTyr jest odpowiedzialne za poziom całościowej pigmentacji organizmu, nie zaś za typ produkowanego
barwnika. Poszczególne formy alleliczne wpływają na zmniejszenie ilości produkowanego barwnika,
aż do zupełnego jego zablokowania w przypadku działania alleli cc ( Tyrc).
Znane formy alleliczne locus Tyr:
TyrC dzika forma genu warunkująca pełną produkcję pigmentu.
Tyr
c-ch
warunkujący tzw. szynszylowe zabarwienie (allel ten intensywniej redukuje
feomelaninę niż eumelaninę).
Tyr
c-h
dający umaszczenie himalajskie zwane też u kotów syjamskim (umaszczenie z
ciemnymi końcówkami partii dystalnych ciała– nos, uszy, kończyny, ogon- i jaśniejszym
tułowiem. Intensywność umaszczenia zależna od temperatury, im niższa tym umaszczenie
ciemniejsze. Oczy intensywnie niebieskie- u myszy oczy z wiekiem stają się rubinowe.) Na
poziomie budowy enzymu mutacja ta objawia się substytucją argininy w miejsce histydyny w
pozycji 420.
Tyr c-m– szynszyla cętkowana (motlet) – prawie białe plamy na tle czarnym.
Tyr c-e ekstremalne rozjaśniona sierść. Myszy brudno- białe. Oko ciemne. Brzuch jaśniejszy niż
grzbiet.
Tyr c- albinos całkowity brak pigmentu w skórze, sierści i oczach - oczy czerwone – przebija
barwa hemoglobiny w naczyniach krwionośnych.
Klasyczna mutacja Tyrc jest spowodowana substytucją nukleotydu guaninowego na cytozynowy w
pozycji 308 nukleotydu tyrozynazy. Konsekwencją tej zamiany jest zmiana aminokwasu cysteiny,
występującego w pozycji 103, na serynę.
Zmniejszenie intensywności koloru futra jest skorelowane ze zmniejszeniem ilości melaniny.
Głównym czynnikiem wpływającym na zmniejszającą się ilość melaniny u czarnych zwierząt, jest
wielkość ziaren melaniny, ale wpływ może mieć również ich liczba, kształt i rozmieszczenie we włosie.
U myszy o umaszczeniu brązowym allele z serii Tyr nie wpływają na wielkość ziaren melaniny, ale
127
powodują redukcję ich liczby. Geny te oddziałują podobnie na ziarna melaniny u zwierząt o żółtym
kolorze futra, chociaż wykazują również niewielki wpływ na wielkość granul.
5.5.1. Locus Tyrp1 (inaczej B)
Innym locus ważnym w oddziaływaniu na barwę sierści zwierząt jest Tyrp1 (tyrosinaserelated protein-1), dawniej określany symbolem B. Jego wpływ na melanosomy ma miejsce w czasie
ich dojrzewania, czyli kiedy melanina jest magazynowana wzdłuż włókien melanosomów. Gen,
którego produktem jest białko- oksydaza kwasu 5,6-dihydroksyindolo-2-karboksylowego, składa się z
ośmiu eksonów. Prawdopodobnie białko to związane jest z błoną melanosomu i jest konieczne do
uformowania struktury równoległych włókien melanocytu, które mają zdolność wiązania tyrozynazy
w określonej ilości. Allel Tyrp1 B jest dziką formą genu odpowiedzialną za produkcję czarnej melaniny
i nie ma wpływu na produkcję feomelaniny. W szeregu alleli tego locus występują allele, które są
dominujące względem formy dzikiej– warunkującej czarną melaninę, które działają w kierunku
rozjaśnienia barwy sierści
Allele w locus Trp1
Tyrp1Blt- najsilniej dominujący allel dający jasne, prawie białe futerko z wyraźnymi ciemnymi
końcami włosów.
Tyrp1Bw– część włosów jest pigmentowana brązowo a część czarno, od podstawy włosa
rozjaśnienie dwukrotnie szersze niż w przypadku Tyrp1 Blt.
Tyrp1B– allel typu dzikiego warunkujący czarne umaszczenie ( granule pigmentu duże,
owalne).
Tyrp1bc– umaszczenie typu kurdyban (brązowe z pozłoceniem)
Tyrp1b- barwa futerka brązowa – czekoladowa (zmiana barwy związana ze zmianą wielkości i
kształtu ziaren melaniny. Ziarna melaniny myszy brązowych zawierają niewiele ponad jedną
trzecią ilości barwnika, w porównaniu z melanosomami myszy o czarnym kolorze futra).
5.5.2. Locus nonagouti (a)
Umaszczenie powstające pod wpływem allelu A charakteryzuje się występowaniem
specyficznego rozłożenia obu form melaniny wzdłuż włosa. Podstawa włosa jest czarna lub brązowa
(zależnie od alleli locus Tyrp1) i taka sama jest końcówka włosa. Podszczytowo we włosach
pokrywowych, występuje jeden lub więcej prążków żółtych. Taki rozkład barwników wzdłuż włosa
spowodowany jest zaprzestaniem odkładania się eumelaniny w trzonie włosa, na korzyść
feomelaniny, po czym ponownie we włosie odkładana jest eumelanina. Ten typ umaszczenia
128
określany jest jako dzika forma genu, bowiem występuje często u zwierząt dziko żyjących
umożliwiając im maskowanie się w naturalnym terenie ich bytowania.
Najbardziej znaną formą mutacji w tym locus jest allel nonagouti (a). Allel a jest bardzo
dawną mutacją występującą w tym obszarze genomu. Myszy o genotypie a/a mają jednolicie
wybarwione, nieprążkowane włosy. Występuje w nich głównie eumelanina, chociaż włosy na uszach i
za uszami, oraz na sutkach mają, przynajmniej częściowo, żółte zabarwienie. W locus agoutistwierdzono 17 alleli ułożonych w szereg dominacyjny. Oto niektóre z nich;
Ay w cebulkach włosowych produkowana jest tylko feomelanina- włos jest żółty, oko czarne, allel
letalny w homozygocie- osobniki zamierają w stadium moruli/blastocysty, u heterozygoty występuje
otłuszczenie, cukrzyca, sterylność, wrażliwość na raki płuc i sutka u samic. Pozostałe, nie żółte myszy
tych cech nie posiadają.
Avy- włos żółty w czarne pasy, oko czarne, myszy żywotne
Aiy- włos żółty jak u wszystkich myszy z allelem Ay . Myszy są otłuszczone – blokada
metabolizmu tłuszczu, uszy mają ciemniejsze niż u poprzednich żółtych genotypów.
Asy- (inwersja) jasno- żółty włos z czarną końcówką.
Aw – aguti, białobrzuche, oko czarne; agouti (włos strefowy, brzuch szary, oko czarne).
Ai – brzuch brudno- żółty, grzbiet bardzo ciemny aguti.
at – nieaguti podpalane (grzbiet czarny, brzuch brązowy, oko czarne), uszy jasne nieaguti,
uszy jasne
ac- całkowicie nonaguti- brak jakichkolwiek żółtych włosów, produkowana jest tylko
eumelania
al.- letalne nieaguti
5.5.3. Locus E- extension
Geny locus e- extension (wg nowej nomenklatury Mc1r) odpowiedzialne są za syntezę
receptora melanokortyny, białka stymulującego komórki do produkcji barwnika. Gen ten znany jest u
wielu gatunków zwierząt (np. psy, świnki morskie, króliki) i jego produkt odpowiada za intensywność
barwy oraz za masę ciała. Geny z locus e, odpowiadające za kolor sierści, czyli wytwarzanie
melanokortyny, kontrolują również produkcję białek zwanych defensywami, (rodzina małych
peptydów przeciwbakteryjnych), które występują w neutrofilach, a także w komórkach jelita
cienkiego oraz komórkach epitelialnych krtani i języka. Gen ten występuje w dwóch podstawowych
postaciach. E- warunkuje intensywną barwę czarną ( eumelaninę), działa zaś hamująco na produkcję
feomelaniny. Allel recesywny, e– warunkuje powstanie feomelaniny. Oba allele działają epistatycznie
129
w stosunku do locus aguti. Allel E występując razem z A blokuje powstawania żółtego prążka na
włosie, natomiast genotyp ee aa –warunkuje produkcję żółtego barwnika ograniczając ją tylko do
cebulki włosowej
5.5.4. Locus D- dilution
Locus Myo5a tradycyjnie zwany locus d, powoduje rozjaśnienie barwy sierści w zależności od
tła genetycznego ; czarną do niebieskiej, ciemno brązową (czekoladową) do beżowej. W obecności
genów A. B.- daje jasny aguti, a na tle genotypu A.bb daje umaszczenie określane jako jasny
cynamon.
Efekt występuje zarówno w przypadku włosów zawierających eumelaninę jak i feomelaninę.
Efekt ten nie jest spowodowany redukcją ilości pigmentu, przeciwnie, średnia ilość pigmentu we
włosie zwierzęcia z mutacją jest większa niż u zwierzęcia o podobnym genotypie, ale bez mutacji w
locus- Myo5a.( D). Przyczyną rozjaśnionego koloru sierści jest zbrylanie się pigmentu. Powstające
bryły nie absorbują tak wiele światła jak równomiernie rozłożony we włosie barwnik. Zbrylaniu
pigmentu występującemu głównie w rdzeniu włosa często towarzyszy zmniejszenie liczby ziaren
melaniny w warstwie korowej włosa, Dzieje się tak z powodu nieregularnego rozmieszczenia
niezbrylonych ziaren melaniny, oraz opóźnienia pigmentacji. Melanina znajdująca się w warstwie
korowej utrzymuje intensywny kolor włosa, zapobiegając rozpraszaniu się promieni świetlnych w
pustych przestrzeniach rdzenia włosa. Zbrylanie barwnika występuje także w siatkówce oka.
Wykazano, że gen Myo5a koduje białko miozynę-Va (MyoVA). Białko to należy do rodziny
niekonwencjonalnych miozyn, o ogólnym planie budowy: N-terminalna domena „głowowa”,
posiadająca zdolność wiązania aktyny, C-terminalna domena „ogonowa” i łącząca je domena
„szyjna”. Białka z tej rodziny występują szeroko poza tkanką mięśniową u kręgowców i
bezkręgowców. Uważa się, że MyoVA bierze udział w zależnym od aktyny transporcie organelli w
komórce, w tym również melanosomów.
W locus Myo5a zostało zidentyfikowanych ponad 200 mutacji zarówno spontanicznych jak i
indukowanych. Jednym z ciekawszych alleli jest allel dl (dilute-lethal)- Myo5a l, który jest recesywny w
stosunku do allelu d, jak i do formy dzikiej genu- D. Oprócz rozjaśnienia sierści, które jest nie do
odróżnienia od zwierząt o genotypie d/d, u myszy homozygotycznych pod względem allelu dl
występują ciężkie zaburzenia, nerwowo-mięśniowe. Charakteryzują się one konwulsjami i tężcem
grzbietowym, wyginając łukiem w górę głowę i ogon zwierzęcia. W układzie nerwowym następuje
degeneracja mieliny, co prowadzi do śmierci myszy w wieku około trzech tygodni. Stwierdzono także
poważne zaburzenia w metabolizmie fenyloalaniny.
130
Mutacje w ludzkim homologu Myo5a, genie MYH12 powodują chorobę Griscelliego,
charakteryzującą się siwieniem, różnorodnymi defektami neurologicznymi, oraz niedoborami
odpornościowymi.
5.5.5. Locus S (receptor endoteliny typu B – Ednrbs)
Locus S w formie niezmutowanej warunkuje umaszczenie zależne od innych loci.
Mutacje w tym locus prowadzą do blokady rozwoju melanocytów w skórze. W zależności od mutacji,
ograniczenie produkcji melanocytów a w związku z tym i barwy sierści, następuje poczynając od
dystalnych części (łapki, brzuch) do objęcia białą łata prawie całego ciała.
I tak np. mutacja w kierunku s– może powodować depigmentację np, tylko czubka nosa, części
twarzowej między oczami, kołnierza wokół szyi, brzucha, czy wystąpienie jasnych skarpetek na
łapkach.
Bardziej skrajna mutacja w tym locus, sl-warunkuje tzw. letalną srokatość. Myszy dotknięte tą
mutacją są białe, z barwną, o nieregularnym kształcie i wielkości plamą na głowie, a homozygoty pod
względem tego allelu, umierają.
5.5.6. Locus W (Dominant White Spotting)
Locus W– dominującej białości, (w nowej nomenklaturze kitw) warunkuje syntezę białka
receptorowego kinazy tyrozynowej (Kit). Znany jest też jako homolog onkogenu V-kit, który
stwierdzono również u innych gatunków ssaków takich jak pies, świnia, owca, bydło, a także u
człowieka. Białko to wytwarzane jest w melanocytach, komórkach prekursorowych erytrocytów,
komórkach tucznych i komórkach zarodka. Razem z czynnikiem wzrostu komórek tucznych Mgf
(Mast Cell Growth Factor) syntetyzowanym przez zupełnie inne locus (Kitl) współdziała w rozwoju i
migracji komórek zarodkowych pnia (ESC) a także, wymienionych wcześniej komórek oraz ma wpływ
na ich przeżywalność w rozwoju zarodkowym.
Mutacja w dzikim allelu tego locus w, w kierunku W, prowadzi do blokady rozwoju
melanocytów zarówno w skórze (skóra i włos biały) jak i w źrenicy oka (źrenica niebieska) a także
może zaburzyć prawidłowy rozwój komórek nerwowych (stąd mogą występować zaburzenia w
układzie nerwowym). W obrębie tego locus u myszy, znanych jest kilka mutacji:
W– dominująca biel futerka, ale oko czarne
W42J– allel letalny w homozygocie. Heterozygota ma plamy na głowie i w okolicy uszu, oczy
czarne.
131
Wsh– allel letalny w homozygocie. Heterozygota-charakteryzuje się białym pasem
przebiegającym przez lędźwie.
Wv- zmniejszona wielkość granul pigmentu – myszy żywotne, szarawe z białym brzuchem i
zmienną liczbą białych plam na grzbiecie. Stopy i ogon pozbawione pigmentu
w– pełna pigmentacja, allel dziki.
W sąsiedztwie allelu W znajdują się jeszcze dwa geny wpływające na łaciatość myszy. Jest to gen
Ph ( patch)– warunkujący białe plamy na futerku oraz gen Rw (rump white) warunkujący powstanie
białej plamy na zadzie. Geny te są ściśle sprzężone z locus W (Ph-W =0,8cM, Rw – W= 0,4cM, Ph –
Rw= 1,4cM).
Znane są też podobne mutacje, które nie warunkują letalności nosicieli a dają podobny obraz
fenotypowy, jak biały pas przechodzący przez grzbiet, czy zabarwienie okolic nosa. Sposób
dziedziczenia tego typu plamistości przedstawia się następująco: homozygota – barwa tylko w okolicy
nosa, heterozygota– biały pas przechodzący przez grzbiet, homozygota brak mutacji –pełne
wybarwienie sierści.
Genotypy umaszczenia u myszy z uwzględnieniem wymienionych loci genowych
Fenotyp umaszczenie
Genotyp
Dzikie ( aguti)
A.B.C.D.ee P.S. ww
Cynamonowe
A. bb.C.D.ee P.S.ww
Rozjaśniony aguti
A.B.C.dd ee P.S.ww
Rozjaśniony cynamon
A.bb.C.dd ee P.S.ww
Złocisty ciemny (różowooki)
A.B.D.ee pp S.ww
Złocisty jasny (różowooki)
A Bb D.ee pp S ww
Złocisty ciemny rozjaśniony różowooki
A.B.C.dd ee pp S. ww
Złocisty jasny, rozjaśniony rożowooki
A. Bb C. dd ee pp S ww
Aguti łaciaty
A.B.C.D.ee P.ss ww
Jednolicie czarny dominujący
A/a.B.C.D.E.P.S.ww
Czarny recesywny
aa B.C.D.ee P.S.ww
Czarny podpalany
atat B.C. ee P.S.ww
Brązowy /czekoladowy
aa bb C.D.ee P S ww
132
Fenotyp umaszczenie
Genotyp
Ciemny niebieski/ granatowy
aa B. C. dd ee P S ww
bBżowy
aa bb C. dd ee P S.ww
Niebieski , oko różowe
aa B. C. D. ee pp S.ww
Kremowy, oko różowe
aa bb C. D. ee pp S.ww
Jasno niebieski, oko różowe
Aa B.C. dd ee pp S ww
Jasno kremowy, oko różowe
aa bb C.dd ee pp S ww
Czarny łaciaty
aa B. C. D. ee P.ss ww
Biały, czarnooki
A/a B/b C. D.ee P.ss W.
A.– oznacza, że może tu być homozygota dominująca lub heterozygota
A/a oznacza, że w tym locus może wystąpić każdy genotyp. Genotyp ten nie ma wpływu na fenotyp.
5.6. Skutki mutacji w genach warunkujących umaszczenie u zwierząt
Mutacja warunkująca dominujące białe umaszczenie u myszy, ma swoje analogi u różnych
gatunków ssaków i tak, u kotów białych może powodować głuchotę, ale tylko w sytuacji wystąpienia
oczu o niebieskich źrenicach. W przypadku jednej źrenicy niebieskiej a drugiej pomarańczowej, kot
jest głuchy tylko na jedno ucho, po stronie oka niebieskiego. Podobną wadę można obserwować u
białych bokserów. U ludzi odpowiednikiem jest tzw. choroba Waardenburga powodującą osłabienie
słuchu i nieprawidłową pigmentację skóry i siatkówki oka.
U myszy występuje mutacja powodująca szereg objawów typowych dla syndromu
Waardenburga, które pozornie wydają się ze sobą niezwiązane. Można u nich zaobserwować
nieprawidłową pigmentację, rozrost okrężnicy i głuchotę. Myszy heterozygotyczne pod względem
zmutowanego genu nie wykazują tych objawów. Natomiast zwierzęta homozygotyczne posiadają
rozległe białe łaty i powiększoną okrężnicę. Początkowo nie wykazują żadnych innych objawów
chorobowych, ale w wieku dwóch tygodni ujawnia się u nich coraz wyraźniejsze powiększenie powłok
brzusznych i myszy umierają przed osiągnięciem wieku siedmiu tygodni. Powiększenie okrężnicy
spowodowane jest brakiem splotów nerwowych Auerbacha w błonie mięśniowej dystalnego odcinka
okrężnicy. Uniemożliwia to ruch mięśni okrężnicy i prowadzi do zastoju treści pokarmowej w jelicie
grubym.
U myszy tych występuje głuchota będąca wynikiem nieprawidłowości w budowie ślimaka w
uchu wewnętrznym. W narządzie Cortiego brak jest dostrzegalnych komórek włoskowatych
(zmysłowych komórek słuchowych) oraz endolimfy, która w normalnych warunkach wytwarzana jest
133
przez prążek naczyniowy. Pierwotną przyczyną tych deformacji jest brak komórek pośrednich prążka
naczyniowego- pochodzących od komórek cewy nerwowej melanocytów.
Myszy dotknięte tymi wadami mają zmutowany gen receptora endoteliny B (EDRNB), którego
produkt u zdrowych zwierząt współdziała z endoteliną 3 w różnicowaniu i rozwoju komórek cewy
nerwowej, Komórki te są prekursorami melanocytów, oraz komórek zwojów nerwowych jelita.
Zmiany w genie kodującym endotelinę-3 prowadzą do podobnych skutków.
Odpowiednikiem opisanego syndromu jest umaszczenie overo u koni, które charakteryzuje
się obecnością białych łat na brzuchu, rozpościerających się również na boki i grzbiet zwierzęcia, nie
przekraczając jednak linii kręgosłupa. Dwa osobniki o takim umaszczeniu mogą dać biało umaszczone
źrebię, które wydaje się zdrowe, ale nie przeżywa 48 godzin od urodzenia. Przyczyną śmierci jest brak
zwojów nerwowych w jelitach. Powoduje to czynnościowy zator w jelicie. Chociaż nie wszystkie
źrebięta miały przeprowadzane badanie słuchu, przynajmniej u części z nich wykryto głuchotę.
Niektóre osobniki miały niebieskie tęczówki. Objawy występujące u białych źrebiąt, przypominają te,
występujące u pacjentów z chorobą Hirschsprunga.
Inne przypadki letalności zwierząt związane z umaszczeniem to np. gen Merle występujący u
psów (dogów i jamników), omówiony dokładniej w rozdziale 7.
Literatura do rozdziału 5
1. Nowicki B. i Kosowska B., 1985, Genetyka i podstawy hodowli zwierząt.- Rozdział o umaszczeniu
koni. PWRiL
2. Smolarek D., Krop-Wątorek A., Waśniowska K., Czerwiński M., 2008, Molekularne podstawy
układu grupowego ABO. Hig. Med. Dośw. 52, 4-17
3. Wirth-Dzięciołowska E., 2008, Poradnik hodowcy kotów. Multico
Zadania do rozdziału 5
Zadanie 5.1
Ustal, który z podanych buhajów jest ojcem cielęcia.
Układy grupowe krwi
AH
B
C
FV
J
L
M
SU
Z
T
R
cielę
H/-
BG/E’2K’
C/W
F/-
J/-
L/-
M/M
U1/U1
Z/-
-/-
-/-
krowa
H/-
A’O’/ E’2K’
C/CX1
F/V
-/-
L/-
M/-
U1/U2
Z/-
-/-
-/-
buhaj1
A/-
BG/BGY2
W/X3
F/F
J/-
-/-
M/-
S/U1
-/-
-/-
-/-
buhaj2
H/-
BG/ E’2K’
C/W
F/-
J/-
L/-
M/-
U2/-
Z/-
-/-
-/-
134
Zadanie 5.2
Ile
potencjalnych
genotypów
można
zidentyfikować
w
układzie
zgodności
tkankowej
reprezentowanym przez 6 różnych alleli?
Zadanie 5.3
Mężczyzna posiadający grupę krwi B jest podany do sądu w sprawie o ojcostwo przez kobietę o
grupie krwi A. Dziecko ma grupę krwi 0.
a)
czy ten mężczyzna może być ojcem tego dziecka?
b)
Jeśli jest ojcem dziecka, jaki powinien posiadać genotyp? Jaki genotyp ma w takim razie
matka dziecka?
c)
Jeśli mężczyzna miałby grupę krwi AB, czy mógłby być ojcem dziecka?
Zadanie 5.4
Największej różnorodności grup krwi można oczekiwać wśród licznych potomków zrodzonych z
rodziców mających genotypy jak w zestawie:
Ojciec
Matka
a)
AB
00
b)
A0
BB
c)
A0
B0
d)
AA
B0
Zadanie 5.5
Kolor oczu
Możliwy genotyp
Niebieski
bbgg
Brązowy
B.gg; B.G.
Zielony
bbG.
Pewien mężczyzna miał z kobietą z zielonymi oczami i grupą krwi „0” dwoje dzieci: zielonooką
córeczkę z grupą krwi „A” i chłopca o brązowych oczach i tej samej grupie krwi co siostra. Tak się
złożyło, że z inną błękitnooką niewiastą z grupą krwi „A” miał jedno dziecko- chłopca o zielonych
oczach i grupie krwi „B”. Jakiego koloru oczy i jaką grupę krwi miał ojciec dzieci?
Zadanie 5.6
Albinotyczny, mężczyzna z grupą krwi „0”, poślubia kobietę o normalnej pigmentacji z grupą krwi
„AB”. Jakiego potomstwa można spodziewać się w tym małżeństwie? Określ genotypy i
prawdopodobieństwo ich wystąpienia.
Zadanie 5.7
135
Umaszczenie królików uwarunkowane jest szeregiem alleli wielokrotnych, które pod względem
dominowania dadzą się uszeregować w następującej kolejności: C – umaszczenie jednolicie ciemne,
cch – umaszczenie szynszyli, cm – umaszczenie kuny, ch – umaszczenie himalajskie, c – albinosy.
Jakich genotypów i fenotypów oraz z jakim prawdopodobieństwem można oczekiwać w potomstwie
następujących par rodzicielskich:
cchcm x chc
b) Cc x Cch
c)cmch x cchc
Zadanie 5.8
Skojarzono samca o umaszczeniu szynszyli z samicą o umaszczeniu himalajskim, której ojciec był
albinosem. Wśród potomstwa pojawiły się osobniki o fenotypach obojga rodziców w jednakowej
proporcji. Podaj genotypy rodziców.
Zadanie 5.9
Skojarzono jednolicie ciemnego samca z dwoma samicami. Z pierwszą, również jednolicie ciemną,
otrzymano potomstwo o fenotypie identycznym jak rodzice. Wśród potomstwa z drugą samicą, o
umaszczeniu kuny, pojawiły się młode o umaszczeniu ciemnym, kuny oraz albinosy w proporcji 2:1:1.
Podaj genotypy zwierząt.
Zadanie 5.10
Wyjaśnij w jakich sytuacjach może dojść do wykluczenia:
- ojcostwa
-matki
-obojga rodziców.
Zadanie 5.11
Jasnobrzucha aguti samica dała potomstwo: jasnobrzuche, podpalane i czarne w stosunku 2:1:1. Jaki
był jej genotyp, oraz jaki był fenotyp i genotyp samca? Przedstaw rozumowanie przy pomocy
schematu.
Zadanie 5.12
Dziki typ umaszczenia królików ( C) dominuje nad szynszyla ( c
ch
), nad himalajskim (ch), nad
albinosem ( c). Ustal jakie były fenotypy i genotypy par rodzicielskich królików jeśli w miotach
otrzymano potomstwo od 1 pary – 3 szynszyle : 1 himalajskiego
od 2 pary – 2 agouti : 1 himalajskiego : 1 szynszyla.
od 3 pary 2 agouti : 2 szynszyli
od 4 pary – 2 agouti : 1 himalajskiego : 1 albinosa.
Napisz krzyżówki używając odpowiednich symboli
Zadanie 5.13
U kotów w locus C występuje seria alleli na którą składają się ; allel C – pełna produkcja melaniny,
allel cb – daje umaszczenie brunatne, focze zwane też burmańskim , allel ch –warunkuje umaszczenie
136
himalajskie, allel ca – umaszczenie białe, oczy niebieski, Allel c- albinizm. Allel cb i ch nie wykazują
między sobą dominowania i występując razem dają umaszczenie typowe dla kotów tonkijskich. Zapisz
poprawnie przy pomocy schematu kolejność uszeregowania alleli i zależności między nimi Ile jest
możliwych różnych genotypów i fenotypów w zakresie wymienionej serii alleli? Jakich umaszczeń
można spodziewać się w potomstwie kota o pełnym umaszczeniu z kotką o umaszczeniu tonkijskim?
Przy jakim genotypie kota o pełnym umaszczeniu ma szansę pojawić się największa różnorodność
umaszczeń wśród kociąt.. Rozważ wszystkie możliwości.
Zadanie 5.14
Samca myszy o umaszczeniu niebieskim/granatowym wywołanym obecnością genu d skojarzono z
samicą albinotyczną. W potomstwie urodziły się myszki o umaszczeniu aguti, czarnym,
niebieskim/granatowym i jasnym aguti.
Zapisz przy pomocy symboli fenotypy potomstwa. Ustal na tej podstawie, jakie były genotypy
rodziców. Jakie jeszcze inne fenotypy mają szansę pojawić się w dalszych kojarzeniach wśród
potomstwa wymienionych rodziców?
Zadanie 5.15
Jakie były genotypy i fenotypy rodziców jeśli albinotyczna samica urodziła potomstwo, wśród których
były myszy o umaszczeniu czekoladowym, beżowym, cynamonowym i jasno cynamonowy.
Zapisz przy pomocy symboli fenotypy (genotypy) potomstwa. Ustal na tej podstawie genotypy
rodziców. Jak umaszczony mógł być ojciec tego potomstwa. Uwaga mogą być różne odpowiedzi.
Zadanie 5.16
Jakiego potomstwa pod względem umaszczenia i w jakim stosunku fenotypowym należy oczekiwać
po skojarzeniu między sobą dwóch heterozygot w loci C, A i D. Jaki to jest typ dziedziczenia.
Zadanie 5.17
Czarnobiała kotka przyniosła do domu miot składający się z 3 kociąt;
jednolicie czarnego, czarnobiałego i himalajsko umaszczonego. Zapisz przy pomocy symboli fenotypy
wszystkich zwierząt. Ustal, jaki mógł mieć kolor ojciec tego miotu.
Ustal przypuszczalne genotypy wszystkich zwierząt w zadaniu.
Odpowiedzi do zadań
Ad1. Buhaj nr 2
Ad2. 21
B
A
Ad3. a) TAK; b) mężczyzna: I i, kobieta: I i; NIE
Ad4. c
Ad5. oczy brązowe, grupa krwi AB
137
A
A
A
A
A
Ad6. wariant I: 100% CcI i; wariant II: 50% CcI i, 50% ccI i; wariant III: 50% CcI i, 50% Ccii; wariant IV: 25% CcI i,
A
25% Ccii, 25% ccI i, 25% ccii
Ad7. łatwe….
ch h
h
Ad8. c c x c c
m
Ad9. samiec: Cc; samica I: CC, samica II: c c
Ad.11. Samica Awa, to samiec ata
Ad12. 1para; cchc x cchc, 2para; Cch x cchch lub cchc
Ad13.a) różne, zależnie od genotypu kota,.b) Cc
Ad14. Rozwiązanie:
Potomstwo aguti
Cc .A. B. Dd.
Potomstwo czarne
Cc aa.B. Dd.
Potomstwo granatowe/ niebieskie Cc aa B. dd
Jasne aguti
Cc A. B.dd
Genotyp ojca C. aa B. dd x genotyp matki cc Aa. B. Dd
Inne fenotypy; jeśli w locus B jest u obojga rodziców b to
potomstwo czekoladowe Cc aa bb Dd
cynamonowe
CcAa bb Dd
jasny cynamon
Cc Aa bb dd
beżowe
Cc aa bb dd
Ad15. Rozwiązanie ( genotypy potomstwa z drugiej części poprzedniego zadania)
Na tej podstawie genotyp matki; cc Aa/ aa bb Dd/dd
Genotyp ojca CC aa bb dd – granatowy/ niebieski
Lub
CC Aa bb dd – jasny cynamon
Lub
CC Aa bb Dd cynamon
Lub
CC aa bb Dd –czarny.
Ad16. Rozwiązanie.
CcAaDd x CcAaDd
C.A.D.
3x3x3 = 27 agouti
C.A. dd 3x3x1= 9 jasny aguti
C.aa D. 3x1x3 =9 czarny
cc A.D. 1x3x3= 9 albinosy
C.aadd
3x1x1=3 granatowe/niebieskie
ccA.dd
1x3x1=3 albinosy
ccaaD.
1x1x3=3 albinosy
ccaadd
1x1x1=1 albinosy
27 agouti:9 jasny agouti :9 czarnych :3 granatowych :16 albinosów
Ad17. Rozwiązanie
Kotka CchBB ss x kocur Cch BB Ss
138
Kociak jednolicie czarny C.BBSs
Czarno biały
Himalajski
C.BB ss
chch BB Ss
139
6. Mapowanie genów
Autorka: Zuzanna Nowak
Mapowanie genomów polega na przypisaniu genom lub wybranym odcinkom DNA (zwanym
markerami) ich miejsca w chromosomach i wykazaniu wzajemnych relacji. W mapowaniu genomów
wykorzystuje się dwa główne założenia:- geny ułożone są na chromosomach liniowo;- geny zajmują
na chromosomach ściśle określone, stałe miejsce- locus. Autorem tych założeń był Thomas Morgan,
który za swoje odkrycia w 1933r dołączył do grona noblistów. Wyróżnia się dwa rodzaje mapowania
genomów: mapowanie fizyczne i genetyczne, zwane również sprzężeniowym. Wynikiem mapowania
fizycznego jest mapa pokazująca rzeczywistą odległość pomiędzy genami wyrażoną w parach zasad.
Wynikiem mapowania genetycznego jest uzyskanie mapy, pokazującej odległość między
poszczególnymi genami w jednostkach mapowych (j.m.) lub odpowiadających im centyMorganach
(cM); jednostki te mają charakter względny i nie pokazują rzeczywistej odległości między genami.
Jeden cM jest tym samym, co jednostka mapowa (1 j.m.) i odpowiada 1% crossing over w obrębie
pary genów.
6.1. Zjawisko rekombinacji
Crossing over jest procesem, w którym dochodzi do wymiany odcinków chromatyd
(niesiostrzanych) w biwalencie (Ryc.6.1). Proces ten ma miejsce w profazie pierwszego podziału
mejotycznego, w pachytenie. Podczas crossing over wytwarza się nietrwałe połączenie dwóch
chromatyd (ustawionych do siebie w tym samym kierunku) zwane chiazmą. W rezultacie, po
zakończonym crossing over może dojść do trwałej wymiany odcinków chromatyd między
chromosomami homologicznymi na odcinku położonym bliżej telomeru lub między dwoma
chiazmami. Zjawisko to nazywa się rekombinacją a powstałe nowe formy- rekombinantami. Jeśli
fragmenty chromosomów homologicznych, zawierające dwa lub więcej genów przedstawimy w
postaci odcinków linii prostej, to wystąpienie crossing over w obrębie tych odcinków spowoduje
wzajemną wymianę, ich części wraz ze znajdującymi się na nich genami (Ryc.6.2)- w ten sposób
powstaną gamety zrekombinowane o innym niż rodzicielski układzie alleli. Crossing over nie zachodzi
ze stałą częstością. Znacznie częściej zachodzi w okolicach telomerów, bardzo rzadko w okolicy
centromeru. Częściej zachodzi w mejozie u samic niż u samców. Częściej również dochodzi do
crossing over na długich odcinkach chromosomu niż na krótkich. Zjawisko to, prowadzące do
powstania nowych form genetycznych jest główną przyczyną pojawiania się zmienności genetycznej
w populacji i podstawą określania sprzężenia między dowolnymi odcinkami DNA.
140
6.2. Sprzężenie genów
Sprzężeniem genów lub markerów nazywa się ich wzajemne relacje w powiązaniu z
przynależnością do chromosomu. Geny, które leżą na jednym chromosomie nazywa się sprzężonymi
choć nie oznacza to, że będą dziedziczyć się zawsze w tym samym układzie. Geny sprzężone tworzą
grupy sprzężeń a ich liczba jest równa haploidalnej liczbie autosomów w komórce i chromosomów
płci (Ryc.6.3).
Geny występujące w różnych chromosomach nie są sprzężone i podlegają losowej segregacji
w czasie tworzenia gamet a ich dziedziczenie określa się jako niezależne. Geny leżące bardzo blisko
siebie na jednym chromosomie w czasie wytwarzania gamet, zawsze będą przekazywane razem (w
tym samym układzie), będą one wykazywać sprzężenie całkowite. W przypadku sprzężenia
częściowego może dochodzić do wystąpienia crossing over i część powstałych gamet będzie
zrekombinowanych, czyli posiadających inny układ alleli niż rodzicielski. Aby więc udowodnić
sprzężenie genów, można odwołać się do drugiego prawa Mendla. Krzyżując osobniki o
przeciwstawnych genotypach pod względem dwóch cech dziedziczących się z całkowitą dominacją
(podwójną homozygotę dominującą i podwójną homozygotę recesywną) w pokoleniu F1 otrzymamy
100% mieszańców wykazujących cechy dominujące. Proporcje otrzymanych fenotypów w pokoleniu
F2 będą dla nas wyznacznikiem stopnia sprzężenia dwóch testowanych genów. Stosunek fenotypów
zbliżony do przewidzianego w doświadczeniu przez Mendla (9:3:3:1), wykaże, że testowane geny
dziedziczą się niezależnie od siebie. Pojawienie się w pokoleniu F2 tylko dwóch fenotypów (zgodnych
z rodzicielskimi) w proporcjach zbliżonych do 3:1 dowiedzie całkowitego sprzężenia testowanych
genów. Uzyskanie czterech fenotypów lecz w proporcjach znacznie różnych niż „mendlowskie”
będzie oznaczało częściowe sprzężenie genów (Ryc.6.4a-c). Pojawienie się w ostatnim z trzech
opisanych przypadków, fenotypów innych niż rodzicielskie i z inną częstością niż wynikająca z zasad
kombinacji 4 elementów (za jakie można uważać w tym momencie allele poszczególnych genów
łączące się w zygocie), będzie świadczyło o tym, że w obrębie loci dwóch testowanych genów
wystąpił crossing over i część gamet rodzicielskich została zrekombinowana.
Rycina 6.1. Crossing over– biwalent chromosomów konika polnego (Chorthippus parallelus) z widocznymi
pięcioma chiazmami (Prof. Bernard John, http://biology-pages.info)
141
Rycina 6.2. Wymiana odcinków chromatyd w wyniku wystąpienia crossing over (rys. Z. Nowak)
Rycina 6.3. Przykładowe grupy sprzężeń
Człowiek Homo sapiens 2n= 46; 24 grupy sprzężeń [22 pary chromosomów autosomalnych + X,Y]
Kura domowa Gallus gallus domesticus 2n=78; 39 grup sprzężeń [35 par chromosomów
autosomalnych + Z,W]
Rycina 6.4. Przykładowe typy segregacji genów w zależności od sprzężenia
a) Niezależna segregacja genów A i B znajdujących się w różnych chromosomach
142
b) geny leżące w tym samym chromosomie i całkowicie sprzężone segregują zawsze razem
c) geny leżące w tym samym chromosomie i wykazujące pewne sprzężenie nie będą segregować
losowo.
6.3. Metody obliczania sprzężeń między genami
Mapowanie genetyczne wykorzystuje zjawisko crossing over przy tworzeniu gamet przez
rodziców i jego obserwowany skutek w fenotypie (i lub genotypie) potomstwa. Częstość
zrekombinowanych układów badanych genów u potomstwa (frakcja rekombinacji) będzie wyznaczała
odległość między loci tych genów, odległość ta oznaczana jest symbolem θ (theta). Wartość
współczynnika θ=0 oznacza całkowite sprzężenie a tym samym brak rekombinacji na odcinku
chromosomu między badanymi loci. Wartość maksymalna współczynnika θ=0,5 oznacza brak
sprzężenia- nie oznacza jednak, że badane loci nie leżą na tym samym chromosomie. Mogą one
zajmować miejsce na tym samym chromosomie lecz pozostawać w dużym oddaleniu. Wtedy częstość
rekombinacji tak długiego odcinka jest tak duża, że wyklucza przenoszenie alleli tych genów zawsze w
tym samym układzie- czyli oznacza ich losową segregację do gamet.
143
6.3.1. Krzyżówka dwupunktowa
Najprostszym i jednocześnie najrzadziej stosowanym sposobem na wyznaczenie odległości
między genami jest krzyżówka dwupunktowa (dwu-cechowa), polegająca na skrzyżowaniu podwójnej
heterozygoty z podwójną homozygotą recesywną. W krzyżówce tej dobór osobników, które pozwolą
nam sprawdzić odległość między badanymi loci nie jest bez znaczenia, ponieważ sposób interpretacji
czy
mamy
do
czynienia
z
genotypem
zrekombinowanym,
czy
w
typie
rodzicielskim
(niezrekombinowanym) będzie zależał od układu alleli u osobnika heterozygotycznego (Ryc.6.5a-b].
Rycina 6.5. Wzajemne układy alleli u osobnika heterozygotycznego
A
B
a
b
a) układ wzajemnego przyciągania się (cis), na każdym chromosomie znajdują się równocenne allele
z każdego locus (dwa dominujące lub dwa recesywne)
a
B
A
b
b) układ wzajemnego odpychania się (trans), na każdym chromosomie znajdują się inne allele z
każdego locus (dominujący i recesywny)
Przykład 6.1
Rozpatrujemy sprzężenie loci odpowiedzialnych za kolor oczu i wytwarzanie skrzydeł u muszki
owocowej Drosophila melanogaster. Allel pr+- warunkuje oczy czarne (dominacja zupełna),
recesywny allel pr- oczy purpurowe; allel vg+- skrzydła normalne (dominacja zupełna), vg- skrzydła
szczątkowe. Obie cechy można łatwo zaobserwować.
Krzyżówka wstępna:
genotyp
fenotyp
P:
pr+pr+vg+vg+ x prprvgvg
oczy czarne, skrzydła normalne x oczy purpurowe, skrzydła
szczątkowe
F1:
pr+prvg+vg
oczy czarne, skrzydła normalne
Uzyskane osobniki heterozygotyczne mają testowane geny w układzie cis
144
Każde z rodziców może wytworzyć tylko jeden rodzaj gamet. Osobnik z układem homozygotycznym
dominującym wytworzy gamety pr+vg+, osobnik z układem recesywnym- prvg. Heterozygotyczne
potomstwo z tej krzyżówki na jednym chromosomie będzie miało dwa allele dominujące danego
genu a na drugim dwa recesywne- układ wzajemnego przyciągania- cis.
Krzyżówka testowa:
genotyp
P:
pr+prvg+vg x prprvgvg
fenotyp
oczy czarne, skrzydła normalne x oczy purpurowe, skrzydła
szczątkowe
genotyp
F2:
fenotyp
liczebność
pr+prvg+vg
oczy czarne, skrzydła normalne
1005
pr+prvgvg
oczy czarne, skrzydła szczątkowe
153
prprvg+vg
oczy purpurowe,
skrzydła normalne
143
prprvgvg
oczy purpurowe,
skrzydła szczątkowe
968
2269
W pokoleniu rodzicielskim osobnik homozygotyczny może wytworzyć tylko jeden rodzaj
gamet
prvg,
osobnik
heterozygotyczny
może
wytworzyć
cztery
różne
typy
gamet:
niezrekombinowane pr+vg+ i prvg oraz dwa typy gamet po rekombinacji pr+vg i prvg+. Liczba gamet
zrekombinowanych zależeć będzie od częstości wystąpienia crossing over i nigdy nie będzie większa
od liczby gamet niezrekombinowanych. Oznacza to, że po zakończeniu procesu mejozy gamet
niezrekombinowanych będzie zawsze najwięcej. Im mniejsza odległość między analizowanymi
genami, tym mniejsze prawdopodobieństwo wystąpienia crossing over i mniej wytworzonych gamet
zrekombinowanych. Badane cechy dziedziczą się z dominacją zupełną, więc fenotyp potomstwa w
pokoleniu F1 będzie warunkowany gametami osobnika heterozygotycznego. Różne proporcje
obserwowanych w pokoleniu F2 fenotypów świadczą o nielosowej segregacji badanych genów, zaś
pojawienie się czterech a nie dwóch fenotypów, dowodzi iż badane loci nie są ze sobą sprzężone
całkowicie tylko częściowo. Obliczając proporcje fenotypów zrekombinowanych do wszystkich
zaobserwowanych będzie można oszacować odległość między loci.
153 143
100% 13%
1005 153 143 968
Na odcinku chromosomu między badanymi loci zaobserwowano rekombinację u 13% osobników, tak
więc odległość między tymi genami wynosi 13cM
pr
vg
13cM
145
6.3.2. Krzyżówka trzypunktowa
Powszechnie stosowaną odmianą krzyżówki dwupunktowej jest krzyżówka trzypunktowa
(trzy/ wielo-cechowa). Taki sposób testowania sprzężeń pozwala uzyskać punkt odniesienia na mapie
genetycznej (będzie nim locus znajdujące się pośrodku badanej trójki) i w ten sposób łączyć
identyfikowane geny na danym chromosomie w spójną całość. Krzyżówka trzypunktowa różni się od
dwupunktowej przede wszystkim możliwością wystąpienia podwójnego crossing over. Podwójna
rekombinacja to wytworzenie dwóch chiazm w obrębie badanego odcinka chromosomu, czyli
podwójna wymiana fragmentów chromatyd. Charakterystyczną cechą dla gamet powstałych w
wyniku podwójnej rekombinacji jest to, że w wyniku zdublowania wymiany chromatyd na tym
samym odcinku ostatecznie położenie zmienia tylko locus środkowe (Ryc. 6.6). Zjawisko to występuje
na ogół rzadziej niż pojedyncza rekombinacja, ponieważ wystąpienie pojedynczego crossing over
naturalnie ogranicza (rzadziej stymuluje) wystąpienie kolejnego w pobliżu. Proces ten nazwany został
interferencją. Jeśli więc w pokoleniu potomnym, otrzymanym w wyniku krzyżówki testowej możemy
wyróżnić fenotypy niezrekombinowane (będzie ich najwięcej) i zrekombinowane, to wśród tych
drugich fenotypy o najmniejszej liczebności powstaną w wyniku podwójnej rekombinacji gamet.
Rycina 6.6. Podwójny crossing over
146
Przykład 6.2
Rozpatrujemy sprzężenie loci odpowiedzialnych za kolor oczu, kształt i długość skrzydeł u muszki
owocowej Drosophila melanogaster. Allel v+ - warunkuje oczy czarne (dominacja zupełna), recesywny
allel v- oczy cynobrowe; allel cv+- skrzydła proste (dominacja zupełna), cv- skrzydła skrzyżowane; ct+skrzydła długie (dominacja zupełna), ct- skrzydła krótkie. Wszystkie cechy można łatwo
zaobserwować.
Krzyżówka testowa:
genotyp
P:
v+v+cvcvctct x vvcv+cv+ct+ct+
fenotyp
oczy czarne, skrzydła skrzyżowane, krótkie x oczy cynobrowe,
skrzydła proste, długie
v+vcv+cvct+ct
F1:
v+vcv+cvct+ct x vvcvcvctct
klasa
F2:
gamety wytwarzane przez
osobnika
heterozygotycznego
oczy czarne, skrzydła proste, długie x oczy cynobrowe, skrzydła
skrzyżowane, krótkie
fenotyp
liczebność
1
v+ cv ct
oczy czarne, skrzydła
skrzyżowane, krótkie
592
2
v cv+ ct+
oczy cynobrowe, skrzydła
proste, długie
580
3
v+ cv+ ct+
oczy czarne, skrzydła proste,
długie
94
4
v cv ct
oczy cynobrowe, skrzydła
skrzyżowane, krótkie
89
5
v cv ct+
oczy cynobrowe, skrzydła
skrzyżowane, długie
45
6
v+ cv+ ct
oczy czarne, skrzydła proste,
krótkie
40
7
v+ cv ct+
oczy czarne, skrzydła
skrzyżowane, długie
5
8
v cv+ ct
oczy cynobrowe, skrzydła
proste, krótkie
3
1448
147
Określenie wzajemnego układu alleli u osobnika heterozygotycznego:
Fenotypy pokolenia F2 zostały posortowane w zależności od zaobserwowanej liczby. W ten
sposób możemy się zorientować, które osobniki powstały z gamet niezrekombinowanych (jest ich
najwięcej), a które z gamet po podwójnej rekombinacji (jest ich najmniej). Należy zauważyć, że
fenotypy zgodne rodzicielskimi (klasy 4 i 5) nie są reprezentowane najliczniej. Oznacza to, że osobnik
heterozygotyczny nie posiada wszystkich alleli w układzie cis- tylko taki wzajemny układ wszystkich
alleli gwarantowałby powtórzenie tego fenotypu u osobników niezrekombinowanych. Jeśli
przyjrzymy się zapisowi gamet niezrekombinowanych (klasy 1 i 2) możemy stwierdzić, że u osobnika
heterozygotycznego w układzie wzajemnego przyciągania (cis) znajdowały się tylko geny cv i ct,
natomiast gen v pozostawał w stosunku do obu tych genów w układzie odpychania (trans).
v+
cv
ct
v
cv+
ct+
Określenie genu środkowego:
Zgodnie z regułą podwójnego crossing over, gdzie ostatecznej wymianie podlega tylko odcinek
znajdujący się między dwiema chiazmami, należy przyrównać do siebie parami gamety
niezrekombinowane (klasa 1 i 2) i gamety po podwójnej rekombinacji (klasa 7 i 8), gen który w
gamecie po podwójnej rekombinacji nie będzie pasował do układu niezrekombinowanego uległ
wymianie i znajduje się pośrodku. W rozpatrywanym przykładzie jest to gen ct.
v+
cv
ct
Gameta niezrekombinowana
v+
cv
ct+
Gameta po podwójnej rekombinacji
v
cv+
ct+
v
cv+
ct
Gameta niezrekombinowana
Gameta po podwójnej rekombinacji
Ustalenie kolejności pozostałych loci jest niemożliwe. W tym celu należało by wykonać kolejną
krzyżówkę cztero- lub pięciopunktową zawierającą dwa już uwzględnione wcześniej loci i nowe. Na
potrzeby tego przykładu tabela z wytworzonymi przez osobnika heterozygotycznego gametami i ich
148
liczbą zostanie przepisana z zachowaniem właściwego porządku. Geny, których dokładne położenie
nie jest znane zostaną ułożone w kolejności alfabetycznej
klasa
1
2
3
4
5
6
7
8
gamety wytwarzane przez
osobnika
heterozygotycznego
+
cv ct v
+
+
cv ct v
+
+ +
cv ct v
cv ct v
+
cv ct v
+
+
cv ct v
+ +
cv ct v
+
cv ct v
liczebność
592
580
94
89
45
40
5
3
1448
Ustalanie odległości między genami:
W krzyżówce trzypunktowej odległość między genami ustala się w ten sam sposób, co w krzyżówce
dwupunktowej, tak więc należy zidentyfikować gamety powstałe po crossing over w obrębie pary
genów zewnętrznych i środkowego
Odległość między genami cv i ct:
cv
cv+
v+
ct
ct
+
ct
v+
cv
ct+
v
v
Gamety niezrekombinowane
cv+
Gamety po rekombinacji loci cv i ct (klasy 5-8)
45 40 5 3
100% 6,4%
1448
Odległość między loci cv i ct wynosi 6,4cM.
Odległość między genami ct i v:
cv
ct
v+
cv
ct+
v+
cv+
ct+
v
cv+
ct
v
Gamety niezrekombinowane
Gamety po rekombinacji loci ct i v (klasy 3,4,7,8)
149
94 89 5 3
100% 13,2%
1448
cv
ct
6,4cM
Odległość między loci cv i ct wynosi 13,2cM.
v
13,2cM
Odległość między genami cv i v:
cv
ct
v+
cv+
ct
v+
cv+
ct+
v
cv
ct+
v
Gamety niezrekombinowane
Gamety po rekombinacji loci cv i v (klasy 3-6)
94 89 45 40
100% 18,5%
1448
Jeśli zsumuje się odległość obliczoną dla pierwszych dwóch par genów i przyrówna do
odległości obliczonej dla genów skrajnych okaże się, że obie wartości różnią się od siebie. 6,4+13,2=
19,6≠18,5
Dlaczego rzeczywista odległość, obliczona na podstawie obserwowanych rekombinantów jest
mniejsza od sumy poszczególnych odległości między trzema genami? Odpowiedzialne jest za to
zjawisko interferencji.
Interferencja (I) wyrażana jest w wartościach względnych- jest to procent crossing over które nie
zostały zaobserwowane (nie zaszły). Aby poznać stopień interferencji należy obliczyć pomocniczy
współczynnik
koincydencji
(K).
Współczynnik
ten
informuje
o
proporcji
rekombinacji
zaobserwowanych (rzeczywistych) do rekombinacji, które mogły by potencjalnie zaistnieć gdyby nie
istniało zjawisko interferencji. Liczba osobników po podwójnej rekombinacji jest zawsze znana, liczbę
potencjalnych
osobników
prawdopodobieństwa
po
podwójnej
jednoczesnego
rekombinacji
wystąpienia
należy
dwóch
obliczyć
zdarzeń
według
zasady
niezależnych.
Prawdopodobieństwo jednoczesnego wystąpienia dwóch zdarzeń niezależnych jest równe iloczynowi
prawdopodobieństw wystąpienia każdego z tych zdarzeń z osobna. W przypadku krzyżówki
trzypunktowej wystąpienie pojedynczego crossing over jest zdarzeniem pojedynczym i realizowanym
z prawdopodobieństwem równym częstości zaobserwowanych rekombinantów (przedstawionych w
ułamku a nie w procentach). Tak więc wystąpienie podwójnego crossing over przy założeniu braku
interferencji będzie iloczynem częstości zaobserwowanych rekombinantów w pojedynczych crossing
150
over. Jeśli otrzymaną wartość pomnożymy przez sumę potomstwa, otrzymamy potencjalną liczbę
osobników po podwójnej rekombinacji.
K
n2 c / o
nˆ 2 c / o
n2c / o - rzeczywista liczba osobników po podwójnym crossing over
nˆ 2c / o - potencjalna (szacowana) liczba osobników po podwójnym crossing over
nˆ 2c / o = iloczyn częstości wystąpienia każdego pojedynczego crossing over (na odcinku I oraz na odcinku II) i
całkowitej liczebności potomstwa
Znając wartość współczynnika koincydencji można łatwo obliczyć stopień zaistniałej interferencji: I=
(1-K)·100%
Gdy I= 0, oznacza to, że rzeczywista liczba podwójnych rekombinantów jest równa potencjalnej, czyli
interferencja nie zaistniała, czasami wartość współczynnika I jest większa niż 100%. W takich
przypadkach można stwierdzić, że wystąpienie pojedynczego crossing over na danym odcinku
stymulowało wystąpienie kolejnych w jego pobliżu. Pozostałe wartości współczynnika pokazują
procent niezaistniałych rekombinacji.
Obliczanie współczynnika interferencji:
Wykorzystując dane z przykładu omawianego powyżej, możemy sprawdzić, jaki procent podwójnych
crossing over nie doszedł do skutku.
n2c / o 5 3 8
K
8
0,66
12,2
nˆ2c / o 0,064 0,132 1448 12,2
I 1 0,66 100% 34%
W tym przypadku 34% podwójnych rekombinacji nie doszło do skutku.
6.3.3. Określanie sprzężeń metodą statystyczną
Podczas analizy sprzężeń wielu loci jednocześnie na materiale o różnej (często niezbyt dużej)
liczebności, bardzo trudno jest wykonywać przedstawione powyżej krzyżówki i korzysta się na ogół z
informacji w postaci rodowodów. W takich przypadkach tradycyjna metoda obliczania sprzężeń musi
by zastąpiona nowoczesną metodą, w której (najczęściej przy pomocy specjalistycznych programów)
szacuje się statystyczne prawdopodobieństwo, że dwa loci oddalone są od siebie na odległość
wyrażoną w cM. Obliczenia komputerowe oparte na algorytmach optymalizacji podają wartość frakcji
rekombinacji θmax (theta max) dla badanych loci na podstawie maksymalizacji wiarygodności
151
(maximum likelihood estimates). Wartość, która zostaje obliczona w tej metodzie to „LOD score”
(logarithm of the odds), będąca logarytmem dziesiętnym z ilorazu prawdopodobieństwa wystąpienia
osobników zrekombinowanych przy założonej frakcji rekombinacji (0≤θ<0,5) i prawdopodobieństwa
wystąpienia osobników zrekombinowanych przy braku rekombinacji (θ=0,5)- loci niesprzężone.
n
N n
0,5 0,5 1
LODscore log10
0,25N
n- liczba osobników zidentyfikowanych jako rekombinanty dla danej pary loci
N- liczba wszystkich analizowanych potomków
θ- zakładana frakcja rekombinacji między badanymi loci z przedziału <0; 0,5>
Wartość 0,5 znajdująca się w liczniku to prawdopodobieństwo wytworzenia przez osobnika
rodzicielskiego niezrekombinowanej gamety (zgodnie z I Prawem Mendla). Pomnożona przez
zakładaną frakcję rekombinacji daje nam prawdopodobieństwo rekombinacji.
Wartość 0,25 to prawdopodobieństwo wytworzenia przez osobnika rodzicielskiego dowolnego z
czterech typów gamet, przy założeniu niezależnej segregacji badanych loci.
W celu potwierdzenia sprzężenia, wartość LOD score musi dla loci leżących na autosomach być
większa od 3, a dla loci z chromosomu X większa od 2. Oznacza to odpowiednio 1000- lub 100-krotnie
większą szansę wspólnej segregacji alleli, niż przypadkowe przekazanie cech ze sobą niesprzężonych.
Przykład 6.3.
Badane jest sprzężenie loci A i B leżących na chromosomach autosomalnych. Po wykonaniu krzyżówki
testowej stwierdzono wśród 43 analizowanych potomków 9 osobników zrekombinowanych,
czy na tej podstawie można stwierdzić, że odległość między badanymi loci wynosi:
9
100% 21% ?
43
czy otrzymana/zaobserwowana liczba rekombinantów nie jest dziełem przypadku w tak nielicznej,
analizowanej grupie?
Aby sprawdzić to statystycznie założyć należy kilka różnych wartości θ i dla każdej obliczyć wartość
LOD score. W tabeli poniżej zostały zaprezentowane kolejne wartości LOD dla zakładanych wartości
θ:
152
θ (theta)
0
0,1
0,2
0,3
0,4
0,5
LOD
0
2,39
3,36
2,97
1,82
0
Każda z wartości LOD obliczana była po podstawieniu odpowiednich danych do wzoru (przykład dla
θ= 0,1):
LODscore log10
0,5 0,19 0,5 1 0,1439
0,2543
2,39
Tylko jedna wartość LOD score jest większa od 3 i zarazem jest to maksymalna uzyskana wartość,
znajduje się ona przy zakładanej frakcji rekombinacji równej 0,2, czyli 20cM.W ten sposób możemy
potwierdzić sprzężenie badanych loci i ich wzajemną odległość. Zamiast tabeli, przy szacowaniu
wartości LOD score można posłużyć się wykresem;
Wykres wartości LOD w zależności od
zakładanego sprzężenia
4
LOD
3
2
1
0
0
0,1
0,2
0,3
0,4
0,5
theta
Jeśli w badanej grupie 43 osobników pojawiło by się nie 9, a 20 potencjalnie zrekombinowanych
θmax1/2 wszystkich osobników i wskazywało na brak sprzężenia), wykres
osobników (co stanowiłoby
wartości LOD score będzie położony w ujemnej części układu współrzędnych:
Wykres wartości LOD w zależności od
zakładanego sprzężenia
4
3
2
1
LOD
0
-1
-2
-3
-4
-5
-6
-7
-8
-9
0
0,1
0,2
0,3
0,4
0,5
theta
Ujemne wartości LOD score świadczą o całkowitym braku sprzężenia i niezależnej segregacji
badanych loci.
153
6.4. Tworzenie map genetycznych
Efektem końcowym w mapowaniu genetycznym jest utworzenie map sprzężeniowych dla
wszystkich chromosomów danego organizmu, na których zaznaczone będą poszczególne loci genów
lub markerów w odległości nie większej niż 5cM. Tak „wysycona” mapa genetyczna staje się w pełni
informatywną dla jej użytkownika. Należy jednak pamiętać, że mapy sprzężeniowe nigdy nie będą
odzwierciedlały rzeczywistej odległości genów w chromosomie (vide podrozdział 6.1). Stan
mapowania genetycznego człowieka i poszczególnych gatunków zwierząt zależy od przeznaczanych
na ten cel funduszy, ważności użytkowej danego gatunku, bądź profitów płynących ze znalezienia
markera ważnej cechy (Ryc. 6.7). Postęp w mapowaniu genetycznym jest bardzo szybki i liczba
zmapowanych genomów poszczególnych gatunków wciąż ulega zmianie. Do tej pory wykonano
szczegółowe mapy genetyczne prawie 5 tysięcy organizmów. Należą do nich przede wszystkim
organizmy jednokomórkowe ale również 9 gatunków ssaków (w tym bydło domowe, świnia, pies i
mysz domowa). Ponad 5,2 tysiąca markerów genetycznych przypisano do konkretnych miejsc w
chromosomach człowieka, prawie 6 tysięcy markerów genetycznych opisano na bydle domowym.
Znajomość położenia markera cechy, bądź genu za nią odpowiedzialnego pozwala na szybszą i
łatwiejszą diagnostykę oraz selekcję w przypadku zwierząt hodowlanych.
Rycina 6.7. Porównanie wysycenia mapy genetycznej chromosomu 25 bydła domowego i owcy
(www.acedb.org/Cornell/angis)
Fragment genetycznej mapy chromosomu 25 bydła domowego (lewa strona) i owcy
(prawa strona). Poszczególne markery oznaczone są symbolami literowymi i
numerycznymi
154
Literatura do rozdziału 6
1. Brown T.A, 2000, Genomy, wydanie drugie, Oxford: Wiley
2. Kim ES, Sonstegard TS, Silva MV, Gasbarre LC, Van Tassell CP.,2013, Identification of
quantitative trait loci affecting gastrointestinal parasite resistance in an experimental Angus
population, Anim Genet. 2013 Dec 5.
3. Griffiths AJF, Gelbart WM, Miller JH,1999, Modern Genetic Analysis, New York: W. H.
Freeman
4. Griffiths AJF, Miller JH, Suzuki DT,2000, An Introduction to Genetic Analysis, wydanie siódme,
New York: W. H. Freeman
5. Koonin EV, Galperin MY., 2003, Sequence - Evolution - Function: Computational Approaches
in Comparative Genomics, Boston: Kluwer Academic
Zadania do rozdziału 6
Zadanie 6.1
Po testowym skojarzeniu heterozygot (cechy uwarunkowane genami A,a i C,c) uzyskano następujące
potomstwo:
C
c
A
a
120 szt
c
c
a
108szt
a
c
c
A
a
5szt
C
c
a
a
7szt
a. Podaj fazę sprzężenia u heterozygot.
b. Jaka była względna odległość między genami?
Zadanie 6.2
U szczurów w locus B stwierdzono dwa allele: B- maść czarna, b- maść czekoladowa, a w locus S:
allele S-maść normalna i s-maść srebrzysta.
Skrzyżowano podwójna heterozygotę z podwójną homozygotą recesywną otrzymując:
osobniki czarne
5
czarno-srebrzyste
100
czekoladowe
117
czekoladowo-srebrzyste
8
Oblicz odległość pomiędzy obydwoma loci. Określ fazę przyciągania heterozygoty.
Zadanie 6.3
U drozofili cecha barwy tułowia dziedziczy się niezależnie od kształtu skrzydeł, ale sprzężona jest z
barwą oczu. Narysuj schematycznie diploidalną komórkę drozofili i umieść w niej geny wymienionych
cech, wiedząc że na 350 osobników 56 było zrekombinowanych pod względem barwy tułowia i oczu.
155
Ile fenotypów mogłoby powstać z kojarzenia dwóch dihybrydów (pod względem w/w cech) gdyby
wszystkie cechy wykazywały dziedziczenie niezależne i proste?
Zadanie 6.4
Dominujący i sprzężony z płcią gen B u Drosophila melanogaster zajmuje na mapie genetycznej locus
oddalone o 20cM od locus genu C (również dominującego). Wykonano krzyżówkę między
osobnikami: BCbc i b-cIle samic o fenotypie B.cc powinno się pojawić wśród 2000 potomstwa?
Zadanie 6.5
Korzystając z mapy chromosomów Drosophila melanogaster podaj, jakiego procentu c/o można
oczekiwać między genem cętkowanego tułowia a genami:
a) brązowych oczu
c) rozwidlonych szczecinek
Chr. II
Chr. I
b) braku skrzydeł
1,5
oczy białe
centkowany
tułów
d) białych oczu
56,7
rozwidlone
szczecinki
75,5
brak skrzydeł
104,5
oczy
brązowe
Zadanie 6.6
Wykonano krzyżówkę testową muszek owocówek (muszki skrzydlate- cecha dominująca, z
brązowymi oczami- heterozygotyczne w fazie cis x bezskrzydłe i oczy różowe- homozygoty
recesywne- przeciwieństwo oczu brązowych). Ilu muszek z bezskrzydłych z różowymi oczami, oraz
skrzydlatych z oczami różowymi mamy szansę doliczyć się wśród wylęgniętych 236.
Zadanie 6.7
Na podstawie podanych informacji
a) umieść geny w chromosomach,
b) podaj ile różnych rodzajów gamet może wytworzyć zygota w przypadku całkowitego sprzężenia?
c) ile, w przypadku sprzężenia częściowego?
I. komórka zawiera trzy pary chromosomów. Bierzemy pod uwagę 5 par genów. Pary A, a i B, b
sprzężone są w układzie cis. Pary C, c i D, d mieszczą się w innej parze chromosomów i są sprzężone w
układzie trans, para E, e dziedziczy się niezależnie od poprzednio wymienionych.
156
II. komórka zawiera cztery pary chromosomów. Bierzemy pod uwagę 6 par genów. Pary A, a i C, c
sprzężone są w układzie cis. Pary B, b i F, f w układzie trans, pozostałe dziedziczą się niezależnie od
poprzednio wymienionych.
Zadanie 6.8
U Drosophila para genów O, o warunkuje oczy o powierzchni gładkiej (gen dominujący) lub szorstkiej.
Geny F, f decydują o posiadaniu skrzydeł (gen dominujący). Homozygotyczne skrzydlate i szorstkookie
owady skojarzono z bezskrzydłymi o gładkich oczach. Z uzyskanego potomstwa wybrano samice i
skrzyżowano je z bezskrzydłymi samcami o szorstkich oczach. W wyniku kojarzenia otrzymano
potomstwo: skrzydlate, gładkookie (79 sztuk), skrzydlate szorstkookie (81 sztuk), bezskrzydłe
gładkookie (80 sztuk) i bezskrzydłe szorstkookie (76 sztuk). Czy wymienione cechy są ze sobą
sprzężone? Jaka była by odpowiedź, gdyby wśród potomstwa otrzymanego z ostatniego kojarzenia
pojawiły się tylko dwa fenotypy: skrzydlate szorstkookie i bezskrzydłe gładkookie?
Zadanie 6.9
S. szczecinki normalne, ss rozwidlone; B. oko normalnego kształtu, bb wstęgowate; N. włoski
normalne, nn skrócone. Geny tych cech zajmują loci na tym samym chromosomie u muszki drozofili.
Loci oddalone są od siebie: S-B 6cM; B-N 18cM. Stwierdzono interferencję na poziomie 26%.
Wykonano krzyżówkę testową, w której osobniki heterozygotyczne miały wszystkie geny w fazie cis.
Podaj przybliżoną liczbę muszek (na 2000 urodzonych) o następujących fenotypach:
a.
rozwidlone szczecinki, wstęgowate oko i skrócone włoski
b.
rozwidlone szczecinki, normalne oczy i normalne włoski
c.
normalne szczecinki, normalne oczy i skrócone włoski
Zadanie 6.10
Wykonano krzyżówkę testową u Drosophila melanogaser celu określenia sprzężenia między genami:
C- oczy czarne, c- oczy karminowe; F- szczecina normalna, f- szczecina postrzępiona; Y- ciało
popielate, y- ciało żółte; na podstawie otrzymanych fenotypów i ich liczebności oblicz odległość
między genami, wyznacz ich kolejność i fazę sprzężenia, podaj wartość interferencji.
oczy
czarne
karminowe
+
normalna
+
+
+
szczecina
postrzępiona
+
+
+
+
+
+
+
liczebność
żółte
+
+
+
+
+
+
+
+
ciało
popielate
+
+
+
+
+
725
719
419
383
134
109
34
32
157
Odpowiedzi do zadań
Ad1. a. cis; b. θ=5,45cM;
Ad2. a. θ=5,65cM; b. trans
Ad3. 8
Ad4. 100sztuk
Ad5. a. powyżej 50%- segregacja niezależna; b. powyżej 50%- segregacja niezależna; c. segregacja niezależnabrak sprzężenia; d. segregacja niezależna- brak sprzężenia
Ad6. a. ~84 muszki; b. ~ 34 muszki
Ad7. b. I 8; II 16; c. I 32; II 64
Ad8. a. nie; b. sprzężenie całkowite
Ad9. a. 768; b. 52; c. 172
Ad10. kolejność; F-C-Y; geny C-Y cis; geny F-C i F-Y trans; θF-C=12,1cM; θC-Y=34cM; I= 37%
158
7. Wady wrodzone
Autor: Wiesław Świderek
7.1. Podział i przyczyny wad wrodzonych
Wadami wrodzonymi nazywamy wszelkie anomalie dotyczące budowy anatomicznej i
przebiegu procesów fizjologicznych organizmu, powstałe w okresie życia płodowego.
Ze względu na nasilenie zmian zaburzających funkcjonowanie organizmu oraz stopień jego
zniekształcenia, wady wrodzone dzielimy na:
potworności (duże zmiany w wyglądzie ciała)
wady (niewielkie odstępstwa od normalnej budowy)
braki (drobne zmiany nie wpływające na życie osobnika)
Badaniem przyczyn powstawania wad wrodzonych zajmuje się teratologia. Jak wynika z
badań wiele wad wrodzonych ma bardzo złożoną etiologię, najczęściej jednak powstawaniu tych
anomalii sprzyjają dwojakiego rodzaju czynniki:
genetyczne- mutacje genów i chromosomów (strukturalne, liczbowe)
środowiskowe- warunki żywienia, utrzymania i pielęgnacji matek ciężarnych
Podatność na oddziaływanie wymienionych czynników zależy od etapu rozwoju płodu, oraz
interakcji między tymi czynnikami a genotypem. Ten sam czynnik może wywoływać różne wady w
zależności od tego, na jakie struktury komórkowe tkankowe czy narządowe bezpośrednio oddziałuje.
Z tego względu wrodzone anomalie można podzielić na strukturalne (wady rozwojowe) i
funkcjonalne (choroby metaboliczne). Niektórzy autorzy wyróżniają również wrodzone anomalie
behawioralne– zaburzenia w zachowaniu zwierząt (nadmierna agresywność, nieprawidłowe
zachowania seksualne itp.)
Jeśli różne czynniki podczas rozwoju embrionalnego i płodowego nie wywołują trwałych
zmian genetycznych a wpływają tylko na zaburzenia struktury i funkcji danego organizmu, wówczas
anomalie takie nie są dziedziczne a osobniki z takimi wadami nie stanowią zagrożenia dla populacji.
Dlatego w hodowli zwierząt o wiele więcej uwagi poświęca się dziedzicznym wadom wrodzonym,
prowadząc intensywne badania nad ustaleniem ich podłoża genetycznego. Poznanie bezpośredniej
przyczyny wady wrodzonej stwarza możliwość znacznego ograniczenia jej występowania poprzez
eliminację z rozrodu osobników dotkniętych daną wadą oraz osobników z nimi spokrewnionych.
7.2. Wady wrodzone uwarunkowane mutacjami genów
Częstą przyczyną wad wrodzonych są mutacje genów. Ich skutkiem mogą być zarówno
niewielkie zaburzenia morfologiczno-fizjologiczne jak i duże zmiany rozwojowe prowadzące do
159
znacznego upośledzenia wielu funkcji życiowych a nawet do śmierci organizmu. W zależności od tego
jak często zmutowane geny wywołują efekt śmiertelny (letalny) organizmu, podzielono je na geny:
letalne (powodują śmierć organizmu w różnych okresach jego życia),
semiletalne (ich letalne działanie uzależnione od czynników środowiskowych),
subwitalne (utrudniają normalne funkcjonowanie organizmu, rzadko powodując śmierć).
Geny letalne, semiletalne i subwitalne u ludzi i zwierząt mogą ujawnić swoje działanie tuż po
zapłodnieniu w stadium zygoty, w czasie rozwoju embrionalnego i płodowego lub dopiero po
urodzeniu się danego osobnika, w różnych okresach jego życia (noworodkowym, młodzieńczym,
dojrzałym, starczym). Ujawnienie się efektu letalnego zależy od wielu czynników między innymi od
siły oddziaływania genu. Jako przykład może posłużyć dziedziczenie umaszczenia u lisów pospolitych,
uwarunkowane jedną parą alleli (P, p). Homozygoty recesywne (pp) są srebrzyste. U heterozygot,
allel P decyduje o umaszczeniu platynowym, natomiast w układzie homozygotycznym PP prowadzi
do zamierania rozwijających się zarodków (efekt plejotropowy), co negatywnie wpływa na liczebność
rodzącego się potomstwa. Jak wynika z poniższego przykładu, kojarząc ze sobą lisy platynowe,
liczebność miotu może zmniejszyć się o 25%.
P
Pp
gamety
P
x
p
Pp
P
p
F1
PP,
25%
Pp, Pp
pp
platynowe
srebrzyste
50 %
25%
Wobec powyższego, aby uzyskiwać lisy platynowe bez strat liczebności szczeniąt w miocie (efekt
letalny PP) należy kojarzyć lisy platynowe (Pp) ze srebrzystymi (pp).
Przykłady innych wad wrodzonych występujących u zwierząt domowych przedstawiono w tabeli 7.1.
160
Tabela 7.1. Zestawienie wybranych wad wrodzonych zidentyfikowanych u zwierząt domowych
Wada wrodzona
Gatunek zwierząt
Wady uwarunkowane genem dominujący autosomalnym
Epilepsja
bydło
Niepłodność klaczy
konie
Zamknięcie przewodów nosowych
bydło
Wady uwarunkowane genem niezupełnie dominującym autosomalnym
Baraniogłowie
bydło
Letalna szarość u karakułów
owce
Wady uwarunkowane genem dominującym sprzężonym z płcią
Pasmowy brak owłosienia
bydło
Wady uwarunkowane genem recesywnym autosomalnym
Achondroplazja
bydło
Amputacja kończyn
bydło, owce, świnie, konie,
Brak odbytu
bydło, owce, świnie
Brak sierści
bydło
Brak żuchwy
bydło, owce
Niedrożność jelit
bydło, konie
Nieprawidłowy rozwój naskórka
bydło, świnie, konie
Paraliż tylnych kończyn
bydło, świnie, owce
Przykurcz mięśni
bydło, owce, kozy, świnie, konie
Rozszczep podniebienia
bydło, owce, świnie
Rybia łuska
bydło
Skrócenie kręgosłupa
bydło
Sztywność stawów
bydło, owce, świnie
Wodogłowie
bydło, świnie
Poza wadami rozwojowymi zidentyfikowano u zwierząt domowych ponad kilkadziesiąt
różnych chorób związanych z zaburzeniami procesów metabolicznych. Główną przyczyną tych chorób
są zróżnicowane defekty enzymatyczne (brak lub niedostateczna aktywność enzymów)
uwarunkowane najczęściej zmutowanymi genami recesywnymi, zlokalizowanymi w autosomach. Do
takich schorzeń zaliczamy m.in. niedokrwistość hemolityczną, nadwrażliwość na światło, niezborność
ruchową, niewydolność oddechową, zaburzenia krzepliwości krwi oraz wady wzroku i słuchu. Jedną z
ważniejszych gospodarczo chorób występujących u świń, jest hipertermia złośliwa. Pod wpływem
stresu u zwierząt pojawia się gwałtowna gorączka prowadząca do śmierci oraz niekorzystnych
pośmiertnych zmian w mięśniach, zmniejszających przydatność konsumpcyjną mięsa. Znane są
również są choroby „prionowe” prowadzące do zmian zwyrodnieniowych w mózgu. U bydła ta
161
choroba nosi nazwę BSE potocznie „choroba szalonych krów,” u owiec- scrapie. Przyczyną tych
chorób jest zmienione na skutek mutacji białko (prion), którym po spożyciu chorej tkanki, mogą
„zarazić się” zarówno zwierzęta jak i ludzie.
Innym poważnym problemem w hodowli zwierząt jest wnętrostwo. Wada ta powstaje na
skutek niezstąpienia jednego (wnęter jednostronny) lub obu jąder (wnęter obustronny) z jamy
brzusznej do worka mosznowego. Jest to wada dziedziczna uwarunkowana wieloma czynnikami z
głównym udziałem jednego lub kilku genów recesywnych. Na poniższym schemacie przedstawiono
przebieg dziedziczenia tej wady w oparciu o model monogenowy.
♂ Ww
P
gamety
W
♀ Ww
x
w
W
w
F1
Fenotyp
WW
Ww, Ww
25%
50 %
ww
25%
♂ - zdrowy, ♂ - zdrowy nosiciel, ♂ - wnęter
♀ - zdrowa, ♀ - zdrowa nosicielka, ♀ - zdrowa nosicielka
Wobec bezpłodności wnętrów obustronnych, wnętry jednostronne (płodne), przyczyniają się do
rozpowszechnienia tej anomalii w populacji. Aby temu zapobiec wskazane jest niedopuszczanie do
rozrodu wnętrów jednostronnych oraz osobników z nimi spokrewnionych jako ewentualnych nosicieli
niepożądanych genów.
7.3. Wady spowodowane mutacjami chromosomowymi
Oprócz wad uwarunkowanych mutacjami pojedynczych genów, występuje u zwierząt wiele
anomalii wynikających zarówno z nieprawidłowej liczby chromosomów, jak i ze zmian w ich
strukturze. Spośród mutacji strukturalnych opisanych w rozdziałach 1 i 2) najczęściej stwierdzano u
zwierząt domowych fuzje centryczne (translokacje robertsonowskie), powstające w wyniku
połączenia się dwóch różnych chromosomów akrocentycznych, oraz translokacje wzajemne, będące
efektem wymiany fragmentów chromosomów między chromosomami homologicznymi lub
niehomologicznymi. Jak wykazały badania przeprowadzone w Polsce (tabela 7.2.), fuzje centryczne
identyfikowano głównie u bydła ras mięsnych, natomiast translokacje wzajemne u świń. Nosiciele
tych anomalii mają zazwyczaj prawidłowy fenotyp oraz normalnie rozwinięte narządy układu
rozrodczego, natomiast wykazują obniżoną płodność. Większość dotychczas stwierdzanych
162
translokacji u zwierząt domowych dotyczyła autosomów. Translokacje typu autosom-chromosmom
płci, były notowane sporadycznie, głównie u bydła (X;18, Y;9). Poza translokacjami odnotowano, u
zwierząt gospodarskich utrzymywanych w kraju, nieliczne przypadki inwersji zarówno autosomów (1
oraz 8) u świń, jak i chromosomu X u bydła. Inne mutacje strukturalne (delecje, duplikacje) były
bardzo rzadko stwierdzane u zwierząt, natomiast znacznie częściej u ludzi. Znane są przypadki delecji
w obrębie chromosomów 9 i 15 będących przyczyną poważnych zaburzeń rozwoju psychosomatycznego u dzieci, takich jak zespół Wolfa oraz zespół Pradera-Williego.
Tabela 7.2. Mutacje chromosomowe zidentyfikowane u wybranych zwierząt domowych utrzymywanych w
Polsce (na podstawie Świtoński i wsp. 2006)
Rodzaj mutacji
bydło owce kozy świnie konie
Mutacje chromosomu
fuzja centryczna (1;29), (5;22), (13;24)*
x
fuzja centryczna (15;17)
x
translokacja wzajemna (1;5), (7;13), (8;14), (9;14),
x
inwersja chromosomów 1 i 8
x
inwersja chromosomu X
x
Mutacje genomu
monosomia chromosomu X
x
x
x
trisomia XXY
x
x
trisomia XYY
x
x
tetrasomia XXXY
x
zespół odwróconej płci XX lub XY
x
x
x
x
chimeryzm limfocytarny XX/XY
mazaicyzm XX/X, XY/XXY, XY/XYY
x
x
x
x
x
* w nawiasach podano numery chromosomów
Spośród mutacji liczbowych najczęściej notowano u zwierząt domowych trisomie (bydło,
świnie, konie) a tylko sporadycznie monosomie (świnie, konie). Anomalie te dotyczyły głównie
chromosomów płci. Podobne rodzaje mutacji oraz zaburzenia spowodowane tymi mutacjami
występują także u ludzi. Jak wynika z wieloletnich badań, trisomie XXX (supersamica) oraz XYY
(supersamiec), poza niewielkimi zmianami fenotypowymi i zaburzeniami behawioralnymi nie
163
wpływają w sposób istotny na żywotność i rozrodczość danego osobnika. Inny typ trisommi XXY
określany jako zespół Klinefeltera, prowadzi zazwyczaj do ukształtowania się cech interseksualnych,
natomiast monosomia chromosomu X (zespół Turnera) powoduje znaczne zaburzenia wzrostu i
rozwoju organizmu oraz przyczynia się do bezpłodności samic.
Bardzo rzadko u zwierząt domowych stwierdza się aberracje liczby autosomów. Znane są one
głownie u ludzi. Niektóre z tych anomalii są przyczyną dużych zmian degeneracyjnych prowadzących
do śmierci organizmu już w okresie życia płodowego (tisomia 18 – zespół Edwardsa) lub w krótkim
czasie po urodzeniu (trisomia 13 - zespół Pataua). Inne mutacje, tak jak trisomia w 21 parze
chromosomów (zespół Downa) mogą powodować niedorozwój somatyczny i upośledzenie wielu
funkcji życiowych organizmu. W zasadzie nie stwierdza się monosomii autosomów w kariotypach
żywo narodzonego potomstwa, ponieważ taka anomalia prowadzi do zamierania zarodków już we
wczesnej fazie rozwoju. Prowadzone badania wykazały, że ryzyko wystąpienia mutacji a tym samym
pojawienia się wad wrodzonych wzrasta wraz z wiekiem matki.
Inną wadą stwierdzaną głównie u koni i świń jest zespół odwróconej płci. Jest to forma
interseksualizmu, w której fenotyp osobnika (drugorzędowe i trzeciorzędowe cechy płciowe) jest
odwrotny do jego płci genetycznej (pierwszorzędowe cechy płciowe). Mechanizm powstawania tej
anomalii nie jest jeszcze dostatecznie poznany. Najczęściej obojnactwo dotyczy osobników o
zestawie chromosomów płci (XX), które mimo braku obecności w genotypie genu SRY, nabyły cech
męskich. Zdarzają się również przypadki odwrócenia płci u zwierząt z układem chromosomów XY i
stwierdzanym genem SRY.
Specyficznym rodzajem anomalii chromosomowej występującej u zwierząt domowych jest
chimeryzm komórek krwi, objawiający się występowaniem u osobników pochodzących z ciąży
mnogiej różnopłciowej, dwóch populacji komórek o kariotypie XX i XY. Do wymiany komórek między
płodami dochodzi za pośrednictwem łożyskowych naczyń tętniczo-żylnych. Negatywnym
następstwem chimeryzmu jest bezpłodność (frymartynizm) przede wszystkim samic, spowodowana
zmianami patologicznymi układu rozrodczego. Chimeryzm XX/XY może również negatywnie wpływać
na cechy rozrodcze osobników męskich.
Niekiedy somatyczne mutacje chromosomowe oraz zaburzenia podziałów mitotycznych
mogą prowadzić do powstawania, w całym organizmie lub tylko w określonych tkankach, linii
komórkowych różniących się zestawem chromosomów np. XX/X, określanym jako mozaicyzm. Ten
rodzaj anomalii odnotowywano u wielu zwierząt m.in. u koni i owiec.
7.4. Eliminacja wad wrodzonych
Wiele dotychczas poznanych wad wrodzonych warunkowanych jest monogenowo i dziedziczy
się zgodnie z prawami Mendla. Aby zapobiec rozprzestrzenianiu się tych anomalii w populacji należy
164
eliminować z rozrodu osobniki dotknięte wadą oraz unikać wykorzystywania w hodowli nosicieli
niepożądanych genów.
W przypadku chorób i wad rozwojowych, warunkowanych genami dominującymi lub z
niepełną dominacją, dana anomalia ujawnia się fenotypowo, wówczas można łatwo zapobiegać
namnażaniu się osobników obarczonych określoną wadą, poprzez ścisłą kontrolę kojarzeń. Jako
przykład może posłużyć dziedziczenie umaszczenia marmurkowatego u owczarków szkockich,
uwarunkowane jedną parą alleli (M, m). Allel m w tej rasie zmutował w kierunku allelu M - merle,
który w układzie homozygotycznym MM, blokuje procesy przemiany barwnika w organizmie,
powodując powstanie białego umaszczenia a jednocześnie w znaczny sposób przyczynia się do
upośledzenia wzroku i słuchu u tych osobników. Natomiast u zdrowych heterozygot Mm, allel M
decyduje o umaszczeniu marmurkowatym. Homozygoty mm są czarne. Aby uzyskiwać psy
marmurkowate bez ryzyka urodzenia się białego potomka z wadą, należy kojarzyć psy marmurkowe z
czarnymi.
P
Mm
gamety
F1
M
x
m
Mm, Mm
marmurkowate 50 %
mm
m
m
mm, mm
czarne 50%
Eliminowanie wad wrodzonych uwarunkowanych genami recesywnymi, jest zadaniem znacznie
trudniejszym ze względu na brak możliwości odróżnienia homozygot dominujących od heterozygot
(nosicieli niepożądanych genów). Przez wiele lat, gdy nie znane były jeszcze molekularne techniki
analizy DNA, genotyp badanego (testowanego) osobnika można było ustalić jedynie na podstawie
potomstwa pochodzącego z odpowiednio dobranych kojarzeń tego osobnika z innymi osobnikami w
populacji. Najczęściej badaniu poddawane są samce ze względu na niebezpieczeństwo (w przypadku
nosicielstwa) przekazania wielu potomkom niepożądanych genów.
7.4.1. Testowanie nosicielstwa genów recesywnych
W zależności od sposobu oddziaływania genu (letalny, semiletalny, subwitalny) genotyp
samca (reproduktora) możemy ustalić na podstawie kojarzeń z:
recesywnymi samicami,
heterozygotycznymi samicami,
własnymi córkami,
losowo wybranymi samicami.
165
Korzystając z niżej podanego wzoru możemy wyliczyć niezbędną liczbę kojarzeń pozwalającą uznać
testowanego samca za wolnego od nosicielstwa niepożądanego genu.
n
S = p - dotyczy gatunków jednopłodowych (bydło, konie, owce)
gdzie:
S=(1–0,5 q) – proporcja osobników w populacji, u których wada nie ujawni się (homozygoty
dominujące, heterozygoty),
n – minimalna liczba kojarzeń,
p – prawdopodobieństwo statystyczne ( np. 0,05 lub 0,01).
Przykład 7.1
Kojarzenie testowanego samca z recesywnymi samicami
♂
P
gamety
Aa
x
aa,
A
a
a
a
0,5
0,5
1,0
1,0
Aa
F1
♀
1:1
0,5
aa
0,5
Jak wynika z wyżej prezentowanych danych u połowy potomstwa (heterozygoty Aa) wada nie
wystąpi. Odsetek takich osobników możemy wyliczyć ze wzoru S, biorąc pod uwagę częstość
określonych alleli. U osobnika testowanego (samca) prawdopodobieństwo pojawienia się w
gametach zarówno allelu dominującego (A) jak i recesywnego (a) wynosi 50 % (0,5), natomiast u
homozygot recesywnych, ze względu na wytwarzany tylko jeden rodzaj gamet– częstość allelu a
wynosi 100 % (1,00).
Wobec powyższego: S=(1 – 0,5 q)=(1- 0,5*1)=0,5
n
Uzyskaną wartość wstawiamy do wzoru: S =p. Wiedząc, że odwrotnością potęgowania jest
logarytmowanie, możemy wyliczyć n– czyli minimalną liczbę samic, z którymi należy skojarzyć
testowanego samca aby wykluczyć nosicielstwo niepożądanego genu. Przy takiej ocenie zawsze
zakładamy ryzyko popełnienia błędu, najczęściej nie większe niż 5% (0,05) lub 1% (0,01). W związku z
tym, dla p = 0,05 uzyskamy:
166
n
(0,5) = (0,05)
n*log 0,5 = log 0,05
log 0,05
n=
- 1,301
=
=
log 0,5
dla:
4,322 ≈ 5
- 0,301
p = 0,01
- 2,000
n=
=
6,644 ≈ 7
- 0,301
Uzyskane wyniki można zinterpretować następująco. Jeśli testowanego samca skojarzymy z 5
recesywnymi samicami i wśród potomstwa nie pojawi się osobnik z wadą, to z 95 %
prawdopodobieństwem (lub 5% błędem) możemy stwierdzić, że testowany samiec nie jest
nosicielem niepożądanego genu. Aby zmniejszyć ryzyko błędu do 1%, należy testowanego samca
skojarzyć z 7 samicami.
Przykład 7.2
Kojarzenie testowanego samca z heterozygotycznymi samicami.
♂
P
gamety
Aa
♀ Aa,
x
A
a
A
a
0,5
0,5
0,5
0,5
Zgodnie z metodyką przedstawioną w pierwszym przykładzie, wyliczamy:
S = (1 – 0,5 q) = (1- 0,5*0,5) = 0,75
p = 0,05
p = 0,01
- 1,301
n=
- 2,000
n=
- 0,123
n = 10,577 ≈ 11
- 0,123
n = 16,260 ≈ 17
167
Z prezentowanych wyliczeń wynika, że aby wykluczyć nosicielstwo niepożądanego genu liczba
skutecznych kojarzeń testowanego samca z heterozygotami musi być dwukrotnie większa niż z
homozygotami recesywnymi.
Przykład 7.3
Kojarzenie testowanego samca z własnymi córkami
Jeśli założymy, że matki tych córek pochodziły z populacji, w której nie występował zmutowany gen
recesywny, to były one homozygotami dominującymi AA. W takiej sytuacji połowa córek
testowanego samca (potencjalnego nosiciela genu recesywnego) będzie posiadała genotyp AA, druga
połowa Aa. Z kolei kojarząc testowanego samca z własnymi córkami (F1) uzyskamy:
P
♂
Aa
x
F1
♂
Aa
x
gamety
♀ AA
♀ AA,
Aa
A
a
A
a
0,5
0,5
0,75
0,25
S = (1 – 0,5 q) = (1- 0,5*0,25) = 0,875
p = 0,05
p = 0,01
- 1,301
n=
- 2,000
n=
- 0,058
n = 22,431 ≈ 23
- 0,058
n = 34,482 ≈ 35
168
Przykład 7.4
Kojarzenie testowanego samca z losowo wybranymi samicami
♂
P
gamety
Aa
x
♀ AA,
Aa
A
a
A
a
0,5
0,5
0,9
0,1
Z tego względu, że dokładnie nie znamy ile z wybranych losowo matek będzie posiadało genotyp AA,
a ile genotyp Aa, niezbędna jest informacja dotycząca częstości występowania genów w populacji. Na
tej podstawie możemy obliczyć odsetek potomków zdrowych.
Załóżmy, że częstość allelu a w populacji wynosi q = 0,1. Testowany samiec jako potencjalna
heterozygota będzie wytwarzał gamety (A, a) z jednakową częstością 0,5. Korzystając z wyżej
prezentowanych wzorów wyliczamy:
S = (1 – 0,5 q) = (1- 0,5*0,1) = 0,95
Wobec powyższego:
p = 0,05
p = 0,01
n=
- 1,301
- 0,022
n = 59,136 ≈ 60
n=
- 2,000
- 0,022
n = 90,909 ≈ 91
Jak wynika z przedstawionych przykładów, im mniejsza jest frekwencja genu recesywnego w
populacji, z tym większą liczbą samic należy kojarzyć testowanego samca, aby mieć pewność, że nie
jest on nosicielem niepożądanego genu.
W przypadku gatunków wielopłodowych (świnie, drób) testowanego osobnika kojarzy się ze znacznie
mniejszą liczbą samic w porównaniu z gatunkami jednopłodowymi. Wymagana liczba takich kojarzeń
zależy od liczebności miotu.
7.4.2. Diagnostyka cytogenetyczna
Wady wrodzone spowodowane anomaliami chromosomowymi, mają różny obraz
fenotypowy. Niekiedy ujawniają się dopiero u osobników w pełni dojrzałych lub powodują niewielkie
zaburzenia funkcji życiowych organizmu, ale wpływające w sposób istotny na rozrodczość i
produkcyjność zwierząt. Anomalie te identyfikuje się klasycznymi metodami cytogenetycznymi.
169
Zaletą tych metod jest możliwość postawienia diagnozy już we wczesnym etapie życia danego
osobnika, co pozwala na pojęcie decyzji hodowlanych zapobiegających rozprzestrzenianiu się
zidentyfikowanych anomalii w populacji. O randze diagnostyki cytologicznej świadczy fakt, że
zarówno w Polsce, jak i w wielu innych krajach wprowadzono ją, jako obowiązkowe badania dla
rozpłodników (buhaje, tryki, kozły, ogiery, knury) przeznaczonych do użytkowania rozpłodowego
(inseminacji).
Metody diagnostyki cytologicznej – omówiono w rozdziale 2.
7.4.3. Diagnostyka molekularna
We współczesnej praktyce hodowlanej coraz częściej znajduje zastosowanie diagnostyka
molekularna, pozwalająca na wykrywanie mutacji genów będących przyczyną chorób u zwierząt.
Poniżej przedstawiono wybrane choroby genetyczne objęte diagnostyką molekularną:
Hipertermia złośliwa u świń (MH- malignant hyperthemia) prowadząca do nagłej śmierci na
skutek stresu. Dziedziczenie autosomalne recesywne, mutacja - substytucja C˃T w 1843
nukleotydzie genu receptora rianodyny (Ryr1), regulującego przepływ jonów wapnia w
kanale wapniowym. Odnotowano również plejotropowe oddziaływanie tego genu na
niektóre cechy użytkowe. Pozytywny wpływ na rozwój tkanki mięśniowej i mniejsze
otłuszczenie oraz negatywny na jakość konsumpcyjną i przydatność technologiczną mięsa.
Zamieranie zarodków u bydła spowodowane niedoborem syntezy monofosforanu urydyny
(DUMPS- deficency of uridine monophosphate synthase), ważnego składnika nukleotydów
pirymidynowych. Dziedziczenie autosomalne recesywne, u homozygot efekt letalny, mutacjasubstytucja C˃T w 405 kodonie genu UMPS prowadząca do przedwczesnego zakończenia
translacji.
Okresowy paraliż u koni z wiązany z nadmiarem potasu w organizmie (HYPP- hyperkalemic
periodic paralysis) występujący najczęściej pod wpływem zmiany diety lub czynnika
stresogennego. Dziedziczenie autosomalne z niepełną dominacją, mutacja- substytucja C˃G
w genie HYPP.
Zmniejszona odporność bydła spowodowana niedoborem leukocytarnych cząsteczek
adhezyjnych (BLAD- bovine leukocyte adhesion deficiency). Dziedziczenie autosomalne
recesywne, mutacja– substytucja A>G w 383 nukleotydzie genu ITGB2.
Zespół zniekształceń kręgosłupa (CVM– complex vertebral malformation), wada letalna
powodująca resorbcję zarodków lub poronienia w okresie okołoporodowym. Dziedziczenie
recesywne autosomalne, mutacja– substytucja G>T w 559 nukleotydzie genu SLC35A3.
170
Literatura do rozdziału 7
1. Case L. P., 2010: Pies zachowanie, żywienie i zdrowie. Wydawnictwo Galaktyka, Łódź.
2. Charon K., M., Świtoński, M., 2004: Genetyka zwierząt. PWN Warszawa.
3. Kosowska B., Nowicki B., 1999: Genetyka weterynaryjna. PZWL Warszawa.
4. Müller E., 2009: Testy genetyczne w weterynarii. Weterynaria w praktyce 1-2, 62-64
5. Sadakierska-Chudy A., Dąbrowska G., Goc A., 2004: Genetyka ogólna. Wydawnictwo UMK
Toruń.
6. Świtoński M., Słota E., Jaszczak K., 2006: Diagnostyka cytogenetyczna zwierząt domowych.
Wydawnictwo AR w Poznaniu.
7. Wirth-Dzięciołowska E., 1999: Poradnik hodowcy kotów. Multico Oficyna Wydawnicza.
Warszawa.
8. Zwierzchowski L. i Świtoński M., (pod redakcją), 2009: Genomika bydła i świni. Wydawnictwo
Uniwersytetu Przyrodniczego w Poznaniu.
Zadania do rozdziału 7
Zadanie 7.1
Choroba uwarunkowana jest genem dominującym. Czy możliwe jest uzyskanie zdrowego potomstwa
od chorych rodziców?
Zadanie 7.2
Choroba uwarunkowana jest genem dominującym sprzężonym z chromosomem X. Jaki stan zdrowia
odziedziczy potomstwo (córki, synowie) po rodzicach:
chory samiec x zdrowa samica
zdrowy samiec x chora samica
Zadanie 7.3
Choroba u ptaków uwarunkowana jest genem recesywnym sprzężonym z płcią. Skojarzono zdrowego
samca z chorą samicą.
jaki procent córek odziedziczy chorobę po matce?
jaki procent córek będzie nosicielkami niepożądanego genu?
Zadanie 7.4
Do lekarza weterynarii zgłosili się dwaj hodowcy psów. Jeden z nich przyniósł szczeniaka z objawami
hemofilii (cecha sprzężona z płcią, uwarunkowana genem recesywnym), drugi zaś wnętra (cecha
ograniczona płcią, uwarunkowana genem recesywnym) pochodzących po zdrowych rodzicach. Jaką
decyzję należy podjąć, co do dalszych losów szczeniąt i ich rodzeństwa oraz rodziców w pierwszym
przypadku, a jaką w drugim przypadku? Odpowiedź uzasadnij.
171
Zadanie 7.5
Jakie jest prawdopodobieństwo, że w rodzinie, w której urodził się wnęter:
jego rodzice są nosicielami genu warunkującego tę cechę?
jego matka pochodzi z rodziny wolnej od tej wady?
jego brat, jest zdrowy i nie jest nosicielem genu wnętrostwa?
jego siostry mogą mieć zdrowych synów z psem nosicielem genu wnętrostwa?
Zadanie 7.6
Pewną wadę u bydła powoduje gen recesywny autosomalny. Z iloma losowo wybranymi krowami
należałoby skojarzyć testowanego buhaja, aby mieć 99% pewność że jest on wolny od nosicielstwa
niepożądanego genu, którego częstość w populacji wynosi:
a) 0,9 b) 0,8 c) 0,75 d) 0,7 e) 0,65 f) 0,15 g) 0,05
Zadanie 7.7
Z iloma losowo wybranymi krowami należałoby skojarzyć testowanego buhaja, aby mieć 99%
pewność, że jest on wolny od nosicielstwa recesywnego genu wnętrostwa, którego częstość w
populacji wynosi 0,02.
Wyliczeń dokonaj korzystając z danych zamieszczonych w poniższej tabeli.
S lub p
0,01
0,02
0,03
0,04
0,05
0,06
0,07
0,08
0,09
log
-2,000
-1,699
-1,523
-1,398
-1,301
-1,222
-1,155
-1,097
-1,046
S lub p
0,10
0,20
0,25
0,30
0,35
0,40
0,45
0,50
0,55
log
-1,000
-0,699
-0,602
-0,523
-0,456
-0,398
-0,347
-0,301
-0,260
S lub p
0,600
0,625
0,650
0,675
0,700
0,725
0,750
0,875
0,900
log
-0,222
-0,204
-0,187
-0,171
-0,155
-0,140
-0,125
-0,058
-0,046
S lub p
0,910
0,925
0,930
0,940
0,950
0,960
0,975
0,980
0,995
log
-0,041
-0,034
-0,032
-0,027
-0,022
-0,018
-0,011
-0,009
-0,002
Odpowiedzi do zadań
Ad.1 tak, rodzice muszą być heterozygotami
Ad.2 a) chore córki, zdrowi synowie; b) matka homozygota – całe potomstwo chore; matka heterozygota –
połowa córek i synów chora, połowa córek i synów zdrowa
Ad.3 a) wszystkie córki będą zdrowe; b) płeć heterogametyczna nie może być nosicielem
H h
Ad.4 a) wykluczyć z rozrodu matkę (nosicielka) i siostry hemofilityka (podejrzenie nosicielstwa); Rodzice X X x
H
H H
H h
H
h
X Y, potomstwo: X X , X X , X Y, X Y (chory); b) wykluczyć z rozrodu całą rodzinę (podejrzenie nosicielstwa)
172
Rodzice
Córki
Wariant I ww x Ww
Wariant II Ww x Ww
Synowie
Ww, Ww
zdrowa nosicielka
Ww, Ww
zdrowy nosiciel
ww, ww
zdrowa nosicielka
ww, ww
wnęter
WW*
zdrowa
WW*
zdrowy
Ww, Ww
zdrowa nosicielka
Ww, Ww
zdrowy nosiciel
ww
zdrowa nosicielka
ww
wnęter
* brak możliwości odróżnienia homozygot od heterozygot
Ad.5 a) 100 %, b) 0 %, c) 0 % - wariant I, 25 % - wariant II, d) 50 % lub 75% - wariant I, 100 %, 75 %, 50 %
(uzasadnienie - tabela powyżej).
Ad.6 a) 8
b) 9
c) 10
d) 11
e) 12
f) 60
g) 182
Ad.7 Należałoby nasieniem buhaja skutecznie zapłodnić 1838 (2 x 919) krów. Wynika to z faktu, że wnętrostwo
dotyczy tylko osobników męskich a prawdopodobieństwo urodzenia się osobnika męskiego wynosi 50%.
173
8. Struktura genetyczna populacji
Autorka: Joanna Gruszczyńska
8.1. Frekwencja genów i genotypów
Populacja to grupa osobników należących do tego samego gatunku, zamieszkujących ten sam
obszar geograficzny w tym samym czasie, między którymi zachodzi swobodne kojarzenie. Gatunek
tworzą wszystkie jego populacje. Każda z nich ma swoją pulę genetyczną, czyli zbiór wszystkich alleli
genów, obecnych w populacji.
Matematyk brytyjski– Godfrey Hardy i fizyk niemiecki– Wilhelm Weinberg prowadząc
badania niezależnie od siebie, w 1908 roku ogłosili teorię dotyczącą rozkładu genów i genotypów w
populacji. Obecnie znamy ich teorię jako Prawo Hardy-Weinberga, które brzmi następująco: „w
bardzo dużej populacji organizmów diploidalnych, rozmnażających się płciowo, o niezachodzących na
siebie pokoleniach i pełnej losowości kojarzeń, w której frekwencja genów u obu płci jest taka sama,
frekwencja genów i genotypów nie zmienia się z pokolenia na pokolenie”. Taka populacja pozostaje
w równowadze genetycznej, jeśli nie działają na nią czynniki naruszające tę równowagę. Kojarzenie
losowe
(kojarzenie
panmiktyczne)
to
system
kojarzeń,
w
którym
istnieje
jednakowe
prawdopodobieństwo kojarzenia między wszystkimi osobnikami w populacji.
Frekwencja genów, to udział poszczególnych alleli w ogólnej puli genów w danym locus w badanej
populacji.
Frekwencja genotypów/fenotypów, jest to udział danego genotypu/fenotypu w ogólnej liczbie
osobników.
Jeśli częstość jednego z dwóch alleli w jednym locus oznaczymy jako p, a drugiego allelu jako
q, to suma częstości tych alleli będzie wynosiła: p+q=1. Jeśli w populacji zachodzi kojarzenie losowe,
to frekwencja genotypów w pokoleniu potomnym występuje w określonych proporcjach. Suma
częstości genotypów p2 + 2pq + q2 jest rozwinięciem dwumianu kwadratowego (p + q)2, którego
wartość musi wynosić 1. Zatem frekwencja poszczególnych genotypów w populacji będzie
kształtowała się następująco:
Frekwencja homozygot dominujących - p2
Frekwencja heterozygot
2pq
Frekwencja homozygot recesywnych
- q2
Jeśli mamy do czynienia z locus, w którym znajdują się tylko 2 allele, a każdy genotyp będzie
zestawem 2 alleli, to wg praw kombinatoryki korzystając z następującego wzoru
n!
n,
2(n 2)!
gdzie n to liczba rodzajów alleli w danym locus, możemy obliczyć liczbę występujących rodzajów
genotypów. W liczniku obliczamy liczbę możliwych różnych heterozygot, a w mianowniku liczbę
174
różnych homozygot. Liczba homozygot równa się liczbie alleli występujących w danym locus. Jeśli
zatem w danym locus występują tylko 2 allele, to liczba różnych genotypów wynosić będzie
2!
1 2
2
23
2(2 2)!
(2 1)
Przy rozpatrywaniu frekwencji genów i genotypów w przypadku alleli wielokrotnych sprawa
jest nieco trudniejsza, bowiem należy uwzględnić frekwencję każdego allelu; np. mamy trzy allele A,
A’ i a wtedy przypisujemy im symbole oznaczające frekwencje: p, r, q. Suma frekwencji tych alleli
zawsze musi być równa jedności, czyli (p+r+q)=1, a frekwencja ich genotypów równa się trójmianowi
kwadratowemu, czyli (p+r+q)2=1
Zatem, liczba genotypów:
3!
1 2 3
3
36
2(3 2)!
2(1!)
Lub też zastosować mniej skomplikowany wzór, gdzie n – liczba alleli:
nn 1 33 1
6
2
2
Stan równowagi genetycznej w populacji mogą zakłócić:
mutacje
dryf genetyczny
migracje osobników
selekcja
dobór (zakłócenie losowości kojarzeń)
Zmiany genetyczne wywołane w populacji przez mutacje, dryf genetyczny, migracje i selekcję
są zmianami trwałymi, gdyż dotyczą frekwencji genów, a co za tym idzie także zmiany częstości
występowania określonych genotypów. Dobór ma wpływ na częstość genotypów/ fenotypów bez
zmiany frekwencji genów. Selekcja zwierząt, czyli wybór zwierząt na rodziców następnego pokolenia,
jest najskuteczniejszym czynnikiem zmieniającym pod względem genetycznym populację w
pożądanym kierunku.
8.1. Frekwencja genów i genotypów– cechy uwarunkowane jedną parą alleli
Przykład 8.1
Umaszczenie u rasy bydła shorthorn warunkowane jest allelami: R, R’ (cecha z dominowaniem
niezupełnym). Stado składa się z 160 sztuk bydła biało umaszczonego (RR); 480 mroziatych (RR’); 360
175
czerwonych (R’R’). Obliczyć frekwencję genotypów i alleli. Sprawdzić czy populacja znajduje się w
równowadze genetycznej.
Frekwencja fenotypów w pokoleniu rodziców- P
160 : 1000 = 0,16
białych RR
480 : 1000 = 0,48
mroziatych RR’
360 : 1000 = 0,36
czerwonych R’R’
W przypadku cech z dominowaniem niezupełnym frekwencja genotypów jest równa frekwencji
fenotypów
Frekwencja genotypów w pokoleniu rodzicielskim- P
p2+2pq+q2 = 1
0,16 + 0,48 + 0,36=1
Jeśli osobników w populacji jest 1000, a każdy z nich ma 2 allele z danego locus, to pula alleli w tej
populacji wynosi 2000.
Frekwencja alleli w pokoleniu rodziców - P
p= (160 2+480)/2000 = 0,6 - frekwencja allelu (R)
q= (360 2+480)/2000 = 0,4 - frekwencja allelu (R’)
Frekwencja genotypów w pokoleniu potomnym - F1
R (p)
RR
p●p=p2
R’ (q) RR’
p●q=pq
2
p +2pq+q2=1
R (p)
R’ (q)
RR’
p●q=pq
R’R’
q●q=q2
(0,4)2+2 0,4 0,6 + (0,6)2 = 1
Frekwencja alleli w pokoleniu potomnym - F1:
Skoro p2+2pq+q2 = 1 jest rozwinięciem dwumianu kwadratowego (p+q)2 =1, więc p+q=1, zatem:
0,16+0,48+0,36 = 1 (0,4+0,6)2 =1, więc 0,4+0,6=1.
Odpowiedź:
Frekwencja alleli i genotypów nie zmienia się z pokolenia na pokolenie, zatem badana populacja
pozostaje w równowadze genetycznej.
176
Przykład 8.2
Umaszczenie u rasy Aberdeen Angus jest uwarunkowane jedną parą alleli. Czarne umaszczenie (E)
dominuje całkowicie nad czerwonym (e). Stado składa się z 840 krów czarnych E. i 160 krów
czerwonych (ee). Obliczyć frekwencję genotypów i alleli. Ile wśród krów czarnych jest homozygot, a
ile heterozygot?
W tym przykładzie nie jesteśmy w stanie odróżnić homozygot dominujących od heterozygot. Jedynie
fenotyp homozygot recesywnych w pełni odpowiada genotypowi, zatem z frekwencji tego genotypu
możemy obliczyć frekwencje allelu recesywnego.
p2+2pq+q2=1
p+q=1
Frekwencja genotypu ee
q2 = 160/1000 = 0,16
Frekwencja allelu e
q=
Frekwencja allelu E
p = 1 – q = 1 – 0,40 = 0,60
Frekwencja genotypu EE
p2 = (0,60)2 = 0,36
Frekwencja genotypu Ee
2pq = 2 0,40 0,6 = 0,48
Liczba homozygot EE
0,36 1000 sztuk = 360 sztuk
Liczba heterozygot Ee
0,48 1000 sztuk = 480 sztuk
0,16 = 0,40
Odpowiedź: Wśród 840 krów czarno umaszczonych, 360 osobników jest homozygotami a 480 to
heterozygoty.
Przykład 8.3
Sprawdźmy na modelu jednego locus, czy rzeczywiście populacja pozostaje w stanie równowagi
genetycznej, czyli frekwencja genów i genotypów nie ulega zmianie w kolejnych pokoleniach przy
zachowaniu losowości kojarzeń.
W pokoleniu rodzicielskim (P) kojarzymy osobniki homozygotyczne: AA x aa
Założenie: w pokoleniu P frekwencja allelu A (czyli p) = 0,5 i allelu a (czyli q) = 0,5
W pokoleniu F1, rozpatrując wszystkie możliwe kombinacje, otrzymamy 4 osobniki tylko o genotypie
Aa. Okazuje się, iż frekwencja alleli nie ulega zmianie, gdyż mamy w sumie 4 allele A na 8 alleli w
pokoleniu F1, czyli p=q=0,5.
177
Jeśli skojarzymy osobniki z F1 między sobą, to w pokoleniu F2 otrzymamy (u każdej płci) osobniki o
następujących genotypach: AA, Aa, Aa, aa. Częstość allelu A w populacji (8 alleli A na 16 alleli w całej
populacji) p = 0,5 i allelu a (q) także równa się 0,5.
Frekwencja genotypów u każdej płci będzie następująca:
AA= p2 = 0,25
2Aa= 2pq = 0,5
aa = q2 = 0,25
czyli zgodna jest ze stosunkiem 1:2:1.
Jak będzie wyglądała sytuacja, gdy pozwolimy losowo rozmnażać się osobnikom pokolenia F2, czyli
każdy osobnik męski o danym genotypie będzie miał szansę spotkać osobnika żeńskiego o każdym
genotypie? Założenie: z każdego kojarzenia rodzi się taka sama liczba potomstwa.
Typ kojarzenia w
pokoleniu F2
(♂ x ♀)
AA x AA
AA x Aa
AA x aa
Aa x AA
Aa x Aa
Aa x aa
aa x AA
aa x Aa
aa x aa
Liczba możliwych genotypów u
potomstwa
AA
Aa
aa
4
2
2
4
2
2
1
2
1
2
2
4
2
2
4
9 AA
18 Aa
9 aa
Frekwencja genotypów
p2
4/36
2/36
2/36
1/36
p2 = 9/36 =
0,25
2pq
2/36
4/36
2/36
2/36
2/36
4/36
2/36
pq = 18/36 =
0,5
q2
1/36
2/36
2/36
4/36
q2 = 9/36 =
0,25
Zatem w pokoleniu trzecim losowo rozmnażającej się populacji frekwencja poszczególnych
genotypów wynosi 1:2:1.
Frekwencja alleli będzie wynosiła: p =
0,25 =0,5; q=1-p=0,5
8.2. Frekwencja genów i genotypów- allele wielokrotne
O szeregu alleli wielokrotnych mówi się wtedy, gdy mamy do czynienia, z co najmniej trzema
allelami jednego genu. Allele te mogą wykazywać w stosunku do siebie różny stopień dominacji, m.in.
Kodominacja kodominacją, którą określamy równorzędność (brak dominacji pomiędzy dwoma
allelami) przy jednocześnie pełnej dominacji nad trzecim allelem z szeregu alleli wielokrotnych.
Przykładem może być dziedziczenie grup krwi u ludzi. Założenie- populacja jest w równowadze
genetycznej.
178
Przykład 8.4
W grupie ludzi złożonej z 400 osobników stwierdzono, że 100 osób ma grupę krwi „0”, 50 grupę krwi
„AB”, 140 grupę krwi „B”, 110 osób grupę „A”. Oszacować frekwencję genów w tej populacji.
Mamy do czynienia z przykładem 3 alleli w serii alleli wielokrotnych. Wiemy, iż suma frekwencji
wszystkich alleli w danym locus równa się jeden.
Frekwencja alleli:
p + q + v= 1
Zatem frekwencja genotypów będzie rozwinięciem trójmianu (p + q + v)2.
Frekwencja genotypów:
(p + q + v)2= p2 + 2pq + q2 + 2qv + 2pv + v2= 1
Fenotyp
Genotyp
IAIA, IAi
Oczekiwana
frekwencja fenotypu
p2+2pv
Obserwowana
frekwencja fenotypu
0,275
A
B
IBIB, IBi
q2+ 2qv
0,350
AB
IAIB
2pq
0,125
0
ii
v2
0,250
Frekwencja genotypu (ii) v2=0,250, to frekwencja allelu (i) v = 0,5.
Znając frekwencję allelu (i), możemy przystąpić do obliczenia frekwencji allelu (IA). W tym celu
musimy wykorzystać informację o obserwowanej frekwencji osobników mających grupę krwi „A” i
grupę „0”.
p2+2pv+v2=A+0
p+v=
(p+v)2 = A+0
A 0 , więc z przekształcenia powyższego wzoru, będziemy mogli obliczyć frekwencję allelu
(IA) jako: p= A 0 – v
Zatem frekwencja allelu (IA) jest następująca: p=
0,275 0,25 – 0,5=0,225
Wiedząc, że suma frekwencji alleli w danym locus: p + q + v= 1 oraz znając frekwencję alleli (i) i (IA)
jesteśmy w stanie obliczyć frekwencję allelu (IB), która wynosi: q=1 - (p+v)
q=1 - (0,225+0,5)=0,275
179
Odpowiedź: Frekwencja alleli w badanej populacji ludzkiej, liczącej 400 osobników wynosi:
Allel
Symbol allelu
Frekwencja allelu
IA
p
0,225
B
I
q
0,275
i
v
0,5
W poniższym przykładzie zaprezentowano szereg alleli wielokrotnych, w którym jeden z alleli
dominuje nad dwoma pozostałymi, drugi z kolei jest recesywny w stosunku do pierwszego i
dominujący w stosunku do trzeciego, natomiast trzeci z alleli jest recesywny w stosunku do dwóch
wspomnianych wcześniej.
Przykład 8.5
U królików gen umaszczenia warunkującego pełen kolor (C) dominuje nad allelem warunkującym
umaszczenie himalajskie (ch), który z kolei dominuje nad allelem warunkującym albinizm (c). W
populacji 1000 królików odnotowano 510 sztuk ciemno umaszczonych, 450 himalajskich i 40 sztuk
albinotycznych. Oszacuj, jaka jest frekwencja alleli w tej populacji, ustal, jaka jest frekwencja
poszczególnych genotypów. Sprawdź, czy populacja ta znajduje się w stanie równowagi genetycznej.
Oznaczenie frekwencji poszczególnych alleli: C = p, ch = q, c= v
Fenotyp
Genotyp
Oczekiwana
frekwencja fenotypu
Obserwowana
frekwencja fenotypów
pełna barwa
CC; Cch; Cc
p2+2pq+2pv
510/1000 = 0,51
himalajski
chch; chc
q2+ 2qv
450/1000 = 0,45
albinos
cc
v2
40/1000 = 0,04
Skoro frekwencja genotypu i fenotypu osobników albinotycznych jest równa v2= 0,04, to frekwencja
allelu c wynosi v= 0,2.
W dalszym etapie wyliczymy frekwencję allelu ch:
(q2 + 2qv) + v2=0,45 + 0,04= 0,49
(q+v)2=0,49
q+v=
q=
0,49
0,49 - v
q=0,7- 0,2
frekwencja allelu ch wynosi q = 0,5
Wiedząc, iż p+q+v=1
To frekwencja allelu C będzie wynosiła: p= 1 - (0,5 + 0,2) = 0,3
180
Odpowiedź: Frekwencja alleli w badanej populacji królików, liczącej 1000 osobników wynosi:
Allel
Symbol allelu
Frekwencja allelu
C
p
0,3
Ch
q
0,5
c
v
0,2
Sprawdźmy zatem, jaka będzie frekwencja poszczególnych fenotypów w pokoleniu potomnym przy
zachowaniu losowości kojarzeń.
Prawdopodobieństwo spotkania się gamet przenoszących poszczególne allele będzie :
Allele w gametach
żeńskich
Allele w
gametach
męskich
C
ch
c
(p)
(q)
(v)
C (p)
CC (p2)
Cch (pq)
Cc (pv)
ch (q)
C ch (pq)
chch (q2)
chc (qv)
c (v)
Cc (pv)
chc (qv)
Cc
(v2)
Zatem, prawdopodobieństwo wystąpienia poszczególnych fenotypów w pokoleniu potomnym będzie
wynosiło:
Osobniki o pełnej barwie C. = p2 + 2pq +2pv = 0,09 +0,30+ 0,12 = 0,51
Osobniki o umaszczeniu himalajskim ch. = q2 +2qv =0,25 +0,20 = 0,45
Osobniki albinotyczne cc = v2 =0,04
Frekwencja poszczególnych fenotypów nie różni się w obu pokoleniach, zatem populacja znajduje się
w równowadze genetycznej.
8.3. Frekwencja genów i genotypów- dwie lub więcej cech jednocześnie
Przykład 8.6
W populacji liczącej 1000 sztuk kur andaluzyjskich stwierdzono 360szt. czarnych szurpatych (Bl’Bl’FF),
60szt. niebieskich szurpatych (BlBl’FF), 20 szt. białych szurpatych (BlBlFF), 160 szt. czarnych słaboszurpatych (Bl’Bl’FF’), 120 niebieskich słabo-szurpatych (BlBl’FF’), 40 białych słabo-szurpatych
(BlBlFF’), 20 szt. czarnych normalnie opierzonych (Bl’Bl’F’F’), 140 szt. niebieskich normalnie
opierzonych (BlBl’F’F’) i 80 szt. białych normalnie opierzonych (BlBlF’F’). Obliczyć frekwencję genów i
frekwencję genotypów (rzeczywistą i oczekiwaną). Obliczyć frekwencję genotypów w pokoleniu F1 i
181
sprawdzić, czy jest zgodna z frekwencją oczekiwaną, przy założeniu, że populacja ta rozmnaża się
losowo.
Oznaczenia genów: pióra białe (splash) (Bl)– p; pióra czarne (Bl’)- q; szurpatość (F)– r; prawidłowa
budowa piór (F’)- z
Obie cechy dziedziczone są z dominowaniem niezupełnym, zatem liczba klas fenotypowych 3x3=9, a
także, gdy będziemy rozpatrywać każde locus oddzielnie frekwencja fenotypów = frekwencji
genotypów.
Najpierw należy wyliczyć frekwencję genów w pokoleniu rodzicielskim. W tym celu musimy każdą z
cech traktować osobno:
Ptaki o czarnych piórach: 360+160+20=540 sztuk; frekwencja fenotypu Q=0,54
Ptaki o piórach niebieskich: 60+120+140=320; frekwencja fenotypu H=0,32
Ptaki o piórach białych: 20+40+80=140; frekwencja fenotypu P=0,14
Frekwencja alleli:
p= P + ½ H
q= Q + ½ H
p= 0,14 + 1/2 0,32= 0,3
q= 0,54 + 1/2 0,32= 0,7
Frekwencja genotypów:
p2=0,09
2pq=0,42
q2=0,49
Ptaki szurpate: 360+60+20=440; frekwencja fenotypu R=0,44
Ptaki słabo-szurpate: 160+120+40=320; frekwencja fenotypu V=0,32
Ptaki normalnie opierzone: 20+140+80=240; frekwencja fenotypu Z=0,24
Frekwencja alleli:
r=0,44+1/2 0,32=0,6
z=0,24+1/2 0,32=0,4
Frekwencja genotypów:
r2=0,36
2rz=0,48
z2=0,16
182
Obliczenie frekwencji rzeczywistej i oczekiwanej
Fenotyp
Genotyp
Frekwencja
obserwowana
fenotypu=
frekwencji
genotypu
0,36
0,06
0,02
0,16
Frekwencja
oczekiwana
genotypu
Frekwencja
oczekiwana
genotypu
Bl’Bl’FF
BlBl’FF
BlBlFF
Bl’Bl’FF’
Frekwencja
obserwowana
fenotypu=
frekwencji
genotypu
360/1000
60/1000
20/1000
160/1000
czarne szurpate
niebieskie szurpate
białe szurpate
czarne
słabo-szurpate
niebieskie
słabo-szurpate
białe
słabo-szurpate
czarne normalnie
opierzone
niebieskie normalnie
opierzone
białe normalnie
opierzone
q2●r2
2pq●r2
p2●r2
q2●2rz
0,1764
0,1512
0,0324
0,2352
BlBl’FF’
120/1000
0,12
2pq●2rz
0,2016
BlBlFF’
40/1000
0,04
p2●2rz
0,0432
Bl’Bl’F’F’
20/1000
0,02
q2●z2
0,0784
BlBl’F’F’
140/1000
0,14
2pq●z2
0,0672
BlBlF’F’
80/1000
0,08
p2●z2
0,0144
Frekwencja rzeczywista genotypów nie jest zgodna z frekwencją oczekiwaną. Populacja rodzicielska
nie jest w równowadze genetycznej.
Sprawdźmy testem Chi2, zgodność rozkładu rzeczywistej frekwencji poszczególnych klas
fenotypowych z teoretyczną aby zobaczyć, czy różnice są istotne statystycznie?
Klasa- Fenotypowa (k)
Genotyp
Frekwencja
oczekiwana
genotypu (pi)
Oczekiwana liczba
osobników (pi ●N)
Bl’Bl’FF
BlBl’FF
BlBlFF
Bl’Bl’FF’
obserwowana
liczba osobników
w klasach
fenotypowych (ni)
360
60
20
160
czarne szurpate
niebieskie szurpate
białe szurpate
czarne
słabo-szurpate
niebieskie
słabo-szurpate
białe
słabo-szurpate
czarne
normalnie
opierzone
niebieskie
normalnie
opierzone
białe normalnie opierzone
SUMY
0,1764
0,1512
0,0324
0,2352
176,4
151,2
32,4
235,2
BlBl’FF’
120
0,2016
201,6
BlBlFF’
40
0,0432
43,2
Bl’Bl’F’F’
20
0,0784
78,4
BlBl’F’F’
140
0,0672
67,2
BlBlF’F’
80
1000
0,0144
1
14,4
1000
183
Ho: Rzeczywisty rozkład frekwencji poszczególnych klas fenotypowych JEST zgodny z teoretycznym
H1: Rzeczywisty rozkład frekwencji poszczególnych klas fenotypowych NIE jest zgodny z teoretycznym
k
ni pi N 2
i 1
pi N
2
emp
Gdzie:
ni – liczebność obserwowana w poszczególnych klasach fenotypowych
pi – prawdopodobieństwo wystąpienia danego fenotypu obliczone wg wzorów skróconego mnożenia
(p + q + r + z)2=1
pi ●N- oszacowana liczebność w poszczególnych klasach fenotypowych
N- całkowita liczebność badanych zwierząt
(360 176,4) 2 (60 151,2) 2 (20 32,4) 2 (160 235,2) 2 (120 201,6) 2 (40 43,2) 2 (20 78,4) 2 (140 67,2) 2 (80 14,4) 2
176,4
151,2
32,4
235,2
201,6
43,2
78,4
67,2
14,4
191,1 55,0 4,7 24,0 33,0 0,2 43,5 78,9 298,8 729,4
2
Chi emp.
Chi2 tab α=0,05; v=9-1= 15,50731
Chi2 tab α=0,01; v=9-1= 20,09016
Liczba stopni swobody: v= k-1= 9-1=8
k- liczba klas fenotypowych
Chi2 emp> Chi2 tab
Odpowiedź: Różnice w rozkładzie frekwencji oczekiwanej i obserwowanej są statystycznie wysoko
istotne.
Obliczenie frekwencji rzeczywistej gamet (założenie- brak crossing-over)
Fenotyp
Genotyp
Frekwencja
rzeczywista
genotypów
Frekwencja rzeczywista gamet
czarnych szurpatych
niebieskich szurpatych
białych szurpatych
czarnych
słaboszurpatych
niebieskich
słaboszurpatych
białych
słaboszurpatych
czarnych
normalnie
opierzonych
niebieskich normalnie
opierzonych
białych
normalnie
opierzonych
SUMY
1
Bl’Bl’FF
BlBl’FF
BlBlFF
Bl’Bl’FF’
0,36
0,06
0,02
0,16
BlF
0,03
0,02
-
BlF’
-
Bl’F
0,36
0,03
0,08
Bl’F’
0,08
BlBl’FF’
0,12
0,03
0,03
0,03
0,03
BlBlFF’
0,04
0,02
0,02
-
-
Bl’Bl’F’F’
0,02
-
-
-
0,02
BlBl’F’F’
0,14
-
0,07
-
0,07
BlBlF’F’
0,08
-
0,08
-
-
0,1
0,2
0,5
0,2
184
Frekwencja genotypów w pokoleniu F1:
Gamety
samice
samce
BlF
0,1
BlF’
0,2
Bl’F
0,5
Bl’F’
0,2
BlF
0,1
BlF’
0,2
Bl’F
0,5
Bl’F’
0,2
BlBlFF
0,01
BlBlFF’
0,02
BlBl’FF
0,05
BlBl’FF’
0,02
BlBlFF’
0,02
BlBlF’F’
0,04
BlBl’FF’
0,1
BlBl’F’F’
0,04
BlBl’FF
0,05
BlBl’FF’
0,1
Bl’Bl’FF
0,25
BlBl’FF’
0,1
BlBl’FF’
0,02
BlBl’F’F’
0,04
BlBl’FF’
0,1
BlBl’F’F’
0,04
Porównanie frekwencji w pokoleniu F1 i pokoleniu rodzicielskim P
Genotyp
Bl’Bl’FF
BlBl’FF
BlBlFF
Bl’Bl’FF’
BlBl’FF’
BlBlFF’
Bl’Bl’F’F’
BlBl’F’F’
BlBlF’F’
Frekwencja genotypów
w pokoleniu F1
0,25
0,10
0,01
0,20
0,24
0,04
0,04
0,08
0,04
Frekwencja genotypów
w pokoleniu rodzicielskim P
0,36
0,06
0,02
0,16
0,12
0,04
0,02
0,14
0,08
Odpowiedź:
Rozpatrywana populacja ze względu na dwie cechy równocześnie nie osiągnęła stanu równowagi
genetycznej w pokoleniu potomnym.
8.4. Frekwencja genów i genotypów- cechy sprzężone z płcią
W przypadku cech sprzężonych z płcią u osobników homogametycznych frekwencja
poszczególnych genotypów będzie miała rozkład dwumianowy p2+2pq+q2=1.
Natomiast w przypadku płci heterogametycznej osobniki są nosicielami tylko jednego z alleli. Dlatego
frekwencja genotypów u płci heterogametycznej nie będzie wykazywała rozkładu dwumianowego i
będzie równa frekwencji genów: p+q=1
Przykład 8.7
W pewnej grupie 1000 osób frekwencja genu hemofilii h (q)=0,08. Oblicz, jaka będzie frekwencja
genotypów u mężczyzn i kobiet. Ile osobników męskich będzie chorych na hemofilię?
185
Frekwencja genu h (q)=0,08
Frekwencja genu H (p) p= 1-0,08=0,92
Frekwencja genotypów u mężczyzn:
H= p= 0,92
h= q = 0,08
Frekwencja genotypów u kobiet:
HH= p2 = (0,92)2 = 0,8464
Hh= 2pq = 2 ● 0,92 ● 0,08=0,1472
hh= q2 = (0,082)2 = 0,0064
Rozkład liczebności genotypów:
Płeć (heterogametyczna) męska 0,5(p+q)
0,5 (0,92●1000+0,08●1000)
460 mężczyzn zdrowych o genotypie H40 mężczyzn chorych o genotypie hPłeć (homogametyczna) żeńska 0,5 (p2+2pq+q2)
0,5 (0,8464●1000+0,1472●1000+0,0064●1000)
423 kobiet zdrowych o genotypie HH
74 kobiet nosicielek o genotypie Hh
3 kobiety chore na hemofilię o genotypie hh
Literatura do rozdziału 8
1. Hardy G. (1908) Mendelian proportions in a mixed population Science, 28:49-50
2. Weinberg W. (1908) On the demonstration of heredity in man. Naturkunde in Wurttemberg,
Stuttgart, 64:368-382
3. Gillespie J.H. Population Genetics 1998 A Concise Guide, Second Edition, The Johns Hopkins
University Press Baltimore and London
4. Halliburton R. (2004) Introduction to Population Genetics, Pearson Prentice Hall Pearson
Education International
5. Krzanowska H., Łomnicki A., Rafiński J. Wprowadzenie do genetyki populacji. 1982 PWN,
Warszawa
6. Falconer D.S. Dziedziczenie cech ilościowych. 1974 PWN, Warszawa
186
Zadania do rozdziału 8
Zadanie 8.1
Umaszczenie u rasy Shorthorn warunkowane jest allelami: R, R’. Stado składa się z 250 krów białych
(RR); 500 mroziatych (RR’); 250 czerwonych (R’R’). Obliczyć frekwencję genotypów i alleli. Sprawdzić
czy populacja znajduje się w równowadze genetycznej.
Zadanie 8.2
Kolor upierzenia u drobiu andaluzyjskiego warunkowane jest allelami: Bl i Bl’. Stado składa się z 640
ptaków czarnych (Bl’Bl’); 320 niebieskich (BlBl’); 40 białych (BlBl). Obliczyć frekwencję genotypów i
alleli. Sprawdzić czy populacja znajduje się w równowadze genetycznej.
Zadanie 8.3
Umaszczenie u rasy Aberdeen Angus jest uwarunkowane jedną parą genów. Czarne umaszczenie (N)
dominuje nad czerwonym (n). Stado składa się z 810 krów czarnych i 190 krów czerwonych. Obliczyć
frekwencję genotypów i alleli.
Zadanie 8.4
Frekwencja genu daltonizmu (d) w populacji wynosi q=0,04. Oblicz frekwencję alleli (D, d) i
frekwencję genotypów u mężczyzn i u kobiet.
Zadanie 8.5
W pewnej populacji stwierdzono, że frekwencje genotypów wynoszą odpowiednio AA (0,2), Aa (0,7),
aa (0,1). Proszę obliczyć frekwencję genów A i a.
Zadanie 8.6
W populacji ludzkiej złożonej z 1849 osobników stwierdzono, że 808 osób ma grupę krwi „0”, 83
grupę krwi „AB”, 699 grupę krwi „A”, a 259 grupę krwi „B”. Oszacować frekwencję genów w tej
populacji
Zadanie 8.7
U kur występuje dziedziczna anomalia polegająca na skróceniu dzioba, warunkowana jedną parą
alleli. W pewnej rasie kur na 1000 szt. rodzi się 1 ze skróconym dziobem. Obliczyć częstość
występowania osobników heterozygotycznych.
Zadanie 8.8
U ludzi gen hemofilii (h) znajduje się w chromosomie X i występuje z częstotliwością 0,03. Jeśli w
jednym z miast mieszka 2 000 000 ludzi, to ile kobiet i ilu mężczyzn będzie prawdopodobnie
chorować na hemofilię (zakładając stosunek płci 1:1)?
Zadanie 8.9
187
W populacji ludzi złożonej z 4000 osobników odnotowano, iż 1000 osób ma grupę krwi „0”, 500
grupę krwi „AB”, 1400 grupę krwi „A” i 1100 grupę krwi „B”. Założenie: populacja znajduje się w
stanie równowagi genetycznej. Oszacować frekwencję genów w tej populacji.
Zadanie 8.10
Umaszczenie u szynszyli jest warunkowane m.in. w locus A (alele: a-nie agouti (równomierne
rozłożenie pigmentu na całej długości włosa); A- agouti); w locus C (Cn- kolorowy; c- albinotyczny).
Znane są 3 fenotypy:
Agouti barwny A_Cn_
A_cc
Nie agouti barwny aaCn_
aacc
albinos
W pewnej populacji odnotowano 40% zwierząt albinotycznych, 25% nie agouti barwnych i 35% agouti
barwnych. Oblicz frekwencję poszczególnych genotypów i alleli.
Odpowiedzi do zadań
Ad.1.
Frekwencja alleli: p (R) = 0,5, q (R’) = 0,5
2
2
Frekwencja genotypów: p (RR) = 0,25; 2pq (RR’) = 0,5; q (R’R’) = 0,25
Ad.2.
Frekwencja alleli: p (bl) = 0,8, q (Bl) =0,2.
2
2
Frekwencja genotypów: p (blbl) = 0,64; 2pq (Blbl) =0,32; q (BlBl); = 0,04
Ad.3.
Frekwencja alleli: p (N) = 0,1, q (n) =0,9.
2
2
Frekwencja genotypów: p (NN); = 0,81; 2pq (Nn) =0,18; q (nn) = 0,01
Ad.4.
Frekwencja alleli: p (D) = 0,1, q (d) =0,9.
2
2
Frekwencja genotypów u kobiet: p (DD); = 0,81; 2pq (Dd) =0,18; q (dd) = 0,01
Frekwencja genotypów u mężczyzn: p (D-); = 0,92; q (d-) = 0,08
Ad.5.
Frekwencja alleli: p (A) = 0,55, q (a) =0,45.
Ad.6.
Frekwencja alleli: p (LA) = 0,24; q (LB) =0,1; r(l) = 0,66.
Ad.7.
Frekwencja alleli: p (R) = 0,968; q (r) =0,032.
2
2
Frekwencja genotypów: p (RR); = 0,937; 2pq (Rr) =0,062; q (rr) = 0,001
Ad.8.
Frekwencja alleli: p (H) = 0,97, q (h) =0,03.
2
2
Frekwencja genotypów u kobiet: p (HH); = 0,9409; 2pq (Hh) =0,0582; q (hh) = 0,0009
Frekwencja genotypów u mężczyzn: p (H-); = 0,97; q (h-) = 0,03
Liczba osób chorych na hemofilię: 58 kobiet i 30 mężczyzn.
Ad.9.
Frekwencja alleli: p (LA) = 0,275; q (LB) =0,225; r(l) = 0,5.
Ad.10.
Frekwencja alleli : p(C)= 0,398; q ( c) =0, 632; r (A) = 0,5; s ( a)= 0,5
188
9. Spokrewnienie i inbred
Autorka: Joanna Gruszczyńska
9.1. Rodowód
Rodowód, to usystematyzowany spis przodków danego osobnika. Probant, to osobnik, dla którego
tworzony jest rodowód, a kolejne pokolenia, to pokolenia rodziców, dziadków i dalszych przodków.
Informacje zawarte w rodowodzie probanta są różne w zależności od gatunku zwierzęcia. W
rodowodzie psa można odnaleźć następujące informacje: jego imię, przydomek, rasa, data urodzenia,
płeć, maść, numer tatuażu oraz numer rodowodu i rejestracji w oddziale, jak również adres
właściciela i hodowcy oraz dane o przodkach: imię, przydomek, numer rodowodu, rasa, maść.
Czasami w rodowodach, zwłaszcza w rodowodach psów i kotów, pojawiają się dodatkowe informacje
o uzyskanych tytułach wystawowych np. CH (Champion) lub INT CH (Inter Champion). W
amerykańskich rodowodach psów w rubrykach dotyczących rodziców probanata możemy znaleźć
ponadto: numer OFA, co oznacza, że pies/suka zbadane zostały w kierunku dysplazji; adnotację „DNA
profile” która informuje, że właściciel psa dysponuje wynikami badań genetycznych, które może
okazać zainteresowanym; datę pierwszego krycia lub miotu, a także stopnie wyszkolenia i osiągnięcia
hodowlane.
U zwierząt gospodarskich wg informacji zawartej w „Obwieszczeniu Ministra Rolnictwa i Rozwoju Wsi
z dnia 11 lipca 2008r w sprawie wykazu przepisów Unii Europejskiej dotyczących hodowli zwierząt i
rozrodu” przeczytać możemy, iż Decyzje Komisji Wspólnoty Europejskiej ustanawiają, jakie dane
muszą być zawarte w świadectwach rodowodowych i innych danych szczegółowych dotyczących
zwierząt hodowlanych czystorasowych z gatunku bydła, owiec i kóz, świń i koniowatych.
W Dzienniku Urzędowym Unii Europejskiej L 125/16 z dnia 17 maja 2005r. art.2. czytamy, iż u bydła
świadectwa rodowodowe zawierają następujące dane szczegółowe:
-
tytuł: „Świadectwo rodowodowe wystawione zgodnie z decyzją Komisji 2005/379/WE do
celów handlu wewnątrzwspólnotowego”;
-
nazwa wystawcy– organizacji hodowców uznanej urzędowo zgodnie z decyzją 84/247/EWG;
-
tytuł księgi hodowlanej;
-
rasa;
-
płeć;
-
numer wpisu w księdze hodowlanej;
-
data wydania świadectwa;
-
system identyfikacji;
-
numer identyfikacyjny zgodnie z rozporządzeniem (WE) nr1760/2000;
189
-
data urodzenia;
-
nazwisko (nazwa) i adres hodowcy;
-
nazwisko (nazwa) i adres właściciela;
-
imiona: matki, ojca, dziadka i babki z obu stron rodziców wraz z ich numerami księgi
hodowlanej;
-
wszystkie dostępne wyniki badań sprawności oraz aktualne wyniki oceny genetycznej,
uwzględniające także szczególne cechy genetyczne oraz wady genetyczne, dotyczące
zwierzęcia oraz jego rodziców i dziadków, zgodnie z wymaganiami programu hodowli dla
danej kategorii i danego zwierzęcia. Jeśli wyniki oceny genetycznej są dostępne publicznie w
Internecie, wystarczy podać odniesienie o strony internetowej, na której można znaleźć te
wyniki;
-
w przypadku ciężarnych samic w rodowodzie powinna być zamieszczona data inseminacji lub
krycia oraz identyfikacja buhaja rozpłodnika;
-
nazwisko i stanowisko osoby podpisującej;
-
data i miejsce wydania świadectwa oraz podpis osoby upoważnionej przez organizację
hodowców wydającą świadectwo.
Świadectwa rodowodowe sporządzane na mocy niniejszej decyzji są wystawiane przez zatwierdzone
organizacje lub stowarzyszenia hodowców (lub „organizacje hodowców”) uznane urzędowo zgodnie z
decyzją 84/247/EWG. Świadectwa rodowodowe nasienia mogą być również wystawiane przez centra
pozyskiwania lub przechowywania nasienia zatwierdzone zgodnie z dyrektywą 88/407/EWG, a
świadectwa rodowodowe zarodków przez zespoły pobierania zarodków zatwierdzone zgodnie z
dyrektywą 89/556/EWG, na podstawie danych szczegółowych dostarczanych przez organizację
hodowców zgodnie z art. 3 ust. 2 i 5 ust. 2 niniejszej decyzji.
W Dzienniku Urzędowym L 247, 23/08/1989 P. 0022- 0030 przedstawiono Decyzję Komisji z dnia 18
lipca 1989 r. ustanawiająca świadectwo dla świń hodowlanych czystorasowych, ich nasienia, komórek
jajowych i zarodków (89/503/EWG) w Artykule 1. W świadectwie dotyczącym świń hodowlanych
czystorasowych muszą zostać wymienione poniższe dane szczegółowe:
-
organ wydający świadectwo;
-
nazwa księgi hodowlanej;
-
numer wpisu w księdze hodowlanej;
-
data wydania;
-
system identyfikacji;
-
identyfikacja;
-
data urodzenia;
190
-
rasa;
-
płeć;
-
nazwisko i adres hodowcy;
-
nazwisko i adres właściciela;
-
imiona: matki, ojca, dziadka i babki z obu stron rodziców wraz z ich numerami księgi
hodowlanej;
-
wyniki kontroli wydajności i uaktualnione wyniki, ze wskazaniem pochodzenia, oceny
wartości genetycznej samego zwierzęcia oraz jego rodziców i dziadków.
W Dzienniku Urzędowym L 145, 08/06/1990 P. 0039- 0047 przedstawiono Decyzję Komisji z dnia 10
maja 1990 r. ustanawiającą świadectwa zootechniczne dla owiec i kóz hodowlanych czystorasowych,
ich nasienia, komórek jajowych i zarodków (90/258/EWG). W art. 1 przedstawiono identyczne
wymagania co do danych szczegółowych w rodowodach świń. W świadectwie, przygotowanym
zgodnie z decyzją Komisji 90/256/EWG [2], należy zamieścić wyniki badań wydajności oraz
uaktualnione wyniki, wraz ze źródłem, ocenę wartości genetycznej samego zwierzęcia, jego rodziców
i dziadków.
W rodowodzie koni zawarte są następujące informacje:
-
numer wpisu i symbol rejestru;
-
numer identyfikacyjny;
-
płeć;
-
nazwa;
-
data urodzenia;
-
maść i odmiany oraz inne znaki identyfikacyjne;
-
wymiary;
-
dane przodków- minimum 3 pokolenia (płeć, nazwa, numer identyfikacyjny, maść, rok
wpisu do księgi stadnej)
-
dane dotyczące hodowcy i właściciela;
-
wynik oceny wartości użytkowej i hodowlanej
Umiejętność tworzenia rodowodów, znajomość ich konstrukcji, a także umiejętność korzystania z
zawartych w nich informacji może hodowcom pomóc w prawidłowym prowadzeniu pracy
hodowlanej w swoich stadach/hodowlach.
Rodowody klasyczne zawierają informacje obejmujące dane zarówno po stronie żeńskiej, jak i
męskiej. Do rodowodów klasycznych zaliczamy rodowody: tabelaryczne, klamrowe i strzałkowe.
191
W rodowodach tabelaryczne samice zapisuje się po lewej stronie rodowodu, a osobniki męskie po
prawej stronie rodowodu, kolejne pokolenia oddzielają od siebie linie poziome.
Z
A♀
B♂
C♀
F♀
D♂
D♂
G♀
E♀
H♂
J♀
D♂
K♂
G♀
H♂
W rodowodzie klamrowym osobniki męskie są wpisywane na górze, a żeńskie na dole.
D♂
B♂
E♀
Z
D♂
A♀
C♀
W rodowodzie strzałkowym, strzałki pokazują kierunek przekazywania genów od przodka do
potomka.
D♂
B♂
E♀
Z
D♂
A♀
C♀
W rodowodzie danego osobnika znajdziemy informacje o trzech lub czterech pokoleniach
wstecz, a to dlatego, że największe znaczenie mają przodkowie najbliżsi w rodowodzie danego
osobnika, ponieważ procent genów przekazywanych przez każdego przodka zmniejsza się o połowę w
każdym następnym pokoleniu. Sięganie głębiej (do dalszych przodków) w rodowodzie nie jest celowe
ze względu na niewielki procent identycznych genów w genotypie analizowanych osobników w
stosunku do ich dalszych przodków. Czyli na danego probanta największy wpływ mają przodkowie,
którzy znajdują się najbliżej w jego rodowodzie.
192
9.2. Obliczanie spokrewnienia i inbredu
Współczynnik spokrewnienia wyraża stopień genetycznego podobieństwa między dwoma
spokrewnionymi osobnikami, określa podobieństwo genotypów, czyli odpowiada na pytanie jaka
część genów obu osobników jest identyczna wskutek pochodzenia po wspólnych przodkach.
Współczynnik spokrewnienia można interpretować, jako prawdopodobieństwo, że dany gen z
pojedynczej pary alleli osobnika jest identyczny z jednym spośród alleli analogicznej pary drugiego
osobnika [5].
Przykład 9.1
Rodowód probanta Z. Rodzice (osobniki: B i C) probanta Z są ze sobą spokrewnieni– mają tę samą
matkę- osobnika D.
Probant
Z
Rodzice
B♀
C♂
Dziadkowie
D♀
E♂
D♀
F♂
Genotyp
A1
A2
A3
A4
A1
A2
A5
A6
dziadków*
*genotypy dziadków (osobniki nie spokrewnione) wyrażono symbolami alleli hipotetycznego locus A
Rozpatrzmy wszystkie możliwe genotypy, które mogą posiadać osobniki B i C.
Możliwe genotypy osobnika B:
D♀
A1
A2
E♂
A3
A1
A3
A2
A3
A4
A1
A4
A2
A4
Możliwe genotypy osobnika C:
D♀
A1
A2
F♂
A5
A1
A5
A2
A5
A6
A1
A6
A2
A6
Aby obliczyć spokrewnienie osobników B i C należy w nim uwzględnić wszystkie rodzaje genotypów,
jakie mogą mieć w/w osobniki.
Podobieństwo genotypów osobników B i C:
193
B♀
A1A3
A2A3
A1A4
A2A4
C♂
A1A5
50%
A2A5
50%
50%
A1A6
50%
A2A6
50%
50%
50%
8 0,5 1
16
4
50%
Kierując się w swych rozważaniach interpretacją współczynnika spokrewnienia jako
”prawdopodobieństwo, że dany gen z pojedynczej pary alleli osobnika jest identyczny z jednym
spośród alleli analogicznej pary drugiego osobnika”, możemy oszacować spokrewnienie osobników B
i C, jako ich podobieństwo genetyczne. Na 16 możliwości 8 z nich świadczy o tym, iż genotypy
osobników B i C są w 50% podobne, np.: genotyp A1A3 (osobnik B) i genotyp A1A5 (osobnik C)–
allelem, który występuje w obu przypadkach genotypów to allel A1. Z racji posiadania tej samej matki
osobniki B i C prawdopodobnie posiadają ¼ identycznych genów.
Ponieważ osobniki B i C są ze sobą spokrewnione, to ich potomek- osobnik Z będzie
zinbredowany. Rozpatrzmy wszystkie możliwości genotypów, jakie może posiadać osobnik Z. W tym
celu musimy przedstawić wszystkie możliwe allele, jakie każde z rodziców osobnika Z może mu
przekazać. Okazuje się, że na 16 możliwości istnieją tylko 2, kiedy osobnik Z będzie homozygotą (tzn.:
A1A1 oraz A2A2). Dlatego też „prawdopodobieństwo, że oba allele jednej pary genów są identyczne”
wynosi 1/8. Taki wynik możemy też interpretować jako prawdopodobieństwo wystąpienia
homozygotyczności danego osobnika, którego rodzice byli ze sobą spokrewnieni.
Współczynnik inbredu jest miarą podobieństwa genetycznego gamet. Możemy go interpretować,
jako prawdopodobieństwo, że oba allele jednej pary genów są identyczne (albo, że łączące się w
zygotę gamety przenoszą w danym locus identyczne geny) [5].
Możliwe genotypy osobnika Z:
B♀
C♂
A1
A2
A1
A2
A3
A4
A1A1
A2A2
2 1
16 8
A5
A6
194
9.3. Spokrewnienie w linii prostej i w linii bocznej
Dwa osobniki są spokrewnione ze sobą w linii prostej, jeśli jeden z nich jest przodkiem
drugiego (np.: rodzic-potomek) lub w linii bocznej, gdy posiadają one co najmniej jednego wspólnego
przodka
(np.:
spokrewnienie
między
rodzeństwem
lub
pół-rodzeństwem).
Współczynnik
pokrewieństwa wyraża stopień genetycznego podobieństwa między dwoma spokrewnionymi
osobnikami. Jego wartość mówi nam jaka część genów u obu osobników jest identyczna wskutek
wspólnego pochodzenia.
W obliczeniach spokrewnienia dwóch osobników należy uwzględnić wszystkich przodków,
sięgając jednak do przodków znajdujących się najbliżej w rodowodzie. Przygotowując się do obliczeń
współczynnika spokrewnienia dwóch osobników w rodowodzie strzałkowym, przodka danego
osobnika można umieścić tylko raz, ale liczba ścieżek wychodząca od niego musi być zgodna z
rodowodem tabelarycznym (z rodowodem/ami, na podstawie, których dokonujemy obliczeń). Za
pomocą ścieżek Wright’a zaznacza się w kolejnych pokoleniach odległości między osobnikami.
Poszukując odpowiednich dróg łączących dwa osobniki nie można poruszać się wstecz, gdy już raz
podąży się naprzód, ani też nie można przechodzić ponownie w rodowodzie przez to samo miejsce
położenia danego przodka.
9.3.1. Spokrewnienie w linii prostej
Współczynnik pokrewieństwa w linii prostej osobników X i A:
RX ,A
1
2
n
1 FA
1 FX
RXA – współczynnik spokrewnienia między osobnikiem X i jego przodkiem A
n - liczba pokoleń dzielących danego osobnika X z jego przodkiem A
FA – inbred przodka A
FX – inbred osobnika X
Współczynnik inbredu osobnika Z potomka osobników X i A: FZ = ½ RX,A
RX,A – współczynnik spokrewnienia osobników X i AY
Rodowód tabelaryczno-szachownicowy osobnika C:
C
B
D
A
H
E
I
J
F
K
L
G
M
N
O
Rodowód strzałkowy do obliczeń współczynnika pokrewieństwa:
195
RAC=1/4
A- babka osobnika C
B- matka osobnika C
Spokrewnienie między rodzicem i potomkiem. Osobnik (A) jest matką osobnika (B) i przekazuje mu ½
założeń genetycznych. Liczba ścieżek dzieląca potomka (B) i przodka (A) jest równa 1, zatem
współczynnik pokrewieństwa między rodzicem i potomkiem wynosi ½.
1
RA, B
1 1
2 2
1
2
2
Spokrewnienie między osobnikiem (A) i (C), czyli między babką i wnuczką, to RA,C
1
4
Podobieństwo między nimi wynosi 25%- prawdopodobieństwo/pewność posiadania identycznych
genów z racji tego, że jeden osobnik (A) jest przodkiem drugiego (C).
Jeśli jedno z rodziców danego osobnika jest zinbredowane, to okazuje się, że podobieństwo
genetyczne między potomkiem i rodzicem jest większe w porównaniu do przypadku, gdyby rodzic
danego probanta nie byłby zinbredowany (przykład w rodowodzie poniżej).
Poniżej przedstawiono wskazówki jakie kroki kolejno należy uczynić, aby obliczyć spokrewnienie w
linii prostej:
na podstawie rodowodu tabelarycznego stworzyć rodowód strzałkowy probanta
wyszukać danego przodka
sprawdzić czy przodek jest zinbredowany - obliczyć jego inbred
sprawdzić czy probant jest zinbredowany - obliczyć jego inbred
wyznaczyć wszystkie możliwe ścieżki łączące probanta z przodkiem
obliczyć spokrewnienie probanta i jego przodka
196
Rodowód tabelaryczno - szachownicowy osobnika C:
C
B
D
A
E
H
I
H
F
K
L
G
M
N
O
Rodowód strzałkowy:
Spokrewnienie między osobnikiem B i osobnikiem C:
RC , B
1
2
n
1 FB
1 FC
Współczynnik inbredu osobnika B można obliczyć, jako ½ spokrewnienia jego rodziców.
2
FB
1
1 1
1
RA , E
2
2 2 H 8
Osobnik C nie jest zinbredowany, gdyż jego rodzice B i D nie są ze sobą spokrewnieni. FC=0.
1
RC , B
1
2
1
1
8 1 1,125 0,53
1 0 2
1
Spokrewnienie między osobnikiem B i C wynosi 0,53.
Można się oczywiście zastanowić jak to jest możliwe, aby spokrewnienie między matką i
dzieckiem było większe niż ½, pamiętając o tym, iż każde z rodziców przekazuje potomstwu ½ swoich
założeń genetycznych. Na przykładzie rodowodu probanta C (rodowód wyżej) pokazano, że to jest
możliwe. W przypadku, gdy jego matka (osobnik B) jest zinbredowana (jej rodzice są spokrewnieni –
osobniki A i E mają tę samą matkę H), to współczynnik pokrewieństwa między B i C będzie większy o
0,03 w porównaniu z przypadkiem, gdyby osobnik B nie był zinbredowany (patrz rodowód wyżej), gdy
podobieństwo genetyczne jest równe 0,5. Jeśli będziemy rozpatrywać osobnika C, jako jednego z
197
większej liczby potomstwa osobnika B, to prawdopodobieństwo podobieństwa genetycznego między
osobnikiem B i C będzie tym większe, im więcej układów homozygotycznych będzie występować u
osobnika B. Czyli wraz ze wzrostem homozygotyczności osobnika B rośnie prawdopodobieństwo
podobieństwa genetycznego między osobnikiem B i a jego potomkiem.
9.3.2. Spokrewnienie w linii bocznej
n1 n2
Współczynnik pokrewieństwa w linii bocznej osobników X i Y:
RX ,Y
1
2 1 FA
1 FX 1 FY
RXY – współczynnik pokrewieństwa między osobnikiem X i Y
n1- liczba pokoleń dzielących danego osobnika X od wspólnego przodka
n2- liczba pokoleń dzielących danego osobnika Y od wspólnego przodka
FA – inbred wspólnego przodka A
FX – inbred osobnika X
FY – inbred osobnika Y
Wskazówki postępowania przy obliczeniach spokrewnienia w linii bocznej:
na podstawie rodowodu tabelaryczno-szachownicowego stworzyć rodowód strzałkowy probanta
wyszukać wszystkich najbliższych wspólnych przodków dla rodziców probanta
zwrócić uwagę na to, iż może występować spokrewnienie w linii prostej jak i w linii bocznej
sprawdzić, czy wspólni przodkowie są zinbredowani - obliczyć ich inbred
sprawdzić, czy rodzice probanta są zinbredowani – obliczyć ich inbred
wyznaczyć wszystkie możliwe drogi od każdego wspólnego przodka do każdego z rodziców probanta
(zwracając uwagę na to, iż dany osobnik na drodze może wystąpić tylko raz, a także aby drogi nie
krzyżowały się „w jednym” osobniku)
policzyć strzałki na każdej drodze i obliczyć spokrewnienie rodziców probanta
obliczyć inbred probanta
Przykład 9.2
Rodowód tabelaryczny osobnika C:
C
B
D
A
H
E
I
J
F
K
L
E
M
J
K
198
Osobniki B i D mają jednego wspólnego przodka (tego samego ojca E), a liczba ścieżek od niego do
osobnika B n1 = 1, liczba ścieżek od tego samego wspólnego przodka do osobnika D n2 = 1, zatem:
11
RB ,D
1
2
1
4
Osobniki B i D są pół-rodzeństwem, a współczynnik pokrewieństwa w/w osobników wynosi ¼.
Przykład 9.3
Rodowód tabelaryczny osobnika C:
C
B
D
A
H
E
I
J
A
K
H
E
I
J
K
Osobniki B i D mają tych samych rodziców: A i E, więc są pełnym rodzeństwem.
Wiemy, iż rysując rodowody strzałkowe rysujemy je w taki sposób, aby strzałki prowadzone od
wspólnego przodka do danego osobnika nigdzie się nie przecinały. Ale jedynym wyjątkiem jest
rodowód przedstawiający spokrewnienie pełnego rodzeństwa. Dlatego też powyżej przedstawiony
rodowód strzałkowy można przedstawić wyjątkowo w następujący sposób.
199
11
RB , D
11
1 1 1
1
1
4 4 2
2 A 2 E
Współczynnik pokrewieństwa osobników B i D wynosi ½.
Przykład 9.4
Rodowód tabelaryczny osobnika C:
C
B
D
A
E
H
L
I
M
N
A
J
O
P
K
R
S
E
H
R
L
I
M
N
J
O
P
K
R
S
R
Osobniki B i D mają tych samych rodziców: A i E, więc są pełnym rodzeństwem
11
RB , D
11
1
1
1 FE
2 A 2 E
11
1
1 1
1
FE RJ , K
2
2 2 R
8
11
RB , D
11
1 1 1 17
1
1
1 FE 1
0,53125
4 4 8 32
2 A 2 E
Współczynnik pokrewieństwa osobników B i D, które są pełnym rodzeństwem, wynosi 0,53125. Jak
widać w momencie gdy jeden ze wspólnych przodków jest zinbredowany (przodek E), zwiększa się
jego homozygotyczność, dlatego też podobieństwo genetyczne osobników B i D rośnie o 0,03125.
200
Inaczej sytuacja wygląda, gdy nie tylko jeden z przodków jest zinbredowany, ale także osobniki, dla
których liczymy współczynnik pokrewieństwa, są inbredowane.
Przykład 9.5
Rodowód tabelaryczny osobnika C:
C
B
D
E
F
G
I
A
H
J
K
E
L
G
C
M
H
Osobniki B i D mają wspólnego przodka E, spokrewnienie między nimi będzie równe:
3
RB , D
1
1
= 0,125
2 E 8
Ale jeśli się okaże, iż osobnik D będzie zinbredowany
C
B
D
E
F
G
I
A
H
J
K
E
L
G
C
C
H
Spokrewnienie między osobnikami B i D obliczymy w następujący sposób:
3
RB , D
1
1
0,125
2
8
E
0,1118
1 FD 1 1,118
1
4
1
1
1 1
1
FD RA,C
2
2 2 C 4
Jak widać z powyższego przykładu, zinbredowanie osobnika D spowodowało zmniejszenie
podobieństwa genetycznego między osobnikiem D i B o czym świadczy wystąpienie niższego
201
współczynnika spokrewnienia (RB,D =0,1118) niż miało to miejsce w poprzednim rodowodzie (RB,D
= 0,125).
Przykład 9.6
Rodowód tabelaryczny osobnika C:
C
B
D
A
E
H
L
I
O
N
A
A
K
H
E
I
A
K
O
H
I
S
R
L
O
N
O
H
I
S
R
L O N O
L O N O
Osobniki B i D mają tych samych rodziców: A i E, więc są pełnym rodzeństwem, ale spokrewnienie
między nimi nie będzie równe ½, ze względu na fakt, iż osobnik A występuje też w rodowodzie
osobnika E.
Ścieżki, które można poprowadzić od wspólnych przodków do osobników B i D:
B
E
D
B
A
D
B
A
E
D
B
E
A
B
Spokrewnienie między osobnikami B i D obliczymy w następujący sposób:
RB , D
2
1 2 1 3 1 3
1
1 FA
2 E 2 A 2 A 2 A
1 FB 1 FD
2
FA
1
1 1
1
RH , I
2
2 2 O 8
202
1
1
1 1
1
FB RA, E
2
2 2 A 4
1
FD
1
1 1
1
RA, E
2
2 2 A 4
RB , D
2
1 2 1 3 1 3 1
1
1
2 E 2 A 2 A 2 A 8
1 1
1 1
4 4
0,8125
0,65
1,25
9.3.3. Średnie spokrewnienie w stadzie
Niekiedy konieczne jest obliczenie średniego spokrewnienia w stadzie, linii lub całej populacji. W tym
celu należy obliczyć spokrewnienie każdego osobnika z każdym.
R
R
xy
n(n 1)
2
gdzie: Rxy – spokrewnienie między dwoma osobnikami
n – liczba osobników w stadzie
n(n 1)
2
- liczba kombinacji każdego osobnika z każdym
Dzięki znajomości wielkości spokrewnienia każdego osobnika z każdym hodowca wie, jak
prowadzić dobór do kojarzeń, aby przewidywane spokrewnienie w stadzie nie wzrastało, aby nie
doprowadzać do wzrostu inbredu osobników potomnych. Wzrost inbredu związany jest ze wzrostem
homozygotyczności danego osobnika, a co za tym idzie wystąpienia możliwości ujawnienia się
fenotypowego genów recesywnych warunkujących cechy niepożądane, m.in. choroby genetyczne,
ale także może doprowadzić do problemów ze wzrostem i rozwojem osobnika zinbredowanego.
Przykład 9.7
Aby obliczyć średnie spokrewnienie w stadzie liczącym 6 sztuk owczarków kaukaskich, należy obliczyć
15 współczynników spokrewnienia.
Gdy
nn 1
66 1
15
, więc
2
2
203
Wartości spokrewnienia między poszczególnymi parami osobników w stadzie liczącym 6 sztuk.
Rumba
Ali
Biba
Abisal
Assunta
Borisza
0,0221
0,0415
0,5116
0,5116
0,5
0,4416
0,1657
0,1657
0,4790
0,2783
0,2783
0,2077
0,5
0,3385
Ali
Biba
Abisal
Assunta
0,3385
Średnie spokrewnienie: R
4,7801
0,3187
6(6 1)
2
Literatura do rozdziału 9
1. Dziennik Urzędowy Unii Europejskiej L 125/15 z 2005r.
2. Dziennik Urzędowy L 145 , 08/06/1990 P. 0039 - 0047
3. Dzienniku Urzędowy L 247 , 23/08/1989 P. 0022 – 0030
4. Falconer D.S, Dziedziczenie cech ilościowych. 1974 PWN, Warszawa
5. Malécot G. Les mathématiques de l'hérédité. Paris: Masson & Cie, 1948
6. Obwieszczenie Ministra Rolnictwa i Rozwoju Wsi z dnia 11 lipca 2008r w sprawie wykazu
przepisów Unii Europejskiej dotyczących hodowli zwierząt i rozrodu
7. Żuk B., Metody genetyki populacji w hodowli zwierząt. 1973, PWRiL Warszawa
Zadania do rozdziału 9
Zadania 9.1 –9.4 Wpisać przodków danego probanta w szachownicę rodowodową.
Zadanie 9.1 Probant – ogier EPIDIAN
O
OM
MOO
MM
MOM
Akcept 9161
Kerman 9251
Windstille xx
Eryka 7049
Krajanka I
M
MMO
OOO
MO
OMO
Era 8530
Agitacja xx
Neckar xx
Aklamacja xx
Negresco xx
MMM
OOM
OO
OMM
Eurydyka II
Labirynt xx
Weidwerk xx
Aspirant
EPIDIAN
M
Era 8530
O Akcept 9161
Eryka 7049
Kerman 9251
Aklamacja xx
Weidwerk xx
Eurydyka II
Aspirant Krajanka I Labirynt
Agitacja
Negresco Windstille Neckar xx
xx
xx
xx
xx
204
Zadanie 9.2 Probant – ogier HARAP
O
OM
MOO
MM
MOM
Robin Hood 2205
Gosler
Skra
Husaria
Gala
M
MMO
OOO
MO
OMO
Hugona 523
Rosiczka
Los
Rewia
Piołun
MMM
OOM
OO
OMM
Herwia
Eszelon
Sternik
Rumb xx
HARAP
M
O
Zadanie 9.3 Probant – pies AMBROŻY
O
OM
MOO
MM
MOM
FAUVE du Moulin d`Eau
BOR Cerna Hriva
UMETTE DE L`Cinse
DRINA Bochemia Sibelle
ANELLE Zikar
M
MMO
OOO
MO
OMO
DRINA z Michal
RUMBA du Moulin
ROBIN du Logis
TSANA du Moulin
CROCUS des Potteries
MMM
OOM
OO
OMM
AILLENE Bochemia
LUPIN des Philipiques
VANGOGH de L`cinse
VLADIMIR des Elfes
AMBROŻY
M
O
Zadanie 9.4 Probant – suka ARKADIA
O
OM
MOO
MM
MOM
HILL of the Gloaming
CLAUD Bohemia-Sibelle
OBICHE des Carrieres
DIXIE Belong
AILLENE Bochemia
M
MMO
OOO
MO
OMO
ZW. BINY
DAUPHINE
MARADJA
FAQUITA of Gloaming
DOKTOR Doolittle
MMM
OOM
OO
OMM
ARCA Petriny
VLADIMIR des Elfes
FLASCH
JOB de la Plaine
ARKADIA
M
O
Zadanie 9.5
Narysuj rodowód strzałkowy potomka Ambrożego i Arkadii na podstawie ich rodowodów z zadania 3
i 4, odpowiednio. Oblicz spokrewnienie między Arkadią i Ambrożym i inbred ich potomka.
We wszystkich poniżej zamieszczonych zadaniach (zadania od 9.6 do 9.15) oblicz spokrewnienie
rodziców osobnika P, a następnie jego inbred.
Zadanie 9.6
P
1
A
2
B
3
C
4
D
3
E
5
F
6
G
205
Zadanie 9.7
P
1
A
2
B
4
D
3
3
5
E
C
5
F
F
7
H
6
8
G
H
Zadanie 9.8
P
1
A
2
B
4
3
D
3
C
E
5
7
3
5
F
H
8
C
7
F
H
8
6
G
H
H
Zadanie 9.9
P
1
A
2
B
4
3
D
C
3
3
G
E
5
7
5
F
H
8
C
7
F
H
8
6
G
H
H
Zadanie 9.10
P
1
A
2
B
4
3
D
C
-
3
3
G
6 I
E
5
7
F
H
8
C
5
7
F
H
8
6
G
H
6
I
9 J 9 J
H
Zadanie 9.11
P
1
A
2
B
4
D
3
5
E
4
C
D
9
D
6
F
7 G 8 G
Zadanie 9.12
P
1
A
2
B
4
D
6
5
F
7 G 8 G
3
E
4
C
D
5
D
6
F
7 G 8 G
206
Zadanie 9.13
P
1
A
2
B
4
D
3
5
E
9
-
C
4
D
5
D
H
I
-
6
I
F
7 G 8 G
Zadanie 9.14
P
1
A
2
B
4
D
3
5
E
6
H
C
F
H
7
G
H
H
Zadanie 9.15
P
1
A
2
4
B
D
5
H
3
E
6
H
C
F
7
H
G
H
8
I
9 J 9 J
Odpowiedzi do zadań
Ad.5. R (Arkadia,Ambroży) = 0,03125; FP = 0,0156
Ad.6. R 1,A = 0,125; FP = 0,0625
Ad.7. R 1, A= 0,1406; FP = 0,0703
Ad.8. R
Ad.9. R 1, A = 0,3011; FP = 0,1505
1, A =
0,2709; FP = 0,1354
Ad.10. R 1, A = 0,3086; FP = 0,1543
Ad.11. R 1, A = 0,0190; FP = 0,0095
Ad.12. R 1, A = 0,2487; FP = 0,1244
Ad.13. R 1, A = 0,0848; FP = 0,0424
Ad.14. R 1, A = 0,0606; FP = 0,0303
Ad.15. R 1, A = 0,0752; FP = 0,0376
207