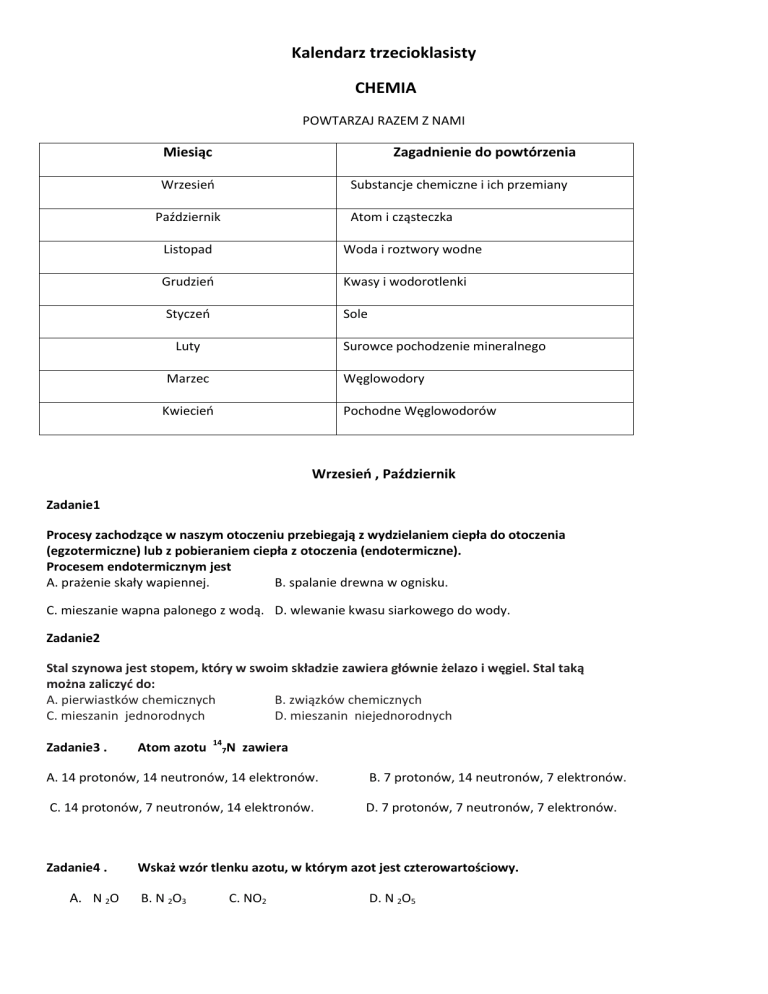
Kalendarz trzecioklasisty
CHEMIA
POWTARZAJ RAZEM Z NAMI
Miesiąc
Zagadnienie do powtórzenia
Wrzesieo
Substancje chemiczne i ich przemiany
Październik
Atom i cząsteczka
Listopad
Woda i roztwory wodne
Grudzieo
Kwasy i wodorotlenki
Styczeo
Sole
Luty
Surowce pochodzenie mineralnego
Marzec
Węglowodory
Kwiecieo
Pochodne Węglowodorów
Wrzesieo , Październik
Zadanie1
Procesy zachodzące w naszym otoczeniu przebiegają z wydzielaniem ciepła do otoczenia
(egzotermiczne) lub z pobieraniem ciepła z otoczenia (endotermiczne).
Procesem endotermicznym jest
A. prażenie skały wapiennej.
B. spalanie drewna w ognisku.
C. mieszanie wapna palonego z wodą. D. wlewanie kwasu siarkowego do wody.
Zadanie2
Stal szynowa jest stopem, który w swoim składzie zawiera głównie żelazo i węgiel. Stal taką
można zaliczyd do:
A. pierwiastków chemicznych
B. związków chemicznych
C. mieszanin jednorodnych
D. mieszanin niejednorodnych
Zadanie3 .
Atom azotu
14
7N
zawiera
A. 14 protonów, 14 neutronów, 14 elektronów.
B. 7 protonów, 14 neutronów, 7 elektronów.
C. 14 protonów, 7 neutronów, 14 elektronów.
D. 7 protonów, 7 neutronów, 7 elektronów.
Zadanie4 .
A. N 2O
Wskaż wzór tlenku azotu, w którym azot jest czterowartościowy.
B. N 2O3
C. NO2
D. N 2O5
Zadanie5 . W pewnym kwasie tlenowym stosunek masy wodoru do masy niemetalu i do masy tlenu jest równy 1 :
6 : 24. Kwasem tym jest
A. H 2CO3
B. H 2SO3
C. HNO3
D. H 2SO4
Zadanie 6 . Ile atomów tworzy cząsteczkę wody i ile pierwiastków wchodzi w jej skład?
A. Dwa atomy, trzy pierwiastki.
C. Trzy atomy, jeden pierwiastek.
B. Trzy atomy, dwa pierwiastki.
D. Dwa atomy, dwa pierwiastki.
Zadanie 7 . Ile gramów wodoru i ile gramów tlenu znajduje się w 72 g wody?
(Masy atomowe: MH = 1 u,
MO = 16 u)
A. wodoru – 8 g, tlenu – 64 g
B. wodoru – 2 g, tlenu – 16 g
C. wodoru – 48 g, tlenu – 24 g
D. wodoru – 64 g, tlenu – 8 g
Zadanie 8 . Na podstawie układu okresowego wybierz zdanie prawdziwe dotyczące sodu
A.
B.
C.
D.
W jądrze atomu sodu jest 11 neutronów.
Liczba atomowa sodu jest równa 12.
Atom sodu ma konfigurację elektronową: 2, 8, 1.
Sód leży w trzecim okresie i drugiej grupie układu okresowego.
Zadanie9 . Pewien pierwiastek, umownie oznaczony literą E, tworzy tlenek o ogólnym wzorze EO3.
Jaki to pierwiastek, jeżeli masa cząsteczkowa jego tlenku wynosi 80,04 u? Zapisz obliczenia.
Zadanie 10
Wartościowośd poszczególnych pierwiastków w tym związku jest równa:
A. Ca – VI, P – X, O – XVI
B. Ca – III, P – II, O – VIII
C. Ca – II, P – III, O – II
D. Ca – II, P – V, O – II
Zadanie 10
Wzór sumaryczny tego związku ma postad:
A. Ca 3(PO4)2
Zadanie 11
B. Ca 3(PO5)2
C. 2 Ca3(PO4)
D. 3 Ca(PO4)2
Na rysunku przedstawiono wybrane informacje z układu okresowego pierwiastków.
(Masy atomowe podane są w zaokrągleniu do jedności).
Korzystając z nich, oblicz masę cząsteczkową związku chemicznego o wzorze sumarycznym Mg3(AsO4)2.
Zadanie 12.
kreskowym
A.CO
Jednym z produktów spalania węgla kamiennego jest tlenek węgla (IV), związek o wzorze
B. C=O
C. CO2
D. O=C=O
Zadanie 13. Szyny kolejowe naprawia się, umieszczając w szczelinie między spojeniami mieszaninę pyłu glinowego
oraz tlenku żelaza (III). Po jej zapaleniu następuje gwałtowna reakcja, podczas której wydziela się żelazo w stanie
płynnym. Stopione żelazo, stygnąc i zestalając się, spaja segmenty szyn. Reakcję tę ilustruje równanie
A. 2 Al + Fe 2O3
2 Fe + Al 2O3
B. 2 Al + 3 FeO
3 Fe + Al 2O3
C . Al + FeO
Fe + Al 2O3
D. Al + Fe 2O3
Fe + Al 2O3
Zadanie 14. Na przystankach Kolei Transsyberyjskiej można kupid orzeszki cedrowe. Zawierają one prawie
wszystkie aminokwasy zarówno ze świata roślin, jak i ze świata zwierząt. Jednym z takich aminokwasów jest lizyna
o wzorze:
Napisz, ile atomów buduje jedną cząsteczkę lizyny.
Zadanie 15. . W skład pewnego sztucznego nawozu do roślin kwitnących wchodzi tlenek azotu (V). Masa
cząsteczkowa tego tlenku o wzorze sumarycznym N2O5 wynosi
Zadanie 16. . Prawo stałości składu związku chemicznego brzmi:
Stosunek mas pierwiastków w każdym związku chemicznym jest stały i charakterystyczny
dla danego związku chemicznego.
Wskaż, która z poniższych wielkości określa stosunek masy azotu do masy tlenu w tlenku azotu (V) o wzorze N 2O5
(mN=14u mO=16u).
A. 2 : 5
B. 5 : 2
C.7 : 20
D. 20 : 7
Zadanie 17..
Blacha wykonana z glinu (Al) jest odporna na działanie czynników atmosferycznych, ponieważ
pokrywa się warstwą ochronną tlenku glinu. Zapisz równanie reakcji tworzenia się tlenku
glinu z pierwiastków, wiedząc, że glin jest trójwartościowy.
Zadanie 18.
Podczas spalania 8 g wodoru w tlenie otrzymano 72 g
wody. Ile gramów tlenu wzięło udział w reakcji?
A. 16
B. 32
C. 36
D. 64
Informacje do zadao 19 i 20
Aby kąpiel w domowym basenie była bezpieczna, woda musi byd poddana uzdatnieniu
chemicznemu. Stosowany do dezynfekcji wody gazowy chlor (Cl2) coraz częściej zastępuje się
jego tlenkiem o wzorze ClO2. Położenie chloru w układzie okresowym przedstawia fragment
układu okresowego
Zadanie 19. Narysuj wzór elektronowy przedstawiający powstawanie wiązania chemicznego w cząsteczce
chloru.
Zadanie 20.
Podaj wartościowośd chloru w tlenku używanym do uzdatniania wody.
Oblicz masę cząsteczkowa tego tlenku.
Listopad: Woda i roztwory wodne
Zadanie1 . Uczniowie mieli otrzymać 5-procentowy wodny roztwór soli. Pracowali w czterech
zespołach. W tabeli podano masy składników wykorzystanych przez każdy z zespołów.
Który zespół prawidłowo dobrał masy składników?
A. Tylko zespół III. B. Tylko zespół IV. C. Zespół I i zespół III. D. Zespół II i zespół IV
Zadanie2 . Wybierz zdanie, które jest prawdziwe dla wody jako związku chemicznego.
A. Woda należy do węglowodanów. B. Skład chemiczny wody można zmienić.
C. Składu chemicznego wody nie można zmienić. D. Woda należy do wodorotlenków.
Zadanie 3 Na wykresach przedstawiono zależność rozpuszczalności wybranych substancji w wodzie
od temperatury.
Ze wzrostem temperatury rozpuszczalnośd soli .........................., a gazów .............................. .
W 100 g wody o temperaturze 50°C można rozpuścid co najwyżej ............... g NH3.
Aby w 50 g wody można było rozpuścid 75 g NaNO3, trzeba ogrzad wodę do temperatury co najmniej
..................°C.
Wykres przedstawia zależność rozpuszczalności wybranych związków wapnia w wodzie od temperatury ( na
jego podstawie rozwiąż zadania 4 i 5)
Zadanie 4.
20ºC?
A. 2,6g
Ile co najwyżej gramów wodorotlenku wapnia można rozpuścid w 1000 g wody w temperaturze
B. 0,26g
C. 0,16g
D. 1,6g
Zadanie 5.
Które zdanie jest prawdziwe?
A. Rozpuszczalność związków wapnia rośnie ze wzrostem temperatury.
B. Przy podnoszeniu się temperatury od 0ºC do 20ºC rozpuszczalność siarczanu(VI) wapnia
rośnie, a wodorotlenku wapnia maleje.
C. Rozpuszczalność siarczanu(VI) wapnia w temperaturze 0ºC i 60ºC jest taka sama.
D. Rozpuszczalność wodorotlenku wapnia jest odwrotnie proporcjonalna do temperatury
Grudzieo
Zadanie1 Wskaż równanie reakcji zobojętniania.
A. 2Na + 2HCl → 2NaCl + H2↑
B. NaOH + HNO3 → NaNO3 + H2O
C. Na2O + 2HNO3 → 2NaNO3 + H2O
D. NaCl + AgNO3 → NaNO3 + AgCl↓
Zadanie 2 . Rośliny iglaste do uprawy wymagają kwaśnego podłoża. Jakie powinno byd optymalne pH gleby dla
tych roślin?
a) pH =11;
b) pH= 8;
c) pH =7;
d) pH =5
Zadanie 3 .
Podczas łączenia tlenku azotu (V) z wodą powstaje
a) kwas tlenowy b) wodorotlenek
c) kwas beztlenowy
d) sól kwasu tlenowego
Zadanie 4. W środowisku obojętnym wywar z czerwonej kapusty jest fioletowy. Pod wpływem kationów
wodoru staje się czerwony. Jaki związek obecny w cytrynie powoduje zmianę barwy wywaru na czerwoną?
A. Sól.
B. Woda.
C. Kwas.
D. Zasada.
Zadanie 5.
Chemicy określają kwasowośd roztworu w jednostkach zwanych pH. Chemicznie czysta woda ma
odczyn obojętny, którego pH= 7. Produkt kosmetyczny , którego wartośd pH =5,5 ma odczyn
A. słabo kwaśny
B. silnie kwaśny
C. silnie zasadowy
D. słabo zasadowy
Zadanie 6.
Woda gazowana zawiera rozpuszczony w wodzie dwutlenek węgla. Niewielkie ilości tego gazu
reagują z wodą , tworząc kwas węglowy . Napisz równanie reakcji tworzenia się tego kwasu.
Zadanie 7.
Ania uważa , że dla uzyskania słomkowożółtego zabarwienia zaparzonej mocnej herbaty należy
dodac soku z cytryny. Podaj , jaką rolę chemiczną pełni herbata po dodaniu do niej soku z cytryny.
A. rozpuszczalnika
B. wskaźnika
C. zagęszczacza
D. rozdrabniacza
Styczeo
Zadanie 1. Do unieruchamiania złamanych kooczyn stosuje się gips palony. Twardnienie tego gipsu jest wynikiem
A. reakcji z wodą B. reakcji z tlenem
C. działania światła
D. reakcji z dwutlenkiem węgla
Zadanie 2. Napisz ciąg reakcji odpowiadający schematowi:
Ca⇒CaO ⇒ Ca(OH)2⇒ CaSO4
Zadanie 3.
W tzw. soli gorzkiej , siarczanie (VI) magnezu , pierwiastki połączone są ze sobą w stsunku
masowym 3: 4: 8 zgodnie z
A. prawem stałości składu
B. prawem okresowości
D. prawem zachowania masy
Zadanie 30. Zapisz równanie reakcji mętnienia wody wapiennej.
C. prawem objętości molowej