Wrocław, 2013-06-20
PROGRAM ĆWICZEŃ Z MIKROBIOLOGII DLA STUDENTÓW III ROKU WYDZIAŁU
LEKARSKIEGO W ROKU AKADEMICKIM 2013/2014 semestr zimowy
Ćwiczenia ćwiczeń z mikrobiologii trwają 3 godziny lekcyjne (135 minut) co 2 tygodnie w sali
ćwiczeń Katedry i Zakładu Mikrobiologii Uniwersytetu Medycznego we Wrocławiu
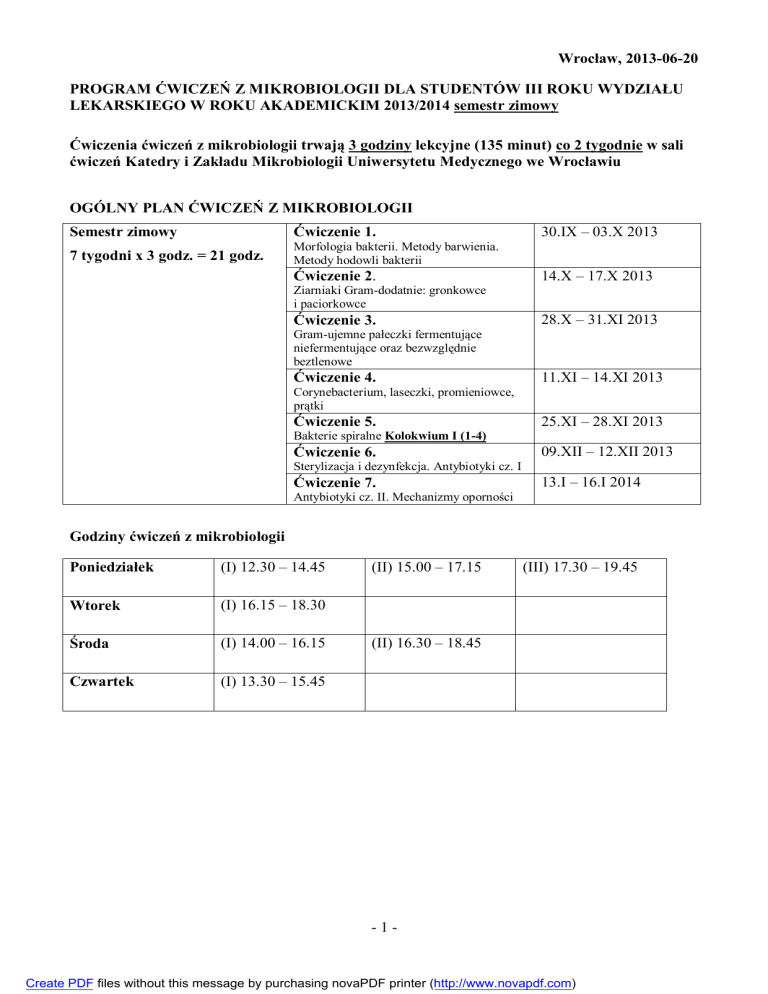
OGÓLNY PLAN ĆWICZEŃ Z MIKROBIOLOGII
Semestr zimowy
Ćwiczenie 1.
7 tygodni x 3 godz. = 21 godz.
Morfologia bakterii. Metody barwienia.
Metody hodowli bakterii
Ćwiczenie 2.
30.IX – 03.X 2013
14.X – 17.X 2013
Ziarniaki Gram-dodatnie: gronkowce
i paciorkowce
Ćwiczenie 3.
28.X – 31.XI 2013
Gram-ujemne pałeczki fermentujące
niefermentujące oraz bezwzględnie
beztlenowe
Ćwiczenie 4.
11.XI – 14.XI 2013
Corynebacterium, laseczki, promieniowce,
prątki
Ćwiczenie 5.
25.XI – 28.XI 2013
Bakterie spiralne Kolokwium I (1-4)
Ćwiczenie 6.
09.XII – 12.XII 2013
Sterylizacja i dezynfekcja. Antybiotyki cz. I
Ćwiczenie 7.
13.I – 16.I 2014
Antybiotyki cz. II. Mechanizmy oporności
Godziny ćwiczeń z mikrobiologii
Poniedziałek
(I) 12.30 – 14.45
Wtorek
(I) 16.15 – 18.30
Środa
(I) 14.00 – 16.15
Czwartek
(I) 13.30 – 15.45
(II) 15.00 – 17.15
(III) 17.30 – 19.45
(II) 16.30 – 18.45
-1-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
OGÓLNY PLAN ĆWICZEŃ Z MIKROBIOLOGII
ĆWICZENIE 1 (30.IX-3.X.2013)
TEMAT: MORFOLOGIA BAKTERII. METODY BARWIENIA. METODY
HODOWLI BAKTERII
Część teoretyczna:
♦
♦
♦
♦
♦
♦
Organizacja i dyscyplina pracy w czasie ćwiczeń z mikrobiologii.
Typy mikroskopów używanych na ćwiczeniach: świetlny, z ciemnym polem widzenia,
fluorescencyjny.
Morfologia bakterii.
Metody barwienia preparatów mikroskopowych: barwienie proste, złożone, pozytywne, negatywne,
negatywno-pozytywne.
Warunki hodowli bakterii tlenowych i beztlenowych in vitro. Wpływ temperatury, pH, potencjału
oksydacyjno-redukcyjnego, egzogennych związków pokarmowych (czynniki wzrostowe).
Podział podłoży mikrobiologicznych (proste, wzbogacone, wybiórczo-różnicujące, różnicujące).
Część praktyczna:
♦
♦
♦
♦
Opisywanie morfologii kolonii na wybranych podłożach.
Sporządzanie i oglądanie w mikroskopie świetlnym preparatów z hodowli bakterii, barwienie metodą
Grama.
Demonstracja gotowych preparatów z bakterii w mikroskopie świetlnym, cpw.
i fluorescencyjnym.
Demonstracja podłoży bakteriologicznych oraz wzrostu bakterii w podłożu płynnym i na podłożach
stałych.
ĆWICZENIE 2 (14-17.X.2013)
TEMAT: ZIARNIAKI GRAM-DODATNIE: GRONKOWCE I PACIORKOWCE
Część teoretyczna:
♦
♦
Charakterystyka i chorobotwórczość Staphylococcus aureus, S. epidermidis, S. saprophyticus.
Charakterystyka i chorobotwórczość Streptococcus pyogenes, S. pneumoniae, S. orale, Enterococcus.
Część praktyczna:
♦
♦
♦
♦
Demonstracja hodowli na agarze z krwią, opis morfologii kolonii, rodzaje hemolizy.
Demonstracja gotowych preparatów z omawianych bakterii w mikroskopie świetlnym.
Testy identyfikacyjne dla gronkowców: wytwarzanie katalazy, CF (wykonanie), wrażliwość na
nowobiocynę i furazolidon, koagulaza (demonstracja), ID32 Staph do odczytu.
Testy identyfikacyjne dla paciorkowców: wrażliwość na bacytracynę i optochinę, szereg
biochemiczny dla enterokoków, wykrywanie antygenów grupowych (demonstracja), API20Strep do
odczytu.
ĆWICZENIE 3 (28-31.X.2013)
TEMAT: GRAM-UJEMNE PAŁECZKI FERMENTUJĄCE, NIEFERMENTUJĄCE
oraz BEZWZGLĘDNIE BEZTLENOWE
Część teoretyczna:
♦
♦
♦
Charakterystyka i chorobotwórczość pałeczek Enterobacteriaceae: Salmonella, Shigella, Escherichia
coli, Proteus, Klebsiella.
Charakterystyka i chorobotwórczość pałeczek niefermentujacych: Pseudomonas aeruginosa,
Acinetobacter baumannii, Stenotrophomonas maltophilia.
Charakterystyka i chorobotwórczość Gram-ujemnych bakterii bezwzględnie beztlenowych
(Prevotella, Porphyromanas, Bacteroides, Fusobacterium).
Część praktyczna:
♦
Demonstracja hodowli bakterii na podłożach wybiórczych: Mac Conkey’a i SS (Enterobacteriaceae)
oraz na agarze zwykłym i Mac Conkey’a (Pseudomonas i Acinetobacter).
-2-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
♦
♦
Demonstracja gotowych preparatów bakteryjnych w mikroskopie świetlnym.
Identyfikacja Gram-ujemnych pałeczek: odczyt testów ID32GN dla Enterobacteriaceae,
Pseudomonas i Acinetobacter. Test na wytwarzanie oksydazy i barwników dla G(-) pałeczek
niefermentujących.
Demonstracja i identyfikacja Gram-ujemnych pałeczek bezwzględnie beztlenowych: odczyt testów
ID32A.
♦
ĆWICZENIE 4 (11-14.XI.2013)
TEMAT: CORYNEBACTERIUM, LASECZKI, PROMIENIOWCE, PRĄTKI
Część teoretyczna:
Charakterystyka i chorobotwórczość laseczek: Bacillus anthracis, Clostridium tetani, Cl. difficile, Cl.
botulinum, Cl. perfringens.
Charakterystyka i chorobotwórczość maczugowców – Corynebacterium diphtheriae.
Szczepionka DPT (diphtheria, pertussis, tetanus).
Podział taksonomiczny prątków
Charakterystyka i chorobotwórczość Mycobacterium tuberculosis oraz mykobakterii MOTT.
Postacie kliniczne gruźlicy, diagnostyka, szczepienia (BCG), próby tuberkulinowe
Odporność śródzakaźna – fenomen Kocha
Charakterystyka i chorobotwórczość Actinomyces spp. i Nocardia spp.
♦
♦
♦
♦
♦
♦
♦
♦
Część praktyczna:
♦
Demonstracja hodowli i gotowych preparatów: Bacillus, Clostridium Corynebacterium.
Testy identyfikacyjne maczugowców (ApiCoryne).
Oglądanie preparatów plwociny od chorego prątkującego barwionych metodą Ziehl-Neelsena
(czynnik wiązkowy – cord factor).
Oznaczanie wrażliwości prątków na tuberkulostatyki.
♦
Demonstracja hodowli i gotowych preparatów Actinomyces spp. i Nocardia spp.
♦
♦
♦
ĆWICZENIE 5 (25-28.XI.2013)
TEMAT: BAKTERIE SPIRALNE.
KOLOKWIUM I (z ćwiczeń 1-4)
Część teoretyczna:
♦
Charakterystyka i chorobotwórczość Treponema pallidum, Leptospira,
Borrelia recurrentis, B. burgdorferi, Campylobacter jejuni, Helicobacter pylori.
Część praktyczna:
♦
♦
♦
♦
♦
♦
Demonstracja hodowli Campylobacter i Helicobacter.
Demonstracja bezpośredniego preparatu z bioptatu z H. pylori.
Demonstracja preparatu srebrzonego z Treponema pallidum.
Demonstracja Leptospira w mikroskopie z ciemnym polem widzenia.
Demonstracja bezpośredniego rozmazu krwi z B. recurrentis.
Oglądanie gotowych preparatów z Campylobacter i Helicobacter.
ĆWICZENIE 6 (09-12.XII.2013)
TEMAT: STERYLIZACJA i DEZYNFEKCJA. ANTYBIOTYKI cz. I
STERYLIZACJA i DEZYNFEKCJA
Część teoretyczna:
♦
Omówienie metod sterylizacji i dezynfekcji oraz preparatów stosowanych w antyseptyce.
Część praktyczna:
-3-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
♦
Ocena skuteczności higienicznego mycia rąk (mycie + jednokrotna dezynfekcja) - jedna płytka
agarowa dla studenta.
ANTYBIOTYKI
Część teoretyczna:
Charakterystyka najważniejszych grup antybiotyków (mechanizm i sposób działania, spektrum
przeciwbakteryjne, mechanizm(y) oporności, farmakokinetyka): β-laktamy, aminoglikozydy,
makrolidy i ketolidy, linkozamidy, glikopeptydy, tetracykliny, tigecyklina, polimyksyny,
oksazolidynony, fluorochinolony, sulfonamidy.
Metody oznaczania wrażliwości bakterii i grzybów na antybiotyki:
- metoda krążkowo-dyfuzyjna (omówienie)
- metoda seryjnych rozcieńczeń w podłożu bulionowym MH – oznaczanie MIC i MBC
(demonstracja)
- oznaczanie MIC metodą E-testu (demonstracja)
- metoda rozcieńczenia leku w pożywce Loewensteina-Jensena dla prątków gruźlicy (demonstracja )
Część praktyczna:
Wykonanie antybiogramu metodą krążkowo-dyfuzyjną dla wybranych szczepów bakterii:
Staphylococcus aureus MRSA i MLSB z ropy
Pseudomonas aeruginosa MBL(+) z ropy
Klebsiella pneumoniae ESBL(+) z plwociny - zapalenie płuc
ĆWICZENIE 7 (13-16.I.2014)
TEMAT: ANTYBIOTYKI cz. II. MECHANIZMY OPORNOŚCI
Część teoretyczna:
Omówienie wybranych mechanizmów oporności bakterii na antybiotyki: MRS, MLSB, VISA, VRSA, HLAR,
VRE, MBL, ESBL, KPC
Część praktyczna:
Odczyt i interpretacja antybiogramów z poprzedniego ćwiczenia.
Odczyt antybiogramów przygotowanych metodą ATB dla różnych szczepów bakterii.
Wykonanie testu z cefinazą – wykrywanie beta-laktamaz u Moraxella.
Demonstracja antybiogramu Enterococcus faecalis HLAR z krwi (zapalenie wsierdzia)
Demonstracja antybiogramu Enterococcus faecalis VRE –E test
Demonstracja testu do wykrywania MBLB
Demonstracja E-testu do wykrywania ESBL
Demonstracja E-testu do wykrywania MBL
Demonstracja testu do wykrywania KPC
Nosicielstwo S. aureus – antybiogram
Wrocław, 2013-06-20
Kierownik Katedry i Zakładu Mikrobiologii
Dr hab. Grażyna Gościniak prof. nadzw.
-4-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
________________________________________________________________________________
PROGRAM ĆWICZEŃ Z MIKROBIOLOGII DLA STUDENTÓW III ROKU WYDZIAŁU
LEKARSKIEGO W ROKU AKADEMICKIM 2013/2014 semestr letni
OGÓLNY PLAN ĆWICZEŃ Z MIKROBIOLOGII
Semestr letni
5 tygodni x 3 godz.
2 tygodnie x 2 godz = 19 godz.
Ćwiczenie 8.
24.II – 27.II. 2014
Podstawy diagnostyki chorób grzybiczych.
Kolokwium II (5-7)
Ćwiczenie 9. Flora fizjologiczna.
10.III – 13.III 2014
Zakażenia górnych i dolnych dróg
oddechowych
Ćwiczenie 10. Zakażenia układu
24.III – 27.III 2014
moczowego i pokarmowego
Ćwiczenie 11. Zakażenia skóry i tkanek
07.IV – 10.IV 2014
miękkich. Choroby przenoszone drogą
płciową.
Kolokwium III (8-10)
Ćwiczenie 12. Zakażenia
ogólnoustrojowe (sepsa) i ośrodkowego
układu nerwowego
Ćwiczenie 13. Podstawy diagnostyki
24.IV.2014(gr. czwartkowa)
28.IV – 30.IV
(gr. poniedziałek-środa)
12.V – 15.V 2014
chorób wirusowych. (Ćw. 2h)
Kolokwium IV (11-12)
Ćwiczenie 14. Egzamin praktyczny
26.V – 29.V 2014
(Ćw. 2h)
SZCZEGÓŁOWY PLAN ĆWICZEŃ Z MIKROBIOLOGII
ĆWICZENIE 8 (24-27.II.2014)
TEMAT: PODSTAWY DIAGNOSTYKI CHORÓB GRZYBICZYCH.
KOLOKWIUM II (z ćwiczeń 5-7)
Część teoretyczna:
♦
Omówienie najczęściej występujących przypadków grzybic miejscowych i układowych oraz
czynników etiologicznych (Candida, Cryptococcus, Aspergillus).
Omówienie pobierania, przesyłania i zasad hodowli grzybów chorobotwórczych.
Charakterystyka najważniejszych grup leków przeciwgrzybicznych: polieny (nystatyna, natamycyna,
amfoteryczna B), imidazole, triazole, antymetabolity (5-fluorocytozyna), echinokandyny.
♦
♦
Część praktyczna:
Identyfikacja grzybów drożdżopodobnych:
- obserwacja morfologii hodowli na podłożu Sabourauda i Chromagar Candida,
- obserwacja blastospor i artrospor w preparatach barwionych metodą Grama,
- odczyt testu filamentacji (wykonanie preparatów natywnych),
- obserwacja charakterystycznych struktur (chlamydospor) w mikrohodowli,
- odczyt testu ID 32 C.
Identyfikacja grzybów pleśniowych i dermatofitów:
- obserwacja morfologii hodowli Aspergillus i Penicillium na podłożu Czapka,
- wykonanie preparatów w laktofenolu i obserwacja charakterystycznych konidioforów.
- obserwacja gotowych preparatów dermatofitów w laktofenolu (Trichophyton, Epidermophyton,
Microsporum).
Oznaczanie wrażliwości grzybów metodą Fungi-Test (demonstracja)
-5-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
Przygotowanie do następnego ćwiczenia. Opracowanie próbek z dróg oddechowych.
1. Pacjent z anginą,
2. Pacjent (pozaszpitalny) z zapaleniem płuc,
3. Pacjent z zapaleniem płuc (hospitalizowany na OIOM).
ĆWICZENIE 9 (10-13.III.2014)
TEMAT: FLORA FIZJOLOGICZNA. ZAKAŻENIA GÓRNYCH I DOLNYCH
DRÓG ODDECHOWYCH
Część teoretyczna:
♦
♦
♦
Omówienie roli flory endogennej człowieka.
Omówienie postaci klinicznych oraz etiologii zakażeń górnych i dolnych dróg oddechowych.
Schemat badania mikrobiologicznego. Pobieranie i przesyłanie próbek do badania.
Część praktyczna:
♦
Odczyt posiewów próbek z zakażeń dróg oddechowych:
♦
Demonstracja hodowli wybranych patogenów górnych dróg oddechowych: Staphylococcus aureus,
Corynebacterium diphtheriae. Demonstracja bezpośredniego z wymazu z gardła chorego na anginę
Plauta-Vincenta.
Opracowanie materiałów diagnostycznych do następnego ćwiczenia: ZAKAŻENIA UKŁADU
MOCZOWEGO i POKARMOWEGO.
Materiał 1 - mocz,
Materiał 2 - mocz,
Materiał 3 - wymazu z odbytu.
ĆWICZENIE 10 (24-27.III.2014)
TEMAT: ZAKAŻENIA UKŁADU MOCZOWEGO i POKARMOWEGO
Część teoretyczna:
Omówienie czynników etiologicznych zakażeń układu moczowego i pokarmowego. Schemat badania
mikrobiologicznego moczu. Pobieranie i przesyłanie materiałów diagnostycznych do badania.
Część praktyczna:
Odczyt posiewów materiałów diagnostycznych:
DEMONSTRACJE:
demonstracja hodowli wybranych patogenów układu moczowego: E. coli, Klebsiella spp., Proteus
spp., Staphylococcus epidermidis, S. saprophyticus, S. aureus, Enterococcus faecalis, Candida
albicans.
demonstracja hodowli wybranych patogenów układu pokarmowego: Salmonella spp., Shigella spp.,
Escherichia coli, Yersinia enterocolitica, Campylobacter jejuni.
demonstracja testu Golda – wynik dodatni i ujemny.
demonstracja wyniku posiewu moczu zanieczyszczonego – 4 szczepy: pałeczki lac(+) i lac(-),
Enterococcus, Staphylococcus.
demonstracja gotowych preparatów ww. patogenów w mikroskopie świetlnym.
demonstracja gotowych zestawów do półilościowego posiewu moczu: Uriline, Uricult.
demonstracja testu do wykrywania rotawirusów i adenowirusów w kale: Rota-Adeno Kit.
demonstracja odczynu Widala
Opracowanie materiałów diagnostycznych do następnego ćwiczenia: ZAKAŻENIA SKÓRY
i TKANEK MIĘKKICH”.
Materiał 1.
Pacjent z ropniem podprzeponowym,
Materiał 2.
Pacjent z czyrakiem mnogim,
Materiał 3.
Pacjent z raną po oparzeniu.
-6-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
ĆWICZENIE 11 (07-10.04.2014)
TEMAT: ZAKAŻENIA SKÓRY i TKANEK MIĘKKICH. CHOROBY PRZENOSZONE
DROGĄ PŁCIOWĄ
KOLOKWIUM III (z ćwiczeń 8-10)
I.
ZAKAŻENIA SKÓRY I TKANEK MIĘKKICH
Część teoretyczna
Omówienie czynników etiologicznych zakażeń skóry i tkanek miękkich. Schemat badania
mikrobiologicznego ropy. Pobieranie i przesyłanie próbek do badania.
Część praktyczna
Odczyt posiewów próbek ze zmian ropnych, identyfikacja szczepów, interpretacja antybiogramów.
Demonstracja hodowli wybranych patogenów zakażeń skóry i tkanek miękkich: Escherichia coli,
Pseudomonas aeruginosa, Staphylococcus aureus, Bacteroides fragilis.
Demonstracja gotowych preparatów ww. patogenów w mikroskopie świetlnym.
II.
CHOROBY PRZENOSZONE DROGĄ PŁCIOWĄ (STD)
Część teoretyczna
Omówienie zakażeń przenoszonych drogą płciową oraz czynników etiologicznych STD.
Część praktyczna – ćwiczenie demonstracyjne
Diagnostyka kiły:
USR i TPHA do odczytu i interpretacji
FTA-ABS i ELISA do omówienia
preparat srebrzony z tkanki mózgowej
Diagnostyka rzeżączki (GU):
hodowla gonokoków na podłożu Roiron
wykonanie testu na oksydazę
demonstracja preparatu z ropy rzeżączkowej
omówienie testu przesiewowego Gonoline Duo 2
Diagnostyka rzęsistkowicy:
- demonstracja preparatu z Trichomonas vaginalis (Giemsa)
Diagnostyka NGU:
hodowla Mycoplasma hominis
Mycoplasma IST-test do odczytu i interpretacji
Chlamydia trachomatis (zakażona linia komórkowa Mc Coy’a - zdjęcie)
Diagnostyka grzybicy dróg rodnych - odwołanie do ćwiczenia z mikologii.
OPRACOWANIE MATERIAŁÓW DIAGNOSTYCZNYCH DO NASTĘPNEGO
ĆWICZENIA: ZAKAŻENIA OGÓLNOUSTROJOWE (SEPSA). ZAKAŻENIA
ÓŚRODKOWEGO UKŁADU NERWOWEGO.
Materiał 1.
a)
b)
c)
Materiał 2.
Pacjent z zapaleniem opon mózgowo-rdzeniowych:
płyn mózgowo-rdzeniowy,
próbka płynu mózgowo-rdzeniowego w jałowej probówce:,
krew.
Pacjent z zapaleniem wsierdzia.
-7-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
Pacjent z zakażeniem odcewnikowym. ĆWICZENIE 12 (24.IV.2014 grupy
czwartkowe; 28-30.IV.2014 grupy poniedziałek-środa)
TEMAT: ZAKAŻENIA OGÓLNOUSTROJOWE (SEPSA). ZAKAŻENIA
OŚRODKOWEGO UKŁADU NERWOWEGO
Materiał 3.
Część teoretyczna
Omówienie czynników etiologicznych zakażeń ogólnoustrojowych i CUN. Schemat badania
mikrobiologicznego krwi i płynu mózgowo-rdzeniowego. Pobieranie i przesyłanie próbek do badania.
Część praktyczna
Odczyt posiewów próbek krwi i płynu mózgowo-rdzeniowego oraz interpretacja antybiogramów:
Demonstracja hodowli wybranych patogenów zakażenia krwi i centralnego układu nerwowego:
Neisseria meningitidis, Streptococcus agalactiae, Streptococcus salivarius, Staphylococcus
epidermidis, Escherichia coli, Enterobacter cloacae, Haemophilus influenzae (różnicowanie Casman
+ BX, demonstracja testu API NH), Candida albicans
Demonstracja gotowych preparatów z w/w drobnoustrojów w mikroskopie świetlnym.
Demonstracja podłoży transportowo-namnażających do posiewu płynów ustrojowych.
Demonstracja aparatu Bact Alert do hodowli próbek płynów ustrojowych.
ĆWICZENIE 13 (12-15.V.2014)
TEMAT: PODSTAWY DIAGNOSTYKI ZAKAŻEŃ WIRUSOWYCH
KOLOKWIUM IV (z ćwiczeń 11-12)
Część teoretyczna
♦
♦
♦
Pobieranie i przesyłanie materiałów do badań wirusologicznych.
Metody hodowli wirusów.
Odczyny serologiczne w diagnostyce chorób wirusowych.
Część praktyczna
♦
♦
♦
♦
Demonstracja zakażonych wirusami linii komórkowych ( efekt cytopatyczny).
Demonstracja hodowli wirusów bakteryjnych (łysinki).
Demonstracja odczynu Hirsta ( miareczkowanie wirusa) i Hirsta-Salka.
Demonstracja odczynu ELISA.
ĆWICZENIE 14 (26-29.V.2014)
TEMAT: EGZAMIN PRAKTYCZNY
UWAGA:
Materiały teoretyczne do ćwiczeń diagnostycznych znajdują się na stronie internetowej
Katedry: www.mbio.am.wroc.pl
Wrocław, 2013-06-20
Kierownik Katedry i Zakładu Mikrobiologii
Dr hab. Grażyna Gościniak prof. nadzw.
-8-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)