136
Fauna
fot. M. Perkowski
137
138
fot. M. Pruszyński
7
Bezkręgowce wodne
Narwiańskiego Parku
Narodowego
Wody Narwi w granicach Narwiańskiego Parku Narodowego cechują się dużą różnorodnością gatunkową bezkręgowców występujących zarówno w nurcie rzeki, w jej
dopływach, a zwłaszcza w starorzeczach, mimo braku
większej liczby gatunków „specjalnej troski”, rzadkich
i chronionych prawnie. Fauna bezkręgowców wodnych
Narwiańskiego Parku Narodowego czeka jednak na wyczerpujące opracowanie. Zgodnie z danymi zebranymi
w ramach planu ochrony na tym obszarze występuje ponad
200 gatunków wrotków, ok. 70 gatunków skorupiaków
planktonowych i ponad 250 gatunków makrobezkręgowców wodnych (Górniak 2013)1.
W ekosystemach wodnych Narwiańskiego Parku Narodowego stwierdzono 218 gatunków wrotków Rotifera.
O dużym bogactwie gatunkowym zespołów wrotków decyduje różnorodność i charakter troficzny siedlisk, specyfika szaty roślinnej oraz układ hydrologiczny Narwi. Zróżnicowanie ilościowe i gatunkowe zespołów Rotifera jest
odmienne w poszczególnych siedliskach. Wzrost tempa
przepływu wody ma zasadniczy wpływ na zagęszczenie tej
grupy bezkręgowców. Najwyższe zagęszczenie i różnorodność fauny Rotifera stwierdzono w starorzeczach i odnogach rzeki, gdzie przepływ wody jest znikomy. Dodatkowym czynnikiem wpływającym na różnorodność i liczebność wrotków jest obfitość roślinności wodnej występującej
w starorzeczach i odnogach Narwi.
W wodach Narwi w granicach Parku Narodowego występuje 71 gatunków skorupiaków planktonowych (Crustacea). Podobnie jak w przypadku wrotków, największe bogactwo gatunkowe i zagęszczenie zooplanktonu skorupiakowego odnotowano w starorzeczach i odnogach rzeki.
W Narwiańskim Parku Narodowym stwierdzono 255
gatunków makrobezkręgowców wodnych z 87 rodzin (Tab.
7.1). Znajduje się wśród nich 13 gatunków zagrożonych
i rzadkich. Należą do nich m.in. nadecznik stawowy Euspongilla lacustris (reprezentujący gąbki Porifera), Dina lineata i Piscicola pojmanskae (pijawki), Baetis liebenaue (z
rzędu jętek), Odontomyia ornata (muchówka z rodziny
lwinkowatych Stratiomyidae), ślimaki – błotniarka otułka
Lymnea glutinosa, zawójka Valvata pulchella, zatoczki:
obrzeżony Planorbis carinatus, moczarowy Anisus spirorbis i łamliwy A. vorticulus oraz małże – skójka gruboskorupowa Unio crassus i szczeżuja spłaszczona Anodonta complanata (por. Ryc. 9.9).
Jednym z bardzo ważnych czynników wpływających na
stan ekosystemów wodnych oraz fauny ich bezkręgowców
jest eutrofizacja. Azot i fosfor, dostając się do wód, wywołują zwiększoną produkcję biomasy, która następie jest deponowana na dnie, co z kolei skutkuje znaczącym obniżeniem stopnia natlenienia wody. Czynniki troficzne wpływają na zmianę struktury organizmów wodnych na korzyść
detrytusożerców i dominacji zielenic nitkowatych oraz
sinic w planktonie. Konsekwencją jest ustępowanie makrofitów i upraszczanie struktury biotycznej starorzeczy oraz
wód płynących.
Wody Narwiańskiego Parku Narodowego są narażone
na umyślne lub nieprzemyślane wprowadzanie egzotycznych gatunków wodnych z akwariów. Na zespoły mięczaków, w tym gatunki chronione, np. Unio crassus niekorzystny wpływ ma również populacja norki amerykańskiej.
Literatura
Górniak A. (kier.) 2013. Operat ekosystemów wodnych. Plan
ochrony Narwiańskiego Parku Narodowego (mscr. w archiwum Narwiańskiego Parku Narodowego).
1
Tekst jest wyciągiem z materiałów operatu ekosystemów
wodnych Narwiańskiego Parku Narodowego (Górniak 2013).
139
Tab. 7.1 Lista gatunków wybranych grup bezkręgowców wodnych
występujących w Narwiańskim Parku Narodowym (Górniak 2013)
Gromada
Rząd
Rodzina
Gatunek
Gąbki Porifera
Ephydatia fluviatilis L.
Gąbki pospolite Demospongiae
Haplosclerida
Spongillidae
Anthoathecata
Hydridae
Ephydatia mülleri Lieberkhün
Euspongilla lacustris L.
Sp. novum
Parzydełkowce Cnidaria
Stułbiopławy Hydrozoa
Hydra vulgaris Pallas
Pelmatohydra oligactis Pallas
Płazińce Platyhelminthes
Dendrocoelidae
Wirki Turbellaria
Tricladida
Dugesiidae
Planariidae
Bdellocephala punctata Pallas
Dendrocoelum lacteum O. F. Müller
Dugesia polychroa Schmidt
Planaria torva O. F. Müller
Polycelis nigra O. F. Müller
Pierścienice Annelida
Lumbriculida
Lumbriculidae
Naididae
Skąposzczety Oligochaeta
Tubificida
Tubificidae
Arhynchobdellida
Erpobdellidae
Haemopidae
Pijawki Hirudinea
Rhynchobdellida
Glossiphonidae
Piscicolidae
140
Lumbriculus variegatus O. F. Müller
Chaetogaster langi Bretscher
Chaetogaster limnaei Baer
Dero digitata O. F. Müller
Nais communis Piguet
Nais pseudobtusa Piguet
Nais variabilis Piguet
Ophidonais serpentina O. F. Müller
Pristina aequiseta Bourne
Pristina longiseta Ehrenberg
Slavina appendiculata d’Udekem
Specaria josinae Vejdovský
Stylaria lacustris L.
Uncinais uncinata Oersted
Aulodrilus pluriseta Piguet
Limnodrilus udekemianus Claparede
Psammoryctides albicola Michaelsen
Psammoryctides barbatus Grube
Spirosperma ferox Eisen
Tubifex ignotus Štolc
Tubifex tubifex O. F. Müller
Erpobdella nigricollis Brandes
Erpobdella monostriata Lindenfeld et Pietruszyński
Erpobdella octoculata L.
Erpobdella testacea Savigny
Dina lineata O. F. Müller
Haemopis sanguisuga L.
Alboglossiphonia heteroclita L.
Glossiphonia complanata L.
Glossiphonia concolor Apáthy
Helobdella stagnalis L.
Hemiclepsis marginata O. F. Müller
Placobdella costata O. F. Müller
Theromyzon tessulatum O. F. Müller
Piscicola pojmanskae Bielecki
Gromada
Rząd
Rodzina
Gatunek
Isopoda
Amphipoda
Decapoda
Asellidae
Gammaridae
Cambaridae
Collembola
Poduridae
Plecoptera
Nemouridae
Asellus aquaticus L.
Gammarus pulex L.
Orconectes limosus Raffinesque
Podura aquatica L.
Isotomurus palustris Muller
Nemoura cinerea Retzius
Siphlonuridae
Siphlonurus aestivalis Eaton
Stawonogi Arthropoda
Pancerzowce Malacostraca
Skrytoszczękie Entognatha
Baetidae
Ephemeroptera
Heptageniidae
Leptophlebiidae
Ephemeridae
Caenidae
Owady Insecta *
Megaloptera
Planipennia
Sialidae
Sisyridae
Dytyscidae
Coleoptera
Gyrynidae
Baetis liebenaue Keffermüller
Baetis buceratus Eaton
Baetis vernus Curtis
Baetis nexus Navas
Baetis tracheatus Keffermüller et Machel
Baetis fuscatus L.
Centroptilum luteolum O. F. Müller
Cloeon dipterum L.
Cloeon inscriptum Bengtsson
Procloeon bifidum Bengtsson
Heptagenia flava Rostock
Heptagenia coerulans Rostock
Heptagenia sulphurea O. F. Müller
Kageronia fuscogrisea Retzius
Paraleptophlebia cincta Retzius
Habrophlebia fusca Curtis
Ephemera vulgata L.
Caenis horaria L.
Caenis luctuosa Burmeister
Brachycercus harrisella Curtis
Sialis lutaria L.
Sisyra nigra Retzius
Acilius (Acilius) canaliculatus Nicolai
Dytiscus circumcinctus Ahrens
Graphoderus cinereus L.
Graptodytes pictus Fabricius
Hydaticus continentalis Balfour-Browne
Hydroporus palustris L.
Hygrotus decoratus Gyllenhal
Hygrotus inaequalis Fabricius
Hygrotus versicolor Schaller
Hygrotus impressopunctatus Schaller
Hydroglyphus geminus Fabricius
Hyphydrus ovatus L.
Ilybius fuliginosus fuliginosus Fabicius
Laccophilus sp. larwy
Porhydrus lineatus Fabricius
Rhantus frontalis Marsham
Rhantus exsoletus Forster
Gyrinus aeratus Stephens
Gyrinus natator L.
Gyrinus marinus Gyllenhal
Gyrinus substriatus Stephens
141
Gromada
Rząd
Rodzina
Elmidae
Haliplidae
Helophoridae
Hydrenidae
Hydrophilidae
Noteridae
Scirtidae
Hydropsychidae
Polycentro­
podidae
Leptoceridae
Trichoptera
Limnephilidae
Hydroptilidae
Corixidae
Gerridae
Heteroptera
Vellidae
Hebridae
Mesovellidae
Naucoridae
Nepidae
Notonectidae
Pleidae
142
Gatunek
Elmis sp. larwy
Oulimnius sp. larwy
Haliplus fluviatilis Aubé
Haliplus ruficollis DeGeer
Haliplidae sp. larwy
Helophorus minutus Fabricius
Helophorus granularis L.
Hydraena palustris Erichson
Hydraena riparia Kugelan
Limnebius crinifer Rey
Limnebius parvulus Herbst
Limnebius atomus Duftschmid
Ochthebius minimus Fabricius
Anacaena lutescens Stephens
Enochrus affinis Thunberg
Enochrus coarctatus Gredler
Enochrus quadripunctatus Herbst
Hydrochara caraboides L.
Noterus crassicornis O. F. Müller
Scirtidae sp. larwy
Hydropsyche augustipennis Curtis
Hydropsyche incognita Pitsch
Neureclipsis bimaculata L.
Holocentropus picicornis Stephens
Athripsodes atterimus Stephens
Mystacides longicornis L.
Oecetis lacustris Pictet
Triaenodes bicolor Curtis
Anabolia sp. (furcata, laevis)
Glyphotaelius pellucidulus Retzius
Halesus digitatus Schrank
Ironoquia dubia Stephens
Limnephilus decipiens Kolenati
Limnephilus flavicornis Fabricius
Limnephilus lunatus Curtis
Limnephilus rhombicus L.
Potamophylax rotundipennis Brauer
Hydroptila sp.
Corixa linnaei Fieber
Callicorixa praeusta Fieber
Cymatia coleoptrata Fabricius
Sigara falleni Fieber
Sigara semistriata Fieber
Sigara striata L.
Gerris (Gerris) lacustris L.
Gerris (Limnoporus) rufoscutellatus Latreille
Microvelia reticulata Burmeister
Hebrus ruficeps Thomson
Mesovelia furcata Mulsant et Rey
Ilyocoris cimicoides L.
Nepa cinerea L.
Ranatra linearis L.
Notonecta glauca L.
Plea minutissima Leach
Gromada
Rząd
Rodzina
Chironomidae
Culicidae
Dixidae
Diptera
Simuliidae
Ephydridae
Ceratopogonidae
Tipulidae
Stratiomyidae
Lepidoptera
Pyralidae
Aranea
Cybaeidae
Pisauridae
Lycosidae
Pajęczaki Arachnida
Arrenuridae
Acari, Hydrachnidia
Eylaidae
Hydrachnidae
Hydrodromidae
Hydryphantidae
Hygrobatidae
Limnesiidae
Pionidae
Unionicolidae
Lebertiidae
Gatunek
Einfeldia sp.
Eukiefferiella sp.
Chironomus sp.
Cryptochironomus
Endochironomus sp.
Glyptotendipes sp.
Polypedilum sp.
Procladius sp.
Anophenes sp.
Dixa maculata Meigen
Dixella autumnalis Meigen
Prosimulium sp.
Eusimulium sp.
Simulium sp.
Pelina sp.
Sphaeromias fasciatus Meigen
Palpomyia lineata Meigen
Sphaeromias pictus Meigen
Culicoides sp.
Tipula lateralis Meigen
Odontomyia ornata Meigen
Odontomyia tigrina Fabricius
Cataclysta lemnata L.
Elophila nymphaeata L.
Nymphula nitidulata Hufnagel
Nymphula stagnata Donovan
Argyronecta aquatica Clerck
Dolomedes fimbricatus Clerck
Pirata piraticus Clerck
Arrenurus batillifer Koenike
Arrenurus bicuspidator Berlese
Arrenurus bruzelii Koenike
Arrenurus maculator O. F. Müller
Eylais hamata Koenike
Hydrachna globosa de Geer
Hydrodroma despiciens O. F. Müller
Hydryphantes crassipalpis Koenike
Hygrobates calliger Piersig
Hygrobates longipalpis Hermann
Limnesia fulgida C. L. Koch
Piona pusilla Neuman
Piona variabilis C. L. Koch
Piona conglobata C. L. Koch
Unionicola crassipes O. F. Müller
Lebertia insignis Neuman
Mięczaki Mollusca
Viviparidae
Monotocardia
Ślimaki Gastropoda
Basommatophora
Valvatidae
Bithyniidae
Physidae
Lymnaeidae
Viviparus contectus Millet
Viviparus viviparus L.
Valvata pulchella Studer
Bithynia tentaculata L.
Physa fontinalis L.
Lymnea auricularia L.
Lymnea glutinosa O. F. Müller
Lymnaea stagnalis L.
Lymnaea (Radix) peregra O. F. Müller
Lymnea truncatula O. F. Müller
143
Gromada
Rząd
Basommatophora
(c.d.)
Rodzina
Planorbidae
Acroloxidae
Unionoida
Unionidae
Veneroida
Sphaeridae
Ctenostomata
Plumatellidae
Małże Bivalvia
Gatunek
Anisus contortus L.
Anisus spirorbis L.
Anisus vortex L.
Anisus vorticulus Troschel
Armiger crista L.
Gyraulus albus O. F. Müller
Planorbarius corneus L.
Planorbis carinatus O. F. Müller
Planorbis planorbis L.
Segmentina nitida O. F. Müller
Acroloxus lacustris L.
Unio crassus Philipsson
Unio pictorum L.
Anodonta anatina L.
Anodonta complanata Rossmässler
Sphaerium corneum L.
Pisidium casertanum Poli
Pisidium henslowanum Shepard
Pisidium personatum Malm
Pisidium nitidum Jenyns
Pisidium subtruncatum Malm
Pisidium sp.
Mszywioły Bryozoa
Phylactolaemata
Plumatella fungosa Pallas
* Zestawienie nie obejmuje ważek Odonata, opracowanych w osobnym rozdziale (przyp. red.).
144
Astakofauna Narwiańskiego PN
W XIX wieku w wodach Polski występowały dwa gatunki
raków: rak szlachetny Astacus astacus i błotny A. leptodactylus. Dominował pierwszy z tych gatunków. W 1890 r. sprowadzono do Polski raka pręgowatego Orconectes limosus,
a w latach 1972–1979 i 1990–1991 – raka sygnałowego Pacifastacus leniusculus (Kulmatycki 1935; Leńkowa 1962; Kossakowski 1966; Kossakowski i in. 1978, 1983; Gondko, Girsztowtt 1987; Krzywosz 1994).
Zasięg występowania raka szlachetnego w Polsce ciągle
się zmniejsza. Rak błotny występuje punktowo praktycznie
na terenie całego kraju, lecz jego liczebność również jest
niska. Oba te rodzime gatunki preferują wody czyste,
o małej trofii, zaliczane do i klasy jakości. Zanieczyszczenie
środowiska i zmniejszenie się powierzchni dogodnych siedlisk, powtarzające się epizoocje dżumy raczej Aphanomyces astacorum i ekspansja raka pręgowatego są głównymi
przyczynami katastrofalnego spadku pogłowia tych gatunków. Rak szlachetny i rak błotny to gatunki zagrożone wyginięciem, umieszczone na Czerwonej Liście Zwierząt Ginących i Zagrożonych oraz na Światowej Czerwonej Liście
Gatunków Zagrożonych. Rak szlachetny jest wymieniony
także w Polskiej Czerwonej Księdze Zwierząt.
Współcześnie rak pręgowaty jest najliczniejszym gatunkiem w polskich wodach. Po sprowadzeniu na teren Polski
miał zastąpić raki szlachetne, wyniszczone w Europie przez
dżumę raczą, na którą rak pręgowaty jest odporny. Dalsze
nieprzemyślane wsiedlenia i naturalne wędrówki spowodowały, że gatunek ten obecnie występuje prawie w całym
kraju (Jażdzewski, Konopacka 1993, 1995; Strużyński,
Śmietana 1998; Mastyński 1999). Rak pręgowaty zasiedla
wszystkie rodzaje wód płynących i stojących, z wyjątkiem
wód typowo górskich. Znosi wody silnie zanieczyszczone
i zniekształcone przez zabudowę hydrotechniczną, takie jak
porty, czy kanały (Białokoz i in. 1996). Nie ma specjalnych
wymagań co do charakteru dna. Żyje zarówno w miejscach
całkiem płytkich, jak i na znacznych głębokościach (Chybowski 2007). Często występuje masowo. Opanowując
zbiorniki uprzednio zasiedlone przez raki rodzime, zajmuje
na stałe ich opuszczone stanowiska. Mając mniejsze wymagania środowiskowe zasiedla znacznie większy areał zbiornika, niż zajmowany uprzednio przez raki rodzime. Współbytowanie raka pręgowatego z rakami szlachetnym i błotnym zazwyczaj prowadzi do eliminacji tych ostatnich ze
zbiornika (Białokoz i in. 1996; Gherardi i in. 2002).
Rak sygnałowy występuje w wodach naturalnych Polski
na 18 udokumentowanych stanowiskach (Jażdżewski, Konopacka 1993, 1995; Krzywosz i in. 1995, Śmietana Krzywosz
2006). Gatunek ten, podobnie jak rak pręgowaty, jest nosicielem dżumy raczej i stanowi duże zagrożenie dla raków
rodzimych.
Na początku XX wieku w Narwi i jej dopływach występował rak szlachetny i, prawdopodobnie, rak błotny1 (Leńkowa 1962; Kossakowski 1966, 1973; K hal, Wojtas 1974;
Kossakowski, Orzechowski 1974; Jażdżewski, Konopacka
1995). Obecnie, zapewne z powodu zanieczyszczeń rzeki
i epizoocji dżumy, na terenie Narwiańskiego Parku Narodowego występuje tylko rak pręgowaty (Chybowski, Białokoz
2004). Zasiedlenie wód przez raka pręgowatego jest często
opisywane jako powrót raków i mylnie interpretowane jako
rezultat poprawy stanu środowiska. W rzeczywistości ten
rak bytuje prawie w każdych wodach. Liczebność raków
pręgowatych w poszczególnych typach wód Parku Narodowego jest zróżnicowana. Jest ona duża w korytach o powolnym nurcie i w starorzeczach, i wyraźnie zmniejsza się w korytach o dużej szybkości nurtu.
W ostatnich latach, z nieznanych jeszcze przyczyn, obserwuje się zmniejszenie populacji raka pręgowatego (Krzywosz 2004; K rzywosz, Ulikowski 2009; Krzywosz i in. 2014),
zauważalna jest też poprawa stanu środowiska wodnego.
Jednak nawet te korzystne zmiany prawdopodobnie nie pozwolą na powrót raków rodzimych, ponieważ współbytowanie raka pręgowatego z rakami rodzimymi zazwyczaj doprowadza, po pewnym czasie, do eliminacji tych ostatnich
ze zbiornika (Białokoz i in. 1992). Współbytowanie raków
rodzimych z gatunkami obcymi zdarza się wyjątkowo. Ma to
na przykład miejsce w jeziorach użytkowanych przez Instytut Rybactwa Śródlądowego, gdzie występują raki błotne
i pręgowate.
1
Raki były dawniej poławiane i, oprócz ryb, odgrywały dość
istotną rolę w handlu prowadzonym przez mieszkańców
nadrzecznych wsi, zwłaszcza pod Choroszczą i Tykocinem.
Łapano je przy pomocy samołówek, rozmieszczanych grupowo lub rzędowo, umieszczając w nich przynętę, np. żaby.
Samołówki takie wykonywano z sieci rozpinanej luźno
na małej obręczy i mocowanej do kołka wbijanego w dno
rzeki lub też w formie tzw. bębenków, czyli rodzaju żaków,
o ścianach sietnych lub z deseczek, z obustronnymi wlotami.
Raki skupowali żydowscy kupcy, a handel nimi ożywił się
bardzo po uruchomieniu kolei warszawsko-petersburskiej
w początku lat 60. XIX w., dzięki czemu można było szybko transportować je także do restauracji i hoteli w stolicy
(przyp. red.).
145
Astakofauna Narwiańskiego
Obecnie astakofauna Narwiańskiego Parku Narodowego
jest uboga, a powrót uprzednio występujących w wodach
Parku rodzimych gatunków raków, czyli raka szlachetnego
i błotnego, jest bardzo mało prawdopodobny. Reintrodukcja
któregoś z nich wydaje się być możliwa jedynie w wybranych i izolowanych od reszty wód stanowiskach.
Kossakowski J. 1973. Próba introdukcji do wód Polski raków Pacifastacus leniusculus Dana. IX Zjazd Hydrobiologów Polskich
w Poznaniu 3−8.09.1973. 115−116. PTH Poznań:
Kossakowski J., Mnich M., Kossakowski G. 1978. The first introduction of the crayfish Pacifastacus leniusculus Dana into Polish waters. Freshwater Crayfish 4: 195.
Kossakowski J., Mnich M., Kossakowski G. 1983. An attempt to raise
Łucjan Chybowski, Dariusz Ulikowski, Piotr Traczuk
juvenile crayfish Pacifastacus leniusculus Dana. Freshwater
Crayfish 5: 555−556.
Kossakowski J., Orzechowski B. 1974. Crayfish Orconectes limosus in
Literatura
Poland. [W:] Avault J. W. Jr (red.), Freshwater crayfish. Second
international symposium on freshwater crayfish. 31−47. Baton
Białokoz W., Chybowski Ł., Krzywosz T. 1996. Ginące gatunki raków
w województwie suwalskim. Zoologica Poloniae 41, Suppl.:
87−91.
Białokoz W., Krzywosz T., Chybowski Ł. 1992. Stan pogłowia oraz
warunki hodowli i ochrony raków w wodach województwa suwalskiego. PZW i UW Suwałki (mscr.).
Chybowski Ł. 2007. Morphometrics, fecundity, density, and feeding
intensity of the spinycheek crayfish Orconectes limosus (Raf.) in
natural conditions. Arch. Ryb. Pol. 15(3): 175−241.
Chybowski Ł., Białokoz W. 2004. Astakofauna Narwiańskiego Parku
niusculus Dana, do wód Polski. Roczn. Nauk. PZW 7: 81−93.
Krzywosz T. 2004. Czy to odwrót rak pręgowatego? Komun. Ryb. 5:
21−23.
Krzywosz T., Białokoz W., Chybowski Ł. 1994. Raki rodzime w województwie suwalskim. Komunikaty rybackie 1: 9−10.
Krzywosz T., Białokoz W., Chybowski Ł. 1995. Rak pręgowaty w wodach województwa suwalskiego. Komunikaty rybackie 2: 8−11.
Krzywosz T., Traczuk P., Ulikowski D. 2014. Stan raka pręgowatego
Narodowego. [W:] Banaszuk H. (red.), Przyroda Podlasia: Nar-
po ponad 120-letniej obecności w Polsce. Komun. Ryb. 2: 30−32.
wiański Park Narodowy. 316–318. Wyd. Ekonomia i Środowi-
Krzywosz T., Ulikowski D. 2009. Unknown causes a sharp decline in
sko, Białystok.
population of spiny-cheek crayfish, Orconectes limosus (Rafin-
Gherardi F., Śmietana P., L aurent P. 2002. Interaction between non-
esque). Future of Native Crayfish in Europe, Regional European
indigenous and indigenous species. Bull. Fr. Péche. Piscic. 367:
Crayfish Workshop 7−10 September 2009, Pisek, Czech Re­
899−909.
public.
Gondko R., Girsztowtt Z. 1987. Zasiedlenie wód Polski nowym ga-
Kulmatycki W. 1935. Cambarus affinis Say. Rak amerykański, nowy
tunkiem raka Pacifastacus leniusculus Dana. Kieleckie Studia Bi-
mieszkaniec wód Pomorza i Wielkopolski. Przegl. Ryb. 10/11:
ologiczne 4: 133−143.
Jażdżewski K., Konopacka A. 1993. Survey and distribution of Crustacea Malacostraca in Poland. Crustaceana 65: 176−191.
Jażdżewski K., Konopacka A. 1995. Katalog Fauny Polski. XIII, 1.
Pancerzowce, Malcostraca. Muzeum Instytutu Zoologii PAN,
Warszawa.
Khal K., Wojtas F. 1974. Przegląd krajowych gatunków z rodzaju
Branchiobdella. Zesz. Nauk. Uniw. Łódz., Ser. 2. Mat.-Przyr. 56:
3−12.
Kossakowski J. 1966. Raki. PWRiL, Warszawa.
1−16.
Leńkowa A. 1962. Badania nad przyczynami zaniku, sposobami
ochrony i restytucją raka szlachetnego Astacus astacus (L.)
w związku z rozprzestrzenianiem się raka amerykańskiego Cambarus affinis Say. Ochr. Przyr. 28: 1−38.
Mastyński J. 1999. Nasze raki – Rak pręgowaty (Orconectes limosus
Raf.). Przegląd Rybacki 3(46): 31−34.
Strużyński, W., Śmietana P. 1998. Ochrona rodzimych raków wobec
zagrożeń związanych z rozprzestrzenianiem się obcych gatunków. Przegląd Rybacki 6(43): 29−31.
Kossakowski J. 1973. The freshwater crayfish in Poland. A short re-
Śmietana P., Krzywosz T. 2006. Determination of the rate of growth
viev of economic and reaserch activities. [W:] Abrahamsson S.
of Pacifastacus leniusculus in Lake Pobłędzie, using polymodal
(red.), Freshwater crayfish. Papers from the First International
length frequency distribution Bull. Fr. Pêche Piscic 380/381:
Symposium on Freshwater Crayfish. 17−26. Hinterthal, Austria,
1229−1243.
Lund.
146
Rouge, Luisiana, USA.
Krzywosz T. 1994. Introdukcja raka sygnałowego Pacifastacus le-
Parku Narodowego
Rak szlachetny (fot. Ł. Chybowski)
Rak błotny (fot. Ł. Chybowski)
Rak szlachetny (fot. Ł. Chybowski)
147
148
fot. C. Bystrowski
8
Owady Narwiańskiego
Parku Narodowego
Stan poznania entomofauny
Narwiańskiego PN
Stan rozpoznania poszczególnych grup owadów w Narwiańskim Parku Narodowym jest bardzo nierównomierny
i na tle innych obszarów chronionych nie wypada szczególnie imponująco (Banaszak 2004). Należy tłumaczyć to
przede wszystkim stosunkowo krótką historią Parku. Od
początków XXI w. dokonał się jednak pewien postęp.
Obecnie najlepiej zbadanymi grupami są motyle dzienne
Lepidoptera: Hesperioidea i Papilionoidea (Frąckiel 1993;
Winiarska 2001; Bystrowski 2009; Deoniziak 2011)
oraz ważki Odonata (Bystrowski 1992; Jödicke 1999; Bystrowski 2003; Buczyńska i in. 2007; Bystrowski 2009;
Matos da Costa 2010, 2011). Badano również muchówki,
szczególnie komary Culicidae (Wegner 2002). Jeśli chodzi
o inne rodziny, to dostępne są tylko fragmentaryczne dane
dotyczące bzygowatych Syrphidae, rączycowatych Tachini-
dae, a także Anthomyiidae, Conopidae, Muscidae, Sciomyzidae (Bystrowski 2009, 2012). Wstępnych inwentaryzacji
doczekały się również pszczoły Hymenoptera: Apiformes
(Banaszak 2006), chruściki Trichoptera oraz wodne
chrząszcze Coleoptera i pluskwiaki różnoskrzydłe Hemiptera: Heteroptera (Buczyńska i in. 2007). W literaturze
można znaleźć również dane dotyczące występowania innych gatunków owadów, np. chrząszczy z rodziny łyszczynkowatych Nitidulidae (Lasoń 2003). Dostępne są również informacje na temat obecności na terenie Parku cennych gatunków błonkówek, tj. wymienionych w Polskiej
Czerwonej Księdze Zwierząt. Bezkręgowce (Głowaciński,
Nowacki 2004): klecanki rdzaworożnej Polistes dominulus
(Oleksa, Wiśniowski 2005) oraz smukwy kosmatej Scolia
hirta i grzebacza wielkiego Ectemnius fossorius (J. Matos da
Costa, dane niepubl.).
Marcin Sielezniew, Cezary Bystrowski
8.1 Motyle dzienne Narwiańskiego
Parku Narodowego
Marcin Sielezniew • Cezary Bystrowski •
Krzysztof Deoniziak
Do najlepiej rozpoznanych grup owadów w Narwiańskim Parku Narodowym można zaliczyć motyle dzienne.
Dwie inwentaryzacje przeprowadzone pod koniec XX w.
wykazały obecność łącznie 50 gatunków, z czego 43 zostały
znalezione przez Frąckiela (1993) i 40 przez Winiarską
(2001). Trzeba jednak zauważyć, że kilka obserwacji Frąckiela (1993) najprawdopodobniej dotyczyło terenów znajdujących poza granicami obecnego Parku Narodowego.
Chodzi tu szczególnie o bory sosnowe w pobliżu Wólki
Waniewskiej, gdzie stwierdzono obecność m.in. modraszka argusa Plebejus argus, przeplatki didymy Melitaea didyma i osadnika megery Lasiommata megera. Nie ma wątpli-
wości, że poza granicami Narwiańskiego Parku Narodowego położone jest miejsce obserwacji ogończyka
ostrokrzewowca Nordmannia ilicis, ponieważ znajdowało
się ono przy szosie z Kruszewa w kierunku Białegostoku.
W ostatnich latach przedmiotem intensywniejszych
badań stało się uroczysko Rynki (Ryc. 8.1). W czasie inwentaryzacji przeprowadzonej tam w 2009 roku wykazano
obecność 46 gatunków (Bystrowski 2009). W latach 2010
i 2011 badania te były kontynuowane w ramach pracy magisterskiej Deoniziaka (2011). Prawie jednocześnie prowadzona była inwentaryzacja strefy buforowej Narwiańskiego Parku Narodowego, która wykazała obecność 45
149
Ryc. 8.1 Siedlisko strzępotka edypusa, strzępotka soplaczka
i przeplatki diaminy w uroczysku Rynki (fot. M. Sielezniew)
gatunków (Deoniziak, Sielezniew 2012). Dobrą okazją
do poprawienia stanu wiedzy na temat najcenniejszych
motyli były prace prowadzone w latach 2012–2013 w ramach przygotowania planu ochrony dla Parku Narodowego i planu zadań ochronnych dla obszaru Natura 2000.
Niektóre powierzchnie były penetrowane również w kolejnych latach przy okazji monitoringu oraz badań poświęconych wybranym gatunkom.
Ogólny stan fauny motyli
dziennych Narwiańskiego Parku
Narodowego
Sześćdziesiąt sześć gatunków motyli dziennych stwierdzonych do tej pory w Narwiańskim Parku Narodowym
(Tab. 8.1) stanowi około 40% krajowej fauny tej grupy
(Buszko, Masłowski 2015; Sielezniew, Dziekańska
2010). Jest to stosunkowo niewiele w porównaniu z innymi
cennymi przyrodniczo obszarami województwa podlaskiego, takimi jak: Biebrzański Park Narodowy, gdzie znaleziono 98 gatunków (Frąckiel, Sielezniew 2009 i niepublikowane), Puszcza Białowieska – 114 (Buszko i in. 1996),
czy też Puszcza Knyszyńska – 101 gatunków (Klimczuk
2011; Sielezniew 2015). Wynika to przede wszystkim ze
znacznie mniejszej powierzchni, mniejszej różnorodności
siedlisk, ale także czasu trwania inwentaryzacji. Dane na
temat motyli z wymienionych obszarów chronionych są
wynikiem wieloletnich prac inwentaryzacyjnych oraz monitoringowych.
150
Nie ma danych, które by wskazywały, że jakikolwiek gatunek wyginął na terenie Parku Narodowego. Brak obserwacji modraszka argusa w uroczysku Rynki wynika prawdopodobnie z faktu, że w przeszłości pomylono go z bardzo podobnym i blisko spokrewnionym modraszkiem
idasem Plebejus idas, zajmującym na Podlasiu podobne co
argus typy siedlisk (wrzosowiska).
Z drugiej strony można przypuszczać, że dwa gatunki
obserwowane po raz pierwszy w latach 2009–2010, tj. modraszek argiades Cupido argiades i polowiec szachownica
Melanargia galathea, mogły zasiedlić teren Parku dopiero
w ostatnim czasie, biorąc pod uwagę ich ekspansję w Polsce
(Sielezniew, Dziekańska 2010). Taki scenariusz jest
prawdopodobny szczególnie w przypadku szachownicy –
gatunku trudnego do przeoczenia z racji charakterystycznego wyglądu, który w okolicach Białegostoku pojawił się
dopiero w 2007 r. w tym samym roku był obserwowany po
raz pierwszy w Biebrzańskim Parku Narodowym, aby od
2008 r. stać się stałym i powszechnym elementem lepidopterofauny tego obszaru (Frąckiel, Sielezniew 2009).
Trudno natomiast interpretować pierwsze obserwacje rusałki drzewoszka Nymphalis xantholemas (Ryc. 8.2), który
wykazuje znaczne międzysezonowe zmiany zarówno zasięgu występowania, jak i liczebności.
Z kolei w czasie prac terenowych w latach 2012–2014
stwierdzono występowanie ośmiu gatunków motyli dziennych, które do tej pory nie były znane z terenu Narwiańskiego Parku Narodowego. Niestrzęp głogowiec Aporia
crataegi został stwierdzony w okolicach Baciut. Na granicy
Parku, we wschodniej części uroczyska Rynki natrafiono
ponadto na pojedyncze osobniki ogończyka wiązowca
Strymonia w-album, a także pazika brzozowca Thecla betu-
Tab. 8.1 Gatunki motyli dziennych Lepidoptera: Papilionoidea i Hesperioidea wykazane z obszaru Narwiańskiego Parku Narodowego
w latach 1993–2013 (Frąckiel 1992; Bystrowski 2009; Deoniziak 2011; Winiarska 2001 oraz własne niepublikowane dane zebrane
w latach 2012–2014)
Lp
Nazwa polska
Nazwa naukowa
1993
2000
2009–2014
Powszelatki
Hesperiidae
1.
Powszelatek malwowiec
2.
Rojnik morfeusz
Pyrgus malvae L.
-
-
+
Heteropterus morpheus Pall.
+
+
+
3.
Karłątek ryska
Thymelicus lineola Ochs.
+
+
+
4.
Karłątek kniejnik
Ochlodes faunus Turati
+
-
+
5.
Karłątek leśny
Thymelicus sylvestris Poda
-
-
+
6.
Karłątek klinek
Hesperia comma L.
-
-
+
Pazie
Papilionidae
Paź królowej
Papilio machaon L.
+
+
+
Bielinki
Pieridae
8.
Wietek gorczycznik/irlandzki*
Leptidea sinapsis L. / juvernica Reiss.*
+
+
+
9.
Zorzynek rzeżuchowiec
Anthocharis cardamines L.
-
+
+
10.
Bielinek kapustnik
Pieris brassicae L.
+
+
+
11.
Bielinek rzepnik
Pieris rapae L.
+
+
+
12.
Bielinek bytomkowiec
Pieris napi L.
+
+
+
13.
Bielinek rukiewnik
Pontia edusa F.
+
-
-
14.
Niestrzęp głogowiec
Aporia crataegi L.
-
-
+
15.
Szlaczkoń siarecznik
Colias hyale L.
+
+
+
16.
Latolistek cytrynek
Gonepteryx rhamni L.
+
+
+
Modraszki
Lycaenidae
17.
Ogończyk śliwowiec
Satyrium pruni L.
-
-
+
18.
Ogończyk wiązowiec
Satyrium w-album Knoch
-
-
+
19.
Pazik brzozowiec
Thecla betulae L.
-
-
+
20.
Zieleńczyk ostrężyniec
Callophrys rubi L.
-
+
+
21.
Czerwończyk żarek
Lycaena phlaeas L.
+
+
+
22.
Czerwończyk nieparek
Lycaena dispar Haw.
-
+
+
23.
Czerwończyk dukacik
Lycaena virgaureae L.
+
+
+
24.
Czerwończyk uroczek
Lycaena tityrus Poda
+
+
+
25.
Czerwończyk zamgleniec
Lycaena alciphron Rott.
+
+
+
26.
Czerwończyk płomieniec
Lycaena hippothoe L.
-
-
+
27.
Modraszek wieszczek
Celastrina argiolus L.
-
+
+
28.
Modraszek argiades
Cupido argiades Pall.
-
-
+
29.
Modraszek idas
Plebejus idas L.
-
+**
+
30.
Modraszek alkon
Phengaris (=Maculinea) alcon Den. et Schiff.
-
-
+
31.
Modraszek ikar
Polyommatus icarus Rott.
+
+
+
32.
Modraszek amandus
Polyommatus amandus Schn.
+
-
+
33.
Modraszek dafnid
Polyommatus daphnis Den. et Schiff.
-
-
+
Rusałki
Nymphalidae
34.
Dostojka laodyce
Argynnis laodice Pall.
+
+
+
35.
Dostojka malinowiec
Argynnis paphia L.
+
+
+
36.
Dostojka aglaja
Argynnis aglaja L.
+
-
+
37.
Dostojka latonia
Issoria lathonia L.
+
+
+
38.
Dostojka selene
Boloria selene Den. et Schiff.
+
+
+
39.
Dostojka dia
Boloria dia L.
+
+
+
40.
Dostojka ino
Brenthis ino Rott.
-
-
+
7.
151
Lp
Nazwa polska
Nazwa naukowa
1993
2000
2009–2014
41.
Rusałka admirał
Vanessa atalanta L.
+
+
+
42.
Rusałka osetnik
Vanessa cardui L.
+
+
+
43.
Rusałka pawik
Aglais io L.
+
+
+
44.
Rusałka pokrzywnik
Aglais urticae L.
+
+
+
45.
Rusałka ceik
Polygonia c-album L.
+
+
+
46.
Rusałka kratkowiec
Araschnia levana L.
+
+
+
47.
Rusałka żałobnik
Nymphalis antiopa L.
+
+
+
48.
Rusałka drzewoszek
Nymphalis xanthomelas Esp.
-
-
+
49.
Przeplatka atalia
Melitaea athalia Rott.
+
+
+
50.
Przeplatka didyma
Melitaea didyma Esp.
-
-
+
51.
Przeplatka cinksia
Melitaea cinxia L.
-
-
+
52.
Przeplatka diamina
Melitaea diamina Lang
-
-
+
53.
Przeplatka britomartis
Melitaea britomartis Assm.
-
-
+
54.
Mieniak strużnik
Apatura ilia Den. et Schiff.
-
+
+
55.
Mieniak tęczowiec
Apatura iris L.
+
-
+
56.
Osadnik egeria
Pararge aegeria L.
-
+
+
57.
Osadnik megera
Lasiommata megera L.
-
-
+
58.
Strzępotek soplaczek
Coenonympha tullia Mull.
+
+
+
59.
Strzępotek edypus
Coenonympha oedippus Fabr.
-
+
+
60.
Strzępotek perełkowiec
Coenonympha arcania L.
+
+
+
61.
Strzępotek glycerion
Coenonympha glycerion Borkh.
+
-
+
62.
Strzępotek ruczajnik
Coenonympha pamphilus L.
+
+
+
63.
Przestrojnik trawnik
Aphantopus hyperantus L.
+
+
+
64.
Przestrojnik likaon
Hyponephele lycaon Rott.
-
-
+
65.
Przestrojnik jurtina
Maniola jurtina L.
+
+
+
66.
Polowiec szachownica
Melanargia galathea L.
-
-
+
Uwagi: z listy gatunków przedstawionych przez Frąckiela (1993) usunięto gatunki obserwowane poza aktualnymi granicami NPN; *
pewne odróżnienie od siebie tych dwóch gatunków wymaga wypreparowania narządów rozrodczych; ** figurujący w zestawieniu Winiarskiej (2001) Plebejus argus, został zastąpiony przez P. idas, ponieważ aktualne obserwacje wskazują na to, że najprawdopodobniej
doszło do pomyłki
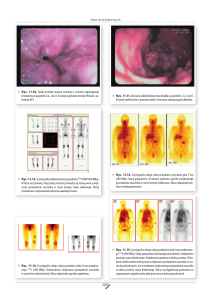
Ryc. 8.2 Rusałka drzewoszek (fot. I. Dziekańska)
152
lae. Jeden osobnik modraszka dafnida Polyommatus daphnis – samiec spijający nektar z kwiatostanu krwawnicy został zaobserwowany na skraju torfowiska w okolicach
Uhowa. Siedlisko lęgowe gatunku, tj. miejsce licznego występowania jedynej rośliny żywicielskiej, cieciorki pospolitej Coronilla varia, znajduje się poza Parkiem, w odległości
około 500 m od jego granic.
Szczególnie interesującym miejscem okazał się być grądzik znajdujący się na południe od wsi Bokiny (Ryc. 8.3).
Znaleziono na nim cztery gatunki nowe dla fauny Narwiańskiego Parku Narodowego: modraszka alkona Phengaris alcon (Ryc. 8.4), przeplatkę didymę Melitaea didyma,
przeplatkę britomartis M. britomartis (Ryc. 8.5) oraz przestrojnika likaona Hyponephele lycaon. Trzy pierwsze z wymienionych gatunków zasługują na troskę konserwatorską.
Wciąż można spodziewać się odnalezienia kilku kolejnych gatunków, choć biorąc pod uwagę charakter i powierzchnię Parku znaczne wydłużenie listy motyli dziennych wydaje się mało prawdopodobne. Nie należy wykluczyć, że kilka gatunków w przeszłości zniknęło
niepostrzeżenie na skutek lokalnej intensyfikacji koszenia
albo wypasu lub też w wyniku sukcesji roślinności wynikającej z zaniechania jakiegokolwiek użytkowania.
Ryc. 8.3 Stanowisko modraszka alkona na grądziku k. wsi Bokiny
(fot. M. Sielezniew)
Ryc. 8.6 Samiec czerwończyka nieparka
(fot. M. Sielezniew)
Ryc. 8.4 Samiec modraszka alkona (fot. M. Sielezniew)
Ryc. 8.7 Samica strzępotka edypusa (fot. M. Sielezniew)
Ryc. 8.5 Przeplatka britomartis na przetaczniku
(fot. M. Sielezniew)
Na terenie Parku Narodowego stwierdzono występowanie czterech gatunków znajdujących się pod ochroną prawną w Polsce (na podstawie Rozporządzenia Ministra Środowiska z dnia 6 października 2014 r. w sprawie ochrony
gatunkowej zwierząt). Są to czerwończyk nieparek Lycaena
dispar (Ryc. 8.6) – wykazywany z grobli pod Kurowem,
uroczyska Rynki oraz wschodniej części obszaru (Winiarska 2001; Bystrowski 2009; Deoniziak 2011, Sielezniew niepublikowane); modraszek alkon – stwierdzony po
raz pierwszy w czasie inwentaryzacji w 2012 r.; strzępotek
edypus Coenonympha oedippus (Ryc. 8.7) wykazany na
grobli pod Kurowem przez Winiarską (2001) i znaleziony
ponownie w czasie inwentaryzacji uroczyska Rynki (Bystrowski 2009) oraz strzępotek soplaczek C. tullia (Ryc.
8.8) obserwowany na bagnie Biel (Frąckiel 1993), grobli
pod Kurowem (Winiarska 2001) i w uroczysku Rynki
(Bystrowski 2009). Czerwończyk nieparek i strzępotek
edypus figurują również w załącznikach II i IV Dyrektywy
Siedliskowej. Wśród motyli objętych ochroną wymieniane
były również paź królowej Papilio machaon, mieniak strużnik Apatura ilia i mieniak tęczowiec A. iris. Trzeba jednak
zauważyć, że wszystkie one zostały usunięte w 2004 roku
z listy gatunków chronionych, a wcześniejsza na niej obecność wynikała raczej z walorów estetycznych niż zagrożeń.
Dwa gatunki motyli znane z Narwiańskiego Parku Narodowego, tj. strzępotek edypus i strzępotek soplaczek znala153
Ryc. 8.8 Samica strzępotka soplaczka (fot. M. Sielezniew)
Ryc. 8.9 Samica przeplatki diaminy na kozłku (fot. M. Sielezniew)
zły się na Czerwonej Liście Motyli Europy (Van Swaay
i in. 2002) ze statusem odpowiednio EN (endangered, zagrożone) i VU (vulnerable, narażone na wyginięcie).
Do innych odnotowanych wcześniej cennych faunistycznie gatunków należy zaliczyć gatunki z polskiej czerwonej listy: przeplatkę diaminę Melitaea diamina (Ryc. 8.9;
status VU), znalezioną na uroczysku Rynki (Bystrowski
2009) oraz rojnika morfeusza Heteropterus morpheus –
(NT, near threatened, bliski zagrożenia) obserwowanego
na grobli pod Kurowem, bagnie Biel i uroczysku Rynki
(Frąckiel 1993; Winiarska 2001; Bystrowski 2009).
Intensywna penetracja Parku Narodowego w celu znalezienia innych cennych gatunków okazała się bezowocna,
choć lokalnie stwierdzono występowanie potencjalnych
siedlisk lęgowych, w tym obecność roślin żywicielskich.
Najbardziej prawdopodobne wydawało się znalezienie
czerwończyka fioletka Lycaena helle – gatunku z II załącznika Dyrektywy Siedliskowej, szczególnie, że stwierdzony
on został w strefie buforowej Parku w okolicach Choroszczy (Deoniziak, Sielezniew 2012), a ponadto występuje
w Biebrzańskim Parku Narodowym (Frąckiel, Sielezniew 2009), w Puszczy Knyszyńskiej, a nawet na terenie
Białegostoku (Klimczuk 2011; Klimczuk i Sielezniew
154
niepublikowane). W Narwiańskim Parku Narodowym
czerwończyk fioletek mógłby potencjalnie występować
w uroczysku Rynki oraz na grądzikach Jesionki, gdzie został znaleziony rdest wężownik Polygonum bistorta, którego liście są jedynym pokarmem gąsienic. Roślina ta rośnie
m.in. także na północ do Suraża na skraju intensywnie koszonych łąk przy wschodniej granicy Parku. Obserwacje
z Podlasia wskazują, że intensywne użytkowanie nie sprzyja rdestowi wężownikowi i prowadzi do jego zaniku.
Nie udało się również znaleźć innych „naturowych” gatunków, w tym przeplatki aurinii Euphydryas aurinii znanej z Puszczy Białowieskiej, Doliny Nurca, a ostatnio
stwierdzonej także w Puszczy Knyszyńskiej (Sielezniew
2015), mimo że w 2013 r. natrafiono w okolicach Łap na jej
potencjalne siedlisko, tj. miejsce licznego występowania
rośliny żywicielskiej gąsienic, którym jest czarcikęs łąkowy
Succisa pratensis. Obecna forma użytkowania tego terenu
(ekstensywny wypas koni) również jest korzystna i wydaje
się, że introdukcja gatunku miałaby tam duże szanse powodzenia.
Grądzik Maliniak ze względu na obecność jesionów i sąsiadujących z nimi kwietnych łąk wydawał się być odpowiedni dla przeplatki maturny Euphydryas maturna występującej Puszczy Białowieskiej, a oraz w dolinie Biebrzy
(Sielezniew i Dziekańska 2016). Grądziki Maliniak, Sosnowiec, Murawiniec i Jesionki były natomiast miejscem
poszukiwań gatunków z IV załącznika Dyrektywy Siedliskowej, strzępotka hero Coenonympha hero oraz niepylaka
mnemozyny Parnassius mnemosyne, znanych z Biebrzańskiego Parku Narodowego. Drugi z tych gatunków występuje zresztą również w dolinie Narwi w okolicach Tykocina
(Bystrowski niepublikowane). Na grądziku Jesionki znaleziono również płat murawy napiaskowej z macierzanką
piaskową Thymus serpyllum – potencjalne siedlisko modraszka ariona Phengaris arion. Stanowisko to jest trudno
dostępne i nie zostało spenetrowane w czasie optymalnym
dla weryfikacji obecności gatunku, ale wydaje się ona być
mało prawdopodobna biorąc pod uwagę relatywnie niewielką powierzchnię.
Priorytetowe gatunki motyli
dziennych i ich ochrona
Czerwończyk nieparek
Czerwończyka nieparka znaleziono na 32 stanowiskach,
we wszystkich 14 kwadratach siatki1 o boku równym 5 km,
obejmujących cały teren Narwiańskiego Parku Narodowego2 i jednocześnie stosowanych w ogólnokrajowym monitoringu (Sielezniew 2015). Obserwacje stadiów preimaginalnych wskazują na szerokie rozprzestrzenienie siedlisk
lęgowych, co jest związane z rozmieszczeniem roślin żywicielskich tego gatunku. Najczęściej był wykorzystywany
szczaw lancetowaty Rumex hydrolapathum, należący do
roślin higrofilnych; w dalszej kolejności, rosnący często
w relatywnie suchych miejscach szczaw kędzierzawy
1
2
W odwzorowaniu ETRS LAEA 52.
W jednym z kwadratów gatunek odnotowano 400 m poza
granicami Parku Narodowego.
R. crispus, a okazyjnie również szczaw tępolistny R. obtusifolius. Poza granicami Parku Narodowego, w okolicach
miejscowości Baciuty, rośliną pokarmową był również inwazyjny gatunek – szczaw omszony R. confertus.
Czerwończyk nieparek jest spotykany przede wszystkim w różnego typu nieużytkowanych lub ekstensywnie
użytkowanych zbiorowiskach nieleśnych: na wilgotnych
i świeżych łąkach, pastwiskach, w zaroślach, a także szuwarach, często również tych okresowo podtapianych lub
wręcz długotrwale zalewanych. Spektrum biotopów,
w których był obserwowany obejmowało nawet widne
młode olsy, jak np. w okolicach Wólki Waniewskiej. Czerwończyk nieparek uważany za gatunek higrofilny, bywa
spotykany także w suchszych miejscach.
Biorąc po uwagę sytuację czerwończyka nieparka w Polsce i na Podlasiu, szerokie rozprzestrzenienie gatunku
w Narwiańskim Parku Narodowym nie może dziwić i nie
świadczy o wyjątkowym znaczeniu tego obszaru. Ponadto
wiele wskazuje, że nieparek wykazuje sezonowe fluktuacje
liczebności, a prawdopodobnie również swojego lokalnego
zasięgu. Zapewne areał gatunku w Parku Narodowym powiększa się latem.
Znaczna liczba stanowisk przy jednocześnie małych zagęszczeniach imagines obserwowanych lokalnie oraz duże
zdolności dyspersji sprawiają, że potencjalne zagrożenia
powinny być rozpatrywane w skali całego obszaru. Na terenach użytkowanych rolniczo częste lub prowadzone
w nieodpowiednich terminach koszenie powoduje śmiertelność stadiów preimaginalnych, a także ogranicza dostęp
gąsienic do bazy roślin żywicielskich oraz postaci dorosłych do roślin nektarodajnych. Przyczyną okresowej redukcji wielkości populacji jest najprawdopodobniej również zalewanie, szczególnie w okresie wiosennym. Innego
rodzaju zagrożeniem są zmiany składu gatunkowego zbiorowisk roślinnych, będące wynikiem sukcesji oraz ekspansji bylin, a zwłaszcza trzciny. Zarastanie obszarów nieużytkowanych drzewami i krzewami skutkuje dodatkowo
ograniczeniem przestrzeni do latania dla gatunków łąkowych, do których należy czerwończyk nieparek. Wymienione zagrożenia oddziałują jednak lokalnie, a mobilność
imagines, szerokie rozprzestrzenienie potencjalnych roślin
żywicielskich oraz różnorodność sposobów użytkowania
terenu sprawiają, że sytuacja gatunku w Narwiańskim
Parku Narodowym wydaje się być stabilna.
Strzępotek edypus
Ten jeden z najbardziej zagrożonych gatunków motyli
w Europie, w Polsce znany jest z około 10 stanowisk w województwach lubelskim i podlaskim (Sielezniew i in.
2010; Sielezniew 2012). Na terenie Parku Narodowego
występuje on wyłącznie w uroczysku Rynki, a zasiedlany
przez niego obszar liczy około 40 ha. Dokładne zdefiniowanie siedlisk lęgowych gatunku nie jest możliwe ze względu na niedostatek wiedzy o preferencjach względem składania jaj oraz o optymalnych miejscach do rozwoju. Na
pewno edypus rozwija się w północnej części torfowiska,
gdzie znajdywano pojedyncze gąsienice (Ryc. 8.10). Dotychczasowe obserwacje wskazują, że larwy żerują najprawdopodobniej na trzęślicy modrej Molinia caerulea.
Ponieważ jednak potencjalnymi roślinami pokarmowymi
Ryc. 8.10 Gąsienica strzępotka edypusa (fot. M. Sielezniew)
są również turzycowate, kwestia preferencji pokarmowych
wymaga dalszych, szczegółowych badań.
W uroczysku Rynki edypus spotykany jest zarówno na
otwartych płatach torfowiska niskiego, osiągając największe zagęszczenia przy jego północnych granicach, jak i na
torfowisku przejściowym. Motyle obserwowane były również poza granicami Parku Narodowego, na obszarach
bezpośrednio do niego przylegających. Pojedyncze osobniki spotykano wyjątkowo poza siedliskami lęgowymi, np.
w czasie pobierania nektaru na macierzankach rosnących
na wydmie oddzielającej torfowisko przejściowe od pozostałego obszaru występowania gatunku.
Obecność gatunku nie została natomiast potwierdzona
na grobli pod Kurowem, skąd był wykazywany przez Winiarską (2001). Biorąc pod uwagę, że autorka penetrowała
zarówno ten obszar, jak i uroczysko Rynki, można przypuszczać, że doszło do pomyłki, tym bardziej, że występowanie gatunku w okolicach Kurowa wydaje się być mało
prawdopodobne ze względu na charakter tamtejszych siedlisk. W 2010 r. w okresie pojawu strzępotka spenetrowano
płaty łąk z trzęślicą modrą położone przy pobliskiej reducie Koziołek, ale bez rezultatu.
Mimo, że zagęszczenia osobników w uroczysku Rynki
są raczej niewielkie, to populacja motyla jest relatywnie
liczna. W szczycie pojawu może liczyć nawet 900 osobników, a całkowitą liczebność imagines w sezonie można szacować na kilka tysięcy.
Główne zagrożenia dla populacji strzępotka edypusa są
związane z sukcesją roślinności polegającą na wkraczaniu
zarośli wierzbowych, brzozy oraz trzciny (Sielezniew i in.
2010). Niebezpieczeństwem jest także intensyfikacja użytkowania, w tym także ta związana z realizacją działań
ochronnych. Zagrożeniem może być również nawożenie
łąk sąsiadujących z siedliskiem gatunku i powodujące eutrofizację, a co za tym idzie zmiany składu gatunkowego
zbiorowisk roślinnych, w tym przyśpieszenie sukcesji
drzew i krzewów. Rzadkość gatunku sprawia, że może być
on potencjalnie także narażony na presję ze strony zbieraczy motyli.
Obecny stan wiedzy odnośnie preferencji siedliskowych
strzępotka edypusa utrudnia zaproponowanie specyficznych działań ochronnych. Wydaje się jednak, że są one
zbieżne z działaniami proponowanymi dla ochrony siedlisk otwartych. Korzystne będzie zatem przemienne, mo155
zaikowe koszenie (najlepiej ręczne), a także usuwanie nadmiaru drzew i krzewów, tak aby ich pokrycie wynosiło
10–20% siedliska gatunku.
Strzępotek soplaczek
Gatunek jest spotykany lokalnie w całej Polsce, częściej
we wschodniej części kraju, gdzie zasiedla torfowiska niskie i przejściowe oraz torfiaste łąki. W Parku Narodowym
prawdopodobnie jedynym miejscem występowania strzępotka soplaczka jest torfowisko Rynki i jego okolice. Mało
wiadomo o jego preferencjach względem roślin żywicielskich. Jak do tej pory zaobserwowano tylko jedną gąsienicę
soplaczka żerującą na turzycy tunikowej Carex appropinquata (Deoniziak 2011).
Gatunek był również obserwowany na bagnie Biel
(Frąckiel 1993) oraz przy grobli pod Kurowem (Winiarska 2001). Trudno powiedzieć czy oba stwierdzenia dotyczą tego samego miejsca i czy w przypadku Winiarskiej
(2001) nie doszło do pomyłki, tak jak jest to podejrzewane
w odniesieniu do strzępotka edypusa (a w rzeczywistości
oba gatunki występowały faktycznie w uroczysku Rynki).
Obecnie wydaje się, że w rejonie Kurowa i Radul nie ma dla
strzępotka soplaczka odpowiednich siedlisk. Być może jest
to skutek ekspansji trzciny lub innych trudnych do określenia zmian charakteru zbiorowisk roślinnych.
Ze względu na podobieństwo pod względem wykorzystywanych siedlisk zagrożenia są prawdopodobnie takie
same, jak w przypadku strzępotka edypusa. W związku
z tym wydaje się, że działania ochronne proponowane
w odniesieniu do poprzedniego gatunku będą też sprzyjać
strzępotkowi soplaczkowi. Warto przy tym podkreślić potrzebę badań ekologicznych, których celem będzie określenie preferencji siedliskowych, szczególnie identyfikacji roślin żywicielskich gąsienic.
Modraszek alkon
Gatunek został stwierdzony jedynie na grądziku w okolicach Bokin i jest to pierwsza obserwacja alkona w tej części Podlasia. W lipcu 2012 r. zaobserwowano imagines,
a w sierpniu już po zakończeniu okresu lotu przeprowadzono liczenie jaj i osłonek jajowych (Ryc. 8.11) łatwych do
znalezienia na osobnikach goryczki wąskolistnej Gentiana
pneumonanthe – roślinie żywicielskiej w początkowej fazie
rozwoju gąsienic. Inwentaryzacja wykazała, że siedlisko
lęgowe modraszka jest znacznie mniejsze niż areał
występowania goryczki i ogranicza się prawie wyłącznie do
południowej części płatu. Goryczka rośnie tam głównie
w towarzystwie trzęślicy modrej oraz pojedynczych
krzewów wierzby rokity Salix rosmarinifolia. Kilkadziesiąt
osobników goryczki wąskolistnej, na których znaleziono
większość z kilkuset osłonek jajowych porasta zwarty obszar o powierzchni ok. 0,3 ha. Liczba jaj, jak również badania z wykorzystaniem metody znakowania pozwalają oszacować wielkość populacji modraszka alkona na zaledwie
kilkadziesiąt osobników dorosłych (Sielezniew i in. niepublikowane).
Choć modraszek alkon nie jest gatunkiem „naturowym”, to niewątpliwie należy go uznać za drugiego pod
względem cenności (po strzępotku edypusie) motyla
dziennego stwierdzonego w Parku Narodowym. Na Podlasiu znany jest on z doliny Biebrzy, gdzie występuje dość
156
Ryc. 8.11 Jaja modraszka alkona na goryczce wąskolistnej
(fot. M. Sielezniew)
duża i stabilna populacja, oraz z doliny Nurca, gdzie jest
spotykany nielicznie. W 2016 r. został znaleziony także
w Puszczy Białowieskiej (Sielezniew i in. niepublikowane).
Modraszek alkon jest motylem o dość złożonej biologii.
Gąsienice przebywają początkowo w kwiatostanach goryczek, zjadając rozwijające się nasiona. Na początku ostatniego stadium spadają na ziemię i ich dalszy los zależy od
tego, czy zostaną znalezione przez robotnice pewnych gatunków mrówek wścieklic Myrmica spp. Tylko bowiem
w ich mrowiskach mają szansę na kontynuację rozwoju,
stając się pasożytami społecznymi karmionymi przez gospodarzy. Aby populacja mogła trwać, mrowiska i goryczki
muszą współwystępować w odpowiedniej liczbie i kombinacji przestrzennej.
W przypadku stanowiska w Bokinach prawdopodobnie
tylko część roślin żywicielskich rośnie w strefie penetracji
mrówek gospodarzy. Ponadto zbyt wczesne koszenie części
powierzchni ogranicza dostępność goryczek i/albo powoduje śmiertelność larw. Motylowi nie sprzyja również
uboga baza roślin nektarodajnych – imagines były obserwowane na kwiatach jasieńca piaskowego Jasione montana
oraz przetacznika kłosowego Veronica spicata i długolistnego V. longifolia.
Głównym gospodarzem modraszka alkona na stanowisku jest wścieklica uszatka Myrmica scabrinodis (Ryc. 8.12),
choć pierwsze badania sugerowały co innego. Wiosną 2013
r. przedpoczwarka motyla została znaleziona w gnieździe
Ryc. 8.12 Gąsienice modraszka alkona
w mrowisku wścieklicy uszatki
(fot. M. Sielezniew)
wścieklicy Schencka M. schencki, na podstawie czego wysnuto hipotezę, że możemy mieć do czynienia z unikalną rasą pokarmową. Późniejsze obserwacje wykazały jednak, że znaczenie wścieklicy Schencka jest drugorzędne (Sielezniew
i in. 2015).
Wyniki badań ekologicznych i genetycznych (Sielezniew i in. niepublikowane) wskazują na to, że populacja gatunku jest nie tylko bardzo niewielka, ale
również i izolowana, stąd bardzo narażona na wyginięcie. W przeszłości na stanowisku prowadzony był ekstensywny wypas, który zapewne sprzyjał siedlisku
modraszka alkona, a jego zaprzestanie skutkuje zmianami sukcesyjnymi. Rozwój zakrzaczeń oraz dominujących i ekspansywnych traw, szczególnie trzcinnika piaskowego Calamagrostis epigejos i w mniejszym stopniu trzęślicy modrej,
wpływa negatywnie na bazę roślin żywicielskich, nektarodajnych, jak również
prawdopodobnie mrówek gospodarzy. Obecnie jedynym czynnikiem hamującym zapewne te procesy jest dzika zwierzyna, której ślady można znaleźć na
stanowisku.
Zabiegi ochronne powinny mieć na celu utrzymanie licznej populacji zarówno mrówek gospodarzy, jak i rośliny żywicielskiej. Goryczka wąskolistna jest
długowieczną byliną, która rozmnaża się tylko przez nasiona. Kiełkowanie jest
możliwe jedynie na małych skrawkach odsłoniętego podłoża, których często
brakuje. W związku z tym wiele populacji tej rośliny jest w „podeszłym” wieku
i niewykluczone, że z taką sytuacją mamy do czynienia na grądziku Bokiny.
Przy braku odpowiedniego użytkowania istnieje niebezpieczeństwo, że w dłuższej perspektywie czasu goryczki wyginą, a wraz z nimi zależny od nich motyl.
Zalecanym działaniem ochronnym jest przywrócenie ekstensywnego wypasu przy użyciu bydła, które efektywnie zredukuje pokrywę dominujących traw.
Efektem wydeptywania będzie także wykreowanie mikrosiedlisk dla kiełkowania nasion goryczek. Gdyby to okazało się nieskuteczne, należy rozważyć bardziej radykalne działanie polegające na wycinaniu małych fragmentów darni.
Alternatywą jest bardziej intensywne, ale krótkotrwałe spasanie na początku
lata przed kwitnieniem goryczki albo jesienią, po wysypie nasion.
Mniej korzystne wydaje się być wprowadzenie koszenia, ponieważ może ono
stymulować trawy do tworzenia bardziej zwartej pokrywy. Koszenie powinno
być wykonywane ręcznie po osypaniu się nasion goryczek, a więc nie wcześniej
niż w połowie września. Nie powinno też dotyczyć całej powierzchni, ale przemiennie różnych fragmentów (np. pasów) siedliska.
157
Przeplatka diamina
Ten wymierający w zachodniej Polsce, ale wciąż dość
szeroko rozprzestrzeniony na wschodzie kraju gatunek, na
terenie Parku Narodowego został znaleziony na pięciu stanowiskach. Najliczniej był on obserwowany na północnych
obrzeżach uroczyska Rynki oraz na łąkach przylegających
do niego od północy, w miejscach licznego występowania
kozłka lekarskiego Valeriana officinalis, będącego rośliną
żywicielską gąsienic. Drugim rejonem występowania przeplatki diaminy są okolice Rzędzian oraz grądzik Sosnowiec, jednak tam gatunek ten jest zdecydowanie mniej liczny. W 2013 r. znaleziono nowe stanowisko diaminy na grądziku Maliniak, a rok później dużą populację również na
grądziku Bokiny.
Głównym zagrożeniem są zmiany sukcesyjne w siedliskach gatunku, a zapobiegać im można przez wprowadzenie koszenia o małej intensywności, wysoko ponad powierzchnią gruntu. Powinno mieć ono charakter przemienny i obejmować małe fragmenty siedlisk, a ponadto
być dokonywane pod koniec sezonu wegetacyjnego, najlepiej ręcznie.
Przeplatka didyma
Pojedyncze okazy przeplatki didymy były obserwowane
jedynie na grądziku Bokiny, na tym samym, na którym został znaleziony modraszek alkon. Wciąż prawdopodobne
jest odnalezienie gatunku na innych stanowiskach w Narwiańskim Parku Narodowym, np. na grądziku Jesionki
oraz w innych płatach muraw i traworośli napiaskowych,
które nie zawsze mogły być spenetrowane w odpowiednim
czasie.
Przeplatka didyma zniknęła w ostatnich dekadach
praktycznie z całej zachodniej Polski, a i na wschodzie
kraju staje się coraz rzadsza. Gąsienice żerują na niektórych roślinach zielnych, m.in. na lnicy pospolitej Linaria
vulgaris (Sielezniew, Dziekańska 2010). Na stanowisku
Bokiny gatunek wydaje się być bardzo zagrożony, a głównym czynnikiem jest wzrost pokrywy traw, głównie trzcinnika piaskowego, w efekcie zaniechania wypasu. Przeplatce didymie będą sprzyjać zabiegi nastawione na ochronę
występujących na stanowisku płatów murawy napiaskowej.
Przeplatka britomartis
Inne potrzeby ma zaobserwowana również jedynie na
grądziku Bokiny przeplatka britomartis. Ten gatunek, znany
jedynie z rozproszonych stanowisk na wschodzie i południu Polski, jest związany w stadium larwy głównie z niektórymi przetacznikami Veronica spp. Na stanowisku
w Parku rośliną żywicielską jest prawdopodobnie przetacznik długolistny. Niewiele wiadomo o ekologii tego motyla,
a co za tym idzie i potrzebach środowiskowych. Na pewno
jednak zagrażają mu zmiany o charakterze sukcesyjnym
Rusałka drzewoszek
Gatunek był stwierdzony w dwóch rejonach: w uroczysku Rynki i w okolicach Topilca, ale można podejrzewać, że
liczba stanowisk lęgowych gatunku jest w rzeczywistości
większa. Warto zauważyć, że drzewoszek jest gatunkiem
wykazującym duże wahania liczebności, a obecność na
wielu stanowiskach może być tylko skutkiem okresowych
kolonizacji (Sielezniew i Dziekańska 2010). Obserwacje
158
gatunku zbiegły się z jego ekspansją, nie sposób w związku
z tym określić, na ile jest stabilna jego sytuacja i jak będzie
kształtowała się w przyszłości. Z tych samych powodów
trudno zdefiniować potencjalne zagrożenia i zaplanować
zabiegi konkretnie pod kątem ochrony tego gatunku.
Z uwagi na zachowania rozrodcze drzewoszka, istotne wydaje się utrzymanie przestrzeni otwartych na śródbagiennych wyniesieniach mineralnych. Z kolei przy odkrzaczaniu torfowisk zawsze należy pozostawiać część wierzb
w celu zachowania bazy roślin żywicielskich gąsienic.
Podsumowanie
Narwiański Park Narodowy charakteryzuje się umiarkowanym bogactwem motyli dziennych, co wynika przede
wszystkim z jego niewielkiej powierzchni. Obszar ten zasługuje jednak na uwagę ze względu na obecność kilku interesujących gatunków, takich jak strzępotek edypus czy
modraszek alkon, które powinny stać się przedmiotem
specjalnej troski konserwatorskiej. Za najcenniejsze fragmenty Parku Narodowego pod względem dziennej lepidopterofauny należy uznać uroczysko Rynki oraz grądziki,
w tym szczególnie ten położony na południe od miejscowości Bokiny. Tereny te są również świetnymi poligonami
do badań ekologii motyli, a wnioski z nich płynące mogą
przyczynić się do bardziej skutecznej ich ochrony. Przy podejmowaniu działań ochronnych nie należy zapominać
o przywracaniu ekstensywnego wypasu, którego zaniechano praktycznie całkowicie w ostatnich 20–30 latach.
Literatura
Banaszak J. 2006. Bees (Hymenoptera: Apiformis) in the Narew
National Park. Polish Journal of Entomology 75: 511–538.
Banaszak J., Buszko J., Czachorowski S., Czechowska W.,
Hebda G., Liana A., Pawłowski J., Szeptycki A., Trojan P.,
Węgierek P. 2004. Przegląd badań inwentaryzacyjnych nad
owadami w parkach narodowych Polski. Wiadomości Entomologiczne 23 Supl. 2: 5–56.
Banaszak J., Krzysztofiak A. 1996. Natural resources of wild
bees (Apoidea, Hymenoptera) in Wigry National Park. Polskie Pismo Entomologiczne 65: 33–50.
Buczyńska E., Buczyński P., Lechowski L. 2007. Wybrane
owady wodne (Odonata, Coleoptera, Trichoptera) Narwiańskiego Parku Narodowego – wyniki wstępnych badań. Parki
Narodowe i Rezerwaty Przyrody 26: 25–40.
Buczyńska E., Cichocki W., Dominiak P. 2012. New data on
the distribution and habitat preferences of Hagenella clathrata
(Kolenati, 1848) (Trichoptera: Phryganeidae) in Poland – the
species from the Polish Red Book of Animals. Annales Universitates Mariae Curie-Skłodowska Sectio C 68: 27–34.
Buszko J., Masłowski J. 2015. Motyle dzienne Polski. Wydawnictwo „Koliber”, Nowy Sącz.
Bystrowski C. 1992. Waloryzacja entomologiczna rzędu ważki
(Odonata) w Narwiańskim Parku Krajobrazowym. Warszawa
(mscr.).
Bystrowski C. 2003. Nowe dane o występowaniu Sympetrum
pedemontanum (Allioni, 1766) (Odonata, Libellulidae) na Północnym Podlasiu. Nowy Pamiętnik Fizjograficzny 1: 209–214.
Bystrowski C. 2009. Inwentaryzacja bezkręgowców: motyli
dziennych i ważek oraz koncepcja i założenia metody monitoringu entomofauny torfowiska Rynki w Narwiańskim Parku
Narodowym. Tykocin (mscr.).
Bystrowski C. 2012. Pierwsze stwierdzenie Peleteria varia (Fabricius, 1794) (Diptera: Tachinidae) w Polsce. Dipteron 28: 2–6.
Deoniziak K. 2011. Motyle dzienne (Lepidoptera: Hesperioidea
i Papilionoidea) wybranych zbiorowisk uroczyska Rynki
w Narwiańskim Parku Narodowym. Praca magisterska.
­Instytut Biologii, Uniwersytet w Białymstoku.
Deoniziak K., Sielezniew M. 2012. Inwentaryzacja motyli
dziennych (Lepidoptera: Papilionoidea i Hesperioidea) strefy
buforowej Narwiańskiego Parku Narodowego. [W:] Suchowolec A. (red.), Ocena efektów renaturalizacji strefy buforowej
Narwiańskiego Parku Narodowego. 46–47. Polskie Towarzystwo Ochrony Ptaków, Białystok.
Frąckiel K. 1993. Inwentaryzacja motyli dziennych Papilionoidea i Hesperioidea Narwiańskiego Parku Krajobrazowego.
Białystok (mscr.).
Frąckiel K., Sielezniew M. 2009. Motyle Biebrzańskiego Parku
Narodowego. Osowiec Twierdza.
Głowaciński Z. (red.) 2002. Czerwona lista zwierząt ginących
i zagrożonych w Polsce. Instytut Ochrony Przyrody PAN
w Krakowie.
Głowaciński Z., Nowacki J. (red.) 2004. Polska czerwona księga zwierząt. Bezkręgowce. Instytut Ochrony Przyrody PAN
w Krakowie, Akademia Rolnicza im. A. Cieszkowskiego
w Poznaniu.
Jödicke R. 1999. Libellenbeobachtugen in Podlasie, Nordostpolen. Libellula 18: 31–48.
Klimczuk P. 2011. Butterflies (Lepidoptera: Hesperioidea, Papilionoidea) of the Knyszyn Forest (Puszcza Knyszyńska) and
adjacent woodland areas of Białystok. Nature Journal 44: 197–
217.
Lasoń A. 2003. Meligethes jelineki Audisio, 1976 – nowy dla
fauny Polski gatunek chrząszcza oraz nowe dane o rozsiedleniu przedstawicieli rodziny Nitidulidae (Coleoptera) na Podlasiu. Wiadomości Entomologiczne 21: 205–212.
Matos da Costa J. 2010. New data of the Odonata order in the
Narew National Park. Odonatrix 6: 33–36.
Matos da Costa J. 2011. First records of some dragonfly (Odonata) species in the Narew National Park. Odonatrix 7: 50–51.
Oleksa A., Wiśniowski B. 2005. Klecanka rdzaworożna Polistes
dominulus (Christ, 1791) (Hymenoptera: Vespidae: Polistinae)
– czy faktycznie gatunek skrajnie zagrożony w Polsce? Wiadomości Entomologiczne 24: 179–188.
Sielezniew M. 2012. Strzępotek edypus Coenonympha oedippus.
[W:] Makomaska-Juchiewicz M., Baran P. (red.), Monitoring
gatunków zwierząt. Przewodnik metodyczny. Część III. 258–
273. GIOŚ, Warszawa.
Sielezniew M. 2015. Czerwończyk nieparek Lycaena dispar.
[W:] Makomaska-Juchiewicz M., Baran P. (red.), Monitoring
gatunków zwierząt. Przewodnik metodyczny. Część III. 258–
273. GIOŚ, Warszawa.
Sielezniew M. 2015. Przeplatka aurinia Euphydryas aurinia
w Puszczy Knyszyńskiej. Chrońmy Przyrodę Ojczystą 71:
221–228.
Sielezniew M., Bystrowski C., Deoniziak K., Da Costa J. M.
2015. An unexpected record of Myrmica schencki Emery, 1895
as a secondary host ant of the hygrophilous form of a small
and isolated population of the Alcon Blue butterfly Phengaris
(=Maculinea) alcon (Denis et Schiffermüller, 1775) (Lepidoptera, Lycaenidae) in NE Poland. Polish Journal of Entomology
84: 49–59.
Sielezniew M., Dziekańska I. 2010. Motyle dzienne. Multico –
Oficyna Wydawnicza, Warszawa.
Sielezniew M., Dziekańska I. 2015. Veronica longifolia L. as an
important initial larval food plant of Scarce Fritillary Euphydryas maturna (Linnaeus, 1758) (Lepidoptera, Nymphalidae):
the ecological uniqueness of populations from the Natura
2000 area “Dolina Biebrzy” (Biebrza Valley) in NE Poland.
Polish Journal of Entomology 85: 247–259.
Sielezniew M., Pałka K., Michalczuk W., Bystrowski C.,
Hołowiński M., Czerwiński M. 2010. False Ringlet Coenonympha oedippus in Poland: state of knowledge and conservation prospects. Oedippus 1: 20–22.
Sielezniew M., Stankiewicz A. M. 2008. Myrmica sabuleti
(Hymenoptera: Formicidae) not necessary for the survival of
the population of Phengaris (Maculinea) arion (Lepidoptera:
Lycaenidae) in eastern Poland: lower host-ant specificity or
evidence for geographical variation of an endangered social
parasite? European Journal of Entomology 105: 637–641.
Van Swaay C., Cuttelod A., Collins S., Maes D., López Munguira M., Šašić M., Settele J., Verovnik, R., Verstrael T.,
Warren M., Wiemers M., Wynhoff I. 2010. European Red
List of European Butterflies. Publication Office of the European Union, Luxembourg, Luxembourg.
Wegner E. 2002. Preliminary study of mosquitoes (Diptera: Culicidae) of Narew National Park. Fragmenta Faunistica 45:
57–65.
Winiarska G. 2001. Butterflies (Lepidoptera: Hesperioidea, Papilionoidea) in Narew National Park. Fragmenta Faunistica
44: 73–78.
159
8.2 Ważki Narwiańskiego
Parku Narodowego
Cezary Bystrowski • Marcin Sielezniew
Wprowadzenie
Badania ważek Odonata doliny Narwi między Surażem,
a Rzędzianami rozpoczęły się w latach 90. ubiegłego
stulecia, kiedy to przygotowano opracowanie na potrzeby
tworzonego wówczas Narwiańskiego Parku Narodowego
(NPN). W trakcie prowadzonych badań na obszarze
obecnego Parku wykazano 22 gatunki (Bystrowski 1992).
Pierwsze publikowane dane dotyczące fauny ważek NPN
znajdują się w pracy Jödicke (1999), prezentującej wyniki
obserwacji prowadzonych przez grupę przyrodników
z Niemiec, którzy na tym terenie napotkali 12 gatunków
tych owadów. Stwierdzenie w Parku Narodowym rzadkiego gatunku – szablaka przepasanego Sympetrum pedemontanum przyniosła publikacja Bystrowskiego (2003).
Szeroko zakrojone badania ważek, w trakcie których
znaleziono 36 gatunków, zostały przeprowadzone w dolinie Narwi w roku 2002 (Buczyńska i in. 2007). Kolejne
prace inwentaryzacyjne dotyczyły uroczyska Rynki.
W 2009 r. podczas badań fauny owadów stwierdzono występowanie 23 gatunków ważek, w tym trzech nie wykazanych dotychczas w Narwiańskim Parku Narodowym: łątki
halabardówki Coenagrion hastulatum, miedziopiersi północnej Somatochlora arctica i pałątki południowej Lestes
barbarus (Bystrowski 2009). Podsumowania informacji
na temat fauny ważek NPN i jego okolic dokonał Matos
da Costa (2010), a rok później autor ten opublikował
stwierdzenia trzech kolejnych gatunków – przedstawicieli
rodzaju zalotka Leucorrhinia (Matos da Costa 2011).
Listę wszystkich 47 gatunków ważek stwierdzonych dotychczas w Narwiańskim Parku Narodowym prezentuje
tabela 8.2.
Fauna ważek Polski liczy obecnie 74 gatunki, a ostatnio
stwierdzonym (w 2016 r.) przedstawicielem tej grupy w naszym kraju był kosmopolityczny migrant, nomadka żółtawa Pantala flavescens (www.wazki.pl). Czterdzieści siedem
gatunków ważek, w tym 30 gatunków z podrzędu ważek
różnoskrzydłych i 17 ważek równoskrzydłych, znalezionych dotychczas w Narwiańskim Parku Narodowym stanowi więc blisko 2/3 fauny krajowej. Dla porównania
w Puszczy Białowieskiej stwierdzono 50 gatunków tych
owadów (Łabędzki 2001), w Poleskim Parku Narodowym
– 52 gatunki (Buczyński 2004), a w Biebrzańskim Parku
Narodowym – 54 (Henel i in. 2014).
Na liście ważek występujących w Narwiańskim Parku
Narodowym znajduje się sześć gatunków objętych ochroną
prawną. Trzy z nich podlegają ochronie ścisłej, w tym dwa
160
gatunki „naturowe” (tj. wymienione w II załączniku tzw.
Dyrektywy Siedliskowej): trzepla zielona Ophiogomphus
cecilia (Buczyńska i in. 2007) i zalotka większa Leucorrhinia pectoralis (Matos da Costa 2011), a także żagnica zielona Aeshna viridis, która została wymieniona w IV załączniku Dyrektywy. Pozostałe trzy gatunki: gadziogłówka
żółtonoga Gomphus flavipes i straszka syberyjska (północna) Sympecma paedisca (również figurujące w załączniku
IV DS) oraz miedziopierś północna Somatochlora arctica
objęte są ochroną częściową. Ta ostatnia umieszczona została ponadto w „Polskiej czerwonej księdze zwierząt”,
z kategorią zagrożenia VU (vulnerable – narażone;
Buczyński, Tończyk 2004), a w ostatniej edycji „Czerwonej listy ważek Polski” otrzymała kategorię zagrożenia EN
(endangered – zagrożone; Bernard i in. 2009). Według
„Czerwonej listy ważek Europy” (Kalkman i in. 2010)
wszystkie gatunki stwierdzone w Narwiańskim Parku Narodowym mają status LC (least concern – najmniejszej troski), za wyjątkiem żagnicy zielonej zaliczonej do kategorii
NT (near threatened – bliskie zagrożenia).
W Narwiańskim Parku Narodowym bardzo liczne,
a przez to stabilne, wydają się populacje ważek związanych
z wodami płynącymi, np. świtezianki błyszczącej Calopteryx splendens, świtezianki dziewicy C. virgo, pióronoga
zwykłego Platycnemis pennipes czy nawet gadziogłówki
pospolitej Gomphus vulgatissimus. Mniej liczne i rzadziej
notowane są gadziogłówka żółtonoga i trzepla zielona. Bardzo liczne są również gatunki eurytopowe: łątka dzieweczka Coenagrion puella, łątka wczesna C. pulchellum, miedziopierś metaliczna Somatochlora metallica i ważka czteroplama Libellula quadrimaculata. Nie wydają się
zagrożone także jakiekolwiek gatunki związane z wodami
stagnującymi i starorzeczami, np.: nimfa stawowa Enallagma cyathigerum, szablak krwisty Sympetrum sanguineum, szablak zwyczajny S. vulgatum, szklarka zielona
Cordulia aenea, żagnica wielka Aeshna grandis, żagnica
zielona A. viridis, żagnica jesienna A. mixta czy żagniczka
wiosenna Brachytron pratense. Jedyną grupą ważek, której
stabilność występowania na obszarze Narwiańskiego
Parku Narodowego jest niepewna, są tyrfobionty występujące wyłącznie w kwaśnych wodach torfowisk sfagnowych.
Należy do nich stwierdzona w ostatnich latach miedziopierś północna oraz wykazana na podstawie jednego osobnika żagnica torfowa Aeshna juncea (Buczyńska i in.
2007). W zasadzie jedynym potencjalnym miejscem rozra-
Równoskrzydłe
Zygoptera
Świteziankowate
Calopterygidae
1.
Świtezianka dziewica
Calopteryx virgo L.
+
+
+
2.
Świtezianka błyszcząca
Calopteryx splendens Har.
+
+
+
Pałątkowate
Lestidae
3.
Pałątka południowa
Lestes barbarus F.
4.
Pałątka mała
Lestes virens Charp.
5.
Pałątka niebieskooka
Lestes dryas Kirby
7.
Pałątka pospolita
Lestes sponsa Hansem.
6.
Pałątka zielona
Chalcolestes viridis Vander L.
8.
Straszka syberyjska (północna) *
Sympecma paedisca Brau.
Matos da Costa (2010, 2011)
Nazwa naukowa
Bystrowski (2009)
Buczyńska i in. (2007)
Nazwa polska
Jödicke (1999)
Lp.
Bystrowski (1992)
Tab. 8.2 Gatunki ważek (Odonata) wykazane z obszaru Narwiańskiego
Parku Narodowego (oryg.)
+
+
+
+
+
+
+
+
+
+
+
+
+
+
Łątkowate
Coenagrionidae
9.
Tężnica wytworna
Ischnura elegans Vander L.
+
+
+
10.
Nimfa stawowa
Enallagma cyathigerum Charp.
+
+
+
11.
Łunica czerwona
Pyrrhosoma nymphula Sulz.
12.
Łątka dzieweczka
Coenagrion puella L.
+
+
+
+
+
13.
Łątka wczesna
Coenagrion pulchellum Vander L.
+
+
+
+
+
14.
Łątka halabardówka
Coenagrion hastulatum Charp.
15.
Oczobarwnica większa
Erythromma najas Hansem.
+
+
+
16.
Oczobarwnica mniejsza
Erythromma viridulum Charp.
17.
Pióronóg zwykły
Platycnemis pennipes Pall.
Różnoskrzydłe
Anisoptera
+
+
+
+
+
+
+
+
+
+
+
+
Gadziogłówkowate
Gomphidae
18.
Gadziogłówka żółtonoga
Gomphus flavipes Charp.
19.
Gadziogłówka pospolita
G. vulgatissimus L.
20.
Trzepla zielona
Ophiogomphus cecilia Four.
Żagnicowate
Aeshnidae
21.
Żagniczka wiosenna
Brachytron pretense O.F. Müll.
22.
Żagnica południowa
Aeshna affinis Vander L.
+
23.
Żagnica sina
Aeshna cyanea O.F. Müll.
+
24.
Żagnica wielka
Aeshna grandis L.
25.
Żagnica (żagiew) ruda
Aeshna isoceles O.F. Müll.
+
26.
Żagnica torfowa
Aeshna juncea L.
+
27.
Żagnica jesienna
Aeshna mixta Latr.
+
+
+
28.
Żagnica zielona
Aeshna viridis Evers.
+
+
+
29.
Husarz władca
Anax imperator Leach
+
+
+
+
+
+
+
+
+
+
+
+
+
+
Szklarkowate
Corduliidae
30.
Szklarka zielona
Cordulia aenea L.
+
+
31.
Miedziopierś żółtoplama
Somatochlora flavomaculata Vander L.
+
+
+
+
32.
Miedziopierś metaliczna
Somatochlora metallica Vander L.
+
+
+
+
+
+
161
Matos da Costa (2010, 2011)
Bystrowski (2009)
Buczyńska i in. (2007)
Bystrowski (1992)
Nazwa polska
Nazwa naukowa
33.
Miedziopierś północna
Somatochlora arctica Zett.
34.
Przeniela dwuplama
Epitheca bimaculata Charp.
Ważkowate
Libellulidae
35.
Ważka płaskobrzucha
Libellula depressa L.
36.
Ważka ruda
Libellula fulva O.F. Müll.
37.
Ważka czteroplama
Libellula quadrimaculata L.
38.
Lecicha białoznaczna
Orthetrum albistylum Sél.
+
39.
Lecicha południowa
Orthetrum brunneum Fons.
+
40.
Lecicha pospolita
Orthetrum cancellatum L.
+
+
41.
Szablak żółty
Sympetrum flaveolum L.
+
42.
Szablak krwisty
Sympetrum sanguineum O.F. Müll.
+
43.
Szablak zwyczajny
Sympetrum vulgatum L.
+
44.
Szablak przepasany**
Sympetrum pedemontanum All.
+
45.
Zalotka większa
Leucorrhinia pectoralis Charp.
+
Jödicke (1999)
Lp.
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
46.
Zalotka torfowcowa
Leucorrhinia dubia Vander L.
+
47.
Zalotka czerwonawa
Leucorrhinia rubicunda L.
+
Razem
22
12
36
23
26
* gatunek znaleziony w NPN w 2016 r. (Bystrowski, niepublikowane)
** dane opublikowane, Bystrowski (2003)
dzania się tych dwóch ważek jest torfowisko przejściowe,
wchodzące w skład uroczyska Rynki. Ten niewielki obiekt
nie posiada jednak trwałego lustra wody, a w lata suche
może silnie przesychać, co stwierdzono m.in. w roku 2002
(Buczyńska i in. 2007).
W Parku Narodowym interesujące są również obserwacje gatunków południowych, nie tworzących raczej stabilnych populacji w naszych warunkach klimatycznych. Wydaje się, że obecnie stałymi elementami fauny Parku nie są
żagnica południowa Aeshna affinis i lecicha południowa
Orthetrum brunneum, które tylko wyjątkowo są w stanie
przetrwać okres zimy w Polsce (Buczyńska i in. 2007). Ich
pojawy zdarzają się w lata ciepłe, sprzyjające południowym, termofilnym gatunkom, charakteryzującym się
szybkim rozwojem larwalnym. Niektóre doniesienia na
temat żagnicy południowej dokumentują rozmnażanie się
tego gatunku w naszym kraju (Buczyński 2006).
Do rzadziej notowanych na Podlasiu gatunków znalezionych w Parku Narodowym można zaliczyć łątkę halabardówkę Coenagrion hastulatum obserwowaną na torfowisku Rynki (Bystrowski 2009) oraz w 2012 r. w uroczysku Sosnowiec koło Radul. Gatunek ten, określany jako
tyrfofil, rozwija się w różnych wodach stojących z preferencją do zasiedlania wód torfowisk sfagnowych (Bernard
i in. 2009). Inną ważką nielicznie do tej pory obserwowaną
na tym terenie jest zalotka czerwonawa Leucorrhinia rubicunda, znaleziona na stanowiskach Topilec, Bojary oraz
Rynki. W dwóch pierwszych lokalizacjach występowała
razem z zalotką większą.
162
Jedynym gatunkiem, który został stwierdzony podczas
pierwszej inwentaryzacji ważek, w latach 90. XX wieku
(Bystrowski 1992, 2003), a którego występowanie nie zostało potwierdzone w trakcie kolejnych prac, jest szablak
przepasany. Ważka ta wykazuje wyraźne skłonności reofilne, zasiedlając najczęściej drobne, wolno płynące cieki
wodne, strumienie, małe rzeki, rowy i kanały (Bernard
i in. 2009). Na terenie obecnego Parku Narodowego była
znaleziona na jednym stanowisku – przy drugiej strudze
przecinającej groblę między jazem w Rzędzianach a miejscowością Pańki (Bystrowski 2003). Stanowisko to prawdopodobnie przestało istnieć w wyniku budowy podpiętrzenia między Pańkami a Rzędzianami. Przyczyną zaniku gatunku mogły być zmiany warunków środowiskowych
i czasowy brak przepływu wody na strugach w okresie letnim, co obserwowano w latach 2012–2013.
Lista ważek stwierdzonych dotychczas na obszarze Narwiańskiego Parku Narodowego (Tabela 8.2) z pewnością
nie jest kompletna. Analiza rozsiedlenia poszczególnych
gatunków w naszym kraju wskazuje na możliwość odnalezienia w Parku dalszych kilkunastu gatunków. Spośród
ważek równoskrzydłych może to być m.in. zimująca w stadium owada doskonałego straszka pospolita Sympecma
fusca, przynajmniej dwa gatunki z rodzaju Coenagrion
(łątka zielona C. armatum i łątka wiosenna C. lunulatum).
Pewne szanse są również na odnalezienie iglicy małej Nehalenia speciosa, najmniejszej ważki krajowej. Spośród
ważek różnoskrzydłych prawdopodobne jest stwierdzenie
szablaka czarnego Sympetrum danae, szablaka przy-
płaszczonego S. depressiusculum i szablaka późnego
S. striolatum, a także zalotki białoczelnej Leucorrhinia albifrons i zalotki spłaszczonej L. caudalis, jak również zalatujących w ciepłe lata z południa Europy: husarza ciemnego Anax parthenope, szablaka wędrownego S. fonscolombii
czy szafranki czerwonej Crocothemis erytraea. Warto zauważyć, że od dłuższego czasu obserwowana jest wyraźna,
systematyczna ekspansja tych południowych elementów
faunistycznych (Bernard i in. 2009)
Priorytetowe gatunki ważek
w Narwiańskim Parku
Narodowym i ich ochrona
Zalotka większa
Zalotka większa Leucorrhinia pectoralis (Ryc. 8.13), choć
figuruje w załącznikach Dyrektywy Siedliskowej, jest szeroko rozsiedlona w naszym kraju. Według „Atlasu Rozmieszczenia Ważek w Polsce” wykazana została współcześnie z 283 kwadratów UTM (10×10 km) (Bernard i in.
2009). Na terenie Parku Narodowego została znaleziona po
raz pierwszy przez Matosa da Costę (2011). W latach
2012–2013 zalotkę większą stwierdzono na sześciu stanowiskach: w okolicach Topilca, Bojar (Ryc. 8.14) i Kurowa
oraz na grądzikach Maliniak, Murawiniec i Jesionki. Należy spodziewać się, że gatunek może być jeszcze szerzej rozprzestrzeniony, ale część lokalizacji nie została wykryta ze
względu na trudną dostępność potencjalnych siedlisk.
Trzeba też wziąć pod uwagę międzysezonowe wahania liczebności lokalnych populacji wynikające m.in. z warunków pogodowych.
Ryc. 8.14 Stanowisko zalotki większej w okolicach wsi Bojary
(fot. M. Sielezniew)
Do podstawowych zagrożeń dla lokalnych populacji zalotki większej należy zaliczyć przede wszystkim zarastanie
i ocienianie stanowisk przez drzewa i krzewy, a także wysychanie zajmowanych zbiorników. Proponowana strategia ochrony zalotki większej obejmuje ekstensywne działania poprawiające parametry siedliska na dwóch stanowiskach gatunku: Topilec oraz Bojary.
Trzepla zielona
Trzepla zielona Ophiogomphus cecilia (Ryc. 8.15) zasiedla prawie całą Polskę, z wyjątkiem obszarów górskich. Populacja krajowa określana jest mianem silnej i stabilnej,
a szczególnie licznie ważka ta spotykana jest w środkowej,
północnej i lokalnie południowej części kraju (Bernard
2010). Priorytetowy status gatunku wynika więc, podobnie
jak w przypadku zalotki większej, nie tyle z rzadkości
w kraju, co z obecności w załącznikach II i IV Dyrektywy
Siedliskowej. W Narwiańskim Parku Narodowym trzepla
zielona została wykazana po raz pierwszy przez Buczyńską i in. (2007). W 2002 r. był to gatunek bardzo liczny,
aczkolwiek dane ówczesne należy traktować z pewnym dystansem. W roku 2013 prowadzono obserwacje zgodnie
z zaleceniami monitoringu gatunku (Bernard 2010) na
sześciu stanowiskach: Suraż 1, Suraż 2 (Ryc. 8.16), Bokiny,
Ryc. 8.13 Samiec zalotki większej (fot. M. Sielezniew)
Elementy siedliska zalotki według kryteriów zaproponowanych przez Bernarda (2012) są zachowane w stanie
dobrym, a cała populacja w Parku Narodowym nie jest izolowana i występuje w obrębie rozległego areału zasiedlanego przez gatunek. Narwiański Park Narodowy wydaje się
ważną ostoją występowania gatunku jedynie w skali regionalnej.
Ryc. 8.15 Samiec trzepli zielonej (fot. M. Sielezniew)
163
Ryc. 8.16 Stanowisko monitoringu trzepli zielonej, „Suraż 2”
(fot. C. Bystrowski)
Ryc. 8.17 Zagęszczenia wylinek trzech gatunków ważek z rodziny
gadziogłówkowatych na stanowiskach monitoringu trzepli
zielonej w NPN w roku 2013
Uhowo, Radule i Rzędziany. Wylinki trzepli zielonej
stwierdzono na wszystkich badanych odcinkach Narwi,
a średnie liczebności na poszczególnych stanowiskach wahały się od 0,2 do 3,0 sztuk na 10 metrów długości jednego
brzegu rzeki. Najwyższe zagęszczenie wylinek stwierdzono na odcinku rzeki poniżej Uhowa, zaś najniższe w Bokinach i poniżej Radul (Ryc. 8.17, 8.18). Stanowisko w okolicy
Uhowa charakteryzowało się najwyższym udziałem piasku
grubego i frakcji żwirowych dna Narwi, co gatunek ten
wyraźnie preferuje (Bernard 2010).
Ocena parametrów środowiska na wszystkich stanowiskach wypadła dobrze, a różnice pomiędzy lokalizacjami
były niewielkie. Wydaje się jednak, że charakter Narwi
w Parku Narodowym nie pozwala uzyskiwać przez ten gatunek bardzo wysokich zagęszczeń. Trzepla zielona jest gatunkiem, który swoje optimum środowiskowe osiąga na
terenie dużych, meandrujących koryt rzecznych z piaszczysto-żwirowym dnem i umiarkowaną prędkością przepływu wody, natomiast wielokorytowość Narwi oraz znaczące zatorfienie doliny nie musi wcale sprzyjać temu gatunkowi. Wydaje się, że negatywny wpływ na populację
trzepli może wywierać jakość wody w Narwi, jednak siła
odziaływania tego czynnika nie jest ostatecznie wyjaśniona. Bernard (2010) stwierdza, że na zachód od Polski ja164
kość wody wydaje się istotna dla trzepli zielonej: z reguły
zasiedlane są wody od dobrej do bardzo dobrej jakości,
rzadko silniej zanieczyszczone. Natomiast w Polsce element
ten nie odgrywa tak dużej roli. Trzepla występuje bowiem
również w rzekach V klasy czystości wody, a wysokie liczebności osiąga jeszcze przy IV klasie. Bardzo możliwe, że
wrażliwość gatunku na obciążenie środowiska zanieczyszczeniami jest znacznie mniejsza na obszarach bliższych centrum zasięgu niż w jego strefie brzeżnej. Takie tłumaczenie
nie jest do końca przekonywujące, brak jest także spójnej
hipotezy tłumaczącej zjawisko, a przede wszystkim nie
wiadomo, jaki jest charakter zanieczyszczeń i skąd one pochodzą. Różny rodzaj zanieczyszczeń może w odmienny
sposób oddziaływać na gatunek (larwy) oraz jego pokarm.
Należy zatem przyjąć, że jakość wody może być jednym
z czynników kluczowych, a jej poprawa będzie sprzyjała
zarówno temu gatunkowi, jak i organizmom, które z nim
współwystępują.
Strategia ochrony trzepli zielonej na terenie Narwiańskiego Parku Narodowego powinna koncentrować się na
intensyfikacji działań i nacisków, których celem będzie poprawa jakości wody w całej dolinie Narwi oraz ograniczenie ilości zanieczyszczeń (różnego typu) przedostających
się do rzeki. Inne działania wydają się na obecnym poziomie wiedzy o wymaganiach gatunku mało efektywne.
Gadziogłówka żółtonoga
Podobnie jak dwa poprzednie gatunki, gadziogłówka
żółtonoga Gomphus flavipes jest szeroko rozprzestrzeniona
w naszym kraju – wykazana współcześnie w 221 kwadratach UTM (Bernard 2010). Na terenie Narwiańskiego
Parku Narodowego po raz pierwszy była obserwowana
przez Buczyńską i in. (2007). W 2013 r. ocena liczebności
tej ważki była przeprowadzona na tych samych powierzchniach, na których monitorowano liczebność trzepli zielonej, przy zastosowaniu tej samej metodyki. Wylinki gadziogłówki żółtonogiej odnaleziono na wszystkich sześciu
stanowiskach, co pozwala sądzić, że jest to gatunek powszechnie występujący w dolinie Narwi. Średnie liczebności stadiów preimaginalnych na poszczególnych stanowiskach wahały się od 0,1 do 1,8 sztuk w przeliczeniu na
­odcinek 10 metrów jednego brzegu rzeki. Najwyższe zagęszczenia obserwowano na stanowisku Suraż 2 i Uhowo,
Ryc. 8.18 Wylinki ważek zebrane w NPN w trakcie monitoringu
trzepli zielonej 30 V 2013 r. (fot. C. Bystrowski)
najniższe zaś w Bokinach i Radulach (Ryc. 8.17, 8.18).
­Ponieważ gatunek współwystępuje z trzeplą zieloną i wykazuje podobne wymagania środowiskowe, wydaje się,
że będzie mu sprzyjać poprawa jakości wody w Narwi.
Na stanowiskach monitoringu trzepli zielonej i gadziogłówki żółtonogiej znajdywano również wylinki gadziogłówki pospolitej Gomphus vulgatissimus. Ważka ta jest
uznawana za najliczniejszy gatunek z rodziny gadziogłówkowatych, dlatego też nie jest objęta ochroną gatunkową.
Ma jednak podobne wymagania jak dwa pokrewne gatunki i dzięki temu możliwe było jednoczesne monitorowanie
jej liczebności. Trzeba jednak być świadomym, że imagines
tej ważki pojawiają się wcześniej niż trzepli zielonej i gadziogłówki żółtonogiej (wylęgi następują nawet od pierwszej dekady maja), przez co jej zagęszczenia mogły być
nieco zaniżone. Gadziogłówka pospolita najliczniej stwierdzona została na stanowiskach w okolicach Suraża (stanowiska Suraż 1 i Suraż 2). Występowała tam odpowiednio
w zagęszczeniach 1,2 i 2,6 wylinki na 10 m jednego brzegu
rzeki. Na pozostałych stanowiskach była bardzo nieliczna
lub nie była w ogóle odnotowywana (Bokiny) (Ryc. 8.17,
8.18).
Żagnica zielona
Żagnica zielona Aeshna viridis (Ryc. 8.19) jest rozsiedlona głównie w północnej i wschodniej Polsce, według „Atlasu rozmieszczenia ważek w Polsce” gatunek był wykazany
współcześnie z 206 kwadratów UTM (Bernard i in. 2009).
Na obszarze Narwiańskiego Parku Narodowego była wymieniana jako bardzo liczna (+++) przez Buczyńską i in.
(2007), jak również notowana przez Bystrowskiego (1992
i 2009). Ważka ta występuje lokalnie w różnych częściach
Parku, wszędzie tam, gdzie występuje osoka aloesowata
Stratiotes aloides (Ryc. 8.20), z którą jest związana cyklem
życiowym. Larwy żagnicy zielonej stwierdzono na osoce
aloesowatej w Kurówce oraz Narwi, w okolicach Kurowa
(Bystrowski 1992). W roku 2009 obserwowano samca na
łące w zachodniej części torfowiska Rynki w pobliżu miejscowości Uhowo (Bystrowski 2009). Na terenie Parku
Narodowego znajduje się wiele rozległych stanowisk osoki
aloesowatej, co zapewnia tej ważce bardzo dobre warunki
rozwoju. Elementy siedliska żagnicy zielonej zachowane są
w stanie dobrym, a obecnie brak jest zagrożeń dla trwałości populacji tej ważki.
Miedziopierś północna
W Polsce miedziopierś północna Somatochlora arctica
ma umiarkowane rozprzestrzenienie biorąc pod uwagę,
że według „Atlasu rozmieszczenia ważek w Polsce” była
odnotowana współcześnie w 61 kwadratach UTM. W Narwiańskim Parku Narodowym po raz pierwszy została wykazana przez Bystrowskiego (2009) z uroczyska Rynki,
gdzie stwierdzono sześć samców tego gatunku. W 2013 r.
zaobserwowano na tym terenie jedną samicę (Matos da
Costa i Sielezniew, dane niepublikowane). Hipotetycznie
larwy mogą rozwijać się na sfagnowym torfowisku przejściowym zlokalizowanym na północno-wschodnim skraju
tego uroczyska. Brakuje tam jednak jakichkolwiek, nawet
niewielkich zbiorników wodnych, a ponadto obszar torfowiska często ulega przesuszeniu. Siedlisko nie ma więc
charakteru optymalnego. W przyszłości należałoby podjąć
Ryc. 8.19 Samiec żagnicy zielonej (fot. M. Sielezniew)
Ryc. 8.20 Siedlisko żagnicy zielonej w okolicach wsi Pańki
(fot. C. Bystrowski)
próby zmierzające do precyzyjnego określenia miejsca rozwoju tej rzadkiej ważki. Bez tego trudno planować konkretne działania na rzecz ochrony tego gatunku.
Straszka syberyjska (północna)
Straszka syberyjska Sympecma paedisca (Ryc. 8.21) szerzej jest rozsiedlona na wschodzie kraju: na Lubelszczyźnie
i Podlasiu, oraz na Pomorzu Zachodnim, chociaż lokalnie
występuje także w innych częściach Polski, z wyjątkiem
południowego zachodu (Bernard i in. 2009). Należy do
gatunków związanych z wodami stojącymi, z reguły niewielkimi zbiornikami o różnym charakterze (Bernard
i in. 2009); zazwyczaj pojawia się nielicznie. Za ciekawostkę
biologii tego gatunku można uznać zimowanie w postaci
165
Ryc. 8.21 Samiec straszki syberyjskiej
(północnej) (fot. M. Sielezniew)
imago. Na Podlasiu znanych stanowisk nie ma zbyt dużo, ale prawdopodobnie wynika to ze słabego zbadania obszaru. Na terenie Parku Narodowego straszka syberyjska została stwierdzona w 2016 r. na grądziku Sosnowiec k. Radul (Bystrowski,
niepublikowane). Należy jednak przypuszczać, że faktyczna liczba stanowisk
w Parku Narodowym jest większa. Stosunkowo niedaleko, nad Narwią pod Tykocinem straszka syberyjska daje się obserwować regularnie niemal co roku (Bystrowski, niepublikowane).
Podsumowanie
Unikalny, wielokorytowy system rzeczny chroniony w Narwiańskim Parku Narodowym kształtuje zróżnicowane warunki ekologiczne oraz siedliska. Występujący tu kompleks środowisk wodnych i torfowisk niskich odgrywa istotną rolę
z punktu widzenia wielu gatunków ważek. Wartość Narwiańskich Bagien jest tym
większa, że wspólnie z doliną Supraśli i Biebrzy tworzą razem sieć ekologicznych
korytarzy zapewniających ciągłość siedlisk, a tym samym łączność lokalnych populacji tych pięknych drapieżnych owadów.
Oceniając stan zachowania ważek w Narwiańskim Parku Narodowym trzeba
pamiętać, że populacje owadów podlegają różnym cyklom zmian liczebności. Dzieje się tak zarówno ze względu na zmienność czynników środowiska (np. lata suche
i mokre), jak i interakcje wewnątrz- i międzygatunkowe. W konsekwencji populacje
szeregu gatunków stają się bardziej liczne w niektóre lata sprzyjające rozwojowi,
a rzadsze w inne. Oddziaływanie gospodarki ludzkiej oraz szeroko rozumianej antropopresji nie ma bezpośredniego przełożenia na te cykle.
Ważnym elementem, utrudniającym precyzyjną ocenę zmian liczebności populacji ważek, jest brak „twardych”, metodycznie zbieranych danych w dłuższych
okresach. Bardzo często przy analizach jedyną dostępną metodą pozostaje porównywanie list gatunkowych, które w przypadku Podlasia nie są kompletne. Tę lukę
może zapełnić w przyszłości monitoring, który w odniesieniu do tzw. „gatunków
naturowych” (tj. wymienionych w II załączniku Dyrektywy Siedliskowej) jest działaniem obowiązkowym i powinien być realizowany. Ponadto odpowiednie zmodyfikowanie metod zbioru wylinek, poprzez zwiększenie liczby kontroli i zbieranie
wszystkich wylinek ważek (a nie np. tylko gatunku „naturowego”, tj. trzepli zielonej) mogłoby poprawić stan wiedzy o cyklach liczebności na poszczególnych stanowiskach, a tym samym i ogólnych trendach.
Warto również podkreślić, że większość ważek jest dobrymi lotnikami, a ich
zdolności dyspersyjne bywają imponujące. Dogodne siedliska lęgowe z pewnością
mogą być i są zasiedlane przez konkretny gatunek wielokrotnie. Ta przesłanka wydaje się zwiększać znacząco możliwości działań ochrony czynnej i kreowania środowisk sprzyjających tym owadom na terenie Narwiańskiego Parku Narodowego.
166
Literatura
Bernard R. 2010. Trzepla zielona Ophiogomphus cecilia. [W:]
Makomaska-Juchiewicz M. (red.), Monitoring gatunków
zwierząt. Przewodnik metodyczny. Część I. 32–58. Główny
Inspektorat Ochrony Środowiska, Warszawa.
Bernard R. 2012. Zalotka większa Leucorrhinia pectoralis. [W:]
Makomaska-Juchiewicz M., Baran P. (red.), Monitoring gatunków zwierząt. Przewodnik metodyczny. Część III. 68−94.
GIOŚ, Warszawa.
Bernard R., Buczyński P., Tończyk G., Wendzonka J. 2009.
Atlas rozmieszczenia ważek (Odonata) w Polsce. Bogucki Wydawnictwo Naukowe, Poznań.
Buczyńska E., Buczyński P., Lechowski L. 2007. Wybrane
owady wodne (Odonata, Coleoptera, Trichoptera) Narwiańskiego Parku Narodowego – wyniki wstępnych badań. Parki
Narodowe i Rezerwaty Przyrody 26: 25−40.
Buczyński P. 2004. Ważki (Odonata) Poleskiego Parku Narodowego i jego otuliny: nowe dane i podsumowanie badań z lat
1985–2003. Parki Narodowe i Rezerwaty Przyrody 23: 381−394.
Buczyński P. 2006. Uwagi o występowaniu Aeshna affinis Vander L. w województwie lubelskim. Odonatrix 2: 33−36.
Buczyński P., Tończyk G. 2004. Somatochlora arctica (Zetterstedt, 1840). Miedziopierś arktyczna. [W:] Głowaciński Z.,
Nowacki J. (red.), Polska czerwona księga zwierząt. Bezkręgowce. Instytut Ochrony Przyrody PAN, Kraków i Akademia
Rolnicza im A. Cieszkowskiego, Poznań: 59−60.
Bystrowski C. 1992. Waloryzacja entomologiczna rzędu ważki
(Odonata) w Narwiańskim Parku Krajobrazowym. Warszawa,
46 ss. (mscr. w archiwum Narwiańskiego Parku Narodowego).
Bystrowski C. 2003. Nowe dane o występowaniu Sympetrum
pedemontanum (Allioni, 1766) (Odonata, Libellulidae) na Północnym Podlasiu. Nowy Pamiętnik Fizjograficzny 1: 209−214.
Bystrowski C. 2009. Inwentaryzacja bezkręgowców: motyli
dziennych i ważek oraz koncepcja i założenia metody monitoringu entomofauny torfowiska Rynki w Narwiańskim Parku
Narodowym, Tykocin VIII 2009 (mscr. w archiwum Narwiań­
skiego Parku Narodowego).
Głowaciński Z., Nowacki J. (red.) 2004. Polska czerwona księga zwierząt. Bezkręgowce. Instytut Ochrony Przyrody PAN
w Krakowie, Akademia Rolnicza im. A. Cieszkowskiego
w Poznaniu.
Henel A., Taylor J.R.E., Frąckiel K. 2014. Ważki i ich siedliska w dolinie Biebrzy. Wszechnica Biebrzańska. Biebrzański
Park Narodowy, Osowiec-Twierdza. Zeszyt 4: 33–37.
Jödicke R. 1999. Libellenbeobachtugen in Podlasie, Nordostpolen. Libellula 18: 31−48.
Kalkman V.J., Boudot J.-P., Bernard R., Conze K.-J., De
Knijf G., Dyatlova E., Ferreira S., Jović M., Ott J., Riservato E., Sahlén G. 2010. European Red List of Dragonflies.
Publication Office of the European Union, Luxembourg.
Łabędzki A. 2001. Odonata − ważki. [W:] Gutowski J.M., Jaroszewicz B. (red.), Katalog Fauny Puszczy Białowieskiej. 88−91.
Instytut Badawczy Leśnictwa, Warszawa.
Matos da Costa J. 2010. New data of the Odonata order in the
Narew National Park. Odonatrix 6: 33−36.
Matos da Costa J. 2011. First records of some dragonfly (Odonata) species in the Narew National Park. Odonatrix 7: 50−51.
167
168
fot. A. Bielonko
9
Ichtiofauna Narwiańskiego
Parku Narodowego
Wiesław Wiśniewolski • Jacek Szlakowski •
Paweł Buras • Mikołaj Adamczyk •
Janusz Ligięza • Paweł Prus
Siedliska bytowania ryb
Cechą charakterystyczną ekosystemów wodnych Narwiańskiego Parku Narodowego jest środowisko przyrodnicze zbliżone do stanu naturalnego. Rzeka płynie tutaj wieloma korytami płaską, zabagnioną doliną o szerokości 2–4
km i nieznacznym spadku, który wynosi około 20–22 cm/
km (0,20–0,22‰). Rozgałęzia się przy tym na liczne aktywne i zamierające boczne ramiona, co sprawia, że sieć
hydrograficzna jest na obszarze Parku Narodowego bardzo
silnie rozwinięta. Cechuje ją obecność zróżnicowanych,
specyficznych środowisk składających się na całość ekosystemu wodnego Narwi (Ryc. 9.1).
Głównym siedliskiem bytowania ryb jest koryto rzeki
dzielące się na liczne ramiona. W tym środowisku
nurtowym Narwi stale zaznacza się wyraźny przepływ
wody, która drąży w torfowym podłożu głębokie rynny.
Osłonięte bujnymi szuwarami tworzą one prawdziwy labirynt, w którym łatwo można się zagubić (Ryc. 9.2). Przepływ wody kształtuje tutaj warunki środowiskowe zapewniające bytowanie różnych roczników takich gatunków jak
jaź, leszcz, miętus, okoń, płoć, szczupak, a także rzadziej
spotykanych: bolenia, klenia i suma. W głębokich zakolach
koryta rzeki doskonałe kryjówki znajduje sum, a zwisające
kurtyny wypłukanych przez wodę korzeni nadbrzeżnych
roślin oraz bogata roślinność wodna stanowią doskonałe
podłoże dla składanej przez tę rybę ikry.
Równie ważnymi siedliskami ichtiofauny są występujące na obszarze Parku Narodowego starorzecza. Liczne są
starorzecza otwarte, stale w ciągu całego roku połączone
z nurtem rzeki, z wyczuwalnym w rejonie połączenia lekkim przepływem wody, zanikającym w miarę posuwania
się w głąb starorzecza. Pełnią one ważną funkcję jako tarliska i miejsca wychowu młodych ryb w pierwszym okresie
życia. Rozradzają się w nich krąp, leszcz, lin, okoń, płoć,
szczupak, wzdręga. Większe i głębsze starorzecza są także
żerowiskami oraz miejscem zimowania starszych ryb.
Innym ważnym typem siedlisk są starorzecza zamknięte,
okresowo łączące się z nurtem tylko przy wysokich stanach
wody. Są one miejscem rozrodu oraz wzrostu gatunków
limnofilnych, unikających przepływu wody, takich jak
karaś pospolity, lin, piskorz, różanka, słonecznica, wzdręga, a także okoń, płoć, szczupak. Starorzecza zamknięte
kontaktują się z wodami rzeki tylko w okresie wezbrań, gdy
zalewana jest cała dolina. Wówczas ryby przedostają się
z nich do koryta głównego rzeki. Okres wiosennych wylewów jest szczególnie ważny dla szczupaka, kluczowego gatunku drapieżnego w zespole ichtiofauny Parku Narodowego. Wczesną wiosną wypływa on na turzycowiska zalane wiosennym przyborem, i w nagrzewającej się, płytkiej
wodzie składa ikrę na zalanych roślinach. Starorzecza są
często bardzo mocno zarośnięte roślinnością wodną, o liściach zanurzonych lub pływających na powierzchni wody.
Zwykle otoczone są zwartym pasem roślinności szuwarowej (Ryc. 9.3).
Specyficznymi, charakterystycznymi dla zalewowej doliny Narwi siedliskami ichtiofauny, są drobne zbiorniki,
tzw. oczka wodne, będące pozostałością po zanikających
starorzeczach (Ryc. 9.4). Często obserwuje się w nich
okresowe przyduchy, tj. spadek ilości tlenu rozpuszczonego
w wodzie do wartości zagrażających życiu ryb. Przyczyniają
się do tego organiczne osady denne, zalegające w nich
grubą warstwą. Warunki te mają decydujący wpływ na
strukturę gatunkową ichtiofauny, zasiedlającej oczka
wodne. Reprezentowana jest ona zwykle przez 2–3 gatunki,
takie jak karaś pospolity, lin, piskorz, które potrafią
przetrwać w tych niekorzystnych warunkach.
Sieć wodną Narwiańskiego Parku Narodowego uzupełniają dopływy Narwi. Są to drobne cieki spływające z wysoczyzn otaczających dolinę rzeczną, wytracające swój bieg
po wpłynięciu w dolinę. W Parku i w części jego otuliny
zachowały one w większości naturalny charakter, powyżej
zostały uregulowane (Ryc. 9.5, 9.6). Siedliska te są płytkie
i oferują specyficzne warunki bytowania ryb. Wiele gatunków wstępuje do nich z Narwi wiosną w celach rozrodu.
W dolnym biegu dopływów można spotkać młode osobniki jazia, krąpia, okonia, płoci, szczupaka. Jednak ich głównymi mieszkańcami są gatunki drobnych ryb: cierniczek,
169
Ryc. 9.1 Stanowiska odłowów ichtiofauny w Narwiańskim Parku Narodowym
(opr. J. Szlakowski)
Ryc. 9.2 Środowisko nurtowe Narwi koło Kurowa (fot. W. Białokoz)
170
Ryc. 9.3 Starorzecze otwarte, Waniewka (fot. J. Szlakowski)
Ryc. 9.4 Oczko wodne, Kolonia Bokiny (fot. J. Szlakowski)
ciernik, kiełb, koza, piskorz, różanka, słonecznica. Część
z nich jest chroniona w ramach prawa krajowego oraz Unii
Europejskiej (Dyrektywa Rady 92/43/EWG; Rozp. Min.
Środ. 06.10.2014). Odnotowano tutaj również obecność
przedstawiciela ryb krągłoustych – minoga ukraińskiego.
Opisywane zróżnicowanie środowiskowe stanowi podstawę bogactwa ichtiofauny (Aarts i in. 2004) ekosystemów wodnych Narwiańskiego Parku Narodowego i stwarza warunki dla występowania licznego zespołu ryb.
Ryc. 9.5 Kowalówka (dopływ z Czaczek) (fot. J. Szlakowski)
171
Bogactwo gatunkowe ryb
zasiedlających wody
Narwiań­skiego Parku
Narodowego
Ryc. 9.6 Awissa w miejscowości Płonka Kościelna
(fot. J. Szlakowski)
W wodach Narwiańskiego Parku Narodowego występuje 26 gatunków ryb oraz jeden gatunek krągłoustych,
którym jest minóg ukraiński (Penczak i in. 1990, 1991;
Sych i in. 1990; Szlakowski, Buras 2006). Jest wśród nich
jeden gatunek obcego pochodzenia, tj. karaś srebrzysty.
Stanowi on zagrożenie dla rodzimego karasia pospolitego,
którego wypiera z wielu stanowisk. Gatunki ryb Parku Narodowego zgrupowane są w 10 rodzinach (Tab. 9.1).
Tab. 9.1 Gatunki minogów i ryb stwierdzone w wodach Narwiańskiego Parku Narodowego
(DS II – gatunek z II załącznika Dyrektywy Siedliskowej; OG – ochrona gatunkowa w Polsce)
172
Nazwa naukowa
Nazwa polska
Petromyzonidae
Eudontomyzon mariae
Anguillidae
Anguilla anguilla
Cyprinidae
Aspius aspius
Leuciscus idus
Leuciscus leuciscus
Carassius carassius
Carassius gibelio
Gobio gobio
Leuciscus cephalus
Blicca bjoerkna
Abramis brama
Tinca tinca
Rutilus rutilus
Rhodeus amarus
Leucaspius delineatus
Alburnus alburnus
Scardinius erythrophthalmus
Cobitidae
Cobitis taenia
Misgurnus fossilis
Nemacheilidae
Barbatula barbatula
Siluridae
Silurus glanis
Esocidae
Esox lucius
Gadidae
Lota lota
Gasterosteidae
Pungitius pungitius
Gasterosteus aculeatus
Percidae
Gymnocephalus cernua
Perca fluviatilis
minogowate
minóg ukraiński
węgorzowate
węgorz
karpiowate
boleń
jaź
jelec
karaś pospolity
karaś srebrzysty
kiełb
kleń
krąp
leszcz
lin
płoć
różanka
słonecznica
ukleja
wzdręga
kozowate
koza
piskorz
przylgowate
śliz
sumowate
sum
szczupakowate
szczupak
dorszowate
miętus
ciernikowate
cierniczek
ciernik
okoniowate
jazgarz
okoń
Status
Grupa rozrodcza
DS II, OG
litofilna
specjalna
DS II
DS II, OG
fitolitofilna
fitolitofilna
fitofilna
fitofilna
fitofilna
psammofilna
litofilna
fitofilna
fitolitofilna
fitofilna
fitolitofilna
ostrakofilna
fitofilna
fitolitofilna
fitofilna
DS II, OG
DS II, OG
fitofilna
fitofilna
OG
psammofilna
fitofilna
fitofilna
litopelagofilna
fitofilna
fitofilna
fitolitofilna
fitolitofilna
Ekologiczne grupy rozrodcze
Wymagania odnośnie miejsca i pory tarła (preferencji
rozrodczych) poszczególnych gatunków ryb występujących na obszarze Parku Narodowego są zróżnicowane
(Balon 1975; Tab. 9.1). Przedstawicielami gatunków składających ikrę na dnie żwirowo-kamienistym (litofilnych)
są kleń i minóg ukraiński. Z kolei gatunki fitofilne wykorzystują w tym celu roślinność podwodną. Jedne, takie jak
np. karaś pospolity, leszcz, lin, szczupak i wzdręga, rozrzucają bezładnie ikrę, która opadając przykleja się samorzutnie do podwodnych roślin. Inne, jak słonecznica, skrupulatnie przyklejają składane ziarna ikry do liści i łodyg roślin wodnych. Ryba ta, podobnie jak sum, opiekuje się
złożoną ikrą, chroniąc ją przed drapieżnikami. Swą ikrę
chronią także ciernik i cierniczek. Z fragmentów podwodnych roślin budują one na dnie gniazdo, w którym kilka
samic składa ikrę, pieczołowicie pielęgnowaną następnie
przez samca. Samiec ciernika przywdziewa w tym okresie
efektowną szatę godową, z jaskrawą czerwienią piersiowych partii ciała. Stojąc przy gnieździe, poprzez wachlujące ruchy płetw wymusza on przepływ wody przez gniazdo,
zapewniając w ten sposób potomstwu odpowiednie natlenienie wody.
Ryby należące do grupy psammofilnej składają ikrę na
podłożu piaszczystym lub piaszczysto-żwirowym. Wiosną
można zaobserwować w płytkiej przejrzystej wodzie dopływów Narwi trące się energicznie ponad piaszczystym
dnem stadka kiełbi lub ślizów.
Fitolitofilne ryby, takie jak jazgarz, jaź i okoń składają
ikrę ponad mineralnym piaszczysto-kamienistym dnem
na szczątkach roślin lub podwodnych przedmiotach. Wiosną spotkać można w kwietniu ikrę okonia rozwieszoną
w postaci długich wstęg na zatopionych w wodzie kamieniach, gałęziach lub roślinności podwodnej.
W odróżnieniu od pozostałych gatunków ryb odbywających tarło w okresie wiosny lub wczesnego lata, litopelagofilny miętus składa ikrę ponad mineralnym lub mulistym dnem zimą, od grudnia do marca. Unosi się ona
w toni wodnej tuż ponad dnem, często zarośniętym roślinnością. Gatunek ten jest jedynym przedstawicielem rodziny dorszowatych w wodach słodkich naszego kraju.
Przedstawicielem dwuśrodowiskowych ryb wędrownych jest zaliczany do grupy specjalnej węgorz. Wody
Parku Narodowego są miejscem, gdzie żeruje, rośnie
i dojrzewa. Z chwilą osiągnięcia wieku dojrzałego opuszcza
on wody słodkie wędrując na tarło do Morza Sargassowego
u wybrzeży Ameryki Środkowej. Po tarle ginie, a do wód
słodkich powraca jego potomstwo, unoszone w postaci
ikry, a następnie larw prądem zatokowym ku wybrzeżom
Europy. Tutaj już jako tzw. węgorz szklisty, a następnie
wstępujący, narybek wędruje aktywnie do rzek, docierając
nimi na śródlądowe żerowiska.
Na koniec wspomnieć należy grupę ryb ostrakofilnych,
do których należy różanka (Ryc. 9.7). Jest ona drobną rybą
z rodziny karpiowatych, jedynym przedstawicielem tej
grupy w ichtiofaunie Polski. Składa ona ikrę do jamy
płaszczowej małży z rodziny skójkowatych. Samica
posługuje się przy tym wprowadzanym do wnętrza małża
specjalnym pokładełkiem, które wyrasta jej w porze tarła.
Chronione grubą skorupą małża bezpiecznie rozwijają się
Ryc. 9.7 Różanka Rhodeus amarus. Awissa, Płonka Kościelna
(fot. J. Szlakowski)
tutaj ikra i wylęg. Młode ryby opuszczają to schronienie
dopiero po osiągnięciu pełnej gotowości do samodzielnego
życia w środowisku wodnym.
Środowiskowe zróżnicowanie
ichtiofauny Narwi
Gatunkami powszechnie spotykanymi w wodach Parku,
zarówno w strefie nurtowej rzeki, jak i w starorzeczach
otwartych, są ryby typowe dla rzek nizinnych: jaź, płoć,
szczupak, nieco mniej licznie okoń, piskorz, różanka
i wzdręga. Gatunki te pomimo powszechności występowania w wodach naszego kraju, w wodach Narwiańskiego
Parku Narodowego tworzą specyficzne zespoły, charakterystyczne dla środowisk bagiennej doliny Narwi. Duży
udział jazia, piskorza, płoci i szczupaka, względnie piskorza i karasia pospolitego (oczka wodne), wskazuje na dobrą
kondycję zespołu ryb i ich środowiska. Gatunkami uzupełniającymi zespół są: okoń, wzdręga oraz różanka, a w strefie nurtu także miętus.
W wodach Narwiańskiego Parku Narodowego można
wyróżnić pięć grup siedlisk, charakteryzujących się występowaniem określonych zespołów ryb (Ryc. 9.8).
Grupa 1 obejmuje stanowiska nurtowe Narwi, poza stanowiskiem Rzędziany. W zespole ichtiofauny tej grupy dominują jaź, kiełb, miętus, płoć oraz szczupak.
Grupa 2 obejmuje starorzecza i oczka wodne. Cechuje się
niewielką liczbą gatunków z dominacją piskorza i karasia pospolitego.
Grupa 3 obejmuje stanowiska dopływu Kurówka w biegu
środkowym i ujściowym, starorzecze przepływowe
(Waniewka) oraz starorzecze zamknięte w Surażu. Liczba gatunków waha się od 11 do 17 na poszczególnych
stanowiskach. Gatunkami dominującymi są kiełb,
okoń, płoć, różanka oraz młodzież szczupaka i jazia.
Grupa 4 obejmuje dopływy i stanowisko nurtowe na Narwi
w Rzędzianach. Liczba gatunków wynosi od 4 do 10 na
poszczególnych stanowiskach. Dominują ryby małe,
o niskiej masie osobniczej: małe osobniki płoci, kiełb,
słonecznica oraz narybek jazia.
173
Ryc. 9.8 Dendrogram analizy skupień ekosystemów wodnych Narwi w oparciu o zespoły
ichtiofauny (opr. J. Szlakowski)
Grupa 5 obejmuje dopływy Struga i Kowalówka, z wyjątkowo ubogą ichtiofauną. W Strudze złowiono tylko pięć małych osobników szczupaka, w Kowalówce występowały trzy gatunki: cierniczek, ciernik oraz słonecznica. Dominował cierniczek (82%).
Wyróżnione charakterystyczne zespoły ryb są powiązane z cechami środowiska. Gatunki bardziej wymagające pod względem natlenienia wody i jej przepływu, takie jak: boleń, jaź, kiełb, kleń, koza, leszcz, miętus, okoń, płoć, różanka, sum, szczupak i ukleja, są typowe dla nurtu i starorzeczy otwartych. Mniej
wymagające: karaś pospolity, lin, piskorz, słonecznica, wzdręga, występują
w starorzeczach zamkniętych, zaś te o najmniejszych wymaganiach (lin, piskorz) – w oczkach wodnych. Odrębną grupę tworzą gatunki związane z drobnymi dopływami – cierniczek, ciernik, koza, minóg ukraiński.
Przedstawione grupy funkcjonalne, odzwierciedlające powiązania gatunków
z ich siedliskiem, nie są w ekosystemach wodnych jedynym przykładem złożonych relacji. Współbytowanie na obszarze Parku Narodowego różanki, płoci czy
wzdręgi z małżami z rodziny skójkowatych Unionidae (Ryc. 9.9) odzwierciedla
również istniejący tutaj układ współzależności między rybami i małżami. Różanka profituje w tym układzie w newralgicznej fazie cyklu biologicznego, jaką
jest rozród. Małże zapewniają bowiem bezpieczny rozwój jej ikry oraz wylęgu.
Korzyści odnoszą również małże, które podczas rozwoju w stadium larwalnym
(glochidia) pasożytują na rybach. Ich żywicielami jest jednak nie tylko różanka,
lecz także inne gatunki jak np. leszcz, płoć, wzdręga. Glochidium przyczepia się
do skrzeli, skóry lub płetw ryb, a następnie zostaje otoczone tkanką żywiciela,
tworząc cystę. Na rybie pojawiają się ciemne punkty. Nie są one objawem chorobowym, lecz znakiem nosicielstwa glochidiów, które odżywiają się pasożytniczo
czerpiąc pokarm z tkanek żywiciela (Ryc. 9.10). W stadium rozwojowym glochidium, małż „wędruje” razem z rybą, która mimowolnie przyczynia się do rozprzestrzeniania areału jego występowania. Po jakimś czasie glochidium przekształca się w postać młodocianą, o wyglądzie dorosłego małża, wydostaje się
z otorbionej cysty, odrywa od ryby i osiada na dnie.
174
Ryc. 9.11 Płoć Rutilus rutilus, przy ujściu Kurówki
(fot. J. Szlakowski)
Ryc. 9.9 Szczeżuja Anodonta sp., przedstawiciel rodziny
skójkowatych (fot. M. Adamczyk)
Ryc. 9.12 Szczupak Esox lucius. Narew, Łupianka (fot. J. Szlakowski)
Ryc. 9.10 Płoć z widocznymi na skórze glochidiami małża
(fot. J. Ligięza)
Przegląd gatunków
Płoć (Ryc. 9.11) jest gatunkiem pospolitym, który w ekosystemach wodnych Narwiańskiego Parku Narodowego
stanowi ważny, charakterystyczny składnik zespołu ryb.
Jej silna populacja informuje o dobrej kondycji środowisk
wodnych. Jest rybą odżywiającą się wodnymi organizmami bezkręgowymi, jednak w jej diecie spotkać można także
fragmenty roślin oraz ich nasiona, a okresowo także owady
zbierane z powierzchni wody. Występuje we wszystkich
siedliskach Parku z wyjątkiem niektórych oczek wodnych,
zdominowanych przez karasia pospolitego i piskorza. Płoć
jest ważnym element diety ryb drapieżnych. Pomimo osiągania niezbyt dużych rozmiarów (do ok. 30 cm) jest rybą
cenioną przez wędkarzy.
Szczupak jest najważniejszym gatunkiem drapieżnym
w wodach Parku Narodowego (Ryc. 9.12). Poluje na wszystkie ryby, jeśli tylko umożliwiają mu to ich rozmiary. Wykazuje przy tym skłonności kanibalistyczne, bowiem nie gardzi również przedstawicielami swego gatunku. Jego ofiarą
padają w pierwszej kolejności osobniki osłabione i chore,
stąd szczupak pełni ważną rolę w utrzymywaniu dobrego
stanu sanitarnego ekosystemu wodnego. Zachowanie licznej populacji tego drapieżnika stanowi gwarancję utrzymania właściwych proporcji liczebności pozostałych gatunków tworzących zespół ryb w wodach Parku. Jest to
trudne i wymaga prowadzenia działań ochronnych, tj.
ochrony miejsc tarła i zimowania, a także wspierania zarybieniami populacji tej ryby, gdyż szczupak jest bardzo
atrakcyjnym obiektem wędkarskich połowów.
Gatunkiem typowo rzecznym jest jaź (Ryc. 9.13). W strefie nurtowej Narwi, której się trzyma, znajduje doskonałe
warunki rozwoju, stąd jest rybą powszechnie spotykaną
w wodach Parku Narodowego. Prowadzi towarzyski tryb
życia, poszukując stadnie pokarmu w strefie przydennej,
w toni wodnej oraz przy powierzchni. W letnie popołudnia
i wieczory można zaobserwować stada tych ryb polujących
na owady siadające na powierzchni wody. W skład diety
jazia wchodzą detrytus, larwy ochotkowatych, glony, rośliny naczyniowe i stawonogi, mięczaki oraz małe ryby.
W niektórych starorzeczach zamkniętych obserwowano
w pewnych latach występowanie licznych zgrupowań młodych jazi, o jednakowej wielkości. Sugeruje to, że siedliska
tych starorzeczy pełnią ważną rolę w cyklu biologicznym
tego gatunku, jako miejsca odchowu młodzieży. Łatwo jest
pomylić młodego jazia z płocią. Różni się on jednak kolo-
175
Ryc. 9.13 Jaź Leuciscus idus. Narew, Bokiny (fot. J. Szlakowski)
176
stadnie na ryby w toni wodnej. Gatunek jest względnie drapieżny. Młode osobniki odżywiają się bezkręgowcami, stanowiąc ważny element sieci troficznej strefy przybrzeżnej.
Ryby starsze żerują na młodocianych formach innych gatunków ryb, zmniejszając ich populacje. Okoń jest ważnym
gatunkiem w wodach Parku Narodowego.
Powszechnie, zwłaszcza w korycie rzeki występuje ukleja (Ryc. 9.15), zasiedlająca strefę wolnej wody. Ta stadna,
drobna ryba, podobnie jak jaź i rzadki w Narwi, w granicach Parku kleń (Ryc. 9.16), poluje na owady unoszące się
na powierzchni wody. Często pada ona ofiarą żerującego
tutaj bolenia, nielicznego w wodach Parku, zwanego również rapą (Ryc. 9.17). Jest on jedynym drapieżnym gatunkiem z rodziny ryb karpiowatych, zasiedlającym wody naszego kraju. Przebywając nad rzeką w ciepłej porze roku
można nierzadko zaobserwować żerowanie bolenia, który
gwałtownie wyskakuje z wody i uderzając energicznie ogo-
Ryc. 9.14 Okoń Perca fluviatilis. Narew, Szołajdy (fot. J. Szlakowski)
Ryc. 9.16 Kleń Leuciscus cephalus (fot. J. Ligięza)
Ryc. 9.15 Ukleja Alburnus alburnus (fot. J. Ligięza)
Ryc. 9.17 Boleń Aspius aspius (fot. J. Ligięza)
rem oczu, które u jazia są czarne, podczas gdy u płoci pomarańczowe.
Okoń (Ryc. 9.14) jest spotykany niemal we wszystkich
siedliskach wodnych Parku Narodowego, najliczniej w strefie nurtu i starorzeczach otwartych. Młode okonie w początkowym okresie trzymają się stadnie, przechodząc wraz
z wiekiem na bardziej samotniczy tryb życia. Nierzadko
spotyka się jednak duże osobniki tego drapieżcy polujące
nem o jej powierzchnię głuszy ukleje, by następnie spokojnie zbierać spływające ryby.
W głębszych partiach koryta Narwi, a także starorzeczy
otwartych, stadnie przeszukuje dno w poszukiwaniu bentosowych organizmów bezkręgowych leszcz (Ryc. 9.18).
Nie jest on zbyt liczny w wodach Parku Narodowego. Tej
atrakcyjnej wędkarsko, osiągającej przeciętnie masę 2–3
kilogramów rybie towarzyszy krąp (Ryc. 9.19). Bardzo
Ryc. 9.18 Leszcz Abramis brama (fot. J. Szlakowski)
Ryc. 9.20 Jazgarz Gymnocephalus cernua (fot. J. Szlakowski)
Ryc. 9.19 Krąp Blicca bjoerkna (fot. J. Szlakowski)
Ryc. 9.21 Sum Silurus glanis (fot. P. Buras)
łatwo jest go pomylić z poprzednim gatunkiem. Różni się
od niego mniejszymi rozmiarami bardziej krępego ciała,
okrytego grubszą łuską oraz czerwonawym podbarwieniem płetw piersiowych i brzusznych, które u leszcza są
szare. Występuje tutaj również nielicznie jazgarz (Ryc.
9.20). Jest gatunkiem o niewielkich wymaganiach środowiskowych. Odżywia się bezkręgowcami wodnymi, małymi
mięczakami, ikrą i wylęgiem ryb. Podobnie jak okoń, składa ikrę w postaci galaretowatych sznurów w płytkich miejscach strefy brzegowej. Jazgarz uzbrojony jest w kolce znajdujące się w płetwach oraz na pokrywach skrzelowych.
Nieostrożne wzięcie jazgarza do ręki doprowadzić może do
przykrych skaleczeń, zwłaszcza że ryba obficie wydziela
śluz silnie drażniący rany.
Gatunkiem osiągającym największe rozmiary wśród
ichtiofauny Narwiańskiego Parku Narodowego jest sum
(Ryc. 9.21), który może mierzyć ponad 2 m, przy masie
ciała ponad 100 kg. W wodach Parku są spotykane osobniki o masie kilkunastu, a nawet kilkudziesięciu kilogramów.
Sum zwykle kryje się w głębokich dołach, w zakolach
głównego koryta Narwi. Po zmierzchu wypływa na płycizny, a także penetruje toń wodną, gdzie poluje na ryby oraz
kręgowce wodne i lądowe, np. płazy czy ptaki wodne. Wiosną, na przełomie maja i czerwca, tworzy skupiska tarłowe,
wypływając na płycizny porośnięte roślinnością wodną lub
do miejsc z występującymi w wodzie nawisami korzeni.
Duża ikra przyklejana jest do tworzących gniazdo korzeni
lub roślinności wodnej. Wylęg przypomina kijankę żaby.
W pierwszym okresie życia sum unika światła, kryjąc się
w zakamarkach dna i wśród roślin.
Trudną do obserwacji rybą, aktywną w porze nocnej
oraz w chłodnych porach roku, jest zasiedlający strefę nurtową rzeki miętus (Ryc. 9.22). W wodach Parku zajmuje
siedliska w głębokich rynnach i dołach. Jest gatunkiem
względnie drapieżnym, młode osobniki odżywiają się bezkręgowcami, ryby starsze żerują na młodocianych formach
oraz ikrze innych gatunków ryb. Ta liczna w narwiańskich
wodach zimnolubna ryba w czasie letnich upałów potrafi
zapaść w swoisty letarg. Spowolniony metabolizm organizmu pozwala jej przetrwać niekorzystny dla niej okres
podwyższonej temperatury wody.
Charakterystycznymi, wskaźnikowymi dla starorzeczy
gatunkami, zarówno starorzeczy otwartych jak i zamkniętych, są karaś pospolity, lin, piskorz, różanka oraz wzdręga.
Wzdręga, zwana także krasnopiórką (Ryc. 9.23), jest gatunkiem zbliżonym wyglądem i wielkością do płoci, od
której różni się złocisto oliwkowym ubarwieniem, jaskrawo czerwonymi płetwami oraz skośnie ustawionym ku
177
Ryc. 9.22 Miętus Lota lota (fot. J. Szlakowski)
Ryc. 9.25 Karaś pospolity Carassius carassius. Bokiny, oczko wodne
(fot. J. Szlakowski)
Ryc. 9.23 Wzdręga Scardinius erythrophthalmus (fot. J. Szlakowski)
Ryc. 9.24 Lin Tinca tinca. Suraż, oczko wodne (fot. J. Szlakowski)
178
górze pyskiem. Dzięki temu z łatwością zbiera z powierzchni wody opadające na nią owady. Jest jednym z niewielu
w ichtiofaunie polskiej gatunków, w którego diecie przeważają rośliny. Obok podwodnych „łąk” jej ulubionym miejscem żerowania są skupiska szuwarów, gdzie w gąszczu
trzcin poszukuje organizmów wodnych. W wodach Parku
Narodowego stanowi obok płoci ważny składnik pokarmu
szczupaka i okonia.
Gatunkiem zasiedlającym partie spokojnej wody jest lin
(Ryc. 9.24). Unika on stref z wyraźnym przepływem wody,
trzyma się natomiast miejsc z silnym porostem roślinności
wodnej, zwłaszcza tej zanurzonej oraz o liściach pływających na powierzchni. Często spotkać go można wśród
grzybieni wodnych i grążeli. W letnie popołudnia i wieczory nierzadko daje się usłyszeć charakterystyczne „cmokania” linów zbierających bezkręgowce z liści roślin wodnych. Lin jest rybą wytrzymałą, znoszącą wysokie i niskie
temperatury wody, a także silne spadki zawartości rozpuszczonego w niej tlenu.
Bardzo dużą odpornością na niekorzystne warunki środowiska charakteryzuje się karaś pospolity (Ryc. 9.25).
W dobrych warunkach pokarmowych ciało tej ryby jest
nieomal okrągłe, a głowa mała, w złych przybiera formę
głodową, tzw. humilis, o wydłużonym ciele z dużą głową.
Karaś pospolity jest rybą potrafiącą przetrwać w zbiornikach, w których zawartość rozpuszczonego tlenu spada do
zera, a temperatura zimą nieco poniżej zera. Okres niekorzystnych warunków potrafi przetrwać zagrzebany w mule.
Latem wytrzymuje wzrost temperatury wody do 36oC. Nie
dziwi zatem fakt, że nierzadko jest wyłącznym mieszkańcem zbiorników wodnych. W niektórych oczkach wodnych
na terenie Parku Narodowego karasiowi pospolitemu towarzyszy jedynie piskorz. W wodach Parku karaś pospolity jest gatunkiem nielicznym. Jest on wypierany przez karasia srebrzystego, gatunek inwazyjny, który przywędrował
do nas ze wschodu.
Gatunki chronione i pozostałe
„specjalnej troski”
Oprócz opisanych gatunków, wody Narwiańskiego Parku Narodowego są
siedliskiem ryb, które ze względu na osiągane małe rozmiary nie są w polu zainteresowania wędkarzy. Niemniej od strony roli odgrywanej w funkcjonowaniu
ekosystemów wodnych, jako ogniwo łańcucha troficznego, stanowią one bardzo
cenny składnik ichtiofauny zwiększający różnorodność gatunkową. Część
z nich jest objęta ochroną gatunkową w ramach prawa krajowego, część również
na mocy załącznika II Dyrektywy Siedliskowej. Gatunkami chronionymi w ramach europejskiej sieci Natura 2000 w obszarze Narwiańskie Bagna PLH200002
są: koza Cobitis taenia, minóg ukraiński Eudontomyzon mariae, piskorz Misgurnus fossilis oraz różanka Rhodeus amarus, a także boleń Aspius aspius, cechujący się większymi rozmiarami.
Minóg ukraiński (Ryc. 9.26) jest gatunkiem rzadkim na obszarze Parku Narodowego. Obecność tego przedstawiciela gromady krągłoustych Cyclostomata
stwierdzono w dolnym biegu dwóch dopływów Narwi: w Turośniance i Czapliniance. Larwy minoga ukraińskiego żyją w nanosach organicznych, odkładających się wzdłuż brzegów odcinków cieków o dnie piaszczystym, odżywiając się
detrytusem – rozdrobnionymi szczątkami roślin, zwierząt oraz ich odchodów,
występującymi na dnie zbiorników wodnych lub unoszącymi się w ich toni. Są
one pozbawione oczu stąd nazywane bywają „ślepicami” (podobnie jak larwy
innych gatunków minogów). Po około czteroletnim okresie larwalnym przeobrażenie w formę dojrzałą rozpoczyna się jesienią i trwa do wiosny. Tarło odbywa się od połowy kwietnia do połowy maja w odcinkach cieków z dnem żwirowatym. Osobniki dorosłe po tarle giną. W trakcie przeobrażenia do postaci
dorosłej następuje bowiem u nich atrofia (zanik) przewodu pokarmowego.
Piskorz (Ryc. 9.27) spotykany jest na obszarze całego Parku Narodowego,
szczególnie licznie w starorzeczach i oczkach wodnych, bowiem preferuje wolno
płynące i stojące wody. Jego pokarm stanowią małe bezkręgowce denne. NieRyc. 9.26 Minóg ukraiński Eudontomyzon
mariae (osobnik dorosły). Turośnianka,
Bojary (fot. J. Szlakowski)
Ryc. 9.27 Piskorz Misgurnus fossilis. Narew,
Bokiny (fot. J. Szlakowski)
179
Ryc. 9.28 Koza Cobitis taenia (fot. J. Ligięza)
zwykłą cechą piskorza jest jego reakcja na zmiany ciśnienia
atmosferycznego. Gdy ciśnienie atmosferyczne gwałtownie
spada, piskorz podpływa ku powierzchni wody, ustawia się
pionowo, głową w górę, i chwyta pyszczkiem powietrze
sponad powierzchni. Oddychanie nim możliwe jest dzięki
specjalnej sieci naczyń krwionośnych znajdujących się
w ściankach jelita tej ryby. Umożliwia to jej bytowanie
w wodach, w których zawartość tlenu spada do zera. Po
wyjęciu ryby z wody, powietrze wydostaje się z przewodu
pokarmowego z charakterystycznym piskiem, stąd też
wzięła się polska nazwa tego gatunku. Ponieważ piskorz
charakteryzuje się bardzo dużą zawartością tłuszczu
w mięśniach, niegdyś wykorzystywany był po wysuszeniu
jako świeczki do oświetlania pomieszczeń.
Koza (Ryc. 9.28) jest małą rybą o długości do 12 cm.
W Parku Narodowym jest nieliczna. Jej występowanie
stwierdzono w odcinkach Narwi z piaszczystym dnem
w rejonie Suraża oraz w ujściowych odcinkach Lizy i Szerokiej Strugi. W rowku skórnym pod okiem tej ryby znajduje się ruchomy dwudzielny kolec, unoszony w razie zagrożenia. Zaniepokojona koza zagrzebuje się w piasek.
Zdarza się obserwować stadko kóz ukrytych w piasku,
z którego wystają tylko ich głowy. Tarło jest porcyjne, trwa
od kwietnia do czerwca. Kleista ikra jest składana na roślinach podwodnych. Larwy ze skrzelami zewnętrznymi,
często rozwijają się wśród mat glonów nitkowych. Gatunek
związany jest z odcinkami potoków i rzek o piaszczystym
i piaszczysto-mulistym podłożu oraz z niezbyt szybkim
prądem wody. Pokarm kozy stanowią drobne bezkręgowce
denne.
Różanka (Ryc. 9.7) jest rybą stadną zamieszkującą przybrzeżne partie wód, chętnie przebywającą wśród roślinności wodnej, gdzie znajduje schronienie oraz pokarm. Odżywia się szczątkami roślin naczyniowych, glonami oraz niewielkimi bezkręgowcami wodnymi. Jej cykl życiowy jest
zależny od obecności małży z rodziny skójkowatych Unionidae, które są ważnym indykatorem dobrej jakości środowiska wodnego. W momencie tarła samica za pomocą pokładełka wprowadza ikrę przez syfon wypustowy małża do
jego jamy skrzelowej, po czym samiec wydala porcje plemników w okolice syfonu wpustowego. Plemniki zostają
„wessane” wraz z wodą do jamy skrzelowej małża i tam
180
dochodzi do zapłodnienia. Narybek różanki opuszcza
małża po 20–40 dniach. W tym okresie młode rybki osiągają długość 11 mm. Tarło różanki jest rozciągnięte w czasie i trwa od końca kwietnia do lipca. Różanka jest gatunkiem o bardzo ciekawym i nietypowym rozmieszczeniu.
Jej wschodnia cześć zasięgu obejmuje dorzecze Amuru
oraz rzeki wpadające do Morza Japońskiego. Na zachodzie
zasiedla wody środkowej Europy.
Mieszkańcem strefy nurtowej Narwi oraz jej dopływów
jest kiełb (kiełb krótkowąsy) (Ryc. 9.29). Kiełb preferuje
miejsca z wyczuwalnym przepływem wody i mineralnym,
piaszczystym dnem. Jest gatunkiem licznym, występującym na obszarze całego Parku Narodowego. Jest rybą towarzyską, trzymającą się płycizn, często tworzy liczne
stada. Prowadzi przydenny tryb życia, spędzając ciepłe
miesiące na płyciznach. Na zimę schodzi do głębszych
Ryc. 9.29 Kiełb Gobio gobio (fot. J. Szlakowski)
miejsc. Przystępuje do tarła na przełomie kwietnia i maja,
wybierając na miejsce rozrodu piaszczyste i żwirowe dno.
Najmniejszymi przedstawicielami ichtiofauny w wodach Narwiańskiego Parku Narodowego, osiągającymi
długość zaledwie 4–7 cm, są cierniczek oraz ciernik. Obydwa gatunki należą do rodziny cierniowatych. Na obszarze
Parku Narodowego cierniczek (Ryc. 9.30) występuje w do-
Ryc. 9.30 Cierniczek Pungitius pungitius
(fot. J. Ligięza)
pływach Narwi, w niektórych z nich (Kowalówka) tworzy większość zespołu
ryb. Trzyma się miejsc o dużym zagęszczeniu roślin. Zaniepokojony chowa się
wśród nich lub zakopuje w dnie. Pokarmem cierniczka są larwy i poczwarki
owadów wodnych, wioślarki, widłonogi oraz małżoraczki. Chętnie żeruje na
ikrze innych gatunków ryb. W okresie późnej wiosny i lata samiec z fragmentów
roślin buduje kuliste gniazdo, które zawiesza wśród roślin, kilka centymetrów
ponad powierzchnią dna. W gnieździe kilka samic składa ikrę, którą, jak i świeżo wyklutym potomstwem, opiekuje się samiec.
Mieszkańcem tych samych siedlisk w wodach Parku Narodowego jest ciernik (Ryc. 9.31). W odróżnieniu od cierniczka, na grzbiecie tej ryby znajdują się
zwykle trzy kolce (od 2 do 5). W skład diety ciernika wchodzą larwy owadów
wodnych, widłonogi, skąposzczety i wioślarki. Nie gardzi on ikrą innych gatunków ryb. Tarło odbywa w okresie późnej wiosny i lata. Samiec wybiera piaszczyste lub gliniaste miejsce na dnie, w którym wykopuje zagłębienie. Buduje w nim
z fragmentów roślin prymitywne, kuliste gniazdo. Do połączenia roślin wykorzystuje kleistą wydzielinę swych nerek. W gnieździe kilka samic składa ikrę,
pilnowaną następnie przez samca. Samiec strzeże nie tylko samego gniazda,
lecz także obszaru wokół niego, starając się odpędzić każdego, kto stanowi zaRyc. 9.31 Ciernik Gasterosteus aculeatus
(fot. J. Ligięza)
grożenie dla złożonej ikry i świeżo wyklutych larw. Cechą ciernika są niskie
wymagania dotyczące jakości wody, stąd spotykany bywa licznie także w wodach zanieczyszczonych.
Rybą żyjącą w niedużych stadkach, w spokojnych siedliskach o łagodnym
przepływie wody jest słonecznica, znana także pod nazwami owsianka czy
wierzchówka (Ryc. 9.32). Na obszarze Parku Narodowego spotykana w dopływach Narwi oraz starorzeczach i drobnych zbiornikach wodnych. Preferuje
wody zeutrofizowane (żyzne). Tworzy liczne populacje, stanowiąc ważne ogniwo łańcucha troficznego, jako konsument zooplanktonu i pokarm ryb drapieżnych. Tarło odbywa od kwietnia do czerwca. Tak jak u innych gatunków ryb
karpiowatych, u samca pojawia się w tym czasie wysypka tarłowa. Samica za
181
Ryc. 9.32 Słonecznica Leucaspius delineatus (fot. J. Ligięza)
Ryc. 9.33 Śliz Barbatula barbatula (fot. J. Ligięza)
pomocą krótkiego pokładełka przykleja ikrę w kolistych
lub spiralnych rzędach do łodyg roślin, następnie pilnuje
i opiekuje się nią samiec.
Rzadko spotykanym gatunkiem w wodach Parku Narodowego, jedynym przedstawicielem w naszych wodach rodziny przylgowatych, jest śliz (Ryc. 9.33). Jego siedliskiem
są głównie nurtowe fragmenty Narwi. Nielicznie występuje
także w niektórych dopływach. Ta niewielka, prowadząca
denny, nocny tryb życia ryba osiąga długość do około 15
cm. Pokarm śliza stanowi drobna fauna denna oraz glony,
a także ikra innych ryb. Dzień spędza on ukryty wśród roślinności, kamieni, korzeni nadbrzeżnych drzew. Tarło ma
miejsce na piaszczystym lub kamienistym podłożu. W tym
czasie samiec i samica posiadają wysypkę tarłową. Złożona
ikra jest pilnowana przez samca, do chwili pojawienia się
wylęgu. Gatunek jest odporny na zanieczyszczenie wody.
Znajduje się pod częściową ochroną gatunkową.
Gatunki inwazyjne
Na przełomie XX i XXI wieku w systemie rzecznym
Bugu pojawiły się inwazyjne gatunki ryb obcych: trawianka Percottus glenii, babka łysa Neogobius gymnotrachelus
i babka szczupła Neogobius fluviatilis (Kostrzewa i in.
2004). Nie pojawiły się one jeszcze w wodach Narwiańskiego Parku Narodowego. Jedynym odnotowanym tutaj do tej
pory gatunkiem obcym nadal pozostaje karaś srebrzysty
Carassius gibelio.
182
Ryc. 9.34 Karaś srebrzysty Carassius gibelio (fot. J. Szlakowski)
Karaś srebrzysty (Ryc. 9.34; Szczerbowski 2001) jest
rybą nielicznie występującą w wodach Parku Narodowego.
W strefie nurtu i w dopływach jest bardzo rzadki, najliczniej występuje w oczkach wodnych (około 5% liczebności
zespołu), konkurując w nich z karasiem pospolitym. Przeciętnie osiąga długość około 20 cm, zdarzają się jednak
osobniki większe. To gatunek ciepłolubny, bardzo wytrzymały na niską zawartość tlenu, ekstremalne temperatury,
podwyższoną mętność i złą jakość wody. Podobnie jak
u karasia pospolitego, również u karasia srebrzystego występują forma normalna oraz głodowa. Jest to gatunek potrafiący wykorzystywać wszelkiego rodzaju dostępny pokarm – od bentosu i planktonu, po detrytus, rośliny i sinice. Niezwykłą cechą tego gatunku jest występowanie
w większości w populacjach jednopłciowych, które tworzone są przez samice. Rozmnażają się one klonalnie poprzez
gynogenezę (rozwój partenogenetyczny, w którym nie następuje zaplemnienie komórki jajowej, a do aktywacji rozwoju jaja wystarcza jego krótkotrwały kontakt ze spermą
innych gatunków ryb karpiowatych). Ikra jest składana na
podwodnej roślinności. Wody Narwiańskiego Parku
­Narodowego stale zasilane są karasiem srebrzystym spływającym ze zbiornika Siemianówka. Pomimo tych sprzyjających gatunkowi uwarunkowań, stan populacji karasia
srebrzystego w Parku wskazuje, że funkcjonujące tutaj powiązania zespołów ryb z zasiedlanymi przez nie siedliskami skutecznie ograniczają inwazyjną presję tego gatunku.
Podsumowanie
Mozaika różnorodnych środowisk wodnych doliny
Narwi tworzy jeden wspólny ekosystem sprzyjający zachowaniu bioróżnorodności bytujących w nim zespołów
ichtiofauny. Zagęszczenia i biomasa ryb w starorzeczach
znacznie przewyższają te obserwowane w nurcie. Starorzecza otwarte odgrywają ogromną rolę jako tarliska oraz
miejsce wychowu i wzrostu narybku i młodzieży ryb. Nie
są natomiast stałym siedliskiem ryb należących do starszych grup wiekowych.
Ważną rolę w utrzymaniu różnorodności biologicznej
zespołów ryb Narwiańskiego Parku Narodowego i jego
otuliny pełnią również oczka wodne wraz ze starorzeczami
zamkniętymi oraz uchodzące do Narwi dopływy. Oczka
i zamknięte starorzecza są siedliskami piskorza oraz karasia pospolitego, natomiast dopływy – drobnych, często
chronionych gatunków ryb, w tym minoga ukraińskiego.
Warunkiem występowania bogatego pod względem
liczby gatunków zespołu ichtiofauny jest zachowanie przynajmniej istniejącego zróżnicowania siedliskowego ekosystemów wodnych. Powiązania pomiędzy poszczególnymi
siedliskami decydują bowiem o możliwości rozwoju gatunków ryb, odznaczających się znacznie zróżnicowanymi
wymaganiami odnośnie miejsc rozrodu, żerowania oraz
zimowania. Pod względem wartości przyrodniczej wszystkie siedliska są jednakowo cenne i decydują o wysokiej bioróżnorodności w odniesieniu do całego obszaru Parku Narodowego. Wynika to z dużej ruchliwości ichtiofauny,
przemieszczającej się w ciągu roku stosownie do realizacji
kolejnych faz cyklu życiowego poszczególnych gatunków.
Jest to również silnie związane z reżimem hydrologicznym
rzeki. Stąd też zachowanie i zapewnienie swobody migracji
ryb pomiędzy tymi siedliskami stanowi jeden z priorytetów ochrony tej grupy zwierząt.
Warto tutaj przypomnieć, że odtworzenie zniszczonych
lub chociażby tylko przekształconych i zubożonych środowisk i sieci powiązań ekologicznych może być trudnym
i długotrwałym procesem. Aarts i in. (2004), jako powód
powolnej odbudowy zespołów ryb, nieprzebiegającej równolegle ze znaczącą poprawą jakości wód w dużych rzekach
europejskich, jak Rodan, Dunaj, Ren i Mozela, widzą w utracie przez ryby, w wyniku regulacji rzek, siedlisk w głównym
korycie rzeki i na nizinie zalewowej, wraz z ekologiczną łącznością pomiędzy nimi. To przesłanie powinno mieć prze-
wodnie znaczenie w ochronie ichtiofauny w ekosystemach
wodnych Narwiańskiego Parku Narodowego.
Literatura
Aarts B. G. W.,van den Brink F. W. B., Nienhuis P. H. 2004.
Habitat loss as the main cause of the slow recovery of fish faunas of regulated large fishes in Europe: the transversal floodplain gradient. River Res. Applic. 20: 3–23.
Balon E. K. 1975. Reproductive guilds of fishes: a proposal and
definition. Can. J. Fish. Aquat. Sci. 32: 821–864.
Borcard D., Gillet F., Legendre P. 2011. Numerical Ecology
with R. Use R Series. Springer, New York.
Dyrektywa Rady 92/43/EWG z dnia 21 maja 1992 r. w sprawie
ochrony siedlisk przyrodniczych oraz dzikiej fauny i flory.
Kostrzewa J, Grabowski M., Zięba G., 2004. Nowe inwazyjne
gatunki ryb w wodach Polski. Arch. Ryb. Pol. 12 (2): 21–34.
Penczak T., Koszaliński H., Buczyńska M., Jakucewicz H.
1990. Ichtiofauna dorzecza Narwi. Część I. Narew. Rocz.
Nauk. PZW 3: 81–94.
Penczak T., Zaczyński A., Koszaliński H., Galicka W.,
Ułańska M., Koszalińska M. 1991. Ichtiofauna dorzecza
Narwi. Część III. Supraśl i inne rzeki Wysoczyzny Białostockiej. Rocz. Nauk. PZW 4: 65–81.
R Core Team 2016. R: a language and environment for statistical
computing. R Foundation for Statistical Computing, Vienna,
Austria. www.R-project.org.
Rozporządzenie Ministra Środowiska z dnia 6 października 2014
r. w sprawie ochrony gatunkowej zwierząt. Dz. U. z dnia 7
października 2014 r., poz. 1348.
Sych R., Nabiałek J., Wiśniewolski W. 1990. Ocena rybackiego znaczenia górnej Narwi. [W:] Banaszuk H. Czeczuga B.
(red.), Narwiański Park Krajobrazowy i okolice. Zagadnienia
Przyrodnicze i gospodarcze. Nauka i Praktyka 1: 179–196.
Szczerbowski J.A. 2001. Carassius auratus (Linneaus, 1758).
[W:] Banarescu P. M., Paepke H.-J. (red.), The Freshwater Fishes of Europe, 5/III Cyprinidae 2. Part III: Carassius to Cyprinus Gasterosteidae. AULA-Verlag: 5–41.
Szlakowski J., Buras P. 2006. Ichtiofauna jako indeks oceny
stanu ekologicznego rzek. [W:] Wołos A. (red.), Rybactwo –
Wędkarstwo – Ekorozwój. 151–169. Wyd. IRŚ, Olsztyn.
183
184
fot. S. Łupiński
10 Płazy i gady
Sebastian Ł. Łupiński • Włodzimierz Chętnicki
Wprowadzenie
Płazy Amphibia i gady Reptilia przez wieki należały do
zwierząt pogardzanych i okrytych złą sławą. Ich negatywny obraz do dziś funkcjonuje w wielu przesądach i porównaniach, jeszcze niedawno wszystkie węże oraz delikatnego
padalca uważało się za stworzenia bardzo jadowite i agresywne. Niewinnego zaskrońca, który był przed wiekami świętym wężem Litwy, pomawiano o wypijanie mleka krowom
z wymion a pożyteczne ropuchy – o zjadanie truskawek
w ogrodach. Wężom przypisywano również zdolność
hipnotyzo­
wania „bezbronnych ptaszków” a nawet ludzi.
Żółwie błotne trzymane w pojemnikach dla bydła miały
wpływać na podniesienie żywotności trzody, żaby w studniach – czyścić i chłodzić wodę. Salamandra wreszcie miała
być jakoby odporna na ogień i gustować w tym „diabelskim
środowisku” (Młynarski 1966). Wstręt i strach jakie budziły (i niestety często budzą) płazy czy gady wynikał z ich
wyglądu, nieznajomości biologii, domniemanej jadowitości czy też negatywnego wizerunku zakorzenionego w kulturze. Za przykład może posłużyć chociażby pomarszczona ropucha, będąca uosobieniem brzydoty oraz nieodzownym atrybutem i składnikiem tajemniczych eliksirów
wiedźm z baśni opowiadanych nam w dzieciństwie. Z kolei
wąż pojawiający się w ogrodzie Eden jest w kulturze chrześcijańskiej symbolem zła i grzechu, który doprowadził do
wyrzucenia Adama i Ewy z Raju. Na szczęście w ostatnich
latach ta niesprawiedliwa ocena uległa znaczącej zmianie
i zwierzęta te są coraz częściej postrzegane jako pożyteczne
i niezbędne do prawidłowego funkcjonowania wielu ekosystemów.
Batrachofauna1 Polski liczy 18 gatunków. Nizinne obszary kraju zamieszkuje 13 z nich; wszystkie przechodzą
rozwój zarodkowy i larwalny w wodzie. Dopiero po metamorfozie wykazują właściwe dla gatunku przywiązanie do
tego środowiska – wchodzą do niej jedynie w celach rozrodu lub spędzają znaczną część roku włącznie z hibernacją.
Również reptiliofauna naszego kraju jest uboga i liczy zaledwie ośmiu przedstawicieli: jeden gatunek żółwia, trzy gatunki jaszczurek i cztery gatunki węży. Spośród nich niemal wszystkie jaszczurki i węże prowadzą tryb życia niezależny od obecności zbiorników wodnych, jedynie zaskroniec
Natrix natrix preferuje obszary wilgotne i podmokłe.
1
Płazy i gady żyjące na danym obszarze określa się wspólnie
jako herpetofaunę, co jest zaszłością historyczną wynikającą
z pierwotnego traktowania tych zwierząt jako jednej gromady; dla odróżnienia fauna płazów nazywana jest batrachofauną, natomiast gadów reptiliofauną.
Herpetofauna Narwiańskiego
Parku Narodowego
Faunę płazów Narwiańskiego Parku Narodowego i jego
najbliższego otoczenia tworzy 12 gatunków (Tab. 10.1).
Najliczniej występują zwierzęta pospolite w całym kraju
(Głowaciński, Rafiński 2003): żaby brunatne i zielone
oraz ropucha szara Bufo bufo (Ryc. 10.1). Spośród występujących tu gatunków płazów traszka grzebieniasta Triturus
cristatus, kumak nizinny Bombina bombina, grzebiuszka
ziemna Pelobates fuscus, ropucha zielona Pseudepidalea viridis, ropucha paskówka Epidalea calamita, rzekotka
drzewna Hyla arborea i żaba moczarowa Rana arvalis objęte są ścisłą ochroną prawną. Kumak i traszka grzebieniasta
chronione są także na mocy II Załącznika do Dyrektywy
Siedliskowej. Pozostałe gatunki znajdują się pod ochroną
częściową.
Traszka grzeben
Traszka zwyczaj
Kumak nizinny
Grzebiuszka ziem
Ropucha szara
Traszka grzebeniasta
Traszka zwyczajna
Kumak nizinny
Rzekotka drzew
żaby zielone ogó
żaby brunatne o
Grzebiuszka ziemna
Traszka grzebeniasta
Traszka
grzebieniasta
Ropucha szara
Traszka zwyczajna
Rzekotka drzewna
Kumak nizinny
żaby zielone ogółem
Grzebiuszka ziemna
żaby brunatne ogółem
Ropucha szara
Ryc. 10.1 Udział procentowy poszczególnych gatunków
Rzekotka drzewna
płazów Amphibia wśród dorosłych osobników odłowionych
w Narwiańskim Parku Narodowym; n = 4936 (opracowanie
żaby zielone ogółem
własne)
żaby brunatne ogółem
185
Spośród płazów ogoniastych Caudata występują tu obie nizinne traszki –
traszka grzebieniasta i zwyczajna Lissotriton vulgaris. Pierwsza z nich jest najrzadszym płazem w Parku Narodowym (Ryc. 10.1; 10.2). Podczas ostatnich
badań wykazano tylko jedno stanowisko tego gatunku, na którym potwierdzono również jego rozród (Łupiński i in. 2013). Zlokalizowane jest ono w okolicach Topilca w dobrze zachowanym płacie olsu z wykształconą strukturą kępkowo-dolinową, który przechodzi w bór sosnowy obfitujący w liczne kryjówki
niezbędne dla tych zwierząt. Wcześniej jednego osobnika tego gatunku odnotowano w 2005 roku w okolicy Baciut podczas akcji przenoszenia płazów przez
drogę Białystok – Wysokie Mazowieckie (Łupiński i in. 2006). Ze względu na
duże wymagania siedliskowe, zarówno w stosunku do ekosystemów wodnych,
jaki i lądowych, ta rzadka traszka nie znajduje w Parku siedlisk o odpowiednich
parametrach. Za to mniejsza od niej traszka zwyczajna występuje na obszarze
Narwiańskiego Parku Narodowego stosunkowo często, a nawet nieco częściej
niż wcześniej (Ryc. 10.2). Gatunek ten w odróżnieniu od traszki grzebieniastej
ma mniejsze wymagania co do miejsc rozrodu i nie jest tak wrażliwy na presję
ryb (Juszczyk 1987).
100
90
2012‐2013ᵃ
2000‐2004ᵇ
80
zasiedlone stanowiska [%]
70
60
50
40
30
20
10
0
Tc
Lv
Bo
Pf
Bb
Pv
Ec
Ha
Pl
gatunek
Ryc. 10.2 Procent stanowisk zasiedlanych przez poszczególne gatunki płazów na obszarze
Narwiańskiego Parku Narodowego w dwóch różnych okresach: a – na podstawie Łupiński
i in. 2013, b – na podstawie Sidoruk 2005; Tc – Triturus cristatus traszka grzebieniasta, Lv –
Lissotriton vulgaris traszka zwyczajna, Bo – Bombina bombina kumak nizinny, Pf – Pelobates
fuscus grzebiuszka ziemna, Bb – Bufo bufo ropucha szara, Pv – Pseudepidalea viridis ropucha
zielona, Ec – Epidalea calamita ropucha paskówka, Ha – Hyla arborea rzekotka drzewna,
Pl – Pelophylax lessonae żaba jeziorkowa, Pe – Pelophylax kl. esculentus żaba wodna, Rt –
Rana temporaria żaba trawna, Ra – Rana arvalis żaba moczarowa, Zz – żaby zielone ogółem,
Zb – żaby brunatne ogółem.
186
Pe
Zz
Rt
Ra
Zb
Ryc. 10.3 Sposoby składania jaj przez krajowe gatunki płazów: a) jaja składane pojedynczo na
liściach roślin wodnych – traszki, b) skrzek postaci małych pakietów jaj przyklejanych wokół
roślin wodnych – kumak nizinny, c) skrzek w postaci grubego, stosunkowo krótkiego rulonu –
grzebiuszka ziemna, d) skrzek w postaci długich, cienkich sznurów – ropuchy, e) skrzek w postaci
małych pakietów – rzekotka drzewna f) skrzek w postaci dużych kłębów – żaby
Traszki na lądzie poruszają się powoli i niezdarnie, jednocześnie wijąc ciałem. Zmienia się to w środowisku wodnym, gdzie stają się zwinne i aktywne, dobrze pływają i polują na żyjące tam organizmy. Jest to możliwe dzięki silnie
bocznie spłaszczonemu ogonowi, który funkcjonuje jak
płetwa i stanowi główny narząd ruchu. Samce traszek nie
posiadają zdolności do wydawania głosów godowych, jednak w okresie rozrodu (po wejściu do wody) pojawia się u
nich charakterystyczna szata godowa, której głównym elementem jest wysoki fałd skórny (grzebień godowy) ciągnący się po grzbietowej stronie ciała. W czasie godów dojrzałe
osobniki zbierają się na tokowiskach w oczekiwaniu na odwiedzające je samice, które szukają partnera do rozrodu.
W tym celu wybierają na dnie zbiornika miejsca pozbawio-
ne roślinności, w których są dobrze widoczne. Funkcjonują
one jak areny, na których odbywają się zaloty oraz rywalizacje. Same zachowania godowe samców (toki) są bardzo
skomplikowane i zupełnie wyjątkowe w świecie płazów,
można je porównać do tańców godowych ptaków. Traszki
składają jaja w bardzo charakterystyczny sposób: samica
przykleja pojedyncze jajo do miękkich liści lub pędów roślin wodnych bądź zanurzonych (Ryc. 10.3) i tylnymi kończynami zawija roślinę w taki sposób, aby znalazło się ono
po wewnętrznej stronie zgięcia, całkowicie niewidoczne od
zewnątrz. W odróżnieniu od kijanek płazów bezogonowych, larwy traszek są drapieżne i podobne do form dorosłych (Ryc. 10.4; Juszczyk 1987a; Rybacki, Maciantowicz 2006).
187
Ryc. 10.4 Larwy traszek wyglądem przypominają osobniki dorosłe;
na zdjęciu wyrośnięta larwa traszki grzebieniastej Triturus cristatus
(fot. S. Łupiński)
się w pobliżu zbiorników, w których odbywał się rozród.
Szczególnie ważne dla tego gatunku są wilgotne lasy liściaste i wszelkiego rodzaju torfowiska, które są dla niego pierwotnymi siedliskami. Obecnie traszki grzebieniaste występują na bardzo różnych stanowiskach antropogenicznych,
gdzie znajdują się takie zbiorniki wodne, jak np. glinianki,
doły pożwirowe, rowy melioracyjne, stawy i rozlewiska,
w których mogą się rozmnażać. Zwierzęta te zimują w norach ziemnych, wśród korzeni drzew, pod stertami drewna, kamieni, liści a nawet w piwnicach (Juszczyk 1987a;
Berger 2000).
Traszka zwyczajna (Ryc. 10.6) należy do najpospolitszych płazów ogoniastych w naszym kraju. Podczas pobytu
w wodzie jej skóra jest gładka, zaś na lądzie chropowata
i ubarwiona w odcieniach brązu z czarnymi plamkami
przy czym samice są zazwyczaj jaśniejsze. Wyjątkowo jak
na traszki, samce tego gatunku osiągają większe rozmiary
od samic. Głównym elementem efektownej szaty godowej
samca jest nieprzerwany i regularnie falisto ząbkowany
grzebień godowy rozciągający się od głowy do końca ogona
(Juszczyk 1987a; Berger 2000).
Ryc. 10.5 Traszka grzebieniasta Triturus cristatus (fot. S. Łupiński)
Traszka grzebieniasta (Ryc. 10.5) pojawia się w zbiornikach wodnych z końcem marca lub na początku kwietnia
i rozmnaża się w nich do czerwca, wyjątkowo do końca
lipca. Dojrzałe samce, w porze godowej, wykształcają głęboko i nieregularnie powycinany grzebień, który w odróżnieniu od pojawiającego się u traszki zwyczajnej, jest przerwany nad nasadą ogona. Po zapłodnieniu samice składają
niewielkie porcje jaj stopniowo i przez długi okres czasu.
Są one około dwa razy większe od jaj traszki zwyczajnej.
Larwy traszki grzebieniastej są drapieżne i bardzo żarłoczne. Polują na drobne bezkręgowce wodne, larwy innych
płazów a nawet mniejsze osobniki własnego gatunku, jednak sposób zdobywania pokarmu sprawia, że są one łatwym łupem dla drapieżników, zwłaszcza ryb. Po metamorfozie większość młodych osobników opuszcza zbiorniki wodne i przebywa w ich pobliżu, stopniowo oddalając
się na coraz większe odległości. Nieliczne mogą zimować
w wodzie (Juszczyk 1987a; Pabijan 2010).
Traszka grzebieniasta jest gatunkiem przede wszystkim
niżowym i dużo bardziej związanym ze środowiskiem
wodnym niż nasze pozostałe gatunki traszek. W okresie
życia lądowego zajmuje silnie wilgotne siedliska znajdujące
188
Ryc. 10.6 Samiec traszki zwyczajnej Lissotriton vulgaris w szacie
godowej (fot. S. Łupiński)
Traszka zwyczajna jest zdolna do rozrodu w niskiej temperaturze, w związku z czym przystępuje do godów bardzo
wcześnie, pojawiając się w zbiornikach wodnych już
w końcu marca. Wybiera przy tym zarówno wody stojące
jak i spokojne odcinki wód płynących, przede wszystkim
jednak płytkie, małe stawy, glinianki, przydrożne rowy,
kanały melioracyjne, a często okresowe oczka wodne.
W okresie życia lądowego, który trwa do późnej jesieni,
traszki zwyczajne przebywają w pobliżu zbiornika wodnego (do 500 m), w którym się rozmnażały. Ich naturalnymi
środowiskami są łąki, lasy liściaste i mieszane, tereny pokryte zaroślami, również parki, sady czy ogrody gdzie
mogą ukryć się wśród krzewów, w zagłębieniach i pod różnymi przedmiotami. W okresie rozrodczym, podczas opadów deszczu i wędrówek na zimowiska traszki są aktywne
przez całą dobę. Przez resztę sezonu prowadzą nocny tryb
życia udając się na łowy dopiero wieczorem. Zimują wyłącznie na lądzie, niekiedy bardzo licznie i w towarzystwie
innych płazów, w różnych szczelinach powierzchni gruntu,
murach, drewnie, w mchu, ściółce leśnej a także w obrębie
zabudowań ludzkich i piwnicach (Juszczyk 1987a; Berger
2000; Mazgajska 2009).
Kumak nizinny jest często spotykanym płazem (Ryc.
10.2), a jego charakterystyczne głosy godowe można usłyszeć prawie w 1/5 zbiorników wodnych Parku. Gatunek ten
występuje głównie w południowej i centralnej części obszaru, najczęściej w płytkich, szybko nagrzewających się
rozlewiskach, stawach i oczkach wodnych, pozbawionych
ryb i położonych w brzeżnych częściach doliny. Szczególnie liczna populacja kumaka zamieszkuje okolice Suraża.
Sprzyja temu niewątpliwie sieć odpowiednich zbiorników
wodnych, która zapewnia możliwość migracji i pozwala na
utrzymanie stabilnej populacji gatunku.
Pora godowa kumaka nizinnego jest uzależniona od
dwóch czynników: temperatury wody w zbiornikach roz-
Kumak nizinny jest zwierzęciem wybitnie ciepłolubnym, o największym przywiązaniu do środowiska wodnego spośród wszystkich krajowych płazów i wykazującym
aktywność całodobową, jednak większą w dzień. W odróżnieniu od innych gatunków płazów dorosłe kumaki nie
wygrzewają się na brzegu zbiornika, lecz przebywają bezpośrednio w wodzie. Szybko kolonizują nowo powstałe
akweny, a po okresie godowym często wędrują na inne obfitujące w pokarm stanowiska. Migracje odbywają się również w okresie rozrodu. Kumaki pokonują wtedy odległości do kilkuset metrów, wędrując zarówno w dzień, jak
i w nocy, jedynie po deszczu i w okresach dużej wilgotności. Na lądzie zwierzęta te w poczuciu zagrożenia, przyjmują specyficzną pozę (tzw. refleks kumaka) wyginając
łukowato ciało i eksponując jaskrawe, ostrzegawcze
ubarwienie powierzchni podgardzielowej i brzusznych powierzchni nóg. Kumaki nizinne zimują zwykle gromadnie
w norach ziemnych, często wspólnie z ropuchami i traszkami (Juszczyk 1987a; Mazgajska, Rybacki 2012).
Ryc. 10.7 Samiec kumaka nizinnego Bombina bombina w trakcie
wydawania głosu godowego (fot. J. M. da Costa)
Ryc. 10.8 Grzebiuszka ziemna Pelobates fuscus
(fot. S. Łupiński)
rodczych oraz od ilości opadów atmosferycznych. Samce
tego gatunku można odróżnić od samic jedynie w czasie jej
trwania. Pojawiają się u nich wtedy płaskie modzele godowe, a podczas wydawania głosów charakterystycznie nadymają ciało i wewnętrzne rezonatory znajdujące się na dnie
jamy gębowej (Ryc. 10.7). Kumaki pojawiają się w zbiornikach najczęściej w kwietniu, jednak gody nie odbywają się
masowo i obejmują trzy miesiące, miedzy majem i lipcem.
Samica składa jaja porcjami, w postaci małych pakietów,
przyklejając je luźno do roślinności podwodnej (Ryc. 10.3),
przy czym proces ten jest mocno rozciągnięty w czasie.
Miejscem rozrodu są przeważnie małe i płytkie naturalne
zbiorniki wody stojącej o mulistym dnie, silnie porośnięte
roślinnością wodną i pozbawione zanieczyszczeń. Mogą to
być starorzecza, zalewane łąki, stawy rybne, małe jeziorka
i oczka wodne, glinianki, żwirownie czy rowy melioracyjne (Juszczyk 1987a; Mazgajska, Rybacki 2012).
Dużo rzadsza jest grzebiuszka ziemna (Ryc. 10.8), która
występuje w niewielu miejscach i mało licznie (Ryc. 10.1;
Ryc. 10.2; Łupiński i in. 2013), podczas gdy jeszcze niedawno była gatunkiem pospolitym na obszarze Parku Narodowego (Ryc. 10.2; Sidoruk 2005) zwłaszcza w brzeżnych
częściach doliny, gdzie znajdują się preferowane przez nią
luźne i piaszczyste grunty (Juszczyk 1987a; Berger 2000).
Grzebiuszki godują bardzo skrycie i nigdy masowo,
a sam rozród jest rozciągnięty w czasie i trwa kilka tygodni
(wyjątkowo do lipca). W odróżnieniu od innych gatunków
płazów bezogonowych, zdolność do wydawania głosów godowych, przypominających ciche stukanie, posiadają zarówno samce, jak i samice. Grzebiuszka rozmnaża się
w różnego typu zbiornikach począwszy od rowów melioracyjnych, poprzez małe, polne oczka wodne, kończąc na sezonowych rozlewiskach podeszczowych, jednak najchętniej wybiera te posiadające piaszczyste dno i silnie poro189
śnięte roślinnością. Samica składa skrzek w postaci
charakterystycznego grubego sznura (Ryc. 10.3), leżącego
luzem na roślinach blisko powierzchni wody lub owiniętego wokół ich pędów. Kijanki grzebiuszki osiągają największe rozmiary wśród form larwalnych pozostałych polskich
płazów. Mogą dorastać nawet do 18 cm, przekraczając tym
samym ponad dwukrotnie rozmiary osobników dorosłych.
Co ciekawe, larwy, które wykluły się z jaj złożonych późno,
mogą zimować w wodzie i przejść metamorfozę dopiero
w następnym roku (Juszczyk 1987a; Krzysztofiak,
Krzysztofiak 2014).
Grzebiuszka ziemna, poza okresem godowym, podczas
którego jest aktywna również w dzień, prowadzi wyłącznie
lądowy i nocny tryb życia. Jako, że jest płazem bardzo
skrytym trudno jest ją spotkać. Zamieszkuje miejsca o glebach, w których łatwo może się zagrzebać, np. lekkich,
piaszczystych, często w borach sosnowych. Lubi też przebywać w ogródkach warzywnych i na polach uprawnych.
Na sen zimowy zakopuje się w ziemi lub zasiedla nory gryzoni, korytarze kretów, a nawet gniazda jaskółek brzegówek (Juszczyk 1987a; Mazgajska 2009).
Jeszcze na początku XXI w. na obszarze Parku występowały wszystkie trzy krajowe gatunki ropuch: szara, zielona
i paskówka, przy czym już wtedy dwie ostatnie należały do
gatunków rzadkich (Ryc. 10.2; Sidoruk 2005). Podczas
ostatnich badań nie wykazano ich obecności, a najbliższe
stanowiska obu gatunków znajdują się w sąsiedztwie Narwiańskiego Parku Narodowego, w obrębie żwirowni we wsi
Jeńki-Romanowo. Ropucha zielona i paskówka przystępują
tam wspólnie do rozrodu, co jest często obserwowanym
zjawiskiem. Preferowane przez nie zbiorniki są bardziej
podatne na wysychanie i zarastanie, toteż zwierzęta te nie
są przywiązane do miejsc, w których składają jaja. Kiedy
zbiorniki rozrodcze tracą określone cechy bądź wysychają
płazy migrują w poszukiwaniu lepszych siedlisk (Juszczyk
1987a). Wydaje się, że są one stałym, aczkolwiek nielicznym składnikiem batrachofauny Parku Narodowego i w
niektórych latach mogą przemieszczać się z jego obszaru
w miejsca bardziej im odpowiadające. Nasza największa
ropucha – ropucha szara – jest jednym z najliczniejszych
gatunków płazów na obszarze Parku, a jej populacja jest
względnie stała (Ryc. 10.2).
W odróżnieniu od żab zielonych czy kumaków, ropuchy
to zwierzęta o wybitnie lądowym trybie życia, które do
wody wchodzą jedynie w okresie rozrodczym. Przed atakiem drapieżników chroni je szorstka skóra wyposażona
w liczne gruczoły jadowe, tworzące skupienia w postaci
brodawek. Szczególnie charakterystyczne i dobrze widoczne są nerkowate gruczoły przyuszne, tzw. parotydy, różnie
rozwinięte u naszych gatunków. Wbrew obiegowej opinii
ropuchy nie są w stanie wydzielać jadu „na zawołanie”. Dopiero mechaniczny uraz np. zranienie czy ugryzienie powoduje jego wyciśnięcie w miejscu gdzie do niego doszło.
Wszystkie składają skrzek w postaci długich cienkich
sznurów (Ryc. 10.3).
Ropucha szara przystępuje do rozrodu najwcześniej,
spośród naszych ropuch. Migracje do zbiorników wodnych
rozpoczyna wkrótce po zakończeniu snu zimowego, pojawiając się w nich zazwyczaj pod koniec godów żaby trawnej. Do łączenia w pary dochodzi często już w czasie wędrówek. Dużo mniejszy i smuklejszy od samicy samiec,
190
wdrapuje się na nią, mocno chwyta i dalszą drogę pokonuje podróżując przyczepiony do grzbietu partnerki (Ryc.
10.9). Samce ropuchy szarej w odróżnieniu od naszych pozostałych ropuch nie posiadają rezonatorów dlatego ich
głos godowy jest słabo słyszalny. Gatunek nie wykazuje
szczególnych preferencji, co do miejsca rozrodu, wyraźnie
jednak unika małych, okresowych zbiorników (Juszczyk
1987a; Berger 2000).
Ryc. 10.9 Ropuchy szare Bufo bufo w ampleksusie (fot. S. Łupiński)
Młode, niedojrzałe ropuchy szare są aktywne przez całą
dobę. Natomiast dorosłe aktywność całodobową wykazują
jedynie podczas okresu godowego oraz migracji na zimowiska. Poza tymi okresami osobniki dojrzałe są aktywne
w nocy – w dzień wychodzą tylko po deszczu. Ropucha
szara zamieszkuje najczęściej wilgotne lasy liściaste i mieszane, łąki, pola uprawne, sady i ogrody. Unika przy tym
terenów suchych i piaszczystych, jak również bardzo podmokłych. Ponieważ jest zwierzęciem bardzo żarłocznym,
zjada wszystko, co znajduje na swojej drodze. Poluje na
duże dżdżownice, nagie ślimaki, owady, pająki, a nawet
małe kręgowce. Na sen zimowy wybiera głębokie dziury,
nory w ziemi czy piwnice. Często zimuje gromadnie z innymi płazami – czasem nawet w płynącej wodzie razem
z żabą trawną i wodną (Juszczyk 1987a; Herczek, Gorczyca 2004).
Pozostałe ropuchy – zielona i paskówka wykazują bardzo wiele cech wspólnych. Obydwie są zwierzętami ciepłoi deszczolubnymi, a ich gody przebiegają niemal identycznie, nieraz w tych samych płytkich, szybko nagrzewających
się zbiornikach i w tym samym czasie. W związku z tym
dość często się krzyżują. Większa z nich, ropucha zielona
(Ryc. 10.10), dzięki obecności zielonych plam pokrywających jasny grzbiet posiada bardzo ciekawe ubarwienie maskujące. Wyróżnia się również dużą wytrzymałością na
suszę oraz wysokie i niskie temperatury. Paskówka (Ryc.
10.11), co jest nietypowe wśród naszych ropuch, woli biegać
niż skakać, przez co dawniej nazywana była ropuchą
żwawą. Obydwa gatunki zimują na lądzie, w różnych kryjówkach ziemnych, a nawet piwnicach (Juszczyk 1987a;
Mazgajska 2009).
Ryc. 10.10 Ropucha zielona Pseudepidalea viridis (fot. S. Łupiński)
Ryc. 10.11 Ropucha paskówka Epidalea calamita (fot. S. Łupiński)
Rzekotka drzewna jest stosunkowo często występującym płazem, który zasiedla ponad 15% stanowisk w Parku
Narodowym (Ryc. 10.2). Dorosłe osobniki można spotkać
nieraz w dzień, gdy przebywają wśród traw i zakrzewień
w pobliżu miejsc, gdzie wcześniej słyszano głosy godowe
samców tego gatunku. Liczba stanowisk zasiedlanych
przez tego drobnego płaza zmniejsza się, co może być efektem zaniku czystych zbiorników, zarośniętych roślinnością wodną i szuwarami oraz intensywnie nasłonecznionych. Częściowo może to być też spowodowane obserwowanym od pewnego czasu wycofywaniem się gatunku
z północno-wschodniej Polski (Siwak i in. 2008).
Rzekotka, jako nasz jedyny płaz, potrafi się doskonale
wspinać i jest jednocześnie jedynym europejskim gatunkiem o nadrzewnym trybie życia (Ryc. 10.12). Skóra pokrywająca jej grzbiet jest zazwyczaj trawiastozielona, jednak
barwa ta może ulegać zmianie pod wpływem różnych
czynników zewnętrznych, np. temperatury otoczenia lub
wilgotności powietrza. Dzięki obecności dużego rezonatora znajdującego się pod językiem samce rzekotek należą do
płazów wydających najdonioślejszy głos w czasie pory godowej, słyszalny nawet z odległości kilku kilometrów
(Juszczyk 1987a; Mazgajska 2009).
Rzekotka należy do naszych najbardziej ciepłolubnych
płazów, dlatego gody rozpoczyna stosunkowo późno, zazwyczaj pod koniec kwietnia. Rozród przebiega w zbiornikach mocno porośniętych roślinnością wodną i szuwarami
oraz intensywnie nasłonecznionych. Liczebność godujących zwierząt jest tym większa, im więcej jest zarośli bądź
skupień drzew, zwłaszcza wierzb, w ich pobliżu. W okresie
rozrodczym rzekotki wykazują aktywność nocną. W dzień
przebywają na lądzie wśród niskiej roślinności trawiastej
lub siedzą na pędach roślin wynurzonych z wody, a dopiero
o zmierzchu wchodzą do wody. Samice składają jaja w kilku
małych, zbitych pakietach (Ryc. 10.3). Na miejsca hibernacji rzekotki wybierają ziemne szczeliny pod grubą warstwą
opadłych liści lub gęste poszycie trawiastej roślinności
(Juszczyk 1987a; Krzysztofiak, Krzysztofiak 2014).
W Parku Narodowym pospolicie występują dwa gatunki żab zielonych – żaba jeziorkowa Pelophylax lessonae
i żaba wodna P. kl. esculentus2. Biorąc pod uwagę ogół żab
zielonych (Pelophylax esculentus complex), wraz z nieoznaczonymi przedstawicielami tej grupy3, aktualnie płazy te
występują w blisko 60% zbiorników Narwiańskiego Parku
Narodowego, co oznacza około 20% spadek w stosunku do
stanu z początku XXI wieku (Ryc. 10.2). Jak dotąd na obszarze Parku nie odnotowano żaby śmieszki P. ridibundus
(Sterzyńska i in. 2002; Sidoruk 2005; Łupiński i in. 2013)
pomimo, że zasięg geograficzny tego gatunku obejmuje
również teren północno-wschodniej Polski (Głowaciński,
Rafiński 2003), a Park obfituje w środowiska przez nią
preferowane: duże zbiorniki wodne, stawy hodowlane
i starorzecza (Juszczyk 1987a). Żaby zielone są mocno
2
Ryc. 10.12 Rzekotka drzewna Hyla arborea jest jedynym
europejskim płazem, który prowadzi nadrzewny tryb życia
(fot. S. Łupiński)
3
Żaba wodna należy do grupy żab zielonych, lecz nie jest
gatunkiem, a naturalną i trwałą hybrydą żaby jeziorkowej
i żaby śmieszki; w niniejszym opracowaniu dla uproszczenia
będzie jednak nazywana gatunkiem.
Żaby zielone są trudne do oznaczenia; kiedy nie godowały,
bądź niemożliwe było ich schwytanie w celu pewnej identyfikacji, zliczano widoczne osobniki, a następnie klasyfikowano je jako nieoznaczone żaby zielone.
191
Ryc. 10.13 Żaba jeziorkowa Pelophylax lessonae
(fot. M. Giedrewicz)
Ryc. 10.14 Żaba wodna Pelophylax kl. esculentus
(fot. M. Giedrewicz)
związane ze środowiskiem wodnym a ich okres godowy,
poprzedzony intensywnym żerowaniem, przypada dopiero
na maj–czerwiec.
Żaba jeziorkowa (Ryc. 10.13) należy do płazów ciepłolubnych, dlatego też do godów przystępuje późno. Jednak
spośród trzech form żab zielonych pora godowa tej żaby
przypada najwcześniej. Rozpoczyna się ona z końcem
kwietnia i trwa do końca maja, czasem jeszcze w czerwcu.
Na miejsca rozrodu wybiera małe, obficie zarośnięte i płytkie zbiorniki zazwyczaj z wodą stojącą. Jest słabiej związana ze środowiskiem wodnym niż pozostałe żaby zielone
i stosunkowo często podejmuje wędrówki po lądzie. Jest
gatunkiem o aktywności dziennej. Może zimować zarówno na lądzie jak i na dnie strumieni oraz innych niewielkich wód płynących (Juszczyk 1987a).
Żaba wodna (Ryc. 10.14) należy do grupy żab zielonych,
lecz nie jest gatunkiem a naturalną i trwałą hybrydą, najczęściej mieszańcem żaby jeziorkowej i żaby śmieszki.
Łączy w sobie wiele cech obu gatunków, zarówno morfo­
logicznych, jak również ekologicznych i biologicz­
nych.
192
Ryc. 10.15 Żaba trawna Rana temporaria
(fot. S. Łupiński)
Większą część życia spędza w wodzie i wykazuje aktywność dzienną. Żaba wodna okres godowy rozpoczyna
w połowie maja. Jest formą eurytopową, co pozwala jej zasiedlać prawie wszystkie typy zbiorników wodnych. Wykazuje duże tendencje do wędrówek (także po lądzie) i z reguły jest pierwszym płazem, który zasiedla nowo powstałe
akweny (żwirownie, glinianki, torfianki). Jest także najliczniejszą żabą zieloną w zbiornikach poddanych silnej
antropopresji. Ze względu na mieszańcowe pochodzenie,
forma ta jest bardziej odporna na niekorzystne zmiany zachodzące w środowisku niż inne żaby zielone. Dorosłe żaby
wodne zimują na dnie wód płynących (Juszczyk 1987a).
Oba żyjące w tej części kraju gatunki żab brunatnych –
żaba trawna Rana temporaria i moczarowa występują pospolicie na całym obszarze Parku Narodowego (Ryc. 10.1).
Rozmnażają się one we wszystkich typach zbiorników
wodnych, od okresowych rozlewisk po stawy hodowlane.
W porze godowej przedstawicieli żab brunatnych można
spotkać w prawie 85% występujących tu zbiorników wodnych, przy czym, odmiennie do lat poprzednich, są to częściej żaby moczarowe (Ryc. 10.2). Żaby brunatne przystępują do rozrodu bardzo wcześnie, bo w okresie końca
marca – pierwszej dekady kwietnia, czyli zaraz po opuszczeniu miejsc zimowania. Poza okresem godowym osobniki dorosłe prowadzą wybitnie lądowy tryb życia (Juszczyk
1987a; Herczek, Gorczyca 2004).
Wiosną żaby trawne (Ryc. 10.15) są pierwszymi żabami
budzącymi się ze snu zimowego i ogólnie rozpoczynają
gody najwcześniej ze wszystkich polskich płazów. Rozród
trwa jedynie kilka dni – zaczyna się przy niskich temperaturach wody głównie w małych i płytkich stawach, kałużach czy rozlewiskach łąkowych. Godujące samce skupiają
się w najliczniej w płytkim, zarośniętym roślinnością i najcieplejszym miejscu zbiornika. Poza okresem godowym
żaba trawna prowadzi wyłącznie lądowy, zmierzchowonocny tryb życia. Zasiedla różnorodne środowiska, zarówno lądowe, jak i podmokłe – lasy, tereny porośnięte krzewami, łąki, polany leśne, tereny trawiaste, torfowiska. Spotyka się ją też na polach, w ogrodach, parkach, nie tylko na
obszarach rolniczych, ale także w miastach. Dorosłe osobniki zimują gromadnie wyłącznie w zbiornikach wodnych
zagrzebane w mule, przede wszystkim w wolno płynących
strumieniach i rzekach, rzadziej stawach (Juszczyk 1987a;
Berger 2000).
Żaba moczarowa przystępuje do rozrodu wczesną wiosną zazwyczaj pod koniec godów żaby trawnej. Miejscem
rozrodu są płytkie zbiorniki o czystej wodzie, w których
najpierw pojawiają się samce. Podczas ciepłej i słonecznej
pogody przybierają one intensywne niebieskie lub niebiesko-liliowe zabarwienie (Ryc. 10.16) i gromadzą się na płyciznach, w zacisznych zatoczkach porośniętych roślinnością wodną (pałką wodną, sitowiem, trzciną) nieustannie
wydając głosy godowe (Juszczyk 1987a). Poza okresem
rozrodczym żaba moczarowa prowadzi lądowy tryb życia,
może żyć nawet w dość suchych biotopach, gdyż jest bardziej wytrzymała na brak wody. Występuje na łąkach, w lasach, na polanach śródleśnych. Można ją spotkać w dzień
nie tylko podczas deszczu, jak większość płazów, ale także
przy słonecznej pogodzie. Na sen zimowy wybiera różne
kryjówki: ziemne zakamarki, nory, jamy, dziury pod korzeniami drzew lub bezpośrednio na powierzchni ziemi
pod sągami drewna, stertami gałęzi czy chrustu. Zdarza się
również, że zimuje w wodzie (Juszczyk 1987; Berger
2000; Mazgajska 2009)
Populacje gadów są z reguły nieliczne, a osobniki
poszczególnych gatunków prowadzą skryty tryb życia i w
czasie godów nie tworzą wielogatunkowych zgrupowań,
jak płazy. Przez to ich monitoring jest dużo trudniejszy,
a informacje dotyczące tej gromady kręgowców są zbierane
zazwyczaj przy okazji prowadzenia innych badań. Pomimo,
iż obserwacje dotyczące tych zwierząt prowadzone są
Ryc. 10.16 w czasie pory godowej samce żab moczarowych Rana
arvalis przybierają intensywnie niebieską lub niebiesko-liliową
barwę (fot. S. Łupiński)
w Narwiańskim Parku Narodowym dopiero od niedawna,
widać, że grupa ta jest uboga w gatunki i zdominowana
przez jeden z nich. Lokalną faunę gadów reprezentuje
jedynie trzech przedstawicieli tej gromady, dwie jaszczurki
– zwinka Lacerta agilis i żyworodna Zootoca vivipara oraz
jeden gatunek węża – zaskroniec zwyczajny (Tab. 10.1).
Wszystkie te gatunki objęte są ochroną częściową.
Tab. 10.1 Skład i status ochronny herpetofauny Narwiańskiego Parku Narodowego i jego najbliższego otoczenia (oryg.)
Nazwa polska
Nazwa naukowa
Płazy
Amphibia
Status ochronny
Dyrektywa Siedliskowa
II, IV
Traszka grzebieniasta
Triturus cristatus
1*
Traszka zwyczajna
Lissotriton vulgaris
2
Kumak nizinny
Bombina bombina
1*
II, IV
IV
Grzebiuszka ziemna
Pelobates fuscus
1
Ropucha szara
Bufo bufo
2
Ropucha zielona
Pseudepidalea viridis
1
IV
Ropucha paskówka
Epidalea calamita
1
IV
Rzekotka drzewna
Hyla arborea
1*
IV
Żaba jeziorkowa
Pelophylax lessonae
2, 3
IV
Żaba wodna
Pelophylax kl. esculentus
2, 3
V
Żaba trawna
Rana temporaria
2
V
1
IV
IV
Żaba moczarowa
Rana arvalis
Gady
Reptilia
Jaszczurka zwinka
Lacerta agilis
2
Jaszczurka żyworodna
Zootoca vivipara
2
Zaskroniec zwyczajny
Natrix natrix
2
Zgodnie z Rozporządzeniem Ministra Środowiska z dnia 6 października 2014 r. w sprawie ochrony gatunkowej zwierząt (Dz. U. z 2014 r.
poz. 1348): gatunki objęte: 1 – ochroną ścisłą, 1* – ochrona ścisłą wymagające ochrony czynnej, 2 – ochroną częściową, 3 – zakazem przetrzymywania, posiadania, zbywania, oferowania do sprzedaży, wymiany, darowizny, a także wywożenia poza granicę państwa. Gatunki
ważne dla Wspólnoty Europejskiej, zamieszczone w Załącznikach do Dyrektywy Siedliskowej UE: II – wymagające wyznaczenia specjalnych obszarów ochrony, IV – wymagające ochrony ścisłej, V – których pozyskiwanie ze stanu dzikiego może podlegać ograniczeniom
193
Ryc. 10.17 Jaszczurka żyworodna Zootoca
vivipara (fot. M. Giedrewicz)
Ze względu na specyfikę obszaru, najliczniej występującym gadem jest
żyworódka (Ryc. 10.17; Łupiński i in. 2013), którą spotykać można w typowych
środowiskach, tj. na podmokłych łąkach, torfowiskach, w pobliżu zbiorników,
a nawet na roślinności wynurzonej rosnącej w strefach brzegowych zbiorników
wodnych. Podczas okresu godowego, rozpoczynającego się około połowy kwietnia, samce przybierają intensywne jaskrawozielone barwy i toczą walki o prawo
do kopulacji (Juszczyk 1987b).
Nazwa jaszczurki żyworodnej jest związana ze sposobem, w jaki się rozmnaża. Zapłodnione jaja dojrzewają w jajowodach samicy, aż do uzyskania przez
zarodki ostatecznej postaci, umożliwiającej im samodzielne życie po urodzeniu.
Młode wylęgają się albo w ciele matki bezpośrednio przed złożeniem jaj lub
zaraz po nim. Ta zdolność do rodzenia w pełni rozwiniętych młodych pozwoliła żyworódce uniezależnić się od suchych miejsc składania i inkubacji jaj oraz
skolonizować nieprzyjazne tereny.
Ryc. 10.18 Jaszczurka zwinka Lacerta agilis
(fot. S. Łupiński)
Jaszczurka ta jest zdecydowanie mniej ciepłolubna i bardziej wytrzymała na
zimno w porównaniu do zwinki. Jest aktywna w dzień i zamieszkuje wilgotne,
słabo nasłonecznione polanki leśne, obrzeża lasów, brzegi torfowisk i podmokłych łąk. Spotyka się ją również w chłodne dni, podczas gdy jaszczurki zwinki
przebywają wtedy w ukryciu. Dobrze pływa i w razie niebezpieczeństwa chętnie
wskakuje do wody. Żyworódka żywi się drobnymi owadami, pająkami, a także
ślimakami i dżdżownicami. W zależności od warunków atmosferycznych sen
194
Ryc. 10.19 Zaskroniec zwyczajny Natrix
natrix (fot. S. Łupiński)
zimowy rozpoczyna pod koniec października lub nawet na początku listopada
(Juszczyk 1987b; Berger 2000).
Drugi gatunek jaszczurki – zwinka (Ryc. 10.18), nie znajduje w Narwiańskim
Parku Narodowym sprzyjających warunków do życia ze względu na małą ilość
preferowanych siedlisk – suchych, mocno nasłonecznionych stanowisk z niską
roślinnością, piaszczystych lub o luźnym podłożu, dogodnym do kopania norek
i jamek. W związku z tym zwierzę to występuje w niewielu miejscach, jedynie na
suchych, brzeżnych obszarach doliny, m.in. na murawach napiaskowych w okolicy Łap i uroczyska Rynki oraz na łące kośnej w okolicach Bokin (Łupiński i in.
2013). W otulinie Parku Narodowego, w miarę oddalania się od obszarów wilgotnych, stosunek dominacji zmienia się na typowy dla reszty kraju i to jaszczurka zwinka jest gatunkiem liczniejszym.
Jaszczurka zwinka jest gadem dziennym i wybitnie ciepłolubnym, noce spędza w norce stanowiącej jej schronienie. Występuje w różnych środowiskach, na
terenach krzewiastych, trawiastych, na skrajach polan leśnych, poboczach dróg
i nasypach kolejowych. W odróżnieniu od jaszczurki żyworodnej zwinka słabo
pływa i szybko tonie. Najczęstszym łupem tego gada padają bezkręgowce.
W skład codziennej diety wchodzą pająki, owady oraz ślimaki. Zdarza się również, że jaszczurka pożywia się gąsienicami. Czasem zwinka staje się kanibalem
i pożera młode własnego gatunku, bądź innych jaszczurek. Dorosłe osobniki
tego gatunku zapadają w sen zimowy pod koniec września (Juszczyk 1987b).
Zaskroniec (Ryc. 10.19), jedyny występujący w Parku wąż, jest gatunkiem
nielicznym i obserwowanym bardzo rzadko. Ostatnie pewne doniesienia na
temat tego gada pochodzą z uroczyska Rynki gdzie spotykano go raczej incydentalnie (Pućkowski, Krzyściak-Kosińska 2012; Pućkowski 2015). Warto
nadmienić, że niedaleko granic Parku, bo w Surażu, gatunek ten występuje na
kilku stanowiskach, a rozmnaża się z powodzeniem przynajmniej na jednym
z nich (Łupiński in. 2013).
Podczas okresu godowego, trwającego zazwyczaj od kwietnia do końca maja,
dorosłe zaskrońce gromadzą się w duże grupy (nawet kilkadziesiąt osobników),
tworząc kłębowiska godujących węży. Najczęściej skupiają się wtedy w zacisznych, nasłonecznionych lub słabo zacienionych miejscach, często w pobliżu kryjówek, w których spędziły sen zimowy. Zaskroniec jest zwierzęciem jajorodnym
– samica składa jaja otoczone miękką, skórzastą osłonką w stertach kompostu,
nawozu, trocin lub gnijących liści. Młode węże, w zależności od temperatury
otoczenia, wykluwają się od sierpnia do późnej jesieni (Juszczyk 1987b).
Zaskroniec jest gatunkiem o aktywności dziennej, przystosowanym do życia
w rozmaitych warunkach i środowiskach. Preferuje jednak tereny podmokłe,
bagniste, żyje w pobliżu rozmaitych zbiorników wodnych. Doskonale pływa
195
i nurkuje, a w wodzie szuka schronienia, kiedy jest prześladowany. Odżywia się głównie płazami (najczęściej żabą
wodną, jeziorkową, trawną, moczarową i ropuchą szarą),
rzadziej rybami, myszami czy owadami. Na początku października, ukryty w wykrotach, stogach siana i norach, zapada w sen zimowy (Juszczyk 1987b; Berger 2000).
Literatura
Berger L. 2000. Płazy i gady Polski. Klucz do oznaczania. Wyd.
PWN, Warszawa – Poznań.
Berger L., Rybacki M. 1994. Distribution and ecology of water
frogs in Poland. Zool Pol. 39: 293–303.
Chętnicki W. 2000. Płazy i gady Narwiańskiego Parku Narodowego. [W:] Sterzyńska M. (kier.), Operat ochrony fauny. Muzeum i Instytut Zoologii PAN, Warszawa (mscr.).
Głowaciński Z., Rafiński J.R. 2003. Atlas płazów i gadów polski. Biblioteka Monitoringu Środowiska, Warszawa – Kraków.
Herczek A., Gorczyca J. 2004. Płazy i gady Polski. Wyd. Kubajak, Krzeszowice.
Juszczyk W. 1987a. Płazy i gady krajowe. Tom 1. Płazy – Amphibia. Wyd. PWN, Warszawa.
Juszczyk W. 1987b. Płazy i gady krajowe. Tom 3. Gady – Reptilia.
Wyd. PWN, Warszawa.
Krzysztofiak A., Krzysztofiak L. 2014. Płazy Polski – przewodnik terenowy. Wyd. Petit Skład–Druk–Oprawa, Lublin.
Łupiński S. Ł., Raczyński J., Chętnicki W. 2013. Plan Ochrony
Narwiańskiego Parku Narodowego. Operat fauny. Herpetofauna i teriofauna w części obejmującej płazy, gady, drobne
ssaki, wybrane gatunki chronione – bobra, wydrę, wilka i ssaki
kopytne, Białystok (mscr.).
Łupiński S. Ł., Suchowolec A., Skrzypko A., Ołdakowski Ł.
2006. Wpływ wybranych czynników pogodowych na dynamikę wiosennych wędrówek płazów w Narwiańskim Parku
Narodowym. [W:] Sobisz Z. (red.), Różnorodność biologiczna,
flora i fauna, bioindykacja, ochrona przyrody. Materiały IX
Przeglądu Działalności Kół Naukowych Przyrodników. 86–
90. Słupsk – Ustka.
196
Mazgajska J. 2009. Płazy świata. PWN, Warszawa.
Mazgajska J., Rybacki M. 2012. Kumak nizinny Bombina bombina (Linnaeus, 1751). [W:] Makomaska-Juchiewicz M., Baran
P., (red.), Monitoring gatunków zwierząt, Przewodnik metodyczny. Cześć III. 346–365. GIOŚ, Warszawa.
Młynarski M 1966. Płazy i gady Polski. Państwowe Zakłady
Wydawnictw Szkolnych, Warszawa.
Pabijan M. 2010. Traszka grzebieniasta Triturus cristatus (Laurenti, 1768). [W:] Makomaska-Juchiewicz M., (red.), Monitoring gatunków zwierząt. Przewodnik metodyczny. Cześć I.
195–219. GIOŚ, Warszawa.
Pućkowski M. 2015. Monitoring herpetofauny. [W:] Kamocki A.
(red.), Raport z monitoringu przyrodniczego torfowiska Rynki
za rok 2015. 56–65. Towarzystwo Ochrony Siedlisk „Prohabitat”, Białystok.
Pućkowski M., Krzyściak-Kosińska R. 2012. Raport końcowy
z realizacji monitoringu herpetofauny torfowiska „Rynki” na
terenie Narwiańskiego Parku Narodowego w latach 2010–2012.
[W:] Kamocki A. (red.), Raport końcowy z monitoringu przyrodniczego torfowiska Rynki. 84–124. Towarzystwo Ochrony
Siedlisk „Prohabitat”, Białystok.
Rybacki M., Maciantowicz M. 2006. Ochrona żółwia błotnego,
traszki grzebieniastej i kumaka nizinnego z instrukcjami
wyszukiwania gatunków w terenie. Wyd. Klubu Przyrodników,
Świebodzin.
Sidoruk K. 2005. Środowiskowe uwarunkowania występowania
i liczebności płazów w Narwiańskim Parku Narodowym,
Praca magisterska wykonana w Zakładzie Zoologii Kręgowców Instytutu Biologii Uniwersytetu w Białymstoku, Białystok (mscr.).
Siwak P., Hermaniuk A., Chętnicki W. 2008. Płazy Suwalskiego Parku Krajobrazowego. Parki nar. Rez. Przyr. 27: 109–125.
Sterzyńska M. (kier.), Nowakowski J., Górski A., Raczyński
J., Gębczyńska Z., Chętnicki W., Pilipuk I., Sterzyński
W., Winiarska G., Wegner E. 2002. Narwiański Park Narodowy. Plan ochrony. Operat: Ochrona Fauny. Muzeum i Instytut Zoologii PAN, Warszawa (mscr.).
Szarski H. 1990. Historia zwierząt kręgowych. PWN, Warszawa.
Znaczenie płazów i gadów
Płazy stanowią bardzo ważny element łańcucha pokarmowego, funkcjonując na jego szczeblach zarówno jako
drapieżniki jak i ofiary. Dorosłe osobniki wszystkich przedstawicieli tej gromady są zwierzętami mięsożernymi i bardzo żarłocznymi, przez co pełnią rolę naturalnego regulatora liczebności różnych grup bezkręgowców. Nie wykazują
przy tym wybiórczości pokarmowej, wobec czego zjadają
w największych ilościach organizmy, które w ich otoczeniu
występują najobficiej. Jako nieliczne zwierzęta, w zdecydowany sposób zmniejszają populację owadów uznawanych
za szkodniki, np. jedna dorosła ropucha szara potrafi zjeść
w sezonie do 2 kg stonki ziemniaczanej. Poza tym kijanki
płazów bezogonowych, odżywiając się różnego rodzaju pokarmem pochodzenia roślinnego i bakteryjnego, przyczyniają się do oczyszczania wód w zbiornikach, w których występują.
Ze względu na swoją biomasę, w każdym stadium rozwojowym, płazy stanowią źródło pokarmu dla wielu gatunków
zwierząt, np. zaskrońca, norki, wydry, różnych ryb i ptaków,
pozostając dla wielu z nich dominującym źródłem poży­
wienia.
Płazy są powszechnie wykorzystywane do badań naukowych w różnych dziedzinach nauk biologicznych, medycznych i farmaceutycznych. Ich duże jaja są, na przykład, dobrymi obiektami do prowadzenia eksperymentów embriologicznych. Poza tym skóra wielu gatunków produkuje
substancje stanowiące surowiec przy wytwarzaniu leków.
Dodatkowo, ze względu na swoje właściwości biologiczne
i dużą wrażliwość na zmiany zachodzące w środowisku,
coraz częściej traktowane są jako organizmy wskaźnikowe.
Gady, podobnie do płazów, regulują liczebność wielu gatunków zwierząt – owadów, ślimaków i gryzoni, w tym mogących powodować duże straty w rolnictwie i leśnictwie.
Dużo leków, w tym przeciwnowotworowych, przeciwreumatycznych i regulujących krzepnięcie krwi, powstaje na
bazie jadu węży.
Dwa gatunki płazów występujące na obszarze Narwiańskiego Parku Narodowego – traszka grzebieniasta i kumak
nizinny należą do tzw. gatunków parasolowych umbrella
species, nazywanych również osłonowymi lub tarczowymi.
Pojęcie to jest stosowane w ochronie przyrody dla określenia gatunku bądź grupy gatunków o dużych wymaganiach
siedliskowych i terytorialnych, których występowanie związane jest z dużą liczbą innych rzadkich gatunków współwy-
stępujących. Według tej koncepcji kompleksowa ochrona
gatunków parasolowych pociąga za sobą również ochronę
pozostałych dzielących z nimi dane środowisko.
Pomimo, iż traszka grzebieniasta i kumak nizinny nie należą w Europie do najrzadszych płazów, liczebność ich populacji zmniejsza się w najszybszym tempie na rozległym
obszarze zasięgu. Pierwsze z wymienionych zwierząt jest
silnie zagrożone wyginięciem w Szwajcarii, Czechach, Słowacji, Austrii i Norwegii. Kumak z kolei jest zagrożony
w Niemczech, wymarł zupełnie w Szwecji (w 1960 r.), gdzie
został następnie pomyślnie reintrodukowany dzięki pomocy Duńczyków, którzy sami w ostatniej chwili ocalili swoje
populacje. Cechą wspólną łączącą oba te gatunki jest wrażliwość na szerokie spektrum zagrożeń ze względu na ich silniejszy, niż u innych płazów, związek ze środowiskiem wodnym oraz mniejszą zdolnością do migracji na długie dystanse (Rybacki, Maciantowicz 2006).
Sebastian Ł. Łupiński, Włodzimierz Chętnicki
Literatura
Rybacki M., Maciantowicz M. 2006. Ochrona żółwia błotnego, traszki
grzebieniastej i kumaka nizinnego z instrukcjami wyszukiwania
gatunków w terenie. Wyd. Klubu Przyrodników, Świebodzin.
fot. A. Bielonko
197
Dlaczego płazy są dobrymi
Jak stwierdzić czy ekosystem jest w dobrym stanie?
Wbrew pozorom nie jest to wcale takie proste. Tradycyjne
metody polegające na analizach chemicznych i bezpośrednim pomiarze fizycznych parametrów środowiska np. temperatury, zasolenia, zawartości składników odżywczych,
zanieczyszczeń czy światła dotyczą zazwyczaj jedynie warunków zastanych w czasie wykonywania analiz. Przez to
w większości przypadków są one mało przydatne i na ich
podstawie nie można udzielić odpowiedzi na kluczowe pytanie – jak ekosystem zareaguje na zaistniałe zmiany
w aspekcie długofalowym? Dodatkowo, metody te nie
uwzględniają kumulacji różnych negatywnych oddziaływań
w czasie, interakcji pośrednich i złożoności procesów zachodzących w biocenozach (Holt, Miller 2011). Ograniczeń
takich pozbawione są natomiast organizmy żywe, których
obserwacja pozwala uzupełnić wyniki „klasycznych” programów monitoringu (Markert i in. 2012). Mówimy wtedy
o tzw. bioindykacji, czyli ocenie stanu środowiska lub natężeń czynników środowiskowych i ich zmian w czasie za pomocą odpowiednich bioindykatorów (biowskaźników, organizmów wskaźnikowych), którymi mogą być rośliny, zwierzęta, mikroorganizmy oraz struktury na różnych poziomach
organizacyjnych.
Idealnymi organizmami wskaźnikowymi są takie, które
dostarczają najwięcej jednoznacznych informacji o zmianach zachodzących w środowisku. Aby było to możliwe
muszą posiadać pewne określone cechy, takie jak: wąski
i specyficzny zakres wymagań ekologicznych, występowanie w różnych środowiskach, dużą liczebność, długi cykl życiowy, łatwość identyfikacji gatunkowej, dobrze poznaną
biologię i ekologię (Biesiadka 2013). Ponieważ kryteria te
często wykluczają się wzajemnie niewiele gatunków jest
w stanie im sprostać.
Kiedy pod koniec lat 80. XX wieku uwagę naukowców
zwrócił, obserwowany na całym świecie, postępujący spadek liczebności populacji wielu gatunków płazów (Blaustein,
Wake 1990; Wyman 1990), w gromadzie tej zaczęto dopatrywać się cech właściwych bioindykatorom. Przede
wszystkim, ze względu na przepuszczalną skórę, złożony
cykl życiowy, rozwinięte adaptacje fizjologiczne i specyficzne wymagania siedliskowe, płazy są szczególnie czułe na
stres środowiskowy występujący zarówno w ekosystemach
wodnych, jak i lądowych. Najbardziej wrażliwe stadia życia
zarodkowego i rozwoju larwalnego, poza nielicznymi wyjąt-
198
kami, spędzają w środowisku wodnym, przy czym większość osobników młodocianych i dorosłych żyje na lądzie.
Jako, że zwierzęta te są uzależnione od wody w czasie rozrodu, osobniki dorosłe wielu gatunków, zwłaszcza w klimacie umiarkowanym, wykazują odległe coroczne migracje
pomiędzy miejscami zimowania, godów i siedliskami letnimi.
Często przejawiają przywiązanie do tych miejsc i jeśli mogą,
wracają do nich przez całe życie. W porównaniu do owadów czy ryb, które również są wykorzystywane jako organizmy wskaźnikowe, płazy żyją stosunkowo długo. Nasza ropucha szara może żyć do 40 lat a rzekotka drzewna co najmniej 15 lat (Mazgajska 2009). Dodatkowo, wiele gatunków
występuje licznie w szerokim zasięgu geograficznym. Na
przykład, wymieniona wcześniej ropucha jest najbardziej
rozpowszechnionym i pospolitym zwierzęciem w Europie,
zasiedlając obszar od koła podbiegunowego w Skandynawii
i Rosji po Morze Śródziemne i Morze Czarne na południu
kontynentu (G łowaciński, R afiński 2003). Wreszcie dorosłe
płazy odgrywają kluczową rolę w ekosystemach, funkcjonując w łańcuchu pokarmowym jako drapieżniki i ofiary,
a płazy bezogonowe charakteryzuje zmiana sposobu odżywania w cyklu życiowym (kijanki odżywiają się pokarmem
roślinnym), co czyni je wrażliwymi na większe spektrum
czynników.
Wymienione cechy sprawiają, że płazy, a zwłaszcza dominujące w tej gromadzie żaby i ropuchy, są powszechnie
wykorzystywane jako organizmy wskaźnikowe, na przykład: do badania akumulacji różnego rodzaju zanieczyszczeń (metale ciężkie, pestycydy, chemikalia przemysłowe)
w środowisku (Simon i in. 2011), oceny stanu cieków (Hartwell i in. 1998), monitoringu zmian ekologicznych w lasach
(Campos i in. 2014) a ostatnio nawet wpływu roślin modyfikowanych genetycznie (GMO) na ekosystemy wodne i lądowe (Böll i in. 2013). Oprócz tego odtwarzanie populacji tych
zwierząt jest oznaką sukcesu w miejscach gdzie podjęto
próby przywrócenia środowisk zniszczonych działalnością
człowieka.
Niestety właściwości, które czynią z płazów dobre
wskaźniki stanu środowiska, przyczyniają się również do ich
zagłady. Paradoksalnie płazy, jako gromada, przetrwały od
późnego dewonu1, opierając się zlodowaceniom, kilku masowym wymieraniom, uderzeniom asteroid, zmianom klimatu i innym czynnikom, które doprowadziły do zniknięcia
z powierzchni Ziemi całych grup zwierząt. Jednak w zderze1
Trzy aktualnie wchodzące w skład gromady rzędy wyodrębniły się w triasie i na początku okresu jurajskiego (Roelants
i in. 2007).
wskaźnikami stanu środowiska?
niu z nową kategorią czynników ekologicznych, nazywanych umownie czynnikami antropogenicznymi lub czynnikami stresu antropogenicznego2 giną szczególnie szybko.
Ocenia się, że tempo wymierania tej gromady jest od 173 do
2351 razy większe niż w czasach historycznych (Catenazzi
2015), a gatunków zagrożonych wyginięciem jest więcej niż
wśród ptaków i ssaków razem wziętych (Bishop i in. 2012).
Przyczyną tej sytuacji są głównie pośrednie skutki działalności człowieka, zwłaszcza szeroko rozumiana chemizacja
środowiska przyrodniczego („kwaśne deszcze”, stosowanie
pestycydów, skażenie metalami ciężkimi), rozwój aglomeracji miejsko-przemysłowych, systemu szos i autostrad, powszechne zasypywanie i niszczenie drobnych zbiorników
wodnych, w tym starorzeczy, czy też osuszanie dolin rzecznych i terenów bagiennych (G łowaciński, R afiński 2003).
Ingerencja w środowisko naturalne jest z reguły sygnalizowana przez różnorodne reakcje organizmów żywych, pojawiające się po przekroczeniu ich zakresu tolerancji. Dla
płazów jest to na ogół moment, w którym widoczny jest
stopniowy zanik populacji zarówno tych najrzadszych gatunków jak i gatunków dotychczas uznawanych za pospolite. Niewątpliwie aktualne wymieranie tych zwierząt, obserwowane nie tylko w skali lokalnej, ale w skali świata, stanowi dla nas ważne ostrzeżenie.
Sebastian Ł. Łupiński, Marzena Giedrewicz
Literatura
Biesiadka E. 2013. Teoretyczne podstawy bioindykacji. [W:] Dynowska M., Ciecierska H. (red.), Biologiczne metody oceny
stanu środowiska. Tom I. Ekosystemy lądowe. 15–35. Wyd.
Mantis, Olsztyn.
Bishop P. J., Angulo A., Lewis J. P., Moore R. D., R abb G. B., Garcia
Moreno J. 2012. The Amphibian Extinction Crisis – what will it
take to put the action into the Amphibian Conservation Action
Plan? S.A.P.I.EN.S. 5(2): 97–111.
Blaustein A. R., Wake D. B. 1990. Declining amphibian populations:
a global phenomenon? Trends Ecol. Evol. 5: 203–204.
Böll S., Schmidt B.R., Veith M., Wagner N., Rödder D., Weimann C.,
Kirschey T., Lötters S. 2013. Anuran amphibians as indicators of
changes in aquatic and terrestrial ecosystems following GM
crop cultivation: a monitoring guideline. BioRisk. 8: 39–51.
2
Wpływ działalności człowieka na funkcjonowanie procesów
przyrodniczych zachodzących w skali Ziemi jest tak duży,
że zaproponowano aby obecną epokę geologiczną określać
mianem Antropocenu.
Campos F. S., Trindade-Filho J., Brito D., Llorente G. A., Sol M. 2014.
The efficiency of indicator groups for the conservation of amphibians in the Brazilian Atlantic Forest. Ecol. Evol. 4(12): 2505–
2514.
Catenazzi A. 2015. State of the World’s Amphibians. Annu. Rev.
Environ. Resour. 40: 91–119.
G łowaciński Z., R afiński J. R. 2003. Atlas płazów i gadów polski. Biblioteka Monitoringu Środowiska, Warszawa – Kraków.
Hartwell H., Welsch J. R., Ollivier L. M. 1998. Stream amphibians
as indicators of ecosystem stress: a case study from California’s
redwoods. Ecol. Appl. 8(4): 1118–1132.
Holt E. A., Miller S. W. 2011. Bioindicators: Using Organisms to
Measure Environmental Impacts. Nature Education Knowledge
2(2): 8.
Markert B., Wünschmann S., Diatta J., Chudzińska E. Innowacyjna
obserwacja środowiska – bioindykatory i biomonitory: definicje, strategie i zastosowania. Ochr. Środ. i Zasob. Natur. 53:
115–152.
Mazgajska J. 2009. Płazy świata. PWN, Warszawa.
Roelants K., Gower D. J., Wilkinson M., Loader S. P., Biju S. D., Guillaume K., Moriau L., Bossuyt F. 2007. Global patterns of diversification in the history of modern amphibians. Proc. Natl. Acad.
Sci. USA. 104: 887–92.
Simon E., Puky M., Braun M., Tóthmérész B. 2011. Frogs and toads as
biological indicators in environmental assessment. [W:] Murray
J. L (red.), Frogs. Biology, Ecology and Uses. 141–150. Nova Science Publishers, New York.
Wyman R. L. 1990. What’s happening to the amphibians? Conserv.
Biol. 4: 350–352.
fot. A. Bielonko
199
200
fot. D. Wołkowycki
11 Ssaki
11.1 Różnorodność fauny ssaków
Narwiańskiego Parku
Narodowego
Marzena Giedrewicz • Jan Raczyński •
Włodzimierz Chętnicki • Sebastian Ł. Łupiński
Ogólna charakterystyka fauny
ssaków Narwiańskiego Parku
Narodowego
Na obszarze Narwiańskiego Parku Narodowego potwierdzono występowanie 36 gatunków ssaków naziemnych należących do owadożernych Insectivora, zajęczaków
Lagomorpha, gryzoni Rodentia, drapieżnych Carnivora
i parzystokopytnych Artiodactyla (Tab. 11.1), a także kilku
gatunków nietoperzy Chiroptera.
Lokalna fauna zajęczaków i drapieżnych poznana jest
stosunkowo słabo, dlatego nie będzie szczegółowo omawiana, a jedynie krótko scharakteryzowana w niniejszym
rozdziale. Zajęczaki reprezentują dwa gatunki – zając szarak Lepus europaeus i obserwowany w pobliżu Parku Narodowego bielak L. timidus. Zając szarak najchętniej zamieszkuje tereny otwarte: pola, suche łąki, nieużytki, a na
terenach bagiennych spotykany jest dość rzadko (Pucek
1984). Od lat 70. ubiegłego wieku, populacja tego pospolitego wcześniej w Polsce gatunku łownego ulegała stopniowej
regresji i obecnie stał się on tak rzadki, że praktycznie zaprzestano na niego polować1 (Kamieniarz, Panek 2008).
Teren Narwiańskiego Parku Narodowego nie jest w dodatku typowym środowiskiem szaraka, pomimo to występuje
on tu regularnie, aczkolwiek mało licznie. W odróżnieniu
1
Przyczyny załamania populacji zająca szaraka w Polsce szcze­
gółowo analizuje Raczyński (2013).
od niego bielak preferuje tereny błotniste i chętnie przebywa w dolinach rzek. Gatunek ten obserwowany był już kilkukrotnie w okolicach Kurowa (Pruszyński 2014).
Zbiorowiska leśne (przeważnie olsy, ale także nasadzone
bory sosnowe, a gdzieniegdzie lasy grądowe) pokrywają
niewielki procent powierzchni Narwiańskiego Parku Narodowego, mimo to stanowią ostoję dla większości gatunków ssaków drapieżnych. Można tu spotkać m.in. lisa Vulpes vulpes, jenota Nyctereutes procyonoides, borsuka Meles
meles, kunę domową Martes foina, kunę leśną M. martes,
łasicę Mustela nivalis i gronostaja M. erminea. Grupa łasicowatych charakterystyczna dla środowisk podmokłych
występuje zwłaszcza w turzycowiskach, co wiąże się
z obecnością licznych populacji nornika północnego, będącego pokarmem drapieżników. W szuwarach turzycowych
można także spotkać tchórza zwyczajnego Mustela putorius, łasicę, gronostaja i norkę amerykańską Neovison
vison.
Drapieżnikiem silnie związanym ze środowiskiem wodnym jest wydra Lutra lutra, będąca jednym z największych
przedstawicieli rodziny łasicowatych. Gibkie, silnie wydłużone i smukłe ciało tego zwierzęcia umożliwia sprawne
pływanie i wykonywanie skomplikowanych ruchów w wodzie oraz swobodne poruszanie się na lądzie (Pucek 1984).
Podobnie jak bóbr, jest ona objęta ochroną jako gatunek
ważny dla Wspólnoty Europejskiej, wymieniony w II Załączniku do Dyrektywy Siedliskowej. Optymalnym środowiskiem dla wydry są zazwyczaj jeziora o naturalnej linii
brzegowej, z zadrzewionymi lub zarośniętymi trzciną
brzegami, a także duże i średnie rzeki o nieuregulowanych
201
brzegach, przynajmniej częściowo zadrzewionych lub zakrzewionych. Jako schronienia dla tego zwierzęcia służą
nory wykopane w brzegach rzek i jezior, ale może także zamieszkiwać opuszczone żeremia bobrowe lub inne schronienia w brzegach np. dziuple czy jamy pod korzeniami
drzew (Jędrzejewski, Sidarowicz 2010). Zasięg terytorium wydry uzależniony jest od dostępności bazy pokarmowej. Osobniki mogą penetrować od kilku do kilkunastu
kilometrów linii brzegowej rzek, natomiast w przypadku
siedlisk nieliniowych, takich jak jeziora czy stawy hodowlane, terytoria mogą mieć jedynie 2,5 km2, przy czym areały samców są większe w porównaniu z areałami samic
(Romanowski i in. 2010; Romanowski i in. 2011).
W licznych dopływach Narwi i rowach melioracyjnych
wydra czuje się bezpiecznie i znajduje odpowiednie warunki do przetrwania okresu zimowego, a także przemieszczania się w celach zdobywania nowych łowisk czy partnera
do rozrodu. Z przeprowadzonych w Narwiańskim Parku
Narodowym badań wynika, że lokalne populacje gatunku
funkcjonują obecnie w układzie stabilnym. Dostępność
bazy pokarmowej w postaci ryb, płazów czy bezkręgowców
wodnych, w tym dostępność optymalnych siedlisk, duży
stopień naturalności oraz ograniczona penetracja ludzka
sprawiają, że w sieci wodnej Narwi wydra jest gatunkiem
powszechnie spotykanym (Łupiński i in. 2013). Podobnie
jednak jak w innych częściach kraju jest ona stosunkowo
nieliczna. Wydaje się, że w Parku Narodowym nie ma
większych zagrożeń dla lokalnej populacji tego gatunku.
Sukcesja roślinności i zmiany stosunków wodnych nie dotykają tego zwierzęcia w sposób znaczący. Prawdopodobnie też nie występują na terenie Parku większe zagrożenia
wynikające z ruchu drogowego, gdyż duże mosty drogowe,
przy rozległości doliny, nie stwarzają trudności w przemieszczaniu się osobników tego gatunku w osi cieków
wodnych. Potencjalnym źródłem zagrożenia dla wydry jest
natomiast gospodarka stawowa, gdzie jest ona gatunkiem
konfliktowym.
Warto także wspomnieć o borsuku, który zasiedla nie
tylko lasy, ale także mozaiki łąk, pastwisk i pól oraz śródbagienne grądziki, gdzie może kopać nory mieszkalne. Najchętniej zjada dżdżownice, ale żywi się też owadami i ich
larwami, mięczakami, płazami, gadami, jajami i pisklętami ptaków, drobnymi gryzoniami. Ważny element w jego
diecie stanowi pokarm roślinny (owoce, zboża, podziemne
części roślin).
W Narwiańskim Parku Narodowym nie odnotowano jak
dotąd śladów obecności wilka Canis lupus, którego najbliższe
stanowiska leżą w Puszczy Knyszyńskiej i Dolinie Biebrzy.
Wybrane grupy ekologiczne
i powiązania ekosystemowe
Drobne ssaki
Drobne ssaki, określane zbiorową nazwą Micromammalia, stanowią istotny składnik ekosystemów, w których pełnią ważną rolę ekologiczną. W skład tej grupy wchodzą
przedstawiciele ssaków naziemnych, reprezentujących dwa
rzędy: owadożerne i gryzonie.
202
Zasadniczym pożywieniem owadożernych są małe
bezkręgowce (np. owady, ślimaki, dżdżownice), kręgowce
(np. płazy); niektóre gatunki, na przykład jeż, odżywiają się
dodatkowo pokarmem roślinnym (Pucek 1984). Ryjówki
i rzęsorki posiadają zabarwione na czerwono końcówki
zębów, nadające im twardość, co jest przystosowaniem do
rozcierania chitynowych pancerzy owadów, którymi się
żywią. Wśród gatunków krajowych można spotkać przedstawicieli trzech rodzin ssaków owadożernych: jeżowate
Erinaceidae, kretowate Talpidae, ryjówkowate Soricidae,
reprezentowanych w faunie Narwiańskiego Parku Narodowego przez takie gatunki jak: jeż wschodni Erinaceus roumanicus, kret Talpa europaea, ryjówka aksamitna Sorex
araneus, ryjówka malutka S. minutus, rzęsorek rzeczek
Neomys fodiens i zębiełek białawy Crocidura leucodon2
(Tab. 11.1).
Rząd gryzoni reprezentowany jest w faunie Narwiańskiego Parku Narodowego przez cztery rodziny: wiewiórkowate Sciuridae, bobrowate Castoridae, nornikowate
Arvicolidae i myszowate Muridae (Tab. 11.1).
Większość gryzoni jest roślinożerna, a ich pokarm stanowią m.in. pędy i kłącza roślin zielnych, nasiona i owoce
drzew i krzewów, bulwy, cebule. Zdolności do wydawania
dużej liczby potomstwa i częstej reprodukcji (mioty mogą
rodzić kilka razy w roku), występujące zwłaszcza u małych
gryzoni sprawiają, że z roku na rok występują duże wahania liczebności populacji prowadzące do masowych pojawów. Przedstawicieli tego rzędu spotyka się w różnorodnych siedliskach lądowych i ziemnowodnych, w tym synantropijnych i agrarnych, gdzie mogą wyrządzać duże
szkody w uprawach rolnych, leśnych i w magazynach (np.
myszowate).
Z wcześniejszych badań przeprowadzonych w środowiskach bagiennych Narwiańskiego Parku Narodowego wynika, że dla zespołów fauny Micro­mam­malia, decydującymi czynnikami zróżnicowania nie są zespoły roślinne (np.
w obrębie turzycowisk), lecz raczej struktury wyższej rangi,
wyróżniane fizjonomicznie, uwzględniające różnice uwodnienia lub osuszenia podłoża, struktury kępowej roślinności, stopnia pokrycia warstwą krzewów, sposobu użytkowania (koszenie, podsiewanie traw) oraz przekształcenia
w wyniku oddziaływania czynników antropogennych aktualnie lub w przeszłości. Wymienione czynniki decydują
w przypadku naziemnych ssaków o stanie bazy żerowej,
miejscach do budowy gniazd (struktura kępowa w środowiskach podmokłych), znalezienia schronień zimowych (gatunki hibernujące) itp. możliwościach przeżycia, uwarunkowanych biologią poszczególnych gatunków (Gębczyńska,
Raczyński 1997). Biorąc to pod uwagę i dokonując pewnej
generalizacji, środowiska doliny Narwi można z punktu
widzenia preferencji drobnych ssaków podzielić na dwie
zasadnicze kategorie.
1. Ekosystemy nieleśne, pośród których największą powierzchnię zajmują otwarte siedliska bagienne i wilgotne zasilane przez wody rzeczne zalewające okresowo
dno doliny. Zdominowane są przez szuwar trzcinowy
2
Rejon doliny Narwi na odcinku chronionym w ramach Narwiańskiego Parku Narodowego leży na granicy zasięgu zębiełka białawego. Z obszaru NPN znane są tylko dwa stanowiska tego gatunku, z Suraża i Łap, pochodzące z wypluwek
sów (Pucek, Michalak 1983).
Tab. 11.1 Skład i status ochronny fauny ssaków naziemnych Narwiańskiego Parku Narodowego (oryg.)
Rząd
Owadożerne
Zajęczaki
Gryzonie
Drapieżne
Parzystokopytne
Nazwa polska
Nazwa naukowa
Status ochronny
Jeż wschodni
Erinaceus roumanicus
2
Kret europejski
Talpa europaea
2
Ryjówka aksamitna
Sorex araneus
2
Ryjówka malutka
Sorex minutus
2
Rzęsorek rzeczek
Neomys fodiens
2
Zębiełek białawy
Crocidura leucodon
-
Zając szarak
Lepus europaeus
3
Zając bielak
Lepus timidus
1
Wiewiórka
Scirius vulgaris
2
Bóbr europejski
Castor fiber
Piżmak
Ondatra zibethicus
3
Nornica ruda
Myodes glareolus
-
Karczownik
Arvicola amphibius
2
Nornik północny
Microtus oeconomus
-
Nornik bury
Microtus agrestis
-
Nornik zwyczajny
Microtus arvalis
-
Mysz domowa
Mus musculus
-
Szczur wędrowny
Rattus norvegicus
-
Badylarka
Micromys minutus
2
Mysz polna
Apodemus agrarius
-
Mysz leśna
Apodemus flavicollis
-
Mysz zaroślowa
Apodemus sylvaticus
2
2*
Lis
Vulpes vulpes
-
Jenot
Nyctereutes procyonoides
-
Borsuk
Meles meles
-
Wydra
Lutra lutra
2
Kuna leśna
Martes martes
-
Kuna domowa
Martes foina
-
Tchórz zwyczajny
Mustela putorius
-
Gronostaj
Mustela erminea
2
Łasica
Mustela nivalis
2
Norka amerykańska
Neovison vison
3
3
Dzik
Sus scrofa
Łoś
Alces alces
Sarna
Capreolus capreolus
3
Jeleń
Cervus elaphus
3
3*
Zgodnie z Rozporządzeniem Ministra Środowiska z dnia 6 października 2014 r. w sprawie ochrony gatunkowej zwierząt (Dz. U. z 2014 r.
poz. 1348): 1 – gatunki objęte ochroną ścisłą, 2 – gatunki objęte ochroną częściową, 2* – gatunek objęty ochroną częściową, który może
być pozyskiwany przez odstrzał z broni myśliwskiej lub chwytanie w pułapki żywołowne – w okresie od 1 października do 15 marca, 3 –
gatunki łowne objęte okresem ochronnym, na które można polować w terminach określonych w Rozporządzeniu Ministra Środowiska
z dnia 16 marca 2005 r. w sprawie określenia okresów polowań na zwierzęta łowne (Dz. U. z 2005 r. Nr 48, poz. 459), 3* – gatunek łowny
od 2001 roku objęty całorocznym okresem ochronnym.
203
szuwary typu
łąk turzycowych
szuwary typu łąk turzycowych
Ryjówka aksamitna
Ryjówka malutka
Rzęsorek rzeczek
Nornica ruda
Nornik północny
Mysz polna
inne
otwarteotwarte tereny wilgotnr ogółem
tereny wilgotne ogółem
szuwary trzcinowe
szuwary trzcinowe
Ryjówka
Ryjówka
Ryjówka aksamitna
Rzęsorek
Ryjówka malutka
Rzęsorek rzeczek
Nornica Nornica ruda
Nornik północny
Nornik p
Mysz polna
Mysz po
inne
Inne
otwarte tereny wilgotnr ogółem
mozaika szuwarów typu łąk
turzycowych
i trzcinowych
mozaika szuwarów tupu łąk turzycowych i trzcinowych
owadożerne:
Ryjówka malutka
Ryjówka aksamitna
Rzęsorek rzeczek
Rzęsorek rzeczek
Nornica ruda
Nornik północny
Mysz polna
inne
Ryjówka aksamitna
gryzonie:
Nornica ruda
Nornik północny
Mysz polna
Inne
Ryc. 11.1 Udział procentowy poszczególnych gatunków w zgrupowaniach
drobnych ssaków Micromammalia Narwiańskiego Parku Narodowego w:
szuwarach typu łąk turzycowych (n = 218), szuwarach trzcinowych (n = 225),
mozaice szuwarów typu łąk turzycowych i trzcinowych (n = 78), otwartych
terenach wilgotnych ogółem (n = 521) (na podst. Łupiński i in. 2013)
204
oraz szuwary mannowe i mozgowe, szuwary typu łąk
turzycowych (z dominacją turzycy zaostrzonej Carex
gracilis), szuwary zastoisk długotrwale zalewanych
(głównie Caricetum elatae i C. ripariae). Wymienione
podtypy ekosystemów zajmują łącznie ponad 70% powierzchni Narwiańskiego Parku Narodowego. Wśród
występujących bardzo nielicznie na obszarze Parku
otwartych terenów suchych warto wspomnieć o ciepłolubnych murawach napiaskowych, które mają postać
luźnych i dość barwnych zbiorowisk trawiastych, o wyraźnie kępowej budowie (Wołkowycki i in. 2013).
2. Ekosystemy leśne, które stanowią olsy i łęgi, z występującymi sporadycznie borami sosnowymi i mieszanymi
oraz mineralnymi wyniesieniami zwanymi „grądzikami”, porośniętymi drzewami liściastymi (głównie lipą
i dębem). Zajmują one łącznie około 10% powierzchni
Narwiańskiego Parku Narodowego (Wołkowycki i in.
2013; por. rozdział poświęcony szacie roślinnej w tym
tomie).
Z badań przeprowadzonych w ostatnich latach (Łupiń­
ski i in. 2013) wynika, że w ekosystemach nieleśnych
Parku: szuwarze trzcinowym, szuwarach typu łąk turzycowych i ich mozaikach najliczniej reprezentowaną grupą
drobnych ssaków (prawie 80%) są gryzonie, pośród których zdecydowanie dominuje nornik północny Microtus
oeconomus (Ryc. 11.1, 11.2). Pojawianie się okresowych zalewów nie jest dla niego groźne, ponieważ nornik swoje
gniazda buduje wysoko w kępach turzyc, dokąd woda zazwyczaj nie sięga. Podstawą pożywienia tego zwierzęcia są
zielone części roślin, a w przypadku ich braku zimą i wczesną wiosną odżywia się korzeniami turzyc i martwymi
częściami roślin. Nornik jest gatunkiem kluczowym
w zgrupowaniach drobnych ssaków turzycowisk, a wahania jego zagęszczenia (od blisko 0 do 300 zwierząt/ha
w Biebrzańskim Parku Narodowym) są czynnikiem warunkującym liczebność populacji wielu gatunków drapieżników i ich presję na inne rodzaje ofiar (Borowski 2013).
Kolejnym gryzoniem, który pojawiał się stosunkowo
licznie podczas badań prowadzonych w ekosystemach nieleśnych była mysz polna Apodemus agrarius3 (Ryc. 11.1),
którą wyróżnia ciemny pasek biegnący przez środek
grzbietu (Ryc. 11.3). Gatunek ten chętnie zamieszkuje
obrzeża lasów, łąki, pola uprawne, wilgotne zarośla, brzegi
rzek i jezior, wykazując skłonność do miejsc wilgotnych.
W odróżnieniu od nornika północnego, mysz polna odżywia się głównie nasionami, wzbogacając dietę pokarmem
zwierzęcym, np. owadami (Pucek 1984). Łąki porośnięte
wysokimi trawami i trzcinowiska chętnie zasiedla też badylarka Micromys minutus (Ryc. 11.4) – najmniejszy krajowy przedstawiciel gryzoni. Ssak ten swoje kuliste gniazda,
zawieszone między łodygami roślin, buduje ze starannie
splecionych łodyg i liści traw (Pucek 1984). Badylarka występuje nielicznie na obszarze Parku Narodowego (Łupiń­
ski i in. 2013).
Gatunkiem współwystępującym w otwartych środowiskach wilgotnych jest ryjówka aksamitna należąca do ssa3
Zgodnie z wydaną w 2015 roku publikacją pt. „Polskie nazewnictwo ssaków świata” rodzajowi Apodemus przypisano
nazwę myszarka (Cichocki i in. 2015). W niniejszym opracowaniu posługiwano się utrwaloną nazwą zwyczajową rodzaju Apodemus – mysz.
Ryc. 11.2 Nornik północny Microtus oeconomus (fot. K. Zub)
Ryc. 11.3 Mysz polną Apodemus agrarius wyróżnia ciemny pasek
biegnący przez środek grzbietu (fot. K. Zub)
Ryc. 11.4 Badylarka Micromys minutus (fot. K. Zub)
ków owadożernych, która dominowała zdecydowanie nad
pozostałymi przedstawicielami tej grupy, tj. ryjówką malutką i rzęsorkiem rzeczkiem (Ryc. 11.1). Ryjówki, których
polska nazwa pochodzi od ruchliwego ryjka, są zwierzętami, które cechuje niezwykle szybka przemiana materii.
Metabolizm spoczynkowy4 ryjówki aksamitnej jest aż
4
Najniższy poziom przemiany materii zwierzęcia stałocieplnego, reprezentujący podstawowy koszt utrzymania orga­
nizmu.
205
trzykrotnie większy, niż można by oczekiwać u ssaka o takiej masie ciała.
W konsekwencji ryjówki muszą praktycznie nieprzerwanie żerować zarówno
w dzień, jak i w nocy, odpoczywając jedynie wtedy, kiedy ich przewód pokarmowy jest przynajmniej częściowo wypełniony. Ryjówka aksamitna musi dziennie
konsumować ilość pokarmu odpowiadającą 120% jej masy ciała. Samice tego
gatunku w szczycie laktacji zjadają dwa razy więcej pokarmu, niż same ważą
(Taylor 2013).
Rzęsorek rzeczek, jako największy i najbardziej związany ze środowiskiem
wodnym przedstawiciel ryjówkowatych, jest doskonale przystosowany do ziemnowodnego trybu życia. Gęste futro chroni jego ciało przed zamoknięciem
w czasie nurkowania, a silne owłosienie tylnych łap i rząd włosów porastających
spodnią stronę ogona (kil) pomagają przy pływaniu. Rzęsorek jest jedynym jadowitym ssakiem krajowym, dzięki czemu może polować na małe żabki i ryby,
paraliżując je jadem zawartym w ślinie (Pucek 1984).
Preferencje siedliskowe tych trzech przedstawicieli Soricidae, tj. ryjówki aksamitnej, malutkiej i rzęsorka rzeczka odzwierciedlają różnice w wyborze miejsc
do żerowania. U ryjówkowatych obserwuje się znaczne międzygatunkowe nakładanie się nisz ekologicznych, jednak dzięki wykorzystaniu nieco odmiennych środowisk i stosowaniu innych metod wyszukiwania pokarmu poszczególni przedstawiciele tej rodziny mogą współwystępować na tym samym terenie
(Ryc. 11.5).
Ryc. 11.5 Dzięki wykorzystaniu nieco odmiennych środowisk
i stosowaniu innych metod wyszukiwania pokarmu, poszczególni
przedstawiciele ryjówkowatych Soricidae mogą współ­w ystę­
pować na tym samym terenie (wg ZUB 2009, zmodyfikowano)
Na nielicznych w Narwiańskim Parku Narodowym murawach napiaskowych dominował nornik zwyczajny (polnik) Microtus arvalis, krewniak nornika północnego (Ryc. 11.6). Gatunek ten zamieszkuje tereny otwarte, głównie
pola uprawne, pastwiska i łąki, trawiaste obrzeża lasów, zachwaszczonych polan
i zrębów przyległych do pól uprawnych. Może być traktowany jako wskaźnik
synantropizacji zespołu drobnych ssaków. Odżywia się zielonymi częściami roślin, głównie motylkowych i traw, ziarnami, kłączami, korzeniami, a nawet korą
drzew. Przy masowych pojawach często wyrządza duże szkody w uprawach. Jest
również zwierzęciem, które osiąga dojrzałość płciową najszybciej ze wszystkich
ssaków (Pucek 1984).
Lasy łęgowe i olsy cechuje bardzo duża różnorodność gatunkowa drobnych
ssaków w porównaniu z innymi ekosystemami Narwiańskiego Parku Narodowego (Gębczyńska, Raczyński 1997; Łupiński i in. 2013). Grupą panującą
(prawie 90% udziału) są gryzonie z dominującymi: nornicą rudą Myodes glareolus, myszą polną Apodemus agrarius i myszą leśną Apodemus flavicollis
206
murawy napiskowe
murawy napiskowe
murawy napiskowe
owadożerne:
gryzonie:
Ryjówka aksamitna
Ryjówka malutka
Ryjówka aksamitna
Nornica ruda
Ryjówka malutka
Nornik północny
Nornica ruda
Nornik zwyczajny
Nornik północny
inne
Nornik zwyczajny
inne
Ryc. 11.6 Udział procentowy poszczególnych gatunków w zgrupowaniach
drobnych ssaków Micromammalia muraw napiaskowych Narwiańskiego
Parku Narodowego; n = 118 (na podst. Łupiński i in. 2013)
zadrzewienie łęgowe i olsowe
zadrzewienie łęgowe i olsowe
zadrzewienia olsowe i łęgowe
owadożerne:
Ryjówka aksamitna
Ryjówka malutka
Ryjówka aksamitna
gryzonie:
Nornica ruda
Ryjówka malutka
Nornik północny
Nornica ruda
Mysz polna
Nornik północny
Mysz leśna
Mysz polna
Mysz zaroślowa
Mysz leśna
inne
Mysz zaroślowa
inne
Ryc. 11.7 Udział procentowy poszczególnych gatunków w zgrupowaniach
drobnych ssaków Micromammalia wybranych ekosystemów leśnych
(zadrzewienia łęgowe i olsowe) Narwiańskiego Parku Narodowego;
n = 270 (na podst. Łupiński i in. 2013)
(Ryc. 11.7). Nornica ruda jest typowym ssakiem leśnym,
który swoją nazwę zawdzięcza futerku zabarwionemu na
czerwono-rudo na grzbiecie (Ryc. 11.8). Jest gatunkiem
sucho- i ciepłolubnym, stąd na terenach podmokłych pojawia się rzadko. Przy pomocy przednich nóg potrafi kopać
rozległe chodniki w glebie i pod ściółką. Odżywia się
przede wszystkim nasionami i owocami drzew oraz krzewów, uzupełniając pokarm o zielone części roślin, grzyby
i bezkręgowce.
Mysz leśna, podobnie jak nornica ruda, zamieszkuje
stare lasy liściaste i mieszane. W odróżnieniu jednak od
niej lubi miejsca zacienione i wilgotne (Pucek 1984). Zjada
głównie nasiona, ale nie gardzi również bezkręgowcami,
ani drobnymi kręgowcami, np. pisklętami. Jej istotną cechą
jest umiejętność wspinania się po pniach drzew (Ryc. 11.9;
Pucek 1984). W badanych ekosystemach leśnych, w grupie
owadożernych, ryjówka aksamitna dominowała nad ryjówką malutką przy zupełnym braku rzęsorka rzeczka
(Ryc. 11.7).
W faunie gryzoni Narwiańskiego Parku Narodowego
nie stwierdzono obecności smużki Sicista betulina, będącej
typowym składnikiem lasów olsowych, wilgotnych borów
Ryc. 11.8 Nornica ruda Myodes glareolus (fot. K. Zub)
207
Ryc. 11.9 Mysz leśna Apodemus flavicollis potrafi wspinać się
po pniach drzew (fot. K. Zub)
czy podmokłych łąk porośniętych krzewami (Pucek 1984).
TTen zanikający w Polsce gatunek może być traktowany
jako wskaźnik naturalności środowisk podmokłych i stanowi pośredni dowód przemian krajobrazu doliny Narwi
w czasach historycznych.
W świetle aktualnych badań zwraca uwagę zdecydowana dominacja gryzoni, które stanowiły ponad 80% wszystkich drobnych ssaków odławianych w szerokim spektrum
środowisk Parku Narodowego w 2012 roku (Łupiński i in.
2013). Jeszcze pod koniec XX w. to owadożerne stanowiły
główny składnik fauny drobnych ssaków tej części doliny
Narwi (około 53%) i występowały najliczniej we wszystkich
środowiskach naturalnych oraz przekształconych, z wyłączeniem zagospodarowanych łąk (Gębczyńska, Raczyński 1997). Spadek reprezentacji tych ssaków w zespołach
Micromammalia do 14% (Łupiński i in. 2013) może świadczyć o postępującym przesuszaniu obszaru Narwiańskiego
Parku Narodowego.
Kopytne
Kopytne Ungulata nie są właściwą jednostką systematyczną, ale reprezentują bogatą w gatunki i liczną grupę
zwierząt, z reguły dużych i odgrywających ważną rolę
w funkcjonowaniu ekosystemów lądowych. W faunie Polski dominują w niej liczebnie jeleniowate Cervidae i dzik
Sus scrofa, należący do świniowatych Suidae.
Występujące w Narwiańskim Parku Narodowym kopytne – jeleniowate i dzik reprezentują zwierzęta łowne
(Tab. 11.1), których populacje na większości obszaru kraju
podlegają gospodarce łowieckiej, m.in. związanej z regulacją liczebności drogą odstrzału5. Nie dotyczy to jednak par5
208
Motywem takiego podejścia jest fakt, iż wskutek licznego występowania ssaki te wpływają w dużym stopniu na
funkcjonowanie ekosystemów leśnych i polnych, objętych
gospodarką człowieka. Dlatego regulowanie ich liczebności
jest tam nieodzownym warunkiem zachowania równowagi
między ich działalnością w środowisku kulturowym, a czerpaniem korzyści z ich hodowli w sensie łowieckim. Należy
bowiem pamiętać, że działalność tych gatunków, tj. dzika
i jeleniowatych, w warunkach współczesnego krajobrazu
ków narodowych. We współczesnym ujęciu ochrony przyrody gatunki te odgrywają zasadniczą rolę w utrzymaniu
fauny dużych drapieżników (wilk, ryś), praktycznie warunkując zachowanie populacji tych chronionych gatunków we współczesnym krajobrazie kulturowym Europy.
Dzik, szeroko rozprzestrzeniony w Europie (z wyjątkiem Wysp Brytyjskich i Skandynawii, gdzie został wcześniej wytępiony), jest jednym z najpospolitszych dużych
ssaków Polski, zamieszkujących zarówno lasy, jak i środowiska polne oraz podmokłe (Ryc. 11.10). Dzik pierwotnie
był mieszkańcem lasów, zwłaszcza urozmaiconych lasów
liściastych i mieszanych, gdzie ważnym czynnikiem dla
dynamiki liczebności jego populacji był urodzaj żołędzi.
Przemiany krajobrazu spowodowały, że to pierwotnie leśne
zwierzę, opanowało także agrocenozy oraz wnika ostatnio
do dużych miast (Tomek, Tomek 1993). Obecnie ssak ten
żeruje często na polach, obfitujących w dostępny żer w postaci roślin okopowych i kukurydzy, co przekłada się na
silny wzrost populacji tego zwierzęcia. Jego liczebność
w kraju wzrastała w okresie powojennym, osiągając obecnie najwyższe zagęszczenia na terenie zachodniej i północnej Polski (Fruziński 1992; Pielowski i in. 1993).
W dolinie Narwi dzik jest pospolitym mieszkańcem
lasów, a także nieleśnych obszarów podmokłych, gdzie
znajduje dogodne ostoje w trzcinowiskach, na grądzikach
i w zakrzewieniach. Często można spotkać samice (lochy)
z warchlakami, które stanowią charakterystyczne grupy
rodzinne. Samce, zwłaszcza stare odyńce są samotnikami.
W strukturze populacji wyróżnia się dodatkowo grupę
przelatków – osobników w drugim roku życia oraz wycinków – w trzecim roku życia. Te ostatnie łączą się zwykle
w grupy samców, podczas gdy trzyletnie samice uczestniczą w rozrodzie i prowadzą potomstwo, tworząc grupy rodzinne, liczące niekiedy kilkanaście osobników. Liczebność populacji dzików zmienia się w poszczególnych latach. Czynnikiem ograniczającym są zwykle ciężkie zimy
(gruba pokrywa śnieżna utrudniająca dostęp do ściółki),
natomiast zimy lekkie sprzyjają odchowaniu większej liczby młodych i skutkują wzrostem stad.
Dziki przemieszczają się swobodnie na większych obszarach, rzeki nie stanowią dla nich przeszkody. W dolinie
Narwi można mówić o lokalnej populacji dzika oraz o penetracji przez te zwierząta odpowiadających im siedlisk
w zależności od pór roku i preferencji środowiskowych.
Ślady obecności dzików w postaci „buchtowania”, można
często obserwować w miejscach, gdzie zwierzęta poszukiwały kłączy lub larw owadów w ściółce leśnej lub na łąkach.
Na obszarach chronionych i w lasach rolę dzika w oddziaływaniu na środowisko przyrodnicze ocenia się jako pozytywną biocenotycznie.
Łoś Alces alces jest największym przedstawicielem jeleniowatych. Jego losy w Polsce w okresie powojennym, gdy
większość naturalnych ostoi gatunku znalazła się poza granicami kraju, kształtowały się w wyniku rozwoju resztkoobszarów zagospodarowanych (lasy gospodarcze, agrocenozy) wiąże się z występowaniem szkód w uprawach leśnych
i polnych, które wymagają rekompensat finansowych i czynnych zabiegów, np. grodzenia upraw leśnych. Nie odnosi się
to jednak do obszarów chronionych, gdzie priorytetowe
znaczenie ma zachowanie naturalnego przebiegu różnorodnych procesów ekologicznych.
Ryc. 11.10 Dzik Sus scrofa jest jednym z najpospolitszych dużych ssaków Polski,
zamieszkujących zarówno lasy, jak i środowiska polne oraz podmokłe; na fotografii
karmiąca locha (fot. K. Zub)
Ryc. 11.11 Dwa łoszaki (bliźnięta) napotkane w rejonie uroczyska Rynki (fot. J. Raczyński)
wej autochtonicznej populacji biebrzańskiej, migracji z Białorusi, Litwy i Ukrainy oraz dzięki udanej introdukcji w Puszczy Kampinoskiej w latach 50. ubiegłego wieku (Dzięciołowski, Pielowski 1975). Rozwój populacji biebrzańskiej
ma szczególne znaczenie, ponieważ zachowały się tu osobniki będące pozostałością dawnego, holoceńskiego zasięgu łosia w Europie (Gębczyńska, Raczyński 2004; Świsłocka i in. 2008). Okres pomiędzy rokiem 1960 a 1980 miał
szczególne znaczenie dla rozwoju populacji łosia w Polsce, ponieważ dzięki
ochronie do 1967 r. i umiarkowanemu odstrzałowi w latach następnych gatunek
ten wzrastał liczebnie i rozprzestrzeniał się ze wschodnich ostoi na zachód, opanowując prawie cały niż Polski (Gębczyńska, Raczyński 2001). Główną ostoję
łosie znalazły w północno-wschodniej i wschodniej części kraju, gdzie oddziaływały zasilające migracje transgraniczne i zachowały się dogodne ostoje bagienne. Na początku lat 80. XX w. liczebność populacji szacowano na około
6200 osobników. W następnych latach wskutek nadmiernej eksploatacji łowiec209
Ryc. 11.12 Tropy łosia Alces alces w płytkim śniegu
(fot. J. Raczyński)
Ryc. 11.13 Typowe zimowe zgryzy pędów szczytowych sosny
dokonane przez łosia Alces alces (fot. J. Raczyński)
kiej, krajowa populacja uległa zmniejszeniu o blisko 2/3,
zaś wiele ostoi tego gatunku w Polsce zachodniej zanikło.
Od 2001 r. obowiązuje moratorium na odstrzał łosi wprowadzone w całym kraju decyzją Ministra Środowiska, zaś
przyszłość gospodarowania tym gatunkiem zależy od
wdrożenia nowych, racjonalnych strategii. Wieloletnia
ochrona spowodowała, że polska populacja łosia rośnie
(13,7 tys. w 2014 r.), co stwarza problemy w zakresie szkód
leśnych i bezpieczeństwa na drogach.
W dolinie Narwi łoś jest często spotykanym gatunkiem
(Ryc. 11.11), czemu sprzyja mała płochliwość tego zwierzęcia,
niemającego obecnie naturalnych wrogów w lokalnej faunie (niedźwiedź, wilk). Zimą łatwo dostrzec charakterystyczne ślady racic łosia (Ryc. 11.12) i typowe ślady żerowania na gałęziach łozowych (spałowanie) i młodych pędach
sosen (Ryc. 11.13). Narwiańska ostoja łosi ma łączność
210
z populacją biebrzańską poprzez komunikujące się doliny,
będące typowymi szlakami migracji. Zwierzęta przemierzające nadnarwiańskie ostępy korzystają z łatwo dostępnej bazy pokarmowej w nadrzecznych łozowiskach oraz
w podrostach sosnowych na grądzikach i w borach.
Sarna Capreolus capreolus, zwana także sarną europejską, zamieszkuje prawie całą Europę, z wyjątkiem Irlandii
i niektórych wysp Morza Śródziemnego. Jej północny zasięg w Skandynawii określają warunki klimatyczne.
­Najpospolitsza jest w Europie środkowej, w tym w Polsce,
gdzie jest najliczniejszym gatunkiem spośród jeleniowatych. Krajowa populacja szacowana jest na ok. 700 tys.
osobników, przy czym największe zagęszczenia występują
w zachodniej części kraju (Kamieniarz, Panek 2008).
Sarna, będaca w naszej faunie najmniejszym przedatwicielem jelniowatych, ma duży zakres preferencji siedliskowych, dzięki czemu można ją spotkać zarówno w lasach,
które stanowią główną ostoję tego gatunku, jak i na polach,
bagnach, w zakrzewieniach, generalnie w środowisku mozaikowym, leśno-polnym (Ryc. 11.14). Na terenach rolniczych, użytkowanych w systemie wielkoobszarowym,
sarny zimą formują duże ugrupowania, co skłaniało niektórych badaczy do wyróżniania ekotypu „sarny polnej”,
jednak takie podejście nie znajduje potwierdzenia w nowszych badaniach. Zagęszczenie sarny w korzystnych warunkach zwykle przekracza 10 osobników/100 ha powierzchni, ale skryty tryb życia tego zwierzęcia utrudnia
oceny na podstawie pobieżnych obserwacji. Stwierdzenie
śladów (tropów) sarny jest częste, z racji pospolitości tego
gatunku, zaś jej obserwacje, zwłaszcza w okresie zimowym
nie nastręczają trudności. Widzi się wówczas najczęściej
grupy rodzinne – samice (kozy) z młodymi, przy czym towarzyszące matce bliźnięta nie należą do rzadkości.
W miesiącach zimowych (luty–kwiecień) widuje się samce
(kozły) z porożem w scypule, który ocierają w kwietniu,
aby było gotowe na okres rui (Ryc. 11.15), trwającej od połowy lipca do połowy sierpnia. Ślady wycierania poroża
zdradzające obecność tego zwierzęcia, można dostrzec na
pędach niskich krzewów w postaci bardzo charakterystycznych otarć kory. Pokarm sarny jest bardzo urozmaicony i obejmuje zarówno zioła, jak i pędy oraz liście drzew
i krzewów, przy czym pobierany jest bardzo selektywnie,
z preferencją wysokoenergetycznych części roślin.
W dolinie Narwi sarna jest gatunkiem pospolitym, nie
unika bowiem terenów bagiennych, dających jej osłonę,
i grądzików, na których często żeruje i spoczywa w celu
przeżuwania. Jednak jej zagęszczenie na terenach sąsiadujących z Parkiem Narodowym jest względnie małe i mieści
się w zakresie 1–3,6 osobników na 100 ha. Na terenie chronionym główne niebezpieczeństwo, na jakie jest narażona,
to kłusownictwo (wnykarstwo) i kolizje z pojazdami.
Dla młodych osobników zagrożenie stanowią lisy i inne
drapieżniki, np. włóczące się psy. Działalność łowiecka
w obwodach przylegających do Parku nie zagraża lokalnej
populacji, ponieważ odbywa się według ustalonych planów
pozyskania. Istotne niebezpieczeństwo dla populacji lokalnych mogą stanowić śnieżne zimy z długim okresem zalegania pokrywy śnieżnej i długotrwałymi niskimi temperaturami, co w ostatnich latach zdarza się rzadko.
Jeleń szlachetny Cervus elaphus występuje współcześnie na terenie całej Polski, ale najliczniej w lesistych
Ryc. 11.14 Rudel saren Capreolus capreolus w szacie zimowej;
charakterystyczne białe „lusterka” różnią je od jeleni (fot. J. M. da Costa)
Ryc. 11.15 Samiec (kozioł) sarny Capreolus capreolus z wytartym porożem
(fot. J. M. da Costa)
211
c­ zęściach kraju: na Mazurach, Pomorzu i w Karpatach. Od
końca lat 90. ubiegłego wieku obserwuje się stałą tendencję
wzrostową populacji krajowej, która osiągnęła w sezonie
2009/2010 stan 141 tys. osobników (Budny i in. 2010). Jest
to gatunek w fazie ekspansji, który zasiedla przede wszystkim lasy liściaste i mieszane, wychodząc także na ich
obrzeża, nie omijając lasów gospodarczych z licznymi zrębami, uprawami leśnymi i młodnikami, stanowiącymi doskonałą bazę pokarmową. W lecie korzysta z zasobów żerowych w postaci traw, ziół i krzewinek, w zimie odżywia
się obok krzewinek (borówka), młodymi pędami drzew
i korą sosny (spałowanie). Rytm aktywności tego roślinożercy wyznaczają okresy żerowania (głównie pora świtu
i zmierzchu) oraz przeżuwania, kiedy przebywa w bezpiecznych kryjówkach.
Jelenie są zwierzętami stadnymi, tworzącymi, zwłaszcza
zimą liczne chmary złożone z łań z przychówkiem oraz
oddzielnie grupy samców (byków). W jesieni odbywają
głośne gody (rykowisko), kiedy wokół uczestniczących
w rozrodzie byków tworzą się haremy rujnych łań. W maju–
czerwcu samice rodzą z reguły tylko jedno młode i opiekują
się nim przez pierwszy rok życia. Naturalnymi wrogami
jeleni są wilki i rysie. Obydwa te drapieżniki współwystępują
z jeleniami w najcenniejszych kompleksach leśnych Polski,
tworząc klasyczny układ drapieżnik – ofiara.
W dolinie Narwi w ostatnich kilkunastu latach ma miejsce ekspansja jelenia na mniejsze kompleksy leśne, gdzie
dotychczas nie występował. Na początku XXI w. pojawianie się jeleni szlachetnych w strefie buforowej Narwiańskiego Parku Narodowego odnotowali Gębczyńska i Raczyński (2000). Obecnie (2016 r.) jelenie występują w 10 na
13 obwodów łowieckich, przylegających do Parku Narodowego. Obserwacje zimowe wykazały obecność tych ssaków
w wielu niewielkich kompleksach leśnych na terenie Parku,
najliczniej w lasach uroczyska Bojary. Pracownicy Parku
systematycznie stwierdzają obecność tego gatunku podczas inwentaryzacji. Pojęcie stałej ostoi jelenia nie jest sprecyzowane pod względem ekologicznym, można jednak
traktować jako ostoje takie miejsca, gdzie zwierzęta te
przebywają stale, także w okresie godowym (rykowisko).
W takim ujęciu niektóre większe kompleksy leśne w granicach Narwiańskiego Parku Narodowego, gdzie panuje
większy spokój, niż w lasach penetrowanych przez turystów, mają szanse stać się ostojami tego gatunku.
Zagrożenia dla zachowania
zespołu ssaków na terenie
Narwiańskiego Parku
Narodowego
Teren Parku Narodowego podlega recesji ekstensywnej
gospodarki rolnej i zmianom wywołanym zaburzeniami
warunków hydrologicznych doliny. Uwodnienie doliny
zmniejsza się na skutek ograniczeń zasięgu i skrócenia
czasu trwania zalewów wiosennych oraz obniżenia stanów
wód w korycie Narwi w okresie wegetacyjnym (Banaszuk
2004). Dominująca wcześniej roślinność jest zastępowana
212
przez szuwar trzcinowy i zakrzaczenia, których sukcesja
nie jest już w ostatnich dziesięcioleciach hamowana przez
koszenie i wypas. Kombinacja tych procesów, tj. naruszenie stosunków wodnych oraz idąca za tym sukcesja stanowią największe zagrożenie dla niektórych gatunków ssaków występujących w dolinie Narwi.
Niepokojące zmiany jakościowe i ilościowe zaobserwowano już w zespołach drobnych ssaków (Łupiński i in.
2013), które są dobrą grupą wskaźnikową przekształceń
zachodzących w ekosystemach. W ciągu ostatnich dwudziestu lat zmniejszył się udział ryjówkowatych oraz nornika północnego – typowego trawożercy preferującego
szuwary turzycowe o strukturze wysokokępowej. Dominująca wcześniej na terenach bagiennych populacja ryjówkowatych (Gębczyńska, Raczyński 1997) została znacznie
zubożona na skutek spadku liczebności ryjówki malutkiej
i rzęsorka rzeczka, co jest najprawdopodobniej wynikiem
postępującego przesuszenia doliny. Uwagę zwraca również
brak smużki, przedstawiciela Micromammalia potencjalnie możliwego do stwierdzenia na tym terenie. Gatunek
ten preferuje środowiska podmokłe, toteż jego nieobecność
może świadczyć o zaawansowanych przemianach siedlisk
bagiennych, zwłaszcza w sensie historycznym, co sugerowali wcześniej Gębczyńska i Raczyński (1997).
Lokalne populacje bobra i wydry są stabilne, czemu niewątpliwie sprzyja dostępność optymalnych siedlisk oraz
ograniczona penetracja terenu przez człowieka. Sukcesja
roślinności i zmiany stosunków wodnych nie dotykają tych
zwierząt w sposób znaczący.
Grupa kopytnych obejmuje gatunki pospolite i zasiedlające środowiska leśne oraz agrocenozy, bądź występujące,
choćby okresowo, w obydwu tych typach. Na terenach otaczających Narwiański Park Narodowy podlegają one gospodarce łowieckiej, regulowanej przepisami ustawy prawo
łowieckie i nie są zagrożone żadnymi zjawiskami występującymi na obszarze chronionym. Potencjalnym zagrożeniem dla niektórych gatunków ssaków może być kłusownictwo.
Rola doliny Narwi i Narwiań­
skiego Parku Narodowego
w ochronie populacji ssaków
Doliny rzeczne stanowią najbardziej uniwersalną formę
korytarza ekologicznego. Dolina Górnej Narwi, w tym jej
część chroniona w ramach Narwiańskiego Parku Narodowego, jest ważnym korytarzem migracyjnym dla ssaków
kopytnych, takich jak łoś, jeleń czy dzik. Jednocześnie,
z uwagi na swoją względnie niewielką szerokość, nie jest
ona areałem osobniczym dla większości gatunków ssaków
dużych i nie stwarza odpowiednich warunków do ich licznego występowania. Doskonale czują się tu natomiast
zwierzęta związane z siedliskami wodno-błotnymi, takie
jak bóbr i wydra. Dla wielu przedstawicieli drobnych ssaków Park Narodowy stwarza korzystne warunki do bytowania. Można tu wymienić m.in. nornika północnego, dla
którego otwarte tereny podmokłe stanowią preferowany
zespół siedlisk naturalnych. Wraz z innymi przedstawicie-
lami Micromammalia stanowi on ważne ogniwo łańcucha
troficznego dla wielu bytujących tutaj gatunków ptaków
i ssaków drapieżnych.
Działania, mające na celu ochronę populacji ssaków doliny Narwi powinny opierać się przede wszystkim na zachowaniu jej unikatowego charakteru, poprzez podejmowanie zabiegów prowadzących do poprawy stosunków
wodnych oraz przeciwdziałaniu procesom zanikania
i ujednolicania się siedlisk.
Literatura
Banaszuk H. (red.) 2004. Przyroda Podlasia. Narwiański Park
Narodowy – monografia przyrodnicza. Wyd. Ekonomia i Środowisko, Białystok.
Borowski Z. 2013. Cykliczna zmienność liczebności nornika
północnego w dolinie Biebrzy. [W:] Taylor J. R. E. (red.), Tajemnice doliny Biebrzy. Eseje naukowe o zwierzętach i roślinach. 55–64. Wyd. Trans Humana, Białystok.
Budny M., Kamieniarz R., Kolanoś B., Mąka H., Panek M.
2010. Sytuacja zwierząt łownych w Polsce w latach 2008–2009.
Biuletyn Stacji Badawczej PZŁ w Czempiniu. 6: 1–56.
Cichocki W., Ważna A., Cichocki J., Rajska-Jurgiel E., Jasiński A., Bogdanowicz W. 2015. Polskie nazewnictwo ssaków świata. Muzeum i Instytut Zoologii PAN, Warszawa.
Dzięciołowski R., Pielowski Z. 1975. Łoś. Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa.
Fruziński B. 1992. Dzik. Wyd. Cedrus, Warszawa.
Gębczyńska Z., Raczyński J. 1997. Fauna i ekologia drobnych
ssaków Narwiańskiego Parku Narodowego. Parki Nar. i Rez.
Przyr. 16: 37–61.
Gębczyńska Z., Raczyński J. 2000. Ssaki Narwiańskiego Parku
Narodowego. [W:] Sterzyńska M. (kierownik tematu), Narwiański Park Narodowy. Plan Ochrony. Operat: Ochrona
Fauny. Muzeum i Instytut Zoologii PAN, Warszawa (mscr.).
Gębczyńska Z., Raczyński J. 2004. Łoś w Kotlinie Biebrzańskiej. [W:] Sytuacja populacji łosia w Polsce. 5–19. Biebrzański
Park Narodowy, Osowiec-Twierdza.
Jędrzejewski W., Sidarowicz W. 2010. Sztuka tropienia zwierząt. Zakład Badania Ssaków Polskiej Akademii Nauk, Białowieża.
Kamieniarz R., Panek M. 2008. Zwierzęta łowne w Polsce na
przełomie XX i XXI wieku. Stacja Badawcza Polskiego Związku Łowieckiego, Czempiń.
Łupiński S. Ł., Raczyński J., Chętnicki W. 2013. Operat fauny.
Herpetofauna i teriofauna w części obejmującej płazy, gady,
drobne ssaki, wybrane gatunki chronione – bobra, wydrę,
wilka i ssaki kopytne. Plan ochrony Narwiańskiego Parku
Narodowego. Białystok (mscr.).
Pielowski Z., Kamieniarz R., Panek M. 1993. Raport o zwierzętach łownych w Polsce. Biblioteka Monitoringu Środowiska, Warszawa.
Pruszyński M. 2014. Narwiański Park Narodowy. [W:] Jamrozy
G. (red.), Ssaki polskich Parków Narodowych: drapieżne, kopytne, zajęczaki i duże gryzonie. Instytut Bioróżnorodności
Leśnej Wydział Leśny Uniwersytetu Rolniczego. 152–161.
Kraków, Krempna.
Pucek Z. 1984. Klucz do oznaczania ssaków Polski. Wyd. PWN,
Warszawa.
Pucek Z., Michalak I. 1983. 0010 Crocidura leucodon (Herman,
1780). [W:] Pucek Z., Raczyński J. (red.), Atlas rozmieszczenia
ssaków w Polsce. Wyd. PWN, Warszawa.
Raczyński J. 2013. Środowisko życia, biologia i ekologia zająca
szaraka Lepus europaeus Pallas, 1778. [W:] Gołko M. (red.),
Gdzie się podział zając szarak? 9–24. Uroczysko, Supraśl.
Romanowski J., Orłowska L., Zając T. 2011. Program ochrony
wydry Lutra lutra w Polsce. Krajowa strategia gospodarowania wydrą. Wyd. SGGW, Warszawa.
Romanowski J., Zając T., Orłowska L. 2010. Wydra ambasador czystych wód. Fundacja Wspierania Inicjatyw Ekologicznych, Kraków.
Świsłocka M., Ratkiewicz A., Borkowska A., Komenda E.,
Raczyński J. 2008. Mitochondrial DNA diversity in moose,
Alces alces from Northeastern Poland: evidence for admixture
in bottlenecked relic population in the Biebrza Valley. Ann.
Zool. Fennici 45: 360–365.
Taylor J. R. E. 2013. Ryjówki – życie na wysokich obrotach. [W:]
Taylor J. R. E. (red.), Tajemnice doliny Biebrzy. Eseje naukowe
o zwierzętach i roślinach. 80–88. Wyd. Trans Humana, Białystok.
Tomek A., Tomek Z. 1993. Zwierzyna w Lesie Wolskim na terenie Krakowa. Przegląd Zool. 3–4: 233–238.
Wołkowycki D., Kołos A., Matowicka B., Szewczyk M., Lickiewicz J., Popławski C., Karczmarewicz R., Danik K.
2013. Operat ekosystemów bagiennych, lądowych i leśnych.
Plan ochrony Narwiańskiego Parku Narodowego. Białystok
(mscr.).
Zub K. 2009. Ssaki. [W:] Okołów C., Karaś M., Bołbot A. (red.),
Białowieski Park Narodowy. Poznać – Zrozumieć – Zachować. 127–142. Białowieski Park Narodowy, Białowieża.
213
Rola drobnych ssaków
Drobne ssaki Micromammalia odgrywają bardzo ważną
rolę w funkcjonowaniu ekosystemów, kształtując je poprzez
wpływ na roślinność, glebę i inne zwierzęta (Hull Sieg 1987).
Gryzonie mogą w dużym stopniu wpływać na produkcję
pierwotną zwłaszcza w okresach szczytów populacyjnych.
Poprzez selektywne zjadanie oraz uszkadzanie określonych
gatunków, jak również zjadanie i przechowywanie zapasów
nasion, modyfikują strukturę zespołów roślinnych i rozmieszczenie gatunków. Pionierskie gatunki mają duże
znacznie w inicjacji procesów sukcesji na obszarach zniszczonych np. przez pożary, wiatr, czy wcześniej nie zasiedlonych przez rośliny, bowiem wpływają pozytywnie na rozprzestrzenianie wielu gatunków roślin i grzybów. Drobne
ssaki, poprzez rycie, kopanie, wydalanie odchodów i moczu
znacząco wpływają na skład chemiczny gleby modyfikując
obieg składników odżywczych i mineralnych. Ich wpływ na
dekompozycję materiału roślinnego jest dużo większy niż
owadów czy ssaków kopytnych. Odchody i mocz wzbogacają glebę w azot, dodatkowo wpływając korzystnie na
wzrost niektórych bakterii azotowych. Dzięki ryciu i kopaniu gleba jest spulchniana, mieszana i przewietrzana.
Micromammalia stanowią podstawowe lub dodatkowe
źródło pożywienia dla wielu gatunków zwierząt wpływając
na ich cykle populacyjne. Owadożerne odżywiając się bezkręgowcami (wśród których duży udział mają owady uznawane za szkodliwe) i innymi zwierzętami, wpływają bezpośrednio na ich populacje oraz pośrednio na produkcję pierwotną.
Marzena Giedrewicz, Jan Raczyński,
Włodzimierz Chętnicki, Sebastian Ł. Łupiński
Literatura
Hull Sieg C. 1987. Small Mammals: Pests or Vital Components of
the Ecosystem. Great Plains Wildlife Damage Control Workshop Proceedings. 97: 88–92.
fot. A. Bielonko
214
11.2 Bóbr i jego „wodna inżynieria”
Marzena Giedrewicz • Sebastian Ł. Łupiński
Witaj miły panie bobrze
Czy w tym stawie Panu dobrze?
Nie za bardzo, wody mało
Zatamować by się chciało
(Motyla 2006)
Ten krótki wiersz w bardzo trafny sposób podsumowuje
działalność niezwykłego zwierzęcia, jakim jest bóbr europejski Castor fiber. Ten gryzoń jest chyba, oprócz człowieka, jedynym gatunkiem na Ziemi, który potrafi wywierać
tak duży wpływ na środowisko, w którym żyje i kształtować je według własnych potrzeb. Doskonale oddają to
słowa Lewartowskiego (1992): wpływ [bobra] na strukturę i funkcjonowanie ekosystemów wodno-bagiennych jest
tak znaczny, że właściwie porównywalny jedynie z możliwościami człowieka w zakresie inżynierii wodnej. Ziemnowodny tryb życia bobra jest bowiem nierozerwalnie połączony z aktywnością budowlaną polegającą na wznoszeniu
tam regulujących poziom wody, kopaniu kanałów oraz budową schronień – nor i żeremi.
Bobry preferują nizinny krajobraz żyznych dolin, okolice wolno płynących rzek i strumieni, zalewów, jezior
o względnie stałym poziomie wody, ich dopływów i małych cieków. Doskonale sobie radzą na niewielkich bagienkach, torfowiskach i w obniżeniach terenowych, przy dostępności podstawowego pokarmu: osiki i wierzby. Są przy
tym bardzo plastyczne i mogą zakładać swoje stanowiska
w środowiskach, które wydają się nieatrakcyjne do zasiedlania, jak np. pola uprawne, bezpośrednie sąsiedztwo gospodarstw rolnych, sadów, dróg, pól campingowych itp.
(Dzięciołowski 2004; Czech 2010).
Każdy element budowy ciała i fizjologia bobra są idealnie dostosowane do trybu życia, jaki prowadzi. Jest to silny,
duży ssak (ważący 18–29 kg) o krępym ciele będący drugim co do wielkości, po kapibarze, gryzoniem na świecie.
Jego masywny opływowy tułów jest zakończony grzbietobrzusznie spłaszczonym ogonem, pokrytym zrogowaciałym
naskórkiem przypominającym rybie łuski. Ogon pełni rolę
steru w wodzie, podpory na lądzie, organu termoregulacji
i magazynu tłuszczu. Przednie kończyny są bardzo zręczne
i chwytne, natomiast tylne, o palcach połączonych błoną
pławną – oprócz spłaszczonego ogona – stanowią siłę napędową podczas poruszania się w wodzie. Jednak chyba
najbardziej charakterystyczną cechą bobra są jego zęby.
Będąc gryzoniem nie posiada kłów, a dochodzące do 10 cm
dłutowate siekacze rosną całe życie i dzięki różnicom
w ścieralności warstwy zewnętrznej i wewnętrznej nigdy
się nie tępią. W razie potrzeby, przy braku innych preferowanych gatunków, bobry są w stanie ścinać nawet najtwardsze drzewa, takie jak dąb czy grab (Czech 2010).
No dobrze, ale skąd bóbr wie, z której strony wykonać
spiętrzenie, jak budować tamy czy żeremia? Po pierwsze,
jeśli weźmiemy pod uwagę stosunek masy mózgu do masy
ciała, okazuje się, że jest on relatywnie największy wśród
gryzoni. Po drugie bóbr potrafi rozwiązywać problemy nie
tylko instynktownie, ale również wykorzystując umiejętności nabywane poprzez obserwację rodziców i starszego
rodzeństwa. Często okazuje się, że zaproponowanie rozwiązań mających na celu zapobieganie powstawaniu szkód
powodowanych przez te zwierzęta jest trudne ze względu
na ich inteligencję, która pozwala szybko znajdować słabe
punkty zastosowanych zabezpieczeń technicznych (Czech
2010).
Chociaż obecnie bóbr jest w Polsce zwierzęciem pospolitym, warto przypomnieć, że jego sytuacja uległa znacznej
poprawie dopiero w ostatnich dekadach. Do wczesnego
średniowiecza bobry występowały pospolicie na obszarze
naszego kontynentu (Janiszewski, Misiukiewicz 2012).
W Krakowskiem znane były żeremia bobrowe nad Nidą,
w Wielkopolsce nad Notecią, w Lubelskiem nad Wieprzem,
ale podobno najliczniejsze były na Podlasiu nad górną Narwią i Biebrzą, którą dawniej nazywano Bobrą od obfitości
tych zwierząt (Gloger 1900). Z czasem, kolonie bobrowe
położone w pobliżu osad ludzkich stały się łatwym łupem
i już w IX w. ich liczba zaczęła się stopniowo zmniejszać.
Pod koniec średniowiecza zwierzęta te żyły już jedynie
w środkowej i północnej Europie oraz na Bałkanach. W Polsce liczebność bobrów zaczęła spadać w XIII w., a u schyłku
XIX w. należały już do rzadkości. Głównym powodem wyginięcia tego gatunku w naszym kraju było pozyskanie castoreum (stroju bobrowego), sadła o właściwościach leczniczych, futer i mięsa. Nie zapobiegło temu nawet wydane
w XI w. przez Bolesława Chrobrego pierwsze prawo ustanawiające urząd bobrowniczego, do którego należała hodowla i ochrona bobrów w obrębie ziem książęcych, opieka
nad żeremiami, zapewnienie spokoju rodzinom bobrowym
oraz selekcyjny odłów. W okolicy Biebrzy i Narwi zwierzęta te przetrwały do początków XIX w. Ostatniego bobra
zabito w majątku Góra w dolinie Narwi około 1835 r. (Janota, Anczyc 1876), po czym zniknął on z ziem polskich
na ponad 100 lat. Dopiero na początku lat 40. XX w. bobry
215
Ryc. 11.16 w miejscach, gdzie nie można wykopać nory, bóbr Castor fiber buduje żeremie.
(fot. S. Łupiński)
Ryc. 11.17 w okresie zimowym pokarm bobra stanowią krzewy i drzewa liściaste, których
zapasy zwierzęta zmagazynowały w spiżarniach (tzw. tratwach) (fot. K. Zub)
pojawiły się w dwóch lokalizacjach, tj. na rzece Marycha i Czarna Hańcza, prawdopodobnie w wyniku dyspersji populacji zlokalizowanej w dorzeczu Niemna.
Ważną rolę w powrocie bobra do naszych rzek odegrali profesorowie Czaja i Dehnel, którzy w 1949 r. przeprowadzili udaną reintrodukcję tych zwierząt z okolic
Woroneża (ówczesny ZSRR). W 1974 r. wobec niezadowalających sukcesów
i braku wzrostu liczebności populacji bobra, dzięki inicjatywie profesora Żurowskiego, powstał plan aktywnej ochrony gatunku, w głównej mierze polegający na reintrodukcji i przesiedleniach osobników. Obecnie bóbr występuje
w całym kraju, z czego najliczniej w północno-wschodniej Polsce, w województwach podlaskim i warmińsko-mazurskim (Janiszewski, Misiukiewicz 2012;
GDOŚ 2013).
216
Pierwsze doniesienia na temat powrotu bobra do doliny
Narwi, na odcinku objętym obecnie ochroną w ramach
Narwiańskiego Parku Narodowego, pochodzą od Lewartowskiego (1992), który prowadził na terenie ówczesnego
Narwiańskiego Parku Krajobrazowego systematyczne obserwacje ornitologiczne. Według tego autora inicjalna populacja bobra składała się, w początkowym okresie zasiedlania obszaru (lata 1976–1980), z trzech rodzin, których
stanowiska zostały stwierdzone w rejonie Bokin nad Turośnianką, nad Awissą koło Płonki Kościelnej oraz na Narwi
koło Śliwna. Wiadomo, że Dolina Narwi w swoim środkowym i dolnym biegu została zasiedlona przez bobry z ostoi
biebrzańskiej, której początek dały osobniki wsiedlone
w Osowcu w 1949 r. (Żurowski 1982). Zasiliły one z pewnością również obszar Narwiańskiego Parku Narodowego.
Potwierdzają to obserwacje prowadzone podczas wcześniejszych penetracji koryta Narwi, kiedy nie odnaleziono
śladów obecności tych zwierząt na odcinku rzeki powyżej
Narwiańskiego Parku Narodowego (Lewartowski 1992).
Wyklucza to tym samym możliwość kolonizacji tego odcinka Narwi z udziałem bobrów ze stanowiska znanego
wcześniej na terenie Puszczy Białowieskiej na rzece Hwoźnej, połączonej z Narwią przez rzekę Narewkę.
Bobry mogą zamieszkiwać trzy rodzaje schronień: nory,
półżeremia lub żeremia, w zależności od ukształtowania
terenu. W wysokich brzegach cieków i zbiorników wodnych bobry budują nory, zaś na obszarach bagiennych,
gdzie brzegi są niskie, wznoszą konstrukcje z gałęzi, resztek roślin i mułu (żeremia; Ryc. 11.16). W przypadku, gdy
brzeg nie jest wystarczająco wysoki, budują tzw. półżeremie: po wykopaniu nory, podwodne wejście jest obudowywane gałęziami, a następnie bobry gromadzą materiał do
umocnienia brzegu i zwiększenia grubości warstwy nad
komorą gniazdową (Janiszewski, Misiukiewicz 2012).
Narwiańskie bobry budują przede wszystkim żeremia.
Większość czynnych stanowisk znajduje się na odcinku
rzeki od Kolonii Topilec do północnej granicy Parku Narodowego. Jest to podobna sytuacja do stwierdzonej przed
dwudziestu laty przez Lewartowskiego (1992)1. Prawdopodobnie populacja bobrów nad Narwią ustabilizowała się,
bowiem l­ iczebność zwierząt zmieniła się od tamtego czasu
nieznacznie, z 70 do 76 rodzin (Łupiński i in. 2013). Aktualnie ekspansja bobrów przebiega w kierunku terenów
przyległych, na co wskazują m.in. ślady zarejestrowane
poza Narwiańskim Parkiem Narodowym, zwłaszcza od
strony wschodniej, gdzie znajdują się dawne obszary bagienne, obecnie zagospodarowane, z systemem rowów melioracyjnych (Kuczynko 2003; Polak 2004; Łupiński i in.
2013). Tereny te, wraz z odcinkami dopływów Narwi (np.
Awissy), położonych poza Parkiem, stały się obszarem ekspansji tego gryzonia.
Pomimo, że bóbr jest zwierzęciem inteligentnym, potrafiącym w dużym stopniu dostosować otoczenie do swoich
potrzeb, o możliwości zasiedlenia terenu w dużym stopniu
decydują uwarunkowania siedliskowe. Oprócz obecności
wody niezbędna jest odpowiednia roślinność, która stano1
Wprawdzie badacz ten prowadził obserwacje na obszarze
ówczesnego Narwiańskiego Parku Krajobrazowego, ale prawie wszystkie stanowiska były zlokalizowane w dzisiejszych
granicach Parku Narodowego.
wi zarówno pożywienie jak i materiał do budowy schronień, czy tam. Bóbr odżywia się prawie wszystkimi gatunkami roślin przybrzeżnych i wodnych. Oczywiście baza
żerowa uzależniona jest od roślinności występującej
w danym środowisku i zazwyczaj jest ograniczona do dość
wąskiej, około 20 m strefy przybrzeżnej, którą penetrują
zwierzęta. Wbrew obiegowej opinii, nie jedzą one drewna,
a jedynie liście, cienkie gałązki, młode pędy, łyko, korę
oraz nadbrzeżne i wodne rośliny zielne, zwłaszcza ich kłącza. Dieta tego gryzonia zmienia się w zależności od pory
roku. Późną wiosną, latem i wczesną jesienią w skład pożywienia wchodzi głównie roślinność zielna, trawy i rośliny
wodne. Począwszy od połowy października pokarm stanowią krzewy i drzewa liściaste, których zapasy bobry magazynują również na zimę w spiżarniach, tzw. tratwach (Ryc.
11.17; Czech 2010). Niektóre rodziny bobrowe, których
stanowiska położone są w sąsiedztwie gruntów ornych,
mogą zjadać i gromadzić nawet buraki, kolby kukurydzy,
czy ziemniaki zbierane z okolicznych pól (Janiszewski,
Misiukiewicz 2012).
Narwiańskie bobry najchętniej osiedlają się w wąskich
ciekach i rowach melioracyjnych, porośniętych wierzbą
szarą Salix cinerea. Wydaje się, że większa dostępność tej
rośliny przyczynia się do pomyślnego rozwoju rodzin
bobrowych i wydania potomstwa, co przekłada się na
większą liczbę żeremi należących do jednej rodziny
(Kuczynko 2003). Wśród preferowanych gatunków drzewiastych, wierzby stanowią właściwie jedyne źródło pokarmu w Narwiańskim Parku Narodowym, przy czym to
wierzba szara jest podstawą zimowej bazy żerowej oraz
służy do budowy żeremi i tam. Miejscowe bobry znacznie
rzadziej korzystają z wierzby białej Salix alba, olchy czarnej
Alnus glutinosa i wierzby rokity Salix rosmarinifolia (Lewartowski 1992; Kuczynko 2003; Polak 2004). Ponieważ nurt Narwi nie sprzyja działaniom budowniczym tych
zwierząt, wydaje się, że unikają one bytowania w pobliżu
większych koryt rzeki. Dodatkowo, tereny leżące bezpośrednio przy korycie Narwi są gorsze jakościowo pod
względem zasobności pokarmu. O pozytywnym wpływie
sieci rowów i kanałów na populację bobra przekonano się
w Rosji, gdzie w wyniku przeprowadzenia prac melioracyjnych zaobserwowano gwałtowny rozrost populacji tych
zwierząt. W ciągu czterech lat przyrost stanowisk na terenach zmeliorowanych wyniósł aż 770% (Dzięciołowski
1996).
Zdolności inżynieryjne bobrów są niespotykane w świecie zwierząt, a ich najbardziej charakterystycznym przejawem jest niewątpliwie budowa spiętrzeń. Umiejętność ta
jest kluczowa dla funkcjonowania siedliska bobrowego,
którego utrzymanie wymaga odpowiedniego poziomu
wody, umożliwiającego bezpieczne dotarcie drogą wodną
do nowych terenów zasobnych w pokarm. Kurczenie się
bazy żerowej w obrębie stanowiska inicjuje proces rozbudowywania tamy lub budowy kolejnych. Powiększające się
w ten sposób rozlewisko obejmuje kolejne obszary, co ułatwia zwierzętom dotarcie do dalej rosnących drzew (Janiszewski, Misiukiewicz 2012). Jak zaawansowaną strukturą jest tama może świadczyć fakt, że po ukończeniu budowy jest szczelna do tego stopnia, że woda może przelewać
się tylko przez jej wierzch. Wszelkie przecieki są szybko likwidowane, ponieważ mogą odsłonić wejścia do schronień
217
i ułatwić atak drapieżnikom. Umożliwia to bardzo czuły
zmysł dotyku, dzięki któremu bobry precyzyjnie wyczuwają dłońmi kierunek i siłę prądu wody. Wydaje się, że wybór
miejsca do budowy jest przemyślany, a bobry „wiedzą” –
dzięki instynktowi bądź doświadczeniu – że posadowienie
tamy w konkretnym punkcie zapewni stały i podwyższony
poziom wody. Dodatkowo istnieją różne doniesienia na
temat sposobu budowy, wskazujące, że zwierzęta te dostosowują go do lokalnych uwarunkowań (Czech 2010).
Swoimi działaniami bobry znacząco wpływają na funkcjonowanie ekosystemów wodnych i przylegających do
nich ekosystemów lądowych. Wznosząc tamy na ciekach,
podnoszą poziom wody, zwiększając tym samym bioróżnorodność środowiska poprzez tworzenie małej retencji
i zwiększenie powierzchni mokradeł. W ten sposób są odtwarzane naturalne zespoły roślinne charakterystyczne
dla dolin rzek, wzrasta liczebność wielu gatunków flory
i fauny2. Dodatkowo podniesienie poziomu wód gruntowych na większych obszarach, zapobiega przesuszaniu
i oddziałuje korzystnie na produkcję rolniczą i leśną,
a okresowe rozlewiska wywierają pozytywny wpływ na
strukturę i żyzność gleb. Kopanie nor i kanałów, transportowanie drewna z lądów oraz piętrzenie wody znacząco
zmienia charakter i kształt linii brzegowej cieków lub
zbiorników inicjując procesy ich renaturalizacji (Czech
2007; Janiszewski, Misiukiewicz 2012).
Z ekologicznego punktu widzenia, obecność i efekty aktywności bobrów mają znaczenie zdecydowanie pozytywne, zwłaszcza na terenach chronionych. Niestety w odniesieniu do gospodarki prowadzonej przez człowieka ich
działalność przynosi wiele szkód, polegających na zalewaniu terenów leśnych i użytkowanych rolniczo, ścinaniu
i ogryzaniu drzew w lasach i sadach owocowych, niszczeniu obwałowań stawów rybnych, nasypów drogowych i kolejowych. Dlatego, zwłaszcza w północno-wschodniej Polsce, gdzie populacja tego gryzonia, jak i wypłacane odszkodowania, są największe (GDOŚ 2013), coraz trudniej jest
pogodzić konieczność ochrony gatunku z potrzebami lokalnych społeczności. Aktualną sytuację chyba najlepiej
podsumowują poniższe słowa: Czy znacie leśnego bobra, /
Znanego drwala nad drwale? / Lubili go dawniej wszyscy, /
Teraz nieomal wcale (Motyla 2006).
Literatura
Czech A. 2007. Krajowy plan ochrony gatunku. Bóbr europejski
(Castor fiber). Kraków.
Czech A. 2010. Bóbr – budowniczy i inżynier. Fundacja Wspierania Inicjatyw Ekologicznych, Kraków.
Dzięciołowski R. 1996. Bóbr. Wyd. Łowiec Polski, Warszawa.
Dzięciołowski R. 2004. Castor fiber (L., 1758). [W:] Adamski P.,
Bartel L., Bereszyński A., Kepel A., Witkowski Z. (red.),
­Gatunki zwierząt (z wyjątkiem ptaków), Poradniki ochrony
2
218
W specyficznych warunkach, zwłaszcza w dolinach mniejszych rzek, bobry mogą jednak powodować zalewanie siedlisk cennych z przyrodniczego punktu widzenia i coraz
rzadziej spotykanych, zależnych od wód rzecznych, opadowych, roztopowych lub podziemnych, ale nie tolerujących
stagnowania wody, tj. mechowiska, bogate gatunkowo łąki
wilgotne, łęgi jesionowo-olchowe i in. (przyp. red.).
siedlisk i gatunków Natura 2000 – podręcznik metodyczny.
Tom 6. 457−462. Ministerstwo Środowiska, Warszawa.
GDOŚ 2013. Krajowa strategia gospodarowania populacją bobra
europejskiego Castor fiber. Generalna Dyrekcja Ochrony Środowiska, Warszawa.
Gloger Z. 1900. Encyklopedia staropolska ilustrowana. Tom I.
Druk P. Laskauera i W. Babickiego, Warszawa.
Janiszewski P., Misiukiewicz W. 2012. Bóbr europejski. Castor
fiber. Katedra Hodowli Zwierząt Futerkowych i Łowiectwa,
Uniwersytet Warmińsko–Mazurski w Olsztynie. Wyd. BTL
Works, Olsztyn.
Janota E., Anczyc W. L. 1876. Obrazki z życia zwierząt: bóbr
i żubr. Wyd. „Czytelni Ludowej” A. Nowoleckiego, Kraków.
Kuczynko R. 2003. Populacja bobra w Narwiańskim Parku Narodowym – wybrane zagadnienia ekologiczne. Praca magisterska wykonana w Zakładzie Zoologii Kręgowców Instytutu
Biologii Uniwersytetu w Białymstoku, Białystok (mscr.).
Lewartowski Z. 1992. Inwentaryzacja stanowisk bobra europejskiego (Castor fiber) w Narwiańskim Parku Krajobrazowym
wraz z opracowaniem zasad ich ochrony. Centrum Badań
i Ochrony Ptaków w Białowieży, Białowieża (mscr.).
Łupiński S. Ł., Raczyński J., Chętnicki W. 2013. Operat fauny.
Herpetofauna i teriofauna w części obejmującej płazy, gady,
drobne ssaki, wybrane gatunki chronione – bobra, wydrę,
wilka i ssaki kopytne. Plan ochrony Narwiańskiego Parku
Narodowego. Białystok (mscr.).
Motyla J. 2006. Przyjaciele Pana Karpia. Wyd. GRAFFITI BC,
Toruń.
Polak R. 2004. Funkcjonowanie stanowisk i baza pokarmowa
bobra europejskiego Castor fiber w Narwiańskim Parku Narodowym. Praca magisterska wykonana w Zakładzie Zoologii
Kręgowców Instytutu Biologii Uniwersytetu w Białymstoku,
Białystok (mscr.).
Żurowski W. 1982. Rozmieszczenie i ekologia bobra europejskiego Castor fiber w pradolinie Biebrzy. Chrońmy Przyr.
Ojcz. 1–2: 18–26.
11.3 Norka amerykańska –
gatunek inwazyjny
Jan Raczyński
Norka amerykańska Neovison vison (Ryc. 11.18), wcześniej znana, zgodnie z ówczesną nomenklaturą zoologiczną, pod nazwą łacińską Mustela vison, jest w Europie gatunkiem inwazyjnym. Pierwotny zasięg tego gatunku obejmował większość kontynentu Ameryki Północnej, bez jego
północnych rubieży. Do Europy trafiła jako zwierzę futerkowe hodowane w fermach, początkowo w Niemczech,
potem w innych krajach Europy Zachodniej, skąd, w następstwie ucieczek, wniknęła do środowiska naturalnego,
rozpoczynając w latach 20. XX w. kolonizację odpowiadających jej ekosystemów. Początkowo rozprzestrzeniła się
w Skandynawii, którą opanowała w latach 90. ubiegłego
wieku. Równocześnie skolonizowała kraje zachodniej Europy oraz rozprzestrzeniła się na terytorium byłego ZSRR
(Rosja, Białoruś, Ukraina), gdzie dodatkowo, od lat 30.
ubiegłego wieku została wprowadzona bezpośrednio do
środowiska w ramach programu aklimatyzacji gatunków
użytkowych. Program tych działań w byłym ZSRR objął,
oprócz europejskiej części, rozległe obszary azjatyckie, aż
do wschodnich stref kontynentu, tworząc wszędzie zwarty
obszar zasiedlenia tego gatunku (Geptner, Naumov 1967).
W Polsce pierwsze informacje o pozyskaniu osobników
norki amerykańskiej pochodzą z połowy lat 50. ubiegłego
wieku i odnoszą sie do zachodniej części kraju (Ruprecht
i in. 1983; Ruprecht 1996). W Puszczy Białowieskiej gatunek ten pojawił się na początku lat 80. XX w., zapewne
wskutek ekspansji z Białorusi (Ruprecht i in. 1983).
W późniejszym okresie, w wyniku rozwoju hodowli klatkowej i ucieczek osobników hodowanych, w latach 80. XX
w. nastąpił gwałtowny rozwój dziko żyjących populacji
w Polsce zachodniej, a następnie na wschodzie kraju. Ten
ostatni obszar zasiedlały prawdopodobnie osobniki migrujące przez wschodnią granicę, głównie z obszaru Białorusi i Litwy. Współcześnie proces inwazji norki amerykańskiej trwa nadal wskutek zasilania przez osobniki hodowlane, zwłaszcza na zachodzie Polski, gdzie koncentruje się
większość ferm komercyjnych (Zalewski i in. 2014).
Obecnie norka amerykańska opanowała przeważający obszar kraju (z wyjątkiem niektórych rejonów południowej
Polski), zaś skutkiem jej obecności są m.in. przekształcenia
zespołu fauny gatunków nadwodnych w następstwie jej
drapieżnictwa. Do ofiar tego zwierzęcia należą gryzonie
żyjące w środowiskach nadwodnych i podmokłych, niektóre gatunki ptaków wodno-błotnych oraz płazy, ryby i bezkręgowce (skorupiaki, owady).
Norka amerykańska i gatunki
pokrewne
Przed pojawieniem się norki amerykańskiej teren Polski
zasiedlała norka europejska Mustela lutreola, która została
wytępiona wiele dziesiątków lat temu. Według Buchalczyka (1984) gatunek ten odnotowany był na początku XX w.
W Puszczy Białowieskiej, Świętajnie w okolicach Elbląga
(lata 20. ubiegłego wieku) oraz w Czerwonym Dworze.
Współcześnie zwierzę to nie występuje w faunie Polski.
Najbliższym geograficznie rejonem występowania norki
europejskiej jest terytorium Białorusi, jednak nawet tam
obserwuje się systematyczne kurczenie zasięgu tego rodzimego gatunku (Sidorovič 1992). Według tego autora proces cofania się norki europejskiej doprowadził do tego, że
zniknęła ona z obszaru obejmującego blisko połowę powierzchni Republiki Białorusi już w latach 60. ubiegłego
wieku. Na początku lat 90. jej zasięg ograniczył się do nielicznych, izolowanych stanowisk. Przyczyn tego zjawiska
badacze upatrują w wypieraniu rodzimego gatunku przez
amerykańskiego krewniaka, charakteryzującego się większym potencjałem rozrodczym, większą masą ciała oraz
możliwością krycia samic norki europejskiej przez samce
norki amerykańskiej. Kontakty te nie prowadzą prawdopodobnie do efektywnego rozrodu wskutek zahamowania
rozwoju płodów, ze względu na różnice w liczbie chromosomów. Sidorovič (1992) nie przecenia wpływu czynnika
rozrodczego w procesie wypierania słabszego gatunku,
zwracając uwagę na udokumentowane kurczenie się areału
norki europejskiej na Białorusi także w rejonach, gdzie
konkurencyjny gatunek jeszcze nie dotarł. Wypieranie
norki europejskiej przez przybysza uważa jednak za fakt,
manifestujący się stopniowym zasiedlaniem areału norki
europejskiej przez nowy gatunek. Intensywne zmniejszanie się areału rodzimego gatunku obserwuje się także
w Rosji już od połowy lat 50. XX w., gdzie kojarzone jest to
z pojawieniem się norki amerykańskiej w następstwie introdukcji oraz migracji uciekinierów z ferm futrzarskich
(Tumanov 1992). Pod koniec XX w. największe zagęszczenia populacji norki europejskiej stwierdzono w centralnej
Rosji, gdzie bytuje połowa krajowych zasobów tego gatunku, zaś jej status oceniany jest jako silnie zagrożony gwałtownym spadkiem liczebności (Tumanov 1992).
219
Ryc. 11.18 Norka amerykańska Neovison vison jest gatunkiem obcym w naszej faunie
(fot. K. Zub)
a)
b)
Ryc. 11.19 Różnice w ubarwieniu głowy – układ białej plamy na
pysku oraz w cechach czaszki (jedno- i dwukorzeniowość PM1
w górnej szczęce): a) norka amerykańska, b) norka europejska
(wg Sidorovič 1992)
220
Obydwa omawiane gatunki mają bardzo podobny wygląd. Różnice morfologiczne w pokroju i ubarwieniu głowy
oraz w strukturze cech czaszki (uzębienia) pomiędzy norką
europejską i amerykańską obrazuje Ryc. 11.19.
Drugim gatunkiem pokrewnym norce jest tchórz zwyczajny Mustela putorius, który ze względu na zbliżoną bazę
pokarmową i częściowo wspólne środowisko bytowania
jest prawdopodobnie również zagrożony przez przybysza.
Biologia i ekologia norki
amerykańskiej
Pokarm norki amerykańskiej jest przedmiotem analiz
wielu badaczy (m.in. Zalewski, Brzeziński 2014), ponieważ umożliwia ocenę znaczenia tego drapieżnika dla populacji zwierząt współżyjących z nim w ekosystemach preferowanych przez ten inwazyjny gatunek. Baza pokarmowa norki amerykańskiej wykazuje znaczne różnice
w zależności od środowiska bytowania drapieżnika. W obrębie całego nowego areału występowania (Eurazja) najczęstszymi ofiarami norki są ryby (32%) i drobne ssaki
(25%), podczas gdy ptaki, płazy i skorupiaki nie są dominującym składnikiem w jej pokarmie. W środowiskach wód
śródlądowych pokarm norki jest silnie zróżnicowany,
­stosownie do rodzaju cieku lub zbiornika i dostępności potencjalnych ofiar. Polskie badania, prowadzone zarówno
w zachodniej (Park Narodowy „Ujście Warty”), jak
i wschodniej części kraju (Pojezierze Mazurskie, Puszcza
Białowieska) pokazały, jak dużym spektrum pokarmowym
charakteryzuje się ten gatunek. Najwyższy udział ryb i płazów zarejestrowano na Pojezierzu Mazurskim. Udział płazów w pokarmie wzrastał w miarę zmniejszania się wielko-
ści cieku, czemu towarzyszył ograniczony dostęp do rybostanu. W krajobrazie rolniczym ważnym składnikiem
pokarmu stają się małe gryzonie (norniki).
Aktywność norki zależy od kilku czynników, między
innymi od pory roku, i z reguły maleje jesienią i zimą.
­A ktywność samców wzrasta na przedwiośniu, w porze rui,
zaś samic – wiosną i latem, w porze karmienia młodych.
W układzie dobowym, na Pojezierzu Mazurskim norki
były aktywne bardziej w dzień, niż w nocy, preferowały
jednak okres świtu i zmierzchu (Brzeziński i in. 2010).
Aktywność dobowa norek wykazuje jednak dużą zmienność, prawdopodobnie zwierzęta dostosowują ją do okresu
aktywności swoich ofiar.
Ruja u norki amerykańskiej, w warunkach europejskich, trwa od lutego do połowy kwietnia, po czym następuje okres ciąży, zmienny w zależności od daty kopulacji.
Podobnie, jak u niektórych innych łasicowatych, w przypadku norek mamy do czynienia z ciążą przedłużoną, będącą osobliwością niektórych ssaków. Polega ona na zahamowaniu rozwoju zarodka w stadium blastocysty, przed
implantacją w macicy. Powoduje to, że czas trwania ciąży,
od kopulacji do urodzenia, trwa u norki od 45 do 78 dni.
Ten typ rozrodu zwiększa szanse przeżycia młodych,
umożliwiając wykoty w okresie sprzyjającym ze względu
na dostępność pokarmu i kondycję samicy. Na Białorusi
okres wykotów trwa od końca kwietnia do czerwca (Sidorovich 1993).
Średnia liczba młodych w miocie jest zmienna i waha się
w zakresie od 2 do 17, zwykle od 4 do 8; średnio 7.
Liczebność żywych urodzeń jest zależna od warunków
pokarmowych i zagęszczenia populacji norki (Sidorovich
1993). Młode rodzą się ślepe i bezzębne i są karmione przez
matkę do około 32 dnia życia, kiedy stopniowo zaczynają
przechodzić na pokarm stały, przynoszony do gniazda
przez matkę. Dojrzałość płciową osiągają pod koniec
pierwszego roku życia i wówczas z reguły przystępują do
rozrodu.
Wybiórczość środowiskowa jest istotnym czynnikiem
w procesie inwazji i zasiedlania nowych ekosystemów
przez norkę amerykańską. Preferowanym środowiskiem
bytowania tego gatunku są tereny przywodne. Badania telemetryczne wykazały, że osiadłe norki nie oddalają się od
brzegów rzek dalej niż na 400 m. W polskich badaniach na
Pojezierzu Mazurskim stwierdzono, że drapieżniki te nie
oddalały się od brzegów jezior dalej, niż na 50 m (Brzeziński i in. 2010). Jako kryjówki norki wykorzystują nory
w ziemi, szczeliny między konarami nadwodnych drzew,
wykroty, ale także nisko położone dziuple i górne partie
żeremi bobrów. Jeśli chodzi o strukturę partii brzegowych
norki amerykańskie preferują tereny gęsto zarośnięte, zarówno drzewami, jak i wysokimi trawami, unikają natomiast rozległych trzcinowisk. Zwierzęta te dużą część
swego aktywnego życia spędzają w wodzie, przemieszczając się nieraz na duże odległości w poszukiwaniu zdobyczy.
Widok norki pływającej na powierzchni wody nie należy
zatem do rzadkości. Podczas polowania chętnie nurkują,
spędzając pod wodą do 30 sekund.
Norka amerykańska żyje w zasadzie samotnie. Zagęszczenia osobników na rzekach Białorusi i Polski wahały
się w zakresie od 2 do 12 osobników na 10 km linii brzegowej, przy czym wyższe były w większych rzekach, niż
w małych ciekach śródleśnych. Na ogół w zbiornikach
słodkowodnych zagęszczenie populacji norki amerykańskiej nie przekracza 10 osobników. Szczegółowe badania
pokazują, że może ono zależeć od takich czynników, jak
obecność żeremi bobrów lub obfitość istotnych gatunków
żerowych, co wpływa na wzrost zagęszczenia populacji.
Wpływ norki amerykańskiej
na populacje ofiar
Pojawienie się norki amerykańskiej jako nowego gatunku w zespołach fauny lokalnej w krótkim czasie prowadziło do zmian tych zespołów wskutek drapieżnictwa w stosunku do określonych gatunków. Zjawisko to stało się
szczególnie widoczne w odniesieniu do ssaków i ptaków
związanych ze środowiskiem wodnym i brzegowym, których utrwalone zespoły zostały naruszone. W warunkach
polskich zaczęły pojawiać się sygnały o drastycznym spadku liczebności takich pospolitych gatunków, jak piżmak
oraz karczownik ziemnowodny, zaś spośród ptaków –
łyski. Źródeł tych zmian zaczęto doszukiwać się w składzie
pokarmu norki w nowo opanowywanych przez nią środowiskach oraz w naruszeniu utrwalonych ewolucyjnie przystosowań w układach drapieżników i ich ofiar na terenach
długotrwałego ich współwystępowania (por. Zalewski,
Brzeziński 2014).
Załamanie populacji piżmaka zostało szybko odnotowane w statystyce łowieckiego pozyskania tego gatunku
w skali Polski, oprócz regionu południowego, gdzie zjawisko to nie wystąpiło. Piżmak, gatunek północnoamerykański, został sprowadzony do Europy na początku XX wieku
i szeroko się rozprzestrzenił na nowym kontynencie.
W Polsce stał się pospolitym zwierzęciem już w latach 50.
ubiegłego wieku (Nowak 1966). Na obszarze naturalnego
współwystępowania obu gatunków, w Ameryce Północnej,
norka żywi się piżmakiem, nie doprowadzając jednak do
spadku liczebności jego populacji. Taki zrównoważony dla
obu gatunków układ nie występuje w Europie, przynajmniej w fazie inwazji nowego drapieżnika. Wraz ze wzrostem liczebności norki w ciągu dwudziestu lat nastąpił
w Polsce 15-krotny spadek pozyskania piżmaków, który
najsilniej zaznaczył się w północnej części kraju (Brzeziński i in. 2010).
Oddziaływanie norki amerykańskiej na populacje karczownika ziemnowodnego Arvicola terrestris wynika również ze wspólnego środowiska bytowania. Opisano przypadki, gdy norka wytępiła karczownika całkowicie na obszarze swojego areału, chwytając osobniki tego gatunku
zarówno w wodzie, jak i w norach, częściej penetrowanych
przez samice drapieżnika. Refugiami dla karczownika
mogą pozostawać tereny położone poza aktywnością żerową norek – na śródpolnych mokradłach i oczkach wodnych
– jednak te elementy krajobrazu zanikają wskutek presji
rolnictwa, a ponadto sprzyjają izolacji lokalnych populacji
tego gryzonia. Wpływ norki amerykańskiej dotyczy także
innych gatunków gryzoni, np. nornika burego Microtus
agrestis na północy Europy lub nornika północnego Microtus oeconomus w Polsce. Jednak obydwa gatunki reprezentują zwierzęta masowo występujące i charakteryzujące się
221
dużą dynamiką populacji, dlatego oddziaływania drapieżnika nie zagrażają ich egzystencji.
Badania ornitologów dokumentują liczne przykłady
wpływu norki amerykańskiej na różne gatunki ptaków
wodnych i błotnych, na które drapieżnik ten oddziałuje
zjadając jaja i pisklęta, ale także polując na osobniki dorosłe. W Parku Narodowym „Ujście Warty” ofiarą norki
amerykańskiej padały najczęściej łyski, perkozy i kaczki,
proporcjonalnie do liczebności tych gatunków w terenie
(Bartoszewicz, Zalewski 2003). Z innych obszarów Europy, zwłaszcza z wybrzeży morskich, istnieją doniesienia
o bardzo silnym oddziaływaniu norki na populacje ptaków
gnieżdżących się na ziemi, prowadzącym nieraz do zniszczenia całych kolonii (rybitwy, mewy). Badania porównawcze wykazały, że najsilniejszy wpływ norki na ptaki
wodno-błotne dokonuje się w początkowym okresie inwazji drapieżnika. Po latach ptaki wypracowują nowe strategie ochronne poprzez zmianę miejsc lęgowych lub tworzenie licznych kolonii, zwiększających sukces lęgowy lokalnych populacji. W warunkach polskich nie dotyczy to na
razie łyski, której drastyczny spadek należy przypisać inwazji norki, np. na Pojezierzu Mazurskim.
Spośród innych gatunków, wchodzących w skład zdobyczy norki amerykańskiej, brak jest dowodów na istnienie
silnej presji na populację płazów i ryb. W stosunku do
raków presja norki kumuluje się z drapieżnictwem wydry,
jednak, jak się wydaje, populacje tych bezkręgowców
kształtowane są przez inne czynniki (stan środowiska
wodnego oraz drapieżnictwo ryb).
Konkurencja z innymi gatunkami
Do gatunków, które mogą wchodzić w interakcje z norką
amerykańską należą tchórz i wydra. Interakcje norki amerykańskiej z tchórzem zwyczajnym mogą wynikać ze
znacznego podobieństwa niszy ekologicznej obydwu gatunków. Jednak tchórz okresowo poszerza swój areał o biotopy bardziej oddalone od nurtu rzek, m.in. penetruje zespoły leśne i środowiska przydomowe. Obecnie brak jest
badań wskazujących na wyraźne oddziaływanie norki na
populacje tchórzy w rejonach wspólnego występowania
obydwu gatunków (Zalewski, Brzeziński 2014).
Dane z Wielkiej Brytanii dowodzą, że norka unika
miejsc zasiedlonych przez wydry oraz, że obecność wydry
wpływa na skład pokarmu norki poprzez przesunięcie jej
terenu polowań na strefę brzegową (Bonesi, MacDonald
2004). Polskie badania dotychczas nie potwierdzają konkurencyjnych układów między norką amerykańską
a wydrą. Należy jednak wspomnieć, że inwazja norki zbiegła się w czasie z odbudową pogłowia wydry, co nie pozwala na wyciąganie jednoznacznych wniosków.
Próby ograniczania liczebności
norki amerykańskiej
Opisane wyżej negatywne oddziaływania norki amerykańskiej, zwłaszcza w fazie inwazji i opanowywania nowych terytoriów, skłaniają zarządców terenów chronio222
nych oraz gospodarzy obiektów rybackich czy obwodów
łowieckich do podejmowania działań mających na celu
zminimalizowanie wpływu tego drapieżnika na faunę
chronioną i na gatunki użytkowe. Czynności w tym zakresie polegają na ocenie i monitorowaniu liczebności drapieżnika oraz wdrażaniu działań mających na celu eliminację norek na chronionym terenie. Wstępne doświadczenia w tej dziedzinie nie gwarantują sukcesu, ale otwierają
pole do dalszych poszukiwań bardziej skutecznych metod.
Inwentaryzację norki amerykańskiej najprościej prowadzi się metodą liczenia śladów w strefie brzegowej rzek
i zbiorników wodnych, licząc zagęszczenie tropów na 10 km
odcinka taksacji. Bardziej dokładną metodą jest zastosowanie pływających tratew, zgodnie z techniką wypracowaną w Wielkiej Brytanii (Reynolds i in. 2004). Na tratwach
znajduje się specjalnie przygotowane podłoże (w części zadaszonej), na którym odbijają się ślady odwiedzających
osobników. Podłoże może być wielokrotnie używane do
rejestracji kolejnych odwiedzin przez norki. Metodę tę stosowano także w Polsce, m. in. na Narwi w granicach Narwiańskiego Parku Narodowego, podczas realizacji programu redukcji populacji tego drapieżnika. Pozwala ona skutecznie kontrolować względną liczebność zwierząt
niezależnie od charakteru brzegu, także na odcinkach zarośniętych gęstą roślinnością oraz identyfikować płeć
osobników, dzięki dokładnej rejestracji śladu. Dokładna
metoda oceny liczebności polega na wielokrotnym odłowie
znakowanych osobników (tzw. metoda CMR) i ma zastosowanie głównie w pracach badawczych. Do stwierdzenia
obecności norki i innych drapieżników strefy przywodnej
coraz częściej stosuje się kamery rejestrujące (foto-pułapki).
Odłów i eliminacja pozyskanych zwierząt stanowią
obecnie najbardziej efektywną metodę ograniczania liczeb­
ności norki amerykańskiej. Stosowanie pułapek zabijających nie wchodzi w grę w świetle prawa. Jest to oczywiste,
ponieważ przy małej selektywności pułapki mogłaby ona
stanowić zagrożenie dla gatunków chronionych. Odstrzał
myśliwski w przypadku norki amerykańskiej, nawet z użyciem specjalnie ułożonych psów, jest mało efektywną metodą eliminacji tego drapieżnika.
W latach 2009–2013 w kilku wybranych polskich parkach narodowych prowadzono program (LIFE+ Nature &
Biodiversity) mający na celu m.in. eliminację norki amerykańskiej i badanie wpływu tego zabiegu na rekolonizację
obszaru objętego eksperymentem (Niemczynowicz i in.
2014). Na terenie Narwiańskiego Parku Narodowego stwier­
dzono najwyższe zagęszczenie populacji norki – 11,4/10
km brzegu (badania prowadzono z użyciem tratw). Podczas odłowów wszędzie stwierdzono wyższy wyłów samców niż samic oraz ustalono podstawowe parametry struktury populacji, przeżywalność młodych (nad Narwią ok.
30%) oraz określono maksymalny wiek zwierząt (5 lat).
Wyeliminowanie 106 norek z badanego odcinka Narwi
spowodowało spadek populacji o ponad połowę. W innych
obszarach (np. w Drawieńskim Parku Narodowym) eliminacja była jeszcze bardziej efektywna. Przy wyłowie wiosną
i jesienią po dwóch latach odłowów monitoring wykazał
spadek odwiedzin tratw z 10,5% do 1%. Wyniki krajowych
badań pokazały, że ograniczanie liczebności norki przynosi lepsze rezultaty, jeśli odłowy prowadzi się na dłuższym
odcinku rzeki lub jeziora (20–40 km) oraz jesienią, co po-
zwala eliminować młode z tegorocznych urodzeń. Na terenie zachodniej Polski, gdzie znajduje się wiele farm hodowlanych, rekolonizacja wskutek napływu uciekinierów może
jednak zniweczyć efekty wyłowu.
Możliwości eliminacji norki
amerykańskiej z terenów
objętych inwazją
Oceny zagadnienia pełnej eliminacji norki amerykańskiej muszą uwzględniać fakt, iż gatunek ten w Europie ma
stosunkowo długą historię rozprzestrzeniania się. Ekspansji sprzyjał z jednej strony rozwój hodowli klatkowej w celach komercyjnych, z drugiej zaś tkwiące w biologii gatunku możliwości adaptacyjne do życia w klimacie umiarkowanym i niewielka specjalizacja pokarmowa. Równocześnie
na wielu obszarach Europy norka amerykańska nie napotkała silnej konkurencji ze strony pobratymców oraz nie
natrafiła na aktywnego wroga naturalnego. Równocześnie
jednak wszędzie, gdzie się pojawiła, stała się istotnym
czynnikiem zagrażającym miejscowym elementom fauny.
Faza aktywnej inwazji niesie ze sobą większą ingerencję
tego gatunku w faunę zasiedlanych ekosystemów, niż okres
stabilizacji, kiedy mogą dojść do głosu czynniki regulacyjne, np. choroby (choroba aleucka, nosówka).
Na terenach o rozwiniętej hodowli fermowej zwalczanie
tego gatunku w przyrodzie nie gwarantuje pełnego sukcesu w jego eliminacji. Na obszarach chronionych redukcja
liczebności norki amerykańskiej wiąże się, jak dotychczas,
z programami efektywnego wyłowu połączonego z usuwaniem schwytanych osobników oraz monitoringu, co wymaga sporych nakładów finansowych i fachowego personelu. W gospodarce łowieckiej nie należy spodziewać się
sukcesów przy zwalczaniu jej metodą odstrzałów, ponieważ spotkanie norki w terenie ma raczej charakter przypadkowy. Gwarancją sukcesu jest dostosowanie wyłowu
do specyfiki lokalnego zasiedlenia oraz znajomość biologii
i ekologii miejscowej populacji. Biorąc pod uwagę te ograniczenia, norka amerykańska pozostanie na długo mieszkańcem pobrzeży naszych rzek, cieków oraz zbiorników
wodnych, zaś ograniczanie jej szkodliwej roli będzie zapewne możliwe jedynie na terenach chronionych.
Buchalczyk T. 1984. Norka europejska – **Mustela lutreola
(Linnaeus, 1761). [W:] Z. Pucek. (red.), Klucz do oznaczania
ssaków Polski. 297−299. Wyd. PWN, Warszawa.
Geptner V. G., Naumov N. P. 1967. Mammals of the Soviet Union:
Sirenia and Carnivores. Izdatelstvo Vysshaja Skola, Moscov.
Niemczynowicz A., Brzeziński M., Zalewski A. 2014. Wpływ
intensywności usuwania norki amerykańskiej (Neovison
vison) na strukturę jej populacji w czterech parkach narodowych. [W:] Ulbrych Ł., Jankow W., Zalewski A., Wypychowski
K. (red.), Ekologia i wpływ na środowisko gatunków inwazyjnych. 139−151. Park Narodowy „Ujście Warty”, Chyrzyno.
Nowak E. 1966. Rozprzestrzenienie się, liczebność i znaczenie
piżmaka Ondatra zibethica (L., 1766) w Polsce. Przegląd Zool.
10: 221−237.
Reynolds J. C., Short M. J., Leight R. J. 2004. Development of
population control strategies for mink Mustela vison, using
floating rafts as monitors and trap sites. Biol. Conservancy
120: 533−543.
Ruprecht A. L. 1996. Materiały do rozmieszczenia przedstawicieli podrodzaju Lutreola Wagner, 1841 (Carnivora, Mustelidae) w Polsce. Przegląd Zool. 40: 223−233.
Ruprecht A. L., Buchalczyk T., Wójcik J. 1983. Występowanie norek (Mammalia: Mustelidae) w Polsce. Przegląd Zool.
27: 87−99.
Sidorovič V. E. 1992. Gegenwärtige Situation des Europäischen
Nerzes (Mustela lutreola) in Belorußland. Hypothese seines
Verschwindens. [W:] R. Schröpfer, M. Stubbe, D. Heidecke
(red.) Semiaquatische Säugetiere. Wiss. Beiträge. Halle/Saale.
Sidorovich V. E. 1993. Reproductive plasticity of the American
mink Mustela vison in Belarus. Acta Theriol. 38: 175−183.
Tumanov I. L. 1992. The number of European mink (Mustela
lutreola L.) in the eastern area and its relation to American
mink. [W:] R. Schröpfer, M. Stubbe, D. Heidecke (red.), Semiaquatische Säugetiere. 329−335. Wiss. Beiträge. Halle/Saale.
Zalewski A., Brzeziński M. 2014. Norka amerykańska. Biologia gatunku inwazyjnego. Instytut Biologii Ssaków PAN, Białowieża.
Zalewski A., Brzeziński M., Kozakiewicz M., Bartoszewicz
M., Ratkiewicz M., Zalewska H. 2014. Zmienność genetyczna norki amerykańskiej w zasięgu jej introdukcji. [W:]
Ulbrych Ł., Jankow W., Zalewski A., Wypychowski K. (red.),
Ekologia i wpływ na środowisko gatunków inwazyjnych. 73–
89. Park Narodowy „Ujście Warty”, Chyrzyno.
Literatura
Bartoszewicz M., Zalewski A. 2003. American mink, Mustela
vison diet and predation on waterfowl in the Słońsk Reserve,
western Poland. Folia Zool. 52: 225−238.
Bonesi L., MacDonald D. W. 2004. Differential habitat use promotes sustainable coexistence between the specialist otter and
the generalist mink. Oikos 105: 509−519.
Brzeziński M., Romanowski J., Żmihorski M., Karpowicz K.
2010. Muskrat (Ondatra zibethicus) decline after the expansion of American mink (Neovison vison) in Poland. Eur. J.
Wildlife Res. 56: 341−348.
223
Nietoperze Narwiańskiego
Nietoperze, mimo, że żyją tak blisko człowieka, nie cieszą
się szczególną sympatią. Ich dosyć niesamowity wygląd
i nocny tryb życia w wielu ludziach budzą obrzydzenie lub
strach, a związane z nimi przesądy wydają się być trwale
wpisane w świadomość społeczną. Są to jednak zwierzęta
pełniące ogromnie ważną rolę w środowisku, zagrożone
przez malejącą liczbę dogodnych schronień oraz chemizację
i wymagające ochrony.
Fauna nietoperzy Narwiańskiego Parku Narodowego
dotąd nie była objęta systematycznymi badaniami. Jako
pierwsi dane na temat występowania i liczebności chiropterofauny zgromadzili Grzegorz Lesiński i Marek Kowalski
(2002) w latach dziewięćdziesiątych XX w., którzy podczas
penetracji kilku schronień zimowych tych zwierząt, położonych na obrzeżach Parku, stwierdzili występowanie dwóch
gatunków, nocka rudego Myotis daubentonii oraz gacka brunatnego Plecotus auritus. Wskazówki dotyczące potencjalnych miejsc występowania tej grupy ssaków w Narwiańskim Parku Narodowym i jego okolicach przekazywał także
Mikołaj Pruszyński. Kolejne badania prowadzone od zimy
2006/2007 do chwili obecnej potwierdziły poprzednie doniesienia, a także zaowocowały nowymi danymi i wskazaniami co do ochrony tych zwierząt. Dotychczas przyniosły
one informacje o występowaniu czterech gatunków nietoperzy na tym obszarze (spośród 14 notowanych w regionie północno-wschodnim i 26 występujących ogółem
w Polsce).
Nietoperze zasiedlają różnorodne obszary i raczej nie
wyróżnia się gatunków przywiązanych w ciągu całego roku
do jednego rodzaju środowiska. Dla wielu gatunków bardzo
istotne są zbiorniki wodne jako miejsca żerowania (np. dla
nocka łydkowłosego Myotis dasycneme) oraz tereny leśne,
jako miejsca rozrodu i żerowania
W Narwiańskim Parku Narodowym nie brakuje otwartych przestrzeni wodnych, ale lasów jest niewiele i być może
dlatego do tej pory nie stwierdzono tu wielu gatunków nietoperzy możliwych do odnalezienia w tej części Polski.
Obecność zadrzewień nie jest jednak czynnikiem, który
mógłby determinować występowanie tych ssaków, tym
bardziej, że nietoperze mogą korzystać z różnych środowisk
w ciągu całego roku. Biorąc ponadto pod uwagę skłonności
synantropijne tych zwierząt, nie można obszaru Parku jednoznacznie określić jako nieistotnego dla ich występowania.
Narwiański Park Narodowy i jego otulina mogą jeszcze
skrywać jeszcze wiele niespodzianek w tym zakresie.
224
Badania nietoperzy na terenie Parku Narodowego i w jego
pobliżu polegały m.in. na:
• kontrolach schronień zimowych – głównie niewielkich
piwnic przydomowych, studni i innych obiektów odpowiednich dla zimujących nietoperzy,
• kontrolach potencjalnych schronień letnich – przede
wszystkim strychów domów mieszkalnych i innych ich
części oraz pozostałych zabudowań, jak i dziupli w starych drzewach,
• nasłuchach detektorowych i analizie nagrań, z wykorzystaniem urządzeń rejestrujących sygnały echolokacyjne,
• obserwacjach terenowych – najczęściej w miejscach
koncentracji nietoperzy, w tym badania przy użyciu endoskopu,
• odłowach w sieci – zwykle na obszarach zalesionych,
w pobliżu wód lub nad wodami.
Gacek brunatny – najliczniejszy gatunek nietoperza
w badaniach zimowych na terenie NPN (fot. G. Błachowski)
W Narwiańskim Parku Narodowym stwierdzono dwa gatunki zimujących nietoperzy: nocka rudego Myotis daubentonii oraz gacka brunatnego Plecotus auritus, które występowały w kilku stanowiskach m.in. w Rzędzianach, Kurowie,
Parku Narodowego
nym obszarze nie prowadzi się ciągłych działań edukacyjnych związanych z tymi zwierzętami.
Grzegorz Błachowski
Literatura
Lesiński G., Kowalski M. 2002. Zimowy monitoring nietoperzy
w Dolinie Narwi i Biebrzy w latach 1992–1999. Nietoperze 3(1):
53–60.
Typowa piwnica we wsi nadnarwiańskiej, w której mogą zimować
nietoperze (fot. G. Błachowski)
Wólce Waniewskiej i Jeńkach (znajdowano niekiedy nawet
do kilkunastu osobników w jednej piwnicy). Większą część
zimy 2010/2011 spędził w piwnicy pod siedzibą Parku
w Kurowie mroczek późny Eptesicus serotinus. Był to osobnik przywieziony z Białegostoku, po uratowaniu go z niebezpiecznej sytuacji. Nie odnaleziono do tej pory dużych
kolonii w schronieniach letnich – liczebność największej
z nich w sięga prawdopodobnie kilkudziesięciu osobników,
zaliczanych do trzech gatunków, którymi były gacek brunatny Plecotus auritus, mroczek późny Eptesicus serotinus
i borowiec wielki Nyctalus noctula. W niektórych przypadkach nie udało się dokładnie oznaczyć gatunku – przestrzenie zajmowane przez nietoperze są często mało dostępne
dla ludzi i nie ma tam możliwości precyzyjnego oznaczania,
tym bardziej, że przy badaniach należy zachować szczególne środki ostrożności, aby nie przeszkadzać zwierzętom.
Cieszy coraz większe zainteresowanie nietoperzami ze
strony mieszkańców regionu oraz przychylność i pomoc
w czasie prowadzenia badań. Zdecydowana większość osób
chce sprzyjać ochronie nietoperzy, a w wielu miejscowościach (np. Borowskie-Żaki, Jeńki, Kurowo, Wólka Waniewska) właściciele posesji zapraszają na kolejne badania i oczekują informacji o tym, jak się miewają „ich nietoperze”. Taka
sytuacja napawa dużą nadzieją na przyszłość, jeśli chodzi
o badania i ochronę nietoperzy, tym bardziej, że na omawia-
Mroczek późny w Kurowie spokojnie czeka na wiosnę
(fot. G. Błachowski)
Chiropterolog wyjmujący „obiekt badań” z sieci
225
226
fot. M. Pruszyński
12 Ptaki Narwiańskiego
Parku Narodowego
Adam Więcko • Mikołaj Pruszyński •
Andrzej K. Kamocki
Dolina Narwi na odcinku między Surażem a Żółtkami
jest jedną z najlepiej zachowanych dolin rzecznych w Europie. Naturalne procesy i ekstensywna gospodarka rolna
kształtujące ekosystemy bagienne przyczyniły się tu do
wykształcenia specyficznych biotopów dogodnych dla awifauny w czasie wędrówek oraz siedlisk lęgowych ptaków
wodno-błotnych. Narwiański Park Narodowy od 2002
roku jest uznawany za obszar wodno-błotny mający znaczenie międzynarodowe i został objęty Konwencją Ramsarską. Od 2004 r. Narwiański Park Narodowy wraz z niemal całą otuliną stanowi obszar specjalnej ochrony ptaków
o nazwie Bagienna Dolina Narwi (PLB200001), wchodzący
w skład Europejskiej Sieci Ekologicznej Natura 2000. Od
2010 roku Bagienna Dolina Narwi uzyskała status ostoi
ptaków IBA (ang. Important Bird Areas). Ostoje IBA są wyznaczane na podstawie ścisłych kryteriów opracowanych
przez organizację BirdLife International i obejmują miejsca
kluczowe dla ochrony ptaków i ich siedlisk na całym świecie (Wilk i in. 2010)1.
W Bagiennej Dolinie Narwi, w latach 2003–2015, stwierdzono 213 gatunków ptaków, w tym 160 lęgowych (Tab.
12.1). Aż 55 gatunków, w tym 34 przeprowadzające lęgi, jest
wymienionych w i Załączniku Dyrektywy Rady 79/409/
EWG. Obserwowane taksony stanowią niemal połowę
z 451 gatunków ptaków tworzących awifaunę Polski2.
Wśród nich 192 gatunki są w świetle polskiego prawa objęte ochroną ścisłą, dziewięć – częściową, a 12 to gatunki
łowne. Spośród gatunków objętych ochroną czterech dotyczy zakaz umyślnego okaleczania lub chwytania, 196 –
zakaz umyślnego niszczenia ich jaj, 46 – zakaz transportu,
55 gatunków wymaga ochrony czynnej, a 11 – ustalenia
stref ochrony ostoi, miejsc rozrodu lub regularnego przebywania (Dz.U. 2014, poz. 1348; Dz.U. 2005 Nr 45, poz. 433
1
2
Znaczenie Narwiańskiego Parku Narodowego dla ochrony
awifauny siedlisk wodno-błotnych podkreśla jego symbol,
którym jest błotniak stawowy.
Stanu na dzień 31 grudnia 2015 r., według podziału przyjętego przez Komisję Faunistyczną Sekcji Ornitologicznej
Polskiego Towarzystwa Zoologicznego.
i 434). Według BirdLife International (2004) dwa gatunki
są zagrożone w skali globalnej, światowa populacja 15 z nich
jest skoncentrowana w Europie i ma niekorzystny status
ochronny w skali kontynentu, a 24 kolejne taksony mają
również niekorzystny status ochronny w Europie, lecz ich
światowa populacja nie jest w niej skoncentrowana. W Bagiennej Dolinie Narwi występuje 37 gatunków wpisanych
do Polskiej Czerwonej Księgi Zwierząt (Głowaciński
2001), w tym 15 lęgowych. Podczas badań terenowych obserwowano 95 gatunków ptaków wytypowanych do objęcia programem Monitoring Ptaków Mokradeł w ramach
Państwowego Monitoringu Środowiska. Spośród nich aż
67 taksonów uznano za lęgowe na obszarze Bagiennej Doliny Narwi.
Dawniej, przed 2003 r., w Narwiańskim Parku Narodowym i w jego otulinie, oprócz stwierdzonych obecnie 213
gatunków ptaków, obserwowano jeszcze trzy gatunki lęgowe: cietrzewia Tetrao tetrix, perkoza rdzawoszyjego Podiceps grisegena i kraskę Coracias garrulus oraz 10 gatunków
ptaków zalatujących: ohara Tadorna tadorna, kulika
mniejszego Numenius phaeopus, biegusa małego Calidris
temminckii i malutkiego C. minuta, brodźca śniadego Tringa erythropus, rybitwę wielkodziobą Hydroprogne caspia,
kanię rudą Milvus milvus, żołnę Merops apiaster, świergotka tajgowego Anthus hodgsoni i rdzawogardłego A. cervinus (Sterzyńska 2004). Za wyjątkiem cietrzewia i kraski
wielce prawdopodobne jest, że taksony te pojawiały się na
opisywanym terenie także w latach późniejszych, w okresie
wędrówek.
W czasie migracji sezonowych, zwłaszcza wiosną, Bagienna Dolina Narwi jest bardzo ważnym miejscem koncentracji ptaków, szczególnie wodno-błotnych. Podtapiane, słabo zadrzewione szuwary i łąki w dolinie Narwi są
doskonałym miejscem odpoczynku i żerowania szeregu
gatunków ptaków w drodze na tereny lęgowe. Dynamika
liczebności przelotu i koncentracji ptaków jest jednak bardzo zróżnicowana w poszczególnych latach. Wysokie i długotrwałe wiosenne wezbrania wód Narwi sprzyjają grupowaniu się wielkich ilości blaszkodziobych Anseriformes
227
Ryc. 12.1 Świstuny Anas penelope
(fot. J. da Costa)
Ryc. 12.2 Gęgawy Anser anser nad Narwią
(fot. M. Pruszyński)
Ryc. 12.3 Rybitwa białoskrzydła Chlidonias
leucopterus (fot. J. da Costa)
228
Ryc. 12.4 Uszatka błotna Asio flammeus (fot. M. Jastrzębski)
Ryc. 12.5 Wodniczka Acrocephalus paludicola (fot. M. Jastrzębski)
i siewkowych Charadriiformes, natomiast przedłużająca się
zima i brak wiosennych wylewów znacznie ogranicza to
zjawisko.
Ocena dynamiki, składu gatunkowego oraz liczebności
ptaków przelatujących nad obszarem Narwiańskiego
Parku Narodowego prowadzona na potrzeby Planu Ochrony NPN (Krogulec 2013) wykazała obecność ponad
12 tysięcy ptaków migrujących pomiędzy połową marca
i początkiem maja 2013 roku. Największy przelot dotyczył
blaszkodziobych, których liczebność przekraczała osiem
tysięcy, z czego prawie sześć tysięcy stanowiły kaczki Anatinae, a wśród nich głównie głowienki Aythya ferina, czernice A. fuligula, płaskonosy Anas clypeata, świstuny A. penelope (Ryc. 12.1), krzyżówki A. platyrhynchos i cyraneczki
A. crecca. Pozostałe ponad dwa tysiące przelatujących
blaszkodziobych stanowiły gęsi Anserinae, z których niemalże wszystkie należały do czterech gatunków: łabędź
niemy Cygnus olor, gęgawa Anser anser (Ryc. 12.2), gęś zbożowa A. fabalis i gęś białoczelna A. albifrons. Spośród 3,5
tysiąca obserwowanych siewkowych ponad dwa tysiące
stanowiły bataliony Calidrix pugnax. Znaczny udział
wśród tej grupy migrantów miały także mewy Laridae
(łącznie ponad tysiąc osobników), głównie śmieszka Chroicocephalus ridibundus oraz rybitwy Sternidae, głównie
rybitwa białoskrzydła Chlidonias leucopterus (Ryc. 12.3).
Spośród wróblowych Passeriformes na przelotach dominowały skowronki Alauda arvensis.
Ornitofauna zimująca Bagiennej Doliny Narwi w latach
2003–2015 liczyła 66 gatunków ptaków i w porównaniu do
danych z lat 1980–2000 (Sterzyńska i in. 2002) zauważyć
można znaczny wzrost, bo aż o 23 taksony, liczby gatunków ptaków obserwowanych zimą. Z pewnością jest to
wynik znacznie łagodniejszych zim w ostatnich latach, ale
nie mniej istotnym czynnikiem jest o wiele lepsze rozpoznanie oraz całoroczna penetracja terenów atrakcyjnych
przyrodniczo przez znacznie szerszą rzeszę ornitologów –
amatorów, wyposażonych w coraz lepszy sprzęt optyczny.
Bagienna Dolina Narwi jest miejscem gniazdowania
niezwykle rzadkich gatunków ptaków w skali całego kraju.
Liczebność populacji lęgowych czterech gatunków ptaków
uznanych za gniazdujące na opisywanym obszarze w latach 2003–2015, rożeńca Anas acuta, uszatki błotnej Asio
flammeus (Ryc. 12.4), zaroślówki Acrocephalus dumetorum
i wójcika Phylloscopus trochiloides, w całej Polsce nie przekracza stu par3. Narwiański Park Narodowy jest również
drugim, po dolinie Biebrzy, miejscem występowania największej populacji wodniczki Acrocephalus paludicola
(Ryc. 12.5) na Podlasiu (Wilk i in. 2010; Świętochowski
i in. 2012). Wodniczka jest ptakiem, za którego przetrwanie
Polska ponosi wyjątkową odpowiedzialność. Według Światowej Czerwonej Listy Gatunków IUCN z roku 2010 jest to
jeden z trzech globalnie zagrożonych gatunków ptaków,
które regularnie pojawiają się w Polsce, i jedyny wśród
nich, którego polska populacja jest istotną częścią światowej. Liczebność wodniczki znacznie spadła w wyniku utraty odpowiednich siedlisk. Straty te były w większości spo3
Według ustaleń Komisji Faunistycznej Sekcji Ornitologicznej Towarzystwa Zoologicznego, stan na dzień 31 grudnia
2015 r.
229
Ryc. 12.6 Samiec błotniaka stawowego Circus aeruginosus
(fot. M. Perkowski)
wodowane odwodnieniem torfowisk oraz terenów zalewowych na potrzeby rolnictwa. Inne zmiany środowiska,
w tym głównie zaprzestanie użytkowania łąkarskiego,
stały się znaczące dopiero po dużych zmianach w reżimie
hydrologicznym mokradeł, niemniej obecnie odgrywają
istotną rolę. Wodniczka, jako gatunek związany z dobrze
wykształconymi, typowymi szuwarami turzycowymi
o strukturze kępowej, jest wyjątkowo wrażliwa na pogorszenie warunków siedliskowych. Liczebność jej populacji
silnie fluktuuje z roku na rok i zwykle jest większa w latach
mokrych. Najliczniejszą populację lęgową tego stenotopowego gatunku w Narwiańskim Parku Narodowym i jego
otulinie stwierdzono w 1994 r., gdy obserwowano około 60
stacjonarnych samców (Lewartowski 1994). Przeprowadzone w ostatnich latach badania wykazały spadek liczebności śpiewających samców wodniczki, z 34 osobników
w roku 2009, do zaledwie 15 w roku 2014. Tendencja ta jednak mogła ulec zahamowaniu lub odwróceniu, gdyż w roku
2015 stwierdzono 24 terytorialne samce wodniczki (Pruszyński 2012 i dane niepubl.).
Poza wymienionymi wyżej gatunkami ptaków Bagienna Dolina Narwi obfituje jeszcze w wiele innych cennych
taksonów. Wśród nich można wyróżnić charakterystyczne
grupy gatunków zajmujące specyficzne siedliska. Typowymi ptakami preferującymi trzcinowiska w dolinie Narwi są
bąk Botaurus stellaris, bączek Ixobrychus minutus i błotniak stawowy Circus aeruginosus (Ryc. 12.6). Przedstawicielami cennych gatunków starorzeczy są rybitwy czarna
Chlidonias niger i białoskrzydła Ch. leucopterus. Rozległe
turzycowiska Narwiańskiego Parku Narodowego zamieszkują dwa bekasy: kszyk Gallinago gallinago i dubelt G.
media (Ryc. 12.7). Do lęgów przystępują tu także chruściele: kropiatka Porzana porzana i zielonka P. parva oraz
kaczka cyranka Anas querquedula. Do gatunków zajmujących ekstensywnie koszone łąki zaliczyć można derkacza
230
Crex crex (Ryc. 12.8), rycyka Limosa limosa (Ryc. 12.9)
i krwawodzioba Tringa totanus (Ryc. 12.10), a liczne zarośla
zamieszkuje podróżniczek Luscinia svecica. Wielkość
i stan zachowania populacji wymienionych wyżej taksonów, niezależnie od grupy gatunków zamieszkujących
określone siedliska, podlega pewnym trendom. Niestety
zauważalny jest silny spadek populacji rycyka i krwawodzioba. Pewnym naturalnym fluktuacjom podlega na opisywanym terenie liczebność bączka oraz rybitw czarnej
i białoskrzydłej. Od szeregu lat obserwowany jest niski,
lecz w miarę stabilny stan liczebności cyranki i dubelta.
Stan populacji pozostałych gatunków ptaków, cennych dla
obszaru Bagiennej Doliny Narwi, również utrzymuje się na
bezpiecznym i niezmieniającym się poziomie.
Głównym czynnikiem, który wpływa na spadek liczebności ptaków wodno-błotnych są zmiany w hydrologii doliny Narwi, które w istotny sposób ograniczają refugia dogodne do lęgów i zdobywania pokarmu. Skrócenie okresu
wylewów Narwi, a w ostatnim okresie ich coraz częstszy
brak, jak i niskie stany wód gruntowych od kwietnia do
sierpnia przyczyniają się do zaniku miejsc gniazdowych
oraz utraty i pogorszenia jakości siedlisk żerowiskowych.
Zmiany warunków wodnych powodują coraz większą izolację niektórych starorzeczy, zmniejszenie powierzchni
narwiańskich rozlewisk, a w połączeniu z zaniechaniem
użytkowania kośnego – niekorzystne przemiany roślinności. Od drugiej połowy lat 80. ubiegłego wieku szuwary turzycowe są zastępowane przez zbiorowiska z dominacją
trzciny, co prowadzi do zaniku siedlisk dogodnych dla
wielu gatunków ptaków, w tym gatunków kluczowych
w obszarze: kropiatki, derkacza, dubelta, wodniczki, rycyka i krwawodzioba. Spadek uwodnienia mokradeł zwiększa także ich dostępność, a zwiększona penetracja miejsc
gniazdowania przez ludzi może istotnie wpływać na sukces lęgowy. Przesuszenie mokradeł, w powiązaniu z dyna-
Ryc. 12.7 Dubelt Gallinago media (fot. M. Jastrzębski)
Ryc. 12.8 Derkacz Crex crex (fot. M. Jastrzębski)
Ryc. 12.10 Krwawodziób Tringa totanus (fot. J. da Costa)
Ryc. 12.9 Rycyk Limosa limosa (fot. J. da Costa)
micznym rozwojem populacji rodzimych i obcych gatunków drapieżników, jest także ważnym zagrożeniem na terenach lęgowych. Ułatwienie możliwości penetracji
przesuszonych siedlisk przez kunę leśną, lisa, dzika, ale
również norkę amerykańską i jenota, naraża lęgi na straty.
Istotny wpływ na kondycję populacji ptaków ma także
postępująca intensyfikacja rolnictwa na terenach przyległych do doliny Narwi. Wprowadzanie monokultur, chemizacja i mechanizacja, zwielokrotnienie liczby pokosów
na łąkach, zbyt duża obsada zwierząt gospodarskich na
pastwiskach, wpływają negatywnie na liczebność ptaków
231
związanych z krajobrazem rolniczym, w tym również gatunków wielośrodowiskowych. Niezwykle istotnym problemem w aspekcie dużych ptaków gniazdujących na starych drzewach jest znikoma powierzchnia lasów i stosunkowo młody wiek drzewostanów w dolinie Narwi i na
terenach sąsiednich.
Ochrona awifauny Narwiańskiego Parku Narodowego
musi być ukierunkowana na odtworzenie biotopów poprzez:
• zachowanie i odtworzenie zasobów wodnych odpowiednich dla właściwego stanu ekosystemów oraz
siedlisk hydrogenicznych;
• skuteczne przeciwdziałanie sukcesji wtórnej na siedliskach nieleśnych, odtworzenie i zachowanie turzycowisk i ekstensywne ich użytkowanie zgodnie z wymogami poszczególnych gatunków ptaków i dobrą
praktyką rolniczą;
• zachowanie starorzeczy oraz utrzymanie strefy szuwarów na obrzeżu małych zbiorników wodnych oraz
w strefach przyległych do koryt rzecznych;
• utrzymanie dotychczasowych areałów ekstensywnych użytków zielonych oraz zarośli.
Zachowanie różnorodności gatunkowej i zatrzymanie
spadku liczebności populacji ptaków powinno być wspomagane odłowem norki amerykańskiej oraz ograniczaniem ryzyka kolizji spowodowanego fragmentacją krajobrazu poprzez budowę nowych dróg.
Literatura
Birdlife International 2004. Birds in the European Union: a status assessment. Wageningen, The Netherlands. Birdlife International.
Dyrektywa Parlamentu Europejskiego i Rady 2009/147/WE
z dnia 30 listopada 2009 r. w sprawie ochrony dzikiego ptactwa (Dyrektywa Ptasia).
Głowaciński Z. (red.). 2001. Polska Czerwona Księga Zwierząt.
Kręgowce. PWRiL, Warszawa.
Krogulec J. (red.). 2013. Operat fauny w zakresie ornitofauny
(projekt). Plan Ochrony Narwiańskiego Parku Narodowego.
ProHabitat, Białystok (mscr.).
Lewartowski Z. 1994. Monitoring ornitologiczny w dolinie
Narwi na terenie Narwiańskiego Parku Krajobrazowego – badania rozmieszczenia i liczebności wskaźnikowych gatunków
ptaków (mscr., archiwum Narwiańskiego Parku Narodowego).
Państwowy Monitoring Środowiska 2007. Monitoring Ptaków
Mokradeł. Instrukcja dla obserwatorów.
Pruszyński M. 2012. Liczebność i rozmieszczenie wodniczki
Acrocephalus paludicola w Narwiańskim Parku Narodowym
i jego otulinie w 2012 r. OTOP, NPN, Kurowo (mscr.).
Sterzyńska M. 2004. Fauna lądowa. [W:] H. Banaszuk (red.),
Przyroda Podlasia. Narwiański Park Narodowy. Monografia
przyrodnicza. Narwiański Park Narodowy, Białystok.
Sterzyńska M., Nowakowski J., Górski A., Raczyński J.,
Gębczyńska Z., Chętnicki W., Pilipuk I., Sterzyński W.,
Winiarska G., Wegner E. 2002. Operat ochrony fauny. Plan
Ochrony Narwiańskiego Parku Narodowego (mscr., archiwum Narwiańskiego Parku Narodowego).
Świętochowski P., Grygoruk G., Wereszczuk M., Korniluk
M., Białomyzy P., Tumiel T. 2012. Inwentaryzacja ptaków
w obszarze Natura 2000 Bagienna Dolina Narwi PLB200001.
TOS ProHabitat, Białystok (mscr.).
Wilk T., Jujka M., Krogulec J., Chylarecki P. (red.) 2010.
Ostoje ptaków o znaczeniu międzynarodowym w Polsce.
OTOP, Marki.
Tab. 12.1 Charakterystyka awifauny Narwiańskiego Parku Narodowego i jego otuliny w latach 2003–2015
232
Lp.
Nazwa polska
Nazwa naukowa
A
B
C
D
1
łabędź niemy
Cygnus olor
+
+
+
1, (2)
2
łabędź czarnodzioby
Cygnus columbianus
3
łabędź krzykliwy
Cygnus cygnus
4
bernikla białolica
Branta leucopsis
5
gęgawa
Anser anser
6
gęś zbożowa
Anser fabalis
Ł
7
gęś białoczelna
Anser albifrons
Ł
8
gągoł
Bucephala clangula
+
1 (+), (2)
9
bielaczek
Mergellus albellus
+
1, (2)
10
nurogęś
Mergus merganser
+
1 (+), (2)
11
szlachar
Mergus serrator
12
głowienka
Aythya ferina
13
podgorzałka
Aythya nyroca
14
czernica
Aythya fuligula
15
cyranka
Anas querquedula
+
+
1 (+), (2)
16
płaskonos
Anas clypeata
+
+
1 (+), (2)
17
krakwa
Anas strepera
+
+
1 (+), (2)
18
świstun
Anas penelope
+
+
+
+
E
F
G
+
1, (2)
+
1, (2)
+
1, (2)
+
+
Ł
+
+
+
1 (+), 4, (2)
EN
Ł
1 (+), (2)
+
+
+
+
EN
Ł
1, (2)
H
+
+
3
+
3
+
+
CR
+
Lp.
Nazwa polska
Nazwa naukowa
19
świstun amerykański
Anas americana
20
krzyżówka
Anas platyrhynchos
21
rożeniec
Anas acuta
+
1 (+), (2)
22
cyraneczka
Anas crecca
+
+
Ł
23
przepiórka
Coturnix coturnix
+
+
1, (2)
24
bażant
Phasianus colchicus
+
+
+
Ł
25
kuropatwa
Perdix perdix
+
+
+
Ł
26
perkozek
Tachybaptus ruficollis
+
+
27
perkoz dwuczuby
Podiceps cristatus
+
+
28
zausznik
Podiceps nigricollis
+
29
gołąb miejski
Columba livia forma urbana
+
30
siniak
Columba oenas
+
31
grzywacz
Columba palumbus
+
+
Ł
32
turkawka
Streptopelia turtur
+
+
1, (2)
33
sierpówka
Streptopelia decaocto
+
+
34
lelek
Caprimulgus europaeus
+
+
1, (2)
+
35
jerzyk
Apus apus
+
+
1 (+), (2)
+
36
kukułka
Cuculus canorus
+
+
1, (2)
37
wodnik
Rallus aquaticus
+
+
1, (2)
38
derkacz
Crex crex
+
+
1 (+), (2)
+
39
kropiatka
Porzana porzana
+
+
1 (+), (2)
+
40
zielonka
Porzana parva
+
+
1, (2)
+
41
kokoszka
Gallinula chloropus
+
+
1, (2)
+
42
łyska
Fulica atra
+
+
Ł
+
43
żuraw
Grus grus
+
+
1, (2)
+
44
siewka złota
Pluvialis apricaria
1, (2)
+
45
sieweczka rzeczna
Charadrius dubius
46
czajka
Vanellus vanellus
47
kulik wielki
Numenius arquata
A
B
C
D
+
+
+
Ł
+
+
+
+
+
G
H
+
EN
+
+
3
+
3
+
1, (2)
+
1, (2)
+
2, (2)
1, (2)
+
1, (2)
+
1
+
+
NT
2
+
+
1 (+), (2)
2
1 (+), (2)(3)
2
rycyk
Limosa limosa
batalion
Calidris pugnax
1 (+), (2)(3)
50
biegus zmienny
Calidris alpina
1 (+), (2)(3)
+
EXP
1, (2)
48
+
F
1, (2)
49
+
E
1 (+), (2)(3)
+
VU
2
+
+
+
EN
+
EN
+
51
słonka
Scolopax rusticola
+
+
Ł
52
dubelt
Gallinago media
+
+
1, (2)(3)
53
kszyk
Gallinago gallinago
+
+
1, (2)(3)
54
bekasik
Lymnocryptes minimus
55
brodziec piskliwy
Actitis hypoleucos
+
+
1, (2)(3)
+
56
samotnik
Tringa ochropus
+
+
1 (+), (2)(3)
+
57
kwokacz
Tringa nebularia
3
+
+
VU
3
1, (2)(3)
+
+
CR
+
1, (2)
58
krwawodziób
Tringa totanus
59
łęczak
Tringa glareola
60
śmieszka
Chroicocephalus ridibundus
61
mewa mała
Hydrocoloeus minutus
62
mewa siwa
Larus canus
1 (+), (2)
63
mewa żółtonoga
Larus fuscus
1, (2)
64
mewa srebrzysta
Larus argentatus
2, (2)
65
mewa białogłowa
Larus cachinnans
66
rybitwa rzeczna
Sterna hirundo
67
rybitwa białoczelna
Sternula albifrons
68
rybitwa białowąsa
Chlidonias hybrida
+
69
rybitwa czarna
Chlidonias niger
+
70
rybitwa białoskrzydła
Chlidonias leucopterus
+
+
+
1 (+), (2)(3)
1 (+), (2)(3)
+
+
2
+
3
+
CR
1, (2)
+
1 (+), (2)(3)
LC
2
+
+
+
+
2, (2)
+
+
+
1 (+), (2)(3)
+
1 (+), (2)(3)
+
+
1 (+), (2)(3)
+
+
1 (+), (2)(3)
+
+
1 (+), (2)(3)
+
NT
+
LC
+
3
+
NT
+
233
234
Lp.
Nazwa polska
Nazwa naukowa
A
B
71
bocian czarny
Ciconia nigra
72
bocian biały
73
74
C
D
E
Ciconia ciconia
+
+
bąk
Botaurus stellaris
+
bączek
Ixobrychus minutus
+
75
ślepowron
Nycticorax nycticorax
76
czapla siwa
Ardea cinerea
77
czapla biała
Ardea alba
1 (+), 4, (2)(3)
+
1 (+), (2)
+
+
1, (2)
+
LC
+
+
1 (+), (2)
+
VU
+
1 (+), 4, (2)(3)
+
LC
+
78
czapla nadobna
Egretta garzetta
79
kormoran
Phalacrocorax carbo
80
rybołów
Pandion haliaetus
81
trzmielojad
Pernis apivorus
+
+
1, (2)(3)
+
82
orlik krzykliwy
Clanga pomarina
+
+
1 (+), 4, (2)(3)
+
83
orlik grubodzioby
Clanga clanga
1 (+), (1)(3)
84
orzeł przedni
Aquila chrysaetos
1 (+), (1)(3)
85
orzełek
Hieraaetus pennatus
86
błotniak stawowy
Circus aeruginosus
87
błotniak zbożowy
Circus cyaneus
88
błotniak łąkowy
Circus pygargus
+
+
89
krogulec
Accipiter nisus
+
+
+
F
G
+
2
+
2, (2)
+
1, (2)
+
1, (2)(3)
+
+
2, (2)
1 (+), 4, (1)(3)
+
+
+
+
H
+
+
VU
+
LC
+
+
CR
+
+
EN
1 (+), 4, (1)(3)
+
CR
1 (+), (2)(3)
+
1 (+), (2)(3)
+
1 (+), (2)(3)
+
2
+
3
VU
+
+
1, (2)(3)
90
jastrząb
Accipiter gentilis
+
+
1, (2)(3)
91
bielik
Haliaeetus albicilla
+
+
1, 4, (2)(3)
+
1
LC
+
92
kania czarna
Milvus migrans
1 (+), 4, (2)(3)
+
3
NT
+
93
myszołów włochaty
Buteo lagopus
94
myszołów
Buteo buteo
95
płomykówka
Tyto alba
96
sóweczka
Glaucidium passerinum
97
pójdźka
Athene noctua
98
uszatka
Asio otus
99
uszatka błotna
Asio flammeus
100
puszczyk
Strix aluco
101
puchacz
Bubo bubo
102
dudek
Upupa epops
103
krętogłów
104
dzięcioł zielonosiwy
+
+
1, (2)
+
+
1, (2)(3)
+
+
1 (+), (2)(3)
1 (+), 4, (2)(3)
+
+
+
+
+
+
+
+
+
LC
+
VU
+
NT
1, (2)
1 (+), (2)(3)
+
+
1 (+), (2)(3)
1, (2)
+
1 (+), 4, (2)(3)
+
+
1 (+), (2)
Jynx torquilla
+
+
Picus canus
+
+
+
3
1 (+), (2)
+
105
dzięcioł zielony
Picus viridis
+
+
dzięcioł czarny
Dryocopus martius
+
+
+
1 (+), (2)
107
dzięcioł duży
Dendrocopos major
+
+
+
1, (2)
1, (2)
+
+
1 (+), (2)
+
1 (+), (2)(3)
+
1 (+), (2)
108
dzięcioł białoszyi
Dendrocopos syriacus
+
+
109
dzięcioł średni
Dendrocopos medius
+
+
110
dzięcioł białogrzbiety
Dendrocopos leucotos
+
+
111
dzięciołek
Dendrocopos minor
+
+
+
1, (2)
112
zimorodek
Alcedo atthis
+
+
1, (2)
113
pustułka
Falco tinnunculus
kobczyk
Falco vespertinus
115
drzemlik
Falco columbarius
116
kobuz
Falco subbuteo
117
sokół wędrowny
Falco peregrinus
118
wilga
119
+
+
1, (2)
+
106
114
+
+
+
2
+
NT
+
+
1 (+), (2)
+
3
1, (2)
1, (2)
+
+
Oriolus oriolus
+
+
1, (2)
gąsiorek
Lanius collurio
+
+
1, (2)
120
srokosz
Lanius excubitor
+
+
+
1, (2)
121
sójka
Garrulus glandarius
+
+
+
1, (2)
122
sroka
Pica pica
+
+
+
2, (2)
+
EXP
+
1 (+), (2)(3)
1 (+), 4, (2)(3)
CR
+
3
3
Lp.
Nazwa polska
Nazwa naukowa
A
B
C
D
E
F
G
H
123
orzechówka
Nucifraga caryocatactes
+
124
kawka
Corvus monedula
+
+
1, (2)
125
gawron
Corvus frugilegus
+
+
+
1, 2, (2)
126
kruk
Corvus corax
+
+
+
2, (2)
127
wrona siwa
Corvus cornix
+
+
+
2, (2)
128
pokrzywnica
Prunella modularis
+
+
129
wróbel
Passer domesticus
+
+
+
1 (+), (2)
3
130
mazurek
Passer montanus
+
+
+
1, (2)
3
131
świergotek drzewny
Anthus trivialis
+
+
1, (2)
132
świergotek łąkowy
Anthus pratensis
+
+
1, (2)
133
świergotek polny
Anthus campestris
+
+
1, (2)
134
pliszka żółta
Motacilla flava
+
+
1, (2)
+
135
pliszka cytrynowa
Motacilla citreola
1, (2)(3)
+
136
pliszka siwa
Motacilla alba
+
+
1, (2)
+
137
zięba
Fringilla coelebs
+
+
138
jer
Fringilla montifringilla
139
grubodziób
Coccothraustes coccothraustes
+
+
140
dziwonia
Erythrina erythrina
+
+
141
gil
Pyrrhula pyrrhula
+
+
+
1, (2)
142
dzwoniec
Chloris chloris
+
+
+
1, (2)
143
makolągwa
Linaria cannabina
+
+
144
rzepołuch
Linaria flavirostris
+
1, (2)
145
czeczotka
Acanthis flammea
+
1, (2)
146
krzyżodziób świerkowy
Loxia curvirostra
147
szczygieł
Carduelis carduelis
+
+
148
kulczyk
Serinus serinus
+
+
149
czyż
Spinus spinus
+
+
150
śnieguła
Plectrophenax nivalis
151
potrzeszcz
Emberiza calandra
+
+
152
ortolan
Emberiza hortulana
+
+
153
trznadel
Emberiza citrinella
+
+
154
potrzos
Emberiza schoeniclus
+
+
155
sosnówka
Periparus ater
+
+
+
1, (2)
156
czubatka
Lophophanes cristatus
+
+
+
1, (2)
157
sikora uboga
Poecile palustris
+
+
+
1, (2)
158
czarnogłówka
Poecile montanus
+
+
+
1, (2)
159
modraszka
Cyanistes caeruleus
+
+
+
1, (2)
160
bogatka
Parus major
+
+
+
1, (2)
161
remiz
Remiz pendulinus
+
+
162
górniczek
Eremophila alpestris
163
lerka
Lullula arborea
+
+
1, (2)
164
skowronek
Alauda arvensis
+
+
1, (2)
165
dzierlatka
Galerida cristata
166
wąsatka
Panurus biarmicus
+
+
1, (2)
167
brzęczka
Locustella luscinioides
+
+
1, (2)
+
168
strumieniówka
Locustella fluviatilis
+
+
1, (2)
+
169
świerszczak
Locustella naevia
+
+
1, (2)
+
170
zaganiacz
Hippolais icterina
+
+
1, (2)
171
wodniczka
Acrocephalus paludicola
+
+
1 (+), (2)(3)
172
rokitniczka
Acrocephalus schoenobaenus
+
+
1, (2)
+
173
zaroślówka
Acrocephalus dumetorum
+
+
1, (2)(3)
+
174
łozówka
Acrocephalus palustris
+
+
1, (2)
+
1, (2)
1, (2)
+
1, (2)
+
1, (2)
+
1, (2)
+
+
1, (2)
+
1, (2)
1, (2)
+
2
LC
+
1, (2)
1, (2)
+
1, (2)
+
1, (2)
1, (2)
1, (2)
+
2
+
2
1, (2)
1, (2)
3
1, (2)
+
+
+
1, (2)
+
2
3
1, (2)
LC
+
VU
+
+
235
Lp.
Nazwa polska
Nazwa naukowa
A
B
175
trzcinniczek
Acrocephalus scirpaceus
+
+
1, (2)
+
176
trzciniak
Acrocephalus arundinaceus
+
+
1, (2)
+
177
oknówka
Delichon urbicum
+
1, (2)
3
178
dymówka
Hirundo rustica
+
1, (2)
3
179
brzegówka
Riparia riparia
+
1, (2)
3
+
180
świstunka leśna
Phylloscopus sibilatrix
+
1, (2)
2
+
181
piecuszek
Phylloscopus trochilus
+
+
1, (2)
182
pierwiosnek
Phylloscopus collybita
+
+
1, (2)
183
wójcik
Phylloscopus trochiloides
+
1, (2)(3)
184
raniuszek
Aegithalos caudatus
+
+
185
kapturka
Sylvia atricapilla
+
+
1, (2)
186
gajówka
Sylvia borin
+
+
1, (2)
187
jarzębatka
Sylvia nisoria
+
+
1, (2)
188
piegża
Sylvia curruca
+
+
1, (2)
189
cierniówka
Sylvia communis
+
+
190
mysikrólik
Regulus regulus
+
+
191
zniczek
Regulus ignicapilla
192
jemiołuszka
Bombycilla garrulus
193
pełzacz leśny
Certhia familiaris
194
pełzacz ogrodowy
Certhia brachydactyla
195
kowalik
Sitta europaea
+
+
+
1, (2)
196
strzyżyk
Troglodytes troglodytes
+
+
+
1, (2)
197
szpak
Sturnus vulgaris
+
+
1, (2)
3
198
muchołówka szara
Muscicapa striata
+
+
1, (2)
3
199
rudzik
Erithacus rubecula
+
+
1, (2)
200
słowik szary
Luscinia luscinia
+
+
1, (2)
201
podróżniczek
Luscinia svecica
+
+
1, (2)
+
+
+
C
+
+
E
F
G
H
1, (2)
+
1, (2)
+
+
+
D
1, (2)
1, (2)
+
1, (2)
+
1, (2)
+
1, (2)
202
muchołówka mała
Ficedula parva
+
+
1, (2)
203
muchołówka żałobna
Ficedula hypoleuca
+
+
1, (2)
204
muchołówka białoszyja
Ficedula albicollis
+
+
1, (2)
205
pleszka
Phoenicurus phoenicurus
+
+
1, (2)
206
kopciuszek
Phoenicurus ochruros
+
+
1, (2)
207
pokląskwa
Saxicola rubetra
+
+
1, (2)
208
białorzytka
Oenanthe oenanthe
+
1, (2)
209
paszkot
Turdus viscivorus
+
+
1, (2)
210
śpiewak
Turdus philomelos
+
+
1, (2)
211
droździk
Turdus iliacus
+
+
1, (2)
212
kos
Turdus merula
+
+
+
1, (2)
213
kwiczoł
Turdus pilaris
+
+
+
1, (2)
+
NT
+
+
2
3
A. Gatunki ptaków lęgowe na obszarze Narwiańskiego Parku Narodowego. B. Gatunki ptaków lęgowe na obszarze Bagiennej Doliny Narwi (PLB 200001). C. Gatunki ptaków obserwowane na obszarze Bagiennej Doliny Narwi (PLB 200001) w okresie zimy. D. Status wg Rozporządzenia Ministra Środowiska z dnia 7 października 2014 r. w sprawie ochrony gatunkowej zwierząt oraz Rozporządzenia Ministra
Środowiska z dnia 11 marca 2005 r. w sprawie ustalenia listy gatunków zwierząt łownych: 1 – objęte ochroną ścisłą z wyszczególnieniem
gatunków wymagających ochrony czynnej (+); 2 – objęte ochroną częściową; 4 – gatunki zwierząt wymagające ustalenia stref ochrony,
miejsc rozrodu i regularnego przebywania; gatunek, którego dotyczy zakaz: (1) umyślnego okaleczania lub chwytania; (2) umyślnego
niszczenia ich jaj lub form rozwojowych; (3) transportu; Ł – gatunki ptaków łownych. E. Gatunki wymienione w załączniku i Dyrektywy
Ptasiej; F. Status SPEC (ang. Species of European Conservation Concern) – wg BirdLife International (2004): 1 – gatunek zagrożony w skali
globalnej, 2 – niekorzystny status ochronny w Europie, światowa populacja jest skoncentrowana w Europie; 3 – niekorzystny status
ochronny w Europie, światowa populacja nie jest skoncentrowana w Europie; G. Kategoria zagrożenia wg Polskiej Czerwonej Księgi
Zwierząt (Głowaciński 2001): EXP – gatunki zanikłe lub prawdopodobnie zanikłe w Polsce; CR – gatunki skrajnie zagrożone; EN – gatunki bardzo wysokiego ryzyka, silnie zagrożone; VU – gatunki wysokiego ryzyka, narażone na wyginiecie; NT – gatunki niższego ryzyka, ale bliskie zagrożenia, LC – gatunki na razie nie zagrożone. H. Gatunki ptaków objęte Monitoringiem Ptaków Mokradeł wg IOŚ 2007
236