17. Badanie właściwości oksydacyjno-redukcyjnych kompleksów żelaza metodą
cyklicznej woltamperometrii
Jedną z częściej stosowanych w badaniach związków kompleksowych technik
jest cykliczna woltamperometria. Wynika to z prostoty pomiarowej tej techniki, łatwości
opracowywania i interpretacji wyników oraz dużej liczby uzyskiwanych informacji o
badanym układzie. Technika ta pozwala wyznaczyć standardowy potencjał redoksowy Eo,
oszacować liczbę transferowanych w tym procesie elektronów oraz określić odwracalność
procesu redoksowego. Dzięki stosowanej technice szybkiej zmiany potencjału w czasie,
pozwala badać nietrwałe produkty utleniania lub redukcji, a w połączeniu z innymi
technikami badawczymi (jak np. spektroskopią elektronową) podać ich charakterystykę.
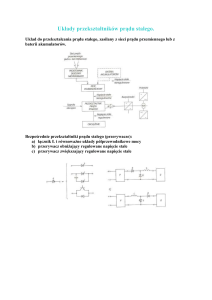
Cykliczna woltamperometria bazuje na pomiarze prądu, płynącego w układzie
pomiędzy elektrodami, przy zmieniającym się potencjale. W przeciwieństwie do polarografii
wymaga elektrod o stałej, niezmiennej powierzchni oraz braku mieszania roztworu. Wykres
zmian potencjału, przykładanego do elektrod, od czasu ma kształt trójkątny, a potencjał zmienia
się cyklicznie od wartości minimalnej (Ep) do wartości maksymalnej (Ek) jak na rys. 1.
Rys. 1. Wykres zmian potencjału przykładanego do elektrod od czasu.
1
Rys. 2. Wykres zmian natężenia prądu od przyłożonego potencjału.
Jeśli w roztworze znajduje się substancja aktywna elektrochemicznie, to przy pewnym
potencjale elektroda staje się zdolna do jej utleniania lub redukcji. Powoduje to wzrost
mierzonego prądu. Stały wzrost potencjału w czasie, powoduje wzrost mierzonego prądu,
gdyż substancja ta coraz łatwiej ulega elektrolizie. Wobec braku mieszania w układzie, przy
szybkim wzroście potencjału, w warstwie dyfuzyjnej elektrody z czasem zaczyna brakować
substancji aktywnej i obserwuje się spadek mierzonego prądu do wartości równej prądowi
dyfuzyjnemu. Na krzywej natężenia prądu od potencjału obserwuje się maksimum. Podobny
przebieg ma pomiar przy powrocie potencjału do wartości wyjściowej a uzyskane krzywe dla
procesu odwracalnego przedstawione są na rys. 2. Dla procesów odwracalnych natężenie
prądu w maksimum można wyrazić zależnością:
gdzie:
0,4463 – współczynnik liczbowy bezwymiarowy
n – ilość elektronów biorących udział w akcie elementarnym
F – stała Faraday’a; F = 96485 [C/ mol],
R – stała gazowa; R = 8,3145 [J/ mol K],
T – temperatura w skali Kelwina
A – pole powierzchni elektrody pracującej [cm2],
D – współczynnik dyfuzji substancji elektroaktywnej [cm2/ s],
c – stężenie substancji elektroaktywnej w roztworze [mol/ cm3],
ν – szybkość przemiatania potencjałem [V/s],
2
zwaną równaniem Randlesa-Sevcika. Jeżeli przyjmiemy, że temperatura wynosi T= 298 K
(25oC), to równanie przyjmie postać:
,
wtedy współczynnik 2,69·105 posiada jednostkę: C·mol·V½.
Symetryczność obserwowanych krzywych utleniania i redukcji pozwala określić
odwracalność układu, a odległość pomiędzy maksimami dla procesu utleniania i redukcji,
pozwala wyznaczyć liczbę transferowanych elektronów. Zachowanie się krzywych przy
zmiennych parametrach pomiarowych (takich jak potencjał początkowy, zakres pomiarowy,
kierunek zmiany potencjału, szybkość narastania potencjału, zmiana stężenia substancji w
roztworze elektrolizowanym, stosowane przerwy, temperatura) pozwala wyciągnąć daleko
idące wnioski o reakcjach przebiegających w układzie.
Celem ćwiczenia jest zapoznanie się z zastosowaniem cyklicznej woltamperometrii w
badaniu związków kompleksowych.
Zakres materiału naukowego
Metody elektrochemiczne – polarografia, polarografia różnicowa, woltamperometria.
Potencjał elektrochemiczny, prawa elektrolizy, odwracalność procesów redoksowych (oraz
określanie
odwracalności
procesu
redoks
na
podstawie
kształtu
krzywych
woltamperometrycznych), rola elektrolitu. Elektrody odniesienia dla roztworów wodnych i
niewodnych oraz ich kalibracja. Wpływ elektrod pomiarowych, rozpuszczalnika oraz
elektrolitu na zakres pomiarowy. Wyznaczanie potencjału standardowego oraz liczby
transferowanych elektronów na postawie woltamperogramów.
Obowiązująca literatura
1. G.W.Ewing „Metody instrumentalne w analizie chemicznej” PWN Warszawa 1980
wyd.3 zm. rozdz.13 i 15.
2. Krzysztof Pigoń, Zdzisław Ruziewicz, Chemia Fizyczna, PWN, W-wa rozdział o
elektrochemii.
Literatura uzupełniająca
1. P.W.Atkins „Podstawy chemii fizycznej” PWN Warszawa 1999 wyd.1
2. G.Kotrüm „Elektrochemia” PWN Warszawa 1970 wyd.1
3
3. S.Glasstone „Podstawy elektrochemii” PWN Warszawa 1956 wyd.1
4. A.Cygański „Metody elektroanalityczne” WNT Warszawa 1991 rozdz.5.7.
5. W.Szczepaniak „Metody instrumentalne w analizie chemicznej” PWN Warszawa
1996 wyd.1 rozdz.12.4.
6. A.Cygański „Podstawy metod elektroanalitycznych” WNT Warszawa 1999 wyd.3
zm. rozdz.5.7
7. Gary A. Mabbott, „Introduction to cyclic voltammetry”, J. Chem. Educ., vol. 60, 1983
str. 697-701.
Uwaga! W niektórych podręcznikach nazwa „cykliczna woltamperometria” jest zastąpiona
nazwą „chronowoltamperomertia”
Odczynniki, naczynia i przyrządy
K4[Fe(CN)6] (r-r wodny 0,025mol/dm³), KNO3 (r-r wodny 1 mol/dm³), Na2[Fe(CN)5NO],
kolby miarowe (25ml, 8 szt.), 4 zlewki, pipeta miarowa na 2 i 5ml, naczyńka wagowe (2 szt.),
2 tryskawki, aparat do pomiarów elektrochemicznych, elektrody pomiarowe – platynowa
dyskowa, platynowa (drut) oraz chlorosrebrowa lub kalomelowa, naczyńko pomiarowe z
mieszadłem magnetycznym, argon, bibuła filtracyjna lub ręczniki papierowe.
Sposób wykonania
Przygotować roztwory K4[Fe(CN)6] o stężeniach 1, 2, 4, 6, 8 i 10 mmol/dm3 w
1mol/dm3 KNO3 w ilości 25ml poprzez rozcieńczenie 25mmol/dm3 roztworu wyjściowego.
Uruchomić aparat do pomiarów elektrochemicznych. Umocować elektrody pomiarowe
(wcześniej przemyte i osuszone) – elektrodę pomiarową (dysk platynowy) przeszlifować
proszkiem ściernym (Al2O3) lub wilgotną ściereczką, przemyć dokładnie wodą destylowaną i
osuszyć. Do naczyńka pomiarowego wlać roztwór K4[Fe(CN)6] (1mmol/dm³) a następnie
wyargonować go przez okres ok. 10 minut (opcja argonowania roztworu jak i jego mieszania
zapewniona jest przez odpowiednie ustawienie w programie obsługującym aparaturę do
cyklicznej woltamperometrii). Przeprowadzić pomiar woltamperometryczny w zakresie od 0
do +700mV przy szybkości przemiatania potencjałem 100mV/s. W podobny sposób wykonać
pomiary dla roztworów o stężeniu 2, 4, 6, 8, 10mmol/dm³ przy zachowaniu tych samych
parametrów pomiarowych. Następnie dla roztworu o stężeniu 10mmol/dm³ zarejestrować
woltamperogramy w zakresie 0 do +700mV przy szybkościach przemiatania potencjałem: 2,
5, 10, 20, 50 i 200mV/s.
4
Wykonać pomiary dla wodnego roztworu kompleksu Na2[Fe(CN)5NO] (ok.
1mmol/dm3) w zakresie -1000 do +1000mV przy szybkości przemiatania potencjałem
200mV/s.
Korzystając z programu komputerowego wyznacz
Ered, Eutl, Ired, Iutl dla każdego
pomiaru i wpisz do tabeli 1. Dla kompleksu Na2[Fe(CN)5NO] oraz dwóch wybranych
pomiarów wydrukuj otrzymane woltamperogramy i załącz do sprawozdania.
Opracowanie wyników
1. Wyjaśnij i uzasadnij celowość argonowania roztworu.
2. Zebrać w tabeli 1 dane pomiarowe zgodnie z przygotowanym wzorcem.
3. Oblicz liczbę transferowanych w procesie elektronów (podaj wartość średnią) i na
podstawie otrzymanych wartości zapisz proces utleniania soli K4[Fe(CN)6] w 1
mol/dm3 KNO3.
4. Oblicz potencjał standardowy badanego układu redoksowego oraz stałą równowagi.
5.
Sprawdź graficznie czy spełnione jest równanie Randles-Sevcik’a przygotowując
wykresy Iutl = f(c), Iutl = f(v1/2) oraz Iutl = f(c·v1/2).
6. Wyjaśnij, jaki typ reakcji redoks zaobserwowano dla tej soli (odwracalny,
nieodwracalny, quazi-odwracalny) i uzasadnij na podstawie otrzymanych wyników.
7. Przyjmując, że elektrodę stanowi dysk o średnicy 2mm oblicz współczynnik dyfuzji
D.
8. Dla wydrukowanych woltamperogramów K4[Fe(CN)6] odczytaj z wykresu Iutl, Ired, Eutl
oraz Ered (rys. 3) i porównań z wartościami otrzymanymi przy zastosowaniu programu
komputerowego.
9. Podaj położenie pików na woltamperogramie Na2[Fe(CN)5NO] i zinterpretuj wyniki z
punktu widzenia odwracalności procesu.
5
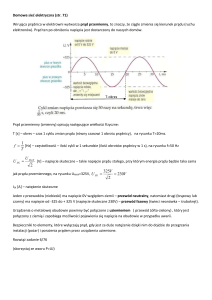
Rys. 3. Sposób wyznaczania parametrów Iutl, Ired, Eutl, Ered z krzywych
woltamperometrycznych.
Sposób graficznego wyznaczania wartości Ipa i Ipk z woltamperogramu:
Aby odczytać wartość prądu utlenienia należy:
1. narysować styczną do prostoliniowego odcinka gałęzi utlenienia woltamperogramu
(na rysunku linia B (prąd dyfuzyjny))
2. z maksimum na tej gałęzi woltamperogramu opuszczamy prostą prostopadłą do osi x
(do przecięcia się z narysowaną w pkt.1 styczną – linią B)
3. różnica wartości prądów w punktach przecięcia prostych A i B z prostopadłą do osi x
da wartość Ipa
6
Aby odczytać wartość prądu redukcji należy:
1. narysować styczną do prostoliniowego odcinka gałęzi redukcji woltamperogramu (na
rysunku linia C (prąd dyfuzyjny))
2. z minimum na tej gałęzi woltamperogramu rysujemy prostą prostopadłą do osi x (do
przecięcia się z narysowaną w pkt.1 styczną – linią C)
3. różnica wartości prądów w punktach przecięcia prostych C i D z prostopadłą do osi x
da wartość Ipk
7
Tabela 1. Zestawienie danych eksperymentalnych i wyników pomiarów metodą cyklicznej
woltamperometrii.
Kompleks
K4[Fe(CN)6]
stężenie
[mmol/dm3]
szybkość
przemiatania Ered
|Ired|
Iutl
Eutl - Ered
Eo
|Ired|/Iutl
1
potencjałem
[mV/s]
100
2
100
4
100
6
100
8
100
10
100
10
2
10
5
10
10
10
20
10
50
10
200
Na2[Fe(CN)5NO] 1
Eutl
100
[V]
[V]
[µA] [µA]
-----
-----
[mV]
[V]
------
8