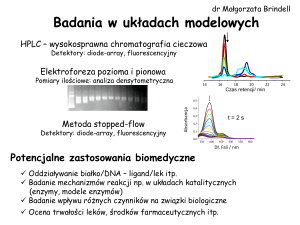
MIKROBIOLOGIA
drożdże
Cykl rozwoju
komórki drożdżowej
mechanizm podziału
i starzenia
dr inż. Aleksander Poreda, dr inż. Piotr Antkiewicz
Uniwersytet Rolniczy w Krakowie
Anna Borla, Bożena Stefaniak
Koło Naukowe Technologów Fermentacji i Mikrobiologów, UR Kraków
Już pod koniec lat 60. amerykański naukowiec Leland Hartwell zaczął wykorzystywać
możliwości metod genetyki do badań nad cyklem rozwoju komórki. Hartwell analizował drożdże
Saccharymyces cerevisiae, a dzięki serii pomysłowych eksperymentów w latach 1970-71 udało
mu się wyizolować komórki, w których geny zarządzające procesami rozwoju były zmienione
(zmutowane). W ten sposób uczony odkrył ponad 100 genów, uczestniczących bezpośrednio
w procesach regulacji rozwoju komórki, które nazwał genami CDC (cell division cycle - cykl
podziału komórki). Jeden z nich, określony przez Hartwella jako CDC28, decyduje o pierwszym
„kroku” rozpoczynającym proces podziału, nazywanym również „START”.
Około 30 lat później, w roku 2001,
Zgromadzenie Nagrody Nobla w szwedzkim
Instytucie Karolińskim postanowiło, że Leland Hartwell otrzyma z dwoma innymi naukowcami (Tim Hunt i Paul Nurse) Nagrodę
Nobla w dziedzinie medycyny i fizjologii za
odkrycie „najważniejszych regulatorów cyklu
komórkowego”. W uzasadnieniu stwierdzono, że nagrodzeni dokonali ważnych odkryć,
dotyczących mechanizmów regulujących
cykl rozwoju komórki. Ich odkrycie dotyczy
wszystkich organizmów eukariotycznych drożdży, roślin, zwierząt, a także człowieka.
„Stwierdzili oni, że zaburzenia regulacji cyklu
komórkowego mogą prowadzić do wystąpienia w chromosomach defektów spotykanych
w komórkach rakowych. W przyszłości ich
dokonania mają otworzyć nowe możliwości
leczenia nowotworów” – można przeczytać
w oficjalnym komunikacie Zgromadzenia
Nagrody Nobla.
Agro Przemysł
3/2008
Cykl życiowy komórki drożdżowej
Kultura drożdżowa zawiera komórki,
znajdujące się w określonym stadium cyklu
życiowego, który obejmuje serię wydarzeń
umożliwiających rozmnażanie wegetatywne
nazywane podziałem komórki, które polega
na przygotowaniu, wytworzeniu, i uwolnieniu
komórki potomnej. Z punktu widzenia browarnika efektywność tego procesu jest krytyczna
dla uzyskania odpowiedniej ilości biomasy
i przeprowadzania wydajnej fermentacji.
W przemyśle piwowarskim odpowiedni przyrost
biomasy ważny jest również ze względu na fakt
wielokrotnego wykorzystania gęstwy drożdżowej
do prowadzenia kolejnych fermentacji.
Cykl życiowy komórki można podzielić
na pięć faz: G0, G1, S, G2, i M (rys. 1). Pierwsza
faza (G1), poprzedzająca rozpoczęcie podziału
chromosomalnego DNA, stanowi fazę wzrostu,
podczas której komórka musi się odpowiednio
powiększyć, zanim rozpocznie się przejście
do kolejnych faz cyklu, komórka musi osiągnąć określony, minimalny rozmiar. Komórki
potomne, które jeszcze nie uległy podziałowi
są mniejsze niż komórki-matki, w związku
z czym czas trwania fazy G1 w ich przypadku
jest dłuższy. Różnica w czasie trwania fazy
G1 między komórkami potomnymi a ich komórkami-matkami nazywana jest „asymetrią
matki-córki”, dzięki czemu komórki potomne
można rozpoznać na podstawie zarówno ich
rozmiaru, jak i szybkości rozmnażania.
Rys. 1. Cykl życiowy komórki drożdżowej
(na podstawie Smart, 1999)
47
MIKROBIOLOGIA
drożdże
Po osiągnięciu przez komórkę określonej wielkości rozpoczyna się następny etap
(S). Podczas fazy S następuje synteza DNA
- podwojenie ilości materiału genetycznego
(replikacja DNA), które prowadzi do powstania kopii każdego chromosomu , natomiast
w fazie mitozy (M) dochodzi do rozdzielenia
chromosomów i podziału całej komórki na
dwie komórki potomne, które dziedziczą
identyczny garnitur chromosomów.
Po fazie M następuje podział komórki,
przy czym rozpoczęcie kolejnego cyklu
rozmnażania nie jest uzależnione od całkowitego oddzielenia się komórki potomnej.
Niepełne oddzielanie się komórki potomnej
od komórki-matki, może skutkować tworzeniem się łańcucha, charakterystycznego dla
niektórych fenotypów wybranych szczepów
drożdży browarniczych.
G1 i G2 to fazy wzrostu (ang. growth
phase), charakteryzujące się różną długością
trwania, umożliwiające wytworzenie organelli oraz prowadzenie procesów życiowych
takich jak wzrost i rozwój. W fazie (G 2)
komórka „upewnia się”, że replikacja DNA
została zakończona i przygotowuje się do
podziału. Po podziale, komórka potomna
znajduje się w fazie G1. Natomiast warto wiedzieć, że nie wszystkie komórki, które znajdą
się w pierwszej fazie - G1, automatycznie
przechodzą do następnych etapów. Niektóre
osiągają stan spoczynku (G0) – na przykład
na skutek niesprzyjających warunków środowiskowych (w tym przypadku po ponownym
nastaniu sprzyjających warunków wzrostu
mogą znowu powrócić do stanu G1 i kontynuować cykl podziału). Wejście komórki
w stan G0 może być również spowodowane
przeprowadzeniem wszystkich „zaprogramowanych” dla danej komórki podziałów,
czyli naturalnie wyczerpaną zdolnością do
dalszej reprodukcji – w tym przypadku jest
to przejście nieodwracalne.
Długość czasu potrzebnego na odbycie
pełnego cyklu rozwoju jest różna dla różnych
typów komórek. Większość komórek ssaków
potrzebuje na to od 10 do 30 godzin, natomiast drożdże wymagają ok. 2h na przeprowadzenie cyklu podziału.
komórkowej – cała synteza ściany następuje
od razu w komórce potomnej. Na tym etapie
mamy do czynienia ze wzrostem wzdłuż
dłuższej osi pączka (etap II). Po osiągnięciu
rozmiaru ok. 2/3 komórki-matki, pączek
zaczyna wzrastać we wszystkich kierunkach,
a materiał ściany komórkowej jest rozkładany równomiernie na całej powierzchni pączka
(III). Podczas odłączania pączka następuje
synteza ściany komórkowej od wewnętrznej
strony komórki-matki, w miejscu oddzielania się pączka (etap IV). Linia przerywana
wskazuje obecność chityny, która w komórce
potomnej syntezowana jest głównie dopiero
po cytokinezie.
dostępności składników odżywczych i prawidłowego zakończenia poprzedniego cyklu.
Na podstawie wyników swoich prac Hartwell
sformułował pojęcie „punktu kontrolnego”,
tzn. zatrzymania cyklu komórkowego w sytuacji, gdy DNA zostało uszkodzone. Dzięki
temu mechanizmowi komórka zyskuje czas
na naprawę łańcucha DNA przed wejściem
w następną fazę cyklu, która następuje
dopiero po potwierdzeniu bezbłędnego
zakończenia poprzedniego etapu.
Ważnym dla sukcesu całego procesu
podziału jest uzyskanie przez komórkę potomną prawidłowej liczby chromosomów.
W organizmach wyższych wszystkie rodzaje
Rys. 2. Biosynteza ściany komórkowej podczas podziału komórki (na podstawie Smits i in., 2001)
Regulacja cyklu komórki
Pod koniec fazy G1, przed zainicjowa-
Drożdże Saccharomyces cerevisiae regulują swój cykl życiowy przy pomocy złożonego systemu sieci genów. Ponad sto genów
tego systemu odkrył Leland Hartwell, nazywając je cdc (ang. cell division cycle) – geny
cyklu podziału komórki. Podczas etapu G1
znaczącą rolę odgrywa gen cdc28, decydujący o rozpoczęciu całego ciągu przemian,
z uwagi na jego rolę nazywa się go również
genem START. Po przejściu przez etap START,
zewnętrzne czynniki środowiskowe, takie jak
stres czy brak składników odżywczych nie są
już w stanie powstrzymać procesu podziału.
Podczas fazy logarytmicznego wzrostu liczba
komórek które przeszły przez ten etap jest
porównywalna do liczby pozostałych komórek. Niemożność przejścia przez punkt START
skutkuje ograniczeniem podziału komórek
i wejściem kultury w stacjonarną fazę
wzrostu, nazwaną G0. Przejście do fazy G0
może być wywoływane, między innymi,
komórek rakowych charakteryzują się właśnie nieprawidłową liczbą chromosomów.
Także wiele wad wrodzonych związanych
jest z niezachowaniem określonej dla danego
organizmu liczby chromosomów.
Paul Nurse, podobnie jak Hartwell,
badał cykl rozwoju komórki przy użyciu
metod genetycznych. W swoich eksperymentach wykorzystywał komórki drożdży
Schizzosaccharomyces pombe. W połowie
lat 70. Nurse odkrył w komórkach S. pombe
gen cdc2 , a następnie opisał złożoną rolę,
jaką produkt tego genu odgrywa w procesie
regulacji cyklu komórkowego (np. przejście
z fazy G2 do M, ale także - analogicznie
jak gen cdc28 odkryty przez Hartwella
– z G1 do S). W ten sposób ustalono, że
cdc2 reguluje różne fazy cyklu komórkowego. W 1987 r. Nurse odkrył odpowiadający
mu gen w organizmie człowieka, nazwany
później CDK1 (ang. cyclin-dependent kinase - kinaza zależna od cykliny 1). Gen
niem nowego cyklu podziału na wewnętrznej
powierzchni komórki pojawia się oczko
chitynowe, wskazujące na miejsce powstawania pączka (rys. 2, etap I). Podczas
wzrostu pączka w komórce-matce nie jest
gromadzony materiał budulcowy ściany
przez niekorzystne warunki otoczenia, np.
wyczerpanie składników odżywczych.
Szybkość rozmnażania jest determinowana przez wzrost pojedynczej komórki.
Zapoczątkowanie nowego cyklu podziału
jest zależne od rozmiaru komórki, jej wieku,
CDK1 koduje białko należące do klasy tzw.
kinaz zależnych od cykliny. Nurse wykazał,
że aktywacja tych białek jest związana
z procesami odwracalnej fosforylacji (przyłączania grup fosforanowych do cząsteczki
białka lub ich odłączania).
Biosynteza ściany komórkowej
podczas cyklu komórkowego
48
3/2008
Agro Przemysł
MIKROBIOLOGIA
drożdże
Liczba
przeprowadzonych
podziałów
Średnica komórki
[µm]
Powierzchnia
komórki
[µm2]
Objętość komórki
[µm3]
0
6,4
133,9
153,6
2
7,4
172,1
214,3
4
8,2
212,7
294,0
6
8,7
239,1
348,9
8
9,0
257,4
390,1
Tab. 1. Zmiany w komórkach drożdżowych związane z procesem starzenia
Pierwszą cyklinę odkrył na początku lat
80. Tim Hunt. Cykliny to białka, które powstają i ulegają rozkładowi podczas każdego
cyklu komórkowego. Nazwa odzwierciedla
charakterystyczne cykliczne zmiany ich
stężenia w przebiegu jednego cyklu. Wiążą
się one z cząsteczkami CDK, regulując ich
aktywność i wybierając te cząsteczki, które
zostaną poddane fosforylacji. Cykliczny rozkład cząsteczek białek to mechanizm regulacyjny o ważnym ogólnym znaczeniu dla cyklu
komórkowego organizmów żywych.
Koordynacja poszczególnych faz rozwoju komórki ma podstawowe znaczenie
dla rozwoju wszystkich organizmów eukariotycznych. Konieczne jest zachowanie
prawidłowej sekwencji etapów rozwoju oraz
zakończenie jednej fazy przed rozpoczęciem
następnej. Wynikiem błędów koordynacji
mogą być zmiany polegające na utracie
całych chromosomów lub ich fragmentów,
zamianie miejscami lub nierównym ich rozłożeniu w komórkach potomnych. Takie zmiany
na poziomie chromosomów często spotyka
się w komórkach nowotworowych.
Starzenie się
– genetyczna regulacja procesu
Starzenie się to uniwersalna cecha, charakteryzująca wszystkie organizmy eukariotyczne. Mechanizm starzenia się i zamierania
drożdży nie jest do końca poznany. Najwcześniejsze hipotezy odnosiły się do zależności
między wstrzymaniem podziału komórki
a stosunkiem powierzchni do objętości.
Wykazywano, że wraz z postępem wieku
komórka drożdżowa rośnie, a po osiągnięciu
krytycznego rozmiaru rozpoczyna się proces
starzenia. Niektórzy naukowcy wykazali, że
zbyt duża liczba blizn pączkowych może
ograniczać powierzchnię do występowania
nowych pączków, a także wymianę związków odżywczych z otoczeniem. Te badania
nie zostały jednak potwierdzone przez inne
ośrodki badawcze, w których udowodniono, że wzrost stężenia chityny (głównego
składnika blizn) w drożdżach mutowanych
genetycznie nie miał wpływu na ich długość
Agro Przemysł
3/2008
życia. Można więc uznać, że rozmiar komórki
oraz liczba blizn, jako takie nie stanowią
głównej przyczyny procesu starzenia, ale są
ubocznymi skutkami postępu cyklu życiowego komórki. Oprócz tego następuje wiele
innych zmian towarzyszących procesowi
starzenia (tab. 1).
Proces starzenia związany jest z liczbą
podziałów danej komórki, a jego postęp
może być mierzony liczbą blizn na powierzchni komórki, wywołanych oddzieleniem się
pączka. W ostatnich latach wzrasta liczba
zwolenników teorii o genetycznej kontroli
procesu starzenia komórek drożdżowych.
Sugeruje się, że starzenie komórki zachodzi
poprzez genetyczną inhibicję tworzenia
białek i enzymów niezbędnych w metabolizmie, takich jak enzymy naprawiające DNA
czy też antyoksydanty. Możliwe również,
że dochodzi do aktywacji genów dających
białka bezpośrednio ograniczające syntezę
DNA. Dotychczas zidentyfikowano już kilka
genów (dokładny opis w Powell i in., 2000),
z których wymienić należy LAG1 i LAG2 (ang.
Longevity Assurance Gene), których wysoka
ekspresja znacznie wydłuża życie komórki,
natomiast ograniczenie ich ekspresji, ma
skutek odwrotny.
Zmiany fizjologiczne
związane ze starzeniem
W konsekwencji starzenia się w komórkach drożdży dochodzi do pewnych
modyfikacji. Mogą one mieć charakter
fizjologiczny, genetyczny, metaboliczny
i morfologiczny. Zmiany fizjologiczne,
kojarzone ze starzeniem są szczególnie
dostrzegalne na powierzchni komórki
i obejmują w szczególności strukturalne
modyfikacje ściany komórkowej, które
mogą wskazywać na wiek komórki. Ściana
komórki jest wysoce dynamiczną strukturą, w której, w miarę wzrostu i rozwoju,
może dochodzić do permanentnych zmian,
zarówno jeśli chodzi o jej właściwości jak
i określone funkcje. Zachodzące równolegle
ze starzeniem komórki modyfikacje ściany
komórkowej, obejmują wzrost rozmiaru,
marszczenie powierzchni komórki w wyniku spadku turgoru i zmianę w składzie
chemicznym ściany komórkowej. Ściana
komórkowa składa się z glukanu, mannanu
oraz małej ilości protein, lipidów i chityny.
Chityna, drugorzędny składnik ściany
komórkowej, jest w głównej mierze ulokowany po stronie wyłaniającego się pączka
i jest produkowana w okresie bezpośrednio
poprzedzającym, a także w trakcie trwania
podziału komórkowego. Komórki S. cerevisiae mogą przed śmiercią ulegać podziałowi około 30-50 razy, w konsekwencji czego,
poziom chityny wzrasta stale przez cały
okres życia. Po cytokinezie na powierzchni
komórki-matki powstaje blizna pączkowa
(fot. 1), która składa się prawie wyłącznie
z kompleksów chitynowo - glukanowych
wzmocnionych przez warstwę glukanowo
– mannanową. Komórki potomne utrzymują mniej wystającą strukturę, znaną jako
blizna porodowa (birth-scar). Wykazano,
że blizna ta zawiera mało lub w ogóle nie
zawiera chityny, ale dokładna jej struktura nie jest jeszcze poznana. Ilość blizn
pączkowych na powierzchni komórki jest
funkcją podziałów, dlatego ich policzenie
umożliwia ustalanie przeciętnego wieku
komórek w populacji.
Fot. 1 Komórki drożdży – oddzielanie
się komórki potomnej i widoczne blizny
pączkowe na powierzchni komórki-matki
Śmierć komórki
Śmierć komórki może nastąpić na dwa
odrębne sposoby: zejściem nekrotycznym
(martwica) lub zaprogramowaną - śmiercią
naturalną. Nekrozę definiujemy jako nagromadzenie nienaprawialnych zniszczeń
wewnątrzkomórkowych składników komórki,
wpływających na jej integralność, prowadzących do śmierci lub autolizy komórki.
Tego typu zniszczenia następują jako efekt
nadmiernego - jednokrotnego oddziaływania
czynników stresowych, czy też powtarzalnego oddziaływania łagodnych czynników
stresowych. Natomiast zejście naturalne
jest wynikiem kontrolowanych genetycznie
przemian, prowadzących ze stanu młodości
do starości, związanych z przeprowadzeniem
„zaprogramowanej” liczby podziałów danej
komórki (rys. 3).
49
MIKROBIOLOGIA
drożdże
Rys. 3 Model ilustrujący przejście ze stanu dziewiczej komórki potomnej do stanu niezdolności do dalszego podziału
Starzenie się drożdży
piwowarskich
Drożdże Saccharomyces cerevisiae
posiadają ograniczoną długość życia, determinowaną przez zdolność do rozmnażania.
Każda komórka w populacji posiada zdolność
do przeprowadzenia określonej, ograniczonej
liczby podziałów. Wykazano, że zarówno
drożdże dolnej jak i górnej fermentacji charakteryzują się ograniczoną, poprzez liczbę
podziałów, długością życia, która zależy od
szczepu, a mieści się w granicach 10-30
podziałów. Po określeniu średniej długości
życia, mierzonej możliwą liczbą podziałów
komórki danego szczepu, można poczynić
pewne założenia co do technologicznej
przydatności danego szczepu. Na przykład
szczepy o niskiej liczbie Hayflicka nie nadają
się zbytnio do systemów ciągłych lub immobilizowanych. W każdym z wymienionych
typów technologii następuje wprawdzie
Cecha/parametr
Rozmiar komórki
Kształt komórki
Liczba blizn pączkowych
Stężenie chityny w ścianie komórkowej
Rozmiar wakuoli
Poziom rRNA
Synteza białek
Aktywność rybosomów
Czas trwania cyklu – generacji komórki
Marszczenie powierzchni
Spadek turgoru
Liza komórek
podział komórek, jednak komórki potomne
mają tendencję do bycia wypłukiwanymi
z reaktora. Z uwagi na fakt, że duża część
młodych komórek jest ciągle usuwana, pozostała populacja staje się coraz starsza.
W odniesieniu do drożdży browarniczych
główną zmianą w fizjologii komórek, związaną ze starzeniem, jest wzrost rozmiarów
(tab. 2). W związku z szybszą sedymentacją
komórek większych (starszych), może dochodzić do sytuacji rozwarstwienia wiekowego
i usuwania poszczególnych frakcji wiekowych podczas kolejnych obciągów gęstwy
ze stożka tankofermentora.
Z uwagi na fakt różnicy w ekspresji poszczególnych genów w zależności od wieku
komórki, właściwe zbalansowanie wiekowe
gęstwy pobieranej do przeprowadzenia
kolejnej fermentacji gwarantować będzie
optymalny przebieg procesu. Natomiast nieTyp zmiany
Wzrost
Zmieniony
Wzrost
Wzrost
Wzrost
Wzrost
Ograniczona
Ograniczona
Wzrost
Wzrost
-
Tab. 2 Zmiana rozmiarów komórek drożdżowych jako funkcja wieku
(średnia z pomiaru 30 komórek)
50
odpowiednie przesunięcie ciężaru w stronę
komórek zbyt młodych lub zbyt starych,
może wpływać na kilka parametrów metabolicznych, docelowo negatywnie oddziaływując zarówno na wydajność fermentacji jak
i jakość produktu finalnego.
Podsumowując, należy stwierdzić,
że starzenie się komórek drożdżowych
szczepów browarniczych może wpływać na
przebieg procesu fermentacji, a odpowiednie
zarządzanie gęstwą, a w szczególności dobór
parametrów jej odbierania z CKT pozwala na
wybór profilu wiekowego populacji używanej do kolejnych rzutów fermentacyjnych.
Tej kwestii zostanie poświęcony oddzielny
artykuł.
Literatura
1. Górnicz M., Stankiewicz M., Medyczny Nobel
2001, Gazeta Lekarska, 11, 2001,
2. Hartwell L.H., Saccharomyces cerevisiae cell
cycle, Bacteriology Reviews, 38, 164-198,
1974.
3. Lew D.J., Reed S.I., A cell cycle checkpoint
monitors cell morphoogenesis in budding yeast,
Current Opinions in Genetic Dev, 129, 739-740,
1995.
4. Mortimer R.K., Johnston J.R., Life span of individual yeast cells, Nature, 183, 1751-1752,
1959.
5. Powell C.D., Quain D.E., Smart K.A., Chitin
scar breaks in aged Saccharomyces cerevisiae,
Microbiology, 149, 3129-3137, 2003.
6. Powell C.D., Van Zandycke S.M., Quain D.E.,
Smart K.A., Replicative ageing and senescence
in Saccharomyces cerevisiae and the impact
on brewing fermentations, Microbiology, 146,
1023-1034, 2000.
7. Smart K.A., Ageing In brewing yeast, Brewers,Guardian, 128, 19-24, 1999.
8. Smits G.J., Ende H., Klis F.M., Differential regulation of cell wall biogenesis during growth
and development in yeast, Microbiology, 147,
781-794, 2001.
3/2008
Agro Przemysł