Wymagania edukacyjne z chemii dla klas pierwszych gimnazjum niezbędne do uzyskania poszczególnych rocznych ocen klasyfikacyjnych
Klasy I B, I E
Rok szkolny 2016/2017
Do uzyskania poszczególnych rocznych ocen klasyfikacyjnych obowiązują wszystkie wymagania edukacyjne do ocen śródrocznych, oraz:
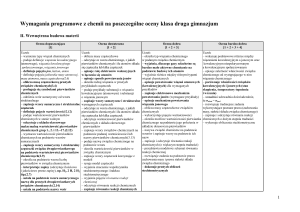
II. Wewnętrzna budowa materii (Pp: 1/3, 2/1-8,12-14, 3/2,4)
Nauczyciel: Krystyna Rypel
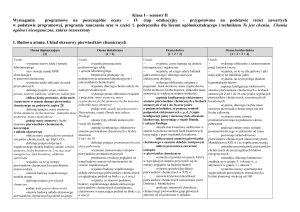
Ocena dopuszczająca
[1]
Ocena dostateczna
[1 + 2]
Ocena dobra
[1 + 2 + 3]
Ocena bardzo dobra
[1 + 2 + 3 + 4]
Ocena celująca
[1+2+3+4+5]
Uczeń:
– definiuje pojęcie materia
– opisuje ziarnistą budowę materii
– opisuje, czym różni się atom od cząsteczki
– definiuje pojęcia jednostka masy atomowej, masa
atomowa, masa cząsteczkowa
– odczytuje z układu okresowego masę atomową
i zaokrągla ja do liczb całkowitych
– oblicza masę cząsteczkową związków chemicznych
(dla prostych przykładów)
– opisuje i charakteryzuje skład atomu pierwiastka
chemicznego (jądro: protony i neutrony oraz
wokół jadra elektrony), wie, że atom jest
elektrycznie obojętny
– definiuje pojęcie elektrony walencyjne
– wyjaśnia, co to jest liczba atomowa, liczba
masowa
– odczytuje liczbę atomową z układu okresowego
– ustala liczbę protonów, elektronów, neutronów
w atomie danego pierwiastka chemicznego, gdy
znane są liczby atomowa i masowa
– definiuje pojęcie izotop
– dokonuje podziału izotopów
– opisuje układ okresowy pierwiastków
chemicznych
– podaje prawo okresowości
– podaje, kto jest twórcą układu okresowego
pierwiastków chemicznych
– odczytuje z układu okresowego podstawowe
informacje o pierwiastkach chemicznych
– odróżnia wzór sumaryczny od wzoru
strukturalnego
– zapisuje wzory sumaryczne i strukturalne
cząsteczek
Uczeń:
– wyjaśnia zjawisko dyfuzji
– podaje założenia teorii atomistyczno- cząsteczkowej budowy materii
– zna rodzaje cząsteczek
– oblicza masy cząsteczkowe
– definiuje pojęcie pierwiastek chemiczny
– wymienia rodzaje izotopów
– wyjaśnia różnice w budowie atomów
izotopów wodoru
– wymienia dziedziny życia, w których stosuje
się izotopy
– korzysta z układu okresowego pierwiastków
chemicznych
– zna związek pomiędzy budową atomu,
a położeniem pierwiastka w układzie
okresowym
– wykorzystuje informacje odczytane z układu
okresowego pierwiastków chemicznych
– podaje maksymalną liczbę elektronów na
poszczególnych powłokach (K, L, M)
– zapisuje konfiguracje elektronowe
– rysuje proste przykłady modeli atomów
pierwiastków chemicznych
– zapisuje wzory sumaryczne i strukturalne
wymaganych cząsteczek
– odczytuje wartościowość pierwiastków
chemicznych z układu okresowego
pierwiastków
– podaje wartościowość pierwiastków
chemicznych w stanie wolnym
– wyznacza wartościowość pierwiastków
chemicznych na podstawie wzorów
sumarycznych
Uczeń:
– planuje doświadczenie potwierdzające
ziarnistość budowy materii
– wyjaśnia różnice między pierwiastkiem
a związkiem chemicznym na podstawie
założeń teorii atomistyczno-cząsteczkowej
budowy materii
– wymienia zastosowania izotopów
– korzysta swobodnie z informacji
zawartych w układzie okresowym
pierwiastków chemicznych
– oblicza maksymalną liczbę elektronów na
powłokach
– zna maksymalna liczbę elektronów
walencyjnych w atomie
– na podstawie modeli atomów ( lub
konfiguracji elektronowej) rozpoznaje
dany atom
– rysuje modele atomów (trudniejsze
przypadki)
– opisuje sposób powstawania jonów
– wykorzystuje pojęcie wartościowości do
rozwiązywania zadań
– określa możliwe wartościowości
pierwiastka chemicznego na podstawie
jego położenia w układzie okresowym
pierwiastków
– zapisuje i odczytuje równania reakcji
chemicznych
– przedstawia modelowy schemat równania
reakcji chemicznej
Uczeń:
– podaje zależność pomiędzy atomowa
jednostką masy, a masą atomu
wyrażona w gramach
– definiuje pojęcie: masa atomowa
jako średnia masa atomowa danego
pierwiastka chemicznego
z uwzględnieniem jego składu
izotopowego
– wyjaśnia związek między
podobieństwami właściwości
pierwiastków chemicznych zapisanych
w tej samej grupie układu okresowego
a budową ich atomów i liczbą
elektronów walencyjnych
– uzasadnia, że msubstr = mprod
– rozwiązuje trudniejsze zadania
wykorzystujące poznane prawa
(zachowania masy, stałości składu
związku chemicznego)
– zapisuje i odczytuje równania reakcji
chemicznych o większym stopniu
trudności
– wykonuje obliczenia
stechiometryczne
– rozwiązuje zadania wymagające
zastosowania nabytej wiedzy do
rozwiązywania problemów
Uczeń:
– oblicza zawartość
procentową izotopów
w pierwiastku chemiczny
– przelicz masy atomowe
(z unitów na gramy)
– określa, na czym polega
promieniotwórczość
naturalna i sztuczna
– rozwiązuje zadania
związane z pojęciem
średniej masy atomowej
– dokonuje obliczeń
z wykorzystaniem wiedzy
jednostce masy atomowej,
masy atomowej
i cząsteczkowej
– dokonuje obliczeń na
podstawie równania
reakcji chemicznej
– stosuje zdobytą wiedzę
w złożonych zadaniach,
nietypowych, jest twórczy
– pogłębia swoją wiedzę
korzystając z różnych
źródeł
– definiuje pojęcie wartościowość
– odczytuje z układu okresowego maksymalną
wartościowość pierwiastków chemicznych grup
1., 2. i 13.- 17.
– wyznacza wartościowość pierwiastków
chemicznych na podstawie wzorów strukturalnych
– zapisuje wzory sumaryczny i strukturalny cząsteczki
związku składającego się z dwóch pierwiastków na
podstawie wartościowości pierwiastków
chemicznych
– określa na podstawie wzoru liczbę pierwiastków
w związku chemicznym
– interpretuje zapisy (odczytuje ilościowo i
jakościowo proste zapisy), np. H2, 2 H, 2 H2
– ustala na podstawie wzoru sumarycznego nazwę
dla prostych związków chemicznych składających
się z dwóch pierwiastków
– ustala na podstawie nazwy wzór sumaryczny
związków chemicznych składających się z dwóch
pierwiastków
– odczytuje ze wzoru chemicznego, z jakich
pierwiastków chemicznych i ilu atomów składa się
cząsteczka lub kilka cząsteczek
– podaje treść prawa stałości składu związku
chemicznego
– zna pojęcia równanie reakcji chemicznej,
współczynnik stechiometryczny
– rozróżnia podstawowe typy reakcji chemicznych
– dobiera współczynniki w prostych przykładach
równań reakcji chemicznych
– zapisuje proste przykłady równań reakcji
chemicznych
– odczytuje proste równania reakcji chemicznych
– podaje treść prawa zachowania masy
– przeprowadza proste obliczenia z wykorzystaniem
prawa zachowania masy
– nazywa związki chemiczne na podstawie
wzorów i zapisuje wzory sumaryczne
i strukturalnych związków na podstawie ich
nazw (trudniejsze przypadki)
– określa wartościowość pierwiastków
w związku chemicznym
– zapisuje wzory cząsteczek korzystając
z modeli
– rysuje model cząsteczki
– wyjaśnia znaczenie współczynnika
stechiometrycznego i indeksu
stechiometrycznego
– zapisuje i dobiera współczynniki
w równaniach reakcji chemicznych
– odczytuje równania reakcji chemicznych
– przeprowadza proste obliczenia
z wykorzystaniem prawa stałości składu
związku chemicznego
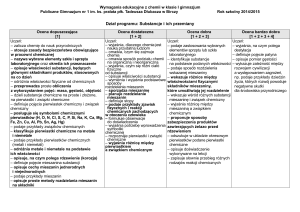
Sposoby sprawdzania osiągnięć edukacyjnych uczniów:
1. Bieżące sprawdzanie osiągnięć edukacyjnych ucznia, będące podstawą ustalania ocen bieżących w skali, o której mowa w § 52 Statutu Gimnazjum
w Niepołomicach, odbywa się w następujących formach:
1) wypowiedzi ustne obejmujące materiał nauczania jednej, dwóch lub trzech ostatnich lekcji;
2) wypowiedzi ustne obejmujące materiał nauczania jednego lub więcej działów programowych, zapowiadane według zasad ustalonych dla sprawdzianów
pisemnych;
3) kartkówki – krótkie pisemne sprawdziany trwające nie dłużej niż 15 minut i obejmujące materiał nauczania z jednej, dwóch lub trzech ostatnich lekcji;
4) kartkówki – krótkie pisemne sprawdziany trwające nie dłużej niż 15 minut i obejmujące wskazany, ściśle określony przez nauczyciela materiał nauczania nie
większy niż jeden dział programowy;
5) sprawdziany pisemne obejmujące materiał nauczania jednego lub więcej działów programowych;
6) ćwiczenia i zadania praktyczne;
7) ćwiczenia i zadania wykonane na lekcji;
8) ćwiczenia i zadania wykonane w domu;
2. Sprawdzian pisemny, o którym mowa w pkt 5, nauczyciel wpisuje do dziennika lekcyjnego oraz informuje uczniów o jego zakresie, formie i terminie z co najmniej
tygodniowym wyprzedzeniem. Każdy sprawdzian pisemny powinien być poprzedzony powtórzeniem wiadomości i podaniem wymagań jakim uczeń będzie musiał sprostać.
3. Kartkówki, o których mowa w pkt 3, nie wymagają zapowiadania.
5. O kartkówkach, o których mowa w pkt 4, nauczyciel informuje uczniów z tygodniowym wyprzedzeniem.
6. Sprawdziany pisemne i kartkówki mogą mieć formę testu.
7. W ciągu tygodnia mogą być przeprowadzone najwyżej trzy pisemne sprawdziany i nie więcej niż jeden w danym dniu.