WYDZIAŁ LEKARSKI II
Nazwa
kierunku
Nazwa
przedmiotu
Biotechnologia, specjalność
Biotechnologia Medyczna
Poziom i forma
studiów
Biochemia II
Punkty ECTS
Jednostka
realizująca
Katedra i Zakład Biochemii i
Biologii Molekularnej
Osoba odpowiedzialna
(imię, nazwisko, email, nr tel.
służbowego)
Rodzaj
przedmiotu
Obszar
nauczania
obowiązkowy
Rodzaj zajęć
i liczba godzin
IV
I stopień
stacjonarne
5
wykłady
14
Prof. dr hab. n. biol. Paweł
Jagodziński
[email protected],
(61) 8546519
ćwiczenia
seminaria
11
40
P1A, M1
C1. Przekazanie wiedzy dotyczącej przemian głównych grup związków chemicznych na poziomie
molekularnym.
C2. Zrozumienie współzależności przemian i końcowego utleniania produktów katabolizmu białek,
węglowodanów i tłuszczów.
C3. Omówienie specyfiki metabolizmu niektórych narządów i tkanek w gospodarce energetycznej
organizmu.
C4. Omówienie podstawowych technik laboratoryjnych stosowanych w pracowni biochemicznej.
Cel kształcenia
C5. Ćwiczenie umiejętności stosowania właściwych technik laboratoryjnych w analizie
biochemicznej.
C6. Rozwijanie i kształtowanie umiejętności poszukiwania i przekształcania informacji w zakresie
procesów biochemicznych.
C7. Uświadomienie konieczności stałego poszerzania wiedzy dotyczącej biochemicznych podstaw
integralności organizmu ludzkiego.
C8. Wypracowanie umiejętności zespołowego opracowywania zagadnień.
Wykłady
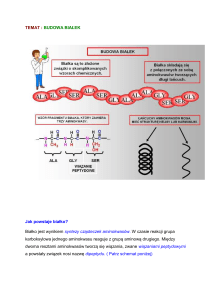
1. Budowa i funkcja peptydów oraz hormonów polipeptydowych i białkowych
Treści
programowe
Glutation i jego metabolizm.
Hormony uwalniające podwzgórza
Hormony przedniego płata przysadki mózgowej
Hormony tylnego płata przysadki mózgowej
Biologicznie czynne peptydy: angiotensyny, insulina, glukagon, parathormon.
2. Cholesterol i jego pochodne biologicznie czynne (kwasy żółciowe, cholekalcytriol i jego
pochodne hydroksylowane): metabolity i enzymy biosyntezy, regulacja biosyntezy
3. Hormony steroidowe
Cholesterol jako substrat dla syntezy hormonów steroidowych
Hormony steroidowe kory nadnerczy (mineralokortykoidy, glukokortykoidy i androgeny
nadnerczowe): metabolity i enzymy biosyntezy, regulacja biosyntezy, transport w osoczu krwi:
białka wiążące i regulacja ich syntezy.
Hormony płciowe (androgeny i estrogeny)
Hormony ciałka żółtego (progestyny)
Mechanizm działania hormonów steroidowych w komórkach docelowych
Genetycznie uwarunkowane nieprawidłowości przemian i mechanizmu działania hormonów
steroidowych.
4. Utleniania biologiczne
Cykl kwasu cytrynowego: metabolity i enzymy, źródła acetylo-CoA i szczawiooctanu,
włączanie aminokwasów do cyklu, wytwarzanie równoważników redukcyjnych, znaczenie
cyklu dla integracji metabolizmu komórki.
Łańcuch oddechowy: źródła równoważników redukcyjnych, struktura poszczególnych ogniw
łańcucha oddechowego, transport elektronów i jego inhibitory, miejsca sprzężenia transportu
elektronów z syntezą ATP, fosforylacja oksydacyjna (hipoteza chemiosmotyczna, inhibitory).
5. Biochemia tkanek
Stres oksydacyjny: (a) mechanizm działania i wytwarzania reaktywnych form tlenu RFT, (b)
mechanizmy obrony antyoksydacyjnej, (c) molekularne mechanizmy naprawy uszkodzeń
DNA spowodowanych przez RFT, (d) stres oksydacyjny i zaburzenia rozwoju płodu, (e)
wolnorodnikowa teoria starzenia się.
Biosynteza i funkcje tlenku azotu (NO).
Biochemia tkanki łącznej: (a) podłoże biochemiczne procesów zachodzących w tkance łącznej,
(b) budowa i funkcje kolagenu, elastyny, fibronektyny i lamininy, (c) budowa kości, (d)
dziedziczne choroby tkanki łącznej.
Ćwiczenia
1. Metody rozdziału białek i oznaczanie stężenia glukozy we krwi
Frakcjonowanie białek surowicy krwi za pomocą elektroforezy w żelu agarozowym.
Oznaczanie stężenia glukozy we krwi pełnej metodą enzymatyczną.
2. Preparatyka i analiza tłuszczów
Celem ćwiczenia jest oznaczenie składu lipidów pochodzących z osocza krwi i żółtka jaja
kurzego oraz analiza składu kamieni żółciowych.
Obejmuje ono metody izolacji lipidów: ekstrakcji, frakcjonowania za pomocą
rozpuszczalników, rozdzielania za pomocą chromatografii cienkowarstwowej,
identyfikacji rozdzielonych grup lipidów, badanie właściwości fizykochemicznych lipidów
złożonych oraz identyfikacji poszczególnych grup.
Seminaria
1. Wybrane białka ustroju
Budowa, właściwości i funkcja mioglobiny.
Hemoglobina jako białko transportowe
Substraty biosyntezy hemu i jej regulacja (enzymy, kofaktory).
Zaburzenia syntezy części białkowej hemoglobiny. Hemoglobiny nieprawidłowe
(talasemie, HbS, HbM, HbC) oraz mechanizmy leżące u podstaw hemoglobinopatii.
Katabolizm hemu i wydalanie produktów jego przemiany
Białka osocza krwi
Białka tkanki łącznej (kolagen i elastyna) i mięśni szkieletowych (aktyna, miozyna i
troponina).
2. Metabolizm mono- i disacharydów
Transport cukrów prostych przez błony komórkowe
Glikoliza: lokalizacja enzymów glikolitycznych w komórkach i tkankach, regulacja
aktywności kluczowych enzymów glikolizy, bilans energetyczny glikolizy w warunkach
tlenowych i beztlenowych.
Cykl pentozofosforanowy: lokalizacja enzymów w komórkach i tkankach, przebieg reakcji
w warunkach zapotrzebowania komórki na równoważniki redukcyjne i w warunkach
zapotrzebowania na pentozy, rola NADPH w procesach biosyntez.
Glukoneogeneza: substraty dla glukoneogenezy (mleczan, alanina i inne aminokwasy
glukogenne, glicerol), reakcje glukoneogenezy i ich lokalizacja.
Przemiana fruktozy: włączenie w przemiany glukozy w wątrobie i w tkankach
obwodowych, szlak sorbitolowy i jego znaczenie.
Przemiana galaktozy: enzymy fosforylujące, synteza laktozy.
Zaburzenia przemiany cukrów prostych: galaktozemia, fruktozuria, wrodzona nietolerancja
fruktozy, zaćma cukrzycowa oraz niedobór dehydrogenazy glukozo-6-fosforanowej w
krwince czerwonej.
3. Metabolizm polisacharydów
Lokalizacja i specyficzność substratowa enzymów trawiących węglowodany w przewodzie
pokarmowym.
Metabolizm glikogenu: glikogeneza, glikogenoliza i regulacja hormonalna przemian
glikogenu.
Synteza prekursorów glikozaminoglikanów: synteza i wykorzystanie UDP-glukuronianu,
biosynteza aminocukrów
Synteza proteoglikanów i glikoprotein: (a) struktura, podział, funkcja, (b) miejsce syntezy
części białkowej i glikozylacji w komórce, (c) tworzenie wiązań O glikozydowych i N
glikozydowych, rola estrów fosforanowych dolicholu, (d) nieprawidłowości syntezy i
rozpadu glikoprotein jako przyczyny wielu chorób.
Zaburzenia metabolizmu wielocukrów: (a) choroby spichrzeniowe, (b)
mukopolisacharydozy.
4. Metabolizm kwasów tłuszczowych
Synteza nasyconych i nienasyconych kwasów tłuszczowych (enzymy i kofaktory)
Regulacja syntezy kwasów tłuszczowych
Utlenianie kwasów tłuszczowych nasyconych i nienasyconych (β oksydacja): aktywacja
kwasów tłuszczowych, rola karnityny (enzymy i translokaza), etapy procesu β oksydacji
(enzymy i kofaktory), bilans energetyczny β oksydacji.
Ketogeneza: (a) reakcje i miejsce syntezy ciał ketonowych, (b) reakcje umożliwiające
utylizację ciał ketonowych przez tkanki pozawątrobowe.
Współzależność pomiędzy metabolizmem kwasów tłuszczowych i glukozy.
5. Biosynteza i degradacja lipidów
Główne miejsca i szlaki biosyntezy TAG (tkanka tłuszczowa, wątroba, ściana jelita): (a)
źródła i aktywacja substratów, (b) enzymy uczestniczące w poszczególnych etapach
syntezy.
Lipoliza TAG: (a) enzymy lipolityczne przewodu pokarmowego, (b) lipaza lipoproteinowa
(osocze krwi), (c) lipaza hormonozależna tkanki tłuszczowej, (d) mechanizmy regulujące
wielkość lipolizy.
Biosynteza i degradacja fosfoglicerydów: biosynteza de novo, modulacja składu kwasów
tłuszczowych oraz zasad azotowych, udział poszczególnych fosfolipaz w metabolizmie
komórkowym oraz rola produktów działania fosfolipaz
Biosynteza i degradacja sfingolipidów: (a) synteza ceramidu jako substratu dla biosyntezy
sfingomieliny, cerebrozydów, sulfatydów i gangliozydów, (b) aktywne nośniki substratów:
UDP-pochodne cukrów, fosfoadenozyno-fosfosiarczan, cytydyloneuraminian, (c)
sfingolipidozy.
6. Transport lipidów w osoczu krwi
Formy występowania tłuszczowców w materiale biologicznym: klasyfikacja lipoprotein,
struktura, skład lipidowy i białkowy lipoprotein (apoproteiny).
Zmiany stężenia składników lipidowych osocza po posiłkach oraz w okresie głodzenia.
Formy transportowe lipidów osocza (lipoproteiny): (a) rola poszczególnych lipoprotein w
międzynarządowym transporcie TAG, cholesterolu oraz wolnych kwasów tłuszczowych,
(b) powstawanie lipoprotein oraz ich wydzielanie do osocza.
Metabolizm chylomikronów oraz lipoprotein o bardzo małej gęstości (VLDL): lipaza lipoproteinowa oraz jej kofaktory (Apo CII, fosfolipidy) i regulacja aktywności.
Udział wątroby oraz tkanki tłuszczowej w metabolizmie TAG, transport w osoczu i
wychwytywanie wolnych kwasów tłuszczowych przez tkanki.
Metabolizm lipoprotein o małej (LDL) oraz dużej gęstości (HDL): (a) transport i
wychwytywanie cholesterolu z krążenia, (b) przebieg oraz rola reakcji katalizowanej przez
acylo-transferazę lecytyna : cholesterol (LCAT), (c) rola HDL w odwrotnym transporcie
cholesterolu (z tkanek obwodowych do wątroby).
Drogi estryfikacji cholesterolu.
Udział wątroby w usuwaniu nadmiaru cholesterolu z osocza krwi; kwasy żółciowe.
7. Nukleotydy purynowe i pirymidynowe
Biosynteza nukleotydów purynowych: de novo i na drodze reutylizacji; zaburzenia
biosyntezy puryn: dna moczanowa, zespół Lesch-Nyhana, kamica nerkowa.
Inhibitory syntezy nukleotydów purynowych: analogi glutaminy i asparaginianu,
syntetyczne analogi puryn i ich rola w terapii.
Degradacja nukleotydów purynowych (metabolity i enzymy) i zaburzenia
(immunodeficjencje, ksantynuria i kamica ksantynowa).
Biosynteza rybonukleotydów pirymidynowych: de novo i na drodze reutylizacji, regulacja
i zaburzenia biosyntezy pirymidyn (acyduria orotowa typu I i II).
Inhibitory syntezy nukleotydów pirymidynowych: sulfonamidy; antagoniści strukturalni
kwasu foliowego (amino i ametopteryna), allopurynol i 6 azaurydyna, syntetyczne analogi
pirymidyn i ich rola w terapii nowotworów.
Redukcja rybonukleotydów do deoksyrybonukleotydów. Struktura i funkcja reduktazy
rybonukleotydowej. Regulacja syntezy deoksyrybonukleotydów.
Degradacja nukleotydów pirymidynowych: metabolity i enzymy, zaburzenia degradacji.
8. Metabolizm aminokwasów cz. I
Źródła metaboliczne wolnych aminokwasów: (a) trawienie w przewodzie pokarmowym,
(b) rozpad białek wewnątrzkomórkowych, (c) degradacja białek pozakomórkowych, (d)
biosynteza aminokwasów (alanina, glutaminian, glutamina, asparaginian i asparagina).
Wchłanianie aminokwasów w nabłonku jelitowym i transport do komórek.
Reakcje ogólne aminokwasów: (a) transaminacja, (b) deaminacja, (c) rola dehydrogenazy
glutaminianowej, (d) dekarboksylacja.
Utlenianie szkieletów węglowych aminokwasów: (a) szlak pirogronianowy, (b) szlak
bursztynianowy, (c) szlak α-ketoglutaranowy, (d) szlak szczawiooctanowy.
Udział jonu amonowego: (a) w syntezie glutaminy i asparaginy, (b) w syntezie mocznika.
Bilans azotowy.
9. Metabolizm aminokwasów cz. II
Synteza aminokwasów endogennych: (a) glicyna, (b) seryna, (c) prolina, (d) cysteina, (e)
tyrozyna. Synteza hydroksyproliny i hydroksylizyny.
Bloki metaboliczne przemiany fenyloalaniny i tyrozyny.
Biologicznie czynne pochodne aminokwasów: (a) kreatyna i kreatynina, (b) karnozyna i
anseryna, (c) poliaminy, (d) tlenek azotu, (e) histamina, (f) serotonina, (g) melatonina, (h)
hormony tarczycy, (i) aminy katecholowe, (j) kwas γ aminomasłowy, (k) cholina i
acetylocholina, (l) karnityna.
10. Integracja metabolizmu
Formy
i metody
dydaktyczne
Metabolizm jako procesy transformacji materii i energii – szlaki kataboliczne i
anaboliczne.
Hormonalna i niehormonalna regulacja szlaków metabolicznych.
Umiejscowienie głównych szlaków metabolicznych w komórce i miejsca ich kontroli.
Integracja metabolizmu na poziomie komórkowym – przepływ kluczowych metabolitów
pośrednich w obrębie oraz pomiędzy różnymi szlakami metabolicznymi.
Specyfika metabolizmu energetycznego niektórych narządów i tkanek: (a) mózg, (b)
mięśnie szkieletowe i mięsień sercowy, (c) wątroba, (d) tkanka tłuszczowa, (e) nerka.
Budowa i funkcja czynnych biologicznie peptydów: insuliny, glukagonu i adrenaliny.
Adaptacja metabolizmu do okresu resorpcyjnego i poresorpcyjnego w gospodarce
energetycznej organizmu.
Cukrzyca jako przykład zaburzenia przemian węglowodanów i lipidów.
Wykłady, seminaria, laboratoria, ćwiczenia, praca w grupie, dyskusje, rozwiązywanie problemu
Stosowany jest system punktowy, a elementy procesu dydaktycznego są punktowane w dwojaki
sposób: jako punkty, stanowiące o ocenie podstawowej (których suma wynosi 100%) oraz jako
punkty dodatkowe będące premią za wyróżniające przygotowanie do zajęć i aktywność (wliczane
do sumy punktów zgromadzonych w ciągu roku akademickiego).
1. Ćwiczenia laboratoryjne: za przygotowanie teoretyczne i wykonanie ćwiczenia od 1 do 5 pkt.
za każde ćwiczenie (łącznie za ćwiczenia można uzyskać od 0 do 10 pkt.). Student
nieprzygotowany teoretycznie nie może być dopuszczony do zajęć i nie otrzymuje punktów.
Za każdą nieobecność odlicza się po 2 pkt.
2. Seminaria: za każdy sprawdzian pisemny student może uzyskać od 0 do 10 pkt. oraz
dodatkowo za aktywny udział w seminarium od 1 do 3 pkt. premii wg uznania osoby
prowadzącej seminarium. Łącznie za każdy temat seminaryjny można więc uzyskać od 0 do
13 pkt.
Forma
i warunki
zaliczenia
W ciągu roku akademickiego uzyskać można maksimum 110 pkt. (100%) plus 30 pkt.
premii.
1. Warunkiem uzyskania zaliczenia zajęć z Biochemii II i dopuszczenia do egzaminu końcowego
jest uzyskanie minimum 66 pkt. (60%).
2. Student, który uzyskał mniej niż 66 pkt., lecz co najmniej 44 pkt. (40%), może ubiegać się
o zaliczenie zajęć na podstawie sprawdzianu z całości materiału obowiązującego na ćwiczeniach
i seminariach. W przypadku nieuzyskania pozytywnej oceny lub nie przystąpienia do sprawdzianu
zaliczeniowego, student ma prawo do 1-krotnego poprawiania go w terminie ustalonym przez
Katedrę. Nie poprawienie tego sprawdzianu powoduje nie zaliczenie zajęć z biochemii II w danym
roku akademickim.
3. Student, który uzyskał mniej niż 44 pkt. nie otrzymuje zaliczenia zajęć i nie ma możliwości
odrobienia zaległości w danym roku akademickim.
4. Suma punktów uzyskanych w ciągu roku akademickiego wyrażona zostanie jako słowna ocena
zaliczenia zajęć z biochemii:
– bardzo dobry
od 106 pkt. (od 96%)
– ponad dobry
od 99 do 105 pkt. (90 – 95%)
– dobry
od 88 do 98 pkt. (80 – 89%)
– dość dobry
od 77 do 87 pkt. (70 – 79%)
– dostateczny
od 66 do 76 pkt. (60 – 69%)
– niedostateczny
poniżej 66 pkt. (poniżej 60%)
Studenta obowiązuje końcowy egzamin potwierdzający opanowanie całości materiału określonego
programem nauczania biochemii II.
Egzamin końcowy z biochemii składa się z części pisemnej (testowy w systemie OLAT)
i części ustnej, o przystąpieniu do której decyduje sam student i może z niej zrezygnować. Z części
pisemnej egzaminu student może uzyskać maksymalnie 100 punktów, zawsze o ocenie pozytywnej
decyduje otrzymanie co najmniej 55 punktów. Do części ustnej egzaminu kwalifikuje się student,
który otrzymał co najmniej 55 pkt. za część pisemną (w I terminie poprawkowym 50 punktów,
a w II terminie poprawkowym 45 punktów).
W przypadku, gdy student z części pisemnej egzaminu końcowego w pierwszym terminie
uzyskał co najmniej ocenę dostateczną (55 pkt.) i uzyskał ocenę niższą niż ocena zaliczenia
przedmiotu, wynik wpisany do indeksu będzie średnią tych dwóch ocen, jako premia za
systematyczne i dobre postępy w nauce.
Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W. Biochemia Harpera, PZWL, Warszawa,
2004, 2008
Literatura
podstawowa
(nie więcej niż 3
pozycje)
Bańkowski E. Biochemia. Podręcznik dla studentów uczelni medycznych, Wydawnictwo
Medyczne Elsevier Urban & Partner, Wrocław, 2009
Hames B.D., Hooper N.M., Houghton J.D. Biochemia – krótkie wykłady, Wydawnictwo Naukowe
PWN, Warszawa, 2006
Berg J.M., Tymoczko J.L., Stryer L. Biochemia, PWN, Warszawa, 2005, 2009
Konieczny L., Roterman I. Strategia działania organizmu żywego, Wydawnictwo „Zamiast
korepetycji”, Kraków, 2000
Literatura
uzupełniająca
Koolman J., Röhm K.-H. Biochemia. Ilustrowany przewodnik, Wydawnictwo Lekarskie PZWL,
Warszawa, 2005
Szafran H., Knapik-Czajka M. Podstawy biochemiczne gospodarki lipidowej organizmu człowieka,
Collegium Medicum UJ, Kraków, 1994
Trzeciak W.H. (red.) Biochemia. Skrypt do Ćwiczeń Laboratoryjnych, Wyd. AM, Poznań 1997
Przedmiotowe
efekty
kształcenia
E_W01
Efekty kształcenia
Opisuje podstawowe szlaki metaboliczne aminokwasów, nukleotydów
purynowych i pirymidynowych, węglowodanów i tłuszczowców.
Odniesienie do
kierunkowych
efektów kształcenia
K_W03, K_W04
E_W02
Zna struktury ważniejszych metabolitów przemian chemicznych, nazwy
enzymów katalizujących kluczowe reakcje oraz czynniki regulujące
przebieg tych procesów.
K_W03, K_W04
E_W03
Opisuje rolę hormonów w homeostazie ustrojowej, szczególnie
w odniesieniu do gospodarki węglowodanowej i lipidowej.
K_W03, K_W04
E_W04
Charakteryzuje profil metaboliczny wybranych narządów i tkanek
w stanie sytości i głodu.
K_W03, K_W04
E_K05
Zna podłoże molekularne wybranych schorzeń metabolicznych
i genetycznych.
K_W03, K_W04
E_W06
Zna zasadę elektroforezy białek, chromatografii cienkowarstwowej
lipidów, ilościowego oznaczania glukozy we krwi pełnej.
K_W16
E_U01
Wykonuje frakcjonowanie białek surowicy krwi za pomocą
elektroforezy w żelu agarozowym i oznaczanie stężenia glukozy we krwi
metodą enzymatyczną.
K_U01, K_U06
E_U02
Przeprowadza izolację i identyfikację lipidów z materiału biologicznego.
K_U01, K_U06
E_U03
Posiada umiejętność samodzielnego przygotowywania się do dyskusji.
K_U15
E_K01
Ma świadomość i potrzebę poszerzania wiedzy dotyczącej
biochemicznych podstaw funkcjonowania organizmu ludzkiego.
K_K01
E_K02
Potrafi współdziałać i pracować w zespole przy rozwiązywaniu
K_K04
postawionych problemów z integracji metabolizmu komórkowego.
Godziny kontaktowe z nauczycielem akademickim
udział w wykładach
udział w ćwiczeniach
Bilans nakładu
pracy studenta
udział w seminariach
udział w konsultacjach związanych z zajęciami
Samodzielna praca studenta
przygotowanie do ćwiczeń
przygotowanie do seminariów
przygotowanie do kolokwiów
przygotowanie do egzaminu
4x3
1x 2
3x3
1x2
10 x 4
10x 1
Razem
14
4x2
10 x 2
2x5
1 x 12
Razem
8
20
10
12
50
Liczba
ECTS
Liczba
godzin
Wskaźniki
ilościowe
11
40
10
75
Nakład pracy studenta związany z zajęciami wymagającymi
bezpośredniego udziału nauczyciela
75
3
Nakład pracy studenta związany z zajęciami o charakterze praktycznym
Łącznie
19
125
1
5
Metody weryfikacji efektu kształcenia
Nr efektu
kształcenia
E_W01-05
Formujące
Ocena aktywności w dyskusji i pisemny
sprawdzian obejmujący treści seminariów
Podsumowujące
Teoretyczny egzamin końcowy składający się
z części pisemnej (testowy w systemie OLAT)
i ustnej
Ocena opracowanego protokołu z laboratoriów
E_W06
Ocena przygotowania teoretycznego
E_U01-02
Obserwacja umiejętności wykonania
praktycznego ćwiczenia laboratoryjnego
Ocena opracowanego protokołu z laboratoriów
E_U03
Ocena aktywności w dyskusji
Zaprezentowanie ustne referatu tematycznego
E_K01-02
Ocena aktywności w dyskusji i pracy w grupie
Zaprezentowanie ustne referatu tematycznego
Data
opracowania
programu
15.03.2013
Program opracował
Dr J.B. Dylewski
Prof. dr P. Jagodziński