1.
Nazwa przedmiotu/modułu w języku polskim
Chemia Ogólna i Analityczna
2.
Nazwa przedmiotu/modułu w języku angielskim
General and Analytical Chemistry
3.
Jednostka prowadząca przedmiot
Wydział Chemii, Uniwersytet Wrocławski
4.
Kod przedmiotu/modułu
29-BT-S1-E1-CHOA
29-BT-S1-E1-CHOAc
5.
Rodzaj przedmiotu/modułu (obowiązkowy lub fakultatywny)
Obowiązkowy
6.
Kierunek studiów
Biotechnologia
7.
Poziom studiów (I lub II stopień lub jednolite studia magisterskie)
I stopień
8.
Rok studiów (jeśli obowiązuje)
I rok
9.
Semestr (zimowy lub letni)
Zimowy
10.
Forma zajęć i liczba godzin
Wykład: 30 h
Laboratorium: 30 h
11.
Imię, nazwisko, tytuł/stopień naukowy osoby prowadzącej zajęcia
prof. dr hab. Adam Jezierski,
dr hab. Lucjan Jerzykiewicz
12.
Wymagania wstępne w zakresie wiedzy, umiejętności i kompetencji społecznych dla
przedmiotu/modułu oraz zrealizowanych przedmiotów
Znajomość podstaw chemii w zakresie szkoły średniej.
13.
Cele przedmiotu
- ugruntowanie i rozszerzenie wybranych treści z chemii ogólnej niezbędnych do
zrozumienia zjawisk i procesów przyrodniczych,
- nabycie umiejętności samodzielnego wykonywania analiz jakościowych i ilościowych
w zakresie niezbędnym w naukach przyrodniczych,
- przygotowanie do samodzielnej pracy laboratoryjnej i właściwej interpretacji wyników
badań.
14.
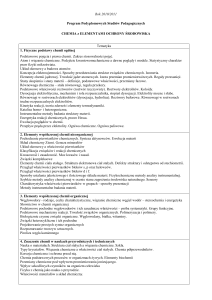
Zakładane efekty kształcenia
Wiedza:
Posiada podstawową wiedzę z zakresu matematyki i
fizyki pozwalająca na opis, zrozumienie i interpretację
podstawowych zjawisk i procesów biologicznych
Ma podstawową wiedzę z różnych dziedzin chemii
takich jak chemia ogólna, analityczna, organiczna i
biofizyczna niezbędną do zrozumienia i interpretacji
K1_W03
K1_W04
procesów przyrodniczych
Zna metody obliczeniowe w zakresie statystyki i
narzędzia informatyczne pozwalające na analizę
danych i interpretację wyników eksperymentów
Zna metody obliczeniowe w zakresie statystyki i
narzędzia informatyczne pozwalające na analizę
danych i interpretację wyników eksperymentów
K1_W07
K1_W10
Umiejętności:
Stosuje podstawowe techniki fizykochemiczne i
biochemiczne niezbędne do badania procesów
biologicznych
K1_U01
Przeprowadza proste eksperymenty badawcze lub
ekspertyzy pod kierunkiem opiekuna naukowego w
zakresie biotechnologii; uzyskane wyniki potrafi
opisać i przedstawić w formie sprawozdania
K1_U05
Stosuje podstawowe metody statystyczne i techniki
informatyczne do opisu zjawisk biologicznych i analizy
danych eksperymentalnych
K1_U06
Przeprowadza podstawowe pomiary fizykochemiczne
w terenie i laboratorium
Dokonuje syntezy informacji pochodzących z różnych
źródeł i poprawnego wnioskowania na ich podstawie
Umie ustnie zaprezentować w języku polskim i
angielskim opracowania wybranych zagadnień
naukowych i podejmować dyskusję
K1_U07
K1_U08
K1_U11
Kompetencje społeczne:
Umie pracować zespołowo, współdziałając w
rozwiązywaniu problemów i wykonywaniu
eksperymentów naukowych
Rozumie potrzebę dokładnego planowania zadań i
eksperymentów naukowych
Zna i przestrzega reguł bezpieczeństwa i higieny
pracy
15.
K1_K02
K1_K03
K1_K05
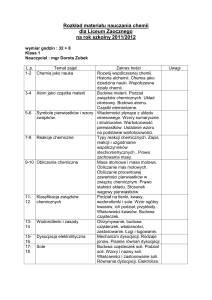
Treści programowe
Wykład:
Podstawy mechaniki kwantowej, funkcja falowa; poziomy energetyczne atomów i
cząsteczek, budowa układu okresowego pierwiastków chemicznych w oparciu o liczby
kwantowe. Zmiany właściwości pierwiastków chemicznych w grupach i okresach.
Wiązania chemiczne kowalencyjne, jonowe, metaliczne i wodorowe – podstawowe
warunki tworzenia, trwałość. Wiązanie chemiczne w skali cząsteczkowej a właściwości
termodynamiczne w skali makroskopowej. Symetria cząsteczek i oddziaływania między
nimi a właściwości gazów, cieczy, ciał stałych. Równania chemiczne. Podstawowe typy
reakcji chemicznych – reakcje Podstawy mechaniki kwantowej, funkcja falowa;
poziomy energetyczne atomów i cząsteczek, budowa układu okresowego pierwiastków
chemicznych w oparciu o liczby kwantowe. Zmiany właściwości pierwiastków
chemicznych w grupach i okresach. Wiązania chemiczne kowalencyjne, jonowe,
metaliczne i wodorowe – podstawowe warunki tworzenia, trwałość. Wiązanie
chemiczne w skali cząsteczkowej a właściwości termodynamiczne w skali
makroskopowej. Symetria cząsteczek i oddziaływania między nimi a właściwości
gazów, cieczy, ciał stałych. Równania chemiczne. Podstawowe typy reakcji
chemicznych – reakcje kwasowo-zasadowe, reakcje utlenienia i redukcji, reakcje w
chemii organicznej (przyłączenie, podstawienie, eliminacja). Reakcje łańcuchowe.
Stechiometria. Obliczenia chemiczne. Rozpuszczalniki i roztwory. Podstawy
termodynamiki chemicznej; pojęcia ciepła reakcji chemicznej, entalpii, entropii, funkcji
Gibbsa. Równowaga chemiczna i reakcje nierównowagowe: przykłady z geochemii,
biochemii, chemii życia codziennego, procesów przemysłowych. Podstawowe pojęcia
kinetyki chemicznej. Kataliza i katalizatory. Reakcje wolnorodnikowe. Nowoczesne
metody
analizy
chemicznej:
spektroskopowe
(IR,
UV-Vis,
NMR,
EPR),
elektrochemiczne,
chromatograficzne
–podstawy
teoretyczne i
zakresy ich
zastosowań..
Laboratorium:
Poznanie podstawowych operacji w pracowni chemii analitycznej. Ćwiczenia obejmują
głównie klasyczną analizę jakościową kationów i anionów i analizę ilościową związków
nieorganicznych.
16.
Zalecana literatura
1. L. Jones, P. Atkins, Chemia ogólna, PWN 2004
2. A. Bielański, Podstawy chemii nieorganicznej, PWN, Warszawa 2002.
3. T. Lipiec, Z. S. Szmal, Chemia analityczna z elementami analizy instrumentalnej,
PZWL W-a 1976.
4. A. Śliwa, Obliczenia chemiczne, PWN, Warszawa 1982.
17.
Forma zaliczenia poszczególnych komponentów przedmiotu/modułu, sposób
sprawdzenia osiągnięcia zamierzonych efektów kształcenia:
Wykład: egzamin pisemny, z możliwością ustnej poprawy oceny
Laboratorium: pisemne zaliczenie
18.
Język wykładowy
Polski
19.
Obciążenie pracą studenta
Forma aktywności studenta
Średnia liczba godzin na
zrealizowanie aktywności
Godziny zajęć (wg planu studiów) z nauczycielem:
- wykład:
- laboratorium:
30
30
Praca własna studenta:
- przygotowanie do zajęć:
- opracowanie wyników:
- czytanie wskazanej literatury:
- sporządzanie sprawozdań z zajęć laboratoryjnych:
- przygotowanie do egzaminu:
20
25
20
15
20
Suma godzin
60+100
Liczba punktów ECTS
3+2