PRACE POGLĄDOWE
Robert KRYSIAK
Bogusław OKOPIEŃ
Zespół Sheehana - zapomniana choroba ze
stuletnią historią
Sheehan’s syndrome - a forgotten disease with 100
years’ history
Klinika Chorób Wewnętrznych i Farmakologii
Klinicznej Katedry Farmakologii Śląskiego
Uniwersytetu Medycznego w Katowicach.
Kierownik:
Prof. zw. dr hab. n. med. Bogusław Okopień
Dodatkowe słowa kluczowe:
zespół Sheehana
etiopatogeneza
objawy kliniczne
diagnostyka
leczenie
Additional key words:
Sheehan’s syndrome
etiopathogenesis
clinical presentation
diagnosis
treatment
Adres do korespondencji:
Robert Krysiak
Klinika Chorób Wewnętrznych i Farmakologii
Klinicznej Katedry Farmakologii Śląskiego
Uniwersytetu Medycznego w Katowicach
ul. Medyków 18, 40-752 Katowice
tel./fax 322523902
e-mail: [email protected]
Przegląd Lekarski 2015 / 72 / 6
Choć nazwana na cześć Harolda
Sheehana, niedokrwienna martwica
przysadki po porodzie była po raz
pierwszy opisana 100 lat temu na
łamach Przeglądu Lekarskiego przez
Leona Konrada Glińskiego. W większości przypadków zespół Sheehana jest
konsekwencją masywnej utraty krwi w
okresie okołoporodowym, której wynikiem jest spadek ciśnienia tętniczego
krwi, a nawet wstrząs oligowolemiczny.
Częstość rozpoznawania tego zespołu
zmniejszyła się w krajach rozwiniętych, jako wynik poprawy w zakresie
opieki położniczej, jednak omawiana
jednostka chorobowa pozostaje wciąż
ważną przyczyną niedoczynności
płata przedniego przysadki w krajach
rozwijających się. Zespół charakteryzuje zmieniający się w czasie stopień
dysfunkcji płata przedniego przysadki,
wynikający z niedoboru różnych hormonów przysadkowych. Najwcześniej
ujawnia się niedobór wydzielania
hormonu wzrostu i prolaktyny, a w
dalszej kolejności gonadotropin, ACTH
i TSH. Kobiety z zespołem Sheehana
wykazują różnorodną manifestację
kliniczną, obejmującą niewydolność
laktacji lub powrotu miesiączkowania,
utratę owłosienie narządów płciowych
i pach, jak również, zwykle ujawniające
się pod dłuższym czasie od porodu,
objawy ośrodkowej niedoczynności
tarczycy i wtórnej niedoczynności
nadnerczy. Rozpoznawanie jest stawiane w oparciu o badania laboratoryjne, polegające na ocenie stężeń
hormonów w warunkach wyjściowych
i w testach czynnościowych. Leczenie
zespołu Sheehana polega na wyrównywaniu niedoborów hormonalnych.
Celem naszej pracy było omówienie
współczesnego stanu wiedzy na temat
istotnych klinicznie aspektów zespołu
Sheehana, jak również dostarczenie
czytelnikowi zaleceń praktycznych
dotyczących współczesnych zasad
jego rozpoznawania i leczenia.
Although named after Harold Sheehan, postpartum ischemic pituitary
necrosis was reported for the first
time 100 years ago in Przegląd Lekarski by Leon Konrad Gliński. In the
majority of cases, the syndrome is a
consequence of severe postpartum
bleeding episode resulting in severe
hypotension or hemorrhagic shock.
The frequency of Sheehan’s syndrome
has decreased in developed countries
as a result of improved obstetrical
care, but this clinical entity remains a
common cause of hypopituitarism in
developing countries. The syndrome
is characterized by varying degrees of
anterior pituitary dysfunction resulting
from the deficiency of multiple pituitary
hormones. The order of frequency
of hormone loss has generally been
found to be growth hormone and
prolactin, gonadotropins, ACTH and
thyrotropin. Women with Sheehan’s
syndrome exhibit a variety of signs and
symptoms including failure to lactate
or resume menses, loss of genital and
axillary hair, and often occurring long
after delivery clinical manifestations
of central hypothyroidism and secondary adrenal insufficiency. Diagnosis is
based on laboratory studies, including
hormone levels and hormone stimulation tests. Treatment of Sheehan’s syndrome involves hormone replacement
therapy. The aim of this study is to
review current knowledge on clinically
relevant aspects of this clinical entity
and to provide the reader with recommendations concerning its diagnosis
and treatment.
Wstęp
Zespół Sheehana jest niedoczynnością
płata przedniego przysadki, wynikającą z
jego martwicy, do której dochodzi w wyniku
niedokrwienia, spowodowanego wystąpieniem głębokiej hipotonii i/lub wstrząsu,
najczęściej wtórnych do masywnego
krwawienia w okresie okołoporodowym [1].
Należy zaznaczyć, iż nazwa „zespół Sheehana” jako określenie powyższej jednostki
chorobowej pojawiła się dość późno. Sam
Sheehan, określał martwicę przysadki mia313
nem zespołu Simmondsa, na cześć badacza
pracującego w Hamburgu, który opisał w
1914 roku przypadek poporodowego zaniku
przysadki w następstwie infekcji septycznej
[2]. Jednak pierwszy opis poporodowej niedoczynności przysadki był dziełem polskiego
patologa, profesora Uniwersytetu Jagiellońskiego, Leona Konrada Glińskiego i został
on opublikowany w 1913 roku w Przeglądzie
Lekarskim [3], tym samym czasopiśmie,
na łamach którego 100 lat później autorzy
niniejszej pracy zamieszczają swój artykuł,
dokumentujący wielki postęp dokonany w
tym czasie w zakresie endokrynologii i opieki
okołoporodowej. Opisany przez Glińskiego
przypadek dotyczył kobiety z masywnym
krwawieniem poporodowym, która zmarła
po 9 dniach w następstwie septycznych
powikłań porodu i został potwierdzony autopsyjnie jako martwica przysadki [3]. Przez
pewien czas funkcjonowało pojęcie choroby
Glińskiego-Simmondsa, którą starano się
odróżnić od zespołu Sheehana przez mniejszą dynamikę procesu chorobowego, jednak
podział ten nie przetrwał próby czasu. Nie
można wykluczyć, iż w przypadku choroby
Glińskiego-Simmondsa mniejsze nasilenie
objawów wynikało z mniejszego uszkodzenia przysadki niż w klasycznych postaciach
zespołu Sheehana lub też ujawniania się
jedynie późnych objawów tej choroby.
Choć świadomość lekarska, co do istnienia
zespołu Sheehana nie jest zbyt duża, trzeba
pamiętać, iż zespół ten stanowić może poważne zagrożenie dla chorych. W ostatnich
latach, zwłaszcza w krajach rozwiniętych
schorzenie to jest rozpoznawane znacznie
rzadziej niż w czasach Sheehana, który
częstość występowania tej jednostki chorobowej szacował na około 100-200 przypadków na 1 000 000 kobiet [4]. Jest on jednak
nadal dużym problemem w krajach słabo
rozwiniętych, gdzie porody w warunkach
domowych są powszechne, zaś stopień
opieki położniczej niesatysfakcjonujący [5].
Dla przykładu, w Indiach częstość zespołu
Sheehana wśród kobiet, które rodziły jest
szacowana na 3,2% [6]. Jednak również w
międzynarodowej bazie Pfizer International
Metabolic Database (KIMS), obejmującej
grupę 1034 chorych zespół Sheehana stanowił 3,1% wszystkich przypadków niedoboru hormonu wzrostu (growth hormone - GH)
[7,8], natomiast w badaniu przekrojowym
(cross-sectional study) przeprowadzonym w
Hiszpanii odpowiadał za 6-10% wszystkich
przypadków niedoboru GH [9]. Ponadto w
opracowaniach z Islandii częstość zespołu
Sheehana szacuje się na 5,1 przypadka na
100 000 kobiet, co może przemawiać za
tym, iż nawet w krajach cywilizowanych zespół ten jest jednostką chorobową znacznie
częstszą niż się przyjmuje [5]. O niedostatecznej świadomości lekarzy, co do istnienia
zespołu Sheehana świadczy zmiennie długi
okres pomiędzy wystąpieniem porodu a
postawieniem rozpoznania choroby, który
mieści się w przedziale od 1 miesiąca do 47
lat [10]. Podobnie jak w przypadku innych
gruczołów wydzielania wewnętrznego, również w przypadku przysadki liczba komórek
syntezujących i wydzielających hormony
znacznie przekracza liczbę niezbędną do
produkcji wystarczającej do utrzymania homeostazy hormonalnej [11]. Przyjmuje się,
314
iż do zespołu Sheehana dochodzi dopiero
wówczas, gdy uszkodzeniu ulega powyżej
75% płata przedniego (gruczołowego)
przysadki [12]. Płat jest znacznie bardziej
wrażliwy na niedokrwienie od płata tylnego
[13]. W rzadkich przypadkach obserwuje się
również obecność zmian w obrębie nerwów
wzrokowych i ich skrzyżowania, a także w
obrębie podwzgórza [4,14]
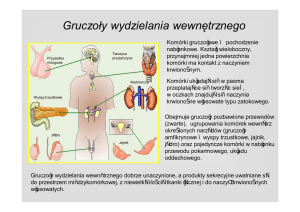
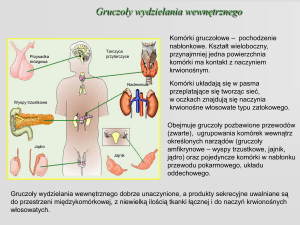
Patofizjologia
W warunkach fizjologicznych przysadka
mózgowa jest zaopatrywana w krew przez
tętnice szyjne wewnętrzne, które oddają z
każdej strony dwa rozgałęzienia: tętnicę
przysadkową górną i tętnicę przysadkową
dolną [15]. Tętnice przysadkowe górne
wnikają w kierunku wyniosłości pośrodkowej, gdzie przekształcają się w sieć naczyń
włośniczkowych, łączących się następnie w
naczynia żylne przenikające do płata przedniego. W płacie tym, dochodzi ponownie
do wytworzenia włośniczek, co oznacza, iż
przysadka jest jednym z niewielu narządów
charakteryzujących się obecnością krążenia
wrotnego. Dzięki temu ułatwione jest sprawne przemieszczenie hormonów wydzielonych w podwzgórzu do płata przedniego
przysadki, stanowiącego najważniejszy
punkt uchwytu działania tych hormonów. Z
kolei tętnice przysadkowe dolne, pomimo
iż przechodzą przez płat przedni, wnikają
do płata tylnego, zaopatrując w krew płat
tylny i szypułę. Pomiędzy oboma krążeniami
istnieją liczne anastomozy pozwalające na
zachowanie przepływu krwi, co niejednokrotnie jest ważnym mechanizmem ochrony
przysadki przed niedokrwieniem [15]. W
przebiegu ciąży dochodzi do stopniowego
wzrostu objętości przysadki oraz zwiększenia jej masy, które osiągają maksymalne
wartości (wzrost o 30-100%) w ciągu pierwszych trzech dni po porodzie, by następnie,
w ciągu kolejnych 6 miesięcy, powrócić do
wartości sprzed ciąży [16,17]. U niektórych
kobiet, szczególnie dziewcząt poniżej 19
roku życia, co obserwowali również autorzy niniejszej pracy, przysadka w ciąży
może ulegać nawet znacznie większemu
przerostowi niż ma to miejsce u większości
ciężarnych [16]. Przyczyną powiększenia
przysadki jest przerost oraz zwiększenie
liczby komórek laktotropowych, które pod
koniec ciąży stanowią około 3/5 wszystkich
komórek przysadki, a więc trzykrotnie więcej
niż przed ciążą [18]. Nie towarzyszy temu
jednak wzrost przepływu krwi przez przysadkę, częściowo uwarunkowany ograniczeniami przestrzennymi siodła tureckiego [12]. Po
porodzie liczba komórek laktotropowych ulega stopniowemu obniżeniu, lecz praktycznie
nigdy nie wraca do wartości stwierdzanych
przed ciążą [18]. Tak więc w końcowym
okresie ciąży i po porodzie przysadka mózgowa wykazuje bardzo dużą wrażliwość
na działanie czynników powodujących jej
niedokrwienie. Przebycie ciężkiego porodu,
zwłaszcza wówczas, gdy jest on związany
z masywną utratą krwi i wynikających z niej
głębokiej hipotonii i/lub wstrząsu, wystąpić
może martwica mniejszych lub większych
obszarów przysadki mózgowej (szczególnie
przedniego płata) [19] która w przypadku
dużej rozległości skutkować może rozwojem zespołu Sheehana. U jej podłoża leżeć
może zaburzenie autoregulacji przepływu
przez tętnice przysadkowe górne (choć jest
to kontrowersyjne), kompresja tych tętnic
w następstwie powiększenia przysadki, jak
również skurcz lub/oraz obecność zmian
zakrzepowych w świetle tętnic przysadkowych górnych [1].
Wśród czynników, którym przypisuje się
pewną rolę w warunkowaniu ryzyka rozwoju zespołu Sheehana wymienia się słaby
rozwój siodła tureckiego [20]. Choć pogląd
ten nie jest przez wszystkich akceptowany
[21] można założyć, iż w przypadku takich
uwarunkowań anatomicznych dochodzi do
zwiększonego ucisku ścian dołu przysadki
na gruczoł, co ułatwia niedokrwienie przysadki [22].
W ostatnich latach pewną rolę przyczynową w powstawaniu zespołu Sheehana
przypisuje się zwiększonej predyspozycji
prozakrzepowej lub upośledzonemu krzepnięciu [1]. Przemawiają za tym obserwacje,
iż ryzyko zespołu Sheehana może być
większe w przypadku obecności mutacji
w obrębie czynników krzepnięcia, które
predysponują do powikłań zatorowo-zakrzepowych, takich jak obecność czynnika V Leiden, FII G20210A, MTHFR C677T, MTHFR
A1298C oraz PAI-1 4G/5G [23], jak również
obniżone stężenia czynnika VIII i czynnika
von Willebranda [1]. U niektórych chorych
rozwój zespołu Sheehana jest poprzedzony wystąpieniem zespołu wykrzepiania
wewnątrznaczyniowego [19]. Teoretycznie
więc martwica przysadki nie musi stanowić
powikłania masywnego krwawienia i rozwijać się w przypadku zespołu wykrzepiania
wewnątrznaczyniowego niezwiązanego z
następczą hipowolemią [19].
W rzadkich przypadkach, w których nie
stwierdza się wystąpienia incydentu naczyniowego, zwraca się uwagę na możliwą rolę
procesu autoimmunologicznego, za czym
przemawia obecność u części chorych
przeciwciał przeciwko komórkom przysadki
mózgowej [10]. Przeciwciała takie wykazano
u 35-60% kobiet z zespołem Sheehana
[24,25]. Przyjmuje się, iż w warunkach
niedokrwienia okołoporodowego i rozwijającej się martwicy przysadki dochodzi do
zwiększonego uwalniania antygenów przysadkowych i wtórnego rozwoju procesów
autoimmunologicznych [25]. Mechanizm
ten, zbliżony do rozwoju niepłodności i
zmian histopatologicznych w jądrze wtórnie
do skręcenia szypuły przeciwstronnego
jądra, może dobrze tłumaczyć późny początek choroby u wielu pacjentek. Opisywano
ponadto przypadki indukowania zespołu
Sheehana pod wpływem terapii interferonem [26]. Wśród mechanizmów wiążących
stosowanie tego leku z omawianą chorobą
zwraca się uwagę na powodowanie zwyrodnienia torbielowatego przysadki, indukowanie współistniejącego stanu zapalnego oraz
dekompensację utajonej niewydolności nadnerczy, za którą przemawiać może niewielki
u części chorych odstęp czasowy (nawet
kilka dni) pomiędzy włączeniem leczenia a
postawieniem rozpoznania choroby [26].
Przyczyną przejściowego charakteru
uszkodzenia przysadki u niektórych chorych
jest szczególne unaczynienie płata przedniego tego gruczołu [15]. Komórki tego płata
przylegające do torebki są unaczynione
R. Krysiak i B. Okopień
przez naczynia torebki, nie zaś przez układ
naczyń wrotnych. Komórki te, jak również
niewielka grupa komórek zlokalizowanych w
warstwie przylegającej do neurohypophysis
nie ulegają destrukcji w przypadku martwicy
płata przedniego [27]. Tak więc w warunkach
regeneracji krążenia wrotnego przysadki,
naczynia wzrastają do przetrwałych części
gruczołu, co umożliwia podjęcie pewnych
funkcji hormonalnych [27]. Proces ten jednak wymaga czasu, a jego wykładnikiem jest
pojawienie się figur podziału [27].
Należy również zwrócić uwagę na to,
iż w bardzo rzadkich przypadkach obserwowano martwicę przysadki bez związku
z ciążą i porodem [22]. Przypadki takie
obserwowano w przypadku urazów (zwłaszcza przy wystąpieniu krwawienia podpajęczynówkowego), masywnych udarów i
gorączki krwotocznej, przy czym czynnikiem
zwiększającym ryzyko była współistniejąca
cukrzyca [22].
Objawy kliniczne
Manifestacja kliniczna zespołu Sheehana jest uwarunkowana lokalizacją, rozległością oraz ewentualną obecnością zmian w
innych strukturach, zwłaszcza podwzgórzu.
Za możliwością ich występowania przemawiają obserwacje niektórych autorów, którzy
wykazali obecność zmian martwiczych,
zwłaszcza w obrębie jądra przykomorowego
podwzgórza [28]. W zależności od stopnia
uszkodzenia przysadki objawy zespołu
Sheehana, jak wspomniano powyżej, pojawiają się albo wkrótce po wystąpieniu
martwicy przysadki, albo też po wielu latach.
W badaniu Serta i wsp. [11] obejmującym
28 kobiet rozpoznanie zespołu Sheehana
stawiano średnio po 13,9 roku od incydentu
położniczego, co przemawia za tym, iż w
większości przypadków choroba jest rozpoznawana późno, jako wynik nieświadomości
lekarskiej lub też stopniowej progresji procesu chorobowego. Najwcześniej dochodzi
do manifestacji hormonalnej niedoboru GH
i prolaktyny, następnie niedoboru gonadotropin, a najpóźniej zwykle niedoboru TSH
i ACTH [29]. W zestawieniu Veldhuisa i
Hammonda [30] niedobór GH obserwowano
u 88% pacjentek, hipoprolaktynemię w 67100% przypadków, niedobór gonadotropin u
8-76% chorych, obniżone stężenie ACTH u
66% pacjentek, zaś ośrodkową niedoczynność tarczycy u 42-53% chorych.
Objawy wczesne
Zwykle pierwszym stwierdzanym objawem jest brak laktacji lub niedostateczna
laktacja, uwarunkowane zmniejszonym
wydzielaniem prolaktyny. Później uwidaczniają się zaburzenia powrotu prawidłowych
cykli miesięcznych, zahamowanie odrostu
włosów w okolicy łonowej, zwiększona utrata
owłosienia łonowego i pod pachami, a także
tendencja do zaniku piersi, stanowiące wynik
niedostatecznej sekrecji gonadotropin i co za
tym idzie estrogenów [11]. Niekiedy zwraca
ponadto uwagę słabe gojenie się ran po
cięciu cesarskim, uogólnione osłabienie oraz
brak apetytu [16]. Trzeba pamiętać, że choć
powyższe objawy są bardzo charakterystyczne dla zespołu Sheehana, ich nieobecność
(prawidłowa laktacja, powrót miesiączek) nie
wyklucza rozpoznania powyższej jednostki
Przegląd Lekarski 2015 / 72 / 6
chorobowej, jednak czyni je mało prawdopodobnym [11]. Ponadto, pacjentki mogą nie
zgłaszać niektórych objawów (brak łaknienia,
brak miesiączki), obecnych we wczesnym
okresie po porodzie, aż do momentu ujawnienia się stanu niedoczynności tarczycy i
nadnerczy [29]. Utrzymująca się tachykardia
oraz niskie wartości ciśnienia tętniczego [17]
przemawiają za dużą rozległością zmian
martwiczych i w takich przypadkach wymagane jest szybkie włączenie farmakoterapii z
uwagi na duże ryzyko wtórnej niedoczynności
nadnerczy [17].
Objawy późne
W przypadkach, w których od momentu
uszkodzenia przysadki mija kilka miesięcy
lub lata objawy kliniczne zespołu Sheehana
zwykle przypominają objawy niedoczynności płata przedniego przysadki mózgowej
na innym tle, stanowiąc konsekwencję
niedostatecznej sekrecji GH, ACTH, TSH i
gonadotropin.
Niedobór GH jest najczęstszym (obok
zaburzeń wydzielania prolaktyny) niedoborem hormonalnym obserwowanym u
chorych na zespół Sheehana [30]. Ponadto
stan niedoboru GH jest większy niż w innych
przypadkach niedoczynności przysadki [18].
Przyczyna szczególnej wrażliwości komórek
somatotropowych na uszkodzenie pozostaje
niewyjaśniona, tym bardziej, iż stanowią one
nawet 50% komórek przysadki [15]. Niewykluczone, że rozmieszczenie tych komórek
głównie w bocznej części przysadki powoduje, iż wykazują one zwiększoną wrażliwość
na działanie czynnika uszkadzającego
(ucisk mechaniczny, zaburzenia przepływu
krwi). Same komórki somatotropowe mogą
wykazywać ponadto zwiększoną wrażliwość
na zmiany wartości ciśnienia płynu mózgowo-rdzeniowego oraz na wpływ układów
podwzgórzowych regulujących sekrecję
hormonów płata przedniego przysadki.
Objawy niedoboru GH u kobiet z zespołem
Sheehana nie różnią się od stwierdzanych
w innych postaciach niedoboru GH u osób
dorosłych [8]. Należą do nich: zmniejszenie masy mięśni i siły mięśniowej, wzrost
zawartości tłuszczu i zmieniona topografia
tkanki tłuszczowej, zmniejszenie wielkości i
kurczliwości serca oraz obniżenie gęstości
mineralnej tkanki kostnej i pogorszenie
jakości życia [31]. Tłuszcz gromadzi się
wtedy głównie w tkance podskórnej tułowia
i częściowo również w jamie brzusznej [31].
Towarzyszy mu zmniejszenie objętości
płynów zewnątrzkomórkowych [32]. Osoby
dorosłe z niedoborem GH (a więc również
chore na zespół Sheehana) obarczone są
zwiększonym ryzykiem zgonu z powodu
schorzeń układu krążenia [33].
Do objawów wtórnej niedoczynności
nadnerczy, poza wymienionymi uprzednio,
należą: osłabienie, uogólnione zmęczenie,
nudności i/lub wymioty, brak łaknienia,
biegunka, bóle brzucha, tendencja do hipoglikemii oraz utrata masy ciała [34]. W przeciwieństwie do pierwotnej niedoczynności
nadnerczy zwraca uwagę hipopigmentacja
skóry, kontrastująca z przebarwieniami skóry typowymi dla choroby Addisona [34,35].
Obecność wtórnej niedoczynności tarczycy
sugerują: suchość skóry, osłabienie pamięci,
spowolnienie procesów myślowych, obni-
żenie nastroju, osłabienie siły mięśniowej,
uogólnione zmęczenie, nietolerancja zimna,
zaparcia oraz hiperlipoproteinemia (w tym
typ III) [36]. W przeciwieństwie do pierwotnej niedoczynności tarczycy, u chorych na
zespół Sheehana nie stwierdza się obecności obrzęków twarzy i okolicy oczodołów
oraz chrypki [36]. Natomiast wykładnikiem
niedoboru gonadotropin jest często brak
miesiączki lub rzadkie miesiączkowanie,
uderzenia gorąca, obniżone libido, dyspareunia, a w przypadku długotrwałego
hipogonadyzmu zmniejszenie wymiarów
macicy oraz osteoporoza [13]. Manifestacja
kliniczna może nawet sugerować istnienie
przedwczesnego wygasania czynności
jajników [29].
Chociaż niedobór prolaktyny jest typową manifestacją kliniczną zespołu Sheehana, opisano w tym zespole przypadki
hiperprolaktynemii [18]. Opisywano również
różnorodne zaburzenia psychiczne, takie
jak apatia, stany depresyjne, zaburzenia
procesów pamięciowych, omamy a nawet
psychozy [37].
Typową cechą zespołu Sheehana w
badaniu fizykalnym jest występowanie
zmarszczek zlokalizowanych wokoło ust
oraz oczu, które najprawdopodobniej stanowią konsekwencję utrzymującego się
przewlekle niedoboru GH i estrogenów [19].
Gruczoł tarczowy jest mały lub jego objętość
mieści się w normie [36].
U części osób obserwuje się bardziej
skąpoobjawowy przebieg zespołu Sheehana. W takich przypadkach pacjentki podają
niejednokrotnie wtórny brak miesiączki,
obniżone libido, zmniejszenie wymiarów
sutków oraz zmniejszenie tolerancji wysiłku
fizycznego [22]. Pomimo niewielkiego nasilenia dolegliwości takie przypadki zespołu
Sheehana nie powinny ujść uwadze lekarza,
gdyż istnieją opisy chorych, u których nierozpoznany i nieleczony zespół Sheehana
manifestował się po raz pierwszy przełomem nadnerczowym, indukowanym ciężką
infekcją lub zabiegiem operacyjnym [13].
Szczególne problemy kliniczne
Funkcja płata tylnego i podwzgórza
Niewydolności przedniego płata przysadki w zespole Sheehana towarzyszy często, przeważnie niewielka, niedomoga płata
tylnego oraz/lub podwzgórza [22]. Wynikiem
tego jest obserwowany u większości kobiet
defekt w zakresie wydzielania wazopresyny
i maksymalnego zagęszczania moczu [19].
Znajduje ona potwierdzenie w wynikach
badań autopsyjnych, które dowodzą, że u
ponad 90% kobiet z zespołem Sheehana
stwierdza się obecność mniej lub bardziej
wyrażonych zmian zanikowych lub bliznowatych w obrębie neurohypophysis, szypule
oraz w jądrach podwzgórza [38, 39]. Ponadto
u 40% pacjentek stwierdza się obecność
przeciwciał przeciwko podwzgórzowym komórkom neurosekrecyjnym [24]. Klinicznie
jawna moczówka prosta występuje tylko u
około 5% chorych na zespół Sheehana [38].
Należy jednak podkreślić, iż w większości
badań oceniających chore z zespołem
Sheehana częstość określonych dysfunkcji
hormonalnych ustalano w oparciu o objawy
kliniczne, nie zaś oznaczenia hormonalne i
biochemiczne [38]. Jak przemawiają za tym
315
badania ostatnich lat u dużej grupy chorych,
być może nawet większości, obserwuje się
dyskretne zaburzenia zagęszczania moczu,
zwłaszcza w teście deprywacji wody i w
teście z hipertonicznym roztworem chlorku
sodu [40]. Ponieważ częściowy niedobór
wazopresyny był rozpoznawany stosunkowo
rzadko i nie wzbudzał zbyt dużego zainteresowania w środowisku medycznym, brakuje
przekonywujących danych na temat jego rozpowszechnienia w zespole Sheehana [38].
W jednym z nielicznych opracowań częstość
częściowej moczówki prostej oceniono na
30% [38]. Niekiedy objawom tym towarzyszył
wzrost osmotycznego progu pragnienia, jako
wynik uszkodzenia ośrodka osmotycznego
[18]. Objawy współistniejącej moczówki
prostej mogą być maskowane w warunkach
niedoboru kortyzolu, gdyż hormon ten jest
wymagany do wydalania ładunku wolnej
wody docierającego do cewki zbiorczej [41].
W tych przypadkach objawy poliurii mogą
uwidocznić się lub ulec nasileniu dopiero
po wyrównaniu wtórnej niedoczynności
nadnerczy [41]. Dlatego ocenę chorego pod
kątem współistnienia moczówki powinno
się przeprowadzić dopiero po wyrównaniu
funkcji nadnerczy [42]. Stąd też wielomocz
wydaje się występować częściej, jednak z
uwagi na częściowy charakter niedoboru
wazopresyny i współistniejące defekty
hormonalne u większości pacjentek jest
on słabo wyrażony i dlatego leczenie tego
stanu jest często zbędne lub też nie musi
być kontynuowane przez całe życie pacjentki
[39,40]. Możliwą przyczyną przejściowego
charakteru moczówki prostej jest częściowa
regeneracji wypustek nerwowych uwalniających wazopresynę, jak również częściowy
związek moczówki z obrzękiem podwzgórza
i/lub przysadki, mającym u większości chorych charakter przemijający [41].
Istnieją ponadto nieliczne opisy pacjentek, u których objawy niedoboru hormonów
płata przedniego przysadki stanowią konsekwencję zaburzeń sekrecji peptydów podwzgórzowych [44]. W takich przypadkach
podstawą różnicowania jest wzrost stężenia
hormonów płata przedniego przysadki w
testach czynnościowych z zastosowaniem
somatoliberyny, kortykoliberyny czy gonadoliberyny [28]. Być może opisywana częstość
zmian czynnościowych podwzgórza nie odzwierciedla ich rzeczywistego występowania
z uwagi na fakt, iż dodatni wynik powyższych
testów wymaga często długotrwałego podawania hormonów podwzgórza [28].
Niedokrwistość
Do typowych objawów klinicznych
stwierdzanych u chorych na zespół Sheehana zalicza się również niedokrwistość,
przypisywaną niedoborowi hormonów kory
nadnerczy, tarczycy i lub/gonad, za czym
przemawia fakt ustępowania powyższych
zaburzeń w wyniku włączenia suplementacji hormonalnej, zwłaszcza skojarzonego
podawania brakujących hormonów [45].
Niedokrwistość ma najczęściej charakter
normocytarny oraz normochromiczny i
występować może nawet u 80% osób z
zespołem Sheehana [43]. Znacznie rzadziej obserwuje się przypadki leukopenii i
trombocytopenii [43]. Całkowite ustąpienie
zmian jest zwykle obserwowane w wyniku
316
łącznego podania glukokortykoidów i Ltyroksyny [45]. Hormony te bowiem wydają
się stymulować erytropoezę, jak również
nasilać działanie erytropoetyny [1]. Ponadto
hormony tarczycy oraz GH wydają się pobudzać proliferację komórek prekursorowych
układu czerwonokrwinkowego [10]. W końcu niedokrwistość stanowić może zmianę
adaptacyjną do zmniejszonego zapotrzebowania na tlen [45]. Choć w większości
przypadków niedokrwistość jest niewielka
lub umiarkowana, u nielicznych chorych
osiągać może ona duże nasilenie [10,12].
Hiponatremia
Hiponatremia jest uważana za najczęstsze zaburzenie elektrolitowe w zespole
Sheehana, którego częstość ocenia się na
33-69% [12] i które u niektórych chorych
odpowiada za dezorientację, spowolnienie,
a w skrajnych przypadkach nawet śpiączkę
[11,46]. Do rozwoju hiponatremii dochodzi
w różnym okresie czasu od wystąpienia
uszkodzenia przysadki, sięgającym od kilku
miesięcy do 33 lat [11]. W zdecydowanej
większości przypadków jednak hiponatremia rozwija się po upływie wielu miesięcy
od uszkodzenia przysadki i ma charakter
przewlekły. Natomiast niesłychanie rzadko rozwija się we wczesnym okresie po
zadziałaniu czynnika sprawczego [46].
Jej podłoże wydaje się złożone i wynika z
niedoczynności nadnerczy, niedoczynności tarczycy, spadku objętości przestrzeni
płynowych i być może również zespołu
nieadekwatnego wydzielania wazopresyny
[11]. W zespole Sheehana dochodzić może
bowiem nie tylko do niedostatecznego ale
i nadmiernego wydzielania wazopresyny
[39]. Zarówno niedoczynność nadnerczy
jak i tarczycy obniżają stężenie sodu przez
zmniejszanie klirensu wolnej wody [13].
Rolę zaburzeń hormonalnych potwierdza
fakt, iż podawanie roztworu chlorku sodu
niejednokrotnie nie powoduje ustępowania
hiponatremii, która wymaga zastosowania
dodatkowo L-tyroksyny i hydrokortyzonu
[12]. Z racji prawidłowej sekrecji aldosteronu
stężenie potasu w osoczu mieści się zwykle
w granicach normy [13].
Zespół Sheehana a następna ciąża
Z uwagi na obecność wielokierunkowych zaburzeń hormonalnych, zwłaszcza
hipogonadyzmu hipogonadotropowego,
prawdopodobieństwo zajścia w ciążę w
przypadku nieleczonego lub niedostatecznie
leczonego zespołu Sheehana jest niewielkie
[17]. Należy jednak podkreślić, iż znane są
przypadki ponownego macierzyństwa u
kobiet z zespołem Sheehana w przypadku
częściowo zachowanej resztkowej sekrecji
gonadotropin [47]. Co ciekawe, wskutek stymulowania rozrostu przetrwałych komórek
przysadkowych - ciąża zmniejszała nasilenie objawów niedoczynności przysadki u
tych chorych [19].
Rozpoznanie
Diagnostyka laboratoryjna
Ocena wydzielania GH
Pulsacyjny charakter sekrecji GH
uzasadnia dokonanie oceny stężenia tego
hormonu w badaniach dynamicznych. W
przypadku obecności zmian w przysadce
lub współistniejących niedoborów hormonalnych przyjmuje się, iż nieprawidłowy wynik
jednego testu wystarcza do postawienia
rozpoznania [48]. Najczęściej stosowanym
z nich jest test hipoglikemii poinsulinowej,
którego dodatkową zaletą jest równoczesna
ocena aktywności osi podwzgórze-przysadka-nadnercza [31]. Ocenę stężenia GH w
ośrodku autorów pracy przeprowadza się w
warunkach wyjściowych oraz po 30, 45, 60
oraz 90 minutach od podania insuliny. Stosowana w powyższym teście dawka insuliny
wynosi zwykle 0,1 IU/kg, z wyjątkiem pacjentek szczególnie dużego ryzyka rozwoju
hipoglikemii, którym zaleca się podawanie
insuliny w dawce 0,05 IU/kg [31]. Test z insuliną wymaga intensywnego nadzoru pacjentki z uwagi na ryzyko wystąpienia głębokiej
hipoglikemii. Choć większość przeciwwskazań do zastosowania tego testu nie dotyczy
przedziału wiekowego, w którym dochodzi
do rozwoju zespołu Sheehana, jednak u
nielicznych kobiet nie można go wykonać
z uwagi na: padaczkę lub obecność innych
schorzeń, którym towarzyszą drgawki,
czynną chorobę niedokrwienną serca lub
uogólniony niedorozwój umysłowy. U większości zdrowych osób w teście hipoglikemii
poinsulinowej stwierdza się wzrost poziomu
GH powyżej 5 µg/l [31]. Natomiast ciężką
postać niedoboru GH definiuje się jako
maksymalna odpowiedź na hipoglikemię
nie przekraczającą 3 µg/l [31]. Alternatywą
do tego testu jest test z glukagonem lub test
łącznego podania somatoliberyny i argininy.
Ograniczeniem pierwszego z nich są objawy
uboczne (nudności, wymioty, bóle brzucha),
nadmierny efekt hipotensyjny oraz długotrwały przebieg badania [49]. Natomiast
test łącznego podawania somatoliberyny i
argininy, choć czuły i uważany jako najlepszy alternatywny test prowokacyjny do testu
hipoglikemii poinsulinowej, jednak trudny do
wykonania z uwagi na niewielką dostępność
somatoliberyny [50]. Należy pamiętać, iż
wartości referencyjne w tym teście zależą w
dużym stopniu od wartości wskaźnika masy
ciała [50]. Mniejszą rolę niż dawniej przypisuje się obecnie próbom prowokacyjnym
z zastosowaniem chlorowodorku argininy,
ornityny, lewodopy i w przeciwieństwie do
dzieci - klonidyny [31]. Cennym badaniem
do oceny funkcji komórek somatotropowych
jest ocena stężenia insulinopodobnego
czynnika wzrostu-I (insulin-like growth
factor-1: IGF-I) [49]. Stwierdzenie niskiego
stężenia tego hormonu nie pozwala jednak
jednoznacznie potwierdzić niedobór GH,
gdyż obniżone wartości stężeń IGF-I mogą
być obserwowane w chorobach wątroby
lub nerek, zaburzeniach funkcji tarczycy,
cukrzycy oraz w stanach złego odżywienia
(w tym w jadłowstręcie psychicznym), zaś
normy stężeń tego hormonu zależą od
wieku [49].
Ocena wydzielania prolaktyny
Typowym wykładnikiem zespołu Sheehana jest występowanie niskiej prolaktynemii. Należy pamiętać, iż w okresie poporodowym stężenie prolaktyny jest zwykle
fizjologicznie 5-10-krotnie podwyższona w
stosunku do stwierdzanej poza ciążą [17].
Stąd też w przypadkach zespołu Sheehana
rozwijających się w ciągu kilku miesięcy
R. Krysiak i B. Okopień
od porodu wykazanie stężenia prolaktyny
mieszczącego się w granicach normy dla
kobiet niekarmiących świadczyć już może o
niewydolności komórek laktotropowych [16].
Dużą wartość diagnostyczną w rozpoznawaniu zespołu Sheehana odgrywa ponadto
wykonanie testu z dożylnym podaniem
tyreoliberyny w dawce 100 µg, w którym
dokonuje się oceny stężenia prolaktyny w
warunkach wyjściowych i po 30 minutach
od podania tyreoliberyny [51]. Za wynik
dodatni w tym teście przyjmuje się zwiększenie prolaktynemii o co najmniej 300%
w porównaniu z wartościami wyjściowymi
[19]. W przypadku zespołu Sheehana wzrost
prolaktynemii jest znacznie mniejszy lub
niejednokrotnie nawet nieobecny. Test ten
jest jednak rzadko wykonywany z uwagi
na ograniczoną dostępność tyreoliberyny.
Należy podkreślić, iż niska prolaktynemia,
zarówno w warunkach wyjściowych, jak i w
teście stymulacji przez tyreoliberynę, jest
bardzo swoistym wykładnikiem zespołu
Sheehana. W przeciwieństwie do niego w
zdecydowanej większości jednostek klinicznych przebiegających z niedoczynnością
przysadki prolaktynemia jest albo prawidłowa albo zwiększona [51].
Ocena funkcji tarczycy
W przypadku rozwoju niedoczynności
tarczycy zwraca uwagę obniżone stężenie
wolnej tyroksyny, podczas gdy stężenie
całkowitej tyroksyny u 40-60% osób z wtórną
niedoczynnością tarczycy (niezależnie od
przyczyny) mieści się w granicach normy
i dlatego wartość tego badania jest ograniczona [48]. Stężenie całkowitej i wolnej
trijodotyroniny jest również obniżone lub
mieści się w normie [48]. Przy interpretacji
stężenia tyroksyny należy pamiętać o tym, iż
w ciągu pierwszych dni po porodzie stężenie
tyroksyny może nie ulegać jeszcze wyraźnemu obniżeniu z uwagi na długi, wynoszący
średnio 7 dni, biologiczny okres półtrwania
tego hormonu [16]. Jednak najbardziej
charakterystyczną cechą wtórnej niedoczynności tarczycy w zespole Sheehana jest zachowanie się stężenia TSH, które może być
obniżone, prawidłowe lub nawet podwyższone. Niskie stężenia TSH są obserwowane
w krótkim czasie od wystąpienia dysfunkcji
osi podwzgórze-przysadka-tarczyca [52].
W późniejszym okresie stężenia te często
ulegają normalizacji lub wzrastają powyżej
normy, najprawdopodobniej wskutek niskiego stężenia tyroksyny, przy czym wzrost ten
ma charakter toniczny [52].
W przypadkach zespołu Sheehana
pomimo podwyższonych wartości TSH amplituda stężeń tego hormonu ulega zmniejszeniu, zaś rytm dobowy spłaszczeniu [52].
U wielu kobiet nie obserwuje się również
istotnego wzrostu stężenia TSH w odpowiedzi na tyreoliberynę, nawet w przypadku jej
wielokrotnego podawania [53,36]. Trzeba
jednak pamiętać o ograniczeniach tego badania, które wykazuje niedostateczny wzrost
stężenia TSH po zastosowaniu tyreoliberyny
jedynie u 35-55% osób z wtórną niedoczynnością tarczycy [48]. Pomimo obecności
podwyższonych stężeń TSH aktywność
biologiczna hormonu jest zmniejszona, jako
wynik wzrostu stopnia sjalilacji cząsteczki
TSH oraz zmniejszonego powinowactwa
Przegląd Lekarski 2015 / 72 / 6
cząsteczki tego hormonu do receptora [52].
Przyczyną możliwego wzrostu stężenia TSH
w takich przypadkach jest przewlekła stymulacja przez tyreoliberynę, jak również wydłużenie okresu półtrwania TSH w następstwie
zmniejszenia klirensu tak zmodyfikowanej
cząsteczki TSH [53]. Wzrost stężenia TSH
może mieć ponadto związek ze współistniejącą niewydolnością nadnerczy, gdyż
glukokortykoidy obniżają stężenie TSH [10].
W końcu pewne znaczenie może odgrywać
niskie stężenie somatostatyny, związane
z niedoborem GH [52]. Poza zespołem
Sheehana obecność prawidłowego lub
podwyższonego stężenia TSH we wtórnej
niedoczynności przysadki jest stwierdzane
praktycznie wyłącznie w niedoczynności tarczycy pochodzenia podwzgórzowego, wówczas jednak odpowiedź TSH na podania
tyreoliberyny jest zachowana [52]. W tych
przypadkach upośledzone działanie TSH
to wynik zwiększenia zawartości mannozy,
nie zaś kwasu sjalowego [52].
Zwraca uwagę brak przeciwciał przeciwko peroksydazie tarczycowej oraz przeciwko tyreoglobulinie (za wyjątkiem osób
ze współistniejącym autoimmunologicznym
zapaleniem tarczycy). Nieobecność powyższych przeciwciał ma istotne znaczenie
w diagnostyce różnicowej, zwłaszcza w
przypadku podwyższonych stężeń TSH,
gdyż umożliwia wykluczenie najczęstszej
przyczyny pierwotnej niedoczynności tarczycy - choroby Hashimoto [53].
Ocena funkcji nadnerczy
Pewne rozpoznanie wtórnej niewydolności nadnerczy możliwe jest wówczas,
gdy stężenie kortyzolu w godzinach rannych
(8.00 i 9.00) wynosi poniżej 3,6 µg/dl i towarzyszy mu niskie stężenie ACTH [48]. Jeśli
stężenie to mieści się w przedziale między
3,6 µg/dl a 18 µg/dl, czyli wartością umożliwiającą pewne wykluczenie niewydolności
nadnerczy, należy dokonać oceny kortyzolemii w teście czynnościowym [54]. Od wielu
lat testem, uważanym za złoty standard
w diagnostyce niedoczynności nadnerczy
jest test hipoglikemii poinsulinowej [55]. W
oparciu o dane z piśmiennictwa i obserwacje
prowadzonych przez siebie pacjentów, autorzy pracy uważają za prawidłowy wynik tego
testu wzrost stężenia kortyzolu ponad 20
µg/dl w warunkach obniżenia glikemii poniżej 40 mg/dl [56]. U osób z niedoczynnością
nadnerczy maksymalne stężenie kortyzolu
w tym teście jest poniżej 18 µg/dl. Więcej
kontrowersji wzbudza zastosowanie testu
z podaniem tetrakozaktydu (Synacthen),
będącego 24-aminokwasowym fragmentem
ACTH [56]. Za reakcję prawidłową przyjmuje
się wzrost kortyzolemii powyżej 22 µg/dl
po 30 min od podania tetrakozaktydu [48].
We wtórnej niedoczynności nadnerczy,
charakterystycznej dla zespołu Sheehana,
w przeciwieństwie do niedoczynności pierwotnej test ten może wypadać prawidłowo w
ciągu pierwszych 6 tygodni od wystąpienia
martwicy przysadki, w czasie których dochodzi do rozwoju atrofii nadnerczy. Dlatego w
przypadkach krótszego odstępu czasowego
test z tetrakozaktydem może dawać prawidłowy wynik oznaczenia kortyzolemii [57].
Znacznie rzadziej wykonywanymi testami
są testy z kortykoliberyną (100 μg dożylnie)
i glukagonem (1 mg podskórnie). Istotnym
ograniczeniem przydatności pierwszego
testu jest stosunkowo niewielka czułość
i swoistość oraz problem w ustaleniem w
nim norm referencyjnych [56], natomiast
drugiego testu długi czas badania (3-5 h)
oraz niezbyt dobra tolerancja glukagonu
(nudności, wymioty) [58]. Pewną wartość
mieć może ponadto zbadanie stężenia
siarczanu dehydroepiandrosteronu, które w
niedoczynności nadnerczy (w tym w zespole
Sheehana) jest niskie [55,56].
Ocena funkcji hormonalnej gonad
Typową cechą zespołu Sheehana jest
współistnienie niskiego stężenia estradiolu
z mieszczącym się poniżej lub – rzadziej
– w dolnych granicach normy stężeniem
FSH i LH [13]. W teście z gonadoliberyną
stwierdza się niedostateczne zwiększenie
stężenia gonatotropin i pojawia się ono z
opóźnieniem [32]. Należy jednak podkreślić,
iż testy dynamiczne z zastosowaniem gonadoliberyny nie pozwalają na różnicowanie z
dostatecznie dużym prawdopodobieństwem
hipogonadyzmu hipogonadotropowego
pochodzenia podwzgórzowego i przysadkowego i dlatego mają ograniczone
wykorzystanie w ustalaniu optymalizacji
terapii, co powoduje, że ich zastosowanie
w diagnostyce jest niewielkie [32].
Badania obrazowe
Obraz zespołu Sheehana w badaniach
obrazowych: tomografii komputerowej i
rezonansie magnetycznym, zależy od fazy
tej choroby. We wczesnym okresie od wystąpienia niedokrwienia wielkość przysadki jest
zwykle prawidłowa lub nawet zwiększona i
niekiedy można w niej wykazać obecność
ognisk martwicy. Ogniska te mogą ujawnić
się jako zmiany hipointensywne w obrazach
T1-zależnych i hiperintensywne w obrazach
T2-zależnych, przy czym ogniska martwicy
występują obok ognisk perfundowanej
tkanki, wykazujących nieregularne wzmocnienie po podaniu gadolinu (wzmocnienie
w limfocytarnym zapaleniu przysadki jest
bardziej jednorodne) [16]. Trzeba jednak
podkreślić, iż stosunkowo rzadko w tym
okresie wykonuje się badania obrazowe i
dlatego prezentacja radiologiczna wczesnych stadiów zespołu Sheehana jest słabo
poznana [12]. Natomiast w fazie przewlekłej
wielkość gruczołu jest albo prawidłowa, albo
też ulega on zanikowi i w takich przypadkach
może dochodzić do rozwoju zespołu pustego siodła [10,21,59].
W diagnostyce różnicowej istotne znaczenie przypada ocenie siodła tureckiego,
które w przypadkach zespołu Sheehana
ma prawidłową wielkość lub jest niekiedy
nawet nieco pomniejszone. Natomiast w
pierwotnym zespole pustego siodła, jak
również w postaci tego zespołu wtórnej do
guza przysadki, będących - jak omówiono
to dalej - jednostkami chorobowymi wymagającymi różnicowania z zespołem Sheehana, wymiary dołu przysadki są często
zwiększone [18].
Diagnostyka różnicowa
W każdym przypadku zespołu Sheehana, należy wykluczyć przede wszystkim
inne schorzenie wykazujące udokumento317
wany związek z okresem ciąży i porodu,
czyli limfocytarne zapalenie przysadki.
Tym bardziej, iż w przypadku obecności
przewlekłego procesu zapalnego przysadka
często ulega obkurczeniu i w późniejszych
fazach tego schorzenia może dochodzić
do rozwoju pustego siodła. Różnicowanie
tych jednostek jest bardzo ważne z uwagi
na odmienne podejście diagnostyczne - w
przeciwieństwie do leczenia zespołu Sheehana w limfocytarnym zapaleniu przysadki
mózgowej można rozważyć diagnostykę
inwazyjną. Limfocytarne zapalenie przysadki ma podłoże autoimmunologiczne i - w
przeciwieństwie do zespołu Sheehana - nie
wykazuje związku z obecnością ostrego
powikłania hemodynamicznego. Charakterystyczną cechą limfocytarnego zapalenia
przysadki jest również jego współistnienie
z innymi chorobami autoimmunologicznymi
oraz zachowana laktacja [60]. W przeciwieństwie do zespołu Sheehana najbardziej typowym defektem hormonalnym w zapaleniu
przysadki mózgowej jest niedobór ACTH,
któremu niekiedy towarzyszy niedobór TSH,
podczas gdy wydzielanie gonadotropin
jest najczęściej, zaś GH prawie zawsze,
zachowane [61]. W badaniach obrazowych
przysadki dotkniętej stanem zapalnym
zwraca uwagę pogrubienie szypuły, jak
również częsta utrata hiperintensywności
płata tylnego (tzw. bright spot) w obrazach
T1-zależnych [61]. Pomimo tych różnic
przyjmuje się, iż w przeszłości wiele przypadków limfocytarnego zapalenia przysadki,
było błędnie rozpoznawane jako zespół
Sheehana [60]. W przypadku istnienia wątpliwości diagnostycznych należy dokonać,
w miarę możliwości, oceny przeciwciał
przeciwprzysadkowych, a w ostateczności
biopsji przysadki [62].
Pewne problemy diagnostyczne budzić
może również różnicowanie z późną fazą
pierwotnej (idiopatycznej) postaci zespołu
pustego siodła, tym bardziej, iż dotyczy on
czterokrotnie częściej kobiet niż mężczyzn,
zaś jego ryzyko wzrasta wraz z liczbą przebytych ciąż [59]. W przypadkach zespołu
pustego siodła wielkość dołu przysadki jest
zwykle prawidłowa lub zwiększona, zaś
schorzenie wiąże się często z otyłością i
nadciśnieniem tętniczym [62]. Innym kryterium wyróżniającym są współistniejące
bóle głowy (niekiedy o dużym nasileniu)
oraz zaburzenia widzenia, obserwowane
odpowiednio u 50% oraz 1,6-16% chorych
z zespołem pustego siodła [59]. Choć u
co czwartej osoby dochodzi do rozwoju
niedoborów hormonów płata przedniego
przysadki (głównie GH), jednak wydzielanie
prolaktyny jest albo prawidłowe, albo podwyższone (u co 10 osoby występują objawy
kliniczne hiperprolaktynemii) [63].
Bardzo rzadko wymagane jest również
wykluczenie martwicy w obrębie guza
przysadki [5]. W takim przypadku w obrazie
klinicznym zwracają często uwagę objawy
kliniczne nadprodukcji hormonów (hiperprolaktynemia, akromegalia, ACTH-zależny
zespól Cushinga), choć wskutek wyparcia
innych komórek przysadkowych mogą
ujawniać się również objawy niedomogi
hormonalnej [33]. Najczęściej do martwicy
guza dochodzi w wyniku włączenia farmakoterapii (leki dopaminergiczne, analogi
318
somatostatyny), jednak może rozwijać się
ona w ciąży [33]. W takich przypadkach rozstrzygające jest zwykle badanie tomografii
komputerowej lub rezonansu magnetycznego przysadki uwidaczniające obecność
ogniska nowotworowego, zlokalizowanego
wewnątrzsiodłowo lub przekraczającego
granicę siodła oraz częste asymetryczne
przemieszczenie szypuły przysadki.
Leczenie
Z uwagi na duże ryzyko związane z
nieleczeniem, w każdym przypadku wtórnej
niewydolności nadnerczy należy bezwzględnie włączyć terapię glukokortykoidami,
zwłaszcza hydrokortyzonem [56]. W przeciwieństwie do choroby Addisona w zespole
Sheehana nie jest wymagane podawanie
mineralokortykoidów, z uwagi na dominującą
rolę reniny i angiotensyny w wytwarzaniu aldosteronu. Hydrokortyzon jest preferowany
względem kortyzonu, ponieważ nie wymaga
wcześniejszych przemian enzymatycznych i co za tym idzie - jego stężenia w osoczu są
znacznie bardziej przewidywalne [56]. Choć
syntetyczne glukokortykoidy (prednizon,
prednizolon czy deksametazon), których
stosowanie jest wygodniejsze (można je
podawać w pojedynczej dawce dobowej),
znajdują pewne wykorzystanie w terapii, jednak ich podawanie niesie ze sobą jeszcze
większe ryzyko indukowania powikłań niż
w przypadku stosowania naturalnych glukokortykoidów [42]. Po podaniu doustnym
biodostępność hydrokortyzonu wynosi około
95%, szczytowe stężenie w osoczu jest
stwierdzane po około godzinie od podania,
zaś biologiczny okres półtrwania tego leku
wynosi 90 min [64]. Uzasadnia to podawanie hydrokortyzonu w 2-3 dawkach w ciągu
doby. We wtórnej niedoczynności nadnerczy zapotrzebowanie na hydrokortyzon
jest zwykle mniejsze niż w niedoczynności
pierwotnej i wynosi zwykle 15-25 mg/dobę
[1]. GH hamuje bowiem aktywność dehydrogenazy 11-α-hydroksysteroidowej typu 1,
enzymu katalizującego konwersję kortyzonu
do kortyzolu, a więc w stanach niedoboru
GH pewna część kortyzolu pochodzi ze
zwiększonej konwersji kortyzonu [32]. W
związku z tym zwiększone zapotrzebowanie na hydrokortyzon niekiedy obserwuje
się u osób z wtórną niedoczynnością kory
nadnerczy po zastosowaniu leczenia rekombinowanym GH. W warunkach niedoboru
dehydrogenazy 11-α-hydroksysteroidowej
typu 1 dochodzi bowiem do konwersji w
odwrotnym kierunku, katalizowanej przez
izoenzym typu 2 [64]. Jak wspomniano
uprzednio wtórna niedoczynność nadnerczy
może maskować objawy współistniejącej
moczówki prostej i dlatego wyrównanie
funkcji nadnerczy może doprowadzić do niekiedy dużego wzrostu diurezy [32]. Istotnym
utrudnieniem terapii hydrokortyzonem jest
brak markera określającego poprawność
doboru dawki. Większość autorów uważa,
że najlepszym parametrem jest ogólne samopoczucie pacjentki i dlatego monitoruje
terapię wyłącznie w oparciu o obraz kliniczny
[64]. Podobnie jak w innych przypadkach
niewydolności nadnerczy w sytuacjach
stresowych wymagane jest zwiększenie
dawki hydrokortyzonu [32]. Niektórzy, w tym
autorzy pracy, zalecają ponadto stosowanie
dehydroepiandrosteronu, najczęściej w
dawce dobowej 25-50 mg [56].
W leczeniu wtórnej niedoczynności tarczycy obowiązuje stosowanie L-tyroksyny,
która jest podawana najczęściej w dawce
dobowej 1,2-1,7 µg/kg. Dawki te są najczęściej mniejsze niż w leczeniu niedoczynności pierwotnej. Zapotrzebowanie na
tyroksynę wzrasta w przypadku stosowania estrogenów, które nasilają produkcję
globuliny wiążącej tyroksynę [48]. Jako
kryterium efektywności terapii przyjmuje się
utrzymywanie stężenia wolnej tyroksyny w
środku [36] lub zdaniem innych autorów [33]
w górnej połowie wartości referencyjnych.
W podgrupie kobiet z wyjściowo podwyższonym stężeniem TSH dochodzić może
do bardzo wyraźnego spadku stężeń tego
hormonu, co jest dodatkowym argumentem
potwierdzającym istnienie w tej grupie kobiet z zespołem Sheehana stymulującego
wpływu wysokiego stężenia tyreoliberyny
na produkcję immunologicznie, lecz nie
biologicznie, aktywnego TSH [52]. Dlatego
w przypadku stężenia TSH powyżej 0,5 mU/l
lub stężenia wolnej tyroksyny w zakresie
dolnego tercyla normy lub poniżej należy
podejrzewać niedostateczne wyrównanie
hormonalne, natomiast w przypadku stężeń
wolnej tyroksyny i wolnej trijodotyroniny powyżej górnego tercyla należy podejrzewać
zastosowanie zbyt dużej dawki [36]. Należy
również pamiętać, iż estrogeny (wskutek
indukowania wzrostu stężenia białka wiążącego tyroksynę) oraz rekombinowany
GH mogą zwiększać zapotrzebowanie na
hormony tarczycy [36]. Bardzo istotne jest
pamiętanie, iż w przypadkach współistniejącej niedoczynności tarczycy włączenie
terapii hydrokortyzonem powinno każdorazowo poprzedzać włączenie do leczenia
L-tyroksyny [64]. Hormony tarczycy nasilają
bowiem metabolizm glukokortykoidów i
mogą odmaskowywać lub zwiększać stopień niedoboru hormonów kory nadnerczy
(średnio o około 5 mg dobę) [33].
Celem leczenia objawów hipogonadyzmu (utrata libido, dyspareunia) zastosowanie znajduje najczęściej doustne podawanie
etynyloestradiolu w dawce 20-35 µg na dobę
[34]. Alternatywnie zastosowanie znajduje
walerianian estradiolu w dawce dobowej
2 mg i skoniugowane estrogeny końskie
w dawce dobowej 0,625-1,25 mg dobę
wraz z gestagenem podawanym cyklicznie
lub ciągle [34]. Podawanie gestagenów w
odstępach trzymiesięcznych nie stanowi
zadowalającej ochrony przed rozrostem
endometrium [32]. Zdaniem części autorów
najkorzystniejszą drogą podawania estrogenów jest droga przezskórna. W przeciwieństwie do drogi doustnej przezskórne
podawanie estrogenów nie powoduje
bowiem zwiększonej syntezy czynników prokoagulacyjnych oraz białek ostrej fazy, jak
również jest związane ze zmniejszeniem zapotrzebowania na rekombinowany GH [48].
Ponadto ta droga podawania estrogenów
nie powoduje wzrostu stężenia globuliny
wiążącej hormony płciowe i tym samym towarzyszy jej wyższe stężenie wolnego testosteronu, które wpływa korzystnie na ogólne
samopoczucie oraz aktywność seksualną
[48]. W przypadku planów macierzyńskich
wymagane jest stosowanie gonadotropin,
R. Krysiak i B. Okopień
przy czym dawki gonadotropin potrzebne
do indukcji owulacji są większe w stanach
niedoboru GH i ulegają zmniejszeniu po
zastosowaniu terapii rekombinowanym GH
[32]. W tym celu w początkowej fazie cyklu
stosuje się izolowany FSH lub ludzką gonadotropinę menopauzalną i ocenia rekrutację
pęcherzyków. W przypadku wzrostu jednego
lub dwóch pęcherzyków (większa liczba
grozi zespołem hiperstymulacji jajników)
podaje się pojedynczą dawkę ludzkiej gonadotropiny kosmówkowej, po której owulacja
następuje po 36-48 godzinach [33].
Najwięcej kontrowersji wzbudza podawanie rekombinowanego GH, które z
medycznego punktu widzenia powinno mieć
miejsce u wszystkich osób z niedoborem
tego hormonu. Celowość podawania rekombinowanego GH uzasadniają również
dane epidemiologiczne [8]. Choć dotyczą
one ogółu pacjentów z wielohormonalną niedoczynnością przysadki (nie tylko chorych z
zespołem Sheehana), jednak wynika z nich,
iż w przypadku niestosowania suplementacji
rekombinowanym GH śmiertelność jest
prawie dwukrotnie większa niż w populacji
ogólnej, pomimo stosowania glukokortykoidów, tyroksyny i hormonów płciowych [33].
Niestety, w większości krajów podawanie
GH u osób dorosłych jest albo nierefundowane (m.in. w Polsce) lub też rezerwowane
wyłącznie dla pacjentów z ciężką postacią
niedoboru GH [31]. Celem leczenia niedoboru GH u kobiet z zespołem Sheehana jest
nie tylko normalizacja fenotypu obserwowanego w stanach niedoboru tego hormonu,
ale również utrzymanie stężenia IGF-I w
górnej połowie przedziału referencyjnego
uwzględniającego wiek pacjentki (u młodych
dorosłych stężenia te są relatywnie duże)
oraz wartość wskaźnika masy ciała [64]. Zalecana dawka początkowa wynosi 0,15-0,3
mg/dobę (0,45-0,9 IU) i jest ona podawana
podskórnie raz na dobę w godzinach wieczornych, a następnie stopniowo zwiększana (o ok. 0,15 mg/dobę co miesiąc) do dawki
ostatecznej, która zwykle nie przekracza 1,0
mg/dobę [34]. U kobiet leczonych doustnie
estrogenami, w celu osiągnięcia podobnych
stężeń IGF-I i efektów metabolicznych, początkowa dawka GH powinna być większa
o około 50%, co stanowi najprawdopodobniej odzwierciedlenie hamującego wpływu
estrogenów na syntezę IGF-I [64]. U osób
otrzymujących rekombinowany GH siarczan
dehydroepiandrosteronu zwiększa odpowiedź na IGF-I, umożliwiając redukcję dawki
GH [33]. Po włączeniu rekombinowanego
GH zwiększa się klirens kortyzolu i dlatego
dawka hydrokortyzonu wymaga niewielkiego zwiększenia (średnio o 5 mg/dobę)
[33]. Zastosowanie rekombinowanego GH
powoduje również przejściową aktywację
dejodynazy i wynikającego z tego wzrost
stężenia trijodotyroniny i spadek stężenia
tyroksyny [32]. Zmiany te jednak są dyskretne, utrzymują się przez krótki okres czasu i
najczęściej nie wymagają modyfikacji dawki
tyroksyny [32].
Podawanie GH jest związane z wieloma
korzyściami klinicznymi: przywracaniem
prawidłowej masy ciała, zmniejszaniem
zawartości tłuszczu i zwiększaniem masy
mięśniowej, odwracaniem zmian miażdżycowych w naczyniach krwionośnych, hamoPrzegląd Lekarski 2015 / 72 / 6
waniem przewlekłego procesu zapalnego na
poziomie mediatorów stanu zapalnego oraz
wzrostem gęstości mineralnej tkanki kostnej
oraz tolerancji wysiłku fizycznego [65]. Podawanie GH doprowadza do redukcji ryzyka
sercowo-naczyniowego, obniżenia stężenia
cholesterolu całkowitego i cholesterolu LDL,
spadku stężenia fibrynogenu i homocysteiny, zmniejszenie grubości kompleksu
intima-media, jak również do wzrostu masy
lewej komory oraz zwiększenia objętości
wyrzutowej [3]. Wyniki większości badań
wskazują na to, że zastosowanie GH poprawia procesy pamięciowe, oraz zmniejsza
natężenie niepokoju, napięcia i lęku, jak
również poprawia jakość życia [33].
Nie stosuje się zwykle leczenia hipoprolaktynemii. Natomiast w rzadkich
przypadkach hiperprolaktynemii wskazane
jest stosowanie leków dopaminergicznych:
bromokryptyny, kabergoliny czy kwinagolidu
[22]. Przypadki moczówki prostej wymagają
podawania desmopresyny [34].
Podsumowanie
Zespół Sheehana jest jednym z niewielu schorzeń gruczołów wydzielania
wewnętrznego, który został opisany po
raz pierwszy przez Polaka. Sto lat, które
minęły od opublikowania w Przeglądzie
Lekarskim pracy Glińskiego, spowodowały
lepsze poznanie patogenezy tego zespołu,
jak również zmniejszenie - w następstwie
poprawy opieki okołoporodowej - częstości
jego występowania. Pomimo zmniejszenia
zapadalności, zespół Sheehana powinien
być zawsze uwzględniany w diagnostyce
różnicowej niedoczynności płata przedniego
przysadki, zwłaszcza w przypadku obciążającego wywiadu położniczego, jak również
objawów niedoboru GH, prolaktyny czy
gonadotropin. Wbrew błędnej opinii zespół
Sheehana jest rozpoznawany często wiele
lat po wystąpieniu epizodu niedokrwiennego związanego z porodem. Utrudnieniem
w rozpoznawaniu tej zapomnianej przez
wielu choroby jest bardzo różnorodna jej
manifestacja kliniczna. U niektórych pacjentek przebieg zespołu Sheehana jest
skąpoobjawowy i może manifestować się po
raz pierwszy klinicznie przełomem nadnerczowym. W diagnostyce zespołu Sheehana
najważniejsza rola przypada oznaczeniom
hormonalnym, wykonywanym zarówno w
warunkach wyjściowych, jak i w testach
prowokacyjnych. Na podkreślenie zasługuje
fakt, iż u wielu chorych stężenie TSH mieści
się w granicach normy lub nawet ją przekracza, jednak aktywność biologiczna hormonu
jest zmniejszona. Leczenie zespołu Sheehana polega na substytucji brakujących
hormonów. Przy ich stosowaniu należy pamiętać o istniejących interakcjach lekowych
pomiędzy poszczególnymi hormonami.
Piśmiennictwo
1. Kilicli F, Acibucu F, Dokmetas HS: Sheehan’s syndrome. Gynecol Endocrinol. 2013; 29: 292-295.
2. Simmonds M: Über Hypophysenschwund mit tödlichem Ausgang. Dtsch Med. 1914; 40: 322-329.
3. Gliński K: Z kazuistyki zmian anatomopatologicznych w przysadce mózgowej. Przegl Lek. 1913;
52: 13-14.
4. Sheehan HL: The frequency of post-partum hypopituitarism. J Obstet Gynaecol Br Commonw. 1965;
72: 103-111.
5. Kristjansdottir HL, Bodvarsdottir P Sigurjonsdottir
HA: Sheehan’s syndrome in modern times: a nationwide retrospective study in Iceland. Eur J Endocrinol.
2011; 164: 349-354.
6. Zargar AH, Singh B, Laway BA, Masoodi SR, Wani
AI, Bashir MI: Epidemiologic aspects of postpartum
pituitary hypofunction (Sheehan’s syndrome). Fertil
Steril. 2005; 84: 523-528.
7. Abs R, Bengtsson BA, Hernberg-Stâhl E, Monson
JP, Tauber JP. et al: GH replacement in 1034 growth
hormone deficient hypopituitary adults: demographic
and clinical characteristics, dosing and safety. Clin
Endocrinol (Oxf). 1999; 50: 703-713.
8. Kelestimur F, Jonsson P, Molvalilar S, Gomez
JM, Auernhammer CJ. et al: Sheehan’s syndrome:
baseline characteristics and effect of 2 years of
growth hormone replacement therapy in 91 patients
in KIMS - Pfizer International Metabolic Database.
Eur J Endocrinol. 2005; 152: 581-587.
9. Regal M, Páramo C, Sierra SM, Garcia-Mayor RV:
Prevalence and incidence of hypopituitarism in an
adult Caucasian population in northwestern Spain.
Clin Endocrinol (Oxf). 2001; 55: 735-740.
10. Ishikawa K, Sohmiya M, Furuya H, Kato Y: A case of
Sheehan’s syndrome associated with severe anemia
and empty sella proved 48 years after postpartum
hemorrhage. Endocr J. 1995; 42: 803-809.
11. Sert M, Tetiker T, Kirim S, Kocak M: Clinical report
of 28 patients with Sheehan’s syndrome. Endocr J.
2003: 50: 297-301.
12. Anfuso S, Patrelli TS, Soncini E, Chiodera P,
Fadda GM, Nardelli GB: A case report of Sheehan’s
syndrome with acute onset, hyponatremia and severe
anemia. Acta Biomed. 2009; 80: 73-76.
13. Schrager S, Sabo L: Sheehan syndrome: a rare
complication of postpartum hemorrhage. J Am Board
Fam Pract. 2001; 14: 389-391.
14. Lavallée G, Morcos R, Palardy J, Aubé M, Gilbert
D: MR of nonhemorrhagic postpartum pituitary
apoplexy. AJNR Am J Neuroradiol. 1995; 16: 19391941.
15. Amar AP, Weiss MH: Pituitary anatomy and physiology. Neurosurg Clin N Am. 2003; 14: 11-23.
16. Krysiak R, Kobielusz-Gembala I, Okopień B:
Choroby przysadki w ciąży i po porodzie. Przegl Lek.
2010; 67: 192-200.
17. Molitch ME: Pituitary disorders during pregnancy.
Endocrinol Metab Clin North Am. 2006; 35: 99-116.
18. Karaca Z, Keleştimur F: Pregnancy and other pituitary disorders (including GH deficiency). Best Pract
Res Clin Endocrinol Metab. 2011; 25: 897-910.
19. Keleştimur F: Sheehan’s syndrome. Pituitary 2003;
6: 181-188.
20. Sherif IH, Vanderley CM, Beshyah S, Bosairi S:
Sella size and contents in Sheehan’s syndrome. Clin
Endocrinol (Oxf). 1989; 30: 613-618.
21. Fleckman AM, Schubart UK, Danziger A, Fleicher
N: Empty sella of normal size in Sheehan’s syndrome.
Am J Med. 1983; 75: 585-591.
22. Tessnow AH, Wilson JD: The changing face of
Sheehan’s syndrome. Am J Med Sci. 2010; 340:
402-406.
23. Gokalp D, Tuzcu A, Bahceci M, Ayyildiz O, Yurt
M, Celik Y. et al: Analysis of thrombophilic genetic
mutations in patients with Sheehan’s syndrome: is
thrombophilia responsible for the pathogenesis of
Sheehan’s syndrome? Pituitary. 2011; 14: 168-173.
24. De Bellis A, Kelestimur F, Sinisi AA, Ruocco G,
Tirelli G. et al: Anti-hypothalamus and anti-pituitary
antibodies may contribute to perpetuate the hypopituitarism in patients with Sheehan’s syndrome. Eur
J Endocrinol. 2008; 158: 147-152.
25. Goswami R, Kochupillai N, Crock PA, Jaleel A,
Gupta N: Pituitary autoimmunity in patients with
Sheehan’s syndrome. J Clin Endocrinol Metab. 2002;
87: 4137-4141.
26. Goswami R, Kochupillai N, Crock PA, Jaleel A,
Gupta N: Conversion from latent to symptomatic
Sheehan’s syndrome by pegylated interferon
therapy for chronic hepatitis C. Intern Med. 2008;
47: 939-941.
27. Benvenga S, Campenní A, Ruggeri RM, Trimarchi
F: Hypopituitarism secondary to head trauma. J Clin
Endocrinol Metab. 2000; 85: 1353-1361.
28. Onose H, Tamura Y, Fujita H, Nakano T, Shibasaki T: A case of Sheehan’s syndrome with
panhypopituitarism due to the impairment of both
the hypothalamus and the pituitary. Endocr J. 2003;
50: 415-419.
319
29. Sencan M, Dokmetas HS: A case of postpartum
hypopituitarism accompanied by Cushing’s syndrome
as a result of an adrenocortical carcinoma. Endocr J.
2005; 52: 219-222.
30. Veldhuis JD, Hammond JM: Endocrine function
after spontaneous infarction of the human pituitary:
report, review, and reappraisal. Endocr Rev. 1980;
1: 100-107.
31. Krysiak R, Okopień B: Somatotropinowa niedoczynność przysadki mózgowej w wieku dorosłym. Przegl
Lek. 2007; 64: 583-589.
32. Lamberts SW, de Herder WW, van der Lely AJ:
Pituitary insufficiency. Lancet 1998; 352: 127-134.
33. Toogood AA, Stewart PM: Hypopituitarism: clinical
features, diagnosis, and management. Endocrinol
Metab Clin North Am. 2008; 37: 235-261.
34. van Aken MO, Lamberts SW: Diagnosis and
treatment of hypopituitarism: an update. Pituitary
2005; 8: 183-191.
35. Burke CW: Adrenocortical insufficiency. J Clin Endocrinol Metab. 1985; 14: 947-976.
36. Persani L: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges Clin Endocrinol
Metab. 1985; 14: 947-976.
37. Hanna SM: Hypopituitarism (Sheehan’s syndrome
presenting with organic psychosis). J Neurol Neurosurg Psychiatry 1970; 33: 192-193.
38. Atmaca H, Tanriverdi F, Gokce C, Unluhizarci
K, Kelestimur F: Posterior pituitary function in
Sheehan’s syndrome. Eur J Endocrinol. 2007 ;156:
563-567.
39. Bakiri F, Bendib SE, Maoui R, Bendib A, Benmiloud M: The sella turcica in Sheehan’s syndrome:
computerized tomographic study in 54 patients. J
Endocrinol Invest. 1991; 14: 193-196.
40. Laway BA, Mir SA, Dar MI, Zargar AH: Sheehan’s
syndrome with central diabetes insipidus. Arq Bras
Endocrinol Metabol. 2011; 55: 171-174.
41. Di Iorgi N, Napoli F, Allegri AE, Olivieri I, Bertelli
E. et al: Diabetes insipidus - diagnosis and manage-
320
ment. Horm Res Paediatr. 2012; 77: 69-84.
42. Hahner S, Allolio B: Therapeutic management
of adrenal insufficiency. Best Best Pract Res Clin
Endocrinol Metab. 2009; 23: 167-179.
43. Laway BA, Mir SA, Bashir MI, Bhat JR, Samoon J,
Zargar AH: Prevalence of hematological abnormalities in patients with Sheehan’s syndrome: response
to replacement of glucocorticoids and thyroxine.
Pituitary 2011; 14: 39-43.
44. Singer PA, Mestman JH, Manning PR, Nicoloff JT:
Hypothalamic-hypothyroidism secondary to Sheehan’s syndrome. West J Med. 1974; 120: 416-418.
45. Laway BA, Bhat JR, Mir SA, Khan RS, Lone MI,
Zargar AH: Sheehan’s syndrome with pancytopenia - complete recovery after hormone replacement
(case series with review). Ann Hematol. 2010; 89:
305-308.
46. Boulanger E, Pagniez D, Roueff S, Binaut R, Valat
AS. et al: Sheehan syndrome presenting as early
post-partum hyponatraemia. Nephrol Dial Transplant.
1999; 14: 2714-2715.
47. Malee MP: Pituitary and adrenal disorders in pregnancy. W: Gabbe S.G., Niebyl J.R., Simpson J.L.
(eds.): Obstetrics: normal and problem pregnancies.
Churchill Livingstone, Edinburgh 2007; Chapter 39.
48. Auernhammer CJ, Vlotides G: Anterior pituitary
hormone replacement therapy - a clinical review.
Pituitary 2007; 10: 1-15.
49. Gabellieri E, Chiovato L, Lage M, Castro AI, Casanueva FF: Testing growth hormone deficiency in
adults. Front Horm Res. 2010; 38: 139-144.
50. Abs R: Update on the diagnosis of GH deficiency in
adults. Eur J Endocrinol. 2003; 148: 3-8.
51. Shahmanesh M, Ali Z, Pourmand M, Nourmand I:
Pituitary function tests in Sheehan’s syndrome. Clin
Endocrinol (Oxf). 1980; 12: 303-311.
52. Oliveira JH, Persani L, Beck-Peccoz P, Abucham
J: Investigating the paradox of hypothyroidism and
increased serum thyrotropin (TSH) levels in Sheeha-
n’s syndrome: characterization of TSH carbohydrate
content and bioactivity. J Clin Endocrinol Metab.
2001; 86: 1694-1699.
53. Hepburn S, Farid S, Dawson J, Goodall S: Thyroid
function testing. Br J Hosp Med (Lond). 2012; 73:
114-118.
54. Nieman LK: Dynamic evaluation of adrenal hypofunction. J Endocrinol Invest.2003; 26: 74-82.
55. Wallace I, Cunningham S, Lindsay J: The diagnosis
and investigation of adrenal insufficiency in adults.
Ann Clin Biochem. 2009; 46: 351-367.
56. Krysiak R, Okopień B: Niedoczynność nadnerczy.
Wiad Lek. 2012; 65: 108-123.
57. Grinspoon SK, Biller BM: Laboratory assessment
of adrenal insufficiency. J Clin Endocrinol Metab.
1994; 79: 923-931.
58. Grossman AB: The diagnosis and management of
central hypoadrenalism. J Clin Endocrinol Metab.
2010; 95: 4855-4863.
59. Giustina A, Aimaretti G, Bondanelli M, Buzi F,
Cannavò S. et al: Primary empty sella: why and
when to investigate hypothalamic-pituitary function.
J Endocrinol Invest. 2010; 33: 343-346.
60. Foyouzi N: Lymphocytic adenohypophysitis. Obstet
Gynecol Surv. 2011; 66: 109-113.
61. Krysiak R, Okopień B, Herman ZS: Zapalenie przysadki mózgowej. Przegl Lek. 2007; 64: 515.
62. Maira G, Anile C, Mangiola A: Primary empty sella
syndrome in a series of 142 patients. J Neurosurg.
2005; 103: 831-836.
63. Agarwal JK, Sahay RK, Bhadada SK. Empty sella
syndrome. JIACM 2001; 2: 198-205.
64. Romijn JA, Smit JW, Lamberts SW: Intrinsic imperfections of endocrine replacement therapy. Eur J
Endocrinol. 2003; 149: 91-97.
65. Krysiak R, Gdula-Dymek A, Bednarska-Czerwińska A, Okopień B: Growth hormone therapy
in children and adults. Pharmacol Rep. 2007; 59:
500-516.
R. Krysiak i B. Okopień