Wydział Chemiczny Politechniki Gdańskiej
Katedra Technologii Leków i Biochemii
Biologia komórki
Porównanie metod dezintegracji komórek
Opracował : mgr Jan Lica;
Zatwierdził (21.04.2016) : dr hab. Ewa Augustin, prof. dr hab. inż. Andrzej Składanowski.
1. Wstęp
Dezintegracja
-
rozkład
lub
dekompozycja
jednolitej
nierozłącznej
struktury;
Dezintegracja komórek - proces powodujący utratę lub osłabienie integralności komórek;
Wydajność - ilość czegoś wytworzonego/uzyskanego z czegoś;
Wydajność metody dezintegracji komórek - stosunek masy produktu otrzymanego w
wyniku dezintegracji, do jego masy teoretycznej;
Utrata albo osłabienie spójności ściany komórkowej lub błony komórkowej, oddzielającej
komórki od środowiska zewnętrznego, powoduje uwolnienie ich zawartości. Dezintegracja
komórek służy pozyskaniu z komórek pożądanego materiału (Rysunek 1.). Pożądanym materiałem
mogą być organella komórkowe (np. mitochondria czy jądro komórkowe, Rysunek 6. A), enzymy
czy też inne związki chemiczne [1-3].
Wybór metody (techniki oraz procedury) dezintegracji komórek zależy od dalszego
wykorzystania wyizolowanego z komórki materiału. Niekiedy krytyczną właściwością decydującą o
przydatności wyizolowanego z komórki materiału jest zachowanie przez niego
aktywności
enzymatycznej (natywnej struktury). Wydajność i efektywność procesu dezintegracji zależy zaś od
wykorzystanego urządzenia, doboru parametrów jego działania, akcesoriów (Rysunek 5.) a także
kontroli środowiska reakcji.
2. Homogenizacja jako sposób dezintegracji komórek
Homogenizacja - proces tworzenia mieszaniny z składników niemieszających się;
Homogenizacja komórek - proces wytwarzania homogenatu (Rysunek. 1);
Homogenat - ekstrakt komórkowy uzyskany po dezintegracji komórek;
Homogenizator laboratoryjny - urządzenie mechaniczne służące do dezintegracji komórek;
1
Rysunek 1. Homogenizacja komórek
Rysunek 1. Schemat przedstawiający najpopularniejsze metody dezintegracji. Na postawie grafiki Garland
Publishing, 1996.
2.A. Homogenizacja przy użyciu homogenizatora laboratoryjnego
1) Homogenizator ultradźwiękowy - Sonikator – urządzenie wykorzystywane procesie dezintegracji
cząstek bądź komórek zawartych w zawiesinie przy użyciu fal ultradźwiękowych (dużej mocy i
małej częstotliwości 20 - 100 kHz). Utrata spójności komórki, następuje wskutek efektu kawitacji.
Kawitacja jest zjawiskiem dynamicznego wzrostu i zaniku pęcherzy parowo-gazowych w cieczy,
wywołane zmianami ciśnienia przy stałej temperaturze. O przebiegu zjawiska kawitacji decydują:
dyfuzja/odgazowanie, parowanie/kondensacja, bezwładność cieczy, napięcie powierzchniowe,
adhezja, lepkość cieczy. Siły mechaniczne tworzące się w miejscu zderzenia pęcherzyków
kawitacyjnych oraz fala uderzeniowa generowana po ich implozji są głównymi czynnikami
odpowiedzialnymi za uszkodzenie komórek. Efekt sonoporacji (nieodwracalne lub odwracalne
uszkodzenie błony komórkowej) potęgowany jest przez substancje o charakterze rodników,
tworzące się w wyniku termicznego rozkładu rozpuszczalnika i cząsteczek zawartych w
zderzających się pęcherzykach. Właściwy przebieg tego procesu zależy od parametrów
2
ultradźwięków, kształtu komórki sonikacyjnej, właściwości
oraz ilości medium poddawanego
sonikacji w tym obecności pęcherzy powierza i cząstek zawiesiny (Rysunek 2., 3., 4.) [4,5].
Rysunek 2. Budowa sonikatora ultradźwiękowego z kabiną/komorą dźwiękoszczelną
A
C
medium
transmisyjne
konwerter
dźwiękoszczelna
obudowa kabiny
głowica
B
cyfrowy panel
sterowania
komórka
sonikacyjna
stojak lub
statyw
laboratoryjny
dźwiękoszczelne
drzwi kabiny
Rysunek 2. Budowa sonikatora W-250 D Branson Ultrasonics, (Chiny); A - Głowica oraz układ elektroniczny
sterujący procesem generacji ultradźwięków; B - Kabina/komora dźwiękoszczelna; C - Uproszczony schemat
zestawu sonikacyjnego.
Rysunek 3. Formowanie oraz implozja pęcherzyków kawitacyjnych
A
B
C
D
E
F
Rysunek 3. A - Zdjęcie formowania pęcherzyków kawitacyjnych, pod wpływem fali dźwiękowej; B - Zdjęcie
pęcherzyka kwitującego; C - Erozja kawitacyjna, przebieg kolapsu pęcherzyka kwitującego w pobliżu ścianki;
D - Zdjęcie końcowej fazy kolapsu pęcherzyka kawitacyjnego; E - Pojedynczy wżer erozyjny wywołany
strumieniem cieczy przebijającym pęcherzyk położony bardzo blisko ściany; F - Pojedynczy wżer erozyjny
wywołany wtórnym kolapsem toroidalnego pierścienia pęcherzyków jaki powstaje, gdy zanikający pęcherzyk
położony jest nieco dalej od ściany [5,12].
3
Rysunek 4. Wybrane parametry wpływające na wydajność sonikacji
A
E
D = 6 mm
F
B
G
D = 30 mm
H
D = 20 mm
D = 50 mm
zwoje miedziane
rurka teflonowa
rdzeń ferromagnetyczny
izolator w postaci
tulei dystansowej
pręt z materiału
przenoszącego drgania
np. stal chromoniklowej
I
C
Rysunek 4. A - Schemat układu doświadczalnego do dezintegracji drożdży [4]; B - Schemat budowy głowicy
sonikatora. Drgania rezonansowe wytworzone - w środowisku - przez głowicę sonikatora powodują powstanie lokalnych mikroprzepływów o gwałtownie zmieniających się prędkościach. Przyczynia się do powstania
wokół pęcherzyków kawitacyjnych dużych naprężeń ścinających; C - Komórka sonikacyjna naczynie do
sonikacji kształtu rozetowego. Budowa naczynia - po uprzednim umieszczeniu w materiale chodzącym, (np.
mieszaninie woda-lód) obniża temperaturę sonikowanej próbki; E, F, G, H - Wpływ odległości głowicy emitera ultradźwięków od dna komórki sonikacyjnej na rozkład amplitudy ciśnienia akustycznego P[Pa], DT = 45
4
mm, V = 90 cm3, dH = 13 mm, f = 20 kH, A = 62 μm; I - Wpływ odległości głowicy emitera od dna komórki
sonikacyjnej D i średnicy komórki sonikacyjnej DT na stężenie uwolnionych protein dla V = 90 cm3, dH = 13
mm, f = 20 kH, A = 62 μm, czas procesu = 180 sekund; Saccharomyces cerevisiae, [4].
2) Homogenizator kulkowy – urządzenie stacjonarne (coraz częściej zautomatyzowane), służące
dezintegracji komórek przy wykorzystaniu
materiału rozbijającego w postaci kulek w
homogenizowanej zawiesinie (wyjątek „procedury suche”). Budowa i właściwości kulek
rozdrabniających, umożliwiają ich użycie w homogenizacji materiału biologicznego, takiego jak:
twarde tkanki zwierzęce (np. tkanka kostna, zęby), twardy materiał roślinny (np. korzeń, nasiona),
(Rysunek 5. D, E); miękkie tkanki zwierzęce (wątroba, serce, mózg, mięśni gładkie) oraz miękki
materiał roślinny (Rysunek 5. F); mikroorganizmy, bakterie oraz ich przetrwalniki (Rysunek 5. G);
biologiczny materiał środowiskowy (gleba, glina, osad, ścieki, odchody), (Rysunek 5. H, I).
Rysunek 5. Akcesoria laboratoryjnego homogenizatora kulkowego Bead Ruptor 12
A
C
B
D
G
E
H
F
I
Rysunek 5. A - Zautomatyzowany homogenizator kulkowy, B - Tarcza rotatora umożliwiająca osadzenie 6
próbek, C - Jednorazowe probówki laboratoryjne, D - Kulki ceramiczne (6,5 mm), E - Kulki metalowe (2,4
mm), F - Kulki ceramiczne (1,8 mm), G - Kulki szklane (0,1 mm), H - Kulki Garnet (0,7 mm), H - Kulki Garnet
(0,15 mm) [Omni International, USA].
5
3) Homogenizator statorowo-rotorowy - urządzenie służące wytworzeniu homogenatu przez
bezpośrednie uszkodzenie nożami głowicy rotora, błony lub ściany komórkowej; Ze względu na
sposób obsługi urządzenia możemy wyróżnić : homogenizator ręczny (Rysunek 6. B) oraz
stacjonarny
homogenizator
dużej
mocy.
Homogenizatory
stacjonarne
posiadają
niezautomatyzowany lub zautomatyzowany (głównie homogenizatory wielostanowiskowe i
wielozadaniowe) tryb pracy (Rysunek 6. C); W praktyce laboratoryjnej homogenizatory statoroworotorowe, (w zależności od budowy rotora i głowicy) wykorzystuje się do pracy z miękkimi lub
twardymi tkankami zwierzęcymi. Homogenizacja tego typu materiału biologicznego, często
wymaga dodania inhibitorów proteaz komórkowych oraz obniżenia temperatury mieszaniny
reakcyjnej (0-4oC).
Rysunek 6. Organella komórkowe, homogenizatory statorowo-rotatorowe;
A
B
C
Rysunek 6. A - Schemat występujących w komórce organelli komórkowych; 1. Błona komórkowa, 2. Cytoplazma, 3. Pęcherzyk fagocytarny, 4. Mitochondrium, 5. Retikulum wewnątrzplazmatyczne, 6. Rybosomy, 7.
Lizosomy, 8. Wodniczki, 9. Aparat Golgiego. 10. Centriole, 11. Błona jądrowa, 12. Jądro, 13. Jąderko; B Cyfrowy homogenizator ręczny z zespołem rozdrabniającym typu stator-rotor, Omni THq (Omni International,
USA); C - Zautomatyzowany wielozadaniowy homogenizator, Omni LH-96 (Omni International, USA).
4) Homogenizator ciśnieniowy (tzw. Prasa Frencha) - urządzenie służące dezintegracji poprzez
poddanie zawiesiny komórek wysokiemu ciśnieniu (podczas jej przemieszczania się przez ciasną
szczelinę) i gwałtownemu uwolnieniu do ciśnienia atmosferycznego. Metoda pozwala na
dezintegrację z wysoką wydajnością zawiesin komórek o objętości ok. 10-30 ml ale staje się
technicznie trudna dla mniejszych objętości i zbyt czasochłonna dla objętości większych. Używana
jest najczęściej do dezintegracji komórek bakteryjnych i drożdżowych.
6
2.B. Homogenizacja bez użycia homogenizatora laboratoryjnego
1) Trawienie enzymatyczne - degradacja przy wykorzystaniu enzymu składników ściany
komórkowej i otrzymaniu sfero/protoplastów. W przypadku bakterii używa się lizozymu trawiącego
bakteryjne peptydoglikany, u drożdży używana jest zymoliaza/glukanaza (enzym trawiący glukan
będący głównym składnikiem ściany komórkowej drożdży). Otrzymane sfero/protoplasy można
poddać szokowi osmotycznemu lub innej technice dezintegracyjnej/separacyjnej (Rysunek 7.) [6].
2) Szok/stres osmotyczny - nagła zmiana stężenia substancji rozpuszczonej wokół komórki,
powodująca gwałtowne zmiany osmotyczne. Osmoza to dyfuzja rozpuszczalnika przez
błonę/membranę rozdzielająca roztwory o różnym stężeniu. Komórki są wrażliwe na szok
osmotyczny gdy przetrzymywane są w roztworach hipotonicznych (o ciśnieniu osmotycznym
mniejszym niż w cytoplazmie). Metodę stosuje się głównie do lizy czerwonych komórek krwi
(erytrocytów), komórek pozbawionych ściany komórkowej (np. protoplastów bakterii), drożdży.
Rysunek 7. Przykłady homogenizacji bez użycia homogenizatora laboratoryjnego
B
A
C
D
E
Rysunek 7. A - Roztwór hipotoniczny (stężenie substancji rozpuszczonej poza komórką jest niższe od
stężenia substancji w
jej środowisku wewnętrznym). Dyfuzja rozpuszczalnika do komórki
powoduje
rozszczelnienie lub trwałą utratę spójności błony komórkowej; B - Roztwór izotoniczny (roztwór otaczający
komórkę ma takie samo stężenie substancji rozpuszczonej jak w jej środowisku wewnętrznym). Dyfuzja
rozpuszczalnika do komórki ma wartość stałą; C - Roztwór hipertoniczny (stężenie substancji rozpuszczonej
na zewnątrz komórki jest większe, od stężenia
substancji w
jej środowisku wewnętrznym; Dyfuzja
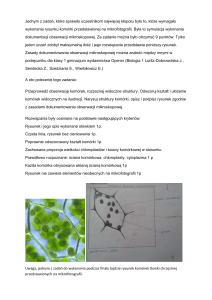
substancji rozpuszczonej z komórki do roztworu otaczającego powoduje jej obkurczenie; D - Zdjęcia z
mikroskopu świetlnego komórek drożdży, oraz wyizolowanych jąder komórkowych; a - Komórki drożdży w
fazie stacjonarnej, b - Komórki drożdży w fazie logarytmicznego wzrostu, c - Sferoplasty (twory podobne
do protoplastów, ale zawierające resztki materiału budującego ścianę komórkową) drożdży uzyskane pod
7
wpływem trawienia enzymatycznego, D - Jądra komórkowe (zaznaczone strzałkami) wyizolowane z
drożdżowych sferoplastów przez szok osmotyczny [7]; E - Jednorazowy zestaw do homogenizacji ręcznej
przez rozcieranie (Omni International, USA).
3) Rozcieranie -
dezintegracja komórek polegająca na ich ucieraniu (np. w moździerzu) z
substancjami ściernymi (np. piasek lub obojętny tlenek glinu) (Rysunek 7. E).
4) Liza detergentami i rozpuszczalnikami organicznymi. Metoda często używana do dezintegracji
komórek utrzymywanych w hodowli tkankowej oraz bakterii. Przy niskim stężeniu stosowanego
detergentu, pozwala zachować własności izolowanych białek. Najczęściej używane detergenty to:
Triton X-100, NP-40, dodecylan sodowy, siarczan sarkozylu, deoksycholan sodowy.
5) Zamrażanie/rozmrażanie - wzrost objętości zamarzającej w cytoplazmie wody oraz powstające
kryształy lodu powodują uszkadzanie ściany/błony komórkowej oraz organelli komórkowych.
Metodę stosuje się podczas izolacji odpornych na denaturację białek. Zamarzanie powoduje
częściową utratę wody hydratacyjnej białek co prowadzi do zmian ich własności (denaturacja).
Ograniczeniem jest również konieczność ochrony białek przed działaniem uwolnionych, głównie z
lizosomów, enzymów proteolitycznych.
Źródła multimedialne :
Zjawisko kawitacji wytworzone przez głowicę ultradźwiękową HBHO o średnicy 35mm;
http://sonomechanics.com/technical_resources/videos/?page=3
Zjawisko kawitacji wytworzone przez głowicę ultradźwiękową FBH o średnicy 35mm;
http://sonomechanics.com/technical_resources/videos/?page=4
Zjawisko kawitacji wytworzone przez głowicę ultradźwiękową FBH o średnicy 75mm;
http://sonomechanics.com/technical_resources/videos/?page=4
Homogenizacja przy wykorzystaniu homogenizatora kulkowego Bead Ruptor 24;
https://www.omni-inc.com/omni-bead-ruptor-24-bead-mill-homogenizer.html
Homogenizacja przy wykorzystaniu cyfrowego ręcznego homogenizatora stator-rotor;
https://www.omni-inc.com/high-shear-lab-homogenizers/omni-thq-digital-tissue-homogenizer/omnithq-digital-tissue-homogenizer.html?tab=fullapplication
Homogenizacja przy wykorzystaniu Prasy Frencha G-M;
http://www.glenmills.com/cell-disruption/high-pressure-homogenizer/french-press-gm/
8
3. Cel ćwiczenia :
Porównanie wydajności wybranych metod* dezintegracji komórek drożdży piekarniczych.
* metody wybrane do ćwiczenia:
1) homogenizacja przy użyciu homogenizatora ultradźwiękowego Branson,
2) homogenizacja przy użyciu stacjonarnego homogenizatora kulkowego (typu : Worteks),
3) liza detergentem : 1% SDS, 1% Triton X-100,
4) rozcieranie z wykorzystaniem moździerza i obojętnego tlenku glinu.
Materiały:
drożdże piekarnicze (Saccharomyces cerevisiae);
PBS: izotoniczny roztwór chlorku sodu buforowany fosforanami, Sigma (USA);
odczynniki do oznaczania białka metodą Bradford; błękit kumazyny G250 ang. Coomassie Briliant Blue, barwnik trifenylometanowy Imperial Chemical Industries,
(UK); Kwas ortofosforowy;
roztwór albuminy wołowej BSA (Sigma) w PBS o stężeniu 10 mg/ml;
1% roztwór SDS (dodecylosiarczan sodu) w PBS lub 1% roztwór Triton X-100 w PBS;
Sprzęt:
jednorazowe probówki 50 ml, Falcon (USA);
jednorazowe probówki 1.5 ml, Medlab (Polska);
jednorazowe końcówki do pipet, Medlab (Polska);
jednorazowe kuwety spektrofotometryczne, Medlab (Polska);
pipety automatyczne, Medlab (Polska);
wytrząsarka laboratoryjna typu Worteks, NeoLab 7-2020 (Niemcy);
spektrofotometr SP-830 plus, Metertech (Tajwan);
50 ml komórka sonikacyjna kształtu rozetowatego, G. Heinemann (Germany);
sonikator W-250 D Branson Ultrasonics, (Chiny);
szklane kulki o średnicy 2 mm;
moździerz, obojętny tlenek glinu;
9
Nadsącz (supernatant) - roztwór znad osadu; surowy ekstrakt;
Spektrofotometr - urządzenie służące ilościowemu pomiarowi transmisji lub odbiciu światła przez
próbkę (Rysunek 8 A.);
Absorbancja - ilościowa miara absorpcji (pochłaniania) światła, stosowana w spektrofotometrii do
oznaczania
stężenia
monochromatycznej
substancji
wiązki
w
roztworze;
wchodzącej
do
logarytm
ośrodka
dziesiętny
absorbującego
ilorazu
i
natężenia
natężenia
wiązki
przepuszczonej przez ten ośrodek (Lamberta-Beera prawo);
Absorpcja - pochłanianie; m.in. chemiczne pochłanianie gazu przez ciecz, fizyczne pochłanianie
promieniowania; w chemii proces dyfuzyjny polegający na pochłanianiu jakiejś substancji (zwany
absorbatem) przez całą objętość innej substancji, która tworzy odrębną fazę (zwany absorbentem).
Absorbatem jest najczęściej gaz lub ciecz, a absorbentem ciecz lub ciało stałe. Absorpcję prowadzi
się często w celu wydzielenia określonego składnika z mieszaniny gazów;
Metoda Bradford - opracowany przez Marion M. Bradford w 1976 roku, sposób oznaczania
stężenia białka. Wykorzystuje on zdolność tworzenia w roztworze kwasu ortofosforowego, wiązań
jonowych
i
oddziaływań hydrofobowych, pomiędzy błękitem
kumazyny,
a
zasadowymi
i
aromatycznymi resztami aminokwasowymi (głównie Agr, ale także His, Lys, Tyr, Typ, Phe).
Związanie błękitu kumazyny z białkiem powoduje przesunięcie jego maksimum absorbancji z 465
nm do 595 nm (czemu towarzyszy również zmiana barwy roztworu z brunatnej na niebieską a,
wzrost liczby niebieskich form barwnika jest proporcjonalny do zawartości białka w rozworze) [8,9].
Rysunek 8. Narzędzia służące do pomiaru absorbancji
A
C
B
10
Rysunek 8. A - Jednorazowe polistyrenowe kuwety spektrofotometryczne; B - Spektrofotometr SP-830 plus,
Metertech; C - Krzywa wzorcowa: zależność stężenie BSA - absorbancja roztworu; Protein Quantitation Kit,
(ab102535) Bradford Assay; abcam (USA).
4. Wykonanie ćwiczenia
A) Organizacja pracy;
Grupa odbywająca ćwiczenie zostanie podzielona na zespoły. Każdy zespół wykona
dezintegrację komórek wybranymi do ćwiczenia metodami. W każdym zespole będzie wyznaczona
osoba odpowiedzialna za wykonanie dezintegracji komórek oraz osoba odpowiadająca za
przygotowanie roztworów wzorcowych do wyznaczenia krzywej wzorcowej: zależność stężenie
BSA - absorbancja roztworu.
B) Przygotowanie próbek;
1) próbki do dezintegracji;
opisać/oznaczyć 50 ml probówki symbolem wybranej metody, a następnie odważyć do każdej z
nich po 2 gramy masy drożdży piekarniczych (w metodzie z moździerzem odważyć i przenieść do
misy moździerza).
Następnie z próbkami dla przypisanych metod należy postępować w następujący sposób :
- kontrola: 50 ml probówkę napełnić PBS do objętości 20 ml i zakręcić. Zawartość probówki
wytrząsać ręcznie przez dwie minuty, a następnie odstawić na 8 minut. Czynność tę powtórzyć
trzykrotnie. Tak przygotowaną próbkę wirować z pozostałymi próbkami (w ciągu 10 minut, w
temperaturze pokojowej, z prędkością 2500 obrotów na minutę). Klarowny nasącz zachować do
oznaczenia stężenia białka.
- do homogenizacji przy użyciu sonikatora: 50 ml probówkę napełnić (używając do tego celu 5 ml
pipety) PBS do objętości 20 ml, zakręcić, a następnie wytrząsać ręcznie przez 30 minut.
Przygotowaną próbkę przelać do komórki sonikacyjnej umieszczonej w układzie chłodzącym
(komórka sonikacyjna, woda/lód, styropian). Układ, zgodnie z instrukcjami prowadzącego
ćwiczenie, umieścić w sonikatorze i nastawić podane przez prowadzącego parametry generacji
ultradźwięków. Po sonikacji homogenat przelać na powrót do probówki 50 ml i zakręcić. Tak
przygotowaną próbkę wirować z pozostałymi (w ciągu 10 minut, w temperaturze pokojowej, z
prędkością 2500 obrotów na minutę). Klarowny nasącz zachować do oznaczenia stężenia białka.
- do homogenizacji przy użyciu stacjonarnego homogenizatora kulkowego: odważyć 16 g
szklanych kulek o średnicy 2 mm i przenieść do przypisanej probówki 50 ml. Pipetą 5 ml uzupełnić
PBS do objętości 20 ml. Próbówkę zakręcić i wytrząsać przez 30 minut przy użyciu Wortexu
(ustawić obroty maksymalne). Po homogenizacji przenieść zawiesinę komórek (posługując się 5
11
ml pipetą) do nowej probówki 50 ml, zakręcić i oznaczyć; (Uwaga: próbówkę falkon 50 ml
zawierającą szklane kulki, zakręcić i oddać prowadzącemu ćwiczenie). Przygotowaną próbkę
wirować z pozostałymi próbkami (w ciągu 10 minut, w temperaturze pokojowej, z prędkością 2500
obrotów na minutę). Klarowny nasącz zachować do oznaczenia stężenia białka.
- do homogenizacji przy użyciu detergentów (SDS i Triton X-100): do 2 próbówek falkon 50 ml,
zawierających po 2 g droży piekarskich, dodać odpowiednio 200 µl 10% SDS albo 200 µl 10%
Triton X-100 i uzupełnić PBS (za pomocą 5 ml pipety) do objętości 20 ml. Probówki zamknąć i
wytrząsać ręcznie przez dwie minuty, a następnie odstawić na 8 minut. Czynność tę powtórzyć
trzykrotnie. Tak przygotowaną próbkę wirować z pozostałymi próbkami (w ciągu 10 minut, w
temperaturze pokojowej, z prędkością 2500 obrotów na minutę). Klarowny nasącz zachować do
oznaczenia stężenia białka.
- do homogenizacji przez rozcieranie: do drożdży w moździerzu dodać 2 ml PBS i rozcierać do
uzyskania jednolitej kleistej masy (w przybliżeniu 25 minut). W czasie rozcierania dodawać
stopniowo 2 g obojętnego tlenku glinu. Do otrzymanego homogenatu dodać 4 ml PBS i dobrze
wymieszać. Przenieść zawiesinę do 50 ml probówki. Przepłukać dokładnie moździerz 5 ml PBS i
przelać zawartość do zawiesiny w
probówce. Próbówkę uzupełnić PBS do objętości 20 ml,
zakręcić i wytrząsać ręcznie przez 1 minutę. Tak przygotowaną próbkę wirować z pozostałymi
próbkami (w ciągu 10 minut, w temperaturze pokojowej, z prędkością 2500 obrotów na minutę).
Klarowny nasącz zachować do oznaczenia stężenia białka.
2) próbki do wyznaczenia krzywej wzorcowej zależności: stężenie BSA - absorbancja
roztworu Bradford;
- rozwory stężeń wzorcowych BSA w PBS; W probówkach 1,5 ml Przy użyciu pipet
automatycznych i jednorazowych końcówek wykonaj roztwór BSA o końcowej objętości 1 ml i
stężeniu :
0 - blank; 1; 2,5; 5; 7,5; 10; 25; 50; 100 [mg/ml] - w PBS. Stężenie roztworu
wyjściowego BSA 100 mg /ml PBS.
- roztwory odczynnika Bradford; przygotować w probówkach 1,5 ml roztwór odczynnika Bradford o
końcowej objętości 1 ml. Liczba przygotowanych próbek powinna zgadzać się z : liczbą próbek
stężeń BSA w PBS (0 - blank; 1; 2,5; 5; 7,5; 10; 25; 50, 100 [mg/ml]) oraz liczbą próbek
(homogenizowanych w eksperymencie wybranymi metodami).
C) pomiar;
- krzywa wzorcowa; do przygotowanych roztworów Bradford, pipetą automatyczną dodać (jeden
roztwór Bradford - jedno stężenie) po 20 µl roztworu stężeń wzorcowych BSA w PBS
(rozcieńczając tym samym stężenie BSA pięćdziesięciokrotnie). Probówki zamknąć i wytrząsać 30
sekund na Worteksie. Uruchomić spektrofotometr i ustawić pomiar absorbancji przy długości fali
λ=595 nm. Roztwór o stężeniu 0 przelać do jednorazowej kuwety spektrofotometrycznej. Umieścić
12
kuwetę, zgodnie z instrukcjami prowadzącego, w spektrofotometrze. Nacisnąć przycisk blank aby
wykalibrować urządzenie. Po dokonanej kalibracji otworzyć spektrofotometr, wyjąć kuwetę i
odstawić. Następnie do jednorazowej kuwety spektrofotometrycznej przenieść roztwór Bradford o
najniższym stężeniu BSA, kuwetę umięsić w spektrofotometrze, zamknąć wieko spektrofotometru,
odczytać i zapisać wynik, usunąć kuwetę. Tak samo postąpić z pozostałymi roztworami BradfordBSA, umieszczając je w spektrofotometrze w kolejności wzrostu ich stężeń. (Z uwagi na
oddziaływanie SDS i Triton X-100 z Bradford, do próbek dezintegrowanych przy użyciu
detergentów powinny zostać wyznaczone oddzielne krzywe wzorcowe zależności stężenie
detergent, BSA - absorbancja Bradford).
-
homogenizowane próbki: z poddanych homogenizacji i wirowaniu próbek, przenieść przy
pomocy pipety automatycznej, po 20 µl nadsączu do probówek z roztworem Bradford, zamknąć je
i wytrząsać na Worteksie w ciągu 30 sekund. Następnie otworzyć probówkę i przelać zawartość do
jednorazowej kuwety spektrofotometrycznej. Kuwetę umieścić w spektrofotometrze, zamknąć jego
wieko,
odczytać
i
zapisać
wynik
a
następnie
kuwetę
usunąć.
Dokonać
pomiaru
spektrofotometrycznego wszystkich próbek, wykonując je w kolejności wzrostu ich stężeń. Po
wykonaniu pomiaru absorbancji ostatniej próbki, ponownie umieścić w spektrofotometrze kuwetę
zwierającą roztwór Bradford-BSA o stężeniu 0, odczytać i zapisać wynik.
D) Opracowanie sprawozdania, (10 pt.);
1) Wstęp, (2 pt.);
Przedstawić cel ćwiczenia (1 pt.) oraz opisać wybraną (jedną) metodę dezintegracji komórek(1 pt.);
2) Opis ćwiczenia, (1 pt.);
Opisać czynności wykonywane podczas realizacji ćwiczenia na zajęciach (0,5 pt) oraz wymienić
wykorzystywane materiały (0,25 pt.) i urządzenia (0,25 pt.), z nazwą i krajem producenta;
3) Uzyskane wyniki (3 pt) :
Przy pomocy programu kalkulacyjnego-ilustratorowego wyznaczyć (krzywą standardową, A = f(c BSA)),
zależność stężenia BSA - absorbancja Bradford. Wynik jako wykres przebiegu krzywej umieść w
sprawozdaniu (0,5 pt.); Zaznaczyć na wykresie przebiegu krzywej wzorcowej zależności absorbancji BSA Bratford, wartości zależności absorbancji dezintegrowane próbki – Bradford (0,5 pt.). Obliczyć i podać w
opisie do rysunku, stężenia białka uzyskane w procesie dezintegracji wybranymi metodami (1 pt.). Na
podstawie uzyskanych danych porównać wydajność metod dezintegracji komórek; przedstawić w postaci
diagramu słupkowego/histogramu (1 pt.);
4) Dyskusja wyników (3 pt) :
Opisać, która z używanych metod dezintegracji jest najbardziej odpowiednia do rozbijania komórek drożdży;
13
5) Estetyka i jakość edytorska sprawozdania (1 pt.) :
Data odbycia ćwiczenia (0,1 pt.), nazwa przedmiotu (0,1 pt.), nazwa ćwiczenia (0,1 pt.), numer grupy
laboratoryjnej (0,1 pt.), imiona i nazwiska osób które sporządziły sprawozdanie (0,1 pt.), imię i nazwisko
prowadzącego ćwiczenie (0,1 pt.), numeracja i podpisy rysunków / numeracja i podpisy tabel (0,1 pt.), tekst
wyjustowany (0,1 pt.), stosowane akapity (0,1 pt.), literatura (0,1 pt.);
5. Literatura :
[1]
Piwnicka M., Darzynkiewicz Z. and Melamed M. R. (1983) RNA and DNA content of isolated
cell nuclei measured by Multiparameter Flow Cytometry. Cytometry,4(3):269-275.
[2]
Frezza C., Cipolat S and Luca Scorrano. (2007) Organelle isolation: functional mitochondria from
mouse liver, muscle and cultured filroblasts. Nature Protocols, 2:287 –295.
[3]
Sasidharan S., Chen Y., Saravanan D., Sundram K.M and Yoga Latha L. (2011) Extraction, Isolation
and Characterization of Bioactive Compounds from Plants' Extracts. Afr. J. Tradit. Complement.
Altern. Med.8(1): 1–10.
[4]
Bałdyga J. (2013) Zastosowanie ultradźwięków w procesach dezintegracji. Inż. Ap. Chem.,
52(3):144-146
[5]
Szantyr J. A. Lecture No. 22: Cavitation Physical basics - Hydrodynamic consequences;
[http://www.pg.gda.pl/~krzyte/students/MPWA22.pdf].
[6]
Lang K.S., Lang P.A., Bauer C., et al. (2005) Mechanisms of suicidal erythrocyte death. Cell. Physiol.
Biochem., 15(5):195–202.
[7]
Kiseleva E., Allen T.D., Rutherford S.A., Murray S., Morozova K., Gardiner F., Goldberg M.W. &
Drummond S.P. (2007) A protocol for isolation and visualization of yeast nuclei by scanning electron
microscopy (SEM). Nature Protocols,2:1943–1953.
Bradford M.M. (1976) A rapid and sensitive method for the quantitation of microgram quantities of
protein utilizing the principle of protein-dye binding. Anal. Biochem., 1976 72 (7):248-54.
[8]
[9]
Praca zbiorowa pod redakcją Sławomira Mileskiego. (2000) Biochemia, ćwiczenia laboratoryjne.
Gdańsk.
[10]
Bollag, D.H. and S.J. Edelstein (1992). Protein Methods. Wiley&Liss, New York.
[11]
Połomska X., KierulM., Dąbrowska A., Żarowska B. (2014). Porównanie efektywności izolacji
liniowych plazmidów DSDNA z drożdży Debaryomyces Hansenii w zależności od technik
dezintegracji komórki. Acta Sci. Pol., Biotechnologia, 13(2):5-16
[12]
Pishchalnikov Y. A., Sapozhnikov O.A., Bailey M. R., Williams J.C., Cleveland R. O., Colonius T.,
Crum L.A., Evan A.P. and McAteer J.A. (2003) Cavitation Bubble Cluster Activity in the Breakage of
Kidney Stones by Lithotripter Shock Waves. J Endourol., 17(7): 435–446.
14