WYKŁAD 4
ZWIĄZKI METALI PRZEJŚCIOWYCH
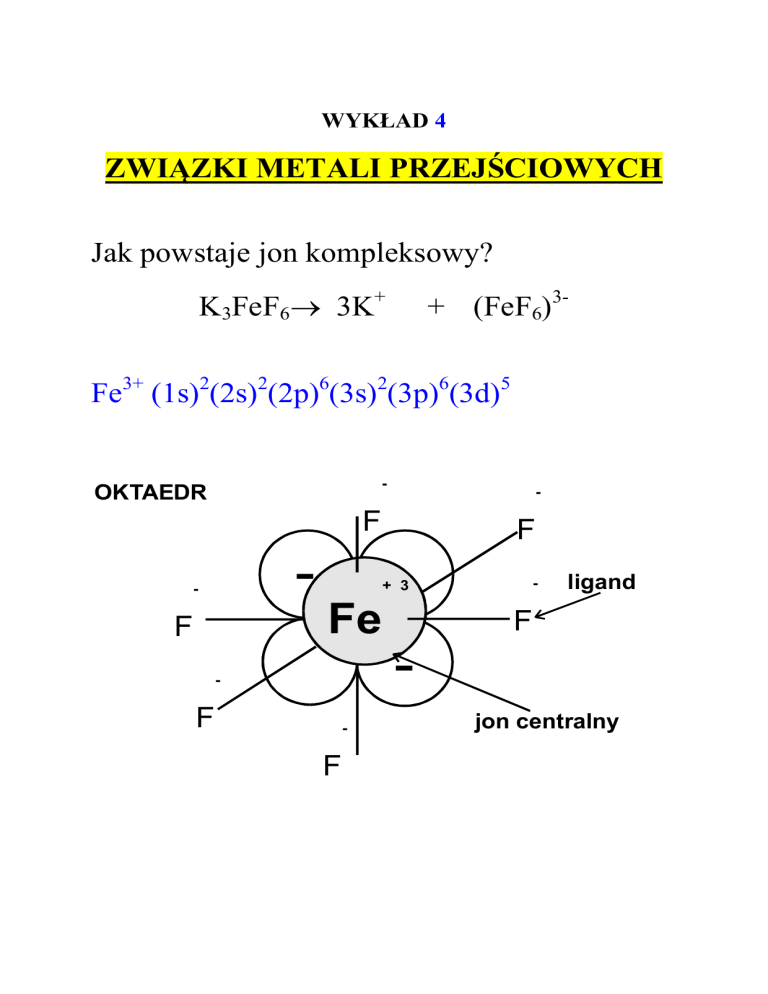
Jak powstaje jon kompleksowy?
K3FeF6→ 3K+
+ (FeF6)3-
Fe3+ (1s)2(2s)2(2p)6(3s)2(3p)6(3d)5
-
OKTAEDR
-
F
-
-
F
F
-
+ 3
Fe
-
F
-
F
-
ligand
F
jon centralny
Energia elektronów d jonu centralnego zmienia się pod
wpływem pola elektrycznego ligandów
∆E
Wolny
jon
Jon w polu
uśrednionym
ligandów
Jon w polu
ligandów
o wysokiej
symetrii
Co zyskujemy dzięki wysokiej symetrii
kompleksu?
∆E
3/5 ∆E
-2/5∆E
Wolny
jon
Kompleks
z uśrednionym Rzeczywisty
polem
kompleks
ligandów
oktaedryczny
WNIOSEK:
Kompleks zyskuje dodatkową energię stabilizacji
(2/5 ∆E dla każdego elektronu umieszczonego na
trzech najniższych poziomach) dzięki symetrii
oktaedrycznej.
KOMPLEKSY KOORDYNACYJNE Z WIĘKSZĄ
LICZBĄ ELEKTRONÓW JONU CENTRALNEGO.
1 elektron d : Ti+3: (1s)2(2s)2(2p)6(3s)2(3p)6(3d)1
∆E
energia stabilizacji ∆=-2/5∆E*1elektron =
-2/5∆E
2 elektrony d: V+3: (1s)2(2s)2(2p)6(3s)2(3p)6(3d)2
∆E
energia stabilizacji ∆=-2/5∆E*2elektrony=
-4/5∆E
3elektrony d:
Cr+3: (1s)2(2s)2(2p)6(3s)2(3p)6(3d)3
∆E
energia stabilizacji ∆=-2/5∆E*3elektrony=
-6/5∆E
4 elektrony d: Mn+3: (1s)2(2s)2(2p)6(3s)2(3p)6(3d)4
czy?
Konfiguracja
niskospinowa
∆E
Konfiguracja
wysokospinowa
Dwa procesy konkurencyjne:
a) elektron traci energię przy ustawieniu
antyrównoległym
(reguła Hunda)
b) elektron zyskuje energię stabilizacji(-2/5 ∆E)
∆E zależy między innymi od rodzaju ligandu
Szereg spektrochemiczny
I- ,Br- ,Cl- , F-,C2H5OH ,H2O ,NH3 ,NO2- ,CNcoraz większe rozszczepienie ∆E
i dlatego:
5 elektronów d:Fe+3: (1s)2(2s)2(2p)6(3s)2(3p)6(3d)5
Kompleks
wysokospinowy
Kompleks
niskospinowy
∆E
-3
[FeF ]
6
-3
[Fe(CN) ]
6
Rozszczepienie poziomów d jonu centralnego
w kompleksie o symetrii:
1. skróconej bipiramidy tetragonalnej
2. oktaedru
3. wydłużonej bipiramidy tetragonalnej
4. bipiramidy rombowej
dx -y
dz
dxy
2
dz
dx -y
dxz dyz
2
2
2
2
dxy
1
2
dxz dyz
2
3
Bipiramida
rombowa
Co decyduje o tym, że jeden jon tworzy
kompleks oktaedryczny a inny wykazuje
symetrię nieco odkształconą od oktaedru, np.
bipiramidy tetragonalnej?
Wszystkie atomy wchodzące w skład cząsteczki,
jonu lub dowolnego układu wieloatomowego
zajmują zawsze takie położenia, aby energia
całego układu była jak najniższa.
ENERGIA DECYDUJE O SYMETRII
KOMPLEKSU.
WNIOSKI:
1. JONY METALI PRZEJŚCIOWYCH
POSIADAJĄCE 1 LUB 9 ELEKTRONÓW d NIE
MOGĄ TWORZYĆ KOMPLEKSÓW
OKTAEDRYCZNYCH (np. Ti+3, Cu+2)
(bo skrócona bipiramida tetragonalna ma niższą
energię)
2. NISKOSPINOWE KOMPLEKSY (TZN, TAKIE W
KTÓRYCH WYSTĘPUJĄ LIGANDY DAJĄCE
DUŻE ROZSZCZEPIENIE) PIĘCIOKROTNIE
ZDEGENEROWANEGO POZIOMU d Z
SZEŚCIOMA ELEKTRONAMI d MOGĄ MIEĆ
SYMETRIĘ OKTAEDRU (np.Fe+2, Co+3 z ligandami
CN-)
3. KOMPLEKSY POSIADAJĄCE 3 LUB 8
ELEKTRONÓW d (np.V+2, Cr+3,Ni+2) MOGĄ MIEĆ
SYMETRIĘ OKTAEDRU
4. WYSOKOSPINOWE KOMPLEKSY (TZN.
KOMPLEKSY, W KTÓRYCH WYSTĘPUJĄ
LIGANDY DAJĄCE MAŁE ROZSZCZEPIENIE
PIĘCIOKROTNIE ZDEGENEROWANEGO
POZIOMU d) Z 5 ELEKTRONAMI MOGĄ MIEĆ
SYMETRIĘ OKRAEDRU.
x
-
+
-
+
y
dyz
z
z
+
+
x
y
dXY
y
+
+
-
x
dxz
z
z
+
x
+
+-
d
y
2
x
2
-y
z
+
y
x
+
2
dz
19
K : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)1
20
Ca : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2
Sc: (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)1
21
22
Ti : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)2
23
V : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)3
24
Cr : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)1(3d)5
25
Mn : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)5
26
Fe : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)6
27
Co : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)7
28
Ni : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)8
29
Cu : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)1(3d)10
30
Zn : (1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10
+3
Ti22 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)1
+3
V23 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)2
+2
V23 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)3
+3
Cr24 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)3
+2
Cr24 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)4
+3
Mn25 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)4
+2
Mn25 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)5
+3
Fe26 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)5
+2
Fe26 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)6
+2
Cu29 : (1s)2(2s)2(2p)6(3s)2(3p)6 (3d)9
0-jon metalu przejściowego bez ligandów
1-jon metalu przejściowego w uśrednionym polu ligandów
2-jon w polu ligandów o symetrii oktaedrycznej
3-jon w polu ligandów o symetrii bipiramidy wydłużonej
4-jon w polu ligandów o symetrii bipiramidy skróconej
5-jon w polu ligandów o symetrii bipiramidy rombowej
1
1
5
4
2
2
3
0
0-jon metalu przejściowego bez ligandów
1-jon metalu przejściowego w uśrednionym polu ligandów
2-jon w polu ligandów o symetrii oktaedrycznej
3-jon w polu ligandów o symetrii bipiramidy wydłużonej
d
d
dxy
dxzdyz
2
1/2∆Ε
−1/2∆Ε
x
2/3∆Ε
−1/3∆Ε
0
1
2
3
-y
2
z
2
0-jon metalu przejściowego bez ligandów
1-jon metalu przejściowego w uśrednionym polu ligandów
2-jon w polu ligandów o symetrii oktaedrycznej
4-jon w polu ligandów o symetrii bipiramidy skróconej
d 1/2∆Ε
d −1/2∆Ε
dxzdyz 1/3∆Ε
−2/3∆Ε
dxy
2
z
2
x
2
-y
4
2
1
0
0-jon metalu przejściowego bez ligandów
1-jon metalu przejściowego w uśrednionym polu ligandów
2-jon w polu ligandów o symetrii oktaedrycznej
d d
2
x
2
-y
2
z
3/5∆Ε
-2/5∆Ε
1
2
0
dxy dxz dyz