Atom jako najmniejsza
cząsteczka
Atom
Atom (gr. atomos; „niepodzielny”) –najmniejszy,
niepodzielny metodami chemicznymi składnik
materii. Atomy składają się z jądra i otaczających jądro
elektronów. W jądrze znajdują się protony i neutrony.
Atomy są podstawowymi elementami budującymi
materię w chemii i nie zmieniają się w reakcjach
chemicznych.
Rozmiary atomu
Rozmiary atomu nie są dokładnie
określone,
zależą od rodzaju atomu i innych
czynników, są
rzędu 10-9 m (nanometr).
Masa w przedziale 10-27 – 10-25 kg.
Masa atomowa
Masa atomowa – liczba określająca, ile
razy jeden atom danego pierwiastka jest
cięższy od 1/12 izotopu 12 C. Masa
atomowa wyrażana jest w jednostkach
masy
atomowej – unitach [u].
Wzorzec masy atomowej
mu = 1u ≈ 1,6605387313 ∙ 10-27 kg
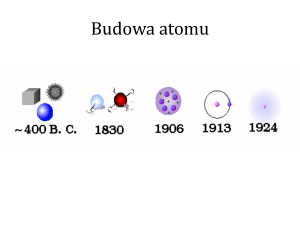
Model budowy atomu
Model Thomsona
W 1903 r. J.J. Thomson
zaproponował następujący
model atomu. Atom ma postać
kuli równomiernie wypełnionej
elektrycznym ładunkiem
dodatnim, wewnątrz której
znajduje się elektron.
Sumaryczny ładunek dodatni
kuli równy jest ładunkowi
elektronu, tak więc atom jako
całość jest obojetny
elektrycznie.
Model Rutherforda
Model Bohra
Według tego modelu
elektron krąży wokół
jądra jako
naładowany punkt
materialny,
przyciągany do jądra
siłami
elektrostatycznymi.
Atom węgla
Masa jednego atomu węgla wynosi
12,0107 u.
Atom wodoru
Masa atomu wodoru wynosi 1 u.
Atom tlenu
Masa atomu tlenu wynosi 15,994 u.
Atom żelaza
Masa atomu żelaza wynosi 55,845 u.
Atom złota
Masa atomu złota wynosi 196,96655 u.
Wykonał:
Norbert Alankiewicz