Budowa atomu
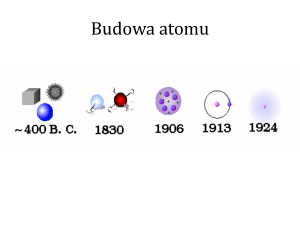
Współczesny model atomu
Rozwój poglądów na budowę materii
Empedokles – pierwasza teoria później
rozwinięta przez Arystotelasa, wg tej teorii
materię stanowiły 4 żywioły:
- Powietrze – mokre i gorące,
- Ogień – suchy i gorący,
- Ziemia – sucha i zimna,
- Woda – mokra i zimna.
Żywioły mogą się łączyć, gdy mają
przynajmniej jedną wspólną cechę.
Cd.
W V i IV w p.n.e. Grecy Demokryt i
Leukippos twierdzili, że materia
zbudowana jest z niepodzielnych drobin –
atomów (z greckiego ATOMOS),
Teoria atomistyczna „odżyła” na początku
XIX w, poniważ umożliwiała wyjaśnić
prawa chemiczne,
Cd
-
-
W 1803r John Dalton ogłosił, że za
pomocą pojęcia atom można wyjaśnić
podstawowe, doświadczalne prawa
chemiczne wcześniej sformułowane, np.;
Prawo zachowania masy (1789 Antoine
Laurent Lavoisier i Michaił Łomonosow),
Prawo stałości składu związku
chemicznego (1770 Joseph Louis Proust)
Cd
Atomistyczna teoria Daltona wyjaśniała
odkryte w 1811r prawo Avogadra oraz
umożliwiła uszeregowanie w 1869r przez
Dymitra Mendelejewa znanych
pierwiastków w układzie okresowym
Założenia hipotezy atomistycznej
Daltona
Atomy danego pierwiastka są jednakowe,
Atomy są niepodzielne,
Atomy łączą się w cząsteczki
2. Model atomu wg Thomsona
Pod koniec XIX w pojawia się pogląd, że atom
jest podzielny i zbudowany z mniejszych
cząsteczek
Podstawą powyższego poglądu były odkrycia
Antoin`a Henriego Becquerel`a, Marii
Skłodowskiej-Curie, Pierre`a Curie. Odkryli oni,
że atomy niektórych pierwiastków samorzutnie
emitują cząsteczki afla i beta oraz
promieniowanie gamma – promieniotwórczość
naturalna.
Cd
W 1887r Joseph John Thompson odkrył
istnienie ujemnie naładowanej cząstki m
niejszej od atomu – ELEKTRON o masie
1/1840u (9,11·10-31kg i ładunku
1,6·10-19C (ładunek -1),
Thompson przedstawiał atom jako
przestrzennie ciągły ładunek dodatni (+),
w którym tkwią punktowe ładunki ujemne
(-) elektrony.
3. Atom wg Ernestra Rutherforda
W 1911 E. Rutherford doświadczalnie
obalił pogląd Thompsona (atom jako
przestrzennie ciągły ładunek dodatni),
przepuszczając przez folię złota strumień
cząsteczek alfa, tylko część cząsteczek
spotykało na swojej drodze ładuneki +,
które odbijały je odbijały, część cząsteczek
alfa przechodziło przez folię.
Cd.
E. Rutherford zaproponował planetarny
model atom, który zakładał, że atom
składa się z dodatnio naładowanego jądra
i krążących wokół nich elektronów,
Rozmiary jądra są bardzo małe w
porównaniu do rozmiaru atomu (nieliczne
cząsteczki alfa były odbijane lub
odchylane)
4. Atom wg Bohra
Sprzeczność w modelu atomu Rutherforda
*elektron krążący po orbicie z pewnym
przyspieszeniem odśrodkowym emituje
falę elektromagnetyczną wytracając swoją
energię zbliżając się do jądra. Więc po
ok. 10-6s atom powinien przestać istnieć,
jednak atomy z reguły są trwałe.
cd.
W 1913r Niels Henrik Bohr założy, że w
fizyce atomów nie mają zastosowania
prawa fizyki klasycznej,
Założył, że elektron krąży wokół jądra po
torze zamkniętym, ściśle określonym
energetycznie – czyli orbicie stacjonarnej,
nie pobierając, ani nie tracąc energii, jeżeli
elektron zmienia energię to musi zmienić
orbitę,
cd.
Elektron pobierając energię w ściśle
określonej porcji – KWANT ENERGII,
przeskakuje na orbitę bardziej oddaloną
od jądra, a tracąc kwant energii,
przechodzi na orbitę bliższą jądra
atomowego,
Elektron w atomie ma więc pewien stan
kwantowy związany z własną energią,
Cd
Stan podstawowy atomu, to stan o
najniższej możliwej energii elektronów w
atomie, a każdy stan o wyższej energii
elektronów, to stan wzbudzony,
Wg tej teorii atom składa się z dwóch
obszarów: dodatnio (+) naładowanego
jądra i ujemnie (-) naładowanej sfery
elektronowej,
Cd
Mechanika kwantowa zakłada, że w
świecie atomów nie obwiązują prawa fizyki
klasycznej,
Wszystkie obiekty mikroświata zachowują
się jednocześnie jako cząsteczki
materialne – korpuskuły mające masę, i
jak fale elekromagnetyczne,
Tę właściwość określa się jako dualizm
korpuskularno – falowy.