Atom - fizyka.doc
(1019 KB) Pobierz
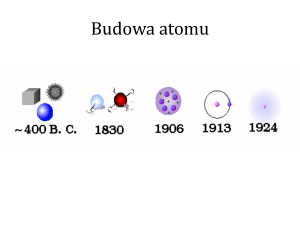
BUDOWA ATOMU
Pojęcie atomu - już w V wieku p.n.e. grecki filozof Demokryt zakładał, że wszelka materia składa się z
niepodzielnych i niezmiennych cząstek - atomów, a różnice składu chemicznego i stanu fizycznego
materii pochodzą z różnic wielkości, postaci, liczby i porządku, tworzących ją atomów.
Odkrycia fizyków i chemików dziewiętnastego wieku stworzyły z koncepcji filozoficznej - podstawy
wiedzy o wewnętrznej budowie materii. Jej zasady były następujące:
• atomy stanowią elementarne, niepodzielne cząstki materii
• istnieje tyle rodzajów atomów, ile jest pierwiastków chemicznych, przy czym każdy pierwiastek
charakteryzuje się określoną masą atomową
• związki chemiczne powstają przez połączenie atomów różnych pierwiastków w prostych stosunkach
liczbowych.
Odkrycie promieni katodowych – to jedno z ważniejszych odkryć, które przyczyniło się do rozwoju
badań w dziedzinie budowy materii. Do opróżnionej z powietrza szklanej bańki wprowadzono dwie
elektrody (katodę i anodę), a następnie przyłożono do nich wysokie napięcie. Katoda stała się źródłem
nieznanego promieniowania, które powodowało fluorescencję szkła (zielonkawe świecenie rury szklanej,
w miejscach naprzeciw ujemnej katody). Źródłem tego promieniowania była katoda, dlatego nazwano je
promieniowaniem katodowym. Badania wykazały, że promienie katodowe:
• emitowane są prostopadle do powierzchni katody, w przeciwieństwie do promieni światła, które ze
źródła rozchodzą się we wszystkich kierunkach,
• pobudzają do świecenia niektóre substancje umieszczone na ich drodze wewnątrz rury katodowej,
• nie przenikają przez przegrody metalowe,
• rozchodzą się po liniach prostych, powstaje cień, gdy umieścimy jakiś przedmiot między katodą, a
ekranem (fosforyzująca ścianka rury),
• niosą ujemny ładunek elektryczny, (gdy promieniowanie katodowe przechodzi pomiędzy okładkami
naładowanego kondensatora, to promienie odchylają się w kierunku elektrody dodatniej),
• składają się z ujemnie naładowanych cząsteczek; wiązka promieni katodowych odchylana jest przez
pole magnetyczne tak samo jak strumień ujemnie naładowanych cząstek,
• cząstki promieniowania posiadają masę, pęd i energię kinetyczną - umieszczony na drodze promieni
wiatraczek obraca się.
Odkrycie elektronów.
Joseph John Thomson wykonał doświadczenie, w którym użył szklanej rury z umocowaną z
jednej strony katodą. Wokół rury wytworzono pole elektryczne i pole magnetyczne. Pole
magnetyczne odchyla cząstki w kierunku pionowym do dołu, a pole elektryczne pionowo do
góry. Tak dobrano natężenie pola elektrycznego i natężenie pola magnetycznego, by cząstki
poruszały się bez zmiany kierunku, a siła elektrostatyczna zrównoważyła się z siłą Lorentza.
czyli:
stąd prędkość cząstek wynosi:
Gdy wyłączono pole elektryczne, pole magnetyczne zakrzywiało tor ruchu cząstek. Poruszały się
one po łuku, a siła Lorentza pełniła rolę siły dośrodkowej:
lub
Po przekształceniach i podstawieniu prędkości otrzymujemy:
Obliczony stosunek okazał się blisko 2000 razy większy niż taki stosunek dla jonu wodoru
(najmniejszej znanej wówczas cząstki). Ładunki q obu cząstek były równe, więc masa cząstek
odkrytych przez Thomsona była blisko 2000 razy mniejsza od masy jonu wodoru. Te cząstki
nazwano elektronami.
Po odkryciu elektronów przez Thomsona postulat, zgodnie z którym atom miał być niepodzielny
upadł. Elektrony okazały się bowiem składnikami atomów. Potrzebny był nowy model, który
tłumaczyłby prawa rządzące światem w skali mikro.
Budowa atomu według Thomsona (model rodzynkowy) – model atomu zaproponowany przez
brytyjskiego fizyka J. J. Thomsona w 1897r.. W modelu tym Thomson założył, że każdy atom
jest zbudowany z jednorodnej kuli naładowanej dodatnio, wewnątrz której znajdują się ujemnie
naładowane elektrony. Model atomu zaproponowany przez Thomsona został nazwany modelem
"ciasta z rodzynkami”, bowiem elektrony umieszczone są w kuli ładunku dodatniego tak jak
rodzynki w cieście. Całkowita ilość ładunków ujemnych zgromadzonych na elektronach jest
równa dodatniemu ładunkowi zgromadzonemu na kuli. W atomie znajdującym się w stanie o
najniższej energii elektrony były nieruchome. Natomiast w atomach o wyższej energii, tzn. w
atomach wzbudzonych (np. w wysokiej temperaturze) elektrony wykonywałyby drgania wokół
położeń równowagi. Drgający elektron wysyła promieniowanie i w ten sposób model Thomsona
wyjaśniał zjawisko emisji promieniowania przez wzbudzone atomy. Jednak zgodności ilościowej
z doświadczeniem nie uzyskano. Dostarczając energię elektronom zwiększamy ich prędkość. Po
dostarczeniu wystarczającej energii elektrony mogą opuścić atom.
Budowa atomu według Rutherforda (model jądrowy, planetarny)
Model "ciasta z rodzynkami" został obalony w eksperymencie ze złotą folią, przeprowadzonym
przez Ernesta Rutherforda i opisanym w 1911 roku.
Cząstki alfa (podwójnie, dodatnio naładowane cząstki o masie zbliżonej do masy atomu helu o
dużej energii) emitowane w wyniku promieniotwórczego rozpadu izotopu polonu 214Po zostały
skierowane na tarczę, którą były atomy złota w postaci bardzo cienkiej folii. Rozproszone
cząstki alfa rejestrowane były na ekranie scyntylacyjnym. Analiza kątów rozproszenia cząstek
alfa pozwoliła określić rozmiary ładunku dodatniego wchodzącego w skład atomu złota (Au).
Rezultat był jednoznaczny i nieoczekiwany. Okazało się, że prawie cała masa atomu skupiona
jest w bardzo małym obszarze atomy. Ten masywny obiekt, w którym zgromadzony jest ładunek
dodatni, nazwany został jądrem atomowym. Rozmiar jądra zależy od pierwiastka, ale może być
oszacowany, jako 10-14-10-15 m. Jest to rozmiar tysiące razy mniejszy niż obszar zajmowany przez
elektrony. Elektrony są lekkimi, ujemnymi cząstkami, których obecność powodujące, że atom
jest obojętny. Obszar, w którym są zlokalizowane elektrony określa rozmiar atomu (tysiące razy
większy niż rozmiar jądra).
Według teorii Thomsona cząstki alfa swobodnie pokonują wnętrze atomu (górny rysunek).
Obserwowany rezultat eksperymentu (dolny rysunek) niewielka część cząstek jest odbijana ukazując mały
skoncentrowany w niewielkiej przestrzeni ładunek dodatni
Model Ernesta Rutherforda został nazwany modelem "planetarnym" (elektrony obiegają jądro
podobnie jak planety obiegają Słońce). Bardzo dobrze tłumaczył on zebrane dane
doświadczalne. Jednak nadal pozostawało kilka znaków zapytania. Zgodnie z klasyczną
mechaniką poruszający się dookoła jądra elektron powinien emitować falę elektromagnetyczną.
Emisja taka jest związana z ucieczką pewnej energii z układu elektron-jądro. Elektron
zmniejszając swoją energię zmniejsza jednocześnie odległość od jądra. Powinien on, więc
poruszać się nie po okręgu, lecz po spirali i ostatecznie zderzyć się z jądrem. Takiego zjawiska
jednak nie obserwowano. Atomy większości pierwiastków są trwałe. Równie poważne było
pytanie, dlaczego jądro atomowe mające duży ładunek dodatni nie rozpada się?
Budowa atomu według Bohra.
Model budowy atomu wodoru według Bohra powstał w 1913r. Bohr przyjął wprowadzony przez
Ernesta Rutherforda model atomu, według którego elektron krąży wokół jądra, jako naładowany
punkt materialny, przyciągany przez jądro siłami elektrostatycznymi. Teoria Bohra oparta jest na
następujących postulatach:
1. Elektron porusza się po orbicie kołowej wokół jądra pod wpływem siły kulombowskiej; ruch
ten podlega prawom mechaniki klasycznej (w szczególności siła kulombowska jest siłą
dośrodkową)
- siła kulombowska
- siła dośrodkowa
2. Elektron może poruszać się tylko po takich orbitach, dla których orbitalny moment pędu
elektronu jest równy całkowitej wielokrotności
:
moment pędu -
, n=1, 2, 3, ….
O takiej wielkości mówimy, że jest skwantowana, czyli przyjmuje ściśle ustalone dyskretne
wartości. Są one numerowane przez liczbę n, którą nazywa się liczbą kwantową.
3. Elektron poruszający się po dozwolonej orbicie nie wypromieniowuje energii
elektromagnetycznej, pomimo że doznaje przyspieszenia - jego energia całkowita jest
zachowana.
4. Przy przechodzeniu atomu z jednego stanu w inny zostaje wyemitowany lub pochłonięty
kwant energii:
gdzie n>k
Promienie orbit elektronowych atomu wodoru.
Porównując siłę kulombowską z siłą dośrodkową (I postulat) i biorąc pod uwagę (II postulat)
otrzymujemy:
oraz
, n=1, 2, 3, ….
Rozwiązujemy powyższy układ równań dokonując podstawienia do pierwszego równania,
Wyprowadzony wzór na promienie orbit elektronowych ma postać:
, gdzie n=1, 2, 3, ….
Jednocześnie
= 0,53·10-10m – jest promieniem atomu Bohra tj. promieniem orbity,
na której znajduje się elektron w pojedynczym atomie wodoru, w stanie podstawowym, w
całkowitej próżni.
Prędkość elektronu na orbicie elektronowej.
Ponieważ
po podstawieniu wzoru na promienie
otrzymujemy:
, gdzie n=1, 2, 3, ….
Prędkość elektronu na pierwszej orbicie (stan podstawowy) wynosi: v1 = 2,18·106m/s.
Energie elektronu w atomie wodoru.
Energia elektronu w atomie wodoru jest sumą energii kinetycznej oraz energii potencjalnej
elektrostatycznego oddziaływania elektronu z protonem (jądrem atomu wodoru). Energia ta
zależy od orbity, na której znajduje się elektron, dlatego jest numerowana liczbą kwantowa n.
(podstawiamy za rn i vn wzory wyprowadzone
powyżej) otrzymując:
, gdzie n=1, 2, 3, ….
Dla n=1 mamy E1 = 13,6eV jest to energia stanu podstawowego.
Zamiana jednostek z [J] na [eV] odbywa się według wzoru:
n
1
2
3
4
5...
r , ·10-10 [m]
0,53
2,12
4,77
8,48
v , ·106 [m/s]
2,18
1,09
0,73
0,55
E , [eV]
-13,6
-3,40
-1,51
-0,85
Plik z chomika:
Lesantiel
Inne pliki z tego folderu:
wskazniki.jpg (63 KB)
Kwasy, woda i metale.xlsx (5 KB)
Atom - fizyka.doc (1019 KB)
Azotowce.doc (29 KB)
Atom.doc (45 KB)
Inne foldery tego chomika:
E[eV] =
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dział Pomocy
Opinie
Regulamin serwisu
Polityka prywatności
Copyright © 2012 Chomikuj.pl
Chemia organiczna