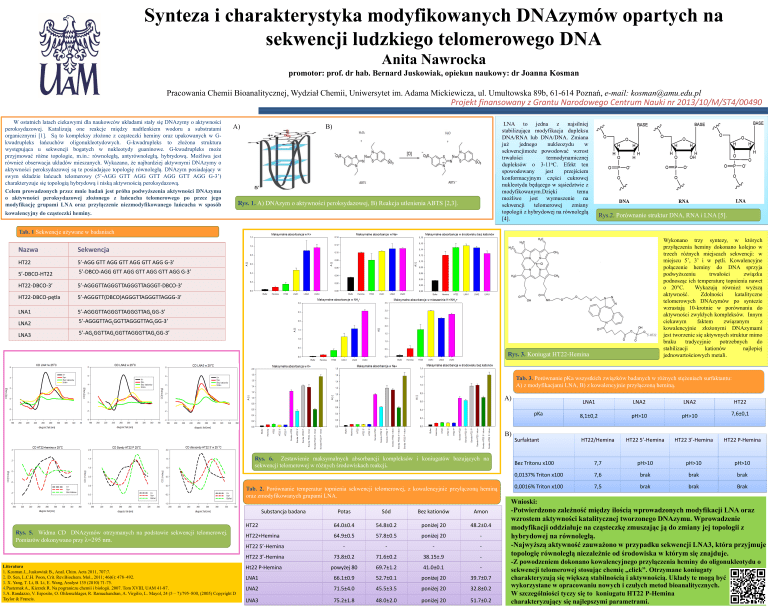
Synteza i charakterystyka modyfikowanych DNAzymów opartych na
sekwencji ludzkiego telomerowego DNA
Anita Nawrocka
promotor: prof. dr hab. Bernard Juskowiak, opiekun naukowy: dr Joanna Kosman
Pracowania Chemii Bioanalitycznej, Wydział Chemii, Uniwersytet im. Adama Mickiewicza, ul. Umultowska 89b, 61-614 Poznań, e-mail: [email protected]
Projekt finansowany z Grantu Narodowego Centrum Nauki nr 2013/10/M/ST4/00490
W ostatnich latach ciekawymi dla naukowców układami stały się DNAzymy o aktywności
peroksydazowej. Katalizują one reakcje między nadtlenkiem wodoru a substratami
organicznymi [1]. Są to kompleksy złożone z cząsteczki heminy oraz upakowanych w Gkwadrupleks łańcuchów oligonukleotydowych. G-kwadrupleks to złożona struktura
występująca u sekwencji bogatych w nukleotydy guaninowe. G-kwadrupleks może
przyjmować różne topologie, m.in.: równoległą, antyrównoległą, hybrydową. Możliwa jest
również obserwacja układów mieszanych. Wykazano, że najbardziej aktywnymi DNAzymy o
aktywności peroksydazowej są te posiadające topologię równoległą. DNAzym posiadający w
swym składzie łańcuch telomerowy (5’-AGG GTT AGG GTT AGG GTT AGG G-3’)
charakteryzuje się topologią hybrydową i niską aktywnością peroksydazową.
Celem prowadzonych przez mnie badań jest próba podwyższenia aktywności DNAzymu
o aktywności peroksydazowej złożonego z łańcucha telomerowego po przez jego
modyfikację grupami LNA oraz przyłączenie niezmodyfikowanego łańcucha w sposób
A)
LNA to jedna z najsilniej
stabilizująca modyfikacja dupleksu
DNA/RNA lub DNA/DNA. Zmiana
już
jednego
nukleozydu
w
sekwencjimoże powodować wzrost
trwałości
termodynamicznej
dupleksów o 3-11oC. Efekt ten
spowodowany
jest
przejściem
konformacyjnym części cukrowej
nukleotydu będącego w sąsiedztwie z
modyfikowanym.Dzięki
temu
możliwe
jest
wymuszenie
na
sekwencji
telomerowej
zmiany
topologii z hybrydowej na równoległą
[4].
B)
Rys. 1. A) DNAzym o aktywności peroksydazowej, B) Reakcja utlenienia ABTS [2,3].
kowalencyjny do cząsteczki heminy.
Rys.2. Porównanie struktur DNA, RNA i LNA [5].
Tab. 1 Sekwencje używane w badaniach
Nazwa
Sekwencja
HT22
5’-AGG GTT AGG GTT AGG GTT AGG G-3’
5’-DBCO-HT22
5’-DBCO-AGG GTT AGG GTT AGG GTT AGG G-3’
HT22-DBCO-3’
5’-AGGGTTAGGGTTAGGGTTAGGGT-DBCO-3’
HT22-DBCO-pętla
5’-AGGGTT(DBCO)AGGGTTAGGGTTAGGG-3’
LNA1
5’-AGGGTTAGGGTTAGGGTTAGLGG-3’
LNA2
5’-AGGGTTAGLGGTTAGGGTTAGLGG-3’
LNA3
5’-AGLGGTTAGLGGTTAGGGTTAGLGG-3’
Wykonano trzy syntezy, w których
przyłączenia heminy dokonano kolejno w
trzech różnych miejscach sekwencji: w
miejscu 5’, 3’ i w pętli. Kowalencyjne
połączenie heminy do DNA sprzyja
podwyższeniu
trwałości
związku
podnosząc ich temperaturę topnienia nawet
o 20°C.
Wykazują również wyższą
aktywność.
Zdolności
katalityczne
telomerowych DNAzymów po syntezie
wzrastają 10-krotnie w porównaniu do
aktywności zwykłych kompleksów. Innym
ciekawym
faktem
związanym
z
kowalencyjnie złożonymi DNAzymami
jest tworzenie się aktywnych struktur mimo
braku
tradycyjnie
potrzebnych
do
stabilizacji
kationów
najlepiej
jednowartościowych metali.
Rys. 3. Koniugat HT22-Hemina
Tab. 3. Porównanie pKa wszystkich związków badanych w różnych stężeniach surfaktantu:
A) z modyfikacjami LNA, B) z kowalencyjnie przyłączoną heminą.
A)
pKa
B)
Rys. 6. Zestawienie maksymalnych absorbancji kompleksów i koniugatów bazujących na
sekwencji telomerowej w różnych środowiskach reakcji.
Tab. 2. Porównanie temperatur topnienia sekwencji telomerowej, z kowalencyjnie przyłączoną heminą
oraz zmodyfikowanych grupami LNA.
Substancja badana
Rys. 5. Widma CD DNAzymów otrzymanych na podstawie sekwencji telomerowej.
Pomiarów dokonywano przy λ=295 nm.
Literatura
1. Kosman J., Juskowiak B., Anal. Chim. Acta 2011, 707:7.
2. D. Sen, L.C.H. Poon, Crit. Rev.Biochem. Mol., 2011; 46(6): 478–492.
3. X. Yang, T. Li, B. Li, E. Wang, Analyst 135 (2010) 71-75.
4.Pasternak A., Kierzek R. Na pograniczu chemii i biologii. 2007. Tom XVIII, UAM 41-87.
5.A. Randazzo, V. Esposito, O. Ohlenschlager, R. Ramachandran, A. Virgilio, L. Mayol, 24 (5 – 7):795–800, (2005) Copyright D
Taylor & Francis.
Potas
Sód
Bez kationów
Amon
HT22
64.0±0.4
54.8±0.2
poniżej 20
48.2±0.4
HT22+Hemina
64.9±0.5
57.8±0.5
poniżej 20
-
HT22 5’-Hemina
-
-
-
-
HT22 3’-Hemina
73.8±0.2
71.6±0.2
38.15±.9
-
Ht22 P-Hemina
powyżej 80
69.7±1.2
41.0±0.1
-
LNA1
66.1±0.9
52.7±0.1
poniżej 20
39.7±0.7
LNA2
71.5±4.0
45.5±3.5
poniżej 20
32.8±0.2
LNA3
75.2±1.8
48.0±2.0
poniżej 20
51.7±0.2
Surfaktant
LNA1
LNA2
LNA2
HT22
8,1±0,2
pH>10
pH>10
7,6±0,1
HT22/Hemina
HT22 5’-Hemina
HT22 3’-Hemina
HT22 P-Hemina
Bez Tritonu x100
7,7
pH>10
pH>10
pH>10
0,0137% Triton x100
7,6
brak
brak
brak
0,0016% Triton x100
7,5
brak
brak
Brak
Wnioski:
-Potwierdzono zależność między ilością wprowadzonych modyfikacji LNA oraz
wzrostem aktywności katalitycznej tworzonego DNAzymu. Wprowadzenie
modyfikacji oddziałuje na cząsteczkę zmuszając ją do zmiany jej topologii z
hybrydowej na równoległą.
-Najwyższą aktywność zauważono w przypadku sekwencji LNA3, która przyjmuje
topologię równoległą niezależnie od środowiska w którym się znajduje.
-Z powodzeniem dokonano kowalencyjnego przyłączenia heminy do oligonukleotydu o
sekwencji telomerowej stosując chemię „click”. Otrzymane koniugaty
charakteryzują się większą stabilnością i aktywnością. Układy te mogą być
wykorzystane w opracowaniu nowych i czułych metod bioanalitycznych.
W szczególniości tyczy się to koniugatu HT22 P-Hemina
charakteryzujący się najlepszymi parametrami.