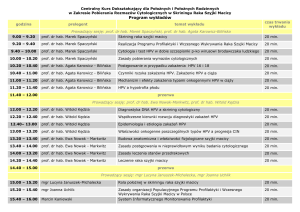
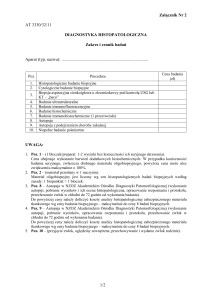
Załącznik nr 2
Do wniosku o przeprowadzenie postępowania
habilitacyjnego dr n. med. Moniki Julity Ołdak
Autoreferat
1.
Imię i Nazwisko
Monika Julita Ołdak
2.
Posiadane dyplomy i stopnie naukowe
- Dyplom lekarza, 2000, II Wydział Lekarski, Akademia Medyczna w Warszawie
(obecnie Warszawski Uniwersytet Medyczny, WUM)
- Stopień doktora nauk medycznych, 2005, Wydział Medyczny Uniwersytetu w
Kolonii, Niemcy (promotor: Prof. Dr med. Sigrun Smola)
- Diagnosta laboratoryjny, 2006, Krajowa Izba Diagnostów Laboratoryjnych
- Tytuł specjalisty w dziedzinie genetyki klinicznej, 2007, Państwowa Komisja
Egzaminacyjna, Centrum Egzaminów Medycznych
3.
Informacje o dotychczasowym zatrudnieniu w jednostkach naukowych
2000 - obecnie, Katedra i Zakład Histologii i Embriologii, Centrum Biostruktury,
Warszawski Uniwersytet Medyczny
2000 - 2006 - asystent
2006 - obecnie – adiunkt
1
4.
Wskazanie osiągnięcia wynikającego z art. 16 ust. 2 ustawy z dnia 14 marca
2003 o stopniach naukowych i tytule naukowym oraz o stopniach i tytule w
zakresie sztuki (Dz. U. nr 65, poz. 595 ze zm.)
Cykl 3 publikacji dotyczących molekularnych mechanizmów interakcji onkogennego wirusa
brodawczaka ludzkiego HPV8 z komórkami gospodarza
a) Autorzy i tytuły publikacji
1. Ołdak M, Maksym RB, Sperling T, Yaniv M, Smola H, Pfister HJ, Malejczyk J,
Smola S. Human papillomavirus type 8 E2 protein unravels JunB/Fra-1 as an
activator of the beta4-integrin gene in human keratinocytes. J Virol. 2010
Feb;84(3):1376-86. IF = 5,189.
2. Ołdak M, Tolzmann L, Wnorowski A, Podgórska MJ, Silling S, Lin R, Hiscott J,
Müller CS, Vogt T, Smola H, Smola S. Differential regulation of human
papillomavirus type 8 by interferon regulatory factors 3 and 7. J Virol. 2011
Jan;85(1):178-88. IF = 5,402.
3. Sperling T#, Ołdak M#, Walch-Rueckheim B, Wickenhauser C, Doorbar J, Pfister
H, Malejczyk M, Majewski S, Keates AC, Smola S. Human Papillomavirus type 8
interferes with a novel C/EBPβ-mediated mechanism of keratinocyte CCL20
chemokine expression and Langerhans cell migration. PLoS Pathog. 2012
Jul;8(7):e1002833. IF = 9,127; #dwóch pierwszych autorów pracy.
2
b) Omówienie celu naukowego ww. prac i osiągniętych wyników wraz z omówieniem ich
ewentualnego wykorzystania
Wirusy brodawczaka ludzkiego (ang. Human Papillomaviruses, HPV), są małymi
wirusami DNA, które zakażają nabłonki wielowarstwowe błon śluzowych i skóry. W
zależności od typu wirusa, HPV mogą indukować w zakażonych tkankach szerokie
spektrum zmian hiperproliferacyjnych od łagodnych brodawek do złośliwych nowotworów.
Do ważnych typów HPV zakażających błony śluzowe i wykazujących wysoki potencjał
onkogenny należą HPV z rodzaju α, m.in. HPV16, 18, 31 i 33. Wirusy te odpowiedzialne
są za dysplazje nabłonka szyjki macicy i zmiany nowotworowe narządów płciowych.
Najlepiej poznany jest ich związek z powstawaniem raka szyjki macicy.
Do rodzaju β HPV należą m.in. HPV5 i 8, które zakażają komórki naskórka i
charakteryzują się wysokim potencjałem onkogennym. Związek pomiędzy zakażeniem
skóry HPV5 i 8 a rozwojem nieczerniakowych raków skóry został po raz pierwszy
wykazany u pacjentów cierpiących na epidermodysplasia verruciformis, genetycznie
uwarunkową chorobę skóry. To zaburzenie genetyczne służy jako choroba modelowa do
badania zmian nowotworowych indukowanych przez HPV.
Potencjał onkogenny HPV8 został również dobrze udokumentowany w badaniach z
wykorzystaniem myszy transgenicznych. Obecnie przedmiotem intensywnych badań jest
poszukiwanie związku pomiędzy zakażeniami HPV z rodzaju β o wysokim potencjale
onkogennym a powstawaniem nowotworów skóry u pacjentów poddanych immunosupresji
oraz w ogólnej populacji. HPV zakażają dzielące się komórki warstwy podstawnej
3
nabłonków wielowarstwowych, ale przeprowadzenie ich cyklu replikacyjnego i wytworzenie
zakaźnych wirionów zachodzi w różnicujących ponadpodstawnych warstwach nabłonków.
Cykl życiowy HPV jest zatem ściśle związany z programem różnicowania komórek
nabłonkowych.
W
prowadzonych
molekularnych
przeze
mechanizmów
mnie
badaniach
wzajemnego
zajmowałam
oddziaływania
się
identyfikacją
białek
potencjalnie
onkogennego HPV8 z komórkowymi czynnikami transkrypcyjnymi związanymi z procesem
różnicowania keratynocytów i immunologią skóry. Badałam, w jaki sposób HPV8
wykorzystuje komórki gospodarza do przeprowadzenia swojego cyklu życiowego, unika
mechanizmów kontrolnych nadzoru immunologicznego i udaje mu się stworzyć lokalne
środowisko, które umożliwia utrzymanie stanu przetrwałego zakażenia, uważanego za
bardzo ważny czynnik ryzyka transformacji nowotworowej. Prowadzone przez mnie
badania były również ukierunkowane na poszukiwanie tzw. „słabych punktów” wirusa,
które mogą być wykorzystane w terapii przeciwwirusowej i zapobieganiu transformacji
nowotworowej.
Do najważniejszych wyników przedstawionych w pracy opublikowanej w Journal of
Virology w roku 2010 (poz.1) należy poznanie mechanizmu wykorzystywanego przez
HPV8 do regulacji ekspresji ludzkiego genu integryny β4. Wybór integryny β4 był związany
z wynikami naszych poprzednich badań, które pokazały po raz pierwszy, że ekspresja
ludzkiego
genu
może
być
bezpośrednio
regulowana
przez
wirusowy
czynnik
transkrypcyjny (Ołdak i wsp. 2004). Integryna β4 jest cząsteczką adhezyjną i jedną z
najpowszechniej występujących integryn na keratynocytach. Jest ona odpowiedzialna za
4
przytwierdzanie
komórek
nabłonkowych
do
błony
podstawnej.
Utrata
adhezji
keratynocytów do błony podstawnej jest związana z ich przemieszczaniem z warstwy
podstawnej do warstw ponadpodstawnych i kontynuacją procesu ich różnicowania.
Komórkowy czynnik transkrypcyjny z rodziny AP-1, dimer JunB/Fra-1, podobnie jak
integryna β4, podlega ekspresji w proliferującej warstwie podstawnej naskórka, która
zawiera komórki będące celem zakażenia HPV. Wyniki moich badań pokazały, że
komórkowy czynnik transkrypcyjny JunB/Fra-1 pełni funkcję aktywatora transkrypcji genu
integryny β4 i może stać się celem wirusowego białka E2. Dla możliwie najwierniejszego
odtworzenia mechanizmów oddziaływania wirus-komórka gospodarza, zachodzących in
vivo, w badaniach wykorzystywano pierwotne ludzkie keratynocyty wykazujące stabilną
ekspresję białka E2 HPV8. Wypierając JunB/Fra-1 z promotora integryny β4 wirus HPV8
naśladuje uwarunkowania transkrypcyjne procesu różnicowania keratynocytów. Uzyskane
przeze mnie wyniki pomagają zrozumieć, w jaki sposób HPV8 kieruje zakażone komórki
na drogę różnicowania, niezbędnego dla zachowania jego cyklu życiowego.
Wyniki badań opisane w Journal of Virology w roku 2011 (poz. 2) pokazują po raz
pierwszy, że czynniki regulatorowe interferonu, IRF-3 (ang. Interferon regulatory factor-3) i
IRF-7 (ang. Interferon regulatory factor-7), o których wiadomo, że indukują ekspresję
interferonów typu I i tworzą pierwszą linię obrony przeciwwirusowej, mogą również
bezpośrednio regulować transkrypcję HPV8. Wyniki prowadzonych przeze mnie badań
pokazały, że efekty działania IRF-3 i IRF-7 wywierają przeciwstawny skutek na aktywność
transkrypcyjną wirusa. Podczas gdy IRF-3 hamuje aktywność transkrypcyjną HPV8, IRF-7
aktywuje wirusa.
5
Obecnie stosowane nieoperacyjne metody leczenia (przed)nowotworowych zmian
skórnych indukowanych przez HPV8 są mało efektywne. Praktycznym aspektem
prowadzonych przeze mnie badań była identyfikacja IRF-3 jako silnego supresora HPV8,
który indukuje w keratynocytach stan autonomicznej odporności przeciwko wirusowi. Silne
właściwości przeciwwirusowe były obserwowane również w komórkach poddanych
działaniu immunostymulujących kwasów nukleinowych, będących silnymi aktywatorami
IRF-3, tj. poly(I:C), które jest syntetycznym analogiem dwuniciowego RNA i 5’pppRNA –
cząsteczce RNA mającej na końcu 5’ reszty fosforanowe. IRF-3 podlega konstytutywnej
ekspresji we wszystkich warstwach naskórka. W związku z tym jest on łatwo dostępny dla
potencjalnych aktywatorów. Dodatkowym atutem poly(I:C) jest jego zdolność do indukcji
ekspresji TLR7 (ang. Toll-like receptor 7), receptora poprzez który działa imiquimod, lek
immunomodulujący obecnie stosowany w terapii zmian skórnych indukowanych przez
HPV. Można przypuszczać, że dzięki tej właściwości, stosowane miejscowo, poly(I:C) lub
jego analogi mogłyby zwiększać skuteczność działania imiquimodu.
Promieniowanie UV odgrywa znaczącą rolę w karcynogenezie związanej z
zakażeniem skóry HPV z rodzaju β. Zmiany skórne indukowane przez HPV „wysokiego
ryzyka” ulegają transformacji nowotworowej zwłaszcza w miejscach eksponowanych na
działanie promieni słonecznych. Wyniki badań przedstawione w pracy opublikowanej w
Journal of Virology w roku 2011 (poz. 2) wykazały po raz pierwszy, że IRF-7 podlega
bardzo dużej ekspresji w warstwach zróżnicowanych naskórka a promieniowanie UV jest
jego ważnym aktywatorem w skórze. Ponadto z przeprowadzonych przeze mnie badań
wynika, że IRF-7 aktywuje bezpośrednio późny promotor HPV8, odpowiedzialny za
ekspresję późnych genów, niezbędnych do wytworzenia nowych cząsteczek wirusa.
6
Ważnym wynikiem moich badań jest odkrycie, że IRF-7 stanowi funkcjonalne ogniwo
pomiędzy dwoma ko-karcynogenami skóry, promieniowaniem UV i aktywacją HPV8.
Wyniki moich badań pokazują, że nad aktywującym wpływem IRF-7 na HPV8 dominują
jednak supresorowe właściwości IRF-3 i jego aktywatorów. IRF-3 jest w stanie wypierać
IRF-7 z jego wiązania z DNA i hamować indukowaną przez IRF-7 aktywację HPV8.
W pracy opublikowanej w PLoS Pahtogens w roku 2012 (poz. 3) pokazałam, że
zmiany skórne indukowane przez HPV8 u pacjentów z epidermodysplasia verruciformis
mają znacznie obniżoną liczbę prezentujących antygen komórek Langerhansa oraz
chemokiny CCL20, która przyciąga komórki Langerhansa do naskórka. Poszukując
przyczyn tych zmian, odkryłam nowy, zależny od komórkowego czynnika transkrypcyjnego
C/EBPβ (ang. CAAT/enhancer binding protein β) mechanizm regulacji ekspresji CCL20.
Dotychczas za główny aktywator ekspresji CCL20 uznawano czynnik transkrypcyjny NFĸB. Moje badania pokazały, że zależna od różnicowania ekspresja CCL20 w warstwach
ponadpodstawnych naskórka jest wynikiem aktywności, podlegającego ekspresji również
w sposób zależny od różnicowania, czynnika transkrypcyjnego C/EBPβ. Przeprowadzone
przez mnie badania pozwoliły również na odkrycie, że białko E7 HPV8 oddziałuje
bezpośrednio z C/EBPβ i w ten sposób zaburza jego wiązanie z promotorem CCL20.
Szczegółowe badania umożliwiły wyodrębnienie pięcio-aminokwasowego motywu FQELL
w części karboksylowej białka E7 HPV8, który bezpośrednio oddziałuje z komórkowym
czynnikiem transkrypcyjnym C/EBPβ. Wiązanie białka wirusowego E7 z komórkowym
C/EBPβ umożliwia HPV8 hamowanie ekspresji CCL20 i migracji komórek Langerhansa,
upośledzając odporność wrodzoną skóry. Stan ten może być punktem wyjścia dla
powstawania przetrwałych zakażeń HPV8 i prokancerogennej aktywności wirusa.
7
Przy okazji prowadzonych badań nad patogenezą zakażeń skóry HPV8 odkryłam
również
nowe
mechanizmy
ważne
dla
prawidłowego
funkcjonowania
naskórka.
Zidentyfikowałam nowy transkrypcyjny mechanizm regulatorowy dla integryny β4, jednego
z głównych receptorów adhezji keratynocytów o fundamentalnym znaczeniu dla
homeostazy nabłonków (poz. 1). Po raz pierwszy pokazałam, w jaki sposób dochodzi w
skórze do zależnej od różnicowania ekspresji chemokiny CCL20, odgrywającej
decydującą rolę w rekrutacji do naskórka prezentujących antygen komórek Langerhansa,
kluczowych dla układu immunologicznego skóry (poz.3). Jestem przekonana, że zdobyta
przez mnie wiedza znajdzie zastosowanie praktyczne w diagnozowaniu i leczeniu chorób
skóry.
5.
Pozostałe osiągnięcia naukowe
5.1.
Inne ważniejsze publikacje naukowe
1. Pollak A, Mueller-Malesińska M, Lechowicz U, Skórka A, Korniszewski L,
Sobczyk-Kopciol A, Waśkiewicz A, Broda G, Iwanicka-Pronicka K, Ołdak
M, Skarzyński H, Płoski R. MTHFR 677T Is a Strong Determinant of the
Degree of Hearing Loss Among Polish Males with Postlingual Sensorineural
Hearing Impairment. DNA Cell Biol. 2012 Jul;31(7):1267-73.
8
2. Pazik J#, Ołdak M#, Dąbrowski M, Lewandowski Z, Sitarek E, Podgórska M,
Ważna E, Płoski R, Szmidt J, Chmura A, Durlik M, Malejczyk J. Association
of UDP-glucuronosyltransferase 1A9 (UGT1A9) gene polymorphism with
kidney allograft function. Ann Transplant. 2011 Oct-Dec;16(4):69-73.
#
dwóch pierwszych autorów pracy.
3. Pazik J#, Ołdak M#, Podgórska M, Lewandowski Z, Sitarek E, Płoski R,
Szmidt J, Chmura A, Durlik M, Malejczyk J. Lymphocyte counts in kidney
allograft recipients are associated with IMPDH2 3757T>C gene
polymorphism. Transplant Proc. 2011 Oct;43(8):2943-5. #dwóch pierwszych
autorów pracy.
4. Rydzanicz M, Cywińska K, Wróbel M, Pollak A, Gawęcki W, WojsykBanaszak I, Lechowicz U, Mueller-Malesińska M, Ołdak M, Płoski R,
Skarżyński H, Szyfter K, Szyfter W. The contribution of the mitochondrial
COI/tRNA(Ser(UCN))
gene
mutations
to
non-syndromic
and
aminoglycoside-induced hearing loss in Polish patients. Mol Genet Metab.
2011 Sep-Oct;104(1-2):153-9.
5. Ołdak M, Szczecińska W, Przybylska D, Maksym RB, Podgórska M,
Woźniak K, Płoski R, Kowalewski C. Gene dosage effect of p.Glu170Lys
mutation in the KRT5 gene in a Polish family with epidermolysis bullosa
simplex. J Dermatol Sci. 2011 Jan;61(1):64-7.
6. Ołdak M, Szaflik JP. Dystrofie śródbłonka rogówki: które geny mają tu
właściwie znaczenie? Okulistyka 2010; 1: 37-42.
7. Rydzanicz M, Wróbel M, Pollak A, Gawecki W, Brauze D, KostrzewskaPoczekaj M, Wojsyk-Banaszak I, Lechowicz U, Mueller-Malesińska M,
Ołdak M, Płoski R, Skarzyński H, Szyfter K. Mutation analysis of
mitochondrial 12S rRNA gene in Polish patients with non-syndromic and
aminoglycoside-induced hearing loss. Biochem Biophys Res Commun.
2010 Apr 23;395(1):116-21.
8. Ołdak M, Kowalewski C, Maksym RB, Woźniak K, Pollak A, Podgórska M,
Wnorowski A, Kosińska J, Płoski R. Novel keratin 14 hotspot mutation in
Dowling-Meara type of epidermolysis bullosa simplex: strategy to avoid
9
KRT14 pseudogene amplification by a simple approach. J Dermatol Sci.
2010 Jan;57(1):69-70.
9. Dole VS, Smola H, Dooley S, Said HM, Ołdak M, Pfister HJ, Smola S. The
adenoviral E1A oncoprotein activates the Smad7 promoter: requirement of
a functional E-box. Int J Oncol. 2009 Dec;35(6):1493-8.
10. Pazik J#, Ołdak M#, Sitarek E, Lewandowski Z, Maksym R, Slubowska K,
Płoski R, Malejczyk J, Durlik M. Multidrug resistance-associated protein 2
gene (ABCC2) variant in kidney allograft recipients. Transplant Proc. 2009
Oct;41(8):3009-10. #dwóch pierwszych autorów pracy.
11. Ołdak M, Szaflik JP. IC3D – The New Classification of the Corneal
Dystrophies. Short Introduction and Comments. Okulistyka 2009; 2: 65-67.
Artykuł po polsku.
12. Szaflik JP#, Ołdak M#, Maksym RB, Kamińska A, Pollak A, Udziela M,
Płoski R, Szaflik J. Genetics of Meesmann corneal dystrophy: a novel
mutation in the keratin 3 gene in an asymptomatic family suggests
genotype-phenotype correlation. Mol Vis. 2008 Sep 15;14:1713-8. #dwóch
pierwszych autorów pracy.
13. Pollak A, Mueller-Malesińska M, Skórka A, Kostrzewa G, Ołdak M,
KorniszewskiL, Kaczynski H, Płoski R. GJB2 and hearing impairment:
promoter defects do not explain the excess of monoallelic mutations. J Med
Genet. 2008 Sep;45(9):607-8.
14. Ołdak M, Maksym R, Korniszewski L, Szaflik J, Malejczyk J, Płoski R,
Szaflik J. Corneal dystrophies associated with TGFBI gene mutations.
Okulistyka 2007;1:21-24.
15. Ołdak M, Maksym R, Korniszewski L, Szaflik J, Malejczyk J, Ploski R,
Szaflik J. Corneal dystrophies with known genetic background other than
TGFBI gene mutations. Okulistyka 2007;1:25-29.
16. Pollak A, Skórka A, Mueller-Malesińska M, Kostrzewa G, Kisiel B,
Waligóra J, Krajewski P, Ołdak M, Korniszewski L, Skarzyński H, Ploski R.
M34T and V37I mutations in GJB2 associated hearing impairment:
10
evidence for pathogenicity and reduced penetrance. Am J Med Genet A.
2007 Nov 1;143A(21):2534-43.
17. Ołdak M, Waligóra J, Gieruszczak-Bialek D, Skórka A, Bocian E, BryczWitkowska J, Stankiewicz P, Korniszewski L. Congenital anomalies and
developmental delay In a boy with double chromosome 6 derived
supernumerary marker. Genet Counsel. 2006;17(1):29-34.
18. Gieruszczak-Bialek D, Ołdak M, Skórka A, Waligora J, Korniszewski L.
Fibula aplasia with ectrodactyly--broadening the clinical spectrum. Eur J
Med Genet. 2006 Jan-Feb;49(1):83-6.
19. Ołdak M, Smola-Hess S, Maksym R. Integrin beta4, keratinocytes and
papillomavirus infection. Int J Mol Med. 2006 Feb;17(2):195-202.
20. Ołdak M, H. Smola, Aumailley M, Riviero F, Pfister H, Smola-Hess S. The
human papillomavirus type 8 E2 protein suppresses beta 4 integrin
expression in primary human keratinocytes. J Virol 2004, 78(19):1073810746.
21. Ołdak M, Majewski S, Grzela T, Stark S, Malejczyk M, Osiecka-Iwan A,
Fuchs PG, Jabłońska S, Pfister HJ, Malejczyk J. Natural cell-mediated
cytotoxicity of peripheral blood lymphocytes against target cells transfected
with epidermodysplasia verruciformis-specific human papilloamvirus type 8
L1 DNA sequences. Int J Mol Med 2004, 13(1):187-191.
22. Hadaschik D, Hinterkeuser K, Ołdak M, Pfister HJ, Smola-Hess S: The
Papillomavirus E2 protein binds to and synergizes with C/EBP factors
involved in keratinocytes differentiation. J Virol 2003, 77(9):5253-5265.
23. Ołdak M, Grzela T, Łazarczyk M, Malejczyk J, Skopiński P. Clinical
aspects of disrupted Hedgehog signaling. Int J Mol Med. 2001, 8(4):445452.
11
5.2.
Sumaryczny impact factor (IF) wszystkich publikacji
Sumaryczny IF = 92,458
IF prac, w których jestem pierwszym autorem = 46,215
5.3.
Liczba cytowań wg bazy Web of Science (bez autocytowań)
na dzień 06.11.2012 = 177
5.4.
Index Hirsha na dzień 06.11.2012 = 8 (wg bazy Web of Science)
5.5.
Kierowanie międzynarodowymi lub krajowymi projektami badawczymi
2011-2014 projekt własny MNiSW, N N402 5915 40; Poszukiwanie nowego podłoża
genetycznego dziedzicznego zaniku nerwu wzrokowego. Ołdak M. – kierownik
projektu, Malejczyk J., Szaflik J., Szaflik J.P, Płoski R., Federowicz A., IwanickaNowicka R.M., Prymakowska-Bosak M.
2011-2014 projekt własny MNiSW, N N402 5916 40; Diagnostyka chorób siatkówki
związanych z mutacjami genu ABCA4 z wykorzystaniem metody "sekwencjonowania
następnej generacji". Ołdak M. – kierownik projektu, Malejczyk J., Płoski R., Szaflik
J., Szaflik J.P., Federowicz A., Ambroziak A.M., Korwin M.M.
2007-2010 projekt własny MNiSW, N N402 4266 33; Rola czynników genetycznych w
odpowiedzi pacjentów na leczenie immunosupresyjne mykofenolanem mofetylu
(MMF). Ołdak M. – kierownik projektu, Pazik J., Malejczyk J., Płoski R., Durlik M.,
Majewski M.
2007-2009 „Grant Młodego Badacza” Akademii Medycznej w Warszawie
1M15/WB1/2007-2009; Rola podjednostek czynnika transkrypcyjnego AP-1 w regulacji
ekspresji integryny beta: potencjalne znaczenie w patogenezie chorób.
2004-2006 „Grant Młodego Badacza” Akademii Medycznej w Warszawie
1M15/WB3/2004-2006; Regulacja ekspresji ludzkiej integryny beta 4 przez białko E2
wirusa brodawczaka ludzkiego (HPV).
12
5.6.
Międzynarodowe lub krajowe nagrody za działalność naukową
Nagrody Naukowe Rektora Warszawskiego Uniwersytetu Medycznego w latach
2005, 2007, 2009, 2010 i 2012
Nagroda Zespołowa Ministra Zdrowia dla nauczycieli akademickich w roku 2007
Stypendium Krajowe Fundacji na Rzecz Nauki Polskiej dla Młodych Naukowców
na rok 2005 i 2006
5.7.
Staże zagraniczne
Staż naukowy - łącznie 24 miesiące w latach 2009-2012
Instytut Wirusologii Uniwersytet Saarland, Homburg, Niemcy
(kierownik prof. dr Sigrun Smola)
Staż naukowy - 2 miesiące w roku 2006 oraz 12 miesięcy w latach 2002-2003
Instytut Wirusologii Uniwersytet w Kolonii, Niemcy
(kierownik prof. dr Herbert Pfister)
Staż naukowy - 1 miesiąc w roku 2003
Instytut Wirusologii Uniwersytet w Kolonii, Niemcy
(kierownik prof. dr Herbert Pfister)
Stypendium Studium Medycyny Molekularnej
Staż naukowy - 2 miesiące w roku 1999
Instytut Wirusologii Uniwersytet w Kolonii, Niemcy
(kierownik prof. dr Herbert Pfister)
Stypendium Polskiej Sieci Biologii Komórkowej
i Molekularnej UNESCO/PAN
Staż naukowy - 2 miesiące w roku 1996
Instytut Wirusologii, Uniwersytet w Kolonii, Niemcy
13
(kierownik prof. dr Herbert Pfister)
§łpendium Fundacji
On
kologii Doświadczal nej i
Kl
inicznej
Aktywny udział w międzynarodowych i kr{owych konferencjach naukowych
Konferencje międzynarodowe - 3ł doniesienia zjazdowe
Konferencie krajowe - 30 doniesień ziazdowych
W,/u
? ll"Zaz
L4