WYKŁAD 4-2
ENTROPIA
Entropia jest funkcją termodynamiczną opartą na zasadach fenomenologicznych. Ma
ona jednak istotną interpretację statystyczna i molekularną .
MOLEKULARNA INTERPRETACJA ENTROPII
Entropia charakteryzuje uporządkowanie układu.
http://mitr.p.lodz.pl/raman/lecture6.pdf
kB = 1.38065×10−23 J K−1 – stała Boltzmanna
W – prawdopodobieństwo termodynamiczne charakteryzuje liczbę „dostępnych”
konfiguracji układu
Jeżeli uporządkowanie układu wzrasta, to maleje liczba dozwolonych
stanów energetycznych, czyli maleje entropia. Entropia jest miarą gęstości
stanów dostępnych w danych warunkach termodynamicznych
Druga zasada termodynamiki
Wszystkie procesy, które zachodzą samorzutnie, są
procesami nieodwracalnymi termodynamicznie
Pokażemy, ze w ustalonej temperaturze i pod stałym ciśnieniem proces jest samorzutny,
jeśli wynikiem tego procesu jest obniżenie entalpii swobodnej układu.
WNIOSEK
W ustalonej temperaturze i
pod stałym ciśnieniem proces
jest samorzutny, jeśli wynikiem
tego procesu jest obniżenie
entalpii swobodnej układu.
• Jest to równoznaczne ze
zmniejszeniem zdolności
układu do wykonania pracy
Analogiczne przypadki można rozważyć dla zmian energii swobodnej układu w
przypadku warunków izochoryczno-izotermicznych.
Molowa entropia tworzenia a entropia
molowa
Molowa entropia tworzenia jest to entropia reakcji tworzenia (z pierwiastków) 1 mola
związku chemicznego
Entropia molowa związku jest miarą stopnia uporządkowania materii w przeliczeniu na 1
mol związku
Jak policzyć entalpię swobodną reakcji w temperaturze innej niż 298 K?
ZASTOSOWANIE DRUGIEJ ZASADY TERMODYNAMIKI
W PRZEMIANACH GAZOWYCH
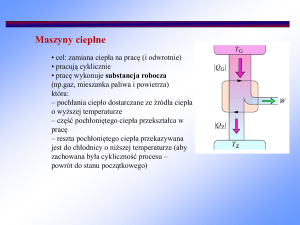
Procesem kołowym albo cyklem nazywamy taki proces, w którego wyniku
ciało robocze powraca do stanu wyjściowego.
Procesy kołowe są podstawą wszystkich maszyn cieplnych:
- silników spalinowych,
- turbin parowych i gazowych,
- maszyn parowych,
- chłodziarek i zamrażarek
Dla procesu kołowego
Z I zasady termodynamiki wynika, że można zbudować urządzenie (perpetum mobile drugiego
rodzaju), w którym ciepło jest całkowicie zamieniane w pracę. Z II zasady termodynamiki
wynika, że zbudowanie perpetum mobile drugiego rodzaju jest niemożliwe, ponieważ nie
istnieje przemiana, w której pobrane ciepło jest całkowicie zamieniane na pracę. Lord Kelvin
(William Thomson), 1848
Cykl Carnota
Na cykl składają się następujące po sobie procesy:
Rozprężanie izotermiczne – czynnik roboczy styka się ze
źródłem ciepła, ma jego temperaturę i poddawany jest
rozprężaniu izotermicznemu w temperaturze T1, podczas
tego cyklu ciepło jest pobierane ze źródła ciepła.
Rozprężanie adiabatyczne – czynnik roboczy nie wymienia
ciepła z otoczeniem i jest rozprężany, aż czynnik roboczy
uzyska temperaturę chłodnicy (T3).
Sprężanie izotermiczne – czynnik roboczy styka się z
chłodnicą, ma temperaturę chłodnicy i zostaje poddany
procesowi sprężania w tej temperaturze (T3). Czynnik
roboczy oddaje ciepło do chłodnicy.
Sprężanie adiabatyczne – czynnik roboczy nie wymienia
ciepła z otoczeniem, jest poddawany sprężaniu, aż uzyska
temperaturę źródła ciepła (T1).
q1
q2
T1
T3
źródło
chłodnica
W
Cykl Carnota
Schemat przedstawia poszczególne stadia
podczas Cyklu Carnota, w którym substancją
roboczą jest gaz doskonały.
q1
T1
Źródło ciepła
grzejnica
q2
T3
chłodnica
Cykl Carnota
Prosty cykl Carnota (A-B-C-D-A) –
silnik cieplny gaz wykonuje pracę
kosztem dostarczonego ciepła.
Praca maksymalna będzie
wykonywana, jeśli procesy będą
odwracalne
Silnik cieplny: wykonaniu pracy kosztem
doprowadzonego ciepła musi towarzyszyć
odprowadzenie części ciepła do otoczenia
Odwracalne rozprężanie adiabatyczne
Równanie adiabaty dla procesu
odwracalnego
Praca odwracalnej przemiany adiabatycznej
jest mniejsza w porównaniu z pracą
odwracalnej przemiany izotermicznej
Sprawność silnika cieplnego
Sprawność silnika cieplnego definiujemy jako stosunek pracy wykonanej do
ilości ciepła pobranego ze źródła ciepła.
Maksymalna sprawność termodynamiczna maszyny cieplnej (odwracalność przemian ciała
roboczego)
Silnik cieplny jest tym doskonalszy im większa część ciepła przemienia się
na pracę użyteczną.
Druga zasada termodynamiki w sformułowaniu Clausiusa (1850):
Dla każdego cyklu realizowanego przez procesy odwracalne suma stosunków ciepła
wymienionego w procesie do temperatury, w której ta wymiana ma miejsce jest równa
zero.
Chłodziarka – urządzenie (maszyna cieplna), którego
zadaniem jest obniżenie temperatury środowiska
chłodzonego, kosztem doprowadzonej energii. W
chłodziarkach absorpcyjnych energia dostarczana jest w
postaci ciepła, natomiast w pozostałych (sprężarkowych,
strumienicowych, termoelektrycznych) w postaci pracy.
Chłodzonym czynnikiem może być powietrze, woda lub
inny czynnik pośredniczący (chłodziwo).
Jeśli ciało robocze (np. gaz)
wykonuje cykl odwrotny, wtedy
kosztem wykonanej pracy można
przenosić ciepło od ciała
chłodnego do ciała gorącego
Odwrotny cykl Carnota (D-C-B-A-D) -praca jest
wykonywana nad gazem (wcykl > 0), a gaz
oddaje ciepło do otoczenia (qcykl< 0).
Odwrotny cykl Carnota jest podstawą
działania chłodziarek i zamrażarek .
Chłodziarka jest tym bardziej ekonomiczna im
mniejsza jest praca otoczenia (zewnętrzna)
niezbędna do odprowadzenia ciepła q3q1q3T1
Do odprowadzenia ciepła od
materii o temperaturze niższej
od otoczenia konieczne jest
wykonanie pracy.
q1
q2
T1
T3
Źródło ciepła
grzejnica
chłodnica
w
Druga zasada -podsumowanie
Druga zasada termodynamiki definiuje zmianę entropii. Może być formułowana na
różne sposoby, ale wszystkie sformułowania są równoważne.
1. Entropia układów izolowanych nigdy nie maleje, S ≥ 0 (nierówność Clausiusa)
2. Zbudowanie perpetum mobile drugiego rodzaju jest niemożliwe, ponieważ nie
istnieje przemiana, w której pobrane ciepło jest całkowicie zamieniane na pracę.
3. Wszystkie procesy, które zachodzą samorzutnie, są procesami nieodwracalnymi
termodynamicznie.
Trzecia zasada Termodynamiki
W temperaturze 0 K w doskonale
uporządkowanym krysztale cząsteczki
mogą zajmować tylko jedno, ściśle
określone położenie.
lim 𝑆=0
𝑇→0
Inne formułowanie III zasady termodynamiki: Osiągnięcie temperatury 0 K nie jest możliwe.
Entropia jest jedyną funkcją termodynamiczną, dla której można
obliczyć wartość bezwzględną
Trzecia zasada termodynamiki definiuje bezwzględną wartość entropii
3 Wnioski z II zasady termodynamiki
3.1 Silnik cieplny nie może działać bez
różnic temperatury
3.2 Śmierć cieplna Wszechświata
3.3 Paradoks nieodwracalności
Śmierć cieplna Wszechświata – (Wielki Chłód), hipoteza zakładająca kres Wszechświata w wyniku osiągnięcia stanu
termicznej równowagi. Stan ten jest konsekwencją dążenia entropii – w izolowanym układzie termodynamicznym – do stanu
maksymalnego. Termin ten został po raz pierwszy użyty przez Hermanna von Helmholtza na podstawie wniosków Rudolfa
Clausiusa wynikających z II zasady termodynamiki.
Paradoks nieodwracalności[edytuj]
Z interpretacją II zasady termodynamiki jest też związany swoisty paradoks. Z jednej strony wynika z niej, że wiele zjawisk
obserwowanych w skali makroskopowej może być nieodwracalnych. Z drugiej strony termodynamika statystyczna, z której ta zasada
się wywodzi, zakłada, że każde jednostkowe zjawisko w skali mikroskopowej, czyli w skali pojedynczych cząstek jest odwracalne.
Mimo że wszystkie zjawiska makroskopowe są sumą odwracalnych zjawisk mikroskopowych, przyjmuje się jednak - wbrew zdrowemu
rozsądkowi - możliwość ich nieodwracalności. Paradoks ten przyczynił się do początkowego odrzucenia równania Boltzmanna,
opisującego procesy nierównowagowe.
Ten paradoks wskazuje na ścisły związek między teorią a pomiarem w fizyce. Interpretacja pomiaru układów wielocząstkowych jest
oparta na teoriach tworzonych dla układów makroskopowych. Można powiedzieć, że pomiary te dotyczą sum uśrednionych zjawisk
mikroskopowych. Dla takich pomiarów koncepcja entropii jest niezbędna teoretycznie. Gdyby jednak dało się w jakiś sposób przejść
do pomiaru tych zjawisk na poziomie pojedynczych cząstek, koncepcja entropii przestałaby być potrzebna. Liczba cząstek w
rzeczywistych, makroskopowych układach doświadczalnych jest jednak bardzo duża (rzędu stałej Avogadra) i dlatego pomiar
większości zjawisk fizycznych na poziomie mikroskopowym jeszcze długo pozostanie poza zasięgiem nauki