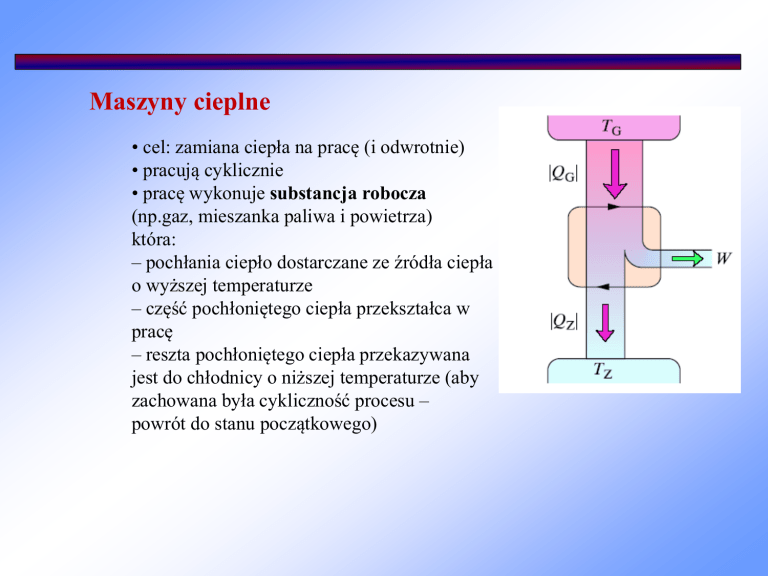
Maszyny cieplne
• cel: zamiana ciepła na pracę (i odwrotnie)
• pracują cyklicznie
• pracę wykonuje substancja robocza
(np.gaz, mieszanka paliwa i powietrza)
która:
– pochłania ciepło dostarczane ze źródła ciepła
o wyższej temperaturze
– część pochłoniętego ciepła przekształca w
pracę
– reszta pochłoniętego ciepła przekazywana
jest do chłodnicy o niższej temperaturze (aby
zachowana była cykliczność procesu –
powrót do stanu początkowego)
Cykl Carnota
Sprawność cyklu η definiujemy jako
stosunek pracy użytecznej W
wykonanej przez gaz do ciepła QG
dostarczonego do gazu w danym
cyklu.
Sprawność
W
Q
ΔU 0
Wykonana praca
Dostarczone ciepło
W QG Q Z
η
QG
QG
QG QZ
TG TZ
TG TZ
η
TG
Cykl Carnota
Sprawność cyklu η definiujemy jako
stosunek pracy użytecznej W
wykonanej przez gaz do ciepła QG
dostarczonego do gazu w danym
cyklu.
Sprawność
W
Q
ΔU 0
Wykonana praca
Dostarczone ciepło
W QG Q Z
η
QG
QG
QG QZ
TG TZ
TG TZ
η
TG
Cykl gazowy – ciepło i praca
Cykl Otta (silnik czterosuwowy)
Cykl Otta (silnik czterosuwowy)
V1
η 1
V 2
R
CV
Silnik benzynowy dwusuwowy
Cykl Diesla
1 V 2 1 V1 V 2
η 1
κ V3 1 V1 V 2
κ
κ
Cykl Stirlinga
η
ηC
cV
1
n R lnV 2 V1 ηC
Silnik Stirlinga
http://www.logicsys.com.tw/wrkbas.htm
Silnik Stirlinga
http://www.logicsys.com.tw/wrkbas.htm
Cykl Carnota
Sprawność cyklu η definiujemy jako
stosunek pracy użytecznej W
wykonanej przez gaz do ciepła QG
dostarczonego do gazu w danym
cyklu.
Sprawność
W
Q
ΔU 0
Wykonana praca
Dostarczone ciepło
W QG Q Z
η
QG
QG
QG QZ
TG TZ
TG TZ
η
TG
Chłodziarka
Sprawność chłodnicza
QZ
TZ
η
QG QZ TG TZ
Pompa cieplna
Mechanizmy przekazywania ciepła
dQ
dT
JQ
dt d S
dx
Prawo Fouriera
Przypadek jednowymiarowy - opis uproszczony
TG TZ
Q
P
kS
t
L
grubość warstwy
współczynnik przewodności cieplnej
Mechanizmy przekazywania ciepła
P
T TZ
Q
kS G
t
L
Prawo Fouriera
k1 S TG T12 k 2 S T12 TZ
P
L1
L2
S TG TZ
P
L1 L2
k1 k 2
S TG TZ
P
Li
i k
i
L
R
kS
Opór cieplny
Mechanizmy przekazywania ciepła
P
T TZ
Q
kS G
t
L
Prawo Fouriera
L
R
kS
Opór cieplny
Promieniowanie cieplne
Prawo Stefana - Boltzmana
E~T4
Promieniowanie cieplne
Konwekcja
Zależna od sił wyporu i lepkości ośrodka.
Przykłady – izolacja termiczna
90-99,8% powietrza
Termos
Aerożel
Rozszerzalność cieplna ciał stałych
ΔL
α L ΔT
L0
ΔV
αV ΔT
V0
Współczynnik rozszerzalności
liniowej i objętościowej
Rozszerzalność cieplna ciał stałych
Bi-metal
Rozszerzalność cieplna ciał stałych
Rozszerzalność wody
Rozszerzalność wody
Cykle termodynamiczne
Cykl: proces lub szereg procesów które doprowadzają układ
termodynamiczny z powrotem do warunków początkowych.
Cykle odwracalne i nieodwracalne
Procesy odwracalne
Proces jest odwracalny, jeśli za pomocą małej (różniczkowej) zmiany
parametrów otoczenia można wywołać proces odwrotny
Proces jest odwracalny, jeśli po przejściu przez niego najpierw w normalnym,
a następnie w przeciwnym kierunku, zarówno układ jak i otoczenie zewnętrzne
wracają do stanu wyjściowego
Cykle termodynamiczne
Proces izotermicznego
sprężania/rozprężania (T=const)
• jest procesem odwracalnym jeśli
przeprowadzany jest bardzo powoli
• staramy się aby układ był w stanie tylko
lekko odbiegającym od stanu równowagi
• przepływ ciepła nie jest spowodowany
przez różnicę temperatur
Procesy odwracalne
Proces adiabatycznego
sprężania/rozprężania (Q=const)
• jest procesem odwracalnym jeśli
przeprowadzany jest bardzo powoli
• staramy się aby układ nie był w stanie
daleko odbiegającym od stanu równowagi
• proces ten nie zamienia ciepła na pracę
mechaniczną
Ciepło i praca
dW Fd l pS dl p Sdl p dV
Vk
W dW pdV
Vp
W p ΔV
I zasada termodynamiki
ciepło dostarczone do układu
ΔU E WK E WP Q W
praca wykonana przez układ
U d Q W
Energia wewnętrzna układu U wzrasta, jeśli układ
pobiera energię w postaci ciepła Q i maleje, kiedy
układ wykonuje pracę W.
Q dU W
Dostarczone do układu ciepło δQ powoduje zwiększenie energii wewnętrznej
układu o dU i wykonanie przez układ pracy δW przeciwko siłom
zewnętrznym.
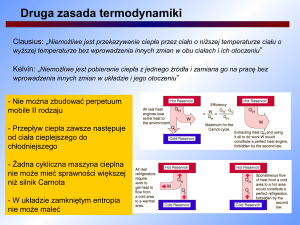
Druga zasada termodynamiki
Clausius: „Niemożliwe jest przekazywanie ciepła przez ciało o niższej temperaturze ciału
o wyższej temperaturze bez wprowadzenia innych zmian w obu ciałach i ich otoczeniu”
Kelvin: „Niemożliwe jest pobieranie ciepła z jednego źródła i zamiana go na pracę bez
wprowadzenia innych zmian w układzie i jego otoczeniu”
- Nie można zbudować perpetuum
mobile II rodzaju
- Przepływ ciepła zawsze następuje
od ciała cieplejszego do
chłodniejszego
- Żadna cykliczna maszyna cieplna
nie może mieć sprawności większej
niż silnik Carnota
- W układzie zamkniętym entropia
nie może maleć
Druga zasada termodynamiki
jest przejawem następujących nieodwracalnych procesów:
1. Kiedy dwa obiekty o różnej temperaturze są ze sobą w kontakcie cieplnym
to przepływ ciepła odbywa się zawsze od obiektu cieplejszego do
zimniejszego
2. Praca mechaniczna może być przetworzona całkowicie na ciepło ale
ciepło nie może być całkowicie przetworzone na mechaniczną pracę (nie
możemy zamienić ciepła w pracę z 100% sprawnością)
mówi, że o energii musimy myśleć nie tylko w kategoriach
jej ilości lecz również jakości
Energia ulega „degradacji” za każdym razem kiedy zostaje użyta:
np. ciepło z reaktora jądrowego Þ elektryczność Þ zasilanie urządzeń
domowych - w każdej z tych przemian dochodzi do strat energii której nie
można odzyskać
Druga zasada termodynamiki
określa kierunek spontanicznych procesów nieodwracalnych
przykłady:
- gaz spontanicznie rozpręża się od obszaru wysokiego ciśnienia do niskiego
- gazy i ciecze mają tendencje mieszania się same ze sobą – niż separowania
- sól kuchenna rozcieńcza się w wodzie, ale nigdy samoczynnie nie wytrąca
się z roztworu
- łatwiej zrobić bałagan w swoim pokoju niż go posprzątać
Druga zasada termodynamiki
Clausius: „Niemożliwe jest przekazywanie ciepła przez ciało o niższej temperaturze ciału
o wyższej temperaturze bez wprowadzenia innych zmian w obu ciałach i ich otoczeniu”
Kelvin: „Niemożliwe jest pobieranie ciepła z jednego źródła i zamiana go na pracę bez
wprowadzenia innych zmian w układzie i jego otoczeniu”
- Nie można zbudować perpetuum
mobile II rodzaju
- Przepływ ciepła zawsze następuje
od ciała cieplejszego do
chłodniejszego
- Żadna cykliczna maszyna cieplna
nie może mieć sprawności większej
niż silnik Carnota
- W układzie zamkniętym entropia
nie może maleć
Perpetuum mobile
I rodzaju: Ciągły „wypływ” energii
II rodzaju: Ciepło zamieniane bezpośrednio w pracę
Demon Maxwella
Ciepło z oceanów
Entropia
dQ
dS
T
Funkcja stanu
K
dQ
ΔS SK SP
T
P
[J/K]
Zmiana entropii zależy jedynie od początkowego i końcowego stanu układu
ΔS n R ln
VK
T
nC V ln K
VP
TP
Dla dowolnej przemiany
Miara energii układu, która nie może być użyta do wykonania pracy mechanicznej
dU T dS p dV
Procesy odwracalne i nieodwracalne
W przemianach odwracalnych w
układzie zamkniętym zmiana entropii
jest równa „0”
S 0
Nierówność Clausiusa
Przemiana nieodwracalna w układzie
zamkniętym zawsze powoduje wzrost
entropii.
Statystyczna definicja entropii
N!
n1!n2!
wielokrotność konfiguracji
SkB ln
Wzór Boltzmana
Układy dążą do stanu bardziej „prawdopodobnego” –
konfiguracji o wyższej wielokrotności (wyższej entropii)
S(1 × 1) = S(1) + S(1)
Statystyczna definicja entropii
N!
n1!n2!
wielokrotność konfiguracji
SkB ln
Wzór Boltzmana
Układy dążą do stanu bardziej „prawdopodobnego” –
konfiguracji o wyższej wielokrotności (wyższej entropii)
S(1 × 1) = S(1) + S(1)
Entropia a oś czasu
W przemianach nieodwracalnych entropia
wyznacza kierunek zachodzenia procesu
Entropia – miara nieuporządkowania
ciepło przemiany
dS
dQ
T
temperatura przemiany
Ekosystemy są układem otwartym
Entropia