Wpływ
Bifidobacterium
animalis
dla zdrowia
Żywność
subsp. lactis na zmniejszenie
nasilenia stanu zapalnego
w jelicie
dr hab. med. prof. nadzw.
Piotr Radwan
Katedra i Klinika
Gastroenterologii
Uniwersytet Medyczny w Lublinie
jelitowej i zjawisk tolerancji pokarmowej odgrywają zasadniczą rolę w etiopatogenezie NZJ [2]. W przebiegu tych
chorób stwierdza się bardzo znaczne różnice ilościowe i jakościowe w zakresie mikroflory jelitowej [2]. Odmienności
flory jelitowej w NZJ obejmują m.in. namnażanie inwazyjnych, przylegających szczepów Eschericha coli (adherent/
invasive E.coli – AIEC). Drobnoustroje te namnażając się w
nabłonku i makrofagach powodują zwiększone wydzielanie cytokin pozapalnych takich jak m.in. czynnik martwicy
guza (tumor necrosis factor α - TNF α) (3).
Zastosowanie probiotyków w terapii WZJG i ChL-C jest
ostatnio tematem bardzo wielu prac, zarówno klinicznych
u chorych na NZJ, jak również w zwierzęcych modelach doświadczalnych. Wykorzystywane są tu własności immunomodulujące probiotyków, wpływających na funkcję komórek dendrytycznych, kompetycyjną eliminację patogenów,
działanie cytoprotekcyjne, jak również modyfikujące profil
cytokin przeciwzapalnych i pozapalnych. W kilku doniesieniach, opublikowanych w ciągu ostatnich lat, stwierdzono
mniejszą liczbę zaostrzeń WZJG po zastosowaniu probiotyków w podtrzymywaniu remisji, ale także korzystny efekt
terapeutyczny w średnio nasilonych zaostrzeniach choroby.
Uzyskana poprawa dotyczyła zarówno parametrów klinicz-
10
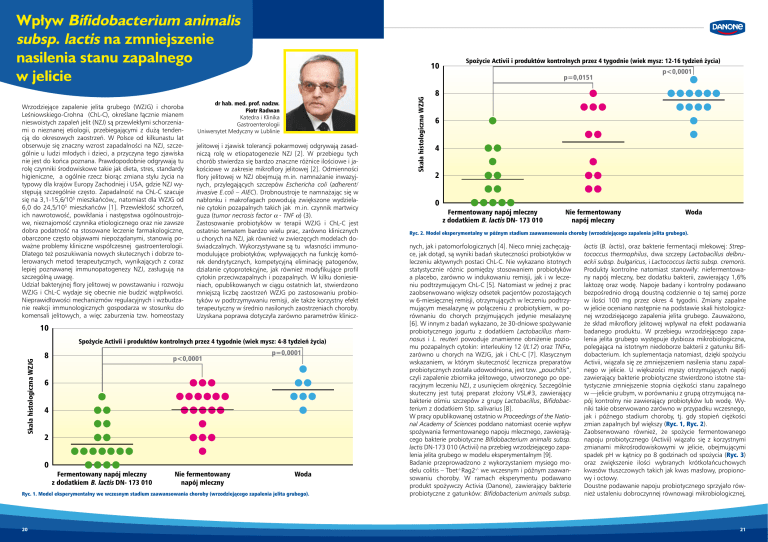
Skala histologiczna WZJG
Spożycie Activii i produktów kontrolnych przez 4 tygodnie (wiek mysz: 4-8 tydzień życia)
8
p<0,0001
p=0,0001
6
4
2
0
Fermentowany napój mleczny
z dodatkiem B. lactis DN- 173 010
Nie fermentowany
napój mleczny
Woda
Ryc. 1. Model eksperymentalny we wczesnym stadium zaawansowania choroby (wrzodziejącego zapalenia jelita grubego).
20
Spożycie Activii i produktów kontrolnych przez 4 tygodnie (wiek mysz: 12-16 tydzień życia)
p=0,0151
Skala histologiczna WZJG
Wrzodziejące zapalenie jelita grubego (WZJG) i choroba
Leśniowskiego-Crohna (ChL-C), określane łącznie mianem
nieswoistych zapaleń jelit (NZJ) są przewlekłymi schorzeniami o nieznanej etiologii, przebiegającymi z dużą tendencją do okresowych zaostrzeń. W Polsce od kilkunastu lat
obserwuje się znaczny wzrost zapadalności na NZJ, szczególnie u ludzi młodych i dzieci, a przyczyna tego zjawiska
nie jest do końca poznana. Prawdopodobnie odgrywają tu
rolę czynniki środowiskowe takie jak dieta, stres, standardy
higieniczne, a ogólnie rzecz biorąc zmiana stylu życia na
typowy dla krajów Europy Zachodniej i USA, gdzie NZJ występują szczególnie często. Zapadalność na ChL-C szacuje
się na 3,1-15,6/105 mieszkańców,, natomiast dla WZJG od
6,0 do 24,5/105 mieszkańców [1]. Przewlekłość schorzeń,
ich nawrotowość, powikłania i następstwa ogólnoustrojowe, nieznajomość czynnika etiologicznego oraz nie zawsze
dobra podatność na stosowane leczenie farmakologiczne,
obarczone często objawami niepożądanymi, stanowią poważne problemy kliniczne współczesnej gastroenterologii.
Dlatego też poszukiwania nowych skutecznych i dobrze tolerowanych metod terapeutycznych, wynikających z coraz
lepiej poznawanej immunopatogenezy NZJ, zasługują na
szczególną uwagę.
Udział bakteryjnej flory jelitowej w powstawaniu i rozwoju
WZJG i ChL-C wydaje się obecnie nie budzić wątpliwości.
Nieprawidłowości mechanizmów regulacyjnych i wzbudzanie reakcji immunologicznych gospodarza w stosunku do
komensali jelitowych, a więc zaburzenia tzw. homeostazy
10
p<0,0001
8
6
4
2
0
Fermentowany napój mleczny
z dodatkiem B. lactis DN- 173 010
Nie fermentowany
napój mleczny
Woda
Ryc. 2. Model eksperymentalny w późnym stadium zaawansowania choroby (wrzodziejącego zapalenia jelita grubego).
nych, jak i patomorfologicznych [4]. Nieco mniej zachęcające, jak dotąd, są wyniki badań skuteczności probiotyków w
leczeniu aktywnych postaci ChL-C. Nie wykazano istotnych
statystycznie różnic pomiędzy stosowaniem probiotyków
a placebo, zarówno w indukowaniu remisji, jak i w leczeniu podtrzymującym ChL-C [5]. Natomiast w jednej z prac
zaobserwowano większy odsetek pacjentów pozostających
w 6-miesięcznej remisji, otrzymujących w leczeniu podtrzymującym mesalazynę w połączeniu z probiotykiem, w porównaniu do chorych przyjmujących jedynie mesalazynę
[6]. W innym z badań wykazano, że 30-dniowe spożywanie
probiotycznego jogurtu z dodatkiem Lactobacillus rhamnosus i L. reuteri powoduje znamienne obniżenie poziomu pozapalnych cytokin: interleukiny 12 (IL12) oraz TNFα,
zarówno u chorych na WZJG, jak i ChL-C [7]. Klasycznym
wskazaniem, w którym skuteczność lecznicza preparatów
probiotycznych została udowodniona, jest tzw. „pouchitis”,
czyli zapalenie zbiornika jelitowego, utworzonego po operacyjnym leczeniu NZJ, z usunięciem okrężnicy. Szczególnie
skuteczny jest tutaj preparat złożony VSL#3, zawierający
bakterie ośmiu szczepów z grupy Lactobacillus, Bifidobacterium z dodatkiem Stp. salivarius [8].
W pracy opublikowanej ostatnio w Proceedings of the National Academy of Sciences poddano natomiast ocenie wpływ
spożywania fermentowanego napoju mlecznego, zawierającego bakterie probiotyczne Bifidobacterium animalis subsp.
lactis DN-173 010 (Activii) na przebieg wrzodziejącego zapalenia jelita grubego w modelu eksperymentalnym [9].
Badanie przeprowadzono z wykorzystaniem mysiego modelu colitis – Tbet-/-Rag2-/- we wczesnym i późnym zaawansowaniu choroby. W ramach eksperymentu podawano
produkt spożywczy Activia (Danone), zawierający bakterie
probiotyczne z gatunków: Bifidobacterium animalis subsp.
lactis (B. lactis), oraz bakterie fermentacji mlekowej: Streptococcus thermophilus, dwa szczepy Lactobacillus delbrueckii subsp. bulgaricus, i Lactococcus lactis subsp. cremoris.
Produkty kontrolne natomiast stanowiły: niefermentowany napój mleczny, bez dodatku bakterii, zawierający 1,6%
laktozę oraz wodę. Napoje badany i kontrolny podawano
bezpośrednio drogą doustną codziennie o tej samej porze
w ilości 100 mg przez okres 4 tygodni. Zmiany zapalne
w jelicie oceniano następnie na podstawie skali histologicznej wrzodziejącego zapalenia jelita grubego. Zauważono,
że skład mikroflory jelitowej wpływał na efekt podawania
badanego produktu. W przebiegu wrzodziejącego zapalenia jelita grubego występuje dysbioza mikrobiologiczna,
polegająca na istotnym niedoborze bakterii z gatunku Bifidobacterium. Ich suplementacja natomiast, dzięki spożyciu
Activii, wiązała się ze zmniejszeniem nasilenia stanu zapalnego w jelicie. U większości myszy otrzymujących napój
zawierający bakterie probiotyczne stwierdzono istotne statystycznie zmniejszenie stopnia ciężkości stanu zapalnego
w ––jelicie grubym, w porównaniu z grupą otrzymującą napój kontrolny nie zawierający probiotyków lub wodę. Wyniki takie obserwowano zarówno w przypadku wczesnego,
jak i późnego stadium choroby, tj. gdy stopień ciężkości
zmian zapalnych był większy (Ryc. 1, Ryc. 2).
Zaobserwowano również, że spożycie fermentowanego
napoju probiotycznego (Activii) wiązało się z korzystnymi
zmianami mikrośrodowiskowymi w jelicie, obejmującymi
spadek pH w kątnicy po 8 godzinach od spożycia (Ryc. 3)
oraz zwiększenie ilości wybranych krótkołańcuchowych
kwasów tłuszczowych takich jak kwas masłowy, propionowy i octowy.
Doustne podawanie napoju probiotycznego sprzyjało również ustaleniu dobroczynnej równowagi mikrobiologicznej,
21
Witamina D
– stary przyjaciel
w nowej roli
Żywność dla zdrowia
8
pH w kątnicy
7
6
5
4
Fermentowany
napój mleczny
z dodatkiem B. lactis
Nie fermentowany
napój mleczny
Woda
Ryc. 3. Zmiany pH w okrężnicy po 8 godzinach od spożycia produktu
probiotycznego i produktu kontrolnego.
związanej ze wzrostem bakterii będących źródłem maślanu
w jelicie grubym. Takie warunki metaboliczne istotnie ograniczają wzrost patogennych drobnoustrojów z grupy Enterobacteriacae, w tym Escherischia coli i Salmonella spp.,
które mogą powodować i nasilać zmiany zapalne w jelicie
grubym, a u pewnej grupy chorych na chorobę Leśniowskiego-Crohna sprzyjają progresji choroby, kolonizując zmiany
w jelicie krętym (Ryc. 4) [10]. Obserwacje te mogą ułatwić
dobór pacjentów z nieswoistymi zapaleniami jelit, u których
można osiągnąć największe korzyści terapeutyczne dzięki
spożyciu funkcjonalnej żywności, zawierającej probiotyczne
szczepy bakteryjne.
Różnica poziomu bakterii przed i po spożyciu wyrażona
jako Log10 (liczba komórek/gram kału)
2
p=0,0132
1
0
-1
-2
-3
Fermentowany napój mleczny z dodatkiem B. lactis
Nie fermentowany napój mleczny
Ryc. 4. Wpływ Activii i niefermentowanego mleka na ilość bakterii
z rodziny Enterobacteriaceae
22
Piśmiennictwo
[1] Loftus E.V.: Clinical epidemiology of inflammatory bowel disease:incidence, prevalence, and
environmental influences. Gastroenterology 2004, 126, 1504-1517
[2] Santor R.B. Microbial influence in inflammatory bowel disease.: Gastroenterology 2008, 134,
577-594
[3] Glasser A.I. et al: Adherent invasive Escherichia coli strains from patients with Crohn’s disease
survive and replicate within macrophages without inducing host cell death. Infect. Immunol. 2001.
69, 5529-37
[4] Rioux K.P., Fedorak R.N.:Probiotics in the treatment of inflammatory bowel diseases. J. Clin.
Gastroenterol. 2006, 40, 260-263
[5] Vanderpool C. et al. : Mechanisms of probiotic action:implications for therapeutic applications
in inflammatory bowel diseases. Inflamm. Bowel Dis. 2008, 14, 1585-1596
[6] Guslandi M. et al : Saccharomyces boulardi in maintenance treatment of Crohn’s disease. Dig.
Dis.Sci.2000,45,1462-64
[7] Lorea Baroja M. et al : Anti-inflammatory effects of probiotic yogurt in inflammatory bowel
disease patients. Clin. Exp. Immunol. 2007,149,470-479
[8] Pardi D.S., Sandborn W.J.: Systematic review: the management of pouchitis. Aliment. Pharmacol. Ther. 2006,8,1087-96
[9] Veiga P. et al : Bifidobatcerium animalis subsp. lactis fermented milk product reduces inflammation by altering a niche for colitogenic microbes. Proc. Natl Acad. Sci USA 2010,107,18132-7
[10] Barnich N, Denizot J, Darfeuille-Michaud A.: E. coli-mediated gut inflammation in genetically
predisposed Crohn’s disease patients. Pathol Biol, 2010 (in press).
Przez ponad 500 milionów lat ewolucji życia na Ziemi witamina D była syntetyzowana przez fito- i zooplankton. Do
chwili obecnej nie w pełni poznaliśmy jej znaczenie w świecie bezkręgowców. Wiemy natomiast, że kręgowcom jej
obecność jest niezbędna do budowy i mineralizacji kości
szkieletowych [1]. Witaminę D odkryto ponad 100 lat temu
i początkowo traktowano wyłącznie jako substancję zapobiegającą rozwojowi krzywicy, która rozpowszechniona
była w miastach w czasie rewolucji przemysłowej. W 1922
roku wielki polski uczony – profesor Jędrzej Śniadecki, jako
pierwszy w świecie, opisał metodę leczenia krzywicy polegającą na zwiększonej ekspozycji na światło słoneczne.
Dziś wiemy już, że witamina D dostarczana jest drogą pokarmową lub syntetyzowana w skórze. Do produktów spożywczych, które zawierają najwięcej witaminy D należą tran i oleje
rybne, ryby (łosoś, dorsz, tuńczyk, śledź, makrela, sardynki),
wątroba, żółtka jaj i grzyby. Z uwagi na to, że dieta w żaden
sposób nie pokrywa dziennego zapotrzebowania, niektóre
produkty spożywcze są sztucznie wzbogacane. W Stanach
Zjednoczonych witaminą D wzbogaca się mleko, jogurty,
płatki śniadaniowe, sok pomarańczowy i margarynę. Jednak
z uwagi na możliwość niekontrolowanego przedawkowania witaminy D, w krajach europejskich lista produktów jest
o wiele krótsza – najczęściej suplementowana jest margaryna i płatki śniadaniowe [2]. W Polsce przykładem wzbogaconego produktu o witaminę D jest serek dla dzieci Danonki.
Zasadniczym źródłem witaminy D w ustroju jest jej fotosynteza, która zachodzi w skórze pod wpływem promieniowania UVB (290-320 nm), docierającego w widmie promieniowania słonecznego do powierzchni Ziemi. Substratem
reakcji jest zawarty w błonach komórkowych keratynocytów 7-dehydrocholesterol (prowitamina D3). Wytworzona
w skórze witamina D uwalnia się z błon komórkowych i po
wniknięciu do naczyń krwionośnych jest transportowana
w krążeniu, w postaci związanej z białkiem wiążącym witaminę D. W wątrobie, we frakcji mikrosomalnej i mitochondrialnej hepatocytów, na skutek reakcji hydroksylacji katalizowanej przez 25–hydroksylazę witaminy D (CYP27A1),
dzięki podstawieniu grupy hydroksylowej (OH-) przy atomie
węgla numer 25, dochodzi do powstania 25-hydroksywitaminy D3 [25(OH)D3]. Utworzona w ten sposób 25(OH)D3
(kalcydiol) jest ponownie uwalniana do krążenia i transportowana w kompleksie białkowym. Metabolit ten w kolejnym etapie aktywacji ulega wychwytywaniu przez komórki
cewek nerkowych, w których pod wpływem mitochondrialnej 1-hydroksylazy 25-hydroksywitaminy D (CYP27B1) ulega
przekształceniu we w pełni aktywny biologicznie metabolit
– 1,25(OH)2D3 (kalcytriol). Intensywność reakcji 1-alfa-hydroksylacji jest uzależniona od stanu homeostazy wapnia
Jest pobudzana przez parathormon oraz zmniejszenie stężenia Ca2+ lub fosforanów w surowicy krwi.
prof. dr hab. n. med. Anna Woźniacka
Katedra i Klinika Dermatologii i Wenerologii UM w Łodzi
Przez wiele lat uważano, że jedyną funkcją witaminy D jest
wpływ na gospodarkę wapniowo-fosforanową i metabolizm tkanki kostnej. Powszechnie utożsamiano jej działanie
z zapobieganiem rozwojowi krzywicy u dzieci, osteomalacji
u dorosłych i zmian mięśniowych, będących następstwem
hipokalcemii. W ostatnich latach badania dotyczące roli
witaminy D w organizmie człowieka przeżywają swoisty
renesans i wskazują na znacznie szerszy zakres oddziaływań witaminy D na ludzki organizm. Dlatego zaleca się,
by racjonalnie suplementować tę witaminę w każdym
wieku.
Liczne opracowania naukowe wykazują związek pomiędzy
niedoborem witaminy D a szeregiem chorób metabolicznych
stanowiących epidemię obecnych czasów. Niskie stężenie
witaminy D nie tylko zwiększa ryzyko rozwoju osteoporozy,
ale również zespołu metabolicznego, cukrzycy typu 1, nadciśnienia, stwardnienia rozsianego, chorób autoimmunizacyjnych, nowotworowych, a nawet psychicznych.
Jednym z podstawowych problemów zdrowia publicznego krajów rozwiniętych jest zespół metaboliczny, określany
inaczej zespołem X. Stanowi on zbiór powiązanych ze sobą
metabolicznych czynników ryzyka rozwoju miażdżycy, cukrzycy i chorób sercowo-naczyniowch [3]. Do rozpoznania
konieczne jest stwierdzenie co najmniej trzech z poniższych
nieprawidłowości: otyłości brzusznej (obwód talii powyżej
88 cm u kobiet i powyżej 102 cm u mężczyzn), podwyższonego stężenia glukozy (powyżej 100mg/dl), nadciśnienia (powyżej 130 mmHg skurczowe lub powyżej 85 mmHg
rozkurczowe), zwiększonego stężenia trójglicerydów (powyżej 150 mg/dl), obniżonego stężenia frakcji HDL-cholesterolu (poniżej 40 mg/dl u mężczyzn i poniżej 50 mg/dl
u kobiet).
Występowanie zespołu metabolicznego zwiększa ryzyko rozwoju choroby niedokrwiennej serca trzykrotnie,
a śmiertelność spowodowaną chorobami sercowo-naczyniowymi nawet pięciokrotnie [4]. Dane te pokazują, jak
ważne jest wczesne wykrywanie czynników ryzyka chorób
cywilizacyjnych, tak aby wprowadzenie działań profilaktycznych mogło przeciwdziałać ich następstwom. Według
danych pochodzących z badań populacji europejskiej, częstość występowania zespołu metabolicznego sięga 15,7%
u mężczyzn i 14,2% u kobiet. U osób z zespołem metabolicznym stężenie witaminy D w surowicy krwi jest istotnie statystycznie niższe aniżeli w porównywalnej populacji
osób zdrowych. Wiele prac wskazuje, że niedobór tej wi-
23