DOI://10.1066/S10023090021
Sonograficzne markery zespołów genetycznych
Sonographic markers of genetic syndromes
Maria Respondek-Liberska
11111111111111111111111111111111111111111111111111111111111111111111111111111111111111
M. Respondek-Liberska (✉), Katedra Morfologii i Embriologii, Instytut Centrum Zdrowia Matki Polki,
Uniwersytet Medyczny, ul. Narutowicza 60, 90–136 Łódź
Zakład Diagnostyki i Profilaktyki Wad Wrodzonych, Ośrodek Kardiologii Prenatalnej typu C, ul. Rzgowska 281,
94–117 Łódź, Tel.: 042 / 271 11 35, Fax: 042 / 271 13 84, [email protected]
praca poglądowa
Przegląd Chirurgii Dziecięcej 2009;4(2—3):29—41
© Blackhorse Science Bussines Media, 2009
Wpłynęło: 01.10.2009; Zaakceptowano: 15.11.2009
Streszczenie Omówiono rodzaje aktualnie dostępnych badań USG: powszechnie stosowane skriningowe
USG i zarezerwowane dla wyselekcjonowanej grupy ciężarnych specjalistyczne badania USG (genetyczny
sonogram + echokardiografię). Te ostatnie badania przeznaczone są dla tych ciężarnych, u których
w badaniu przesiewowym znaleziono jeden z sonograficznych markerów zespołów genetycznych
lub przesiewowy test biochemiczny wypadł nieprawidłowo. Poszukiwanie sonograficznych markerów
zespołów genetycznych przeprowadza się począwszy od 13. tygodnia ciąży. Większość wad i zespołów
genetycznych wykrywa się i diagnozuje w pierwszej połowie ciąży. Prawidłowy przebiegu I połowy ciąży
nie wyklucza możliwości ujawnienia się anomalii u starszych płodów >25. tygodnia ciąży. Omówiono
między innymi takie markery, jak: poszerzenie NT, trudności w ocenie kości nosowej, poszerzenie komór
bocznych mózgu, poszerzenie tylnego dołu czaszki, wady OUN, anomalie twarzoczaszki, anomalie
szwu strzałkowego i ciemiączka płodu, fałd karkowy, aplazje i hipoplazje kości, anomalie kręgów,
anomalie palców i stóp płodu, anomalie płuc płodu, wysięki w jamach ciała, markery kardiologiczne
(niedomykalność zastawki trójdzielnej, przepływ w przewodzie żylnym, ognisko hiperechogeniczne, wysięk
w osierdziu, kardiomegalia, prawostronny łuk aorty, hipoplazja grasicy, wady serca), anomalie przewodu
pokarmowego (nieprawidłowy obraz jelit lub powłok brzusznych), anomalie układu moczowo-płciowego,
anomalie pępowiny i łożyska. Omówiono także nietypową fizjologię płodów z zespołami genetycznymi.
Aktualnie większość częstych, jak i rzadkich zespołów genetycznych można wykryć i zdiagnozować przed
urodzeniem w ośrodkach referencyjnych dla wad płodu (np. zespół Downa, zespół Edwardsa, zespół Pataua,
zespół Noonana, zespół Turnera, zespół SLO, zespół Aperta). Diagnostyka tych zespołów zależy głównie
od doświadczenia lekarza badającego.
Słowa kluczowe echokardiografia płodu • genetyczny sonogram • poszerzenie NT • wada pozasercowa
• wada serca płodu
Abstract Types of current prenatal sonographic examinations were presented: screening ultrasound
for every pregnancy and genetic ultrasound and fetal echocardiography for selected pregnancy (based
on abnormalities found in screening US and /or in biochemical tests). Sonographic genetic markers
could be visualized as early as in 13th week of pregnancy and later on. Most of them could be found
in 1st half of pregnancy. ”Normal” first half of pregnancy may preceed abnormalities seen later on, for
instance >25th week of pregnancy. Several markers would be presented: an increased NT, abnormalities
of nasal bones, ventriculomegaly, cysterna magna dilatation, central nervous system malformations, face
abnormalities, metopic suture and fontanell abnormalities, nuchal fold, long bones aplasia or hipoplasias,
vertebre anomalies, abnormalities of fingers and feets, abnormalities of fetal lungs, hydrothorax, ascites,
cardiac abnormalities ( tricuspid valve regurgitation, ductus venosus flow, bright spot, pericardial
effusion, cardiomegaly, right aortic arch, thymus hypoplasia, heart defects), digestive tract abnormalities,
(including guts and skin: omphalocele/ gastroschisis), renal abnormalities, extrenal genitalia abnormalities,
umbilical and placental abnormalies. In genetic syndromes fetal physiology is also freqeuntly abnormal.
Currently most of common as well as and rare genetic syndromes could be detected and diagnosed before
S10023090021.indd 29
2009-11-27 17:01:19
the delivery in referral center for fetal abnormalities (for instance Down S, Edward’s S, Patau S, Noonan
S, Turner S, SLO, Apert S). Ultrasound/echocardiographic diagnoses in those fetuses is related mainly
to the expertise of the physician in referral center.
Keywords extracardiac malformation • fetal echocardiography • genetic sonogram • heart defect
• NT dilatation
Wstęp
Zanim przejdę do omawiania sonograficznych markerów zespołów genetycznych należy przypomnieć
rodzaje badań USG u płodów, które na przestrzeni
ostatnich kilku lat uległy istotnemu zróżnicowaniu
w związku zarówno z postępem technologicznym,
nowymi umiejętnościami, jak i poprawą w zakresie
interpretacji obrazów [32]. Wyróżniamy następujące
badania [31].
kończyn, łącznie z oceną wszystkich kości długich
(poza kością udową ocenianą w badaniu rutynowym,
ocenia się długość kości ramieniowej, kości łokciowej,
promieniowej, strzałki i piszczeli) [7, 14, 15, 25, 26].
W zakresie szyi płodu ocenia się gruczoł tarczowy,
w zakresie klatki piersiowej echogeniczność płuc
i długość żeber, w zakresie jamy brzusznej: wielkość
i echogeniczność wątroby, śledziony, wielkość i położenie nerek, nadnerczy, śledziony, stan wypełnienia
żołądka i pęcherza moczowego, lokalizację i wielkość
pęcherzyka żółciowego, przyczep płodowy pępowiny,
liczbę naczyń pępowiny, przyczep łożyskowy pępowiny. W zakresie serca płodu ocenia się nie tylko 4
jamy, ale i drogi wypływu oraz śródpiersie u płodu.
Tego typu badanie trwające minimum 45—50 minut
wykonują lekarze zwykle po odpowiednich kilkudniowych kursach. Z roku na rok lista analizowanych
szczegółów u płodu w genetycznym sonogramie ulega
wydłużeniu [16].
Podstawowe rutynowe-przesiewowe badanie USG
USG dopplerowskie
Podstawowe, rutynowe – przesiewowe badanie USG
obejmujące ocenę masy płodu, jego położenia, płci,
objętości wód płodowych i lokalizacji łożyska, z oceną
podstawowej budowy płodu mającej na celu wykluczenie wodogłowia, wysięków w jamach ciała, oceny
czterojamowości serca płodu oraz wykluczenia wysokiej niedrożności przewodu pokarmowego. Badanie
to wykonywanej jest w każdym gabinecie USG, jego
czas wynosi 20—30 minut, najczęściej przez położnika
(w niektórych krajach przez położne lub techników
ultrasonografistów).
Dodatkowym badaniem jest USG dopplerowskie,
które w wersji podstawowej obejmuje ocenę przepływów w tętnicy i żyle pępowinowej, w wersji badania
poszerzonego poza pępowiną ocenia się przepływy
w przewodzie żylnym, żyle głównej dolnej i tętnicy
mózgu środkowej. W wyspecjalizowanych ośrodkach
diagnostyki prenatalnej ocena dopplerowska obejmuje także prawe i lewe płuco płodu, tętnice nerkowe,
tętnice śledzionowa, przepływy płynu owodniowego
w jamie nosowej i ustnej. Czas trwania tego badania
wynosi 15—20 minut. Umiejętności przeprowadzenia,
jak i interpretacji badania Dopplera uczą się położnicy
zwykle na 2—3-dniowych kursach podyplomowych.
Zespoły wad genetycznych występują znacznie częściej w populacji płodów niż w populacji noworodków.
Wynika to z faktu, iż populacja zarodków i płodów
jest liczniejsza od populacji żywo urodzonych dzieci.
Około 50% poronień w pierwszym trymestrze ciąży
jest związanych z aberracjami chromosomalnymi. Ich
procentowy udział w populacji płodów >28 tygodnia
ciąży wynosi już tylko 5% [11].
Genetyczny sonogram-badanie USG II stopnia
30
S10023090021.indd 30
Badanie USG II stopnia to tzw. genetyczny sonogram
oferowany wyselekcjonowanej grupie ciężarnych (na
podstawie anomalii znalezionych w badaniu przesiewowym, badaniach biochemicznych lub na podstawie
wywiadu rodzinnego). Termin ten został wprowadzony w Stanach Zjednoczonych przez położników
i radiologów, obejmuje wszystkie elementy z badania
podstawowego (rutynowego) oraz wiele elementów
dodatkowych: ocenę ośrodkowego układu nerwowego, z pomiarami komór bocznych, pomiarem tylnego
dołu czaszki, pomiarem średnicy móżdżku, wymiaru
dwuoczodołowego, oceną przezierności soczewek,
pomiarem kości nosowej, oceną twarzoczaszki płodu,
ciągłości wargi górnej i dolnej, oceną nozdrzy płodu,
ciągłości kręgosłupa, oceną wszystkich czterech
Echokardiografia płodu
Innym badaniem specjalistycznym jest badanie echokardiograficzne płodu, które obejmuje ocenę czterech
jam, dróg wypływu z prawej i lewej komory, ocenę
śródpiersia płodu polega na osłuchaniu wszystkich
zastawek serca (podobnie jak u noworodka). W odróżnieniu od badania pourodzeniowego w badaniu
u płodu należy osłuchać i udokumentować także
przepływ przez zastawkę otworu owalnego (czy jest
on prawo-lewy, lewo-prawy, czy dwukierunkowy),
należy osłuchać także przewód tętniczy (w skurczu,
jak i w rozkurczu), trzeba osłuchać także przepływ
w cieśni aorty. Na podstawie analizy różnych prezentacji echokardiograficznych należy ocenić stan
2009-11-27 17:01:19
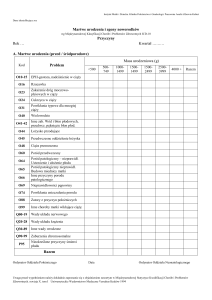
Tabela 1. Rodzaje prenatalnych badań sonograficznych z podaniem okresu szkolenia i liczby gabinetów w Polsce.
Parametry
Badanie USG
przesiewowe
Badanie USG II typu
specjalistyczne
Badanie przepływów
Dopplerem
Badanie echokardiograficzne
(skriningowe i lub
specjalistyczne)
Rodzaj gabinetu
Każdy gabinet
położniczy
Niektóre gabinety
położnicze
Niektóre gabinety
położnicze
Wybrane ośrodki
(w Polsce około 30)
Okres szkolenia
1—2 dni
5—7 dni
2—3 dni
3—5 lat
Wymagane certyfikaty
Nie
Tak
Nie
Tak
Czas trwania badania
15—20 minut
40—60 minut
15—20 minut
45—60 minut
podstawowego badania USG lekarz położnik, radiolog,
technik (?), zauważy przynajmniej jeden z markerów,
stanowi to wskazanie do skierowania pacjenta – płodu na badanie specjalistyczne: ultrasonograficzne II
stopnia lub badanie echokardiograficzne lub badanie
ultrasonograficzne + badanie echokardiograficzne,
łącznie nazywane „USG genetycznym”. Nazwę tę wprowadzono w Stanach Zjednoczonych (Harvard Boston
School of Medicine) głównie na potrzeby firm ubezpieczeniowych celem zróżnicowania opłat za badania
USG podstawowe od badań specjalistycznych.
Ryc. 1. Obraz przezierności karkowej u płodu w pierwszym
trymestrze.
wydolności układu krążenia. W przypadku nieprawidłowej budowy serca wynik badania zaopatrywany
jest dodatkowo w rysunek wady serca i propozycje
dalszego postępowania dla położnika i dla ciężarnej.
Badanie echokardiograficzne w istotny sposób uzupełnia informacje o płodzie z genetycznego sonogramu [15]. Badania echokardiograficzne wykonywane są
w Polsce przez grupę około 30 lekarzy (szczegóły na
stronie www.orpkp.pl lub fetalecho.pl). Czas badania
serca pojedynczego płodu w ośrodku specjalistycznym wynosi 45—60 minut. Okres szkolenia przed
uzyskaniem uprawnień do wykonywania tego rodzaju
badania wynosi u nas kilka lat, zwykle 3—5.
Wiele nieporozumień i pretensji do lekarzy zarówno ze
strony pacjentów, jak i ich prawników wynika z braku
zrozumienia przedstawionych powyżej różnic w badaniach płodu. Zazwyczaj wyniki fałszywie ujemne dotyczą gabinetów, w których wykonane zostało badanie
podstawowe (trwające 15—20 minut), a pacjenci nie
byli uświadamiani, iż mogli w czasie ciąży skorzystać
z szerszej oferty badań USG czy specjalistycznego
badania echokardiograficznego (trwających 2—3
dłużej). Rodzaje badań USG przedstawia Tabela 1.
Omówienie
Inaczej również wygląda monitorowanie stanu płodu w przypadku kolejnych seryjnych badań USG, np.
przy monitorowaniu częstoskurczu u płodu lub bloku
całkowitego serca płodu. Jeżeli w czasie przesiewowego
S10023090021.indd 31
Aktualnie badania USG i ECHO można także podzielić
w zależności od trymestru ciąży: na badania w pierwszym lub drugim lub trzecim trymestrze. Każde z nich
cechuje inna specyfika: badanie w pierwszym trymestrze nazwane zostało w piśmiennictwie anglosaskim
pod koniec XX wieku dating scan, badanie w drugim
trymestrze anomaly scan, badanie w trzecim trymestrze służyło minitorowaniu stanu płodu.
Badania w I trymestrze ciąży
Aktualnie coraz więcej anomalii płodu można wykrywać już w pierwszym trymestrze. W pierwszym
trymestrze (u płodu, którego wymiar siedzeniowogłowowy wynosi od 45 do 84 mm) podstawowym
pomiarem wykonywanym w każdym gabinecie jest
pomiar długości siedzeniowo-ciemieniowej, tzw. CRL
oraz rytm serca płodu.
Natomiast najistotniejszym markerem zespołów genetycznych, w tym wieku płodowym jest poszerzenie
przezierności karkowej (nuchal translucency) >3,5
mm, które w 80% przypadków może być pierwszym
objawem zespołu genetycznego ale w 5% występuje
także w ciążach niepowikłanych (Ryc. 1.). Im większy
pomiar przezierności karkowej, tym większe prawdopodobieństwo zespołów genetycznych (zespołu
Downa, trisomii 18, 13, zespołu Turnera) i lub wady
serca. Przy NT >6,5 istnieje 20% ryzyko obumarcia
płodu. Powiększoną przezierność karkową tłumaczy
się aktualnie: niewydolnością krążenia płodu, zaburzeniem rozwoju układu limfatycznego, zastojem krwi
żylnej, zaburzeniem składu macierzy komórkowej,
anemią płodu, hipoproteinemią płodu lub infekcją
płodu. Poszerzenie NT jest objawem niespecyficznym
(Ryc 1.). Opisano kilkadziesiąt zespołów chorobowych
31
2009-11-27 17:01:19
Ryc. 2. Hipoplazja robaka móżdżku u płodu z trisomią 21
oraz poszerzenie rogów tylnych komór bocznych.
Ryc. 3. Torbiel splotu naczyniówkowego u płodu
z trisomią 18.
i wad genetycznych przebiegających z poszerzeniem
NT w pierwszym trymestrze, a mimo to większość
płodów z poszerzonym NT rodzi się zdrowych.
W pierwszym trymestrze ciąży w badaniu skriningowym zwraca się także uwagę na obecność kości
nosowej, która powinna być widoczna w przekroju
osiowym niezależnie od skóry nosa płodu. Jej brak
lub asymetria może sugerować obecność zespołu
genetycznego (w 60% trisomię 21., w 50% trisomię
18., w 40% trisomię 13.), ale w 3% nie ma to znaczenia
klinicznego, a przebieg ciąży i losy noworodka mogą
być prawidłowe.
W szczegółowym badaniu USG ocenia się także kąt
szczękowo-twarzowy, którzy najczęściej bywa nieprawidłowy w trisomii 18. Rejestruje się także przepływ
krwi metodą Dopplera przez przewód żylny. W przypadku fali wstecznej w czasie skurczu przedsionka,
w 80% przypadków przebieg rozwoju płodu może być
prawidłowy, ale istnieje podwyższone ryzyko występowania zaburzeń chromosomalnych lub izolowanej
wady serca lub zgonu płodu. U 65% płodów z zespołem
Downa oraz 55% płodów z trisomią 18 lub 13 w przewodzie żylnym rejestruje się falę wsteczną.
Ryc. 4. Holoprosencefalia u płodu z trisomią 13.
nieniu tzw. dużych markerów – wad strukturalnych
oraz tzw. soft markerów, które są niespecyficzne i mogą
występować także u płodów zdrowych lub mogą być
sonograficznymi markerami infekcji u płodu zdrowego lub z zespołem genetycznym. Część z tych anomalii
może być dostrzeżona już w pierwszym trymestrze,
ale niektóre dopiero w trzecim trymestrze.
Sonograficzne markery zespołów genetycznych
W szczegółowym badaniu USG zwraca się uwagę na
charakter przepływu krwi przez zastawkę trójdzielną.
Zarejestrowanie niedomykalności zastawki trójdzielnej częściej występuje u płodów obciążonych zespołami genetycznymi: w 55% u płodów z zespołem Downa,
w 30% u płodów z trisomią 18 lub 13, ale także u 1%
płodów zdrowych. W pierwszym trymestrze pomiar
częstości akcji serca płodu sugerujący tachykardię płodu około 170—180 częściej spotyka się w trisomii 13.
Wykrycie jednej z wyżej wymienionych anomalii
w pierwszym trymestrze ciąży jest wskazaniem do
specjalistycznego badania echokardiograficznego
w 13—14 tygodniu ciąży [21].
Badania w II i III trymestrze ciąży
32
S10023090021.indd 32
W drugim i trzecim trymestrze podstawowy podział
markerów zespołów genetycznych polega na wyróż-
Sonograficzne markery zespołów genetycznych w zależności od ich występowania w poszczególnych narządach: Markery sonograficzne zespołów genetycznych
w zakresie OUN (rejestrowane głównie w drugim
trymestrze, ale coraz częściej w pierwszym trymestrze ciąży). Do najczęściej występujących anomalii
zaliczyć należy poszerzenie komór bocznych mózgu.
W warunkach prawidłowych światło komór bocznych
jest szczelinowate. W przypadku chorób płodu lub wad
wrodzonych może występować poszerzenie – mierzone na wysokości przedsionka komory. O wentrikulomegalii mówimy, gdy pomiar ten wynosi >5 mm,
a poniżej 20 mm. W przypadku poszerzenia >20 mm
rozpoznaje się wodogłowie u płodu, które stosunkowo
rzadko występuje w zespołach genetycznych. Łagodne
poszerzenie komór bocznych należy różnicować z agenezją ciała modzelowatego, z dysplazją przegrodowooptyczną (septo-opitc dysplasia), z brakiem przegrody
2009-11-27 17:01:20
Ryc. 5. Spłaszczony nieprawidłowy profil płodu
z agenezją ciała modzelowatego w przebiegu trisomii 18,
z prawidłową kością nosową z nieprawidłowym kątem
czołowo-żuchwowym.
Ryc. 7. Prawidłowy zarys małżowiny usznej u płodu
z Z. Downa.
Ryc. 8. Prawidłowy zarys twarzoczaszki płodu
w prezentacji 2D u płodu z zespołem Downa.
Ryc. 6. Nieprawidłowy siodełkowaty nos płodu
z uwypuklonym czołem w przebiegu zespołu Aperta.
jamy przegrody przezroczystej. W tylnym dole czaszki,
poniżej półkul móżdżku zazwyczaj nie jest widoczna
cysterna magna. Może ona niekiedy zajmować kilka
milimetrów, a gdy jej światło wynosi >10 mm, mówimy o poszerzeniu cysterna magna. W przypadku
znacznego poszerzenia cysterna magna w DGN różnicowej należy brać pod uwagę Zespół Dandy-Walkera
z agenezją robaka móżdżku, hipoplazją móżdżku,
poszerzeniem komory 4. W DGN różnicowej należy
uwzględnić torbiel pajęczynówki (może ona być
zlokalizowana w różnych częściach OUN, nie tylko w
tylnym dole). W tylnym dole czaszki płodu ocenia się
także móżdżek płodu (cerebellum). W zespołach wad
genetycznych może występować hipoplazja robaka
móżdżku (Ryc. 2.). W przypadku obecności objawów
Chariego (wpuklania się móżdżku) należy wykluczyć
obecność przepukliny oponowo-rdzeniowej, ale jest
to rzadki objaw zespołów genetycznych (występuje
w 2—3% trisomii 13 i 18).
Znacznie częściej w zespołach genetycznych (np.
trisomii 18) spotyka się stosunkowo niewielkie
torbiele splotów naczyniówkowych (pojedyncze lub
obustronne), których średnica może wynosić 4—5
mm (Ryc. 3.). Towarzyszą im zwykle inne dodatkowe
markery sonograficzne w zakresie pozostałych narządów. Izolowane zwykle jednostronne torbiele mogą
występować u „zdrowych” płodów około 18.—20.
S10023090021.indd 33
tygodnia ciąży, ulegają one regresji w kolejnych tygodniach a u noworodka nie znajdujemy odchyleń
od normy ani w badaniu przedmiotowym ani w USG
przezciemiączkowym.
Częstym markerem zespołów genetycznych jest holoprosencefalia, czyli brak całkowitego podziału komór
mózgu (Ryc. 4.). Holoprosencefalia może występować
jako lobarna, semilobarna lub alobarna. Najczęściej u
tych płodów występuje trisomia 13 lub 18. Holoprosencephalii mogą towarzyszyć anomalie twarzoczaszki
pod postacią rozszczepu wargi/ podniebienia jednostronne lub obustronne. Markerem zespołów wad
genetycznych może być małogłowie.
W zakresie twarzoczaszki płodu w badaniu ultrasonograficznym w prezentacji 3D, jak i 4D można
obserwować mimikę twarzy płodu, która staje się
szczególnie bogata w III trymestrze ciąży. W niektórych przypadkach można zaobserwować typowe cechy
dysmorficzne u płodu jak: spłaszczony profil (Ryc. 5.),
niską nasadę nosa, uwypuklone czoło (Ryc. 6.), nisko
osadzone małżowiny uszne, czasem nietypowe małe
małżowiny uszne lub o nietypowym kształcie, wyrostki skórne, małą żuchwę, niekiedy cofnięte lub wypukłe
czoło albo duży język („nie mieszczący się w jamie
ustnej”, np. w zespole Beckwith-Wiedemanna lub
mukopolisacharydozach). Analiza małżowin usznych
płodu (Ryc. 7.) jest stosunkowo trudnym elementem
prenatalnej diagnostyki sonograficznej, rzadko jest
dostępna nawet w o środkach referencyjnych [10].
33
2009-11-27 17:01:21
Ryc. 9. Nieprawidłowy zarys stopy u płodu z zespołem
Downa.
Ryc. 10. Nieprawidłowy zarys stopy z „poduszeczką
grzbietową” u płodu z zespołem Turnera.
Częściej natomiast ocenia się rozstaw gałek ocznych:
można wykryć zarówno hipoteloryzm, jak i hiperteloryzm, a także wrodzoną zaćmę jedno- lub obustronną
[17, 24] albo nieprawidłowe wielkości gałek ocznych
[23]. W niektórych przypadkach jednak „rysy” twarzoczaszki płodu z klasycznym zespołem Downa
są nie do odróżnienia od płodu zdrowego (Ryc. 8.).
W prezentacji 3D, jak i 4D, zarówno pracując on-line,
ale częściej off-line możliwe jest „zdjęcie” tkanek
miękkich twarzoczaszki płodu i zobrazowanie szwów
czaszkowych, ciemiączka, kości nosowych.
Szczególną wagę ostatnio przywiązuje się do szwu
metopic. Zmienia on swój kształt w zależności od
wieku ciążowego, od szerokiej litery V do coraz
bardziej linijnego przebiegu pod koniec ciąży.
Przetrwały „szeroki szew metopic” może sugerować
obecność zespołu wad genetycznych, między innymi
pod postacią przedwczesnego zarastania się szwów
skroniowych, np. w zespole Aperta [3]. Szeroka szyja
i kark płodu, niekiedy z objawami jedno- lub obustronnej torbieli limfatycznej może kojarzyć się z zespołem Turnera. Można znaleźć także powiększenie
tarczycy płodu, niezależnie od stanu hormonalnego
ciężarnej. Powiększona tarczyca płodu występuje
zarówno przy nadczynności, jaki i niedoczynności.
W zakresie kręgosłupa płodu stosunkowo rzadko
w zespołach genetycznych obserwuje się rozszczepy kręgosłupa. Częściej natomiast skrzywienia
kręgosłupa płodu. Natomiast stosunkowo często
występują anomalie dotyczące żeber płodu (zarówno
ich liczby, jak i długości), poszczególnych kręgów
(np. kręgi połówkowe), anomalie w zakresie kości
długich (aplazje, hipoplazje, złamania rzekome).
34
S10023090021.indd 34
Aktualnie wykonując szczegółowe badanie USG można ocenić cały układ kostny płodu, nie tylko szerokość
szwów czaszkowych, ale także długość obojczyków,
symetrię łopatek, obecność i pomiary wszystkich
kości długich. Ocenia się także kształt i długość stóp,
odległość pomiędzy paluchem a drugim palcem,
kształt poszczególnych paliczków. Zwykle ocena stóp
płodu jest łatwiejsza od oceny dłoni płodu, które mogą
być „splecione” lub ustawione w”piąstki”. W zakresie
stóp płodu dawniej za charakterystyczny uznawano
sandal gap, czyli zwiększoną odległość pomiędzy
paluchem a drugim palcem. Ale takie ustawienie
Ryc. 11. Obrzęknięta dłoń płodu z zespołem Turnera.
może występować także u zdrowych płodów, zwykle
jest wówczas jednostronne, czasowe (po kilku minutach płód demonstruje klasyczne ustawienie palców
stopy). Można także zaobserwować sandal gap stóp
u zdrowych rodziców. Można u płodu zobrazować
stopy prawidłowe lub piętowe, lub w ustawieniu
szpotawym. Anomalie stóp płodu mogą być efektem
małowodzia, zespołu taśm owodniowych, zespołu wad
genetycznych lub anomalią izolowaną (Ryc. 9—10). W
przypadku kończyn górnych można zobrazować ich
brak, hipoplazje, przykurcze, złamania, polidaktylie,
syndaktylie, klinodaktykie, ektrodaktylię i inne deformacje (Ryc. 11.) [36, 12]. W przypadku zaciśniętych
piąstek i palców płodu zachodzących na siebie należy
brać pod uwagę ich trwały „przykurcz” spotykany w
zespołach genetycznych albo też typowe, chwilowe,
ustawienie piąstek, analogiczne jak u noworodka. Artrogrypoza dawniej opisywana u noworodków dzisiaj
jest do uwidocznienia w szczegółowym badaniu USG
w ośrodkach referencyjnych. Większość wad letalnych
z zakresu układu kostnego można wykryć i zdiagnozować na podstawie szczegółowego badania USG, ale
diagnostyka różnicowa poszczególnych typów wad
jest nadal trudna [41].
Klatka piersiowa: stosunkowo rzadko w zespołach genetycznych spotyka się wady płuc płodu (zwyrodnienie gruczolakowate płuc, sekwestracja płuca, torbiele płuc, rozedma wrodzona
najczęściej występują u płodów z prawidłowym
kariotypem). Natomiast markerem zespołu genetycznego może być wysięk w opłucnej. Częstą anomalią
w zakresie klatki piersiowej, która bywa dostrzegana
2009-11-27 17:01:22
Ryc. 12. Wspólny kanał przedsionkowo-komorowy
u płodu z zespołem Downa.
Ryc. 13. „Prosta” wada serca płodu pod postacią VSD
w przebiegu trisomii 13.
Tabela 2. Markery kardiologiczne zespołów wad genetycznych.
Wady serca
AVC
VSD
ASD
DORV
ToF
Truncus arterio sus
Inne
Anomalie
czynnościowe
Niedomykalność zastawki trójdzielnej
(w pierwszym trymestrze)
Wysięk w osierdziu
Jednakowy poziom przyczepu zastawek
przedsionkowo-komorowych
Kardiomegalia
Inne
Ognisko hiperechogeniczne w lewej
lub prawej komorze serca
Prawostronny łuk aorty
Aberrant subclavian artery
jako jeden z pierwszych marker zespołów genetycznych jest przepuklina przeponowa (najczęściej
lewostronna ale może być także prawostronna). Wykluczenie współistnienia zespołu genetycznego ma w
tych przypadkach kluczowe znaczenie dla ustalenia
nie tylko diagnozy, ale i prognozowania przeżycia
płodu i noworodka. Tylko izolowane przepukliny
przeponowe, przy prawidłowym kariotypie płodu
mają szanse na skuteczną terapię [33]. U co drugiego
S10023090021.indd 35
Ryc. 14. Badanie serca płodu za pomocą jednej z technik
w ośrodku referencyjnym – tissue Doppler – obraz
prawidłowy.
Ryc. 15. Wysięk w osierdziu oraz ognisko
hiperechogeniczne (bright spot) u płodu z zepołem
Downa.
płodu z zespołem wad genetycznych występują anomalie kardiologiczne. Dlatego nazwa wprowadzona
w ubiegłym stuleciu w Stanach Zjednoczonych „genetyczny sonogram” obejmuje szczegółowe badanie
echokardiograficzne.
Markery kardiologiczne zespołów wad genetycznych
Markery kardiologiczne zespołów wad genetycznych
wymieniono w Tabeli 2. Są to najczęściej wady serca,
najczęściej proste, „łagodne” (Ryc. 12.—13.). Aby je
wykryć i właściwie zdiagnozować, stosuje się różne
techniki echokardiograficzne (Ryc. 14.). Według nomenklatury przyjętej w programie Kardio-Prenatal
(www.orpkppl) [35] za wady łagodne uznajemy takie,
które nie stanowią zagrożenia życia płodu, nie wymagają interwencji kardiologiczno-kardiochirurgicznej
w pierwszym miesiącu życia, a mogą być operowane
w okresie niemowlęcym. Są to zwykle ubytki przegród:
międzykomorowej i /lub międzyprzedsionkowej,
wspólny kanał przedsionkowo-komorowy, podwójne
odejście obydwu naczyń z prawej komory. Stosunkowo rzadko w zespołach wad genetycznych występują
złożone wady serca, takie jak serce jednokomorowe,
zespół hipoplazji lewego serca czy transpozycja dużych
35
2009-11-27 17:01:23
Ryc. 16.Duże naczynia u płodu w śródpiersiu – obraz
prawidłowy u płodu z zespołem Noonan – lewostronny
łuk aorty.
Ryc. 19. Prawidłowy zarys twarzoczaszki u płodu
z Rycin 17 i 18.
Ryc. 20. Niedomykalność czynnościowa, protosystoliczna
do 2,5 m/s zastawki trójdzielnej u płodu z prawidłową
budową serca.
Ryc. 17. Prawostronny łuk aorty u płodu z kariotypem
47 XYY.
Ryc. 21. Niedrożność dwunastnicy.
Ryc. 18. Prawidłowy obraz 4 jam serca u płodu z Ryciny 17.
naczyń. Częściej natomiast w zespołach wad genetycznych spotyka się zespół Fallota czy koarktację aorty.
36
S10023090021.indd 36
Wady serca jako „duże” markery zespołów wad
genetycznych mogą być wykryte już w pierwszym
trymestrze przez lekarzy odpowiedniego przeszkolonych [13]. Nie ma specyficznej wady serca dla danego
zespołu genetycznego. Wada serca może być wykryta
praktycznie w każdym gabinecie USG, ale prawidłowo
zdiagnozowana jedynie w ośrodkach kardiologii prenatalnej typu C lub B, które posiadają doświadczenie
w analizie wad płodu minimum 100 przypadków
rocznie (ośrodki typu C) lub minimum 50 rocznie
(ośrodek typu B).
Poza wadami serca do kardiologicznych markerów
zespołów wad genetycznych zaliczamy: ognisko hiperechogeniczne w prawej lub lewej komorze serca
lub obydwu; wysięk w osierdziu; jednakowy poziom
przyczepu zastawek przedsionkowo-komorowych
(Ryc. 15.). W zespołach genetycznych może występować także prawostronny łuk aorty. Na przykład płodu
z kariotypem 46XYY przy prawidłowym obrazie 4
jam serca zarejestrowano prawostronny łuk aorty,
2009-11-27 17:01:24
W zakresie nerek i układu moczowego: u płodu
w przebiegu zespołów genetycznych można uwidocznić agenezję nerek obustronną lub jednostronną,
ektopię nerki, nerkę podkowiastą, wodonercze jednostronne lub obustronne, nerkę torbielowatą, duże
nerki policystyczne, obustronny lub jednostronny
megaureter, pęcherz moczowy olbrzymi, uroterocole,
czy poszerzoną zastawkę cewki tylnej u płodu płci
męskiej [18]. U płodu płci żeńskiej można uwidocznić powiększoną jamę macicy wypełnioną płynem
w przebiegu hydrometrocolpos.
Ryc. 22. Trudna do jednoznacznej interpretacji płeć płodu
– objaw „tulipana”.
a u płodu z zespołem Nooman prawidłowy, typowy
łuk aorty (Ryc. 16—19). Niedomykalność zastawki
trójdzielnej (TR) przy prawidłowej budowie serca
(NHA) można zarejestrować w pierwszym trymestrze.
Należy nadmienić, iż to samo zjawisko (TR, NHA) w II
połowie ciąży nie ma już takiej wagi diagnostycznej.
Objaw ten występuje stosunkowo często – u 6,8%
płodów w ciąży pojedynczej i u 12% płodów z ciąży
wielopłodowej (Ryc. 20.). Objawem kardiologicznym
zespołu wad genetycznych może być także kardiomegalia płodu [9].
Ważnym elementem badania echokardiograficznego
i genetycznego sonogramu jest ocena grasicy płodu.
Jej hipoplazja współistniejąca z wadą serca (zwłaszcza
dotyczącą opuszki serca, np. w przebiegu wspólnego
pnia tętniczego), może sugerować zespół di Georga
przy prawidłowym kariotypie płodu [8].
W zakresie jamy brzusznej płodu klasycznym markerem zespołów genetycznych, w tym najczęściej zespołu Downa jest niedrożność dwunastnicy (Ryc. 21.).
Znacznie rzadziej u płodów z innymi zespołami
genetycznymi spotyka się niedrożność na niższych
poziomach jelita cienkiego czy grubego lub wyższą
niedrożność – przełyku. U płodu można także znaleźć sonograficzne markery niedrożności smółkowej
(pogrubiałe ściany jelit, podwójnie konturowane, hiperechogeniczne jelita, zwapnienia w obrębie jelit, ślad
wysięku pomiędzy pętlami jelit, pseudotorbiele).
Stosunkowo rzadko u płodu można znaleźć niedrożność odbytu lub chorobę Hirschprunga. W czasie 15
lat i ponad 15000 badań u płodów z podejrzeniem wad
wrodzonych w materiale własnym autorów w ZDiPWW ICZMP w Łodzi zaobserwowano takie pojedyncze przypadki. Znacznie częściej markerem zespołów
wad genetycznych jest wysięk w jamie otrzewnowej.
Objaw ten wymaga różnicowania z niewydolnością
krążenia oraz z infekcją u płodu. Częstym markerem
wad genetycznych jest także przepuklina pępowinowa
(omphalocele), które może niekiedy być trudna do
odróżnienia z gastroschisis, zwłaszcza dla początkujących sonografistów. W zespołach genetycznych
znacznie częściej występuje omphalocele [34].
S10023090021.indd 37
Nieuwidocznienie pęcherza moczowego płodu silnie
sugeruje obecność jego ekstrofii. Nie prawidłowy
obraz budowy miednicy mniejszej płodu może być
spowodowany obecnością kloaki, stosunkowo trudnej
do rozpoznania ze względu na sporadyczne występowanie tej anomalii (w materiale ZDiPWW 1 na 4—5
lat, przy średniej liczbie około 1500 badań rocznie
płodów z podejrzeniem wad wrodzonych).
Płeć płodu
Płeć płodu jest także rozpoznawana w badaniu USG,
tym łatwiej, im płód jest starszy i im większa kieszonka
płynu owodniowego znajduje się w badanej okolicy.
Podobnie jak i u noworodka, u płodu spotykamy
zarówno typową płeć żeńską lub typową płeć męską,
można uwidocznić wodniak jądra, nietypowe prącie
w przypadku spodziectwa, ale także obojnactwo,
częściej określane słowami „płeć płodu trudna do
jednoznacznej interpretacji” (Ryc. 22.).
Inne anomalie
Lista anomalii w zespołach genetycznych płodu nie
ogranicza się w diagnostyce prenatalnej jedynie do
anomalii samego płodu. Bardzo ważne miejsce w diagnostyce prenatalnej zajmuje ocena pępowiny: liczby
naczyń, ich symetrii, przyczepu płodowego, przyczepu
łożyskowego, skrętności pępowiny (np. długa prosta
pępowina częściej występuje w wadach płodu),
położenia pępowiny (chore płody częściej są owinięte
pępowiną). Zarówno u zdrowego, jak i u chorego płodu
może wystąpić węzeł prawdziwy pępowiny. W zespołach wad genetycznych stosunkowo często spotyka się
torbiele pępowiny.
Dzisiejsza diagnostyka ultrasonograficzna –
prenatalna to nie tylko morfologia płodu, ale także
ocena jego fizjologii: przepływu płynu owodniowego
w jamie nosowej, połykanie, ruchy języka, mlaskanie,
„ziewanie”, ruchy gałek ocznych, ruchy przepony, ruchy palców dłoni, ruchy w zakresie kończyn dolnych.
U chorych płodów, w tym prezentujących zespoły
wad genetycznych, obserwuje się zarówno wydłużone
okresu „snu fizjologicznego” jak i nadruchliwość zwykle związaną z wielowodziem. Oceniając nietypowe
ustawienie dłoni i stóp płodu oraz zmniejszoną jego
ruchliwość, opisano nie tak dawno po raz pierwszy
prenatalną diagnostykę zespołu Will-Pradera, pomi-
37
2009-11-27 17:01:25
Tabela 3. Najczęstsze zespoły wad genetycznych rozpoznawanych prenatalnie (ograniczono listę najczęstszych anomalii
z rejestru Zakładu Diagnostyki i Profilaktyki Wad Wrodzonych Instytutu Centrum Zdrowia Matki Polki z lat 1994—2008).
38
S10023090021.indd 38
Nazwa zespołu
Najczęstsze anomalie
Trisomia pary 13 (zespół Patau)
Wada serca
Holoprosencefalia
Anomalie twarzoczaszki
Omfalocele
Hiperechogeniczne nerki
Stopy piętowe
Polidaktylia
Trisomia pary 18 (zespół Edwardsa)
Wada serca
Opóźnienie rozwoju wewnątrzmacicznego
Objaw truskawki
Torbiele splotów naczyniówkowych
Agenezja ciała modzelowatego
Poszerzenie zbiornika wielkiego
Rozszczep wargi i podniebienia
Atrezja przełyku
Przepuklina przeponowa
Nieprawidłowe dłonie i stopy
Trisomia pary 21 (zespół Downa)
Poszerzenie NT,
Brak lub hipoplazja kości nosowej
Wada serca
Wada przewodu pokarmowego
Poszerzenie miedniczek nerkowych
Hiperechogeniczne jelita
Skrócenie kości długich
Przerwa sandałowa
Klinodaktylia
Zespół Turnera (monosmia X), 45, Xo
Torbiel limfatyczna szyi u płodu płci żeńskiej
Wada serca
Wada nerek (np. nerka podkowiasta)
Pływ w jamie otrzewnowej, opłucnej
Obrzęki stóp
Zespół Noonan
(kariotyp płodu prawidłowy)
Torbiel limfatyczna szyi
Obrzek płodu
Wada serca
Zespół Aperta (kariotyp płodu prawidłowy)
Wada OUN: wentrikulomegalia, torbiel pajęczynówki, agenezja ciała modzelowatego
Zarośnięcie szwów czaszkowych
Uwypuklone czoło
Niska nasada nosa
Syndaktylia
Zespół Beckwith-Wiedemanna (kariotyp płodu
prawidłowy)
(kariotyp prawidłowy)
Makrosomia
Duży język
Duże nerki
Omphalocele
Predyspozycja do różnych guzów
Zespół Holta-Orama
(kariotyp prawidłowy)
Wada serca
Anomalia kończyny górnej (od klinodaktylii do fokomelii), najczęściej anomalia kciuka
(brak lub hipoplazja lub trójczłonowy)
Zespół Cornelia de Lange
(kariotyp prawidłowy)
Poszerzenie NT
Anomalie kończyn górnych: klinodaktylia, aplazja lub hipoplazja kości łokciowej
Mikrognathia
Nietypowy profil z prominentną warga górną
Wada serca (14—28%)
Przepuklina przeponowa (rzadko)
IUGR
Zespoł Meckel-Grubera
(kariotyp prawidłowy)
Encefalocele
Nerka policystyczna\
Polidaktylia
Powiększenie obwodu brzucha
Wielowodzie
Zespoł Smith-Lemli-Opitza (SLOS)
(kariotyp prawidłowy)
Poszerzenie NT w pierwszym trymestrze
Wada serca
Wada OUN: mikrocefalia , holoprosencefalia, agenezja ciała modzelowatego
Wada układu moczowo-płciowego: torbiele nerek, obojnactwo
Polidaktylia lub syndaktylia
Opóźnienie rozwoju wewnatrzmaciczinego
VACTERL
Vertebral defects – anomalie kręgów
Anal atresia – atrezja odbytu
Cardiac anomalie – wada serca
Tracheoesophageal fistula – przetoka tchawiczo-przełykowa
Esophageal atresia – atrezja przełyku
Renal anomalies – anomalie nerek
Limb defects – wada kończyn (najczęściej agenezja kości promieniowej)
2009-11-27 17:01:25
Tabela 4. Najczęstsze zespoły genetyczne u płodu, w których
występuje wada serca (z bazy danych Zakładu Diagnostyki
i Profilaktyki Wad Wrodzonych ICZMP & Uniwersytetu
Medycznego w Łodzi).
Nazwa anomalii
Rodzaj najczęstszej
anomalii kardiologicznej
płodu*
Trisomia 13
VSD, HLHS
Trisomia 18
VSD
Trisomia 21
AVC, TOF
XO (Turner S)
CoA
Cornelia di Lange
VSD
Noonan S
VSD, PS
Zespół Beckwith-Wiedemanna
Kardiomegalia
Zespół Smith Lemli Opitza
AVC
Zespół Meckel-Grubera
DORV
Zespół Holt-Oram
VSD
Zespół Aperta
ToF
Zespół Frynsa
VSD
Zespół Wolfa-Firschorn
VSD
Zespół di Georga
Truncus arterio sus, TOF,
PA
Tuberous sclerosis
Rhabdomyoma
CHARGE
DORV, TOF
mo braku ewidentnych anomalii strukturalnych [5].
Coraz częściej w badaniu USG można uwidocznić
anomalie diagnozowane dawniej dopiero na podstawie obrazu klinicznego u dziecka [39]. Pełna ultrasonograficzna diagnostyka prenatalna obejmuje
także ocenę objętości płynu owodniowego oraz ocenę
łożyska: zarówno jego lokalizację, przyczepy brzeżne,
grubość i echogeniczność łożyska. Warto pamiętać, iż
niektóre guzy łożyska mogą przebiegać z objawami
niewydolności krążenia płodu.
Postępowanie
Zebranie co najmniej trzech anomalii sonograficzno-echokardiograficznych upoważnia do wysunięcia
w diagnostyce różnicowej rozpoznania zespołu wad
genetycznych. Jeżeli takie anomalie są dostrzeżone
w I połowie ciąży, zazwyczaj zaleca się konsultację
lekarza genetyka i rozważenie przeprowadzenia amniopunkcji celem ustalenia ostatecznego rozpoznania.
W zależności od postawionego pytania badanie cytogenetyczne może dotyczyć tylko oceny kariotypu
lub może być bardziej szczegółowe, np. w kierunku
zespołu DiGeorga.
Im później w czasie ciąży dostrzeżone są anomalie
w badaniu USG+ECHO, tym decyzja o badaniu cytogenetycznym jest trudniejsza a często przesuwana na
S10023090021.indd 39
okres poporodowy. Według danych z rejestru www.
orpkpp.pl w latach 2004—2008 odsetek ciężarnych
decydujących się na przerwanie ciąży nie przekraczał
5%, co oznacza, iż ponad 90% kobiet decydowało się na
kontynuację ciąży, pomimo stwierdzonego problemu
u płodu.
Prenatalna diagnostyka cytogenetyczna w zespołach wad genetycznych może mieć istotne znaczenie
zwłaszcza w tych trudnych przypadkach kiedy lekarz
neonatolog ma do czynienia z noworodkiem urodzonym w zamartwicy z zespołem wad wrodzonych.
Czy należy w takim przypadku podejmować próbę
resuscytacji z podłączeniem do respiratora, czy należy podjąć terapię konserwatywną i zminimalizować
zabiegi reanimacyjne, pozostawiając jedynie zabiegi
pielęgnacyjne?
Im wcześniejsze wykrycie anomalii, im dłuższy
czas na postawienie precyzyjnej diagnozy prenatalnej
wraz z badaniem cytogenetycznym, tym więcej czasu
przed porodem na zaplanowanie optymalnego postępowania w tych przypadkach. Z drugiej strony izolowane anomalie (np. izolowana wentrikulomegalia,
izolowane zwężenie zastawki aortalnej, jednostronne
wodonercze u płodu, izolowana torbiel jajnika) występujące u „zdrowych genetycznie” płodów zauważone
i zdiagnozowane prenatalnie rokują bardzo dobrze
i mogą być skutecznie leczone już przed porodem
lub bezpośrednio po porodzie. Listę najczęściej występujących zespołów genetycznych diagnozowanych
aktualnie prenatalnie przedstawia Tabela 3.
Warto zwrócić uwagę, iż nie ma anomalii specyficznej dla danego zespołu, ale najczęstszą wadą strukturalną, powtarzającą się w różnych zespołach wad
genetycznych jest wada serca [40]. Przy zastosowaniu
modelu analizy statystycznej wielu cech zmiennych
dla zespołu Downa aktualnie przyjmuje się obecność wady serca oraz poszerzenia NT w pierwszym
trymestrze daje czułość wykrycia zespołu Downa
na poziomie 83,3% przy odsetku wyników fałszywie
dodatnich f 28,5%. Według autorów z Węgier do najczęstszych zespołów wad genetycznych analizowanych
przez nich w latach 1990—2004 (22, 150 kariotypów,
w tym 514 nieprawidłowych) zdiagnozowano: 270
przypadków zespołu Downa, 70 przypadków trisomii
18, 28 przypadków trisomii 13 oraz 69 przypadków
zespołu Turnera. W grupie płodów z trisomią 13 dominowały wady serca, OUN I anomalie twarzoczaszki.
U płodów z trisomią 18 i 21 dominowały wady serca,
u płodów z zespołem Turnera najczęściej spotykano
obrzęk limfatyczny szyi i obrzęki płodu. Spośród
mniejszych anomalii najczęściej torbiele splotów naczyniówkowych występowały w trisomii 18, ogniska
hiperechogeniczne w trisomii 13 i 21. [29].
Również według obserwacji z naszego ośrodka
w zespołach genetycznych dominująca wadą były
wady serca [19, 20]. Według Nyberga conajmiej jedną
anomalię w badaniu USG można uwidocznić u 90%
płodów z trisomią 13, u 80% płodów z trisomią 18
39
2009-11-27 17:01:25
i 50—70% płodów z zespołem Downa [26]. Inne
trisomie, np. pary 9, występują sporadycznie i zwykle
są to anomalie letalne [22]. W prezentowanym materiale na ponad 15000 badań u płodów z anomaliami
przypadek trisomii pary 9 wystąpił jeden raz. Do
rzadkich zespołów genetycznych, możliwych aktualnie do rozpoznania w okresie prenatalnym zaliczyć
trzeba między innymi Poland Syndrome, na który
składają się następujące anomalie: hipoplazja klatki
piersiowej, hipoplazja kończyny górnej oraz kręgi
połówkowe [28].
Podsumowanie
W związku z coraz liczniejszymi markerami zespołów wad genetycznych należy się liczyć z możliwością błędnej interpretacji stwierdzanych anomalii.
Ma to szczególne znacznie w odniesieniu do tzw. soft
markerów, jak również do przypadków, w których po
genetycznym sonogramie stwierdzony jest prawidłowy kariotyp [6]. Coraz więcej autorów skłania się do
tego iż w przypadkach obecności izolowanych soft
markerów, o ile w genetycznym sonogramie i w szczegółowym badaniu echokardiograficznym nie znajduje
się innych anomalii, nie należy się spodziewać u płodu
zespołu wad genetycznych [27, 42]. Płody z licznymi
wadami strukturalnymi zwykle zostają wychwycone
w przesiewowych badaniach ultrasonograficznych.
Problemem natomiast stają się płody z pojedynczymi
wadami a szczególnie wadami trudnymi do zauważenia. Do takich należą najczęściej wady serca, ale także
wady kończyn.
Połączenie obrazowania płodu wraz ze skriningowymi
badaniami biochemicznymi z surowicy ciężarnej mają
na celu wyłonienie z grupy ciężarnych niskiego ryzyka
populacji, u której powinno się zastosować szczegó-
łowe badanie USG genetyczne + echokardiograficzne
oraz badania cytogenetyczne [2, 38]. Są jednak głosy
specjalistów podkreślających rolę genetycznego sonogramu jako najlepszej metody wykrywania wad
wrodzonych [14], a nowe testy biochemiczne mogą
podrażać koszty diagnostyki prenatalnej bez wpływu
na jej efektywność [37]. Czy prawidłowo przeprowadzony genetyczny sonogram i pełna echokardiografia
prenatalna wykluczają ujawnienie się zespołu wad
genetycznych w późniejszym okresie ciąży?
Oczywiście istnieją anomalie i zespoły wad, które
mogą przebiegac skrycie, zarówno w okresie płodowym, jak i wczesno noworodkowym. Do takich wad
można zaliczyć między innymi zespół Noonan [1].
Warto także pamiętać iż o anomaliach rejestrowanych
w prenatalnym badaniu USG lub echo powinni pamiętać nie tylko położnicy i genetycy, ale i neonatolodzy
i pediatrzy. U około 10% dzieci z poszerzeniem NT
w pierwszym trymestrze >3 mm, z prawidłowym
kariotypem, bez odchyleń w okresie noworodkowym,
w późniejszym wieku demonstrowało zaburzenia w
rozwoju psycho-ruchowym [4].
sNa zakończenie warto przypomnieć iż prenatalna
diagnostyka ultrasonograficzna wraz z badaniem
echokardiograficznym odgrywają istotną rolę nie
tylko celem potwierdzenia obecności anomalii wykrytej w skriningowym badaniu USG, ale szczególnie
mogą mieć znaczenie w kolejnej ciąży, kiedy dla
ciężarnej metodami obrazowymi można potwierdzić
prawidłowy rozwój jej kolejnego potomka. Również
w grupie ciężarnych >35. roku życia prawidłowy wynik
„genetycznego sonogramu” w połowie trwania ciąży
przyczynia się do ograniczenia wskazań do wykonywania amniopunkcji genetycznych [30].
Piśmiennictwo
1.
2.
3.
4.
5.
6.
7.
40
S10023090021.indd 40
Achiron R, Heggesh J, Grisaru D, Goldman B, Lipitz S,
Yagel S, Frydman M (2000) Noonan syndrome: a cryptic
condition in early gestation. Am J Med Genet
3;92:159—165
ACOG Committee on Practice Bulletins (2007) ACOG
Practice Bulletin No. 77: screening for fetal chromosomal
abnormalities. Obstet Gynecol 1;109:217—227
Athanasiadis AP, Zafrakas M, Polychronou P, Florentin-Arar L, Papasozomenou P, Norbury G, Bontis JN (2008)
Apert syndrome: the current role of prenatal ultrasound
and genetic analysis in diagnosis and counselling.
Fetal Diagn Ther 4;24:495—498
Baumann C, Delagarde R, Vuillard E, Oury JF (2005)
Long-term follow-up of children with increased nuchal
translucency and normal karyotype. J Gynecol Obstet
Biol Reprod (Paris) 34 (Supl. 1):S97—S102
Bigi N, Faure JM, Coubes C, Puechberty J, Lefort G,
Sarda P, Blanchet P (2008) Prader-Willi syndrome:
is there a recognizable fetal phenotype? Prenat Diagn
9:28:796—799
Bilardo CM, Müller MA, Pajkrt E, Clur SA,
van Zalen MM, Bijlsma EK (2007) Increased nuchal
translucency thickness and normal karyotype: time
for parental reassurance. Ultrasound Obstet Gynecol
1;30:11—18
Bromley B, Benacerraf BR (2003) The Genetic Sonogram
Scoring Index. Semin Perinatol 2;27:124—129
8.
9.
10.
11.
12.
13.
14.
Chaoui R, Kalache KD, Heling KS, Tennstedt C,
Bommer C, Körner H (2002) Absent or hypoplastic
thymus on ultrasound: a marker for deletion 22q11.2
in fetal cardiac defects. Ultrasound Obstet Gynecol
6;20:546—552
Chen CP, Lin SP, Tzen CY, et al. (2007) Prenatal diagnosis
and genetic counseling of mucopolysaccharidosis type II
(Hunter syndrome). Genet Couns 1;18:49—56
Chitkara U, Lee L, Oehlert JW, Bloch DA,
Holbrook RH Jr., El-Sayed YY, Druzin ML (2002)
Fetal ear length measurement: a useful predictor of
aneuploidy? Ultrasound Obstet Gynecol 2;19:131—135
Chitty L (1998) Prenatal screening for chromosome
abnormalities. Br Med Bull 4;54:839—856
Chuangsuwanich T, Sunsaneevithayakul P,
Muangsomboon K, Limwongse C (2005) Ectrodactylyectodermal dysplasia-clefting (EEC) syndrome
presenting with a large nephrogenic cyst, severe
oligohydramnios and hydrops fetalis: a case report and
review of the literature. Prenat Diagn 3;25:210—215
Dane B, Dane C, Sivri D, Kiray M, Cetin A, Yayla M (2007)
Ultrasound screening for fetal major abnormalities at
11—14 weeks. Acta Obstet Gynecol Scand 6;86:666—670
DeVore GR (2003) The role of fetal echocardiography in
genetic sonography. Semin Perinatol 2; 27:160—172
2009-11-27 17:01:25
15. DeVore GR, Romero R (2003) Genetic sonography:
an option for women of advanced maternal age with
negative triple-marker maternal serum screening
results. J Ultrasound Med 11;22:1191—1199
16. Fang YM, Benn P, Egan JF (2008) Use of the genetic
sonogram in the United States in 2001 and 2007.
J Ultrasound Med 11;27:1543—1548
17. Fayol L, Garcia P, Denis D, Philip N, Simeoni U
(2006) Adams-Oliver syndrome associated with cutis
marmorata telangiectatica congenita and congenital
cataract: a case report. Am J Perinatol 3;23:197—200
18. Foryś S, Wilczyński J, Oszukowski P, Respondek-Liberska M (2003) Bilateral renal agenesis at the
Department for Diagnosis and Prophylaxis of Fetal
Malformation at the Institute Polish Mother’s Memorial
Hospital with fetal echocardiography in years
1994—2002. Ginekol Pol 10;74:1083—1087
19. Janiak K, Kaczmarek P, Krasoń A, Nowicki G,
Piotrowicz M, Respondek-Liberska M (2002) The role
of fetal echocardiography in the prenatal diagnosis
of aneuploidy based upon prenatally diagnosed patau
syndrome fetuses (case analysis). Ginekol Pol
7;73:606—612
20. Kaczmarek P, Krasoń A, Janiak K, Nowicki G, Czichos E,
Respondek-Liberska M (2002) The role of fetal
echocardiography and genetic sonography in prenatal
diagnosis of the Edward’s syndrome—analysis of
the thirty case diagnosed at the Department of the
Diagnosis for Fetal Malformations at the Institute
„Polish Mother’s Memorial Hospital”. Ginekol Pol
7;73:600—605
21. Kaczmarek P, Respondek-Liberska M, Borowski D,
Wielgoś M, Czuba B, Oszukowski P (2007) Assessment of
fetal circulation in the late first trimester –preliminary
study. Ginekol Pol 11;78:861—864
22. Kor-Anantakul O, Suwanrath C, Kanngurn S,
Rujirabanjerd S, Suntharasaj T, Pinjaroen S (2006)
Prenatal diagnosis of complete trisomy 9: a case report
and review of the literature. Am J Perinatol
2;23:131—135
23. Leśniewicz R, Sulik M, Midro AT (2005) Microphthalmos
and hypertelorism as diagnostic index in ultrasound
diagnosis of Fraser syndrome. Ginekol Pol
2;76:147—152
24. Mashiach R, Vardimon D, Kaplan B, Shalev J, Meizner I
(2004) Early sonographic detection of recurrent fetal eye
anomalies. Ultrasound Obstet Gynecol 6;24:640—643
25. Nyberg DA (2003) Use of genetic sonography for
adjusting the risk for fetal Down syndrome. Semin
Perinatol 2;27:130—144
26. Nyberg DA, Souter VL (2001) Sonographic markers
of fetal trisomies: second trimester. J Ultrasound Med
6;20:655—674
27. Ouzounian JG, Ludington C, Chan S (2007) Isolated
choroid plexus cyst or echogenic cardiac focus on
prenatal ultrasound: is genetic amniocentesis indicated?
Am J Obstet Gynecol 6;196:595.e1—e3
28. Paladini D, D’Armiento MR, Martinelli P (2004)
Prenatal ultrasound diagnosis of poland syndrome.
Obstet Gynecol 5;2:104:1156—1159
29. Papp C, Szigeti Z, Tóth-Pál E, Hajdú J, Joó JG, Papp Z
(2008) Ultrasonographic findings of fetal aneuploidies
in the second trimester-our experiences. Fetal Diagn
Ther 2;23:105—113
30. Pinette MG, Garrett J, Salvo A, Blackstone J, Pinette SG,
Boutin N, Cartin A (2001) Normal midtrimester (17—
20 weeks) genetic sonogram decreases amniocentesis
rate in a high-risk population. J Ultrasound Med
6;20:639—644
31. Respondek-Liberska M (2008) Rodzaje prenatalnych
badań ultrasonograficznych i echokardiograficznych,
aspekty organizacyjune. Ultrasonografia 8;34:78—86
32. Respondek-Liberska M (2008) Rola prenatalnego
badania kardiologicznego w opiece perinatalnej.
Życie i płodność 4;25—34
33. Respondek-Liberska M, Foryś S, Janiszewska-Skorupa J,
et al. (2008) Diaphragmatic hernia in reference hospital
ICZMP – diagnostic problems and outcome. Ginekol
Pol 1;79:23—30
34. Respondek-Liberska M, Papis A, Oszukowski P,
Krasomski G, Maroszyńska I, Chilarski A, Wilczyński J
(2008) Fetal echocardiography in 83 fetuses with
omphalocele from Dept. for Diagnoses and Prevention
of Fetal Malformations, Research Institute Polish
Mother’s Memorial Hospital, and Medical University
of Lodz, (1999-2006). Ginekol Pol 9;79:602—611
35. Respondek-Liberska M, Szymkiewicz-Dangel J,
Tobota Z, Słodki M (2008) Założenia i wstępne wnioski
Ogólnopolskiego Rejestru Patologii Kardiologicznych
Płodun (www.orpkp.pl). Polski Przegląd Kardiologiczny
2;10:129—135
36. Rypens F, Dubois J, Garel L, Fournet JC, Michaud JL,
Grignon A (2006) Obstetric US: watch the fetal hands.
Radiographics 3;26:811—829
37. Shohat M, Frimer H, Shohat-Levy V, et al. (2003)
Prenatal diagnosis of Down syndrome: ten year
experience in the Israeli population. Am J Med Genet
3;122A:215—222
38. Sieroszewski P, Suzin J, Baś-Budecka E (2004)
Combination of screening tests for fetal abnormalities
in the first and second pregnancy trimesters. Ginekol
Pol 3;75:197—202
39. Urban M, Hartung J (2001) Ultrasonographic and
clinical appearance of a 22-week-old fetus with
Brachmann-de Lange syndrome. Am J Med Genet
1;102:73—75
40. Vergani P, Ghidini A, Weiner S, Locatelli A, Pozzi E,
Biffi A (2008) Risk assessment for Down syndrome
with genetic sonogram in women at risk. Prenat Diagn
12;28:1144—1148
41. Witters I, Moerman P, Fryns JP (2008) Skeletal
dysplasias: 38 prenatal cases. Genet Couns
3;19:267—275
42. Zimmer EZ, Lowenstein L, Bronshtein M, Goldsher D,
Aharon-Peretz J (2007) Clinical significance of isolated
mega cisterna magna. Arch Gynecol Obstet
5;276:487—490
41
S10023090021.indd 41
2009-11-27 17:01:25
S10023090021.indd 42
2009-11-27 17:01:25