Państwowa WyŜsza Szkoła Zawodowa w Tarnowie
Instytut : Matematyczno-Przyrodniczy
Specjalność: Ochrona Środowiska
Damian Niziołek
Badanie fizykochemiczne wód i osadów dennych
rzeki Szwedka na obecność metali cięŜkich
Tarnów 2007
W tym miejscu chciałbym złoŜyć szczególne
wyrazy uznania na ręce dr. M. Kawałka za
poświęcony mi czas oraz cenne wskazówki, które
pomogły mi podczas pisania niniejszej pracy.
2
SPIS TREŚCI:
I. WSTĘP.......................................................................................................................... 5
II. ZAKRES I CEL PRACY............................................................................................. 7
III. CZĘŚĆ TEORETYCZNA ......................................................................................... 8
1. CHARAKTERYSTYKA WODY ....................................................................................... 8
1.1 Woda w środowisku ............................................................................................ 8
1.2 Zanieczyszczenia wód powierzchniowych .......................................................... 9
1.2.1. Zanieczyszczenia komunalne ................................................................... 10
1.2.2. Zanieczyszczenia przemysłowe ................................................................ 10
1.2.3 Zanieczyszczenia powierzchniowe w tym rolnicze................................... 10
1.3 Woda - klasyfikacje i normy.............................................................................. 11
1.3.1 Ramowa Dyrektywa Wodna...................................................................... 12
1.3.2 Rozporządzenie Ministra Środowiska z dnia 11 lutego 2004 r.
[Dz.U.04 Nr.32, poz.284] ................................................................................... 13
1.3.3 Rozporządzenie Ministra Środowiska z dnia 27 listopada 2002 r.
[Dz.U.02 Nr.204, poz.1728] ............................................................................... 14
2. OSADY DENNE.......................................................................................................... 15
2.1 Współczynnik akumulacji.................................................................................. 16
3. METALE CIĘśKIE ...................................................................................................... 17
3.1 Źródła zanieczyszczeń metalami cięŜkimi: ....................................................... 18
3.2 Charakterystyka metali cięŜkich ....................................................................... 18
3.2.1 Kadm.......................................................................................................... 18
3.2.2 Ołów........................................................................................................... 19
3.2.3 Cynk........................................................................................................... 19
3.2.4 Miedź ......................................................................................................... 19
3.2.5 śelazo......................................................................................................... 20
3.2.6 Mangan ...................................................................................................... 20
4. ANALITYCZNE METODY OZNACZANIA METALI W WODACH I OSADACH DENNYCH .... 21
4.1 Klasyczne i spektrofotometryczne metody oznaczania metali .......................... 22
4.1.1 Metody klasyczne ...................................................................................... 22
3.1.1.1 Oznaczanie Ŝelaza............................................................................... 22
4.1.1.2 Oznaczanie miedzi.............................................................................. 23
4.1.1.3.Oznaczanie manganu .......................................................................... 23
3
4.1.1.4 Oznaczanie cynku ............................................................................... 24
4.1.2 Metody spektrofotometryczne ................................................................... 24
4.1.2.1 Oznaczanie Ŝelaza............................................................................... 24
4.1.2.2 Oznaczanie miedzi.............................................................................. 26
4.1.2.3 Oznaczanie ołowiu.............................................................................. 29
4.1.2.4 Oznaczanie manganu .......................................................................... 29
4.1.2.5. Oznaczanie cynku .............................................................................. 31
4.1.2.6. Oznaczanie kadmu............................................................................. 32
4.2 ZARYS SPEKTROSKOPII ........................................................................................... 33
4.3 SPEKTROSKOPIA ATOMOWA (ASA)........................................................................ 34
4.3.1 Spektroskopia atomowa – aparatura i przebieg analiz ................................. 35
IV. CZĘŚĆ DOŚWIADCZALNA ............................................................................... 39
1. CHARAKTERYSTYKA GMINY RYGLICE ..................................................................... 39
2. CHARAKTERYSTYKA ZLEWNI I RZEKI SZWEDKA ...................................................... 40
2.1 Zlewnia.............................................................................................................. 40
2.2 Budowa geologiczna ......................................................................................... 41
2.3 Jakość wody ...................................................................................................... 41
3.2 Opis miejsc poboru próbek ............................................................................... 44
4. POBÓR I PRZYGOTOWANIE PRÓBEK .......................................................................... 49
4.1 Próbki wody ...................................................................................................... 49
4.2 Próbki osadów dennych .................................................................................... 49
5. PRZYGOTOWANIE I PRZEBIEG OZNACZENIA .............................................................. 50
6. ZESTAWIENIE WYNIKÓW .......................................................................................... 51
6.1 Wyniki analizy wody ......................................................................................... 51
6.2 Wyniki analizy osadów dennych ....................................................................... 53
6.3 Współczynniki akumulacji................................................................................. 55
V. WNIOSKI ................................................................................................................. 57
VI. STRESZCZENIE ................................................................................................... 59
VII. LITERATURA...................................................................................................... 60
4
I. WSTĘP
"... woda nie jest produktem handlowym takim jak kaŜdy inny, ale raczej dziedziczonym
dobrem, które musi być chronione, bronione i traktowane jako takie..."
Ramowa Dyrektywa Wodna
Woda – najcenniejsze dobro wszech czasów, rozwijamy się w wodzie,
rodzimy się z wody, wciąŜ nawet w XXI wieku nie potrafimy bez niej Ŝyć. Jej ochrona
i zabezpieczenie przed degradacją wydaje się, więc być oczywistym zjawiskiem, jednak
do nie dawna nie przykładano do niej szczególnej uwagi sądząc jakoby jej zasoby były
do tego stopnia nieograniczone, iŜ człowiek nie jest w stanie zakłócić równowagi jej
ilości i składu. Wzrastająca gęstość zaludnienia, wzrost produkcji przemysłowej,
postępująca degradacja środowiska zasygnalizowały potrzebę zmiany podejścia
w gospodarowaniu tym coraz bardziej poŜądanym medium.
Priorytetowym celem niniejszej pracy licencjackiej była analiza zawartości
metali cięŜkich w wodach i osadach dennych rzeki Szwedka, pośrednio jednak chciałem
zwrócić
uwagę
na
zanieczyszczenia
metalami
cięŜkimi
w
obszarach
poza
przemysłowych. Obszar gminy Ryglice jako słabo przekształcony przez człowieka
stanowi doskonałe pole do badań wpływu lokalnych rozproszonych źródeł
zanieczyszczeń metalami na stan wód, które przypisywane są głównie wielkim
zagłębiom przemysłowym. Wybór rzeki Szwedka do obserwacji podyktowany był jej
dramatycznym
zanieczyszczeniem
odpadami
stałymi
oraz
nieuporządkowaną
gospodarką ściekową w gminie, której konsekwencją jest notoryczne odprowadzanie
ścieków komunalnych bezpośrednio do wód. Zanieczyszczenia metalami na obszarach
wiejskich, wolnych od wpływów przemysłowych, mogą w zauwaŜalny sposób wpływać
na jakość wód powierzchniowych i nie powinny pozostawać zaniedbywane. RównieŜ
z racji nadrzędnego celu Ramowej Dyrektywy Wodnej zakładającej osiągnięcie,
co najmniej dobrego stanu wód do roku 2015. Osiągnięcie tak dobrej jakości wód nie
będzie moŜliwe jednak do zrealizowanie bez podjęcia działań ochronnych
na mniejszych dopływach, których jakość wody niestety często pozostawia jeszcze
wiele do Ŝyczenia. Tereny takie jak ten podjęty w niniejszej pracy potrzebują własnego
z racji swej odrębności, przystosowanego dla nich, programu zapobiegania i ochrony
przed skutkami zanieczyszczeń wód w tym równieŜ metalami cięŜkimi.
5
Spośród szerokiej gamy zanieczyszczeń, dostających się od antropogenie
do wód na szczególną uwagę zasługują metale cięŜkie. Ich stosunkowo niewielkie
ładunki
wprowadzane
do
środowiska
niosą
powaŜne
zagroŜenie
zwłaszcza
ekosystemom wodnym a w następstwie człowiekowi, który nie jest w stanie się od nich
uniezaleŜnić. Niskie stęŜenia metali cięŜkich w środowisku kompensowane są przez ich
bardzo wysoką toksyczność oraz zdolność do bioakumulacji w organizmach Ŝywych
i biomagnifikacji w łańcuchach troficznych. Badania wód i osadów dennych powinny
mieć, więc charakter obligatoryjny, zapewniając rzetelny i aktualny obraz ich jakości
w celu zobrazowania ewentualnego miejsca i źródła zanieczyszczeń, aby dostatecznie
szybko podjąć działania zapobiegawcze a w ostateczności neutralizujące skutki
degradacji. Od 1991 roku systematyczna analiza jakości wód powierzchniowych
prowadzona jest przez Państwowy Monitoring Środowiska powołany ustawowo,
od tego czasu obszar badań stale ulega poszerzeniu obejmując równieŜ mniejsze
poboczne cieki. Nieco inaczej przedstawia się sytuacja z analizą osadów dennych,
chociaŜ od roku 1991 na zlecenie Głównego Inspektora Ochrony Środowiska badania
osadów dennych rzek w systemie krajowym wykonuje Państwowy Instytut Geologiczny
wciąŜ nie istnieją w Polsce, Ŝadne normy, które pozwalałyby monitorować zawartości
metali cięŜkich w sposób ilościowy oraz ująć ich koncentrację definiując ją jako
zanieczyszczenie od antropogeniczne. Jest to wciąŜ otwarty problem, który nie wynika
z braku rozwiązań techniczno – aparaturowych a z ogromnej złoŜoności tego
zagadnienia.
Spośród wielu dostępnych obecnie metod oznaczania metali cięŜkich zarówno
w wodach jak i osadach rzecznych największą popularnością cieszy się spektroskopia.
Cała rodzina metod analizy instrumentalnej obejmująca oddziaływanie energii fal
elektromagnetycznych z materią. Chemia analityczna w początkach XXI w.
w analizie środowiskowej odchodzi niemal zupełnie od klasycznych oznaczeń
sprowadzając je raczej do roli edukacyjnej, korzystając przy tym z metod
instrumentalnych, bardzo często powaŜnie zaawansowanych aparaturowo. Metod,
pozwalających na dokonywanie oznaczeń o znacznie większej precyzji, dokładności
przy jednoczesnym skróceniu czasu trwania analizy.
6
II. ZAKRES I CEL PRACY
Celem niniejszej pracy było przeprowadzenie analizy fizykochemicznej wód oraz
osadów dennych rzeki Szwedka lewego dopływu Białej pod kątem zawartości metali
cięŜkich. Oznaczeniu poddano: ołów, kadm, miedź, cynk, Ŝelazo, oraz mangan. Przy
wykonywaniu oznaczeń zastosowano metodę atomowej spektroskopii absorpcyjnej.
Uzyskane wyniki stanowiły podstawę do określona jakość wody w oparciu o polskie
ustawodawstwo, tj. rozporządzenie ministra środowiska z dnia 27 listopada 2002 r.
w sprawie klasyfikacji dla prezentowania stanu wód powierzchniowych i podziemnych,
sposobu prowadzenia monitoringu oraz sposobu interpretacji wyników i prezentacji
stanu tych wód. Oraz o rozporządzenie ministra środowiska z dnia 11 lutego 2004 r.
w
sprawie
wymagań,
jakim
powinny
odpowiadać
wody
powierzchniowe
wykorzystywane do zaopatrzenia ludności w wodę przeznaczoną do spoŜycia.
7
III. CZĘŚĆ TEORETYCZNA
1. Charakterystyka wody
1.1 Woda w środowisku
Woda, dla kaŜdego z nas związek chemiczny wodoru i tlenu - H2O. Efektem jej
unikatowej struktury jest oddziaływanie cząsteczek ze sobą na zasadzie kompensacji
ładunku, tworzone są mostki wodorowe i dlatego cząsteczki są silnie ze sobą związane.
Dzięki tym połączeniom woda nie wrze w -100°C a w 100°C, największą gęstość
osiąga w temperaturze 3,8°C, ma podwyŜszone ciepło parowania, w stanie stałym
wykazuje mniejszą gęstość niŜ w stanie ciekłym, posiada takŜe jedno z najwyŜszych
ciepło właściwe [1]. Te właściwości nadają wodzie unikatowy charakter i sprawiają,
iŜ w warunkach ziemskich nie posiada substytutu, który byłby w stanie zastąpić
ją sprawując jednocześnie wszystkie jej Ŝyciodajne role. W praktyce w środowisku
woda w stanie czystym nie istnieje, jest to roztwór o bardzo róŜnorodnym składzie
chemicznym, którego skład zaleŜy od budowy geologicznej zlewni, warunków
klimatycznych, antropopresji, świata organicznego, pokrywy glebowej itp. Jest
to unikatowa substancja, która w warunkach ziemskich temperatur posiada moŜliwość
zmiany stanów skupienia a dodatkowo zasilana energią słoneczną podlega obiegowi.
KrąŜenie to jest moŜliwe dzięki parowaniu, konwekcji, skraplaniu i ma strategiczne
znaczenie w transporcie wody z nad oceanów nad kontynenty, skąd wraca jako spływ
podziemny i powierzchniowy do oceanu by cykl mógł zostać domknięty [2]. Woda
wchodzi w skład przyrody nieoŜywionej i oŜywionej a więc jest składową biotopu
i biocenozy w środowisku występuje w trzech stanach skupienia: pary wodnej, cieczy
i stałym [3]. Szacuje się, Ŝe zasoby wody na Ziemi to 1 388⋅106 km3 wody. Z czego
aŜ 97,2% to woda zawarta w oceanach i w morzach a zatem woda słona. W lądolodach
zgromadzone jest 2,1% ogólnych zasobów wody na ziemi, zaś 0,6% to wody
podziemne. Niewielkie ilości wody w porównaniu z wymienionymi powyŜej znajdują
się w rzekach, jedynie 0,0001% oraz w atmosferze 0,001%. Całkowita ilość wody
na ziemi pozostaje stała, następuje tylko zmiana jej stanu skupienia, formy i miejsca jej
występowania [4].
8
Tabela 1
Zasoby wody na Ziemi
Forma występowania
Oceany i morza
Lądolody i lodowce
Wody podziemne i glebowe
Powierzchniowe wody lądowe
Wilgoć atmosferyczna
Wody w biosferze
Razem
Zasoby w km3
1 350 000 000
29 400 000
8 400 000
232 300
13 000
600
1 388 115 600
Zasoby w %
97,2
2,1
0,6
0,02
0,001
0,00004
100,0
Polska naleŜy do krajów o jednym z najniŜszych wskaźników zasobności
w wodę. Na jednego mieszkańca przypada 1600 m3 wody na osobę na rok, podczas
gdy w krajach UE wskaźnik ten kształtuje się na poziomie czterokrotnie wyŜszym
ok. 4600m3 na osobę na rok. Zasoby wodne Polski cechuje duŜa zmienność sezonowa
i nierównomierność rozmieszczenia terytorialnego, częste są teŜ okresowe fluktuacje:
powodzie i posuchy. Opady roczne na obszarze Polski wahają się w granicach od 630
do 670 mm/rok w latach 1995-2004. Odpowiada to objętości wody rzędu 200-210
km3/rok. Odpływy wody jest doskonałym wskaźnikiem informującym ile wody
po społu ze środowiskiem jest w dyspozycji człowieka. Odpływ z obszaru Polski
w latach 1995-2004 wynosi 58,8 km3/rok, co przeliczając na 1 mieszkańca daje
zaledwie: 1600-1900 m3 wody na rok, w powiecie tarnowskim jest jeszcze niŜszy
i wynosi 1500 m3/rok [5].
1.2 Zanieczyszczenia wód powierzchniowych
Przez zanieczyszczenie wód naleŜy rozumieć niekorzystne zmiany właściwości:
fizycznych, chemicznych i bakteriologicznych wody spowodowane wprowadzaniem
w nadmiarze substancji nieorganicznych, organicznych, radioaktywnych jak równieŜ
energii, które ograniczają lub uniemoŜliwiają wykorzystywanie wody do picia i celów
gospodarczych [6]. Źródła zanieczyszczeń cieków przybierają formy: punktowych,
liniowych i obszarowych. Podział ten uwzględnia sposób, w jaki zanieczyszczenia
dostają się do rzek. Źródła punktowe to takie, w których obciąŜenie zanieczyszczeniami
odbywa się w jednym miejscu (zrzuty ścieków). Źródła liniowe zanieczyszczają ciek
9
wzdłuŜ pewnej linii (drogi). Źródła powierzchniowe zanieczyszczają środowisko,
w tym ciek na duŜym obszarze (pola uprawne o intensywnej produkcji
z wykorzystaniem nawozów mineralnych i chemicznych środków ochrony roślin) [2].
Najczęstszym sposobem zanieczyszczania wód powierzchniowych są zrzuty
ścieków, czyli substancji płynnych odprowadzanych bezpośrednio lub z pomocą
kanalizacji do wód lub do ziemi. Nie występują ścieki o takich samych właściwościach
fizyko – chemicznych jednak moŜna wydzielić zasadnicze trzy grupy tych form
zanieczyszczeń [2].
1.2.1. Zanieczyszczenia komunalne
Są to ścieki związane z bytowaniem człowieka, około 99% masy tych ścieków
stanowi woda. Jest nośnikiem odpadów z gospodarstw domowych, fekaliów, odpadów
ze szpitali, łaźni, pralni. Znaczną ich część stanowią występujące w postaci zawiesiny
lub rozpuszczone związki organiczne, głównie białka, tłuszcze i węglowodany.
Nie oczyszczone ścieki tego typu stanowią główne źródło substancji biogennych
i odpowiedzialne są za skaŜenia mikrobiologiczne [2].
1.2.2. Zanieczyszczenia przemysłowe
Powstają podczas wielu czynności wykonywanych w róŜnorakich procesach
produkcyjnych. Ich skład jest bardzo zróŜnicowany i zasadniczo zaleŜy od rodzaju
produkcji przemysłowej. W ich składzie dominują: chemikalia, metale, odpady
organiczne oraz rozpuszczalniki, ścieki tego typu są nad wyraz niebezpieczne dla
ekosystemów wodnych, gdyŜ mogą wprowadzać zanieczyszczenia toksyczne zarówno
w stęŜeniach letalnych, jaki i w niŜszych ulegających kumulacji w lokalnym
środowisku a w następstwie w organizmach [2,7].
1.2.3 Zanieczyszczenia powierzchniowe w tym rolnicze
Na ich powstawanie wpływ mają środki ochrony roślin w tym pestycydy
metaloorganiczne, zanieczyszczone nawozy mineralne, środki suszące i konserwujące,
odpady z hodowli zwierząt, kompost i obornik. Nadmierne ilości spływając z wodami
opadowymi lub gruntowymi do wód stanowią źródło związków biogennych bądź
toksyn dla wraŜliwych gatunków roślin i zwierząt, co w efekcie prowadzi do zakłócenia
równowagi ekologicznej [2,7].
10
W związku z szeregiem róŜnorodnych zanieczyszczeń wprowadzanych do wód,
naraŜone są one na: eutrofizację, acidofizację, alkalizację i skaŜenia metalami cięŜkimi
w tym środkami fitotoksycznymi.
Eutrofizacja jest procesem swoistego uŜyźniania wód rzecznych bądź jeziornych
pierwiastkami biogennymi: fosforem i azotem. Jest to zjawisko wybitnie niekorzystne
dla jakości wody oraz ekosystemów wodnych. Wzrost stęŜenia przyswajalnych form
azotu i fosforu powoduje spotęgowany przyrost biomasy a przez jej obumieranie
prowadzi
do
pogorszenia
warunków
tlenowych,
zanieczyszczenia
toksynami
od roślinnymi oraz ogranicza dostęp światła w głąb cieku wymusza przez
to zahamowanie fotosyntezy i pogłębia deficyty tlenu w wodzie.
Acidofizacja jest zakwaszeniem wód, przyjmuje charakter naturalny, częściej
antropogeniczny. Podniesienie stęŜeń jonów wodorowych oddziałuje destrukcyjnie
na środowisko Ŝywe a dodatkowo uruchamia metale cięŜkie wiązane w kompleksach
organicznych i mineralnych osadów dennych.
Alkalizacja to podniesienie w wodach stęŜenia jonów hydroksylowych,
degradacja
występująca
rzadziej,
niemniej
jednak
groźna
dla
biocenoz
wodno – błotnych, w przeciwieństwie do acidofizacji nie uaktywnia jednak metali
cięŜkich zaadsorbowanych w osadach rzecznych.
Zanieczyszczenia
metalami
cięŜkimi
dotyczą
zasadniczo
regionów
przemysłowych, zawartość metali moŜe przyjmować stęŜenia toksyczne i działać
natychmiastowo, ale teŜ chronicznie pozwalając na kumulację w organizmach Ŝywych
[2].
1.3 Woda - klasyfikacje i normy
Woda, którą aktualnie wykorzystujemy lub mamy na celu uŜytkować powinna się
odznaczać ściśle określonymi cechami. Wymagania, jakie stawiamy wodzie zaleŜą
od jej przeznaczenia i najwyŜsze odnoszą się do wody przeznaczonej do celów
zaopatrzenia w wodę do spoŜycia. Odpowiednio niŜszym wymogom podlega woda
przeznaczona do wykorzystania na cele rolnicze czy produkcyjne. Jakość wody a przez
to jej przydatność dla danego zastosowania charakteryzuje się przez określenie jej
aktualnego stanu biologicznego, fizycznego i chemicznego [2]. W Polsce od 2001 roku
obowiązują normy przetransponowane z prawa unijnego, klasyfikacji dokonuje się
11
w zaleŜności od celów, do których ewentualnie woda mogłaby zostać wykorzystana.
W prawie polskim normy jakości wody uściślone są w Ustawie „Prawo Wodne”
z 18 lipca 2001 r. w postaci dwóch rozporządzeń:
− Rozporządzenie Ministra Środowiska z dnia 11 lutego 2004 r. w sprawie
klasyfikacji dla prezentowania stanu wód powierzchniowych i podziemnych,
sposobu prowadzenia monitoringu oraz sposobu interpretacji wyników
i prezentacji stanu tych wód. [Dz.U.Nr.32, poz.284] [9]
− Rozporządzenie Ministra Środowiska z dnia 27 listopada 2002 r. w sprawie
wymagań, jakim powinny odpowiadać wody powierzchniowe wykorzystywane
do zaopatrzenia ludności w wodę przeznaczoną do spoŜycia. [Dz.U.Nr.204,
poz.1728] [10]
W niniejszej pracy przedstawiono dwa akty prawne odnoszące się
bezpośrednio do stanu środowiska jednak naleŜy pamiętać, Ŝe w ustawodawstwie
polskim funkcjonuje jeszcze szereg innych regulacji, determinujących inne aspekty
stanu wód, jak chociaŜby Rozporządzenie Ministra Zdrowia w sprawie jakości wody
przeznaczonej do spoŜycia dnia 19 listopada 2002 r.
1.3.1 Ramowa Dyrektywa Wodna
Ustawa „Prawo Wodne” z 2001 roku jest odpowiedzią na zalecenia UE, które
realizowane są zgodnie z Ramową Dyrektywą Wodną (RDW) we wszystkich krajach
wspólnoty od grudnia 2000 roku. RDW jest zintegrowanym aktem prawnym,
regulującym i uspójniającym przepisy prawne dotyczące gospodarki wodnej,
we wszystkich krajach wspólnoty. Podstawowym zadaniem RDW jest zapewnienie
obecnym i przyszłym pokoleniom dostępu do dobrej jakości wody oraz umoŜliwienie
korzystania z wody na potrzeby m.in. przemysłu i rolnictwa, przy jednoczesnym
zachowaniu i ochronie środowiska naturalnego. Nadrzędnym celem Ramowej
Dyrektywy Wodnej jest osiągnięcie dobrego stanu wód na terenie całej Unii
Europejskiej do roku 2015 [9].
12
1.3.2 Rozporządzenie Ministra Środowiska z dnia 11 lutego 2004 r.
[Dz.U.04 Nr.32, poz.284]
Rozporządzenie Ministra Środowiska z dnia 11 lutego 2004 r. jest
to klasyfikacja, która pojawiła się do zastosowania w celach monitoringu stanu jakości
wód powierzchniowych i podziemnych. Jest to pięciostopniowa skala definiująca
poszczególne klasy jakości wody, na jej podstawie opiera się Państwowy Monitoring
Środowiska [9].
Tabela 2
Zestawienie analizowanych wskaźników jakości wody, klasy I - V
Wskaźnik
jakości wody
Cynk
Miedź
Mangan
śelazo
Kadm
Ołów
Wartości graniczne w klasach I – V (mg/dm3)
I
II
III
IV
V
0,3
0,5
1
2
>2
0,02
0,04
0,06
0,1
>0,1
0,05
0,1
0,5
1,0
>1,0
0,1
0,3
1,0
2,0
>2,0
0,0005
0,001
0,001
0,005
>0,005
0,01
0,01
0,02
0,05
>0,05
Do tego rozporządzenia odnosi się równieŜ Ramowa Dyrektywa Wodna, gdyŜ
to ono definiuje dobry stan wód, który stanowi priorytet dyrektywy europejskiej oraz
jeden z celów średniookresowych „Polityki ekologicznej państwa” do roku 2010 [5].
Rozporządzenie dzieli wody powierzchniowe do następujących klas czystości:
− Klasa I – wody bardzo dobrej jakości - zalicza się wody spełniają wymagania
określone dla wód powierzchniowych wykorzystywanych do zaopatrzenia
ludności w wodę przeznaczoną do spoŜycia, w przypadku ich uzdatniania
sposobem właściwym dla kategorii A1. Wskaźniki jakości wody nie wykazują
na wpływ oddziaływania antropogenicznego.
− Klasa II – wody dobrej jakości – spełniają w odniesieniu do większości
wskaźników jakości wody wymagania określone dla wód powierzchniowych
przeznaczonych do wykorzystania do zaopatrzenia ludności w wodę
przeznaczoną do spoŜycia jednak po wcześniejszym uzdatnianiu sposobem
właściwym dla kategorii A2. W wartościach wskaźników biologicznych pojawia
się niewielki wpływ oddziaływań antropogenicznych.
13
− Klasa III – to wody zadowalającej jakości – wody w tej klasie spełniają
wymagania
określone
dla
wód
powierzchniowych
wykorzystywanych
do zaopatrzenia ludności w wodę do spoŜycia w przypadku, gdy zostaną
poddane sposobem uzdatniania właściwym dla kategorii A2. Wartości
wskaźników biologicznych jakości wody wskazują na umiarkowany wpływ
oddziaływań antropogenicznych.
− Klasa IV – wody niezadowalającej jakości – są to wody nie spełniające
wymagań
określonych
dla
wód
powierzchniowych
wykorzystywanych
do zaopatrzenia ludności w wodę przeznaczoną do spoŜycia, w przypadku
uzdatniania sposobem odpowiednim dla kategorii A3. Wartości wskaźników
biologicznych
jakości
wody
wskazują
na
skutek
oddziaływań
antropogenicznych, pojawiają się zmiany ilościowe i jakościowe w populacjach
biologicznych.
− Klasa V – wody złej jakości – pozostałe wody nie spełniające wymagań dla wód
powierzchniowych wykorzystywanych do zaopatrzenia ludności w wodę
przeznaczoną do spoŜycia. Wartości wskaźników biologicznych wykazują,
na skutek oddziaływań antropogenicznych, powaŜne zmiany polegające
na zaniku występowania znacznej części populacji biologicznych
PowyŜsze rozporządzenie nie jest aktualne, straciło moc prawną z dniem 01.01.2005
roku. Jako, Ŝe do tej pory nie ukazał się Ŝaden nowy zastępujący je akt prawny
klasyfikację prowadzi się nadal w oparciu o to rozporządzenie [10].
1.3.3 Rozporządzenie Ministra Środowiska z dnia 27 listopada 2002 r.
[Dz.U.02 Nr.204, poz.1728]
Klasyfikacja stanu wód w Polsce zgodnie z rozporządzeniem Ministra Środowiska
z dnia 27 listopada 2002 roku. Akt prawny wyróŜnia trzy kategorie jakości wód, podział
ze względu na moŜliwości zastosowania wód do róŜnorodnych celów.
Wymienione zostały:
− kategoria A1, zalicza się tu wody wymagające prostego uzdatniania fizycznego,
w szczególności filtracji i dezynfekcji
14
− kategoria A2, są to wody wymagające typowego uzdatniania zarówno
fizycznego jak i chemicznego w szczególności: utleniania, koagulacji, flokulacji,
dekantacji, filtracji, dezynfekcji (przez chlorowanie końcowe).
− kategoria A3, woda wymagająca wysokosprawnego uzdatniania fizycznego
i chemicznego w tym: utleniania, koagulacji, dekantacji, filtracji, adsorpcji
na węglu aktywnym i dezynfekcji ( przez chlorowanie lub ozonowanie) [11].
Tabela 3
Zestawienie analizowanych wskaźników jakości wody, kategorie A1 – A3
Wskaźnik
jakości
wody
Cynk
Miedź
Mangan
śelazo
Kadm
Ołów
*
Wartości graniczne w kategoriach A1- A3 (mg/dm3)
A1
*
A2
A3
1
0,5
0,02
2
3,0
0,05
1
1,0
0,05
2
5,0
0,05
1
1,0
0,1
2
5,0
0,5
0,05
0,1
0,001
-
0,05
0,3
0,005
0,05
0,1
1,0
0,001
-
0,1
2,0
0,005
0,05
1,0
1,0
0,001
-
1,0
2,0
0,005
0,05
1 – zalecane; 2 – dopuszczane
2. Osady denne
Osady denne są integralnym elementem ekosystemów wodnych i stanowią
granicę kontaktu wód powierzchniowych z materią skalną zlewni. Ich morfologia
zaleŜy zasadniczo od budowy i charakteru geologicznego podłoŜa oraz od intensyfikacji
procesów erozyjnych zachodzących w korycie. Skład chemiczny osadów dennych jest
wypadkową ich pochodzenia geologicznego oraz chemizmu wód, z którymi pozostaje
w nieustannym kontakcie. Osady rzeczne są miejscem depozycji róŜnych związków
chemicznych, w tym metali cięŜkich. Pod wpływem czynników naturalnych (powodzi)
lub antropogenicznych (budowy konstrukcji wodnych, zakwaszenia wód), osady
zawierające substancje toksyczne mogą przekształcić się w potencjalne źródła
zanieczyszczeń, szczególnie niebezpiecznych dla organizmów wodnych. Skład
geochemiczny osadów gromadzących się na dnie rzek i zbiorników wodnych jest
bardzo dobrym wskaźnikiem jakości wód powierzchniowych, a zwłaszcza zawartości
metali cięŜkich, które w aluwiach występują w znacznie wyŜszych stęŜeniach niŜ
w wodzie. Analiza chemiczna osadów umoŜliwia wykrywanie zmian stęŜeń tych metali
15
w środowisku, nawet
przy stosunkowo niskiej ich zawartości w wodach
powierzchniowych. Od roku 1991 na zlecenie Głównego Inspektora Ochrony
Środowiska badania osadów dennych rzek i jezior w systemie krajowym wykonuje
Państwowy Instytut Geologiczny. Jednak brak jest w Polsce prawnie obowiązujących
kryteriów oceny jakości osadów dennych a w badaniach i ocenie stęŜeń zanieczyszczeń
osadów uwzględnia się kryteria tła geochemicznego, czyli naturalną zawartość
pierwiastków występujących w osadach nie zanieczyszczonych. Określenie przy
obecnym stanie środowiska zawartości metali cięŜkich, które moŜna byłoby uznać
za tło jest kłopotliwe z racji powszechnego zanieczyszczenia: tarasów aluwialnych,
koryt rzecznych, wreszcie samych osadów. Proponuje się, aby za punkt odniesienia
przyjąć osady z głębokich warstw aluwialnych, które zgromadzone zostały przez rzekę
w okresie przed industrialnym. Natomiast w przypadku mniejszych cieków zwłaszcza
pogórza przyjąć za punkt odniesienia wartości z początkowego biegu rzeki, gdzie rzeki
często wykazują jeszcze charakter naturalny [6].
2.1 Współczynnik akumulacji
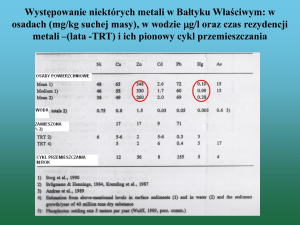
Metale cięŜkie podobnie jak wiele innych związków rozpuszczonych w wodach
powierzchniowych akumulują się w osadach dennych, dzieje się to za sprawą wielu
róŜnorodnych procesów fizycznych i chemicznych. Za najistotniejsze uwaŜane są:
wytrącanie metali z roztworu w postaci trudno rozpuszczalnych soli, adsorpcja fizyczna
i chemiczna, wiązanie w kompleksach organicznych i mineralnych budujących osad.
Podatność metali cięŜkich na wiązanie się z osadami rzecznymi, chociaŜ zaleŜy
od charakteru danego metalu ściśle nie określa jego podatności na zatrzymywanie
w osadzie, oczywiście są metale takie jak cynk i ołów, które wykazują zwiększoną
podatność na akumulację oraz te, które ulegają jej w mniejszym stopniu np. kadm
i miedź. Jednak sam proces zatrzymywania metali na osadzie dennym jest wypadkową
wielu czynników zewnętrznych w tym: morfologii koryta, granulometrii osadu,
odczynu wody, organicznych ilości zawartości związków organicznych będących
składową osadu, oraz obecności i stęŜenia innych jonów. Badania koncentracji metali
cięŜkich w poszczególnych frakcjach osadów wskazują, iŜ największe ich ilości
koncentrują się w frakcjach o silnym rozdrobnieniu.
16
Liczbowe ujęcie podatności metali cięŜkich na zatrzymywanie w osadzie dennym
umoŜliwia zastosowanie współczynnika akumulacji:
K=
CMo
CMw
gdzie: C Mo – stęŜenie metalu w osadzie dennym, mg/kg s.m.;
C MW – stęŜenie metalu w wodzie, mg/dm3
Współczynnik akumulacji jest, więc stosunkiem zawartości metalu w osadzie
dennym wyraŜonym w mg/kg suchej masy osadu do stęŜenia metalu w wodzie,
wyraŜonego w mg/dm3 [6].
3. Metale cięŜkie
Jednoznacznej definicji metali cięŜkich nie ma, przyjmuje się, Ŝe są to metale,
których gęstość jest większa od 6 g/cm3 [7], zaś według innych źródeł to metale,
których liczba atomowa jest wyŜsza od 20 z pominięciem metali ziem rzadkich
aktynowców i lantanowców [2]. W wodzie powierzchniowej metale występują
najczęściej w formie jonowej, ale teŜ w postaci róŜnorodnych kompleksów. StęŜenia
metali w wodach rzecznych są relatywnie niskie jednak są to często stęŜenia toksyczne
dla organizmów w tym dla człowieka. Do metali nazywanych mianem „cięŜkich”
zaliczane są zarówno absolutnie niezbędne mikroelementy jak: Fe, Mn, Zn, Cu ale teŜ
ksenobiotyki: Pb i Cd powodujące zatruwanie organizmu i szereg powikłań [7].
Metale cięŜkie jako pierwiastki nie podlegają rozkładowi natomiast ulegają
bioakumulacji w organizmach oraz biomagnifikacji w kolejnych ogniwach łańcucha
troficznego. Są to zjawiska wybitnie niekorzystne i groźne gdyŜ w ich konsekwencji
stęŜenia metali w organizmach mogą wielokrotnie przekraczać stęŜenia notowane w
środowisku. W ten sposób niewielkie stęŜenia w naturze, stają się po długookresowej
biologicznej koncentracji silnie toksyczne. Niebezpieczeństwo to polega głównie na
dezintegracji przez kation metalu delikatnej struktury białka do tego stopnia, iŜ
przestaje
ono
spełniać
swoją
dotychczasową
biofilną
funkcję
(najczęściej
enzymatyczną). Mechanizm ten polega na podstawianiu się kationu metalu w miejsce
centra aktywnego enzymu, co prowadzi do jego zablokowania lub nieodwracalnej
przebudowy
i
stałej
dezaktywacji.
Zaburzenie
bądź
wyłączenie
szlaków
enzymatycznych w organizmie prowadzi do jego dysfunkcji te zaś ostatecznie kończyć
mogą się śmiercią. Obawy związane ze szkodliwością metali cięŜkich mogą potęgować
17
informacje dowodzące, iŜ skutki ich działania nie są natychmiastowe, ujawniają się po
wielu latach, pokoleniach jak równieŜ fakt, Ŝe nie są w pełni poznane [8].
3.1 Źródła zanieczyszczeń metalami cięŜkimi:
Zasadniczo źródła metalami cięŜkimi moŜemy podzielić na:
− źródła naturalne
− źródła antropogeniczne
Metale cięŜkie w warunkach naturalnych występują w środowisku w śladowych
ilościach, to teŜ często nazywa się je „pierwiastkami śladowymi”. Drogą naturalną
dostają się do środowiska na skutek erupcji wulkanicznych lub wietrzenia minerałów
skalnych. Cała gama metali cięŜkich dostaje się do środowiska w bezpośredniej
konsekwencji działań człowieka, za sprawą:
− górnictwa rud metali
− elektroniki
− rolnictwa
− przemysłu chemicznego
− spalania paliw kopalnych
− produkcji farb i pigmentów
− przemysłu metalowego
− usuwania odpadów [7].
3.2 Charakterystyka metali cięŜkich
3.2.1 Kadm
W warunkach naturalnych w wodach powierzchniowych nie występuje,
w przyrodzie pojawia się w koncentracjach bardzo rozproszonych w swoich minerałach
CdS i CdCO3. Podlega intensywnej kumulacji na minerałach ilastych, zwłaszcza grupy
illitu. Przy niskim pH i w warunkach utleniających przechodzi w formy łatwo migrujące
[12]. Pojawia się w ciekach odwadniających obszary przemysłowe, dostaje się
do środowiska z zakładów metalurgicznych, farbiarskich i tworzyw sztucznych.
Niewielkie ilości mogą dostawać się do wód przy stosowaniu nawozów fosforanowych,
oraz z dróg szybkiego ruchu [13]. NaleŜy do trucizn kumulatywnych, gromadzi się
głównie w nerkach i kościach ssaków. Po przekroczeniu dawki progowej moŜe
powodować uszkodzenie nerek, anemię, zaburzenia równowagi jonowej potasu i
magnezu we krwi, chorobę nadciśnieniową. Powoduje teŜ odwapnienie kości
prowadzące do złamań i pęknięć. W łańcuchu troficznym ulega silnej biomagnifikacji,
18
wielokrotnie przekraczającej stęŜenia w wodach, dawka śmiertelna kadmu jest
najniŜsza ze wszystkich metali cięŜkich [7].
3.2.2 Ołów
W warunkach naturalnych w wodach płynących pojawia się nad wyraz rzadko,
w naturze występuje w postaci galeny (PbS), podobnie jak kadm migruje w środowisku
dość trudno jednak przy zakwaszeniu poniŜej 6 pH przechodzi w formę Pb2+, i staje się
bardzo mobilny zwłaszcza w wodach miękkich [12]. Zanieczyszczenia ołowiem,
powodowane są najczęściej za sprawą górnictwa, produkcją barwników, preparatów
ochrony roślin, metalurgii. Źródłem zanieczyszczenia jest produkcja benzyn
wysokooktanowych i akumulatorów [12,13]. Ołów jest silną neurotoksyną, ulegająca
akumulacji w organizmie, zatrucie ołowiem początkowo przebiega przez fazę utajoną.
Z upływem czasu dochodzi do inhibicji hemu, prowadzące do silnej anemii,
uszkodzenia nerek. Jako neurotoksyna powodować moŜe obrzęk mózgu, stanowi
przyczynę zaburzeń enzymatycznych i psychosomatycznych. Ołów podejrzewany jest
o właściwości kancerogenne [7].
3.2.3 Cynk
W środowisku występuje w minerałach zawierających siarczki, w wodach
dobrze rozpuszczalny najczęściej w formie Zn2+, łatwo ulega migracji przy kwaśnym
odczynie wody, słabiej transportowany w środowisku obojętnym i alkalicznym [12].
W odróŜnieniu do poprzednich metali w niskich stęŜeniach niezbędny budujący
enzymy, odpowiedzialny za tworzenie witaminy A [7]. Niedobór cynku moŜe
przejawiać się zaburzeniami układu kostnego, chorobami skóry, zaburzeniami
płodności. ChociaŜ cynk pełni rolę mikroelementu to w wodzie do picia nie jest
poŜądany gdyŜ w stęŜeniach wyŜszych niŜ 5 mg/dm3 powoduje mętnienie wody
i nadaje jej metaliczny posmak [13]. W wodach powierzchniowych podwyŜszona
zawartość cynku jest konsekwencją zrzutów ścieków z zakładów metalurgicznych oraz
przemysłu chemicznego [7].
3.2.4 Miedź
Miedź jest pierwiastkiem szeroko rozpowszechnionym w przyrodzie jednak
w niewielkich ilościach. W wodach powierzchniowych występuje bardzo rzadko.
Najczęściej w postaci Cu2+, takŜe w kompleksach z cyjnakami i kwasami organicznymi.
19
W postaci nierozpuszczalnej występuje w związkach z węglanami, siarczkami
i w formie wodorotlenków [12]. Miedź jest mikroelementem niezbędnym dla
organizmu, nie ulega akumulacji w organizmie, dlatego nie stanowi dla organizmu
zagroŜenia [13]. Zalecana dawka dobowa dla człowieka to 2 mg Cu, w większych
ilościach związki miedzi są szkodliwe, mogą powodować wymioty, a w stanach
chronicznych uszkodzenia wątroby [7]. ObciąŜenie środowiska tym metalem pochodzi
głównie z metalurgii, w mniejszych ilościach z korodujących elementów miedzianych.
Przy stęŜeniu 1 mg/dm3 nadaje wodzie gorzki smak [7,14].
3.2.5 śelazo
Występuje w środowisku znacznie częściej niŜ omawiane pierwiastki, Ŝelazo
jest
jednym
z
wiodących
pierwiastków
wchodzących
w
skład
minerałów
skałotwórczych. W wodach powierzchniowych pochodzi z ługowania minerałów
skałotwórczych, ścieków przemysłowych, z wód kopalnianych oraz korozji elementów
stalowych. W wodach występuje w postaci jonowej jako Fe2+ i Fe3+ lub w formie
koloidalnej [12]. W wodach dobrze natlenionych praktycznie nie występuje, gdyŜ
utlenia się do formy trójwartościowej i wypada z roztworu w postaci osadu. Nie stanowi
powaŜnego zagroŜenia dla zdrowia, podwyŜszone stęŜenia tego pierwiastka (0,5
mg/dm3) pogarszają właściwości organoleptyczne wody i są niewskazane w wielu
gałęziach przemysłu [13].
3.2.6 Mangan
W wodach powierzchniowych występuje często w parze z Ŝelazem. Zachowuje
się analogicznie do Ŝelaza, utlenia się wypadając z roztworu przy dobrym natlenieniu
wody, jego ilości są znacznie niŜsze, średnio 10 – krotnie niŜsze niŜ Ŝelaza. Pochodzi
z ługowania minerałów, z gleby, z resztek roślinnych i zanieczyszczeń przemysłowych
[13]. Występuje w wodach na trzech stopniach utlenienia: Mn(II), Mn(III), Mn(IV).
Najpowszechniejszą formą jest Mn(II) w tej postaci głównie zachodzi jego migracja,
forma trójdodatnia jest formą przejściową, natomiast czterododatnia łatwo wydziela się
z wody jako MnO2, który wypada z roztworu tworząc stabilne fazy manganonośne [12].
Przy stęŜeniu 0,1 mg/litr powoduje powstawanie brunatnych plam przy praniu bielizny
i zacieków na urządzeniach sanitarnych. ToteŜ limitowanie jego ilości jest podyktowane
głównie względami gospodarczymi nie zaś zdrowotnymi, nie dowiedziono jakoby
mangan zawarty w wodzie oddziaływał szkodliwie na organizm człowieka [13].
20
4. Analityczne metody oznaczania metali w wodach i osadach dennych
Obecna ilościowa analiza chemiczna odchodząc niemal zupełnie od klasycznych
oznaczeń opiera się na szeregu metod instrumentalnych, zapewniających duŜo większą
powtarzalność oznaczeń oraz dokładność i precyzyjność dokonywanych pomiarów
z jednoczesnym skróceniem czasu analizy próbki [14,15].
Do
prowadzenia
oznaczeń
metali
wykorzystuje
się
następujące
metody
instrumentalne:
− spektroskopowe
-
oddziaływanie
promieniowania
elektromagnetycznego
o róŜnej częstości drgań z materią.
− chromatograficzne - rozdzielanie mieszanin substancji w układzie faz oraz
oznaczanie rozdzielonych składników dowolną metodą.
− elektrochemiczne - efekty towarzyszące przepływowi prądu przez badany
roztwór lub efekty spowodowane reakcjami elektrod zanurzonych w roztworze
− radiometryczne - efekty naturalnej lub sztucznej promieniotwórczości oraz
efekty współdziałania promieniowania jonizującego z próbką [15].
Metody spektroskopowe opierają się na analizie i interpretacji oddziaływania
promieniowania elektromagnetycznego z materią w wszystkich jej formach.
Spektroskopia z łac., spectrum - widmo i z gr. skopien - oglądam, jest nauką zajmującą
się analizą i interpretacją widm, w tym spektroskopia atomowa widm atomowych.
Widma zaś są bezpośrednim i mierzalnym wynikiem oddziaływania energii z materią.
Oddziaływanie to w przypadku spektroskopii sprowadza się głównie do obserwacji
i analizy pochłaniania lub emisji energii w postaci fali elektromagnetycznej przez
interesujący analizatora fragment materii, w przypadku spektroskopii atomowej są nimi
pojedyncze atomy [15].
NajwaŜniejsze gałęzie spektroskopii to:
− spektroskopia UV-VIS, metoda dotycząca widm powstających w zakresie
nadfioletu (UV z ang. ultra violet) i promieniowania widzialnego (VIS z ang.
visible), zakresem badań są widma elektronowe.
21
− spektrofluorymetria, oparta na zjawiskach fluorescencji i fosforescencji , emisji
promieniowania przez cząsteczki w stanie wzbudzonym przechodzące do stanu
podstawowego
− spektrofotometria w podczerwieni (IR z ang. infrared), wykorzystuje absorpcję
promieniowania podczerwonego przez oscylujące cząsteczki.
− laserowa spektroskopia ramanowska, odnosząca się do zjawiska rozpraszania
promieniowania elektromagnetycznego, na cząsteczkach
− spektroskopia magnetycznego rezonansu jądrowego (NMR z ang. nuclear
magnetic resonance spectroscopy), dotyczy oddziaływania promieniowania
elektromagnetycznego o częstości radiowej z jądrami atomowymi w
jednorodnym polu elektromagnetycznym
− spektroskopia atomowa (AAS z ang. atomic absorption spectroscopy), dziedzina
wykorzystująca ilościowe zaleŜności między przejściami elektronowymi a
oddziałującą na nie energią [15].
4.1 Klasyczne i spektrofotometryczne metody oznaczania metali
4.1.1 Metody klasyczne
Współczesna analiza chemiczna rzadko korzysta z tych metod, na korzyść metod
instrumentalnych, które zapewniają zdecydowanie większą dokładność oraz szybkość
oznaczeń [13].
3.1.1.1 Oznaczanie Ŝelaza
Metoda Reinhardta – Zimmermanna, przy jej zastosowaniu do oznaczenia Ŝelaza
stosowany jest nadmanganian potasu (KMnO4). W środowisku kwasu siarkowego(VI)
manganian(VII) utlenia jony Ŝelaza(II) do Ŝelaza(III) według równania:
MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
Mieszanina Zimermmermanna – Reinhardta składa się z kwasu siarkowego(VI), kwasu
fosforowego oraz siarczanu manganu. Kwas siarkowy(VI) zapewnia prawidłowy
przebieg oznaczenia, kwas fosforowy wiąŜe utlenione Ŝelazo w bezbarwne kompleksy
a przy tym obniŜa potencjał utleniający okładu Fe(III)/Fe(II), a więc zwiększa zdolność
redukującą jonów Fe2+. Kompleksowanie jonów Ŝelaza(III) przez kwas fosforowy,
dodatkowo nie pozwala na powstawanie chlorkowych kompleksów Ŝelaza(III), które
22
barwiąc roztwór na Ŝółto przeszkadzałyby w obserwacji punktu końcowego
miareczkowania. Aby zapobiec utlenianiu jonów chlorkowych przez manganian dodaje
się jonów manganu najczęściej w postaci MnSO4 ich obecność obniŜa potencjał
utleniający nadmanganianu. Aby oznaczyć Ŝelazo naleŜy je przeprowadzić do postaci
dwuwartościowej w tym celu redukuje się je za pomocą SnCl2, dodaje się go aŜ do
odbarwienia się roztworu. Aby pozbyć się nadmiaru reduktora Sn(II) naleŜy dodać
niewielką ilość HgCl2. NaleŜy to robić ostroŜnie, aby do roztworu nie wprowadzić
nadmiaru chlorku rtęci(II), gdyŜ spowoduje to wytrącenie szarego zawierającego rtęć
metaliczną osadu, który w tej postaci mógłby redukować jony manganianowe(VII)
[16].
Cu2+ + I- → CuI + I
I2 + 2S2O32- → 2I + S4O62Reakcja równoległa:
CuI + SCN- → CuSCN + I2Cu(SCN)2 + 2Na2S2O3→ 2CuSCN + 2NaSCN + Na2S4O6
4.1.1.2 Oznaczanie miedzi
Metodę jodometryczną z zastosowaniem jodku potasu (KI) stosuje się rzadko
aczkolwiek jest ona bardzo pomocna do oznaczania duŜych zawartości miedzi
w zakresie 2 – 20 mg w próbce. Miedź(II) w środowisku kwaśnym, przy pH około 4
wydziela jod z jodku potasu, redukując się przy tym do jonów miedzi(I) w postaci
trudno rozpuszczalnego jodku miedzi(I). RównowaŜną ilość wydzielonego jodu
oznacza się przez zmiareczkowanie tiosiarczanem sodu (Na2S2O3). Powstawanie
wolnego jodu przyspiesza się za pomocą rodanków jednak wchodzą one z miedzią
w reakcję i naleŜy je następnie oznaczyć dodatkowo za pomocą miareczkowania
tiosiarczanem sodowym [13,16].
4.1.1.3.Oznaczanie manganu
Manganometryczne oznaczanie manganu według Volharda opiera się na reakcji
utleniania jonów manganu(II) manganianem(VII) w środowisku obojętnym, według
reakcji:
2MnO4- + 3Mn2+ + 2H2O → 5MnO2(↓) +4H+
23
Miareczkowanie prowadzi się na gorąco wprowadzając do roztworu zawiesinę tlenku
cynku zapobiegając w ten sposób adsorpcji jonów manganu(II) na uwodnionym
dwutlenku manganu [16].
4.1.1.4 Oznaczanie cynku
Miareczkowanie roztworem K4[Fe(CN)6] jest metodą strąceniową, której
podstawą jest tworzenie się w kwaśnym środowisku trudno rozpuszczalnego
Ŝelazocyjanku cynku i potasu zgodnie z równaniem reakcji:
2Fe(CN)64- +3Zn2+ + 2K+ → Zn3K2[Fe(CN)6]2 (↓)
Koniec miareczkowania rozpoznaje się za pomocą azotanu uranylu lub częściej
difenyloaminy. Kropla miareczkowanego roztworu dodana do umieszczonej na płytce
porcelanowej bądź bibule kropli wskaźnika, powoduje brunatne odbarwienie roztworu,
jeśli w miareczkowanym roztworze jest juŜ nadmiar jonów Ŝelazocyjankowych [16].
4.1.2 Metody spektrofotometryczne
4.1.2.1 Oznaczanie Ŝelaza
a. Metoda z 1,10-fenantroliną i 2,2’-bipirydylem
2+
N
N
N
N
1,10-fenantrolina
N
Fe
N
N
N
N
N
2,2'-bipirydyl
kompleks fenantroliny z Ŝelazem (II)
Najbardziej rozpowszechniona metoda oznaczania Ŝelaza. Przy zastosowaniu
obu odczynników analizę przeprowadza się w środowisku kwaśnym do obojętnego przy
pH 2 – 7. Metoda polega na redukcji Ŝelaza(III) do Ŝelaza(II) najczęściej za pomocą
chlorowodorku
z
hydroksyloaminy
odczynnikiem
(NH2OH⋅HCl),
kompleksującym,
w
po
przypadku
czym
zachodzi
fenantroliny
reakcja
otrzymujemy
pomarańczow-oczerwone a w przypadku bipirydylu róŜowe zabarwienie roztworu
24
[12,16]. Metodą tą moŜemy oznaczać Ŝelazo w stęŜeniach mieszczących się w zakresie
0,001–0,1 mg w próbce. Z racji swojej konfiguracji elektronowej Ŝelazo posiada liczbę
koordynacyjną 6, zarówno fenantrolina jak i bipirydyl łącząc się wiązaniem
koordynacyjnym, uwspólniają z metalem po dwa elektrony z jednego ligandu i powstaje
trwały barwny kompleks. Zarazem bipirydyl jak i fenantrolina pełnią w kompleksie rolę
ligandów dwukleszczowych, związków, które zawierają w swojej budowie dwa atomy
wiąŜące atom centralny (Ŝelazo) poprzez dwuelektronowe wiązanie kowalencyjne [17].
b. Metoda rodankowa
Fe2+ + SCN- → [Fe(SCN)]2+
Fe2+ + 2SCN- → Fe(SCN2)+
Najstarszą metodą jest zastosowanie do
oznaczania rodanków, metoda obecnie jednak
rzadko stosowana gdyŜ oznaczenie jest bardzo
podatne na metale przeszkadzające. śelazo(II) utleniane jest do Ŝelaza(III), po czym
reaguje ono z tiocyjanianem potasu (KSCN) bądź z tiocyjanianem amonu (NH4SCN)
tworząc czerwony kompleks, o intensywności zabarwienia proporcjonalnej od stęŜenia
metalu, powstają kompleksy [Fe(SCN)]2+ oraz Fe(SCN2)+. Połączenia kompleksowe
Ŝelaza z rodankami są nietrwałe i juŜ po 30 min. obserwowane jest osłabienie
zabarwienia, za sprawą redukcji Ŝelaza(III) do Ŝelaza(II) [13,17].
c. Metoda batofenantrolinowa
N
N
betofenantrolina
Batofenantrolina jest pochodną 1,10-fenantroliny, do której zostały przyłączone
dwie grupy fenylowe, podobnie jak fenantrolina zachowuje się tworząc kompleks
z Ŝelazem(II). Metoda ta jest, dwukrotnie dokładniejsza niŜ metoda z fenantroliną, przy
czym
aby
dokonać
spektrofotometrycznego
oznaczenia
naleŜy
wcześniej
wyekstrahować jej kompleks z Ŝelazem do fazy organicznej, aby zapobiec rozkładaniu
się kompleksu [17].
25
d. Metoda sulfosalicylowa
OH
SO3H
COOH
kwas sulfosalicylowy
Jest to metoda, w której kwas sulfosalicylowy tworzy z Ŝelazem(III) fiołkowy
kompleks. Wygodna przy oznaczaniu Ŝelaza(III) obok Ŝelaza(II), w sytuacji, gdy
chcemy oznaczyć całkowitą zawartość Ŝelaza przeprowadzić je do formy utlenionej.
Przy stosowaniu tej metody naleŜy pamiętać o utrzymaniu pH w zakresie 2 - 7 oraz
o wyeliminowaniu interferentów miedzi i manganu [17].
4.1.2.2 Oznaczanie miedzi
a. Metoda ditizonowa
N
NH
N
NH
N
N
N
N
S
Cu
kompleks ditizonu z miedzią (II)
ditizon
SH
Miedź jest metalem, który posiada właściwości chromoforowe, dlatego moŜna
stosować do jej oznaczania odczynniki barwne oraz bezbarwne. Najpopularniejsza
a zarazem najbardziej czuła jest metoda z zastosowaniem ditizonu. Jego dodatek
do kwaśnego roztworu zawierającego miedź(II) powoduje powstawanie fiołkowego
kompleksu. Przed oznaczeniem naleŜy przeprowadzić kompleks do fazy organicznej
[13,17].
26
b. Metody kuproinowe
N
N
N
kuproina (2,2'-dwuchinolil)
+
N
N
H3C
CH3
neokuproina
(2,9-dimetylo-1,10-fenantrolina)
N
H3C
CH3
Cu
H3C
CH3
N
N
N
H3C
kompleks neokuproiny z miedzią (I)
N
CH3
batokuproina
(4,7-difenylo-2,9-dimetylo-1,10-fenantrolina)
W tej rodzinie metod wykorzystuje się pochodne 2,2’-bipirydylu i 1,10fenantroliny, które posiadają w swojej budowie specyficzne ugrupowanie atomów,
umoŜliwiające wiązanie jonów miedzi. Stosowane są najczęściej kuproina, neokuproina
i batokuproina wszystkie charakteryzują się podobnym mechanizmem reakcji
kompleksowania [13,17]. Kuproina tworzy z roztworami miedzi(I) przy pH 4 – 7
czerwony kompleks, w którym stosunek miedzi do kuproiny wynosi 1:2. Miedź
w wodach najczęściej występuje na drugim stopniu utlenienia, dlatego przed dodaniem
odczynnika kompleksującego naleŜy ją zredukować, najczęściej do tego celu stosowana
jest hydroksyloamina [17].
c. Metoda kuprizonowa
N
HN
O
N
NH
O kuprizon
27
Metoda z zastosowaniem kuprizonu wykorzystuje chromoforowe właściwości
miedzi, sam odczynnik jest bezbarwny jednak w połączeniu z jonami miedzi(I) nadaje
roztworowi niebieskie zabarwienie. Oznaczenie przeprowadza się w środowisku
alkalicznym przy ściśle określonym pH, wyŜszym od 6,5, w niŜszym kompleksy nie
powstają i do pH 12 w wyŜszym zabarwienie blednie [17].
d. Metoda z dietyloditiokarbaminianem ( DDTK)
Na
S
S
C
2
S
S
+ Cu2+
S
C
Cu
C
N
N
(C2H5) 2
(C2H5)2
+
S + 2Na
HN
(C2H5)2
dietylodikarbaminian sodu
Metoda kolorymetryczna pozwala na oznaczanie wysokich stęŜeń miedzi na
poziomie 0,01 - 0,2 mg.Jony Cu2+ reagują w środowisku kwaśnym przy pH ok. 8,5
z DDTK dając Ŝółtobrązowe zabarwienie roztworu. DDTK nie jest jednak
odczynnikiem
specyficznym
dla
jonów
miedzi,
aby wyeliminować
związki
przeszkadzające i zapewnić jego specyficzność naleŜy roztwór zadać wersanianem
dwusodu. Związana miedź jest następnie ekstrahowana do warstwy chloroformu
i oznaczana [17].
e. Metoda pirydylazorezorcynolu (PAR)
OH
N
N
N
OH
4-(2-pirydyloazo)rezolcynol (PAR)
Do oznaczenia miedzi w środowisku wodnym moŜliwe jest zastosowanie PAR
4-(2-pirydyloazo)-rezorcynolu, jest to N – heterocykliczny odczynnik azowy, który
w środowisku kwaśnym tworzy z miedzią kompleksy barwiąc roztwór na czerwono.
PAR tworzy z miedzią połączenia kompleksowe w stosunku 1:1 [17].
28
4.1.2.3 Oznaczanie ołowiu
a. Metoda dtizonowa
Metoda ta wymaga ekstrakcji kompleksów ołowiowych do fazy organicznej,
w przypadku ditizonu korzystamy z czterochlorku węgla (CCl4), do którego
przeprowadzamy ditizonian ołowiowy (PbHDz)2. Reakcję prowadzi się w środowisku
obojętnym lub lekko alkalicznym przy pH 7 – 10, kompleksy są trwałe jednak nie
naleŜy ich eksponować na światło słoneczne. Mechanizm reakcji jest analogiczny
do kompleksowania miedzi. Metoda nadaje się do zastosowania przy stęŜeniu
0,002 – 0,1 mg Pb/dm3 [13,17].
b. Metoda pirydylazorezarcyny (PAR)
4-(2-pirydyloazo)rezorcyna reaguje z ołowiem w roztworach alkalicznych przy pH
około 10 dając czerwony chelat co stanowi podstawę tego oznaczenia. Kompleks
ołowiu z odczynnikiem kompleksującym pozostaje w proporcji Pb : PAR = 1 : 1 i jest
stabilny. Metoda ta wymaga dodatku 10-krotnie większej ilości odczynnika w stosunku
do Pb oraz zamaskowania jonów przeszkadzających, głównie Ag, Cd, Cu, Co, Zn, Ni
i Hg [16].
4.1.2.4 Oznaczanie manganu
a. Metoda manganianowa
Najstarszą a zarazem najczęściej stosowaną metodą oznaczania manganu jest
metoda wykorzystująca barwną postać jonów tetraoksomanganianowych MnO4-. Polega
ona na utlenieniu jonów manganu Mn2+ w środowisku kwaśnym do jonów
manganianowych(VII) charakteryzujących się fioletowym zabarwieniem [12]. Reakcje
przebiegają zgodnie z równaniami:
2Mn2+ + 5S2O82- + 8H2O → 2MnO4- + 10SO42- + 16H+
2Mn2+ + 5IO4- + 3H2O → 2MnO4- + 5IO3- + 6H+
Jako
utleniacz
stosuje
się
tutaj
peroksodisiarczan(VI)
sodu
(Na2S2O8),
peroksodisiarczan(VI) diamonu ((NH4)2S2O8), lub rzadziej jodan potasu KIO4, przy
uŜyciu pierwszego naleŜy zapewnić dodatek katalizatora w postaci jonów srebrowych
oraz związać chlorki za pomocą siarczanu(VI) rtęci(II) HgSO4, który powoduje ich
wytrącanie [17].
29
b. Metoda formaldoksymowa
H
OH
C
N
H
formaldoksym
Gdy w analizowanym roztworze znajduje się mangan oraz formaldoksym, wówczas
po zalkalizowaniu go amoniakiem bądź wodorotlenkiem sodu, powstanie początkowo
bezbarwny kompleks, który po czasie utlenia się tlenem z powietrza i przyjmuje
brunatnoczerwoną barwę. Jeśli w próbce znajduje się mangan w postaci MnO4- lub
zawiesiny
to
MnO2aq
początkowo
mangan
ulega
redukującemu
działaniu
formaldoksymu do drugiego stopnia utlenienia, po tym przechodzi jednak w barwny
kompleks. [17].
c. Metoda pirydyloazonaftolu
N
N
N
HO
1-(2-pirydylazo)-2-naftol (PAN)
Zastosowanie 1-(2-pirydylazo)-2-naftolu (PAN) sprawia, Ŝe jest to bardzo czuła
metoda, PAN reaguje w środowisku alkalicznym przy pH 8-10 z manganem na drugim
stopniu utlenienia, tworząc fiołkowe kompleksy. Sam odczynnik jednak słabo
rozpuszcza się w fazie wodnej podobnie jego kompleksy, dlatego ekstrahuje się go za
pomocą czterochlorku węgla lub benzenu do fazy organicznej, w której to dokonuje się
oznaczenia. Stosując tą metodę naleŜy pamiętać, aby mangan znajdował się w postaci
zredukowanej, dlatego do roztworu dodaje się hydroksyloaminę, aby utrzymać jego
stopień utlenienia i zapewnić powtarzalność pomiarów [17].
30
4.1.2.5. Oznaczanie cynku
a. Metoda ditizononowa
Metoda ta naleŜy do najczulszych w spektroskopowym oznaczaniu metali,
wykorzystujemy ditizon, który naleŜy ekstrahować z roztworu wodnego do fazy
organicznej najczęściej przy uŜyciu tetrachlorku węgla. Optymalne środowisko
do prowadzenia reakcji kompleksowania charakteryzuje się szerokim zakresem i mieści
się w pH 4-11, przeprowadzony kompleks ditizonianu cynku do fazy organicznej
zmienia swoje zabarwienie z zielonego na róŜowe, które jest podstawą oznaczenia
spektrofotometrycznego [13]. Ditizon jest odczynnikiem stosowanym, jak juŜ
wcześniej wspomniano, do oznaczania ołowiu, dlatego aby móc zastosować go
do oznaczania cynku naleŜy pozostałe metale cięŜkie zamaskować, stosuje się do tego
celu bardzo wydajne tiosiarczany ale takŜe tiomocznik i inne tworzące trwałe
kompleksy. Przy odpowiednim dobrze pH i odczynnika maskującego moŜna uznać
metodę ditizonową za specyficzną wobec cynku [18].
b. Metoda pirydyloazonaftolu (PAN)
1-(2-pirydylazo)-2-naftol tworzy z jonami cynku przy pH 5-11 wewnętrzny, chelat,
który stanowi podstawę oznaczenia spektrofotometrycznego. Sam odczynnik, jak juŜ
wspomniano przy oznaczaniu manganu, jest dobrze rozpuszczalny w odczynnikach nie
polarnych i wykazuje własne słabe jasnoŜółte zabarwienie nie przeszkadzające jednak
przy oznaczaniu. Tworzy wewnętrzne chelaty z cynkiem, które ekstrahuje się
do środowiska nie polarnego gdzie poddaje się je oznaczeniu [17].
c. Metoda cynkonowa
OH
OH
O
O
N
S
N
N
C
NH
HO
O
2-karboksy-2'-hydroksy-5'-sulfoformazylobenzen CYNKON
31
Cynkon
(2-karboksy-2’-hydroksy-5’-sulfoformazylobenzen)
jest
znanym
odczynnikiem proponowanym do oznaczania cynku. W słabo alkalicznym środowisku
przy pH około 9, jony cynku w reakcji z cynkonem tworzą niebieski kompleks. Jednak
metoda ma swoje wady, oznaczeniu przeszkadzają liczne metale, co powoduje,
Ŝe naleŜy ekstrahować cynk do fazy organicznej i tu poddawać go dalszym zabiegom
prowadzącym do oznaczenia jego stęŜenia. J. Dojlido mając na uwadze szerokie
wiązanie cynkonu z metalami cięŜkimi proponuje związać je w kompleksy cyjankowe
dodając KCN [17].
4.1.2.6. Oznaczanie kadmu
a. Metoda ditizonowa
Metoda ditizonowa jest wiodącym sposobem na oznaczanie kadmu w wodzie,
ditizon jednak stosuje się do oznaczania jeszcze kilku innych metali. Dlatego naleŜy
stworzyć takie warunki, w których odczynnik ten byłby jak najbardziej podatny
do tworzenia kompleksów tylko z kadmem. Jony kadmu w środowisku silnie
alkalicznym reagują z ditizonem dając związek o zabarwieniu róŜowym do czerwonego,
który moŜe być następnie ekstrahowany chloroformem. W oznaczeniu nie
przeszkadzają jony innych metali w stęŜeniach normalnie występujących w wodzie
[13,17].
b. Metoda 5-Br-PADAP
Br
N
N
N
HO
5-Br-PADAP
5-Br-PADAP,
N(C2H5)2
czyli
2-(5-bromo-2-pirydylazo)-5-dietyloaminofenol
przy
pH
w zakresie 9-11 tworzy z jonami kadmu intensywnie zabarwiony kompleks, który
stanowi podstawę czułej metody oznaczania kadmu. Kompleks wykazuje duŜą trwałość
w roztworze mieszanym (woda + rozpuszczalnik polarny), nawet do 1 godziny.
Odczynnik powinien wprowadzony być do roztworu w nadmiarze około 3-krotnym
[17].
32
4.2 Zarys spektroskopii
Podstawy dzisiejszej spektroskopii atomowej sięgają początków XIX wieku,
kiedy to niezaleŜnie obok siebie Wollaston i Fraunhofer odkryli w ciągłym widmie
światła słonecznego ciemne linie, które nie bez kozery nazwano później widmami
Fraunhofera. Jednak dopiero w latach 1861-1869 Kirhoff i Bunsen badając zachowanie
par soli chlorku sodowego w płomieniu palnika wyjaśnili istotę odkrytego przez
poprzedników zjawiska. Doświadczenia te pozwoliły na sformułowanie kilku bardzo
istotnych wniosków, mianowicie: stwierdzono, iŜ źródłem promieniowania są wolne
atomy nie zaś ich związki (spektroskopia atomowa). SpostrzeŜono teŜ, Ŝe owe wolne
atomy są zdolne do absorpcji promieniowania jednak tylko przy długości fali, przy
których same je emitują. Oraz co miało później stanowić podstawę metod
spektroskopowych, obserwacja, iŜ otrzymywane linie widmowe są charakterystyczne
tylko dla danego rodzaju atomów. Ostatnie z twierdzeń stało się podstawą analizy
jakościowej w oparci o ASA [18]. Zanim jednak Kirhoff wyjaśnił znaczenie widm
atomowych swoje prace juŜ duŜo wcześniej prowadził August Beer, w drugiej połowie
XVII wieku dostrzegł on, iŜ wiązka promieniowania przenikając przez kuwetę
z roztworem stopniowo wygasza się pokonując kolejne warstwy, sformułował I prawo
absorpcji [19]. W 1729 roku Pierre Bouguer powiązał zaleŜnością absorpcję
promieniowania z grubością warstwy roztworu, zwanej teŜ długością drogi optycznej
wiązki, spostrzeŜenie to uzyskało jednak dopiero w 1760 roku ścisłą matematyczną
formułę za sprawą J.H. Lamberta.
W ten sposób sformułowane zostało II prawo absorpcji (prawo Lamberta – Beera):
A = log
Gdzie:
I0
= a ⋅b⋅c
I
I0 – natęŜenie promieniowanie padającego na ośrodek absorbujący
I – natęŜenie promieniowania przechodzącego przez ośrodek absorbujący
a – współczynnik absorpcji
b – grubość warstwy absorbującej
c – stęŜenie analitu [20]
Nieco później, bo w 1859 roku August Beer podał zaleŜność absorbancji
od stęŜenia substancji w roztworze, a Walter 37 lat później uznał grubość warstwy
roztworu i stęŜenie za dwie róŜne wielkości, od, których absorbancja zaleŜy
33
w jednakowy sposób, w ten sposób określone zostało III prawo absorpcji [19]. Dalsze
koleje spektroskopii to lata 1955 rok, kiedy Alan Walsh znalazł zastosowanie
analityczne dla atomowej spektroskopii absorpcyjnej wprowadzając teŜ jako pierwszy
lampę HCL. Od tego czasu jesteśmy świadkami ciągłego rozwoju metody,
ze szczególnym naciskiem na elementy związane z atomizacją próbki oraz z detekcją
promieniowania [18].
4.3 Spektroskopia atomowa (ASA)
Budowa atomu oferuje elektronom mnogość poziomów energetycznych,
co warunkuje wiele moŜliwości przejść elektronowych. Przejście elektronowe zachodzi
podczas wzbudzenia atomu i moŜe być powodowane za sprawą ogrzewania, reakcji
chemicznej bądź absorpcji promieniowania. W zakresie UV-VIS przejściom ulegają
tylko elektrony walencyjne [19].
Rys. 1
Schemat przejść elektronowych i związany z nim transfer energii
Elektron moŜe przejść z jednego stanu energetycznego w drugi jednak
w kaŜdym przypadku ma to związek z emisją lub absorpcją kwantu promieniowania.
Aby zaszło przeniesienie elektronu na wyŜszy poziom wzbudzenia elektron musi
pochłonąć energię o wartości równej róŜnicy energetycznej pomiędzy stanem
podstawowym a stanem wzbudzonym, na który ma się udać. Przejście elektronu moŜna
opisać równaniem:
∆E = EP − EW = h ⋅ν =
h⋅c
ν
Gdzie: EP - energia stanu podstawowego
34
EW -energia stanu wzbudzonego
h - stała Plancka [6.67⋅10-34 J⋅s]
c- prędkość światła [2,99⋅108 m/s]
ν- częstotliwość padającego promieniowania [20]
Wówczas w zaleŜności od zaabsorbowanej energii elektron zostaje przeniesiony
na dany stan wzbudzony charakteryzujący się pochłoniętą energią. Elektrony dąŜą
w atomie do osiągnięcia minimum energetycznego a mogą je osiągnąć znajdując się
tylko na poziomach trwałych, z których nie wypromieniowują energii, są to orbity
znajdujące się najbliŜej jądra. Wszystkie stany energetyczne z wyjątkiem tego jednego
o najniŜszej energii są nietrwałe, dlatego elektron przebywa w nich ok. 10-8 s, poczym
wraca do stanu podstawowego, emitując przy tym kwant promieniowania o takiej samej
długości fali, fazie, polaryzacji, oraz kierunku rozchodzenia się fali, jaką zaabsorbował.
Zjawisko to nosi nazwę spontanicznej emisji promieniowania. NajniŜszy poziom
wzbudzony, na który moŜe udać się elektron nosi nazwę poziomu rezonansowego
a odpowiadająca mu linia spektralna zwana jest linią rezonansową [18]. Elektron moŜe
zostać poddany oddziaływaniu wyŜszej energii a to sprawia, Ŝe moŜe on zostać
przeniesiony na wyŜsze poziomy i tym samym obserwujemy większą liczbę linii
spektralnych w widmie. Przejścia absorpcyjno-emisyjne dla atomów o niskich liczbach
atomowych są stosunkowo proste w interpretacji gdyŜ dotyczą niewielkiej liczby
elektronów sytuacja jednak o wiele bardziej się komplikuje, jeśli obserwujemy widma
pierwiastków d-elektronowych. Dlatego teŜ do celów analitycznych zasadnicze
znaczenie w spektroskopii ma odpowiedni dobór linii widmowej w oparciu, o którą
dokonujemy analizy tak, aby nie pokrywały się z liniami widmowymi innych
pierwiastków [19].
4.3.1 Spektroskopia atomowa – aparatura i przebieg analiz
Metoda atomowej spektroskopii absorpcyjnej (ASA) bazuje na zjawisku
pochłaniania promieniowania elektromagnetycznego, kaŜde z przejść charakteryzuje się
specyficzną porcją energii niezbędnej do jego zajścia, dlatego dostarczanie ściśle
określonej ilości energii w postaci fali elektromagnetycznej składnikom próbki
powoduje jej selektywne pochłanianie. Absorpcja jest proporcjonalna do zawartości
atomów znajdujących się w próbce, co przekłada się na stęŜenie oznaczanego
35
pierwiastka [20]. Aby móc przeprowadzić próbkę do roztworu w zaleŜności od jej
charakteru naleŜy ją poddać specjalnej obróbce przez roztwarzanie, mineralizację bądź
rozpuszczanie. Próbki wody są duŜo prostsze w oznaczaniu gdyŜ rzadko wymagają
wcześniejszego przygotowania. W skład układu do atomowej spektroskopii emisyjnej
wchodzą:
− nebulizer
− palnik
− źródło promieniowania monochromatycznego
− monochromator
− detektor
− wzmacniacz
− urządzenie rejestrujące [15]
Rys. 2
Schemat ideowy spektofotometru do atomowej spektroskopii absorpcyjnej (ASA).
Analizy najczęściej przeprowadzane są na roztworach wodnych, do ich aplikacji na
urządzenie zastosowano nebulizer z pompką ssącą, pobiera on małymi porcjami roztwór
podając go do komory. Dostający się do komory nebulizera analit przyjmuje formę
aerozolu, układu dwufazowego złoŜonego z rozproszonej cieczy w gazie. Komora
nebulizera słuŜy równieŜ do kontroli przepływu aerozolu na palnik oraz stopnia
dyspersji roztworu. Tylko niewielka część analitu po przejściu przez komorę dostaje się
36
do atomizera. W spektrofotometrze płomieniowym rolę atomizera pełni płomień, jego
temperatura dobierana jest do oznaczanej substancji, przez zastosowanie określonej
pary gazów – palnego i utleniającego. Jednak temperatura około 2000K z powodzeniem
prowadzi szereg przemian fizycznych aerozolu na atomizacji skończywszy.
Rozpuszczalnik w płomieniu ulega spaleniu lub w przypadku wody wyparowuje.
Powstaje układ, aerozolou drobinek ciała stałego w gazie, w dalszej kolejności dochodzi
do odparowania substancji stałej i otrzymywany jest gaz cząsteczkowy, zbudowany
z cząsteczek i rodników substancji, które znajdowały się w próbce. Następnie w wyniku
termicznej dysocjacji lub chemicznej redukcji powstają wolne atomy. Powstały gaz
atomowy, stanowi sedno tej metody gdyŜ to on moŜe absorbować promieniowanie.
Temperatura płomienia powinna być optymalnie dobrana tak, aby w optymalny sposób
zachodziła atomizacja, tzn. nie moŜe być za niska, aby w sposób wydajny powodowała
atomizację, ale teŜ nie za wysoka by nie dochodziło do wzbudzania atomów przez sam
płomień, lub ich jonizacji [18].
Nebulizer – zadaniem nebulizera jest przeprowadzić płynną próbkę w postać
aerozolu, dodatkowo urządzenie to zapewnia właściwe dozowanie analitu na palnik
oraz kontroluje wielkość kropel analizowanej substancji podawanej w strefę atomizacji
płomieniowej. Nebulizer zapewnia właściwe tempo podawania analitu na komorę
nebulizacyjną gdzie dochodzi do pełnego wymieszania składników próbki z gazem
palnym i utleniającym.
Atomizer – w klasycznej metodzie płomieniowej atomizacja atomów zachodzi
w płomieniu, jego zadaniem jest wytworzeniem z próbki analitycznej dostateczną ilość
wolnych atomów oznaczanego pierwiastka. Płomień, nie jest jedynym sposobem
na przeprowadzenie substancji w gaz atomowy, obecnie coraz częściej stosuje się do
tego celu kuwetę grafitową lub plazmę wzbudzoną indukcyjnie. Zarówno pierwsza jak
i druga metoda pozwala na dokonywanie znacznie precyzyjniejszych oznaczeń.
Źródło promieniowania – od 1955 roku stosowane są lampy HCL (z ang. hollow
catode lamp) lampy tego typu wprowadzone zostały przez A. Walsha [18]. Są to rurki
szklane z okienkiem kwarcowym, wypełnione gazem szlachetnym (argonem lub
neonem). W lamie umieszczone są dwie elektrody: anoda wolframowa i katoda
wykonana z metalu, którego linie widmowe lampa powinna emitować. Po przyłoŜeniu
napięcia kationy gazu szlachetnego bombardują katodę wybijając z niej atomy metalu.
Wzbudzone atomy metalu wybite z katody emitują promieniowanie. Lampy HCL mogą
37
być zbudowane z jednego metalu, ale teŜ ze stopu kilku metali jednak w tej drugiej
sytuacji powstają większe szumy. Wzbudzenie prowadzi się równieŜ za pomocą lamp
bezwyładowczych (EDL z ang. electrodeless discharge lamps), jest to kwarcowa rurka,
zawierająca gaz szlachetny i pierwiastek, którego promieniowanie ma emitować.
Przykładając
pole
elektromagnetyczne
duŜej
częstości
następuje
wzbudzenie
promieniowania [15].
Monochromator – jest urządzeniem zapewniającym spektralny rozkład wiązki
promieniowania elektromagnetycznego. Monochromator umoŜliwia wyjście przez
szczelinę w kierunku detektora tylko jednej linii rezonansowej tej, która absorbowana
będzie przez atomizer. Rozszczepienie zachodzi najczęściej na siatkach dyfrakcyjnych
rzadziej na pryzmatach, nie zapewniających odpowiednio korzystnej szerokości
spektralnej wiązki [18].
Detektor – stosowane są najczęściej fotopowielacze, światło przez okienko
kwarcowe pada na światłoczułą katodę, z której wybijany zostaje elektron,
przyspieszany w kierunku serii dynod, na których następuje wzmacnianie sygnału przez
powielanie elektronów. Po opuszczeniu ostatniej dynody elektrony padają na ostatnią
anodę, generując w ten sposób prąd elektryczny, który jest wzmacniany i kierowany
do rejestratora.
Rejestrator – obecnie jest nim komputer, sterujący pomiarem, zapisujący i
magazynujący dane w pamięci, pozwalający równieŜ na dokonywanie automatycznych
obliczeń i statystycznej obróbki wyników [15].
38
IV. CZĘŚĆ DOŚWIADCZALNA
1. Charakterystyka Gminy Ryglice
Gmina Ryglice połoŜona jest w województwie małopolskim, w południowowschodniej części powiatu tarnowskiego, jest to obszar w całości przynaleŜący do
Pogórza CięŜkowickiego w południowej części wchodzący w skład Pasma Liwocza
i Brzanki, ciągu wzniesień o nazwie pochodzącej od dwóch skrajnych form tutejszego
reliefu. Rzeźba terenu umiarkowanie urozmaicona, przy południowej granicy z Gminą
Szerzyny i Gminą Rzepiennik StrzyŜewski teren przechodzi w mocno pagórkowaty
z duŜymi wysokościami względnymi oraz wzniesieniami dochodzącymi do 536 m
n.p.m. (góra Brzanka). Poprzecinany głębokimi wąwozami ku północy wypłycającymi
się w łagodne doliny, północny fragment gminy równieŜ wydatnie pofałdowany jednak
o niŜszych wysokościach bezwzględnych, wzniesienia sięgające do około 390 m n.p.m
przy północnej granicy z Gminą Skrzyszów. Ze wschodu na zachód rozciąga się płytka
silnie zdenudowana dolina rzeki Szwedka, od której prostopadle w obu kierunkach
odchodzą mniejsze doliny dopływów. Powierzchnia gminy to 117 km2, jest to obszar
w zdecydowanej mierze przeznaczony pod grunty uprawne, lasy zajmują niespełna
25% powierzchni, niewielki procent stanowią takŜe nieuŜytki. W budowie
geologicznej ziemi Ryglickiej dominują utwory czwarto i trzeciorzędowe. Gmina
Ryglice jest typową gminą rolniczą, w której dominują gospodarstwa indywidualne,
produkcja przemysłowa reprezentowana jest przez niewielką firmę „STALBOMAT”
wytwarzającą konstrukcje stalowe. Działalność gospodarcza ogranicza się do kilku
niewielkich zakładów produkujących wyroby stolarskie, ferm drobiu oraz ośrodków
turystyki konnej. Gospodarka odpadowo-ściekowa wywiera pośrednio wpływ
na jakość wód rzeki Szwedka, głównego odbiornika wód z gminy Ryglice. Do maja
2007 roku gmina Ryglice nie realizowała planów gospodarki odpadami, a z terenu
gminy zamieszkałej przez 11 669 mieszkańców (stan z dnia 31.12.2006) odpady
odbierane były do lokalnie usytuowanych koszy na śmieci. W ośmiu sołectwach
wchodzących w skład gminy funkcjonują dwie oczyszczalnie ścieków o łącznej
przepustowości 171 m3/dobę. Pierwsza z nich, kontenerowa oczyszczalnia ścieków
„KOS” oddana do uŜytku w 1992 roku odbierająca ścieki z części miasta Ryglice
39
przeznaczona jest do modernizacji. W miejscowości Zalasowa funkcjonuje
oczyszczalnia typu „BIOCLERE” uruchomiona po raz pierwszy w 1997 roku. Odsetek
skanalizowanych gospodarstw jest bardzo niski, związany z występującymi
oczyszczalniami i wynosi 31% w miejscowości Ryglice w i 9% w Zalasowej.
2. Charakterystyka zlewni i rzeki Szwedka
2.1 Zlewnia
Rys. 3
Sieć rzeczna powiatu tarnowskiego, podpisano rzeki objęte państwowym monitoringiem.
Szwedka, jest prawym dopływem Białej Tarnowskiej, uchodzącej do Dunajca,
prawego dopływu Wisły. Do Białej uchodzi na 13,5 km jej biegu osiągając
powierzchnię zlewni równą 75 km2, cały ten obszar zlokalizowany jest na terenie gminy
Ryglice. Średni przepływ na punkcie pomiarowym w miejscowości Ryglice wynosi
Qśr.= 0,03 m3/sek. Szwedka bierze swój początek w miejscowości Joniny, przy granicy
z miejscowością Swoszowa, na wysokości 450 m npm. w masywie pasma LiwoczaBrzanki. Początkowo zasilana niewielkimi potokami, na 8,2 km biegu odbiera wodę z
jednego ze swoich większych dopływów Zalasówki i w końcowym odcinku na 11,5 km
40
z Potoku Uniszowskiego. Zlewnia rzeki jest słabo zalesiona i praktycznie ogranicza się
do jej górnego biegu oraz źródłowiskowych odcinków jej dopływów. W środkowym
biegu przepływa przez administracyjne granice miasta Ryglice, stając się odbiornikiem
oczyszczonych ścieków z miejskiej oczyszczalni. Na terenie miasta Szwedka przyjmuje
wody z Zalasówki, będącej odbiornikiem oczyszczonych ścieków z oczyszczalni w
miejscowości Zalasowa. Na odcinku przylegającym do miasta rzeka odbiera powaŜne
ilości surowych ścieków komunalnych z nie skanalizowanej części miasta, oraz nie
oczyszczone ścieki z kanalizacji burzowej. Rzeka w swym środkowym i końcowym
biegu przepływa przez gęsto zabudowane tereny rolnicze o nieuporządkowanej
gospodarce ściekowej jest, więc silnie zanieczyszczana przez spływy obszarowe oraz
zrzuty ścieków bytowych z gospodarstw domowych.
2.2 Budowa geologiczna
W budowie geologicznej obszaru objętego zlewnią, w przypowierzchniowej
warstwie gleby biorą udział utwory czwartorzędowe - holoceńskie w postaci glin
napływowych oraz Ŝwirów rzecznych na utworach fliszu karpackiego. Zbudowanego
z górno kredowych łupków i piaskowców o niewielkiej miąŜszości, te wsady skalne
dominują w centrum fałdu Brzanka – Liwocz w południowej części gminy. Pozostałe
to łupki zielone i pstre występujące w postaci cienkich wkładek w gruboziarniste
utwory piaskowcowe zbudowane ze źle wysortowanego materiału.
2.3 Jakość wody
Od roku 2004 stan wód rzeki Szwedka podlega monitorowaniu przez
Państwowy Inspektorat Ochrony Środowiska w Krakowie z delegaturą w Tarnowie,
prowadzone badania wskazują na silne zanieczyszczenie związkami biogennymi w tym
azotem i fosforem. Taki stan jakości wody kwalifikuje ją do V klasy czystości i czyni
nieprzydatną do zaopatrzenia w wodę przeznaczoną do spoŜycia. W 2005 roku
Szwedka prowadziła wody klasy V, a czynnikami decydującymi o degradacji cieku
były: fosfor i zawiesina ogólna. Rok wcześniej rzeka zaliczona została do III klasy
jakości wody a czynnikami degradującymi były: BZT5 i azotany(III). Tak, więc
głównym zagroŜeniem dla wód Szwedki są substancje biogenne: azotany i fosforany
oraz zanieczyszczenia mikrobiologiczne, pojawiające się na skutek odprowadzania
ścieków komunalnych bezpośrednio do wód [21,22].
41
3.Miejsca poboru próbek
3.1 Lokalizacja punktów
poboru próbek
Rys. 4
Mapa zlewni rzeki Szwedka
wraz z lokalizacją stanowisk
poboru próbek.
42
W celu dokonania analizy wód rzeki Szwedka na odcinku 13,5 km określono pięć
punktów pomiarowych:
Tabela 4
Lokalizacja miejsc poboru próbek na rzece Szwedka.
Nr miejsca
poboru
próbek
Miejsce poboru
próbek
Wstępna charakterystyka miejsc poboru próbek
Punkt ulokowano w celu zdiagnozowania tła
1
LiciąŜ Mała
zanieczyszczeń, powyŜej tego miejsca presja
- odcinek
antropogeniczna na ciek jest znikoma, moŜna na
źródłowy
stwierdzić, iŜ skład fizyko-chemiczny wody i
osadów dennych przybiera charakter naturalny.
2
Joniny
Miejsce zlokalizowano poniŜej dopływu rzeki
- poniŜej
„Wolninka”, w odniesieniu do wyników z punktu nr
dopływu rzeki
1 moŜna diagnozować ewentualne zanieczyszczenia
Wolninka
pochodzące z fragmentu wsi Kowalowa.
Próbka dostarczająca informacji dwojakiego rodzaju.
3
Ryglice 1
Lokalizacja poniŜej dopływu rzeki „Zalasówka”
- poniŜej
dostarcza informacji o jej stanie fizykochemicznym,
dopływu rzeki
ponadto punkt zlokalizowany jest przed
Zalasówka
oczyszczalnią ścieków a w odniesieniu do próbki nr
4 słuŜy do określenia jej wpływu na jakość wody.
Ryglice 2
4
- poniŜej
oczyszczalni
ścieków
Tuchów
5
- przy ujściu
Szwedki do
Białej
Lokalizacja punktu podyktowana jest miejscem
odprowadzenia ścieków z oczyszczalni, w
odniesieniu
do punktu nr 3 pozwala diagnozować wpływ
oczyszczalni na jakość wody.
Punkt określa jakość wody na końcowym odcinku
rzeki, lokalizacja poniŜej dopływu dwóch
mniejszych cieków Potoku Uszwickiego i potoku
bez nazwy wypływającego z południowej części
miejscowości Zalasowa.
43
3.2 Opis miejsc poboru próbek
Rys. 5
Punkt poboru próbek wody i osadów dennych w miejscowości Joniny ( fot. D.Niziołek)
Miejscowość Joniny, przysiółek LiciąŜ Mała, punkt poboru w odległości 2,8 km
od źródła, okoliczny teren charakteryzuje się rozproszoną zabudową, u źródeł teren
zalesiony, zabudowa nie występuje. UŜytkowanie rolnicze bardzo ekstensywne,
przylegające obszary zajęte pod uŜytki zielone.
44
Rys. 6
Punkt poboru wody i osadów dennych w miejscowości Joniny ( fot. D.Niziołek)
Miejscowość Joniny, punkt poboru usytuowany jest 5 km od źródeł, poniŜej
dopływu rzeki „Wolninka” wypływającej z miejscowości Kowalowy. Przyległy teren
charakteryzuje się rozproszoną zabudową, obszar pokryty luźnym zadrzewieniem
zlokalizowanym bezpośrednio w pobliŜu koryta, występujący w mozaice z trwałymi
uŜytkami zielonymi.
45
Rys. 7
Punkt poboru próbek wody i osadów dennych w miejscowości Ryglice (fot. D.Niziołek)
Miejscowość Ryglice, punkt poboru zlokalizowany 8,4 km od źródeł, 100 m
poniŜej dopływu rzeki „Zalasówka” biorącej swój początek w miejscowości Zalasowa.
Miejsce w centrum miasta jednocześnie znajdujące się przed wylotem oczyszczalni
ścieków. Koryto bardzo mocno zanieczyszczone odpadami stałymi. Obszar o zwartej
zabudowie mieszczącej się często w bezpośrednim sąsiedztwie koryta. WzdłuŜ rzeki
porasta rozrzedzony i nieregularny pas roślinności wysokiej, otaczający teren
zabudowany, w części przeznaczony pod uŜytki zielone.
46
Rys. 8
Punkt poboru próbek wody i osadów dennych w miejscowości Ryglice ( fot. D.Niziołek)
Miejscowość Ryglice, punkt poboru próbek zlokalizowany 50 m poniŜej zrzutu
ścieków z oczyszczalni, miejsce połoŜone 8,9 km od źródeł rzeki. Otaczający obszar
pokryty jest rozproszoną zabudową, wykorzystywany pod pola uprawne oraz trwałe
uŜytki zielone, wzdłuŜ koryta rozciąga się pas nieregularnej, pofragmentowanej
roślinności drzewiastej.
47
Rys. 9
Punkt poboru próbek wody i osadów dennych w miejscowości Tuchów ( fot. D.Niziołek)
Miejscowość Tuchów, punkt poboru zlokalizowany na 13,4 km od źródeł, tym
samym umiejscowiony 0,5 km od ujścia rzeki Szwedka do Białej Tarnowskiej. Koryto
jest mocno zanieczyszczone odpadami stałymi zaś okoliczny teren niezabudowany,
przyległy obszar wykorzystywany pod trwałe uŜytki zielone w mniejszej części pod
grunty uprawne.
48
4. Pobór i przygotowanie próbek
4.1 Próbki wody
Próbki do analizy pobierano w miejscach reprezentatywnych to jest takich,
których usytuowanie dostarczało największą moŜliwą ilość informacji. Punkty te
zostały wytypowane w oparciu o lokalizację najbardziej prawdopodobnych miejsc
mogących wpływać na zanieczyszczenie wody. Pobór próbek wody odbywał się
wczesną wiosną 2007 roku przy niskim stanie wód, przy prędkości przepływu nie
powodującej unoszenia zawiesiny (tj. V<0,3 m/s). Próbki wody pobierano w miejscu
najsilniejszego prądu tzn. w nurcie rzeki do sterylnych butelek polietylenowych.
Natychmiast po pobraniu wodę zakwaszono kwasem HNO3 1:1 do pH ok. 2,
zastosowanie w utrwaleniu próbki stęŜonego kwasu sprawia, Ŝe nie trzeba wprowadzać
poprawki na rozcieńczenie roztworu. Jest to niezbędny zabieg zabezpieczający przed
ewentualnym wytrącaniem się metali w związkach o niskim iloczynie rozpuszczalności,
głównie Ŝelaza. Pominięcie utrwalenia mogłoby w znacznym stopniu spowodować
zafałszowanie
końcowego
wyniku.
Wodę
przechowywano
w
chłodziarce
w temperaturze 2~5°C natomiast oznaczenia dokonano w dobę po poborze materiału
analitycznego.
4.2 Próbki osadów dennych
Próbki osadów dennych pobierano w miejscach poboru wody powierzchniowej, z
dna koryta w miejscu spokojnego nurtu. Typowano moŜliwie jednorodne miejsca
charakteryzujące się podobnym składem frakcji i morfologią osadu. Ze względu na
niewielką głębokość cieku osad pobierano ręcznie przy uŜyciu pojemników
polietylenowych. Po dekantacji wody osad przeniesiono na bibułę celulozową
pozostawiając go wyschnięcia w temperaturze pokojowej przez okres 2 tygodni. Po
wyschnięciu osad przesiano przez sito o oczkach 2 mm, po czym przeniesiono do
szczelnie zamkniętych pojemników polietylenowych.
49
5. Przygotowanie i przebieg oznaczenia
Zakwaszone próbki wody nie wymagały złoŜonej obróbki przed oznaczeniem przy
zastosowaniu metody ASA, w sytuacji gdyby woda zawierała duŜo zawiesiny wtenczas
naleŜałoby ją poddać filtracji. Z próbki ogólnej wydzielono próbki analityczne, które
poddano oznaczeniu. Próbki osadu poddano mineralizacji utleniającej na mokro, w tym
celu odwaŜono po około 3 g osadu z kaŜdej próbki i przeniesiono ilościowo do kolby
Kjeldahla. Zawartość kolby zwilŜono niewielką ilością wody redestylowanej, następnie
dodano 7 cm3 kwasu azotowego(V) oraz 21 cm3 kwasu solnego uzyskując w ten sposób
wodę królewską. Osad pozostawiono na noc, następnego dnia przeprowadzono
mineralizację wstępnie przygotowanego osadu. Kolby Kjeldahla umieszczono w
płaszczach grzejnych i ogrzewano przez 2 godziny podtrzymując niewielkie wrzenie, w
końcowej fazie mineralizacji zwiększono temperaturę celem odpędzenia z roztworu
tlenków azotu. Po zakończonej mineralizacji roztwory wystudzono do temperatury
pokojowej, po czym przesączono do kolb miarowych na 100 cm3 i dopełniono wodą
destylowaną do kreski. Przygotowane do oznaczenia próbki przeniesiono do
pojemników polietylenowych, z których następnie poddawano je oznaczeniu. W
przypadku oznaczania Ŝelaza i manganu, których stęŜenia wykraczały poza zakres
krzywej kalibracyjnej, dodatkowo rozcieńczono 20 krotnie ich roztwory zanim
dokonano analizy.
Rys. 10
Badania przeprowadzono na spektrofotometrze produkcji amerykańskiej
Perkin Elmer AAnalyst 300.
50
6. Zestawienie wyników
6.1 Wyniki analizy wody
Tabela 5
StęŜenia Ŝelaza w wodzie
L.p.
(nr.st.)
1
2
3
4
5
StęŜenie
metalu
(mg/dm3)
0,144
0,154
0,146
0,169
0,311
Klasy jakości wody
według RMŚ
z dnia 11 lutego 2004 r.
II
II
II
II
III
Kategorie jakości wody
według RMŚ
z dnia 27 listopada 2002 r.
A1
A1
A1
A1
A2
Klasy jakości wody
według RMŚ
z dnia 11 lutego 2004 r.
I
II
II
II
III
Kategorie jakości wody
według RMŚ
z dnia 27 listopada 2002 r.
A1
A1
A1
A1
A2
Klasy jakości wody
według RMŚ
z dnia 11 lutego 2004 r.
II
III
II
III
III
Kategorie jakości wody
według RMŚ
z dnia 27 listopada 2002 r.
A1
A1
A1
A1
A1
Tabela 6
StęŜenie manganu w wodzie
L.p.
(nr.st.)
1
2
3
4
5
StęŜenie
metalu
(mg/dm3)
0,014
0,054
0,057
0,074
0,119
Tabela 7
StęŜenie cynku w wodzie
L.p.
(nr.st.)
1
2
3
4
5
StęŜenie
metalu
(mg/dm3)
0,046
0,058
0,046
0,057
0,059
Klasy czystości:
bardzo dobra
I
dobra
II
zadowalająca
III
niezadowalająca
IV
zła
V
51
Tabela 8
StęŜenie miedzi w wodzie
StęŜenie
metalu
(mg/dm3)
0,020
0,004
0,023
0,004
0,011
L.p.
(nr.st.)
1
2
3
4
5
Klasy jakości wody
według RMŚ
z dnia 11 lutego 2004 r.
II
I
II
I
I
Kategorie jakości wody
według RMŚ
z dnia 27 listopada 2002 r.
A1
A1
A1
A1
A1
Klasy jakości wody
według RMŚ
z dnia 11 lutego 2004 r.
I
I
I
I
I
Kategorie jakości wody
według RMŚ
z dnia 27 listopada 2002 r.
A1
A1
A1
A1
A1
Klasy jakości wody
według RMŚ
z dnia 11 lutego 2004 r.
I
I
I
I
I
Kategorie jakości wody
według RMŚ
z dnia 27 listopada 2002 r.
A1
A1
A1
A1
A1
Tabela 9
StęŜenie ołowiu w wodzie
StęŜenie
metalu
(mg/dm3)
<0,001
<0,001
<0,001
<0,001
<0,001
L.p.
(nr.st.)
1
2
3
4
5
Tabela 10
StęŜenie kadmu w wodzie
L.p.
(nr.st.)
1
2
3
4
5
StęŜenie
metalu
(mg/dm3)
<0,001
<0,001
<0,001
<0,001
<0,001
Klasy czystości:
bardzo dobra
I
dobra
II
zadowalająca
III
niezadowalająca
IV
zła
V
52
6.2 Wyniki analizy osadów dennych
Tabela 11
Zawartość Ŝelaza w osadach dennych
Lp.
(nr.st.)
Masa
próbki
(g)
1
2
3
4
5
3,002
3,136
2,965
2,965
3,013
StęŜenie
metalu
ASA
(mg/dm3)
9,148
16,37
12,17
11,89
9,319
Stopień
rozcieńczeni
a
Rzeczywista
masa metalu
(mg)
20
20
20
20
20
18,296
32,74
24,34
23,78
18,638
Zawartość
metalu w
osadzie
(mg/kg)
6095
10441
8209
8021
6186
Tabela 12
Zawartość manganu w osadach dennych
Lp.
(nr.st.)
Masa
próbki
(g)
1
2
3
4
5
3,002
3,136
2,965
2,965
3,013
StęŜenie
metalu
ASA
(mg/dm3)
0,234
1,015
0,371
0,195
0,247
Stopień
rozcieńczenia
Rzeczywista
masa metalu
(mg)
20
20
20
20
20
0,467
2,03
0,742
0,39
0,493
Zawartość
metalu w
osadzie
(mg/kg)
155,7
647,4
250,4
131,4
163,8
Tabela 13
Zawartość cynku w osadach dennych
Lp.
(nr.st.)
Masa
próbki
(g)
1
2
3
4
5
3,002
3,136
2,965
2,965
3,013
StęŜenie
metalu
ASA
(mg/dm3))
0,612
1,202
0,713
0,803
0,509
Stopień
rozcieńczenia
Rzeczywista
masa metalu
(mg)
1
1
1
1
1
0,0612
0,1202
0,0713
0,0803
0,0509
Zawartość
metalu w
osadzie
(mg/kg)
20,38
38,33
24,04
27,09
16,91
53
Tabela 14
Zawartość miedzi w osadach dennych
Lp.
(nr.st.)
Masa
próbki
(g)
1
2
3
4
5
3,002
3,136
2,965
2,965
3,013
StęŜenie
metalu
ASA
(mg/dm3)
0,121
0,225
0,127
0,114
0,052
Stopień
rozcieńczenia
Rzeczywista
masa metalu
(mg)
1
1
1
1
1
0,0121
0,0225
0,0127
0,0114
0,0052
Stopień
rozcieńczenia
Rzeczywista
masa metalu
(mg)
1
1
1
1
1
0,0091
0,0213
0,0041
0,0031
<0,0003
Stopień
rozcieńczenia
Rzeczywista
masa metalu
(mg)
1
1
1
1
1
0,0014
0,0021
<0,0003
0,0004
<0,0003
Zawartość
metalu w
osadzie
(mg/kg)
4,028
7,182
4,274
3,842
1,713
Tabela 15
Zawartość ołowiu w osadach dennych
Lp.
(nr.st.)
Masa
próbki
(g)
1
2
3
4
5
3,002
3,136
2,965
2,965
3,013
StęŜenie
metalu
ASA
(mg/dm3)
0,091
0,213
0,041
0,031
<0,003
Zawartość
metalu w
osadzie
(mg/kg)
3,018
6,805
1,376
1,052
<0,1
Tabela 16
Zawartość kadmu w osadach dennych
Lp.
(nr.st.)
Masa
próbki
(g)
1
2
3
4
5
3,002
3,136
2,965
2,965
3,013
StęŜenie
metalu
ASA
(mg/dm3)
0,014
0,021
<0,003
0,004
<0,003
Zawartość
metalu w
osadzie
(mg/kg)
0,463
0,670
<0,1
0,138
<0,1
54
6.3 Współczynniki akumulacji
Metodyka badań osadów dennych, którą zastosowano w tej pracy licencjackiej jest
rozwiązaniem zaadaptowanym z oznaczania metali cięŜkich glebach. Metale cięŜkie
podobnie jak inne liczne związki ulegają depozycji w osadzie rzecznym, jest to jeden ze
sposobów samooczyszczania rzek. Pojemność sorpcyjna osadów ma jednak ściśle
określone granice a po jej przekroczeniu metale nie podlegają dalszej sorpcji i pozostają
w dynamicznej równowadze pomiędzy roztworze wodnym a osadem. Nasycenie
osadów rzecznych metalami jest zjawiskiem niebezpiecznym, gdyŜ przy niewielkim
spadku pH wody wymywane są z kompleksów i uwalniane.
Przy obliczaniu współczynnika akumulacji K, miary stopnia zatrzymania metali w
osadzie uwzględniono cztery przypadki:
1) zawartość metalu w osadzie i stęŜenie metalu w wodzie są dokładnie wyznaczone
wówczas K = CMos / CMw
2) stęŜenie metalu w roztworze po mineralizacji osadu leŜy poniŜej granicy
oznaczalności CRm < od 0.003 mg/dm3 wówczas K < 0,003 / C Mw
3) gdy CMos da się oznaczyć, a stęŜenie w wodzie leŜy poniŜej granicy oznaczalności tj.
CMw < 0.001 mg/dm3 – wtedy K > CMos / 0,001
4) jeśli zarówno stęŜenia metalu w roztworze po mineralizacji osadu jak i w wodzie
leŜą poniŜej granicy oznaczalności wtedy współczynnika nie da się wyliczyć.
Tabela 17
Współczynniki akumulacji K metali w osadach dennych
L.p. (nr.st.)
1
2
3
4
5
Fe
Mn
42326 11121
67799 11989
56226 4393
47462 1776
19891 1376
Zn
443
661
523
475
287
Cu
201
1796
186
961
156
Cd
>3018
>6805
>1376
>1052
-
Pb
463
670
138
-
55
Rys. 11
Wykres przedstawiający procentowy udział akumulacji metali w osadzie rzecznym
Określenie współczynnika akumulacji metali w osadzie rzecznym wskazuje, iŜ
nie wszystkie metale mają podobną tendencję do gromadzenia się w osadzie. Miedź,
cynk i ołów akumulują się dość słabo osadzie, czego dowodzi niska wartość
współczynnika K. Stosunkowo dobrze akumulowany jest kadm pomimo jego
śladowych stęŜeń w wodzie. DuŜe stęŜenia Ŝelaza i manganu w wodzie związane są
analogiczne z wyŜszą akumulacją w osadzie. Zarówno Ŝelazo jak i mangan w wodach
powierzchniowych występują w formach utlenionych, trudno rozpuszczalnych toteŜ
łatwiej ulegają deponowaniu. śelazo najczęściej w postaci trudno rozpuszczalnego
Fe(OH)3, mangan jako Mn(OH)2 stąd tak duŜe w ich przypadku wartości
współczynnika K.
56
V. WNIOSKI
ZałoŜeniem opracowania było oznaczenie zawartości metali cięŜkich w wodzie i
osadach dennych rzeki Szwedka. Jakość wody płynącej badana pod kątem na zawartość
metali cięŜkich nie budzi powaŜnych zastrzeŜeń. Woda kwalifikuje się do I i II klasy
czystości na przewaŜającym odcinku, przy ujściu do Białej I klasa czystości obniŜa się
do poziomu III. Wskaźnikami decydującymi o degradacji do tej klasy są stęŜenie
Ŝelaza, cynku i manganu jednak dopiero w końcowym biegu rzeki. Ilości Cd, Pb, Cu
znajdują się w stęŜeniach, które występują w środowisku jako śladowe i naturalne,
pochodzące z utworów geologicznych. StęŜenia ołowiu i kadmu na wszystkich
punktach pomiarowych są niŜsze niŜ 0,001 mg/dm3 i pod tym względem woda
kwalifikuje się do I klasy czystości. Zawartość miedzi waha się na poziomie 0,004-0,02
mg/dm3 kwalifikując wodę do I i II klasy czystości. StęŜenia miedzi rozkładają się
równomiernie na całej długości cieku i mieszczą się w zakresie 0,046-0,059 mg/dm3
klasyfikując wodę do II i III klasy czystości. W wodzie znajduje się podwyŜszona
zawartość manganu i Ŝelaza, zjawisko ma charakter naturalny gdyŜ pierwiastki te
występują powszechnie w fliszowych utworach geologicznych, z których zbudowana
jest zlewnia. StęŜenie Ŝelaza stopniowo wzrasta wzdłuŜ biegu rzeki, począwszy od
0,014 mg/dm3 w odcinku źródłowym do 0,119 mg/dm3 przy ujściu do Białej. Po kątem
zawartości Ŝelaza woda kwalifikuje się od I do III klasy czystości w końcowym biegu
rzeki. StęŜenia manganu klasyfikują wodę do II i III klasy czystości i zawierają się w
przedziale od 0,014 do 0,311 md/dm3.
W odniesieniu do rozporządzenia MŚ w sprawie wymagań, jakim powinny
odpowiadać wody powierzchniowe wykorzystywane do zaopatrzenia ludności w wodę
przeznaczoną do spoŜycia na wszystkich punktach pomiarowych jakość wody
kwalifikuje się do klasy A1 z wyłączeniem stanowiska w Tuchowie, przy ujściu
Szwedki gdzie woda zaliczona została do klasy A2, czynnikiem degradującym była
podwyŜszona zawartość Ŝelaza i manganu.
Pogarszanie się wskaźników w środkowym i dolnym odcinku rzeki moŜe być skutkiem:
1. Odprowadzania nie doczyszczonych ścieków z oczyszczalni
2. Nagminnego odprowadzania surowych ścieków komunalnych bezpośrednio
do wód
3. Dopływu zanieczyszczeń ze źródeł obszarowych
4. Odprowadzania wód z dróg i z kanalizacji burzowej bezpośrednio do wód
57
5. Drastycznego zanieczyszczenia odpadami stałymi w obrębie koryta, z których
zanieczyszczenia uwalniane są do wody
6. Deponowania
w
okresie
zimowym
i
wczesnowiosennym
popiołów
po paleniskowych w obrębie koryt i migracji związków metali do wód
Osady denne badane pod kątem na zawartości metali cięŜkich nie wskazują na
powaŜne zanieczyszczenie. Na stanowisku w Joninach odnotowano podwyŜszone ilości
wszystkich z sześciu analizowanych metali. Wobec podobnego składu mineralnego
i chemicznego pobranych na tym punkcie osadów w stosunku do pozostałych próbek
odchylenie to moŜe wynikać z przewaŜającej ilości drobnej frakcji osadów o średnicy
< 0,020 mm. Wraz ze wzrostem rozdrobnienia osadów rzecznych wzrasta ich
powierzchnia właściwa a wraz z nią następuje intensyfikacja procesów wymiany
jonowej, adsorpcji i wytrącania. Mniejsza granulometria osadów zwiększa ich
moŜliwości sorpcyjne, sprawiając, Ŝe mogą zgromadzić w sobie większe ilości metali.
Dlatego teŜ nie moŜna stwierdzić znacznego zanieczyszczenia w tym punkcie,
zwłaszcza, iŜ nie stwierdzono w terenie potencjalnych źródeł zanieczyszczeń. Poza tym,
koncentracja metali cięŜkich utrzymuje się w stęŜeniach determinujących je jako tło.
Zawartość Ŝelaza utrzymuje się na poziomie 6 186 do 8 210 ppm, manganu 131 do 230
ppm, są to pierwiastki występujące w największych ilościach. StęŜenia cynku mieszczą
się w zakresie 169 do 270 ppm, miedzi w przedziale 1,7 ppm do 4,3 ppm. Odnotowano
śladowe zawartości kadmu i ołowiu odpowiednio w zakresach: 30 do 440 ppb kadmu
i 30 ppb do 3 ppm ołowiu. NajwyŜszą podatność na kumulację w osadach dennych
wykazują Ŝelazo i mangan, a ich podwyŜszona zawartość w odniesieniu do pozostałych
wskaźników ma charakter naturalny i jest konsekwencją geologii zlewni, zbudowanej
z utworów fliszowych zasobnych w minerały zawierające te pierwiastki.
PowyŜsze wyniki pozwalają na stwierdzenie, iŜ zawartości metali cięŜkich mieszczą
nie wykazują powaŜnej presji antropogenicznej, aczkolwiek zanieczyszczenie wzrasta
widoczne wraz z biegiem cieku. Reasumując moŜna stwierdzić, iŜ stan wód
powierzchniowych rzeki Szwedka badany na zawartość metali cięŜkich określić moŜna
jako zadowalający. Metale cięŜkie zaliczane do grona ściśle toksycznych praktycznie
nie występują a stęŜenia pozostałych utrzymują się w zakresie średnich wartości.
Szwedka nie jest bezpośrednio zagroŜona na zanieczyszczenia tymi związkami,
powaŜny problem stanowią substancje biogenne i wskaźniki mikrobiologiczne,
te jednak wykraczają poza zakres niniejszego opracowania.
58
VI. ABSTRAKT
Celem pracy licencjackiej było określenie stęŜenia wybranych metali cięŜkich tj.
miedzi, cynku, kadmu, ołowiu, manganu i Ŝelaza w wodach rzeki Szwedki. Oznaczeniu
poddano równieŜ zawartość wyŜej wymienionych metali w osadach dennych. Uzyskane
wyniki do określonych klas czystości wód zgodnie z krajowym ustawodawstwem.
W niniejszej pracy pośrednio zwrócono uwagę na źródła zanieczyszczeń metalami
cięŜkimi na obszarach zlewni, wolnej od zanieczyszczeń przemysłowych. Wskazano
głównie na dramatyczne zanieczyszczenie koryta Szwedki odpadami stałymi, oraz na
nie uporządkowaną gospodarkę ściekową ( zał. prezentacja ppt CD).
W części teoretycznej ze względu na środowiskowy charakter próbek, dokonano
charakterystyki wody jako składowej środowiska przyrodniczego. Omówiono główne
formy zanieczyszczeń wód powierzchniowych, odniesiono się równieŜ do krajowego
ustawodawstwa ujmującego problematykę prowadzenia analiz wód powierzchniowych
oraz sposobu przedstawiania ich wyników. W kolejnym rozdziale, poświęconym
metalom cięŜkim, dokonano ich charakterystyki, poruszono aspekt ich występowania w
środowisku oraz ujęto główne źródła zanieczyszczeń tymi substancjami. W dalszej
części omówiono przykłady metod klasycznych w oznaczaniu metali cięŜkich,
zwrócono szczególną uwagę na metody spektrofotometryczne, z racji ich szerokiego
rozpowszechnienia w analityce środowiskowej. Opisano wiodące metody oznaczania
metali w spektroskopii UV-VIS, sporo miejsca poświęcono atomowej spektroskopii
absorpcyjnej (ASA), przybliŜając historię jej rozwoju. Scharakteryzowano sposób
oznaczania metali cięŜkich za pomocą ASA oraz przedstawiono budowę i
funkcjonowanie wykorzystywanej przezeń aparatury.
Część
doświadczalną
wprowadzeniu
rozpoczyna
charakterystyki
obszaru
charakterystyka
omówiono
gminy
jakość
Ryglice,
wód
po
Szwedki,
scharakteryzowano jej zlewnię i budowę geologiczną. W dalszej części pracy dokonano
charakterystyki miejsc poboru próbek, zaprezentowano miejsca w formie dokumentacji
fotograficznej oraz ukazano ich lokalizację na mapie. Następnie omówiono dokładnie
przebieg poboru próbek wód i osadów dennych, po czym przedstawiono proces ich
przygotowania do oznaczenia oraz sam przebieg analizy. W końcu części
doświadczalnej zestawiono wyniki analizy wody, osadów dennych oraz przedstawiono
wartości współczynników akumulacji poszczególnych metali w osadach dennych rzeki
Szwedki. W ostatnim rozdziale pracy licencjackiej oceniono uzyskane wyniki i
sformułowano wnioski.
59
VII. LITERATURA
1. J. Dojlido „Chemia wody” Wydawnictwo Arkady 1987
2. W. Chełmicki „Wody – zasoby, degradacja, ochrona” PWN Warszawa 2002
3. E. Gomółka A. Szaynok „Chemia wody i powietrza” Oficyna Wydawnicza
Politechniki Wrocławskiej Wrocław 1997
4. W. Stankowski „Geografia fizyczna z Geologią” WSiP 1997
5. „Stan Środowiska w Polsce na tle celów i priorytetów Unii Europejskiej” Raport
Wskaźnikowy 2004 Biblioteka Monitoringu środowiska Warszawa 2006
6. „Problemy analityczne badań osadów dennych” Uniwersytet im. A. Mickiewicza
w Poznaniu Zakład Analizy Wody i Gruntów, Politechnika Radomska Katedra
Ochrony Środowiska, WyŜsza Szkoła Ekologii i Zarządzania w Warszawie
Poznań 2001
7. B. J. Alloway, D. C. Ayres “Chemiczne podstawy zanieczyszczania środowiska”
PWN Warszawa 1999
8. C.H. Walter, S.P. Hopkin, R.M. Silby, D.B. Peakall „Podstawy ekotoksykologii”
PWN 2002
9. P. Rymanowicz, I. Figiel, D. Uhlig „Krajowe i unijne przepisy w zakresie ochrony
Środowiska” Towarzystwo na rzecz ziemi Oświęcim 2002
10. Rozporządzenie Ministra Środowiska z dnia 11 lutego 2004 r. w sprawie
klasyfikacji dla prezentowania stanu wód powierzchniowych i podziemnych,
sposobu prowadzenia monitoringu oraz sposobu interpretacji wyników i prezentacji
stanu tych wód.
11. Rozporządzenie Ministra Środowiska z dnia 27 listopada 2002 roku w sprawie
wymagań, jakim powinny odpowiadać wody powierzchniowe wykorzystywane do
zaopatrzenia ludności w wodę przeznaczoną do spoŜycia.
12. A. Macioszczyk, D. Dobrzyński „Hydrogeochemia – strefy aktywnej wymiany wód
podziemnych” PWN Warszawa 2002
13. W. Hermanowicz, J. Dojlido, W. DoŜańska, B. Koziorowski, J. Zerbe „Fizycznochemiczne badanie wody i ścieków” Wydawnictwo Arkady 1999
14. Praca zbiorowa pod redakcją J. Namieśnika i Z. Jamrógiewicza „Fizykochemiczne
metody kontroli zanieczyszczeń środowiska” Wydawnictwo Naukowo-Techniczne
Warszawa 1998
15. W. Szczepaniak „Metody instrumentalne w analizie chemicznej” PWN 1999
60
16. J. Minczewski, Z. Marczenko „Chemia analityczna – chemiczne metody analizy
ilościowej” PWN Warszawa 2004
17. Z. Marczenko, M. Balcerzak „Spektrofotometryczne metody w analizie
nieorganicznej” PWN Warszawa 1998
18. K. Dittrich „Absorpcyjna spektrometria atomowa” PWN 1988
19. A. Cygański „Metody spektroskopowe w chemii analitycznej” Wydawnictwo
Naukowo Techniczne Warszawa 1998
20. J. Dojlido, J. Zerbe „Instrumentalne metody badania wody i ścieków”
Wydawnictwo Arkady 1997
21. „Ocena jakości wód powierzchniowych w 2004 roku w regionie tarnowskim”
WIOŚ w Krakowie, delegatura Tarnów
22. „Ocena jakości wód powierzchniowych w 2005 roku w regionie tarnowskim”
WIOŚ w Krakowie, delegatura Tarnów.
61