SYLABUS
1.1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE
Nazwa przedmiotu/ modułu
Chemia ogólna i analityczna
Kod przedmiotu/ modułu*
Wydział (nazwa jednostki
prowadzącej kierunek)
Wydział Biologiczno-Rolniczy
Nazwa jednostki
realizującej przedmiot
Katedra Chemii i Toksykologii Żywności
Kierunek studiów
Biologia
Poziom kształcenia
Pierwszy stopień
Profil
Ogólnoakademicki
Forma studiów
Stacjonarne
Rok i semestr studiów
Rok I, semestr 1
Rodzaj przedmiotu
Podstawowy
Koordynator
Imię i nazwisko osoby
prowadzącej / osób
prowadzących
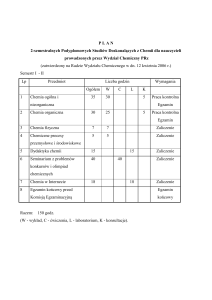
1.2. FORMY ZAJĘĆ DYDAKTYCZNYCH, WYMIAR GODZIN I PUNKTÓW ECTS
Wykł.
Ćw.
Konw.
26
Lab.
Sem.
ZP
Prakt.
Inne (jakie?)
Liczba pkt ECTS
26
4
1.3. SPOSÓB REALIZACJI ZAJĘĆ
☒ zajęcia w formie tradycyjnej
☐ zajęcia realizowane z wykorzystaniem metod i technik kształcenia na odległość
1.4.
2.
FORMA ZALICZENIA PRZEDMIOTU/ MODUŁU
egzamin
WYMAGANIA WSTĘPNE
Wiadomości z chemii z zakresu szkoły średniej na poziomie podstawowym egzaminu maturalnego z chemii.
3.
CELE, EFEKTY KSZTAŁCENIA , TREŚCI PROGRAMOWE I STOSOWANE METODY
DYDAKTYCZNE
3.1. CELE PRZEDMIOTU/MODUŁU
C1
Zapoznanie z terminologią i nomenklaturą chemiczną.
C2
Wyrobienie umiejętności posługiwania się podstawowymi pojęciami i prawami chemicznymi.
C3
Przybliżenie budowy elektronowej pierwiastków, rodzajów wiązań występujących w związkach
chemicznych.
C4
Zapoznanie z rodzajami reakcji chemicznych.
C5
Charakterystyka związków nieorganicznych i kompleksowych.
C6
Opanowanie podstaw termodynamiki chemicznej: elektrolity, równowagi w roztworach
elektrolitów, równowagi kwasowo-zasadowe.
C7
Zapoznanie z procesami oksydacyjno-redukcyjnymi oraz elektrochemicznymi.
C8
Wprowadzenie podstaw chemii analitycznej.
C9
Wyrobienie umiejętności opisu reakcji chemicznych za pomocą równań, wykonywania prostych
obliczeń chemicznych, wykonywania analiz ilościowych i jakościowych w zakresie niezbędnym do
wyjaśniania zjawisk i procesów biologicznych, bezpiecznego wykonywania doświadczeń
chemicznych i posługiwania się sprzętem laboratoryjnym.
3.2. EFEKTY KSZTAŁCENIA DLA PRZEDMIOTU/ MODUŁU ( WYPEŁNIA KOORDYNATOR)
EK (efekt
kształcenia)
Treść efektu kształcenia zdefiniowanego dla przedmiotu
(modułu)
Student:
Odniesienie
do efektów
kierunkowych
(KEK)
EK_01
objaśnia i interpretuje prawa chemiczne
K_W01, K_W04
EK_02
opisuje właściwości poszczególnych grup związków
nieorganicznych
K_W01, K_W04
EK_03
opisuje reakcje chemiczne za pomocą równań
K_W01, K_W04
EK_04
K_U03, K_U13
wykonuje proste analizy chemiczne ilościowe i jakościowe
EK_05
wykonuje proste obliczenia stechiometryczne
K_U12
EK_06
posługuje się podstawowymi pojęciami z zakresu chemii
K_U10
EK_07
pracuje w zespole
K_K02
EK_08
stosuje zasady bezpieczeństwa obowiązujące w laboratorium
chemicznym.
K_U01, K_K05
3.3. TREŚCI PROGRAMOWE
A. Problematyka wykładu
Treści merytoryczne
Materia i jej podział. Podstawowe pojęcia i prawa chemiczne.
Pierwiastek, a związek chemiczny. Nomenklatura chemiczna.
Układ okresowy pierwiastków. Konfiguracje walencyjne grup pierwiastków chemicznych na tle układu
okresowego. Prawo okresowości.
Wiązanie chemiczne; rodzaje wiązań.
Przemiany chemiczne - podstawowe typy reakcji chemicznych. Szybkość reakcji chemicznych i czynniki
wpływające na nią. Reakcje odwracalne. Prawo równowagi chemicznej.
Systematyka związków nieorganicznych.
Związki kompleksowe - budowa, nomenklatura, znaczenie i zastosowanie.
Roztwory. Rodzaje roztworów. Stężenie, rozpuszczalność substancji w cieczach. Adsorpcja, osmoza.
Dysocjacja elektrolityczna. Elektrolity słabe i mocne. Prawo rozcieńczeń Ostwalda. Iloczyn jonowy wody,
pH roztworu. Hydroliza. Bufory - znaczenie roztworów buforowych. Rozpuszczalność elektrolitów trudno
rozpuszczalnych - iloczyn rozpuszczalności. Wybrane teorie kwasów i zasad.
Reakcje utleniania-redukcji. Równanie Nernsta. Szereg napięciowy metali.
Analiza jakościowa: podział kationów na grupy analityczne, odczynniki grupowe. Reakcje
charakterystyczne wybranych kationów i anionów.
Analiza ilościowa. Alkacymetria, redoksometria, kompleksometria.
Wybrane metody analizy instrumentalnej.
B. Problematyka ćwiczeń audytoryjnych, konwersatoryjnych, laboratoryjnych, zajęć praktycznych
Treści merytoryczne
Przepisy BHP obowiązujące w Pracowni Chemicznej. Zapoznanie się ze sprzętem i szkłem
laboratoryjnym.
Wybrane typy reakcji chemicznych: podział reakcji chemicznych, efekt cieplny reakcji, przeprowadzenie
przykładowych reakcji syntezy, analizy i wymiany.
Obliczenia stechiometryczne: skład procentowy związku, obliczenia oparte o stechiometryczne równanie
reakcji chemicznej, wydajność reakcji.
Procesy utleniania-redukcji: bilansowanie reakcji utleniania-redukcji, wykonanie wybranych reakcji
utleniania-redukcji.
Analiza kationów i anionów
Rodzaje stężeń (obliczenia).
Badanie właściwości fizycznych roztworów, sporządzanie roztworów o zadanym stężeniu.
Równowagi kwasowo-zasadowe w roztworach wodnych. Potencjometryczny pomiar pH: pojęcie pH, skala
pH, obliczanie pH roztworów kwasów i zasad, sposoby pomiaru pH, sporządzenie i badanie właściwości
buforu octanowego.
Analiza miareczkowa: wprowadzenie do analizy miareczkowej, reakcje zobojętniania, wykonanie
oznaczenia alkacymetrycznego.
Związki kompleksowe. Analiza miareczkowa - kompleksometria: twardość wody, reakcje kompleksowania
z udziałem EDTA, oznaczenie twardości wody metodą kompleksometryczną.
Metody optyczne w analizie chemicznej. Kolorymetria: zjawisko absorpcji promieniowania, prawa
absorpcji, kolorymetryczne oznaczenie zawartości żelaza (III)
w roztworze metodą krzywej wzorcowej.
3.4.
METODY DYDAKTYCZNE
Wykład: wykład z prezentacją multimedialną.
Ćwiczenia laboratoryjne: wykonywanie doświadczeń, praca w grupach, interpretacja uzyskanych wyników.
4.
METODY I KRYTERIA OCENY
4.1. Sposoby weryfikacji efektów kształcenia
Symbol efektu
Metody oceny efektów kształcenia
Forma zajęć
dydaktycznych
EK_01
egzamin pisemny, kolokwia
w, ćw.
EK_02
egzamin pisemny, kolokwia
w, ćw.
EK_03
egzamin pisemny, kolokwia
w, ćw.
EK_04
obserwacja w trakcie zajęć, ocena wykonanych analiz
ćw.
EK_05
obserwacja w trakcie zajęć, kolokwia
ćw.
EK_06
obserwacja w tracie zajęć, kolokwia
ćw.
EK_07
obserwacja w tracie zajęć
ćw.
EK_08
obserwacja w tracie zajęć.
ćw.
4.2. Warunki zaliczenia przedmiotu (kryteria oceniania)
Ćwiczenia: aktywne uczestniczenie we wszystkich zajęciach laboratoryjnych; ocenianie ciągłe, cząstkowe
kolokwia pisemne bez możliwości poprawiania w ciągu semestru, pozytywne zaliczenie kolokwiów
cząstkowych, ocena ustalona w oparciu o średnią arytmetyczną ocen cząstkowych, przy <50% ocen
pozytywnych poprawa w formie kolokwium zaliczeniowego z całości materiału
Wykład: egzamin pisemny z pytaniami otwartymi (w tym równania reakcji i obliczenia)
Warunkiem zaliczenia przedmiotu jest osiągnięcie wszystkich założonych efektów kształcenia.
O ocenie pozytywnej z przedmiotu decyduje liczba uzyskanych punktów (>50% maksymalnej liczby
punktów): dst 51-65%, dst plus 66-75%, db 76-85%, db plus 86-95%, bdb 96-100%.
5.
CAŁKOWITY NAKŁAD PRACY STUDENTA POTRZEBNY DO OSIĄGNIĘCIA ZAŁOŻONYCH
EFEKTÓW W GODZINACH ORAZ PUNKTACH ECTS
Aktywność
Liczba godzin/ nakład pracy studenta
godziny zajęć wg planu z nauczycielem
52 (26w +26ćw)
przygotowanie do zajęć
25
udział w konsultacjach
5
czas na napisanie referatu/eseju
przygotowanie do egzaminu
30
udział w egzaminie
2
inne (jakie?)
SUMA GODZIN
114
SUMARYCZNA LICZBA PUNKTÓW
ECTS
6.
PRAKTYKI ZAWODOWE W RAMACH PRZEDMIOTU / MODUŁU
wymiar godzinowy
zasady i formy odbywania praktyk
7.
4
-
LITERATURA
Literatura podstawowa:
Fisher J., Arnold J. R. P. Chemia dla biologów, PWN Warszawa 2008.
Kędryna Z., Chemia ogólna z elementami biochemii, Wyd. ZAMKOR Kraków 2010.
Minczewski J., Marczenko Z. Chemia analityczna, PWN Warszawa 2008.
Śliwa A. (red.), Obliczenia chemiczne, PWN Warszawa 1987.
Dżugan M., Kisała J., Pasternakiewicz A. Chemia dla kierunków przyrodniczych. Część 1. Chemia ogólna
i analityczna, Wydawnictwo Uniwersytetu Rzeszowskiego 2011.
Literatura uzupełniająca:
Bielański A Podstawy chemii nieorganicznej, PWN Warszawa 2010.
Cotton F.A., Wilkinson G., Gaus P.L. Chemia nieorganiczna, PWN Warszawa 2002.
Lipiec T., Szmal Z.S. Chemia analityczna z elementami analizy instrumentalnej, PZWL Warszawa 1997.
Szczepaniak W. Metody instrumentalne w analizie chemicznej, PWN Warszawa 2008.
Galus Z. (red.) Ćwiczenia rachunkowe z chemii analitycznej. PWN Warszawa 2005.
Akceptacja Kierownika Jednostki lub osoby upoważnionej