Uploaded by
common.user4166
Chemia strukturalna związków nieorganicznych - wyzwania dydaktyczne

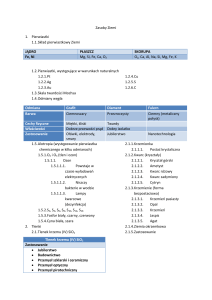
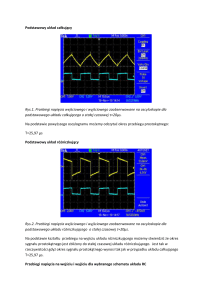
Nauka i technika „Czàsteczki” zwiàzków nieorganicznych Przekazywanie wiedzy na temat chemii strukturalnej, szczególnie na podstawowym poziomie, jest jednym z najtrudniejszych elementów dydaktyki chemii, zaÊ realizowany obecnie i podawany w podr´cznikach opis struktur i reakcji chemicznych, szczególnie nieorganicznych, cz´sto nie przystaje do wspó∏czesnego stanu wiedzy. ZYGMUNT GONTARZ, JANUSZ ZACHARA e wspó∏czesnej chemii obserwuje si´ coraz szersze wykorzystanie nowoczesnych technik, które pozwalajà na coraz g∏´bsze wnikanie w struktur´ materii. Do najwa˝niejszych nale˝à tu metody wykorzystujàce zjawiska dyfrakcji promieniowania rentgenowskiego, wiàzki neutronów, elektronów na sieciach krystalicznych zwiàzków oraz metody spektralne, a w szczególnoÊci jàdrowy rezonans magnetyczny. W coraz wi´kszym stopniu zdajemy sobie spraw´, ˝e zrozumienie chemii wymaga szeroko rozumianej znajomoÊci struktur zwiàzków chemicznych, z których wynikajà ich w∏aÊciwoÊci chemiczne, okreÊlane przez udzia∏ tych zwiàzków w reakcjach chemicznych jako konkretnych reagentów. Zwiàzki chemiczne, jako uk∏ady makroskopowe, zbudowane sà z wielkiej liczby chemicznych elementów strukturalnych zwanych drobinami. Nale˝à do nich elektrooboj´tne czàsteczki wiàzane s∏abymi oddzia∏ywaniami mi´dzyczàsteczkowymi oraz kationy i aniony, cz´sto o bardzo z∏o˝onej strukturze, wyst´pujàce w zwiàzkach jonowych. W zale˝noÊci od mocy oddzia∏ywaƒ wyst´pujàcych mi´dzy drobinami, zwiàzki mogà wyst´powaç w trzech ró˝nych stanach skupienia. W 6 198 Równania reakcji chemicznych, tzw. „czàsteczkowe” czy pe∏ne lub skrócone „jonowo-czàsteczkowe”, sà najcz´Êciej zapisami bilansowymi uwzgl´dniajàcymi bilans materia∏owy i ∏adunkowy, a podawane w zapisie reakcji wzory chemiczne odzwierciedlajà cz´sto jedynie stechiometri´ reagujàcych zwiàzków lub drobin i równie˝ cz´sto nie reprezentujà sobà rzeczywistych elementów struktury zwiàzków. Szczególne nieporozumienia pojawiajà si´ przy tzw. wzorach kreskowych, cz´sto nazywanych „strukturalnymi”, tworzonych na podstawie wartoÊciowoÊci (poj´cie odpowiadajàce liczbie wiàzaƒ pierwiastka z tlenem lub wodorem). Korzystajàc z poj´cia wartoÊciowoÊci mo˝na okreÊliç stechiometri´ zwiàzków, ale wnioskowanie o strukturze jest najcz´Êciej nieuprawnione. Poj´cie to, które w zasadzie formalnie znikn´∏o w chwili obecnej z chemii i, mimo prób jego ró˝nej reinterpretacji, zosta∏o zastàpione stopniem utlenienia, nie pozwala na opis rzeczywistych struktur, gdy˝ przypisywanie mu liczby tworzonych wiàzaƒ nie jest zgodne z rzeczywistoÊcià. Poruszony problem opisu struktur jest bardzo szeroki, w zwiàzku z tym w artykule ograniczymy si´ do pokazania tych Chemia w Szkole Nauka i technika zagadnieƒ na kilku prostych, powszechnie znanych, przyk∏adach. Rozpatrzmy prostà reakcj´ pomi´dzy tlenkiem wapnia i wodà, opisujàcà proces gaszenia wapna. Mo˝emy jà zapisaç równaniem bilansowym: CaO + H2 O → Ca(OH)2 Równanie to podaje proporcje, w jakich reagujà substraty i ile otrzymujemy produktu, czyli np. ˝e jeden mol tlenku wapnia reaguje z jednym molem wody z utworzeniem jednego mola wodorotlenku wapnia. Nie oznacza natomiast, ˝e jedna czàsteczka CaO reaguje z jednà czàsteczkà wody z utworzeniem jednej czàsteczki wodorotlenku wapnia, gdy˝ nie ma czàsteczek CaO i Ca(OH)2 jako drobin równowa˝nych czàsteczce wody a cz´sto zapisywanych za pomocà tzw. wzorów kreskowych lub strukturalnych: Ca=O i HO−Ca−OH. Tlenek wapnia jest zwiàzkiem zbudowanym z równej sobie liczby jonów: kationów Ca2+ i anionów O2− powiàzanych wiàzaniem jonowym w przestrzennà sieç krystalicznà tlenku wapnia (Rys. 1). O2− , a ka˝dy anion tlenkowy przez 6 równo oddalonych kationów wapniowych. W strukturze tej nie mo˝na wyró˝niç czàsteczek CaO. Podobna sytuacja wyst´puje w wodorotlenku wapnia, który jest strukturà przestrzennà powiàzanych wiàzaniem jonowym kationów Ca2+ i jonów wodorotlenkowych OH− (Rys. 2a). W tej strukturze ka˝dy jon Ca2+ jest otoczony oktaedrycznie przez szeÊç znajdujàcych si´ w jednakowej odleg∏oÊci anionów OH− (Rys. 2b), a ka˝dy jon OH− przez trzy równoodleg∏e kationy Ca2+ . Równie˝ w tej strukturze nie ma czàsteczek Ca(OH)2 . Rys. 2a Rys. 1 W strukturze tlenku wapnia ka˝dy jon Ca2+ otoczony jest oktaedrycznie przez 6 równo oddalonych anionów tlenkowych 4/2005 Rys. 2b 199 7 Nauka i technika Reakcja na poziomie drobinowym sprowadza si´ w tym przypadku do równania jonowo-czàsteczkowego reagujàcych ze sobà drobin: O2− + H2 O → 2OH− Jony O2− i OH− sà elementami struktury jonowej sta∏ego substratu i produktu, jakimi sà tlenek i wodorotlenek wapnia, natomiast te same jony Ca2+ stanowià dla nich przeciwjony. W podobny sposób reagujà z wodà inne jonowe tlenki, np.: Na2 O, K2 O, BaO, SrO czy La2 O3 . Trzeba tutaj wyraênie podkreÊliç, ˝e wzrost energii sieci krystalicznej i kowalencyjnoÊci wiàzaƒ powoduje zmiany tak w strukturze, jak i w reaktywnoÊci zwiàzków. Tlenki innych pierwiastków na +2 stopniu utlenienia, takie jak MgO, ZnO czy HgO nie b´dà ju˝ reagowa∏y z wodà tak jak CaO. Przeprowadzenie ich do roztworu jest mo˝liwe dopiero w reakcji z kationami H3 O+ wyst´pujàcymi w du˝ym st´˝eniu w roztworach kwasów i b´dàcymi dostatecznie silnymi donorami kationów wodorowych. Jony H3 O+ reagujà z silniej zwiàzanymi w sieci anionami O2− , przekszta∏cajàc je w drobiny wody, co jednoczeÊnie powoduje przejÊcie do roztworu kationów M2+ (oczywiÊcie hydratowanych): [M2+ , O2− ] + 2H3 O+ → M2+ + 3H2 O Zmiany strukturalne, spowodowane wzrostem kowalencyjnoÊci wiàzaƒ, objawiajà si´ najcz´Êciej poprzez zmniejszenie liczby koordynacyjnej, jak na przyk∏ad ma to miejsce w szeregu tlenków: MgO, ZnO, HgO i CO. Najbardziej jonowy MgO charakteryzuje si´ liczbà koordynacyjnà 6 i takà samà strukturà jak omówiony ju˝ tlenek wapnia. Bardziej elektroujemny kation cynku, w tlenku ZnO, wià˝e cztery aniony tlenkowe i odwrotnie (Rys. 3). W sieci krystalicznej HgO wyst´pujà równoleg∏e do siebie „nieskoƒczone” zygzako- 8 200 wate ∏aƒcuchy b´dàce rzeczywistymi czàsteczkami HgO (Rys. 4). Dopiero w tlenku w´gla pojawiajà si´ izolowane czàsteczki CO, które w niskich temperaturach tworzà kryszta∏y molekularne o budowie przedstawionej na Rys. 5. Rys. 3 Rys. 4 Rys. 5 Chemia w Szkole Nauka i technika W czàsteczce CO wyst´puje jednak wiàzanie potrójne, tak jak w czàsteczce N2 , gdy˝ obie zawierajà po 10 elektronów walencyjnych (sà izoelektronowe): |N≡N| |C≡O| W ka˝dym wi´c przypadku wzory kreskowe tlenków M=O nie odpowiadajà rzeczywistym strukturom zwiàzków. Rozpatrzmy dalej specyficzny typ reakcji, jakim jest reakcja rozk∏adu termicznego sta∏ej soli, np. w´glanu wapnia CaCO3 , która przebiega w temperaturze oko∏o 900◦ C, wg równania bilansowego: Rys. 6b CaCO3 → CaO + CO2 Równie˝ w tym przypadku w´glan wapnia nie ma budowy czàsteczkowej, podobnie jak i omawiany wczeÊniej produkt jego rozk∏adu – tlenek wapnia. W´glan wapnia znany jest w trzech odmianach polimorficznych: wateryt, aragonit i kalcyt, z których najtrwalszy jest kalcyt. Jest on zbudowany z kationów wapniowych Ca2+ i anionów w´glanowych CO2− 3 , tworzàc struktur´ krystalicznà przedstawionà na Rys. 6a. Kationy wapniowe w tym krystalicznym zwiàzku sà otoczone przez szeÊç anionów w´glanowych – Rys. 6b, a ka˝dy anion w´glanowy ma w swym najbli˝szym sàsiedztwie szeÊç kationów Ca2+ (Rys. 6c). Rys. 6a 4/2005 Rys. 6c Anion w´glanowy CO2− 3 przedstawia si´ wzorem kreskowym, w którym ka˝da kreska odpowiada parze elektronów tworzàcych wiàzanie, przy czym trzy kreski oznaczajà wiàzanie typu sigma (σ), a czwarta oznacza zdelokalizowane wiàzanie pi (π). Poniewa˝ d∏ugoÊci wiàzaƒ C−O w anionie sà jednakowe, to przybli˝onà struktur´ wyra˝ajà trzy wzory tzw. struktur rezonansowych: Wydzielajàcy si´ w reakcji gazowy CO2 tworzy w niskich temperaturach krystalicznà faz´ zbudowanà z izolowanych, oboj´tnych czàsteczek CO2 , powiàzanych s∏abymi oddzia∏ywaniami van der Waalsa (Rys. 7). Faza ta jest znana jako tzw. suchy lód. W tym wypadku wzór kreskowy O=C=O 201 9 Nauka i technika (pami´tajmy o liniowoÊci czàsteczki) odpowiada rzeczywistej strukturze drobiny zwiàzku i jej budowie elektronowej, gdy˝ kreski oznaczajà wiàzania σ i π. Jak widaç zwiàzek ten jest zbudowany z takich samych drobin CO2 , niezale˝nie od stanu skupienia. cze kryszta∏y lub krystality SiO2 powinny byç traktowane jako oddzielne makroczàsteczki. W ka˝dym krysztale SiO2 istnieje bowiem sieç przestrzenna, w której ka˝dy atom krzemu jest po∏àczony kowalencyjnie z czterema atomami tlenu, a ka˝dy atom tlenu pe∏ni rol´ mostka wià˝àcego czworoÊciany, co prowadzi do stechiometrii SiO2 . W zwiàzku tym nie ma pojedynczych czàsteczek SiO2 i oczywiÊcie wzór kreskowy, analogiczny do CO2 , jest tu nie na miejscu. Rys. 7 W reakcjach chemicznych z udzia∏em CO2 , np. w reakcji ze sta∏ym tlenkiem sodu – Na2 O, równanie bilansowe ma postaç: CO2 + Na2 O → Na2 CO3 Jednak w interpretacji drobinowej winno ono byç przedstawione jako równanie jonowo – czàsteczkowe: CO2 + O2− → CO2− 3 CO2 + [2Na+ , O2− ] → [2Na+ , CO2− 3 ] W wymiarze makroskopowym reakcja prowadzi do utworzenia w´glanu sodu Na2 CO3 o budowie jonowej, w którym ka˝otoczony jest dy anion w´glanowy CO2− 3 przez szeÊç kationów sodowych Na+ . Zupe∏nie inaczej jako reagent zachowuje si´ dwutlenek krzemu SiO2 , który jest stechiometrycznym analogiem CO2 . Wynika to z odmiennej struktury tego tlenku wyst´pujàcego w wielu odmianach polimorficznych. Jednà z nich jest α-kwarc, którego struktur´ przedstawiono na Rys. 8a oraz Rys. 8b na II s. ok∏adki czasopisma. Nale˝y podkreÊliç, ˝e ca∏e pojedyn10 202 Rys. 8a Reakcje SiO2 z tlenkami zasadowymi polegajà na wiàzaniu anionów tlenkowych z tlenku zasadowego, co powoduje rozrywanie mostków tlenkowych w strukturze SiO2 i prowadzi do ró˝norodnych produktów, w zale˝noÊci od wyjÊciowej stechiometrii u˝ytych substratów. JeÊli wi´c przeprowadzimy reakcj´ SiO2 z CaO wed∏ug stechiometrii 1:2: SiO2 + 2CaO → Ca2 SiO4 to otrzymamy wówczas jonowy zwiàzek zbudowany z kationów wapniowych Ca2+ oraz izolowanych czworoÊciennych anionów krzemianowych SiO4− 4 . Struktura anionu mo˝e byç opisana prostym wzorem kreskowym, gdy˝ w anionie wyst´pujà cztery pojedyncze wiàzania pomi´dzy Chemia w Szkole Nauka i technika tlenem i krzemem. Przy innych stosunkach reagentów mo˝na otrzymaç wiele soli o ró˝nych stechiometriach podsieci anionowych z czworoÊciennym otoczeniem krzemu i ró˝nà liczbà mostków tlenowych. Jonowe zwiàzki otrzymane w reakcjach przy stechiometrii CaO : SiO2 , jak 1 : 1 i 1 : 2: w ka˝dym przypadku innà liczb´ wiàzaƒ z tlenem wynoszàcà, odpowiednio: cztery, pi´ç i szeÊç, a wieloÊciany koordynacyjne ∏àczà si´ poprzez mostki tlenkowe w przestrzennà sieç o stechiometrii Si2 O2− 5 . CaO + SiO2 → CaSiO3 CaO + 2SiO2 → CaSi2 O5 zawierajà odpowiednio polianiony SiO2− 3 i Si2 O2− 5 . W rzeczywistoÊci, w zale˝noÊci od warunków syntezy czy rodzaju kationu, z∏o˝ona podsieç anionowa o prostej stemo˝e mieç ró˝nà budochiometrii SiO2− 3 w´. Mogà na nià sk∏adaç si´ makro∏aƒcuchy, utworzone z ∏àczàcych si´ poprzez dwa mostki tlenowe czworoÊcianów SiO4 , ustawione równolegle do siebie i powiàzane w strukturze wiàzaniem jonowym poprzez kationy Ca2+ (rysunek 9a na II s. ok∏adki). Zwiàzek o stechiometrii CaSiO3 mo˝e równie˝ byç zbudowany z pierÊcieniowych anionów Si3 O6− 9 w jonowym uk∏a2+ dzie z kationami Ca (Rys. 9b na III s. ok∏adki). CiÊnieniowe warunki syntezy mogà te˝ prowadziç do utworzenia struktury CaSiO3 przedstawionej na I i III s. ok∏adki (Rys. 9c). W tym wypadku podsieç SiO2− 3 ma budow´ przestrzennà obejmujàcà, jak w przypadku SiO2 , ca∏y kryszta∏ zwiàzku i jest uk∏adem po∏àczonych poprzez mostki tlenowe oÊmioÊciennych jednostek SiO6 , w których krzem tworzy szeÊç wiàzaƒ z tlenem. Jeszcze bardziej z∏o˝one mogà byç podsieci anionowe Si2 O2− w CaSi2 O5 . 5 Przyk∏ad jednej z takich podsieci pokazany jest na Rys. 10. Z∏o˝ona przestrzenna podsieç zawiera krzem w trzech ró˝nych otoczeniach: czworoÊciennym, oÊmioÊciennym i w postaci piramidy o podstawie kwadratowej. Jak widaç, krzem tworzy 4/2005 Rys. 10 Tego typu sytuacje wyst´pujà w wi´kszoÊci zwiàzków nieorganicznych, tworzonych przez ró˝ne pierwiastki. Równie˝ wymienione wczeÊniej tlenki magnezu, cynku i rt´ci, reagujàc z jonowymi, silnie zasadowymi tlenkami (Na2 O, K2 O, BaO), b´dà tworzy∏y, podobnie jak SiO2 , sole o prostych stechiometriach: K6 MgO4 , Na6 ZnO4 , K4 ZnO3 , Ba2 ZnO3 , BaZnO2 i Na2 HgO2 . Zawierajà one proste lub z∏o˝one aniony z uk∏adami wiàzaƒ nie majàcymi wiele wspólnego z wartoÊciowoÊcià tworzàcych je pierwiastków. W K6 MgO4 i Na6 ZnO4 wyst´pujà czworoÊcienne aniony MgO6− 4 4− i ZnO6− 4 , a w K4 ZnO3 p∏askie jony ZnO3 (izoelektronowe z CO2− 3 ). Ta sama stechiometria podsieci anionowej w soli Ba2 ZnO3 jest realizowana dla odmiany w postaci nieskoƒczonych ∏aƒcuchów utworzonych przez po∏àczone wierzcho∏kami czworoÊciany ZnO4 (podobnie do ∏aƒcuchowych anionów SiO2− 3 w CaSiO3 ). Z kolei podsieç anionowa w BaZnO2 ma struktur´ przestrzennà zbli˝onà do β -kwarcu (kolejnej odmiany polimorficznej SiO2 ), zaÊ aniony HgO2− 2 w soli Na2 HgO2 odpowiadajà strukturalnie czàsteczkom CO2 . W przypadku wi´c zwiàzków jonowych, ale nie tylko, stosowany dla nich 203 11 Nauka i technika „czàsteczkowy” opis z uwzgl´dnieniem tylko wartoÊciowoÊci i nast´pnie sztucznie rozwijany do postaci wzoru kreskowego oddaje jedynie stechiometri´ zwiàzku i nie mo˝e byç stosowany do opisu struktury. ¸àczenie atomów pierwiastków kreskami, których liczba wynika z tzw. wartoÊciowoÊci, jest wi´c niecelowe i daje abstrakcyjny obraz struktury. Ten nieprawdziwy obraz ma równie˝ wp∏yw na interpretacj´ wielu reakcji, jak na przyk∏ad zachowania si´ wodorotlenków amfoterycznych: Zn(OH)2 , Al(OH)3 czy oksowodorotlenku AlOOH. Wszystkie te zwiàzki nie majà budowy czàsteczkowej, sà polimerami nieorganicznymi o budowie warstwowej, stàd sà nierozpuszczalne w wodzie i nie dysocjujà jak kwasy, a wi´c nie tworzà w roztworach 3− czy AlO− wodnych jonów: ZnO2− 2 . 2 , AlO3 Sole zawierajàce takie podsieci anionowe sà znane jedynie w fazie sta∏ej i sà to podsieci równie˝ polimeryczne, w których cynk i glin otoczony jest przez cztery a nawet szeÊç tlenów. Aniony w takiej postaci nie istniejà w roztworach wodnych, a w wyniku dzia∏ania wody ulegajà hydrolizie. AmfoterycznoÊç wymienionych wodorotlenków wynika jedynie z reakcji wiàzania anionów OH− i tworzenia rozpuszczalnych w wodzie soli z jonami takimi jak, np. 3− Zn(OH)2− 4 czy Al(OH)6 : pomi´dzy „abstrakcyjnymi" kreskowymi strukturami zwiàzków, wyprowadzanymi na podstawie wartoÊciowoÊci pierwiastków, a rzeczywistymi strukturami wyznaczanymi przez uk∏ad wiàzaƒ chemicznych. Ta sytuacja wyst´puje szczególnie cz´sto w chemii nieorganicznej, gdzie przewa˝ajàca wi´kszoÊç zwiàzków nie ma budowy „czàsteczkowej” to˝samej z ich najprostszym sk∏adem stechiometrycznym. Cz´sto spotykamy si´ te˝ z sytuacjami, w których podanie takiego wzoru jest wr´cz niemo˝liwe. Dla przyk∏adu sugerujemy rozwa˝enie wzorów kreskowych dla kwasu tetrafluoroborowego HBF4 i jego soli, np. NaBF4 , czy te˝ NF4 BF4 . MoglibyÊmy tutaj zaproponowaç te˝ porównanie z chemià organicznà, gdzie w´giel w zwiàzkach tworzy na ogó∏ cztery wiàzania. Jednak gdyby wyjÊç wy∏àcznie ze stechiometrii tych zwiàzków, sytuacja by∏aby doÊç podobna. ˚aden chemik na podstawie najprostszej stechiometrii nie b´dzie przecie˝ rysowa∏ wzorów strukturalnych. Co by to by∏o, gdyby na podstawie najprostszego sk∏adu stechiometrycznego benzenu (CH) mia∏ on wnioskowaç o jego strukturze? Chemik lepiej zaznajomiony z chemià wyprowadzi∏by zapewne struktury czàsteczek wielu w´glowodorów – acetylenu C2 H2 , poliacetylenu, nasyconych w´glowodorów o klatkowej strukturze, takich jak pryzman C6 H6 , kuban C8 H8 , itp. Zn(OH)2 + 2NaOH → Na2 Zn(OH)4 Al(OH)3 + 3NaOH → Na3 Al(OH)6 Interpretacja na poziomie drobinowym jest taka jak dla omówionej wczeÊniej reakcji SiO2 z CaO, przy czym rol´ anionów O2− przejmujà aniony wodorotlenkowe OH− : PROF. NZW. PW, DR HAB. ZYGMUNT GONTARZ pracuje w Katedrze Chemii Nieorganicznej i Technologii Cia∏a Sta∏ego Politechniki Warszawskiej, prowadzi wyk∏ady z Podstaw Chemii i z Chemii Nieorganicznej, specjalizuje si´ w chemii zwiàzków tlenowych. E-mail: [email protected]. Zn(OH)2 + 2OH− → Zn(OH)2− 4 Al(OH)3 + 3OH− → Al(OH)3− 6 Reasumujàc, chcieliÊmy na tych kilku wybranych przyk∏adach zwróciç uwag´ czytelników na fundamentalne rozbie˝noÊci 12 204 DR IN˚. JANUSZ ZACHARA jest adiunktem w Katedrze Chemii Nieorganicznej i Technologii Cia∏a Sta∏ego Politechniki Warszawskiej, prowadzi wyk∏ady z Chemii Nieorganicznej i Krystalografii, specjalizuje si´ w chemii strukturalnej. E-mail: [email protected]. Chemia w Szkole